A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מתן אפשרות לפיצוי בזמן אמת בחומציות פוטוכימיות מהירות של חלבונים לקביעת שינויים בטופוגרפיה של חלבונים
In This Article
Summary
חמצון פוטוכימי מהיר של חלבונים היא טכניקה מתפתחת לאפיון מבני של חלבונים. תוספי ממס שונים ליגנדים יש תכונות שונות הידרוקסיל רדיקלי ים. כדי להשוות את מבנה החלבון בתנאים שונים, פיצוי בזמן אמת של רדיקלים הידרוקסיל שנוצר בתגובה נדרש כדי לנרמל את תנאי התגובה.
Abstract
חמצון פוטוכימי מהיר של חלבונים (FPOP) היא טכניקת ביולוגיה מבנית מבוססת ספקטרומטריה מסה הבדיקה את שטח פני השטח נגיש ממס של חלבונים. טכניקה זו מסתמכת על התגובה של שרשראות צד חומצת אמינו עם רדיקלים hydroxyl מפזר בחופשיות בתמיסה. FPOP מייצר רדיקלים אלה ב situ על ידי פוטו-ליזה לייזר של מי חמצן, יצירת פרץ של רדיקלים הידרוקסיל כי הוא מרוקן על סדר של microsecond. כאשר רדיקלים הידרוקסיל אלה מגיבים עם שרשרת צד חומצת אמינו נגישה ממס, מוצרי התגובה להפגין שינוי המוני שניתן למדוד וכמת על ידי ספקטרומטריית מסה. מאחר שקצב התגובה של חומצת אמינו תלוי בחלקו במשטח הנגיש הממוצע של חומצת אמינו זו, שינויים מדודים בכמות החמצון של אזור נתון של חלבון יכולים להיות קשורים ישירות לשינויים בנגישות ממס של אזור זה בין קונפורמציות שונות (למשל, ליגנד-bound לעומת ליגנד חינם, מונומר לעומת צבירה, וכו ') FPOP הוחל במספר בעיות בביולוגיה, כולל אינטראקציות חלבון-חלבון, שינויים קונפורמציה חלבון, וכריכת חלבון ליגנד. כמו הריכוז הזמין של רדיקלים הידרוקסיל משתנה בהתאם לתנאים ניסיוניים רבים בניסוי FPOP, חשוב לפקח על המינון הרדיקלי היעיל אליו אנליטיט החלבון נחשף. ניטור זה מושגת ביעילות על ידי שילוב dosimeter מוטבע כדי למדוד את האות מתגובת FPOP, עם fluence לייזר מותאם בזמן אמת כדי להשיג את הכמות הרצויה של חמצון. עם פיצוי זה, ניתן לקבוע שינויים בטופוגרפיה של חלבונים המשקפים שינויים קונפורמיים, משטחים מחייבים ליגנד ו/או ממשקי אינטראקציה חלבון-חלבון ניתן לקבוע בדגימות הטרוגניות באמצעות כמויות מדגם נמוכות יחסית.
Introduction
חמצון פוטוכימי מהיר של חלבונים (FPOP) היא טכניקה מתפתחת לקביעת שינויים טופוגרפיים חלבון על ידי שינוי קוולנטי אולטרה מהיר של שטח הפנים חשוף ממס של חלבונים ואחריו זיהוי על ידי LC-MS1. FPOP מייצר ריכוז גבוה של רדיקלים הידרוקסיל ב situ על ידי לייזר UV פלאש פוטוליזה של מי חמצן. רדיקלים הידרוקסיל אלה הם מאוד תגובתיים וקצרים, נצרך בערך ציר זמן microsecond בתנאים FPOP2. רדיקלים הידרוקסיל אלה לפזר דרך מים וחמצון רכיבים אורגניים שונים בתמיסה בקצבים קינטיים בדרך כלל החל מהיר (~10 6 M-1 s-1)כדי דיפוזיהמבוקרת 3. כאשר הרדיקלי הידרוקסיל נתקל משטח חלבון, הרדיקלי יהיה חמצון שרשראות צד חומצת אמינו על פני השטח של החלבון, וכתוצאה מכך שינוי המוני של חומצת אמינו (בדרך כלל תוספת נטו של אטום חמצן אחד)4. קצב תגובת החמצון בכל חומצת אמינו תלוי בשני גורמים: תגובתיות הטבועה של חומצת אמינו זו (התלויה בשרשרת הצדדית ובהקשר הרצף)4,,5, ונגישות השרשרת הצדדית לרדיקל הידרוקסיל המפזר, המתאם באופן הדוק לאזור הממסהממוצע הנגיש 6,,7. כל חומצות אמינו סטנדרטיות למעט גליצין נצפו כפי שכותרתו על ידי רדיקלים הידרוקסיל תגובתיים מאוד אלה בניסויי FPOP, אם כי בתשואות שונות באופן נרחב; בפועל, סר, ת'ר, אסן ועלא נתפסים לעתים נדירות כחמצון ברוב הדגימות למעט במינונים קיצוניים גבוהים ומזדהים על ידי פיצול ETD ממוקד זהירורגיש 8,9. לאחר חמצון, דגימות מרווה כדי להסיר מי חמצן וחמצון משני (superoxide, חמצן singlet, הידרופרוקסיד פפטידיל, וכו ') הדגימות המיוות מתעכלות לאחר מכן כדי ליצור תערובות של פפטידים מחומצנים, כאשר המידע המבני מוקפא כ"תצלום בזק" כימי בתבניות של מוצרי חמצון של הפפטידיםהשונים (איור 1). כרומטוגרפיה נוזלית בשילוב ספקטרומטריה מסה (LC-MS) משמש כדי למדוד את כמות חמצון של חומצות אמינו בפפטיד פרוטאוליטי נתון בהתבסס על העוצמות היחסיות של גירסאות מחומצנות ולא חמצון של פפטיד זה. על ידי השוואת טביעת הרגל החמצונית של אותו חלבון המתקבל בתנאים קונפורמיים שונים (למשל, ליגנד-bound לעומת ליגנד חינם), הבדלים בכמות החמצון של אזור נתון של החלבון יכול להיות מתואם ישירות עם הבדלים באזור פני השטח נגיש ממס שלאזור זה 6,7. היכולת לספק מידע טופוגרפי חלבון הופך FPOP טכנולוגיה אטרקטיבית לקביעת מבנה בסדר גבוה יותר של חלבונים, כולל גילוי טיפוליחלבון ופיתוח 10,11.

איור 1: מבט כולל על FPOP. פני השטח של החלבון משתנים באופן קוולנטי על ידי רדיקלים הידרוקסיל תגובתיים מאוד. הרדיקלים הידרוקסיל יגיבו עם שרשראות צד חומצת אמינו של החלבון בקצב כי הוא מושפע מאוד על ידי הנגישות ממס של השרשרת הצדדית. שינויים טופוגרפיים (לדוגמה, בשל הכריכה של ליגנד כפי שהראה לעיל) יגנו על חומצות אמינו באזור של אינטראקציה מתן תגובה עם רדיקלים הידרוקסיל, וכתוצאה מכך ירידה בעוצמה של פפטיד שונה באות LC-MS. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
מרכיבים שונים הנוכחים בתמיסת FPOP (למשל, ליגנדים, excipients, מאגרים) יש פעילות טיהור שונה כלפי רדיקלים hydroxyl שנוצר על פוטו-ליזה לייזר של מיחמצן 3. באופן דומה, שינוי קטן בריכוז מי חמצן, פלור לייזר, והרכב מאגר עשוי לשנות את המינון הרדיקלי היעיל, מה שהופך את הרבייה של נתוני FPOP מאתגר על פני הדגימות ובין מעבדות שונות. לכן, חשוב להיות מסוגל להשוות את המינון הרדיקלי hydroxyl זמין להגיב עם חלבון בכל מדגם באמצעות אחד מכמה dosimeters רדיקליהידרוקסיל זמין 12,,13,,14,,15,16. הידרוקסיל רדיקל dosimeters לפעול על ידי מתחרה עם analyte (ועם כל אוכלי הנבלות בתמיסה) עבור הבריכה של רדיקלים הידרוקסיל; המינון היעיל של רדיקלים הידרוקסיל נמדד על ידי מדידת כמות חמצון של הדוסימטר. שים לב כי "מינון רדיקלי הידרוקסיל יעיל" היא פונקציה של הריכוז הראשוני של הידרוקסיל רדיקלי שנוצר ואת מחצית החיים של הרדיקלי. שני פרמטרים אלה תלויים זה בזה חלקית, מה שהופך את המודל הקינטי התיאורטי למורכב במקצת(איור 2). שתי דגימות יכול להיות שונה בפראות רדיקלי ים מחצית חיים תוך שמירה על אותו מינון רדיקלי יעיל על ידי שינוי הריכוז הראשוני של הידרוקסיל רדיקלי נוצר; הם עדיין ייצרו עקבות זהות17. Adenine13 ו Tris12 הם נוח הידרוקסיל רדיקלי dosimeters כי רמת חמצון שלהם ניתן למדוד על ידי ספקטרוסקופיה UV בזמן אמת, המאפשר לחוקרים לזהות במהירות כאשר יש בעיה עם מינון רדיקלי הידרוקסיל יעיל כדי לפתור את הבעיה שלהם. כדי לפתור בעיה זו, dosimeter מוטבע הממוקם במערכת הזרימה מיד לאחר האתר של הקרן שיכול לפקח על האות משינויים בספיגת אדנין בזמן אמת חשוב. זה עוזר בביצוע ניסויים FPOP במאגרים או כל excipient אחר עם רמות שונות באופן נרחב של הידרוקסיל רדיקלי קיבולתניבים 17. פיצוי מינון רדיקלי זה יכול להתבצע בזמן אמת, מניב תוצאות סטטיסטיות לא שונות עבור אותו conformer על ידי התאמת המינון הרדיקלי היעיל.
בפרוטוקול זה, יש לנו הליכים מפורטים לביצוע ניסוי FPOP טיפוסי עם פיצוי מינון רדיקלי באמצעות אדנין כמו מינון רדיקלי אופטי פנימי. שיטה זו מאפשרת לחוקרים להשוות עקבות בין תנאי FPOP בעלי יכולת נקה שונה על-ידי ביצוע פיצוי בזמן אמת.
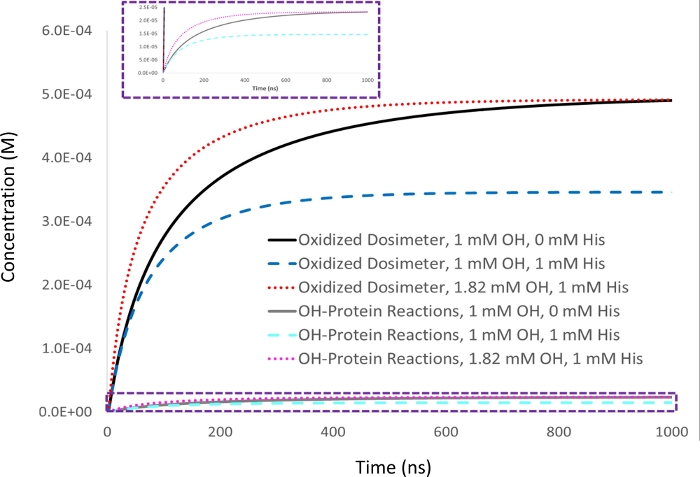
איור 2: סימולציה קינטית של פיצוי מבוסס ניסיון. 1 mM אדנין דוסימטר תגובה נמדדת 5 μM ליזוזים analyte עם 1 mM ריכוז רדיקלי הידרוקסיל ראשוני (▪OH t1/2=53 ns), ולהגדיר כתגובה דוסימטר היעד (שחור). עם תוספת של 1 מ"מ של היסטדין אוכלי נבלות, תגובת הדוסימטר (כחול) פוחתת יחד עם כמות חמצון חלבון באופן פרופורציונלי (ציאן). גם מחצית החיים של הרדיקלי הידרוקסיל פוחתת (▪OH t1/2=39 ns). כאשר כמות הידרוקסיל רדיקלי שנוצר גדל כדי לתת תשואה שווה ערך של דוזימטר מחומצן בדגימה עם 1 mM היסטידין אוכל נבלות כפי שהושג עם 1 mM הידרוקסיל רדיקלי בהיעדר s נבלות (אדום), כמות חמצון חלבון המתרחשת באופן דומה הופך זהה (מג'טנטה), בעוד המחצית חיים רדיקלי hydroxyl פוחתת עוד יותר (▪OH t1/2=29 ns). מותאם באישור שארפ J.S., Am Pharmaceut Rev 22, 50-55, 2019. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
Protocol
1. להכין את הספסל האופטי ואת נערך עבור FPOP
התראה: לייזרים של KrF excimer הם סכנות עיניים קיצוניות, ואור ישיר או משתקף עלול לגרום לנזק בלתי הפיך לעיניים. תלבש תמיד הגנת עיניים מתאימה, הימנע מנוכחות של עצמים מחזירי אור ליד נתיב הקרן במידת האפשר, והשתמש בבקרות הנדסיות כדי למנוע גישה בלתי מורשית ללייזר פעיל ולרסן השתקפויות תועות.
- הכן את הספסל האופטי FPOP.
- הפעל את הלייזר כדי להתחמם. הגדר את הלייזר להדק חיצוני, אנרגיה קבועה, אין החלפת גז. הגדר את אנרגיית הלייזר לכל פעימה (בדרך כלל בין 80-120 mJ / דופק).
- הגדר את הספסל האופטי עם עדשת plano-convex (30 מ"מ Dia. x 120 מ"מ FL ללא מעצורים) ישירות בנתיב של קרן הלייזר וstopstop לא רפלקטיבי לספוג את האור כפי שמצג איור 3A.

איור 3: ספסל אופטי לניסוי FPOP. (א)הדגימה מעורבבת עם H2O2, אדנין עשה דם רדיקלי, ונבלות גלוטמין וטעון לתוך המזרק. המדגם נדחף דרך נמת סיליקה מותכת דרך נתיב קרן ממוקד של לייזר UV Excimer KrF. אור UV photolyzes H2O2 לתוך רדיקלים הידרוקסיל, אשר חמצון את החלבון ואת אדנין דוסימטר. זרימת המזרק דוחפת את הדגימה המוארת אל מחוץ לנתיב הלייזר לפני פולס הלייזר הבא, עם נפח אי-הכללה לא מנוקד בין אזורים מוארים. מיד לאחר חמצון, המדגם מועבר דרך ספקטרופוטומטר UV מוטבע, אשר מודד את ספיגת UV של אדנין ב 265 מילימטר. לאחר מכן, הדגימה מופקדת במאגר מרווה כדי לחסל אתחמצוןH 2 O2 הנותרים וחמצונים משניים. (ב)גודל הספוט נמדד לאחר הקרן של פתק דביק צבעוני מודבק מאחורי הנימו עם הלייזר ב 248 דפים לשעה. רוחב הנקודה משמש לחישוב קצב הזרימה לדוגמה, והצללית של נימי במרכז הנקודה משמשת ליישור הספסל האופטי. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
- חותכים את האורך המתאים של נמת סיליקה מותכת (קוטר 360 μm בקוטר חוץ וקוטר פנימי של 100 μm) ובשימוש בשרוול, להתחבר מזרק גז הדוק באמצעות מחבר נפח מת נמוך.
- לשרוף בעדינות את ציפוי polyimide של נימיה עם לפיד בוטאן במקום שבו dosimeter מוטבע קורא את אות הספיגה ב 265 מילימטר לאחר חשיפה לייזר של הדגימות. נגב את הפסולת על הנתים בעדינות באמצעות מתנול על מגבון ללא מוך. ציפוי פולימיד באתר של שכיחות לייזר יכול גם להישרף באופן דומה עם לפיד בוטאן או נשרף עם לייזר excimer ירי בהכח נמוכה.
הערה: המתן נכים להתקרר כפי שהוא סכנת אש להשתמש מתנול על נכים חם. - מקם את נימה זה דרך נתיב הקרן של הלייזר לתוך הדו-מים בתוך הדרך.
- לחץ על הידית על החלק העליון של הסימטר ההתוכך כדי לפתוח את ציר. הסר את המחזיקים המגנטיים. מניחים את הניים בגרוב המכונן של התסה בתוך קו, באמצעות המחזיקים המגנטיים כדי לשמור על נימה במקום. סגור את ציר הדו-סימיטר מעל הניים, לוחץ עליו עד שהנינוף ננעל במקומו.
- באמצעות תוכנת dosimetry, לחץ על לחצן התחל פלאש כדי להתחיל לירות את הלייזר excimer. הגדר את כוח הלייזר המוגדר מראש בין 50-100 mJ/pulse על תוכנת בקרת הלייזר עצמה, והגדר את קצב החזרה המוגדר מראש בין 10-20 הרץ בכרטיסיה הגדרות של תוכנת dosimetry.
- מקד את קרן הלייזר באמצעות עדשת קמבוקס פלאנו המותקן על במה מנונעת ליניארית. מדוד את הרוחב והגובה של נקודת הלייזר במיקום נמת על פתק דביק בדיוק באמצעות קליפר כדי לחשב את שטף האירוע (mJ/mm2)כפי המוצג באות 3B.
- מקם צמצם אטום ליד הניים כדי להבטיח רוחב מואר עקבי של נימות ללא קשר לשינויים בגודל הקרן עקב תנועת העדשה או שינוי האנרגיה לכל פעימה שללייזר 18.
- עם ירי הלייזר, להזיז את השלב הממונע דרך טווח התנועה שלה. ודא כי הקרן נשארת מרוכזת על הצמצם ואת הצללית של הנים ניתן לצפות לאורך כל. קוטר הצמצם חייב להיות קטן יותר מרוחב הקורה המנוקדת הנוכלת בכל נקודה בטווח של השלב הממונע.
- להריץ מים דרך הנתים ב 20 μL / דקה לפחות לפחות דקה אחת כדי לשטוף את הנתים.
- לחץ על לחצן התחל נתונים + AutoZero על תוכנת dosimeter כדי לאפס את הדוז'יטר למים ולהתחיל באיסוף נתונים.
הערה: אם מערכת המאגר עבור FPOP יש ספיגת UV משמעותית ב 265 נארם, מערכת FPOP צריך להיות מאופס על המאגר, לא מים.
- לחץ על לחצן התחל נתונים + AutoZero על תוכנת dosimeter כדי לאפס את הדוז'יטר למים ולהתחיל באיסוף נתונים.
- הגדר את קצב הזרימה המחושב במשאבת המזרק.
- קצב הזרימה של דגימת החלבון תלוי בנפח המוקרן לזריקה (VIrr), מספר יריות לייזר לשנייה (R), ואת שבר נפח החרגה ללא rradiated הרצוי(FEx)כדי לתקן את אפקטי זרימת למינאר דיפוזיה לדוגמה (0.15-0.30 מומלץ)2,19,20. חשב את VIrr (ב μL) בהתבסס על הקוטר הפנימי של נמת במ"מ (ד) ואת רוחב נקודת הלייזר המקלקלת על נערך (כלומר, רוחב הצמצם) במ"מ(w)באמצעות המשוואה הבאה:
VIrr = π(d/2)2 רוחבw - חשב את קצב הזרימה הרצוי (ב- μL/min) בהתבסס על המשוואה הבאה:
זרימה = 60R[VIrr (1 + FEx)]
- קצב הזרימה של דגימת החלבון תלוי בנפח המוקרן לזריקה (VIrr), מספר יריות לייזר לשנייה (R), ואת שבר נפח החרגה ללא rradiated הרצוי(FEx)כדי לתקן את אפקטי זרימת למינאר דיפוזיה לדוגמה (0.15-0.30 מומלץ)2,19,20. חשב את VIrr (ב μL) בהתבסס על הקוטר הפנימי של נמת במ"מ (ד) ואת רוחב נקודת הלייזר המקלקלת על נערך (כלומר, רוחב הצמצם) במ"מ(w)באמצעות המשוואה הבאה:
2. הכנת תמיסת החלבון ל-FPOP
- הכינו את החלבון בשני התנאים השונים או יותר להשוואה (לדוגמה, ליגנד כבול וחופש ליגנד; צבירה ומונומר; לבד ועם שותף מחייב חלבון; וכו') לזיהוי השינויים הקונפורמיים.
- הגדר את אמצעי האחסון הכולל המשמש עבור FPOP כך שיתאים לצרכי הניסוי. המגבלה המינימלית תלויה בדרך כלל בנפח של נימות ההבהרה ובחומר הנדרש לזיהוי חזק וכימות יחסי, והיא תשתנה במידה רבה בהתאם למערכת LC-MS/MS המשמשת ולשיטת העיבוד לדוגמה לאחר תיוג. הנפח הכולל עבור פתרונות FPOP נפוץ בקבוצה שלנו הוא 20 μL לאחר תוספת של מי חמצן. הריכוז הסופי של החלבון הוא בדרך כלל 1-10 μM, עם גלוטמין 17 mM (כדי להגביל את החיים של רדיקלי הידרוקסיל), 1 mM אדנין (לפעול כמו דוסימטר רדיקלי)13,,17 ו 10 mM פוספט מאגר (מאגר שהוא אוכל נבלות עני של רדיקלים הידרוקסיל). דוגמאות מוכנות בדרך כלל עם שכפולים מרובים כדי לאפשר מידול סטטיסטי של תוצאות.
- לרוב המטרות הכלליות, הכינו דגימות בשלושה רישיות בשתי המדינות, בתוספת לפחות מדגם אחד לשימוש כפקד ללא לייזר כדי למדוד חמצון רקע. הכן 18 μL של תמהיל פתרון FPOP זה.
הערה: מאגרים ותוספים רבים המשמשים בדרך כלל בביוכימיה הם אוכלי נבלות רדיקליים הידרוקסיל. ניתן להשתמש בתוספים ובמאגרים אלה; עם זאת, הפחתות חמצון עקב הידרוקסיל רדיקלי נקיקה של המאגר יכול להתרחש. באופן כללי, לשמור את כל התוספים למינימום הנדרש על ידי המערכת הביולוגית כדי למקסם את תפוקת חמצון חלבון. דימתיל sulfoxide יש להימנע בשל הנטייה ליצור רדיקלים משניים; דימתילפורממיד היה אלטרנטיבה שימושית בידיים שלנו. בעת שימוש במאגרים חזקים הידרוקסיל רדיקלי אוכלי נבלות, גלוטמין לעתים קרובות ניתן להוציא את תמהיל פתרון FPOP.
- לרוב המטרות הכלליות, הכינו דגימות בשלושה רישיות בשתי המדינות, בתוספת לפחות מדגם אחד לשימוש כפקד ללא לייזר כדי למדוד חמצון רקע. הכן 18 μL של תמהיל פתרון FPOP זה.
- הכן מי חמצן M 1 מיד לפני ניסוי FPOP.
הערה: 30% מי חמצן כפי שנמכר בדרך כלל על ידי ספקים כולל מייצב, אשר מגדיל את חיי המדף. ברגע מדולל, מי חמצן צריך לשמש במהירות, בהחלט בתוך אותו היום. מי חמצן צריך גם להיבדק באופן קבוע לריקבון על ידי FPOP באמצעות דוסימטר רדיקלי הידרוקסיל. - להכין צינורות microcentrifuge המכיל 25 μL של פתרון quench של 0.5 μg / μL של מתונין בין ו 0.5 μg / μL קטלאז. אם אמצעי אחסון לדוגמה גדול מ- 20 μL משמש עבור FPOP, הגדל את נפח פתרון ההתרווה באופן פרופורציונלי.
3. בצע את ניסוי FPOP
- להוסיף 2 μL של מי חמצן ב 18 μL של תמהיל פתרון FPOP. מערבבים את התוכן בעדינות עם פיפטה ומסובבים במהירות את הפתרון לתחתית צינורות המיקרוצנטריפוגה. מיד לאסוף עם מזרק לחוץ ולטעון לתוך משאבת המזרק.
- התחל את הזרימה על משאבת המזרק עם קצב הזרימה כפי שנקבע בשלב 1.8.1 (בדרך כלל בין 8-16 μL/min) על ידי לחיצה על לחצן התחל משאבה על תוכנת dosimeter.
- נטר את קריאת אדנין בזמן אמת באמצעות הדוזמוניזם בתוך המסך (ראה טבלת חומרים)ואיסוף הדגימה בפסולת. חכה לאות שריריהבטן 265 להתייצב.
- לחץ על לחצן התחל פלאש בתוכנה dosimeter כדי להתחיל לירות את הלייזר בקצב החזרה מוגדר מראש ואנרגיה.
- נטר את קריאת אדנין בזמן אמת באמצעות מנון מוטבע (ראה טבלת חומרים); ההבדל ב-Abs265 עם הלייזר כבוי והלייזר הוא הקריאה של265 ה-100.
הערה: המראה של קריאות Abs265 מאוד לא יציב בעת ירי הלייזר בנוכחות מי חמצן הוא בשל הדור של בועות בתמיסה. להפחית את השטף של הלייזר ו / או את הריכוז של מי חמצן כדי לחסל את הבועות.
4. ביצוע פיצוי
הערה: ליגנדים שונים, מאגרים, וכו 'ייתכן שיש קיבולת נקה שונה כלפי רדיקלים hydroxyl. חשוב להבטיח כי מינונים רדיקליים הידרוקסיל יעילים דומים זמינים להגיב עם חלבון על פני דגימות שונות. פעולה זו מושגת על ידי הבטחת תגובת דוסימטר הידרוקסיל רדיקלי שווה בין דגימות. באמצעות dosimetry אדנין, השינוי בספיגת UV ב 265 nm (ThAbs265)משקף את המינון הרדיקלי הידרוקסיל יעיל; ככל שה-265 גדול יותר ,כךהמינון הרדיקלי ההידרוקסי האפקטיבי גבוה יותר.
- השוו את הקריאה265 שהתקבלה עם ה-dosimeter inline עם הקריאההרצויה 265 שהתקבלה על ידי ניסויים או בקרות קודמים. קריאה נמוכה יותרמהקריאה הרצויה מצביעה על מנה יעילה לא מספקת של רדיקלים הידרוקסיל; קריאה של265 מ"ס מצביעה על מינון רדיקלי יעיל גבוה מדי. אם הקריאה של ThAbs265 נמצאת ברמה הרצויה, אספו את הדגימה מיד לאחר ההקרן בלייזר במאגר ההתרווה17.
- לפצות את המינון הרדיקלי היעיל כדי להשוות את265 ThAbs. פיצוי זה יכול להתבצע בשלוש דרכים: לשנות את ריכוז מי חמצן, להגדיל את fluence לייזר על ידי שינוי אנרגיית הלייזר לכל פעימה, או להגדיל את fluence לייזר על ידי שינוי מישור המוקד של העדשה מיקוד.
- כדי לבצע שינוי גדול (>10 mAU) בקריאה265, עשה מחדש את המדגם עם פחות או יותר מי חמצן וההפעלה מחדש של הדגימה לפי סעיף 3.
- כדי לבצע שינוי קטן בקריאה של265 בזמן אמת, התאם את מישור המוקד של קרן האירוע על-ידי התאמת מיקום העדשה הממוקדת באמצעות השלב הממונע של 50 מ"מ. הבאת המטוס המוקד קרוב יותר למיקום של ניח יגדיל את הקריאה265; הבאת המטוס המוקד רחוק יותר ממיקום נבואה תקטין את הקריאהשל 265 ה-100.
- לפקח על אדנין265 כדי למדוד את הכמות היעילה של הידרוקסיל רדיקלי הנוכחי בדגימה לאחר הקרןלייזר 13. ניטור בזמן אמת עם גלאי נים UV מוטבע מאפשר פיצוי בזמן אמת כמתואר ב- 4.2.2; כוונן את מיקום העדשה באמצעות השלב הממונע עד שהקריאהב-265 תשווה לקריאה הרצויה. מדידות ספיגה לאחר ניסיוני עם ספקטרופוטומטר UV הם גם מדויקים, אבל דורשים דגימות חדשות לשמש עבור כל מינון רדיקלי יעיל.
5. לעכל את דגימות החלבון
הערה: Trypsin משמש בדרך כלל לעיכול דגימות חלבון עבור FPOP, והוא protease בשימוש בפרוטוקול זה. זהו פרוטאז אמין המייצר פפטידים עם אתרים בסיסיים הן ב- N- ו- C-terminus, קידום יונים פפטידים טעונים להכפיל טרשת נפוצה. יתר על כן, זה cleaves לאחר ליצין ארגינין, שתי חומצות אמינו כי הם רק תגובתית במתינות רדיקלים הידרוקסיל; לכן, שינויים בתבנית העיכול עקב חמצון אנליטי הוא נדיר. פרוטאזים אחרים שימשו בהצלחה עם FPOP21, אבל יש לנקוט בזהירות כדי להבטיח דפוסי עיכול דומים בין דגימות לא חמצון מחומצן.
- מדוד את אמצעי האחסון הסופי של מדגם FPOP מרווה. הוסף 500 mM Tris, pH 8.0 עם 10 mM CaCl2 המכיל 50 mM dithiothreitol (DTT) לפתרון החלבון לאחר ההתרוות לריכוז הסופי של 50 mM Tris, 1 mM CaCl2 ו 5 mM DTT.
- מחממים את דגימת החלבון ב-95 מעלות צלזיוס במשך 15 דקות.
- מיד לקרר את הדגימה על קרח במשך 2 דקות.
- הוסף את יחס משקל 1:20 טריפסין / חלבון לדגימות.
- מעכלים את החלבון למשך הלילה ב-37°C עם ערבוב.
- להפסיק את תגובת העיכול על ידי תוספת של 0.1% חומצה תכלת ו / או חימום הדגימה 95 ° C במשך 10 דקות.
- הוסף 2 mM DTT לדגימות וחום ב- 60 °C במשך 15 דקות מיד לפני LC-MS/MS.
הערה: בעוד קבוצות אחרות דיווחו אלקלוציה של thiols בניסויי FPOP, בידיים שלנו יש לנו ציין מוצרי צד על אלקסילציה של חלבונים מחומצנים (אולי בשל תגובה עם קרבוניל נוקליאופילי שנוצר כמוצר חמצון קטין). לכן, אנו בוחרים להימנע אלקלוציה של thiols כאשר הדבר אפשרי.
6. ביצוע ספקטרומטריה נוזלית כרומטוגרפיה-דו-דם מסה (LC-MS / MS)
- הכינו את שלב א' הנייד המורכב ממים המכילים 0.1% חומצה פרמית ושלב B נייד המורכב מאצטוניטריל עם חומצה פוטמית של 0.1%.
- טען את הדגימה תחילה על עמודת מלכודת C18 (300 μm I.D. x 5 מ"מ 100 גודל נקבוביות Å, 5 μm גודל חלקיקים) השמנה ולשטוף עם 2% ממס B במשך 3 דקות בקצב זרימה של 5.0 μL / min כדי להסיר מלחים מולקולות קטנות הידרופיליות.
- לאחר מכן הפרד את הפפטידים על ננו-קולומן C18 (0.75 מ"מ x 150 מ"מ, גודל חלקיק 2 μm, גודל נקבוביות 100 Å) בקצב זרימה של 300 nL/min. השינוע מורכב מעלייה ליניארית מ-2 ל-35% ממס B במשך 22 דקות, נגח ל-95% ממס B במשך 5 דקות והחזיק מעמד 3 דקות כדי לשטוף את הטור, ולאחר מכן חזר ל-2% B על פני 3 דקות והחזיק מעמד 9 דקות כדי לצייד מחדש את העמודה.
הערה: מעבר צבע זה מספיק עבור LC-MS/MS של רוב תערובות FPOP חד-חלבון ושני חלבונים המבקשים לעשות כימות ברמת פפטיד. אחוז הממס B ייתכן שיהיה צורך לשנות כדי להגדיל את רזולוציית פפטיד במקרים נדירים שבהם פפטידים להפריע זה לזה בשל זמני שמירה דומים וערכי m/z. FPOP22 בקנה מידה פרוטאומי או עיצובים ניסיוניים המבקשים להפריד בין isomers מוצר חמצון פפטיד1,23,24,25 עשוי לדרוש מעברי צבע LC ארוכים יותר והם מעבר להיקף של דו"ח זה. - התעדכו את הפפטידים ישירות למקור הננו-ספארי של ספקטרומטר מסה ברזולוציה גבוהה באמצעות מקרן ננו-ספארי מוליך.
- השג את הנתונים במצב יון חיובי. הגדר את מתח הריסוס ל- 2400 V, ואת הטמפרטורה של צינור העברת היונים ל- 300 °C.
- לרכוש את סריקות MS המלא מ m/z 250 עד 2000 ברזולוציה נומינלית ב m/z 200 של 60,000 ואחריו שמונה סריקות יון ליניאריות תלויות נתונים עוקבות על שמונה יונים פפטידים הנפוצים ביותר באמצעות דיסוציאציה המושרה התנגשות ב 35% אנרגיה מנורמלת כדי לזהות את הפפטידים. פצלו את הפפטידים עד חמש פעמים בתוך 30 שניות ולאחר מכן עברו לרשימת אי-הכללה של 60 שניות.
7. עיבוד נתונים וחישוב חמצון ממוצע של פפטידים
- לקבוע את כיסוי הרצף של החלבון, ערכי m/z, וזמי שמירה של פפטידים לא חמצון באמצעות מנוע החיפוש פרוטאומיקה MS / MS.
- הגדר את עמידות המסה הקדמה ל- 10 עמודים לדקה ואפשר עד שני אתרי מחשוף שלא נענו עבור הדגימות המעוכלות של טריפסין, תוך שימוש ספציפיות סטנדרטית במחשוף ים-סוף.
- הגדר את סובלנות מסה פפטיד רסיס ל 0.4 דלטון.
- בהתבסס על יחס m/z של פפטידים שלא שינו זוהו ואת משמרות המסה הידועות של מוצרי חמצון העיקריים, לחשב את m/z של מוצרי חמצון תיאורטיים שונים של כל פפטיד4,,26,27,28,,29.
- זהה את כרומטוגרמה יון שחולצו של ערכי m/z אלה באמצעות תוכנה כדי להציג את הריצה ספקטרומטרית מסה (איור 4). זהה את מוצרי החמצון פפטיד בהתבסס על m/zשלהם , מצב החיוב שלהם, ואת הדמיון בזמן התחסה לפפטיד שלא שינה. בידיים שלנו, מוצרי חמצון פפטיד לבלוט בין 240 שניות לפני 180 שניות לאחר פפטיד שלא שינה באמצעות מעבר הצבע LC לעיל. כמו חמצון לעתים קרובות לגרום מוצרי חמצון איזורי מרובים, זה נפוץ לצפות פסגות מרובות נפתרו חלקית כרומטוגרמות יון שחולצו של מוצרי חמצון פפטיד, כפי שהראה איור 4. מוצרי חמצון פפטיד מכמתים בהתבסס על האזור של שיאים(ים) כרומטוגרמות יון שחולצו.
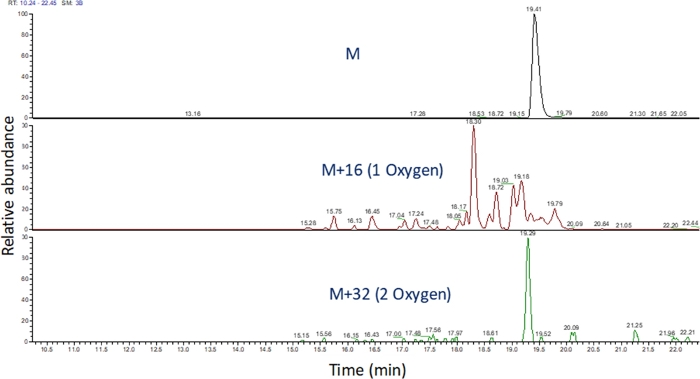
איור 4: כרומטוגרמה יון מופקת של פפטיד ומוצרי החמצון שלה לאחר FPOP. m/z של מוצרי חמצון פפטיד מחושבים בהתבסס על m/z של פפטיד לא חמצון ומוצרי חמצון ידועים; והתחומים של מוצרי פפטיד אלה נקבעים. האזור של מוצרי פפטיד משמש לאחר מכן לחישוב של אירועי חמצון הממוצע לכל פפטיד. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
- חשב את החמצון הממוצע של הפפטידים באמצעות המשוואה הבאה.
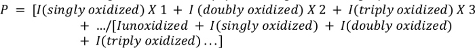
כאשר P מציין את המספר הממוצע של אירועי חמצון לכל מולקולת פפטיד, ואני מייצג את אזור השיא של פפטיד לא חמצון (Iunoxidized) ואת פפטיד עם אירועי חמצון n. שים לב כי אני (חמצון סינגלי) יכלול לא רק תוספות של אטום חמצן יחיד, אלא גם אירועים אחרים פחות נפוצים חמצון יחיד כי החוקר עשוי לבחור למדוד (למשל, decarboxylation חמצוני, היווצרות קרבוניל, וכו ') 4,,26,,27,,28,,29.
תוצאות
השוואה של טביעת הרגל פפטיד שרשרת כבדה של adalimumab biosimilar במאגר פוספט וכאשר מחומם ב 55 ° C עבור 1 h להראות תוצאות מעניינות. מבחן t של התלמיד משמש לזיהוי פפטידים שהשתנו באופן משמעותי בשני תנאים אלה (p ≤ 0.05). הפפטידים 20-38, 99-125, 215-222, 223-252, 260-278, 376-413, ו 414-420 מראים הגנה משמעותית מפני ממס כאשר החלבון מחומם לאצ?...
Discussion
טכניקות מבניות מבוססות ספקטרומטריה מסה, כולל החלפת מימן-דיטריום, קישור צולב כימי, תיוג קוולנטי, ספקטרומטריה מסה ספריי מקורית וניידות יון גדלו במהירות בפופולריות בשל הגמישות שלהם, רגישות, והיכולת להתמודד עם תערובות מורכבות. FPOP מתגאה במספר יתרונות שהגבירו את הפופולריות שלה בתחום של טכניקו?...
Disclosures
יהושע ס. שארפ חושף עניין פיננסי משמעותי ב-GenNext Technologies, Inc., חברה קטנה המבקשת למסחר טכנולוגיות לניתוח מבנה סדר גבוה יותר של חלבון, כולל טביעת רגל של חלבון רדיקלי הידרוקסיל.
Acknowledgements
אנו מכירים מימון מחקר מהמכון הלאומי למדעי הרפואה הכלליים להעניק R43GM125420-01 כדי לתמוך בפיתוח מסחרי של התקן FPOP ספסל ו R01GM127267 לפיתוח פרוטוקולי סטנדרטיזציה וdsimetry עבור FPOP אנרגיה גבוהה.
Materials
| Name | Company | Catalog Number | Comments |
| Adenine | Acros Organics | 147440250 | Soluble in water upto 3.5 mM |
| Aperture | Edmund Optics | 39-905 | 1000 μm Aperture Diameter, Gold-Plated Copper Aperture |
| Aperture holder | Edmund Optics | 53-287 | 25.8mm Outer Diameter, Precision Pinhole Mount |
| Catalse | Sigma Aldrich | C-40 | Catalase from bovine liver, lyophilized powder, ≥10,000 units/mg protein |
| COMPex Pro laser | Coherent | 1113836 | COMPexPRO 102, F-Vversion, KrF laser, No XeCl |
| Dithiotheitol (DTT) | Promega | V3151 | DTT, Molecular Grade (DL-Dithiothreitol) |
| Fraction collector | GenNext Technologies, Inc. | N/A | Automated fraction collector |
| Fused silica capillay | Molex | 1068150023 | Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 100 µm, Outer Diameter 375 µm, TSP100375 |
| Glutamine | Acros Organics | 119951000 | L(+)-Glutamine, 99% |
| Holder for lens | Edmund Optics | 03-668 | 53 mm Outer Diameter, Three-Screw Adjustable Ring Mount |
| Hydrogen peroxide | Fisher Scientific | H325-100 | Hydrogen Peroxide, 30% (Certified ACS), Fisher Chemical |
| LC-MS/MS system | Thermo Scientific | IQLAAEGAAPFADBMBCX | Dionex Ultimate 3000 coupled to Orbitap Fusion Tribrid mass spectrometer |
| Mas spec grade Acetonitrile | Fisher Scientific | A955-1 | Acetonitrile, Optima LC/MS Grade, Fisher Chemical |
| Mass spec grade formic acid | Fisher Scientific | A117-50 | Formic Acid, 99.0+%, Optima™ LC/MS Grade, Fisher Chemical |
| Mass spec grade water | Fisher Scientific | W6-4 | Water, Optima LC/MS Grade, Fisher Chemical |
| MES buffer | Sigma Aldrich | M0164 | MES hemisodium salt |
| Methionine amide | Bachem | 4000594.0005 | H-met-NH2.HCl |
| Micro V clamp | Thor Labs | VK250 | Micro V-clamp with stainless steel blades |
| Motorized stage | Edmund Optics | 68-638 | 50mm Travel Motorized Stage System with Manual Control |
| Nano C18 colum | Thermo Scientific | 164534 | Acclaim PepMap 100 C18 HPLC Columns |
| Optical bench | Edmund Optics | 56-935 | 18" x 18" breadboard |
| Pioneer FPOP Module System | GenNext Technologies, Inc. | N/A | Inline FPOP Radical Dosimetry System |
| Post holder | Edmund Optics | 58-979 | 3" Length, ¼-20 Thread, Post Holder |
| Sodium phosphate dibasic | Fisher Scientific | BP331-500 | Sodium Phosphate Dibasic Heptahydrate (Colorless-to-White Crystals), Fisher BioReagents |
| Sodium phosphate monobasic | Fisher Scientific | BP330-500 | Sodium Phosphate Monobasic Monohydrate (Colorless-to-white Crystals), Fisher BioReagents |
| Syringe | Hamilton | 81065 | 100 µL, Model 1710 RN SYR, Small Removable NDL, 22s ga, 2 in, point style 3 |
| Syringe pump | KD Scientific | 788101 | Legato 101 syringe pump |
| Trap C18 column | Thermo Scientific | 160454 | Thermo Scientific Acclaim PepMap 100 C18 HPLC Columns |
| Tris | Sigma Aldrich | 252859 | Tris(hydroxymethyl)aminomethane |
| Trypsin | Promega | V5111 | Sequencing Grade Modified Trypsin |
| UV plano convex lens | Edmund Optics | 84-285 | 30 mm Dia. x 120 mm FL Uncoated, UV Plano-Convex Lens |
References
- Kaur, P., Kiselar, J., Yang, S., Chance, M. R. Quantitative protein topography analysis and high-resolution structure prediction using hydroxyl radical labeling and tandem-ion mass spectrometry (MS). Molecular & Cellular Proteomics. 14 (4), 1159-1168 (2015).
- Hambly, D. M., Gross, M. L. Laser flash photolysis of hydrogen peroxide to oxidize protein solvent-accessible residues on the microsecond timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Buxton, G. V., Greenstock, C. L., Helman, W. P., Ross, A. B. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O- in Aqueous Solution. Journal of Physical and Chemical Reference Data. 17 (2), 513 (1988).
- Xu, G., Chance, M. R. Radiolytic modification and reactivity of amino acid residues serving as structural probes for protein footprinting. Analytical Chemistry. 77 (14), 4549-4555 (2005).
- Sharp, J. S., Tomer, K. B. Effects of anion proximity in peptide primary sequence on the rate and mechanism of leucine oxidation. Analytical Chemistry. 78 (14), 4885-4893 (2006).
- Huang, W., Ravikumar, K. M., Chance, M. R., Yang, S. Quantitative mapping of protein structure by hydroxyl radical footprinting-mediated structural mass spectrometry: a protection factor analysis. Biophysical Journal. 108 (1), 107-115 (2015).
- Xie, B., Sood, A., Woods, R. J., Sharp, J. S. Quantitative protein topography measurements by high resolution hydroxyl radical protein footprinting enable accurate molecular model selection. Scientific Reports. 7 (1), 4552 (2017).
- Li, Z., et al. High structural resolution hydroxyl radical protein footprinting reveals an extended Robo1-heparin binding interface. Journal of Biological Chemistry. 290 (17), 10729-10740 (2015).
- Li, X., et al. Structural analysis of the glycosylated intact HIV-1 gp120-b12 antibody complex using hydroxyl radical protein footprinting. Biochemistry. 56 (7), 957-970 (2017).
- Li, K. S., Shi, L., Gross, M. L. Mass spectrometry-based fast photochemical oxidation of proteins (FPOP) for higher order structure characterization. Accounts of Chemical Research. 51 (3), 736-744 (2018).
- Li, J., Chen, G. The use of fast photochemical oxidation of proteins coupled with mass spectrometry in protein therapeutics discovery and development. Drug Discovery Today. 24 (3), 829-834 (2019).
- Roush, A. E., Riaz, M., Misra, S. K., Weinberger, S. R., Sharp, J. S. Intrinsic buffer hydroxyl radical dosimetry using Tris(hydroxymethyl)aminomethane. Journal of the American Society for Mass Spectrometry. 31 (2), 169-172 (2020).
- Xie, B., Sharp, J. S. Hydroxyl radical dosimetry for high flux hydroxyl radical protein footprinting applications using a simple optical detection method. Analytical Chemistry. 87 (21), 10719-10723 (2015).
- Niu, B., Zhang, H., Giblin, D., Rempel, D. L., Gross, M. L. Dosimetry determines the initial OH radical concentration in fast photochemical oxidation of proteins (FPOP). Journal of the American Society for Mass Spectrometry. 26 (5), 843-846 (2015).
- Niu, B., et al. Incorporation of a reporter peptide in FPOP compensates for adventitious scavengers and permits time-dependent measurements. Journal of the American Society for Mass Spectrometry. 28 (2), 389-392 (2017).
- Garcia, N. K., Sreedhara, A., Deperalta, G., Wecksler, A. T. Optimizing hydroxyl radical footprinting analysis of biotherapeutics using internal standard dosimetry. Journal of the American Society for Mass Spectrometry. 31 (7), 1563-1571 (2020).
- Sharp, J. S., Misra, S. K., Persoff, J. J., Egan, R. W., Weinberger, S. R. Real time normalization of fast photochemical oxidation of proteins experiments by inline adenine radical dosimetry. Analytical Chemistry. 90 (21), 12625-12630 (2018).
- Zhang, B., Cheng, M., Rempel, D., Gross, M. L. Implementing fast photochemical oxidation of proteins (FPOP) as a footprinting approach to solve diverse problems in structural biology. Methods. 144, 94-103 (2018).
- Konermann, L., Stocks, B. B., Czarny, T. Laminar flow effects during laser-induced oxidative labeling for protein structural studies by mass spectrometry. Analytical Chemistry. 82 (15), 6667-6674 (2010).
- Gau, B. C., Sharp, J. S., Rempel, D. L., Gross, M. L. Fast photochemical oxidation of protein footprints faster than protein unfolding. Analytical Chemistry. 81 (16), 6563-6571 (2009).
- Li, K. S., et al. Hydrogen-Deuterium exchange and hydroxyl radical footprinting for mapping hydrophobic interactions of human bromodomain with a small molecule Inhibitor. Journal of the American Society for Mass Spectrometry. 30 (12), 2795-2804 (2019).
- Espino, J. A., Jones, L. M. Illuminating biological interactions with in vivo protein footprinting. Analytical Chemistry. 91 (10), 6577-6584 (2019).
- Charvatova, O., et al. Quantifying protein interface footprinting by hydroxyl radical oxidation and molecular dynamics simulation: application to galectin-1. Journal of the American Society for Mass Spectrometry. 19 (11), 1692-1705 (2008).
- Gau, B., Garai, K., Frieden, C., Gross, M. L. Mass spectrometry-based protein footprinting characterizes the structures of oligomeric apolipoprotein E2, E3, and E4. Biochemistry. 50 (38), 8117-8126 (2011).
- Gau, B. C., Chen, J., Gross, M. L. Fast photochemical oxidation of proteins for comparing solvent-accessibility changes accompanying protein folding: Data processing and application to barstar. Biochimica et Biophysica Acta. 1834 (6), 1230-1238 (2013).
- Garrison, W. M. Reaction mechanisms in the radiolysis of peptides, polypeptides, and proteins. Chemical Reviews. 87 (2), 381-398 (1987).
- Xu, G., Chance, M. R. Radiolytic modification of sulfur-containing amino acid residues in model peptides: fundamental studies for protein footprinting. Analytical Chemistry. 77 (8), 2437-2449 (2005).
- Xu, G., Chance, M. R. Radiolytic modification of acidic amino acid residues in peptides: probes for examining protein-protein interactions. Analytical Chemistry. 76 (5), 1213-1221 (2004).
- Xu, G., Takamoto, K., Chance, M. R. Radiolytic modification of basic amino acid residues in peptides: probes for examining protein-protein interactions. Analytical Chemistry. 75 (24), 6995-7007 (2003).
- Misra, S. K., Orlando, R., Weinberger, S. R., Sharp, J. S. Compensated hydroxyl radical protein footprinting measures buffer and excipient effects on conformation and aggregation in an adalimumab biosimilar. AAPS Journal. 21 (5), 87 (2019).
- Simmons, D. A., Konermann, L. Characterization of transient protein folding intermediates during myoglobin reconstitution by time-resolved electrospray mass spectrometry with on-line isotopic pulse labeling. Biochemistry. 41 (6), 1906-1914 (2002).
- Vahidi, S., Konermann, L. Probing the time scale of FPOP (fast photochemical oxidation of proteins): radical reactions extend over tens of milliseconds. Journal of the American Society for Mass Spectrometry. 27 (7), 1156-1164 (2016).
- Chance, M. R. Unfolding of apomyoglobin examined by synchrotron footprinting. Biochemical and Biophysical Research Communications. 287 (3), 614-621 (2001).
- Xu, G., Chance, M. R. Hydroxyl radical-mediated modification of proteins as probes for structural proteomics. Chemical Reviews. 107 (8), 3514-3543 (2007).
- Zhang, Y., Rempel, D. L., Zhang, H., Gross, M. L. An improved fast photochemical oxidation of proteins (FPOP) platform for protein therapeutics. Journal of the American Society for Mass Spectrometry. 26 (3), 526-529 (2015).
- Cornwell, O., Radford, S. E., Ashcroft, A. E., Ault, J. R. Comparing hydrogen deuterium exchange and fast photochemical oxidation of proteins: a structural characterisation of wild-type and ΔN6 β(2)-microglobulin. Journal of the American Society for Mass Spectrometry. 29 (2), 2413-2426 (2018).
- Xie, B., Sharp, J. S. Relative Quantification of sites of peptide and protein modification using size exclusion chromatography coupled with electron transfer dissociation. Journal of the American Society for Mass Spectrometry. 27 (8), 1322-1327 (2016).
- Srikanth, R., Wilson, J., Vachet, R. W. Correct identification of oxidized histidine residues using electron-transfer dissociation. Journal of Mass Spectrometry. 44 (5), 755-762 (2009).
- Li, X., Li, Z., Xie, B., Sharp, J. S. Improved identification and relative quantification of sites of peptide and protein oxidation for hydroxyl radical footprinting. Journal of the American Society for Mass Spectrometry. 24 (11), 1767-1776 (2013).
- Li, X., Li, Z., Xie, B., Sharp, J. S. Supercharging by m-NBA Improves ETD-Based Quantification of Hydroxyl Radical Protein Footprinting. Journal of the American Society for Mass Spectrometry. 26 (8), 1424-1427 (2015).
- Khaje, N. A., Sharp, J. S. Rapid quantification of peptide oxidation isomers from complex mixtures. Analytical Chemistry. 92 (5), 3834-3843 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved