Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Protein Topografya Değişikliklerinin Belirlenmesinde Proteinlerin Hızlı Fotokimyasal Oksidasyonlarında Gerçek Zamanlı Telafinin Sağlanması
Bu Makalede
Özet
Proteinlerin hızlı fotokimyasal oksidasyonu proteinlerin yapısal karakterizasyonu için ortaya çıkan bir tekniktir. Farklı solvent katkı maddeleri ve ligandlar çeşitli hidroksil radikal atma özelliklerine sahiptir. Farklı koşullarda protein yapısını karşılaştırmak için reaksiyonda oluşan hidroksil radikallerinin gerçek zamanlı telafisi reaksiyon koşullarını normalleştirmek için gereklidir.
Özet
Proteinlerin hızlı fotokimyasal oksidasyonu (FPOP), proteinlerin çözücüye erişilebilen yüzey alanını araştıran kütle spektrometresi temelli yapısal biyoloji tekniğidir. Bu teknik, amino asit yan zincirlerin çözeltide serbestçe difüzyon olan hidroksil radikalleri ile reaksiyonuna dayanır. FPOP hidrojen peroksit lazer fotolizi ile yerinde bu radikalleri oluşturur, bir mikrosaniye sırasına göre tükenmiş hidroksil radikallerin bir patlama oluşturma. Bu hidroksil radikalleri bir çözücü erişilebilir amino asit yan zincir ile reaksiyona girdiğinde, reaksiyon ürünleri ölçülebilir ve kütle spektrometresi ile ölçülen ve ölçülen bir kütle kayması sergiler. Bir amino asitin reaksiyon oranı kısmen o amino asitin ortalama çözücü erişilebilir yüzeyine bağlı olduğundan, bir proteinin belirli bir bölgenin oksidasyon miktarındaki ölçülen değişiklikler, farklı konformasyonlar arasındaki bölgenin çözücü erişilebilirliğindeki değişikliklerle doğrudan ilişkili olabilir (örn. ligand bağlı vs. ligand-vs. agrega, monomer vs. agrega, vb.) FPOP biyolojide protein-protein etkileşimleri, protein konformasyonel değişiklikleri ve protein-ligand bağlanması gibi bir dizi sorunda uygulanmıştır. Hidroksil radikallerinin mevcut konsantrasyonu FPOP deneyindeki birçok deneysel koşula bağlı olarak değiştiğinden, protein analitinin maruz kaldığı etkili radikal dozu izlemek önemlidir. Bu izleme, FPOP reaksiyonundan gelen sinyali ölçmek için sıralı bir dosimetre nin biraraya gelmesiyle etkin bir şekilde sağlanır ve istenilen miktarda oksidasyon elde etmek için gerçek zamanlı olarak ayarlanmış lazer fluence ile sağlanır. Bu kompansasyon ile, protein topografyasında konformasyonel değişiklikleri, ligand-bağlayıcı yüzeyleri ve/veya protein-protein etkileşim arayüzlerini yansıtan değişiklikler nispeten düşük örneklem miktarları kullanılarak heterojen örneklerde belirlenebilir.
Giriş
Proteinlerin hızlı fotokimyasal oksidasyonu (FPOP), proteinlerin solvente maruz kalan yüzey alanının ultra hızlı kovalent modifikasyonu ve ardından LC-MS1tarafından saptanması ile protein topografik değişikliklerinin belirlenmesinde ortaya çıkan bir tekniktir. FPOP hidrojen peroksit UV lazer flaş fotoliz ihda hidroksil radikallerin yüksek konsantrasyon üretir. Bu hidroksil radikalleri çok reaktif ve kısa ömürlü, FPOP koşulları altında kabaca bir mikrosaniye zaman ölçeğinde tüketilen2. Bu hidroksil radikalleri su yoluyla yayılır ve genellikle hızlı (~106 M-1 s-1)difüzyon kontrollü3arasında değişen kinetik oranlarda çözelti çeşitli organik bileşenleri okside . Hidroksil radikal bir protein yüzeyi karşılaştığında, radikal protein yüzeyinde amino asit yan zincirleri okside edecek, bu amino asit bir kitle kayması ile sonuçlanan (en yaygın bir oksijen atomunun net eklenmesi)4. Herhangi bir amino asit oksidasyon reaksiyonu oranı iki faktöre bağlıdır: bu amino asit doğal reaktivite (yan zincir ve dizi bağlamına bağlıdır)4,5 ve difüzyon hidroksil radikal bu yan zincirin erişilebilirlik, hangi yakından ortalama ortalama çözücü erişilebilir yüzey alanı ile ilişkilidir6,7. Glisin dışındaki tüm standart amino asitler, fpop deneylerinde bu son derece reaktif hidroksil radikalleri tarafından etiketlenmiş olarak gözlenmiştir, çok farklı verimde de olsa; uygulamada, Ser, Thr, Asn ve Ala nadiren yüksek radikal dozlar altında dışında çoğu örnekte oksitlenmiş olarak görülür ve dikkatli ve hassas hedefli ETD parçalanma8,,9ile tanımlanır. Oksidasyondan sonra, hidrojen peroksit ve sekonder oksidanları (süperoksit, tek oksijen, peptidil hidroperoksitler vb.) çıkarmak için numuneler söndürülür. Söndürülen numuneler daha sonra oksitlenmiş peptidlerin karışımlarını oluşturmak için proteolytically sindirilir, burada yapısal bilgiler çeşitli peptidlerin oksidasyon ürünlerinin desenlerinde kimyasal bir "anlık" olarak dondurulur(Şekil 1). Kütle spektrometresi (LC-MS) ile birleşen sıvı kromatografisi, bu peptidin okside ve oksitlenmemiş versiyonlarının göreceli yoğunluklarına göre belirli bir proteolitik peptiddeki amino asitlerin oksidasyon miktarını ölçmek için kullanılır. Farklı konformasyonel koşullar altında elde edilen aynı proteinin bu oksidatif ayak izini karşılaştırarak (örn. ligand bağlı karşı ligand-free), proteinin belirli bir bölgenin oksidasyon miktarındaki farklılıklar doğrudan o bölgenin solvent erişilebilir yüzey alanında farklılıklar ile ilişkili olabilir6,7. Protein topografik bilgi sağlamak için yeteneği FPOP proteinlerin yüksek sıralı yapı belirlenmesi için cazip bir teknoloji yapar, protein terapötik keşif ve geliştirme dahil10,11.

Şekil 1: FPOP'a genel bakış. Proteinin yüzeyi son derece reaktif hidroksil radikalleri tarafından kovalent olarak modifiye edilir. Hidroksil radikalleri kuvvetle yan zincirin solvent erişilebilirlik etkilenir bir oranda proteinamino asit yan zincirleri ile tepki verecektir. Topografik değişiklikler (örneğin, yukarıda gösterildiği gibi bir ligand bağlanması nedeniyle) hidroksil radikalleri ile reaksiyona etkileşim bölgesinde amino asitler koruyacak, LC-MS sinyalinde modifiye peptit yoğunluğunda bir azalmaya neden. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
FPOP çözeltisinde bulunan farklı bileşenler (örn. ligandlar, eksipiyanlar, tamponlar) hidrojen peroksit3'ünlazer fotolizisi üzerine üretilen hidroksil radikallerine karşı farklı atma aktivitesine sahiptir. Benzer şekilde, peroksit konsantrasyonu küçük bir değişiklik, lazer fluence, ve tampon kompozisyon etkili radikal dozu değiştirebilir, örnekler arasında ve farklı laboratuvarlar arasında zorlu FPOP verilerinin çoğaltılması yapma. Bu nedenle, birkaç mevcut hidroksil radikal doz12,,13,1412,,15,16kullanarak her örnekte protein ile reaksiyona mevcut hidroksil radikal dozu karşılaştırmak mümkün olması önemlidir. Hidroksil radikal dosimetreler hidroksil radikalleri havuzu için analit (ve çözelti tüm çöpçüler ile) ile rekabet ederek hareket; hidroksil radikallerin etkin dozu dozimetreoksidasyon miktarı ölçülerek ölçülür. "Etkili hidroksil radikal doz" hidroksil radikal üretilen ilk konsantrasyonu ve radikal yarı ömrü hem de bir fonksiyonu olduğunu unutmayın. Bu iki parametre kısmen birbirine bağımlı dır ve teorik kinetik modellemeyi biraz karmaşık hale getirirler(Şekil 2). İki örnek, oluşan hidroksil radikalin ilk konsantrasyonunu değiştirerek aynı etkili radikal dozu korurken çılgınca farklı ilk radikal yarı yaşamlara sahip olabilir; onlar hala aynı ayak izleriüretecek 17. Adenin13 ve Tris12 uygun hidroksil radikal dozimetrelerdir çünkü oksidasyon düzeyleri UV spektroskopisi ile gerçek zamanlı olarak ölçülebiliyor, bu da araştırmacıların etkili hidroksil radikal dozda bir sorun olduğunda hızlı bir şekilde belirlemelerine ve problemlerini çözmelerine olanak sağlıyor. Bu sorunu çözmek için, akış sisteminde bulunan ve ışınlama bölgesinden hemen sonra bulunan ve adenin emicilik değişikliklerinden gelen sinyali gerçek zamanlı olarak izleyebilen bir sıralı dosimetre önemlidir. Bu tamponlar veya hidroksil radikal atma kapasitesi17geniş ölçüde farklı seviyelerde başka bir eksipiyan FPOP deneyleri yürütülmesinde yardımcı olur. Bu radikal doz telafisi gerçek zamanlı olarak yapılabilir, etkili radikal doz ayarlayarak aynı konformer için istatistiksel olarak ayırt edilemez sonuçlar veren.
Bu protokolde, bir iç optik radikal dosimetre olarak adenin kullanarak radikal dozaj telafisi ile tipik bir FPOP deney icra etmek için ayrıntılı prosedürler var. Bu yöntem, araştırmacıların gerçek zamanlı olarak tazminat gerçekleştirerek farklı atma kapasitesine sahip FPOP koşulları arasında ayak izlerini karşılaştırmalarına olanak tanır.
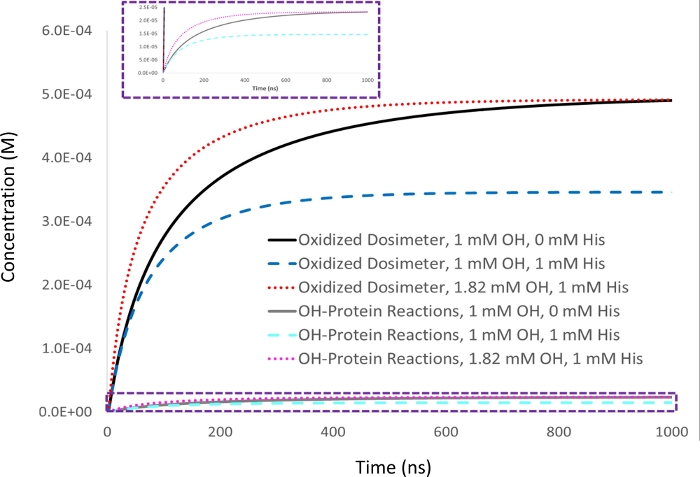
Şekil 2: Dozimetri bazlı kompanzasyonun kinetik simülasyonu. 1 mM adenin dosimetre yanıtı 5 mm ilk hidroksil radikal konsantrasyonu (▪OH t t1/2=53 ns) ile 5 μM lizozim analyit cinsinden ölçülür ve hedef dosimetre yanıtı (siyah) olarak ayarlanır. 1 mM'lik ekskavatif histidin eklenmesi yle, dosimetre yanıtı (mavi) protein oksidasyonu miktarı ile birlikte orantılı bir şekilde azalır (siyan. Hidroksil radikalinin yarı ömrü de azalır (▪OH t1/2=39 ns). Üretilen hidroksil radikal miktarı, 1 mM histidin çöpçü ile numunede oksidasyonlu dosimetrenin eşdeğer verimini vermek için arttırıldığında, çöpçü (kırmızı) yokluğunda 1 mM hidroksil radikal ile elde edilen protein oksidasyonu miktarı benzer şekilde aynı hale gelirken (macenta), hidrosil radikal yarı ömrü daha da azalır (▪OH t1/2=29 n9). Sharp J.S., Am Pharmaceut Rev 22, 50-55, 2019 izniyle uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
1. FPOP için Optik Tezgah ve Kılcal hazırlayın
DİkKAT: KrF excimer lazerler aşırı göz tehlikeleri vardır, ve doğrudan veya yansıyan ışık kalıcı göz hasarına neden olabilir. Her zaman uygun göz koruması takın, mümkün olduğunda ışın yolunun yakınında yansıtıcı nesnelerin varlığından kaçının ve aktif bir lazere yetkisiz erişimi önlemek ve başıboş yansımaları dizginlemek için mühendislik kontrollerini kullanın.
- FPOP optik tezgahı hazırlayın.
- Isınmak için lazeri açın. Lazeri Harici Tetik, Sabit Enerji, Gaz Değişimi Yok'a ayarlayın. Darbe başına lazer enerjisini ayarlayın (genellikle 80-120 mJ/nabız arasında).
- Optik tezgahı plano-dışbüvek lens (30 mm Dia. x 120 mm FL kaplamasız) ile doğrudan lazer ışınının yoluna ve Şekil 3A'dagösterildiği gibi ışığı absorbe etmek için yansıtıcı olmayan bir arka stopa kurun.

Şekil 3: FPOP deneyi için optik tezgah. (A) Örnek H2O2, adennine radikal dosimetre ve glutamin çöpçü ile karıştırılır ve şırınga içine yüklenir. Örnek bir KrF excimer UV lazer odaklanmış ışın yolu üzerinden erimiş silika kılcal itilir. UV ışığı H2O2'yi hidroksil radikallere fotolize eder, bu da protein ve adenin dosimetreyi oksitler. Şırınga akışı, ışıklı bölgeler arasında ışıksız bir dışlama hacmi yle, bir sonraki lazer darbesinden önce, ışıklı numuneyi lazerin yolundan dışarı iter. Oksidasyondan hemen sonra, numune 265 nm'de adenin UV emülsinini ölçen sıralı bir UV spektrofotometreden geçirilir. Numune daha sonra kalan H2O2 ve ikincil oksidanları ortadan kaldırmak için bir söndürme tamponuna yatırılır. (B) Nokta boyutu, 248 nm'de lazerle kılcal damarın arkasına yapıştırılmış renkli yapışkan bir nota ışınlandıktan sonra ölçülür. Noktanın genişliği örnek akış hızının hesaplanmasında kullanılır ve noktanın merkezindeki kılcal damar silueti optik tezgahı hizalamak için kullanılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Erimiş silika kılcal damarının uygun bir uzunluğunu (360 μm dış çapı ve 100 m iç çapı) kesin ve bir kılıf kullanarak, düşük ölü hacimli konektör kullanarak gaz geçirmez şırıngaya bağlanın.
- Kapillerin poliimid kaplamasını, numunelerin lazerle maruz kaldıktan sonra 265 nm'de inline dosimetrenin emici sinyali okuduğu yerde bir bütan meşaleile hafifçe yakın. Tüy bırakmayan bir mendilde metanol kullanarak kılcal damardaki enkazı silin. Lazer insidansı yerinde poliimid kaplama ya benzer bütan meşale ile yanmış ya da düşük güçte excimer lazer ateş ile yanmış olabilir.
NOT: Sıcak kılcal damarüzerinde metanol kullanmak bir yangın tehlikesi olduğu gibi kılcal serinlemek için bekleyin. - Bu kılcal damarı lazerin ışın yolundan ve sıralı dosimetreye yerleştirin.
- Menteşeyi açmak için satır lı dosimetrenin üstündeki kolu basın. Manyetik tutucuları çıkarın. Kapilleri yerinde tutmak için manyetik tutucuları kullanarak kapilleri sıralı dosimetrenin işlenmiş oluğuna yerleştirin. Kulak tırnağı nın üzerindeki dosimetre menteşesini kapatın ve kol yerine kilitlenene kadar bastırın.
- Dozimetri yazılımını kullanarak, excimer lazeri ateşlemeye başlamak için Flash'ı Başlat düğmesine tıklayın. Lazer kontrol yazılımının kendisinde önceden ayarlanmış lazer gücünü 50-100 mJ/darbe arasında ayarlayın ve dozimetri yazılımının Ayarlar sekmesinde önceden ayarlanmış tekrarlama oranını 10-20 Hz arasında ayarlayın.
- Doğrusal motorlu bir sahneye monte edilmiş plano konveks lens kullanarak lazer ışınına odaklanın. Şekil 3B'degösterildiği gibi olay fluence 'ı (mJ/mm2)hesaplamak için bir kaliper kullanarak yapışkan bir not üzerindeki kılcal damarın konumundaki lazer lekesinin genişliğini ve yüksekliğini ölçün.
- Merceğin hareketi veya lazerin darbe başına enerjideğişimi nedeniyle ışın boyutundaki değişikliklerden bağımsız olarak kılcal damarın tutarlı ışıklı genişliğini sağlamak için kılcal damarın yakınına opak bir diyafram açıklığı yerleştirin18.
- Lazer le ateş ile motorlu sahneyi hareket menzilinde hareket ettirin. Kirişin diyafram açıklığına odaklanmış olarak kaldığından ve kılcal damarın siluetinin boyunca gözlemlenebilmesini sağlayın. Diyafram çapı motorlu sahne aralığında her noktada impinging odaklı Kiriş genişliğinden daha küçük olmalıdır.
- Kapilleri yıkamak için en az bir dakika boyunca 20 μL/dk'da kılcal damardan su geçirin.
- Dosimetre yi suya sıfırlamak ve veri toplamaya başlamak için dosimeter yazılımındaki Başlat Veri + AutoZero düğmesini tıklatın.
NOT: FPOP için tampon sistemi 265 nm önemli UV emici varsa, FPOP sistemi tampon değil, su üzerinde sıfırlanmış olmalıdır.
- Dosimetre yi suya sıfırlamak ve veri toplamaya başlamak için dosimeter yazılımındaki Başlat Veri + AutoZero düğmesini tıklatın.
- Şırınga pompasıüzerinde hesaplanan akış hızını ayarlayın.
- Protein örneğinin akış hızı çekim başına ışınlanmış hacim bağlıdır(VIrr),saniye başına lazer çekim sayısı(R),ve istenilen Unradiated dışlama hacmi fraksiyonu(FEx) laminar akış etkileri ve örnek difüzyon (0.15-0.30 önerilen) 22,19,20. Mm(w)içinde mm (w) içinde kapiller iç çapı(d) ve kılcal (yani, diyafram genişliği) üzerine imping lazer nokta genişliği ne dayalı Vİrr (μL) hesaplayın:
Vİrr = π(d/2)2w - Aşağıdaki denklemi temel alan istenilen akış hızını (μL/dk olarak) hesaplayın:
Akış = 60R[VIrr (1 + FEx)]
- Protein örneğinin akış hızı çekim başına ışınlanmış hacim bağlıdır(VIrr),saniye başına lazer çekim sayısı(R),ve istenilen Unradiated dışlama hacmi fraksiyonu(FEx) laminar akış etkileri ve örnek difüzyon (0.15-0.30 önerilen) 22,19,20. Mm(w)içinde mm (w) içinde kapiller iç çapı(d) ve kılcal (yani, diyafram genişliği) üzerine imping lazer nokta genişliği ne dayalı Vİrr (μL) hesaplayın:
2. FPOP için protein çözeltisinin hazırlanması
- Proteini iki veya daha fazla farklı koşullarda (örn. ligand bağlı ve ligand-free; agrega ve monomer; tek başına ve protein-protein bağlayıcı partneri ile; vb.) karşılaştırılabilir şekilde hazırlayın.
- FPOP için kullanılan toplam hacmi denemenin gereksinimlerine uyacak şekilde ayarlayın. Minimum sınır genellikle ışınlama kılcal damarının hacmine ve sağlam algılama ve göreceli nicelik için gerekli olan malzemeye bağlıdır ve büyük ölçüde kullanılan LC-MS/MS sistemine ve etiket sonrası numune işleme yöntemine bağlı olarak değişir. Grubumuzda yaygın olarak kullanılan FPOP çözeltilerinin toplam hacmi hidrojen peroksit ilavesinden sonra 20 μL'dir. Proteinin son konsantrasyonu genellikle 1-10 μM, 17 mM glutamin ile (hidroksil radikalin ömrünü sınırlamak için), 1 mM adenin (radikal bir dosimetre olarak hareket etmek için)13,,17 ve 10 mM fosfat tampon (hidroksil radikallerinin zayıf bir leş yiyici bir tampon). Örnekler genellikle sonuçların istatistiksel modellemesine olanak sağlamak için birden çok çoğaltma ile hazırlanır.
- En genel amaçlar için, her iki eyalette de triplicate örnekleri hazırlamak, artı arka plan oksidasyon ölçmek için bir no-lazer kontrolü olarak kullanmak için en az bir örnek. Bu FPOP çözeltisi karışımının 18 μL'sini hazırlayın.
NOT: Biyokimyada yaygın olarak kullanılan birçok tampon ve katkı maddesi hidroksil radikal leş yiyicilerdir. Bu katkı maddeleri ve tamponlar kullanılabilir; ancak, tampon hidroksil radikal atma nedeniyle oksidasyonda azalmalar oluşabilir. Genel olarak, protein oksidasyon verimini en üst düzeye çıkarmak için biyolojik sistemin gerektirdiği minimumda tüm katkı maddelerini saklayın. Dimetil sülfoksit ikincil radikaller oluşturmak için eğilimi nedeniyle kaçınılmalıdır; dimethylformamide elimizde yararlı bir alternatif olmuştur. Güçlü hidroksil radikal leş yiyiciler tamponlar kullanırken, glutamin genellikle FPOP çözeltikarışımı hariç tutulabilir.
- En genel amaçlar için, her iki eyalette de triplicate örnekleri hazırlamak, artı arka plan oksidasyon ölçmek için bir no-lazer kontrolü olarak kullanmak için en az bir örnek. Bu FPOP çözeltisi karışımının 18 μL'sini hazırlayın.
- FPOP deneyinden hemen önce 1 M hidrojen peroksit hazırlayın.
NOT: Satıcılar tarafından yaygın olarak satılan % 30 hidrojen peroksit raf ömrünü artırır bir dengeleyici içerir. Bir kez seyreltilmiş, hidrojen peroksit hızlı bir şekilde kullanılmalıdır, kesinlikle aynı gün içinde. Hidrojen peroksit de düzenli olarak bir hidroksil radikal dosimetre kullanılarak FPOP tarafından ayrışma için test edilmelidir. - 0.5 g/μL metiyonin amid ve 0.5 μg/μL katalaz 25 μL söndürme çözeltisi içeren mikrosantrifüj tüpleri hazırlayın. FPOP için 20°L'den büyük bir numune hacmi kullanılıyorsa, söndürme çözeltisi hacmini orantılı olarak artırın.
3. FPOP deneyini gerçekleştirin
- FPOP çözeltisi karışımının 18°L'ine 2 μL hidrojen peroksit ekleyin. İçeriği bir pipetle hafifçe karıştırın ve çözeltiyi mikrosentrifuge tüplerinin dibine doğru hızla döndürün. Hemen bir gastight şırınga ile toplamak ve şırınga pompası içine yükleyin.
- Dosimetre yazılımındaki Start Pump düğmesine tıklayarak şırınga pompasıüzerindeki akışı adım 1.8.1'de (genellikle 8-16 μL/dk arasında) belirlenen akış hızıyla başlatın.
- Satır içi dosimetreyi kullanarak gerçek zamanlı adenin okumasını izleyin (Bkz. Malzemeler Tablosu)ve numuneyi atıkta toplayın. Abs265 sinyalinin sabitolmasını bekleyin.
- Önceden ayarlanmış tekrarlama hızı ve enerji de lazer ateş başlatmak için dosimeter yazılımında Flash Başlat düğmesine tıklayın.
- Satır içi dosimetre kullanarak gerçek zamanlı adenin okumasını izleyin (bkz. Malzeme Tablosu); lazer kapalı ve lazer ile Abs265 farkı ΔAbs265 okuma.
NOT: Hidrojen peroksit varlığında lazer ateş üzerine son derece kararsız Abs265 okumaların görünümünü çözelti kabarcıkları nesil kaynaklanmaktadır. Kabarcıkları ortadan kaldırmak için lazer ve / veya hidrojen peroksit konsantrasyonu fluence azaltın.
4. Tazminat Gerçekleştirin
NOT: Farklı ligandlar, tamponlar, vb hidroksil radikallere karşı farklı atma kapasitesine sahip olabilir. Bu karşılaştırılabilir etkili hidroksil radikal dozlar farklı örnekler arasında protein ile reaksiyona kullanılabilir olduğundan emin olmak önemlidir. Bu, numuneler arasında eşit hidroksil radikal dosimetre tepkisi sağlayarak gerçekleştirilir. Adenin dozimetri kullanarak, UV emiciliği ndeki değişim 265 nm (ΔAbs265)etkili hidroksil radikal dozu yansıtır; büyük ΔAbs265, yüksek etkili hidroksil radikal doz.
- Elde edilen ΔAbs265 okumasını satır satır dosimetreile önceki deneyler veya kontrollerle elde edilen istenilen ΔAbs265 okumasıyla karşılaştırın. ΔAbs265 okuma istenilen okuma daha düşük hidroksil radikallerin yetersiz etkili doz gösterir; ΔAbs265 okuması çok yüksek etkili bir radikal dozu gösterir. ΔAbs265 okuma istenilen düzeyde ise, söndürme tampon 17 lazer ışınlama hemen sonra örnek toplamak17.
- ΔAbs265eşitlemek için etkili radikal dozu telafi edin. Bu telafi üç şekilde yapılabilir: hidrojen peroksit konsantrasyonu değiştirmek, darbe başına lazer enerji değiştirerek lazer fluence artırmak, ya da odaklama lens odak düzlemi değiştirerek lazer fluence artırmak.
- ΔAbs265 okumasında büyük bir değişiklik (>10 mAU) yapmak için, numuneyi az çok hidrojen peroksitle yeniden yapın ve örneği Bölüm 3'e göre yeniden çalıştırın.
- ΔAbs265 okumasında gerçek zamanlı olarak küçük bir değişiklik yapmak için, 50 mm Motorlu Sahne'yi kullanarak odaklama merceğinin konumunu ayarlayarak olay ışınının odak düzlemini ayarlayın. Odak düzleminin kılcal damar konumuna yakgitmesinin ΔAbs265 okumasını artıracağı; odak düzlemini kılcal damar konumundan daha uzağa getirmek ΔAbs265 okumasını azaltacaktır.
- Lazer ışınlama dan sonra numunede bulunan hidroksil radikalin etkin miktarını ölçmek için adenin ΔAbs265'i izleyin13. Bir sıralı UV kılcal dedektörü ile gerçek zamanlı izleme 4.2.2 açıklandığı gibi gerçek zamanlı tazminat sağlar; ΔAbs265 okuma istenilen okumaya eşit olana kadar motorlu sahne yi kullanarak lens konumunu ayarlayın. UV spektrofotometreile deneysel sonrası emici ölçümler de doğrudur, ancak her etkili radikal doz için yeni numunelerin kullanılmasını gerektirir.
5. Protein örneklerini sindirin
NOT: Tripsin en yaygın FPOP için protein örnekleri sindirmek için kullanılır ve proteaz bu protokolde kullanılan. Hem N- hem de C-terminus'ta temel sitelerle peptidler üreten güvenilir bir proteazdır ve MS'de çoğalan peptid iyonlarını destekler. Ayrıca, lizin ve arginin sonra cleaves, hidroksil radikallere sadece orta reaktif olan iki amino asitler; bu nedenle, analit oksidasyonu nedeniyle sindirim paterninde değişiklikler nadirdir. Diğer proteazlar başarıyla FPOP21ile kullanılmıştır, ancak sindirim desenleri unoxidized ve oksitlenmiş örnekler arasında karşılaştırılabilir sağlamak için dikkatli olunmalıdır.
- Söndürülen FPOP numunesinin son hacmini ölçün. 50 mM Tris, 1 mM CaCl 2 içeren 10 mM CaCl2 içeren 50 mM Tris, 1 mM CaCl2 ve 5 mM DTT son konsantrasyonuna kadar söndürüldükten sonra protein çözeltisine 500 mM Tris, pH 8.0 ekleyin.
- Protein örneğini 95 °C'de 15 dakika ısıtın.
- Numuneyi hemen 2 dk buz üzerinde soğutun.
- Numunelere 1:20 tripsin/protein ağırlık oranını ekleyin.
- Karıştırma ile 37 °C'de bir gecede proteini sindirin.
- %0,1 formik asit ilave ederek sindirim reaksiyonu durdurun ve/veya numuneyi 10 dakika boyunca 95 °C'ye ısıtın.
- Numunelere 2 mM DTT ekleyin ve LC-MS/MS'den hemen önce 15 dk için 60 °C'de ısıtın.
NOT: Diğer gruplar FPOP deneylerinde tiyollerin alkilinini rapor ederken, elimizde okside proteinlerin alkilasyonu üzerine yan ürünler kaydettik (muhtemelen küçük bir oksidasyon ürünü olarak oluşan nükleofilik karboniller ile reaksiyona bağlı). Bu nedenle, mümkün olduğunda tiyollerin alkilasyonu önlemek için seçin.
6. Sıvı kromatografi-tandem kütle spektrometresi (LC-MS/MS) yapın
- %0,1 formik asit içeren su içeren mobil faz A'yı ve %0,1 formik asit içeren asetonitriliçeren gezici faz B'yi hazırlayın.
- Numuneyi ilk olarak c18 kapan ı kolona (300 μm I.D. x 5 mm 100 şgözenek boyutu, 5 μm partikül boyutu) yükleyin ve tuzları ve hidrofilik küçük molekülleri temizlemek için 5,0 μL/dk akış hızında %2 solvent B ile 3 dakika yıkayın.
- Daha sonra C18 nanokol üzerindeki peptidleri (0,75 mm x 150 mm, 2 μm parçacık boyutu, 100 şgözenek boyutu) 300 nL/dk akış hızıyla ayırın. Degrade 22 dakika üzerinde% 2 ila 35 solvent B doğrusal bir artış oluşur, 5 dakika üzerinde% 95 solvent B rampalı ve sütun yıkamak için 3 dakika boyunca düzenlenen, ve daha sonra% 2 B 3 dakika üzerinde döndü ve sütun yeniden dengelemek için 9 dakika için düzenlenen.
NOT: Bu degrade, peptit düzeyinde niceleme yapmak isteyen bir ve iki proteinli FPOP karışımlarının çoğu LC-MS/MS için yeterlidir. Benzer tutma süreleri ve m/z değerleri nedeniyle peptidlerin birbirine müdahale ettiği nadir durumlarda, çözücü B'nin yüzdesinin peptit çözünürlüğünü artırmak için değiştirilmesi gerekebilir. Proteome ölçekli FPOP22 veya deneysel tasarımlar peptid oksidasyon ürün izomerleri ayırmak isteyen1,23,24,25 uzun LC gradyanlar gerektirebilir ve bu raporun kapsamı dışındadır. - Peptitleri iletken nanosprey yayıcısı kullanarak yüksek çözünürlüklü kütle spektrometresinin nanosprey kaynağına doğrudan eve getirin.
- Verileri pozitif iyon modunda edinin. Püskürtme gerilimini 2400 V'a, iyon transfer tüpünün sıcaklığını 300 °C'ye ayarlayın.
- M/z 250'den 2000'e kadar tam MS taramalarını 60.000'in m/z 200'ünnominal çözünürlükte elde edin ve ardından, peptidleri tanımlamak için %35'te çarpışmaya bağlı dissosiyasasyon kullanarak en bol peptid iyonları üzerinde sekiz veriye bağlı doğrusal iyon tuzağı MS/MS taraması elde edin. 30 s içinde beş kez kadar peptidler parçalayın ve daha sonra 60 s için bir dışlama listesine aktarın.
7. Peptidlerin ortalama oksidasyonunun veri işleme ve hesaplanması
- MS/MS proteomics arama motoru kullanarak protein, m/z değerleri ve oksidasyonsuz peptidlerin tutma sürelerini belirleyin.
- Öncül kütle toleransını 10 ppm'e ayarlayın ve standart tripsin dekolte özgüllüğünü kullanarak tripsin sindirilmiş numuneler için en fazla iki cevapsız dekolte alanı bekleyin.
- Peptit kütle parçası kütle toleransını 0.4 Dalton'a ayarlayın.
- Tespit edilen değiştirilmemiş peptidlerin m/z oranına ve ana oksidasyon ürünlerinin bilinen kütle kaymalarına göre, herpeptitinçeşitli teorik oksidasyon ürünlerinin m/z'sini hesaplayabilirsiniz 4,26,27,28,29.
- Kütle spektrometrik çalışmasını görüntülemek için yazılımı kullanarak bu m/z değerlerinin çıkarılan iyon kromatogramınıtanımlayın (Şekil 4). Peptit oksidasyon ürünlerini m/z,şarj durumlarını ve elüsyon süresindeki benzerliği değiştirilmemiş peptidlere göre tanımlayın. Elimizde, peptit oksidasyon ürünleri yukarıdaki LC gradyanı kullanarak değiştirilmemiş peptid sonra 240 saniye ile 180 saniye arasında elat. Oksidasyon genellikle birden fazla izorik oksidasyon ürünleri ile sonuçlanacağı için, Şekil 4'tegösterildiği gibi, peptit oksidasyon ürünlerinin çıkarılan iyon kromatogramlarında kısmen çözülmüş birden fazla pik gözlemlemek yaygındır. Peptit oksidasyon ürünleri çıkarılan iyon kromatogramlarında tepe (ler) alanına göre ölçülür.
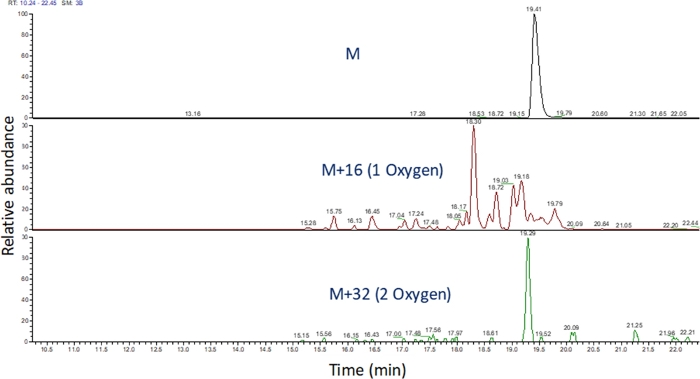
Şekil 4: FPOP sonrası bir peptidin ve oksidasyon ürünlerinin çıkarılan iyon kromatogramı. Peptit oksidasyon ürünlerinin m/z değeri, oksidasyonsuz peptidin m/z'si ve bilinen oksidasyon ürünleri esas alınerek hesaplanır; ve bu peptid ürünlerinin alanları belirlenir. Peptit ürünlerinin alanı daha sonra peptid başına ortalama oksidasyon olaylarının hesaplanmasında kullanılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Aşağıdaki denklemi kullanarak peptidlerin ortalama oksidasyonunu hesaplayın.
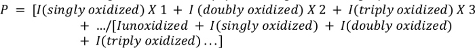
P peptit molekülü başına oksidasyon olaylarının ortalama sayısını gösterir nerede, ve ben unoxidized peptidin pik alanı temsil eder(Iunoxidized) ve n oksidasyon olayları ile peptid. Ben (tek bir oksijen atomu değil, aynı zamanda araştırmacı ölçmek için seçebilirsiniz diğer daha az yaygın tek oksidasyon olayları (örneğin, oksidatif dekarboksilasyon, karbonil oluşumu, vb) sadece eklemeler içereceğini unutmayın 4,26,27,28,29.
Sonuçlar
Adalimumab biyobenzerinin fosfat tamponundaki ağır zincir peptid ayak izinin karşılaştırılması ve 55 °C'de 1 saat ısıtıldığında ilginç sonuçlar ortaya çıkar. Öğrencinin t-testi, bu iki durumda önemli ölçüde değişen peptidlerin tanımlanmasında kullanılır (p ≤ 0.05). 20-38, 99-125, 215-222, 223-252, 260-278, 376-413 ve 414-420 peptidler protein agregaoluşturmak için ısıtıldığında çözücüye karşı önemli bir koruma göstermektedir (Şekil 5)
Tartışmalar
Hidrojen-döteryum değişimi, kimyasal çapraz bağlama, kovalent etiketleme ve yerli sprey kütle spektrometresi ve iyon hareketliliği gibi kütle spektrometresi tabanlı yapısal teknikler, esneklikleri, duyarlılıkları ve karmaşık karışımları idare etme yetenekleri nedeniyle hızla popülerlik kazanmıştır. FPOP kütle spektrometresi tabanlı yapısal teknikler alanında popülaritesini artırdı çeşitli avantajlara sahiptir. Çoğu kovalent etiketleme stratejileri gibi, çoğu post-labeling süreçleri ...
Açıklamalar
Joshua S. Sharp GenNext Technologies, Inc, hidroksil radikal protein ayak izi de dahil olmak üzere protein yüksek sipariş yapısı analizi için teknolojileri ticarileştirmek isteyen küçük bir şirket önemli bir mali ilgi açıklar.
Teşekkürler
Biz Ulusal Genel Tıp Bilimleri Enstitüsü hibe R43GM125420-01 bir benchtop FPOP cihaz ve R01GM127267 yüksek enerjili FPOP için standardizasyon ve dozimetre protokollerinin geliştirilmesi için ticari gelişimini desteklemek için araştırma finansmanı kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Adenine | Acros Organics | 147440250 | Soluble in water upto 3.5 mM |
| Aperture | Edmund Optics | 39-905 | 1000 μm Aperture Diameter, Gold-Plated Copper Aperture |
| Aperture holder | Edmund Optics | 53-287 | 25.8mm Outer Diameter, Precision Pinhole Mount |
| Catalse | Sigma Aldrich | C-40 | Catalase from bovine liver, lyophilized powder, ≥10,000 units/mg protein |
| COMPex Pro laser | Coherent | 1113836 | COMPexPRO 102, F-Vversion, KrF laser, No XeCl |
| Dithiotheitol (DTT) | Promega | V3151 | DTT, Molecular Grade (DL-Dithiothreitol) |
| Fraction collector | GenNext Technologies, Inc. | N/A | Automated fraction collector |
| Fused silica capillay | Molex | 1068150023 | Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 100 µm, Outer Diameter 375 µm, TSP100375 |
| Glutamine | Acros Organics | 119951000 | L(+)-Glutamine, 99% |
| Holder for lens | Edmund Optics | 03-668 | 53 mm Outer Diameter, Three-Screw Adjustable Ring Mount |
| Hydrogen peroxide | Fisher Scientific | H325-100 | Hydrogen Peroxide, 30% (Certified ACS), Fisher Chemical |
| LC-MS/MS system | Thermo Scientific | IQLAAEGAAPFADBMBCX | Dionex Ultimate 3000 coupled to Orbitap Fusion Tribrid mass spectrometer |
| Mas spec grade Acetonitrile | Fisher Scientific | A955-1 | Acetonitrile, Optima LC/MS Grade, Fisher Chemical |
| Mass spec grade formic acid | Fisher Scientific | A117-50 | Formic Acid, 99.0+%, Optima™ LC/MS Grade, Fisher Chemical |
| Mass spec grade water | Fisher Scientific | W6-4 | Water, Optima LC/MS Grade, Fisher Chemical |
| MES buffer | Sigma Aldrich | M0164 | MES hemisodium salt |
| Methionine amide | Bachem | 4000594.0005 | H-met-NH2.HCl |
| Micro V clamp | Thor Labs | VK250 | Micro V-clamp with stainless steel blades |
| Motorized stage | Edmund Optics | 68-638 | 50mm Travel Motorized Stage System with Manual Control |
| Nano C18 colum | Thermo Scientific | 164534 | Acclaim PepMap 100 C18 HPLC Columns |
| Optical bench | Edmund Optics | 56-935 | 18" x 18" breadboard |
| Pioneer FPOP Module System | GenNext Technologies, Inc. | N/A | Inline FPOP Radical Dosimetry System |
| Post holder | Edmund Optics | 58-979 | 3" Length, ¼-20 Thread, Post Holder |
| Sodium phosphate dibasic | Fisher Scientific | BP331-500 | Sodium Phosphate Dibasic Heptahydrate (Colorless-to-White Crystals), Fisher BioReagents |
| Sodium phosphate monobasic | Fisher Scientific | BP330-500 | Sodium Phosphate Monobasic Monohydrate (Colorless-to-white Crystals), Fisher BioReagents |
| Syringe | Hamilton | 81065 | 100 µL, Model 1710 RN SYR, Small Removable NDL, 22s ga, 2 in, point style 3 |
| Syringe pump | KD Scientific | 788101 | Legato 101 syringe pump |
| Trap C18 column | Thermo Scientific | 160454 | Thermo Scientific Acclaim PepMap 100 C18 HPLC Columns |
| Tris | Sigma Aldrich | 252859 | Tris(hydroxymethyl)aminomethane |
| Trypsin | Promega | V5111 | Sequencing Grade Modified Trypsin |
| UV plano convex lens | Edmund Optics | 84-285 | 30 mm Dia. x 120 mm FL Uncoated, UV Plano-Convex Lens |
Referanslar
- Kaur, P., Kiselar, J., Yang, S., Chance, M. R. Quantitative protein topography analysis and high-resolution structure prediction using hydroxyl radical labeling and tandem-ion mass spectrometry (MS). Molecular & Cellular Proteomics. 14 (4), 1159-1168 (2015).
- Hambly, D. M., Gross, M. L. Laser flash photolysis of hydrogen peroxide to oxidize protein solvent-accessible residues on the microsecond timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Buxton, G. V., Greenstock, C. L., Helman, W. P., Ross, A. B. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O- in Aqueous Solution. Journal of Physical and Chemical Reference Data. 17 (2), 513 (1988).
- Xu, G., Chance, M. R. Radiolytic modification and reactivity of amino acid residues serving as structural probes for protein footprinting. Analytical Chemistry. 77 (14), 4549-4555 (2005).
- Sharp, J. S., Tomer, K. B. Effects of anion proximity in peptide primary sequence on the rate and mechanism of leucine oxidation. Analytical Chemistry. 78 (14), 4885-4893 (2006).
- Huang, W., Ravikumar, K. M., Chance, M. R., Yang, S. Quantitative mapping of protein structure by hydroxyl radical footprinting-mediated structural mass spectrometry: a protection factor analysis. Biophysical Journal. 108 (1), 107-115 (2015).
- Xie, B., Sood, A., Woods, R. J., Sharp, J. S. Quantitative protein topography measurements by high resolution hydroxyl radical protein footprinting enable accurate molecular model selection. Scientific Reports. 7 (1), 4552 (2017).
- Li, Z., et al. High structural resolution hydroxyl radical protein footprinting reveals an extended Robo1-heparin binding interface. Journal of Biological Chemistry. 290 (17), 10729-10740 (2015).
- Li, X., et al. Structural analysis of the glycosylated intact HIV-1 gp120-b12 antibody complex using hydroxyl radical protein footprinting. Biochemistry. 56 (7), 957-970 (2017).
- Li, K. S., Shi, L., Gross, M. L. Mass spectrometry-based fast photochemical oxidation of proteins (FPOP) for higher order structure characterization. Accounts of Chemical Research. 51 (3), 736-744 (2018).
- Li, J., Chen, G. The use of fast photochemical oxidation of proteins coupled with mass spectrometry in protein therapeutics discovery and development. Drug Discovery Today. 24 (3), 829-834 (2019).
- Roush, A. E., Riaz, M., Misra, S. K., Weinberger, S. R., Sharp, J. S. Intrinsic buffer hydroxyl radical dosimetry using Tris(hydroxymethyl)aminomethane. Journal of the American Society for Mass Spectrometry. 31 (2), 169-172 (2020).
- Xie, B., Sharp, J. S. Hydroxyl radical dosimetry for high flux hydroxyl radical protein footprinting applications using a simple optical detection method. Analytical Chemistry. 87 (21), 10719-10723 (2015).
- Niu, B., Zhang, H., Giblin, D., Rempel, D. L., Gross, M. L. Dosimetry determines the initial OH radical concentration in fast photochemical oxidation of proteins (FPOP). Journal of the American Society for Mass Spectrometry. 26 (5), 843-846 (2015).
- Niu, B., et al. Incorporation of a reporter peptide in FPOP compensates for adventitious scavengers and permits time-dependent measurements. Journal of the American Society for Mass Spectrometry. 28 (2), 389-392 (2017).
- Garcia, N. K., Sreedhara, A., Deperalta, G., Wecksler, A. T. Optimizing hydroxyl radical footprinting analysis of biotherapeutics using internal standard dosimetry. Journal of the American Society for Mass Spectrometry. 31 (7), 1563-1571 (2020).
- Sharp, J. S., Misra, S. K., Persoff, J. J., Egan, R. W., Weinberger, S. R. Real time normalization of fast photochemical oxidation of proteins experiments by inline adenine radical dosimetry. Analytical Chemistry. 90 (21), 12625-12630 (2018).
- Zhang, B., Cheng, M., Rempel, D., Gross, M. L. Implementing fast photochemical oxidation of proteins (FPOP) as a footprinting approach to solve diverse problems in structural biology. Methods. 144, 94-103 (2018).
- Konermann, L., Stocks, B. B., Czarny, T. Laminar flow effects during laser-induced oxidative labeling for protein structural studies by mass spectrometry. Analytical Chemistry. 82 (15), 6667-6674 (2010).
- Gau, B. C., Sharp, J. S., Rempel, D. L., Gross, M. L. Fast photochemical oxidation of protein footprints faster than protein unfolding. Analytical Chemistry. 81 (16), 6563-6571 (2009).
- Li, K. S., et al. Hydrogen-Deuterium exchange and hydroxyl radical footprinting for mapping hydrophobic interactions of human bromodomain with a small molecule Inhibitor. Journal of the American Society for Mass Spectrometry. 30 (12), 2795-2804 (2019).
- Espino, J. A., Jones, L. M. Illuminating biological interactions with in vivo protein footprinting. Analytical Chemistry. 91 (10), 6577-6584 (2019).
- Charvatova, O., et al. Quantifying protein interface footprinting by hydroxyl radical oxidation and molecular dynamics simulation: application to galectin-1. Journal of the American Society for Mass Spectrometry. 19 (11), 1692-1705 (2008).
- Gau, B., Garai, K., Frieden, C., Gross, M. L. Mass spectrometry-based protein footprinting characterizes the structures of oligomeric apolipoprotein E2, E3, and E4. Biochemistry. 50 (38), 8117-8126 (2011).
- Gau, B. C., Chen, J., Gross, M. L. Fast photochemical oxidation of proteins for comparing solvent-accessibility changes accompanying protein folding: Data processing and application to barstar. Biochimica et Biophysica Acta. 1834 (6), 1230-1238 (2013).
- Garrison, W. M. Reaction mechanisms in the radiolysis of peptides, polypeptides, and proteins. Chemical Reviews. 87 (2), 381-398 (1987).
- Xu, G., Chance, M. R. Radiolytic modification of sulfur-containing amino acid residues in model peptides: fundamental studies for protein footprinting. Analytical Chemistry. 77 (8), 2437-2449 (2005).
- Xu, G., Chance, M. R. Radiolytic modification of acidic amino acid residues in peptides: probes for examining protein-protein interactions. Analytical Chemistry. 76 (5), 1213-1221 (2004).
- Xu, G., Takamoto, K., Chance, M. R. Radiolytic modification of basic amino acid residues in peptides: probes for examining protein-protein interactions. Analytical Chemistry. 75 (24), 6995-7007 (2003).
- Misra, S. K., Orlando, R., Weinberger, S. R., Sharp, J. S. Compensated hydroxyl radical protein footprinting measures buffer and excipient effects on conformation and aggregation in an adalimumab biosimilar. AAPS Journal. 21 (5), 87 (2019).
- Simmons, D. A., Konermann, L. Characterization of transient protein folding intermediates during myoglobin reconstitution by time-resolved electrospray mass spectrometry with on-line isotopic pulse labeling. Biochemistry. 41 (6), 1906-1914 (2002).
- Vahidi, S., Konermann, L. Probing the time scale of FPOP (fast photochemical oxidation of proteins): radical reactions extend over tens of milliseconds. Journal of the American Society for Mass Spectrometry. 27 (7), 1156-1164 (2016).
- Chance, M. R. Unfolding of apomyoglobin examined by synchrotron footprinting. Biochemical and Biophysical Research Communications. 287 (3), 614-621 (2001).
- Xu, G., Chance, M. R. Hydroxyl radical-mediated modification of proteins as probes for structural proteomics. Chemical Reviews. 107 (8), 3514-3543 (2007).
- Zhang, Y., Rempel, D. L., Zhang, H., Gross, M. L. An improved fast photochemical oxidation of proteins (FPOP) platform for protein therapeutics. Journal of the American Society for Mass Spectrometry. 26 (3), 526-529 (2015).
- Cornwell, O., Radford, S. E., Ashcroft, A. E., Ault, J. R. Comparing hydrogen deuterium exchange and fast photochemical oxidation of proteins: a structural characterisation of wild-type and ΔN6 β(2)-microglobulin. Journal of the American Society for Mass Spectrometry. 29 (2), 2413-2426 (2018).
- Xie, B., Sharp, J. S. Relative Quantification of sites of peptide and protein modification using size exclusion chromatography coupled with electron transfer dissociation. Journal of the American Society for Mass Spectrometry. 27 (8), 1322-1327 (2016).
- Srikanth, R., Wilson, J., Vachet, R. W. Correct identification of oxidized histidine residues using electron-transfer dissociation. Journal of Mass Spectrometry. 44 (5), 755-762 (2009).
- Li, X., Li, Z., Xie, B., Sharp, J. S. Improved identification and relative quantification of sites of peptide and protein oxidation for hydroxyl radical footprinting. Journal of the American Society for Mass Spectrometry. 24 (11), 1767-1776 (2013).
- Li, X., Li, Z., Xie, B., Sharp, J. S. Supercharging by m-NBA Improves ETD-Based Quantification of Hydroxyl Radical Protein Footprinting. Journal of the American Society for Mass Spectrometry. 26 (8), 1424-1427 (2015).
- Khaje, N. A., Sharp, J. S. Rapid quantification of peptide oxidation isomers from complex mixtures. Analytical Chemistry. 92 (5), 3834-3843 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır