このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
タンパク質トポグラフィ変化の測定のためのタンパク質の高速光化学酸化におけるリアルタイム補正の実現
要約
タンパク質の高速光化学酸化は、タンパク質の構造特性を示す新たな手法です。異なる溶媒添加剤およびリガンドは、ヒドロキシルラジカル清掃特性を多様に有している。異なる条件でタンパク質構造を比較するために、反応で生成されたヒドロキシルラジカルのリアルタイム補償が反応条件を正常化するために必要である。
要約
タンパク質の高速光化学酸化(FPOP)は、タンパク質の溶媒にアクセス可能な表面積をプローブする質量分析ベースの構造生物学技術です。この技術は、溶液中で自由に拡散するヒドロキシルラジカルとのアミノ酸側鎖の反応に依存する。FPOPは過酸化水素のレーザー光分解によってその際にこれらのラジカルを生成し、マイクロ秒のオーダーで枯渇するヒドロキシルラジカルのバーストを作り出す。これらのヒドロキシルラジカルが溶媒にアクセス可能なアミノ酸側鎖と反応する場合、反応生成物は質量分析法により測定および定量することができるマスシフトを示す。アミノ酸の反応速度はそのアミノ酸の平均溶媒アクセス可能な表面に部分的に依存するため、タンパク質の所定の領域の酸化量の測定された変化は、異なる立体間のその領域の溶媒アクセシビリティの変化(例えば、リガンド結合対リガンドフリー、モノマー対集合体)に直接相関することができる。FPOPは、タンパク質とタンパク質の相互作用、タンパク質の立体構造変化、タンパクリガンド結合など、生物学における多くの問題に適用されてきました。ヒドロキシルラジカルの利用可能な濃度は、FPOP実験における多くの実験条件に基づいて変化するので、タンパク質検体が暴露される有効なラジカル用量を監視することが重要である。このモニタリングは、FPOP反応からの信号を測定するためにインライン線量計を組み込むことによって効率的に達成され、レーザーフルエンスはリアルタイムで調整され、所望の酸化量を達成する。この補正により、コンフォメーション変化、リガンド結合面、タンパク質間相互作用界面を反映したタンパク質トポグラフィーの変化を、比較的低いサンプル量を用いて異種サンプルで決定することができます。
概要
タンパク質の高速光化学酸化(FPOP)は、溶媒曝露されたタンパク質の表面積の超高速共有修飾によるタンパク質地形変化の測定に新たな技術であり、続いてLC-MS1による検出を行う。FPOPは、過酸化水素のUVレーザーフラッシュ光分解により、その一部に高濃度のヒドロキシルラジカルを生成する。これらのヒドロキシルラジカルは、非常に反応性と短命であり、FPOP条件2の下でおよそマイクロ秒のタイムスケールで消費される。これらのヒドロキシルラジカルは、水を介して拡散し、一般に高速(〜106M-1 s6 -1)から拡散制御3に至るまで、運動速度で溶液中の様々な有機成分を酸化する。ヒドロキシルラジカルがタンパク質表面に遭遇すると、ラジカルはタンパク質表面上のアミノ酸側鎖を酸化し、そのアミノ酸(最も一般的には1つの酸素原子の純加量)の質量シフトを生じる4。任意のアミノ酸における酸化反応の速度は、そのアミノ酸の固有反応性(側鎖および配列コンテキストに依存する)4、5,5およびその側鎖の拡散ヒドロキシルラジカルへのアクセス可能性の2つの要因に依存し、これは平均溶媒アクセス可能な表面積6,77と6密接に相関する。グリシンを除くすべての標準的なアミノ酸は、FPOP実験でこれらの反応性の高いヒドロキシルラジカルによって標識されているように観察されています, 大きく異なる収率ではあるが;実際には、Ser、Thr、Asn、およびAlaは、高ラジカル用量の下で、慎重かつ敏感な標的ETDフラグメンテーション88、99によって同定される以外、ほとんどのサンプルで酸化されると見られることはほとんどありません。酸化後、試料を消光して過酸化水素および二次酸化剤(スーパーオキシド、一酸化酸素、ペプチジルヒドロペルオキシドなど)を除去する。次いで、クエンチされたサンプルをタンパク質分解して酸化ペプチドの混合物を生成し、構造情報は、様々なペプチドの酸化生成物のパターンにおいて化学的「スナップショット」として凍結される(図1)。質量分析(LC-MS)に結合された液体クロマトグラフィーは、そのペプチドの酸化および非酸化バージョンの相対的な強度に基づいて、所定のタンパク質分解ペプチドにおけるアミノ酸の酸化量を測定するために使用されます。異なる立体構造条件下で得られた同じタンパク質のこの酸化足跡を比較することにより(例えば、リガンド結合対リガンドフリー)、タンパク質の所定の領域の酸化量の差は、その領域66,77の溶媒アクセス可能表面積の違いと直接相関することができる。タンパク質の地形情報を提供する能力は、FPOPタンパク質の高次構造決定のための魅力的な技術を作ります, タンパク質の治療の発見と開発中を含みます10,,11.

図 1: FPOP の概要タンパク質の表面は、高反応性ヒドロキシルラジカルによって共有結合的に修飾される。ヒドロキシルラジカルは、側鎖の溶媒のアクセス性に強く影響される速度でタンパク質のアミノ酸側鎖と反応する。地形変化(例えば、上に示したリガンドの結合に起因する)は、相互作用の領域におけるアミノ酸をヒドロキシルラジカルと反応することから保護し、LC-MSシグナルにおける修飾ペプチドの強度の低下をもたらす。 この図の大きなバージョンを表示するには、ここをクリックしてください。
FPOP溶液中に存在する異なる成分(例えば、リガンド、賦形剤、緩衝剤)は、過酸化水素3のレーザー光分解に際して発生するヒドロキシルラジカルに対して異なる清掃活性を有する。同様に、過酸化物濃度、レーザーフルエンス、および緩衝剤組成のわずかな変化は、効果的なラジカル用量を変更し、サンプル間および異なる実験室間でFPOPデータの再生を困難にする可能性があります。したがって、利用可能なヒドロキシルラジカル線量,を、12、13、14、15、16,13の利用可能なヒドロキシルラジカル線量の1つを用いて、各サンプル中のタンパク質と反応させることができるヒドロキシルラジカル用量15を16比較できることが重要である。,14ヒドロキシルラジカル線量計は、ヒドロキシルラジカルのプールのための(そして溶液中のすべてのスカベンジャーと)アナライトと競合することによって作用します。ヒドロキシルラジカルの有効用量は、線量計の酸化量を測定することによって測定される。なお、「有効ヒドロキシルラジカル用量」は、発生したヒドロキシルラジカルの初期濃度とラジカルの半減期の両方の機能である。これら2つのパラメータは、部分的に相互に依存しており、理論運動モデリングはやや複雑になる(図2)。2つのサンプルは、形成されたヒドロキシルラジカルの初期濃度を変更することによって同じ効果的なラジカル用量を維持しながら、最初のラジカル半減期を大きく異なることができる。彼らはまだ同じフットプリント17を生成します。アデニン13およびTris12は、酸化のレベルをリアルタイムでUV分光法で測定できるため、効果的なヒドロキシルラジカル用量に問題がある場合に研究者が迅速に特定し、その問題をトラブルシューティングすることができるため、便利なヒドロキシルラジカル線量計です。この問題を解決するためには、リアルタイムでアデニン吸光度変化からの信号を監視できる照射部位の直後にフローシステムに位置するインライン線量計が重要である。これは、ヒドロキシルラジカル清掃能力17の広く異なるレベルを有するバッファーまたは他の賦形剤でFPOP実験を行うのに役立つ。このラジカル投与量補償はリアルタイムで行うことができるが、有効ラジカル用量を調節することによって同じコンフォーマーに対して統計的に区別できない結果をもたらす。
本プロトコルでは、内部光学ラジカルドシメータとしてアデニンを用いたラジカル投与量補償を用いた典型的なFPOP実験を行うための詳細な手順を有する。この方法により、調査員はリアルタイムで補正を実行することにより、異なる清掃能力を有するFPOP条件全体のフットプリントを比較することができます。
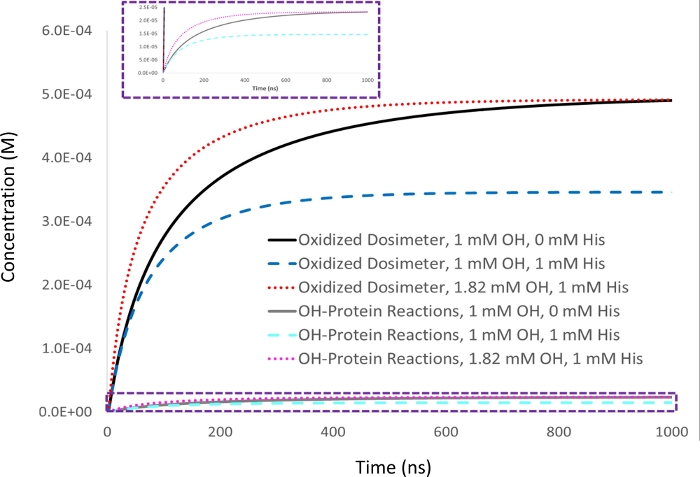
図2:ドシメトリー報酬の運動シミュレーション1 mM アデニン線量計応答は、5 μM リソザイム分析物で 1 mM 初期ヒドロキシルラジカル濃度 (▪OH t1/2=53 ns)で測定し、対象線量計応答(黒)として設定した。スカベンジャー賦形ヒスチジンの1mMを添加すると、量濃度応答(青色)は比例的にタンパク質酸化量(シアン)と共に減少する。ヒドロキシルラジカルの半減期も減少する(▪OH t1/2=39ns)。生成されたヒドロキシルラジカルの量が増加すると、スカベンジャー(赤色)の不在時に1mMヒスチルラジカル(赤)で達成した1mMヒスチジンスカベンジャーを用いてサンプル中の酸化された線量計の同等の収量を得るために(▪tOH/29=29)、同様に起こるタンパク質酸化量(マゼンタ)が減少する一方で(tOH19/ns=29)。=シャープJ.S.、アムファーマセウトRev 22、50-55、2019の許可を得て適応。 22,この図の大きなバージョンを表示するには、ここをクリックしてください。
プロトコル
1. FPOP用のオプティカルベンチとキャピラリーを準備する
注意:KrFエキシマレーザーは極端な目の危険であり、直接または反射光は永久的な眼の損傷を引き起こす可能性があります。常に適切な目の保護を着用し、可能な場合はビームパスの近くに反射物の存在を避け、アクティブなレーザーへの不正アクセスを防ぎ、迷子の反射を抑制するためにエンジニアリングコントロールを使用します。
- FPOP オプティカルベンチを準備します。
- レーザーをオンにしてウォームアップします。レーザーを外部トリガー、一定エネルギー、ガス交換なしに設定します。パルスあたりのレーザーエネルギーを設定します(通常、80~120 mJ/パルス)。
- 図3Aに示すように、光を吸収するために、レーザービームの経路にプラノ凸レンズ(30mm Dia.x 120 mm FLアンコート)を直接設置し、反射しないバックストップを設置します。

図3:FPOP実験用の光学ベンチ(A)試料をH2O2、ア2デニンラジカルドシメータ、グルタミンスカベンジャーと混合し、注射器に装填する。試料はKrFエキシマUVレーザーの焦点を合わせるビームパスを通して融合シリカキャピラリーを通して押される。UV光はH2O2をヒドロ2キシルラジカルに光分解し、タンパク質とアデニン線量計を酸化する。シリンジの流れは、次のレーザーパルスの前にレーザーの経路から照らされたサンプルを押し出し、照らされた領域間の非照光排他体積を有する。酸化直後に、試料は265nmでアデニンのUV吸光度を測定するインラインUV分光光度計を通過する。次いで、試料をクエンチバッファーに沈着させ、残りのH2O2および二次酸化剤を除去する。2(B)スポットサイズは、248 nmでレーザーで毛細管の後ろに貼り付けられた色付き付箋を照射した後に測定されます。スポットの幅はサンプル流量の計算に使用され、スポットの中央の毛細血管のシルエットを使用して光学ベンチを揃えます。この図の大きなバージョンを表示するには、ここをクリックしてください。
- 融合したシリカキャピラリー(360μmの外径と100μmの内径)の適切な長さをカットし、スリーブを使用して、低いデッドボリュームコネクタを使用してガスタイトなシリンジに接続します。
- サンプルのレーザー露光後、265 nmの吸光度信号を読み取る場所で、ブタントーチで毛細管のポリイミドコーティングを静かに燃焼させます。糸くずのない拭き取りでメタノールを使用して、キャピラリーの破片を静かに拭きます。レーザー発生率の部位でのポリイミドコーティングは、同様にブタントーチで焼き払うか、低電力でエキシマレーザー焼成で焼き払うことができます。
注:毛細血管が冷却されるのを待つのは、ホットキャピラリーのメタノールを使用する火災の危険です。 - この毛管をレーザーのビームパスを通り、インライン線量計に入れる。
- インライン線量計の上部にあるレバーを押して、ヒンジを開きます。磁気ホルダーを取り外します。キャピラリーを所定の位置に保つために磁気ホルダーを使用して、インライン線量計の機械加工された溝にキャピラリーを置きます。毛細管の上にドーシメータヒンジを閉じ、レバーが所定の位置にロックされるまで押します。
- ドシメトリーソフトウェアを使用して、[ スタートフラッシュ ]ボタンをクリックしてエキシマレーザーの発射を開始します。レーザー制御ソフトウェア自体で50~100 mJ/パルスの間にプリセットレーザーパワーを設定し、ドシメトリーソフトウェアの[設定]タブで10〜20 Hzの間でプリセットの繰り返しレートを設定します。
- 直線電動ステージに取り付けられたプラノ凸レンズを使用して、レーザービームを焦点を合わせます。図3Bに示すように、キャリパーを使用してキャピラリーの位置にあるレーザースポットの幅と高さを正確にキャリパーで測定し(mJ/mm2)を計算します。2
- レンズの動きやレーザー18のパルス当たりのエネルギー変化によるビームサイズの変化に関係なく、キャピラリーの一貫した照明幅を確保するために、毛細管の近くに不透明な開口部を配置する。
- レーザー焼成で、動きの範囲を通してモーターを備えた段階を動かします。ビームが開口部の中心に留まり、毛細管のシルエットが全体を通して観察できることを確認します。絞りの直径は、電動ステージの範囲内のすべての点で、衝突焦点を合わせるビームの幅よりも小さくなければなりません。
- キャピラリーを洗浄するために、20 μL/min で少なくとも 1 分間水を流します。
- 線量計ソフトウェアの [データ+オートゼロを開始 ]ボタンをクリックして、水に対する線量をゼロにしてデータ収集を開始します。
注: FPOP のバッファー システムが 265 nm で大きな UV 吸光度を持つ場合、FPOP システムは水ではなくバッファーでゼロにする必要があります。
- 線量計ソフトウェアの [データ+オートゼロを開始 ]ボタンをクリックして、水に対する線量をゼロにしてデータ収集を開始します。
- シリンジポンプで計算された流量を設定します。
- タンパク質サンプルの流量は、1ショット当たりの照射体積(VIrr)、1秒当たりのレーザーショット数(R)、およびラミナル流れ効果とサンプル拡散(0.15-0.30推奨)2、19、2019,20に対する必要な未照射排除体積分率(FEx)に依存する。次の式Irrを使用して、キャピラリーの内径 (mm (d) と、毛管に衝突するレーザースポットの幅 (つまり、開口の幅) を mm(w)で計算します。
VIrr = π(d/2)2w - 次の式に基づいて、希望の流量(μL/min)を計算します。
フロー = 60R[VIrr (1 + FEx)]
- タンパク質サンプルの流量は、1ショット当たりの照射体積(VIrr)、1秒当たりのレーザーショット数(R)、およびラミナル流れ効果とサンプル拡散(0.15-0.30推奨)2、19、2019,20に対する必要な未照射排除体積分率(FEx)に依存する。次の式Irrを使用して、キャピラリーの内径 (mm (d) と、毛管に衝突するレーザースポットの幅 (つまり、開口の幅) を mm(w)で計算します。
2. FPOP用タンパク質溶液の調製
- 比較される2つ以上の異なる条件(例えば、リガンド結合およびリガンドフリー;凝集体および単量体;単独およびタンパク質結合パートナーなど)でタンパク質を調製し、立体構造変化を検出する。
- 実験のニーズに合わせて、FPOP に使用する総ボリュームを設定します。最小制限は通常、照射毛細血管の体積と、堅牢な検出と相対定量に必要な材料に依存し、使用されるLC-MS/MSシステムとポストラベリングサンプル処理方法によって大きく異なります。当社グループで一般的に使用されるFPOPソリューションの総容積は、過酸化水素添加後20μLです。タンパク質の最終的な濃度は一般的に1〜10 μMであり、17 mMグルタミン(ヒドロキシルラジカルの寿命を制限するため)、1mMアデニン(ラジカル線量計として作用する)13、17および1710mMリン酸緩衝液(ヒドロキシルラジカルのスカベンジャーが乏しい緩衝液)である。サンプルは、結果の統計的なモデル化を可能にするために、一般的に複数の反復で準備されます。
- ほとんどの一般的な目的のために、両方の状態で三重にサンプルを調製し、バックグラウンド酸化を測定するためのレーザー制御として使用する少なくとも1つのサンプルを用意します。このFPOP溶液ミックスの18 μLを準備します。
注:生化学で一般的に使用される多くのバッファーおよび添加剤は、ヒドロキシルラジカルスカベンジャーです。これらの添加剤とバッファーを使用できます。しかし、バッファーのヒドロキシルラジカル清掃による酸化の減少が起こり得る。一般に、タンパク質の酸化収率を最大化するために、生物学的システムで必要な最小限の添加剤を維持します。ジメチルスルホキシドは二次ラジカルを生成する傾向のために避けるべきです;ジメチルホルムアミドは、私たちの手の中で有用な代替手段となっています.強力なヒドロキシルラジカルスカベンジャーであるバッファーを使用する場合, グルタミンは、多くの場合、FPOP溶液ミックスから除外することができます.
- ほとんどの一般的な目的のために、両方の状態で三重にサンプルを調製し、バックグラウンド酸化を測定するためのレーザー制御として使用する少なくとも1つのサンプルを用意します。このFPOP溶液ミックスの18 μLを準備します。
- FPOP実験の直前に1M過酸化水素を調製します。
注:ベンダーが一般的に販売する過酸化水素30%には安定剤が含まれており、貯蔵寿命が向上します。一度希釈したら、過酸化水素は、間違いなく同じ日の中で、迅速に使用する必要があります。過酸化水素はまた、ヒドロキシルラジカル線量計を使用してFPOPによる分解について定期的に試験されるべきである。 - 0.5 μg/μLのメチオニンアミドと0.5 μG/μLカタラーゼのクエンチ溶液25 μLを含むマイクロ遠心チューブを用意します。FPOPに20μLを超えるサンプルボリュームを使用する場合は、クエンチ溶液の体積を比例的に増やします。
3. FPOP 実験を実行する
- FPOP溶液ミックスの18 μLに2μLの過酸化水素を加えます。内容物をピペットで軽く混ぜ、マイクロ遠心チューブの底まで溶液を素早く回転させます。すぐにガス密なシリンジで収集し、シリンジポンプにロードします。
- ステップ1.8.1(通常は8-16 μL/min)で決定された流量で、線量計ソフトウェアの ポンプ開始 ボタンをクリックして、シリンジポンプのフローを開始します。
- インライン線量計を使用してリアルタイムのアデニン読み取り( 材料表を参照)を監視し、サンプルを廃棄物に集めます。腹筋265 信号が安定するのを待ちます。
- 線量計ソフトウェアの スタートフラッシュ ボタンをクリックすると、あらかじめ設定された繰り返し速度とエネルギーでレーザーの発射を開始します。
- インライン線量計を使用してリアルタイムのアデニン読み取りを監視する( 材料表を参照)。レーザーをオフにして、レーザーをオンにした腹筋265 の違いはΔAbs265 の読み取り値です。
注:過酸化水素の存在下でレーザーを発射したときの非常に不安定な腹筋265 の測定値の出現は、溶液中の気泡の発生によるものです。レーザーのフルエンスや過酸化水素の濃度を下げ、気泡を除去します。
4. 補償の実施
注:異なるリガンド、緩衝液などは、ヒドロキシルラジカルに対して異なる清掃能力を有する可能性があります。異なるサンプル間でタンパク質と反応するために、同等の有効なヒドロキシルラジカル用量が利用可能であることを確認することが重要です。これは、サンプル間の等しいヒドロキシルラジカル線量計応答を確保することによって達成される。アデニン線量測定を使用して、265 nm(ΔAbs265)におけるUV吸光度の変化は、有効なヒドロキシルラジカル用量を反映する。ΔAbs265が大きいほど、有効なヒドロキシルラジカル用量が高くなります。
- インライン線量計で得られたΔAbs265 の測定値を、事前の実験または制御によって得られた所望のΔAbs265 測定値と比較します。ΔAbs265 所望の読み取り値よりも低い読み取り値は、ヒドロキシルラジカルの不十分な有効用量を示す;ΔAbs265 の読み取り値は、高すぎる有効なラジカル用量を示す。ΔAbs265 の読み取り値が所望のレベルにある場合は、クエンチバッファ17にレーザー照射後すぐに試料を集める。
- 有効なラジカル用量を補償してΔAbs265を均等にする。この補正は、過酸化水素濃度の変化、パルス当たりのレーザーエネルギーの変化によるレーザーフルエンスの増加、または焦点レンズの焦点面の変更によるレーザーフルエンスの増加の3つの方法で行うことができます。
- ΔAbs265 の読み取り値で大きな変更 (>10 mAU) を行う場合は、多かれ少なかれ過酸化水素でサンプルを作り直し、セクション 3 に従ってサンプルを再実行します。
- ΔAbs265 の読み取り値をリアルタイムで小さく変更するには、50mm電動ステージを使用して集光レンズの位置を調整して、入射ビームの焦点面を調整します。焦点面を毛細血管の位置に近づけるとΔAbs265 の読み取り値が増加します。焦点面を毛細血管の位置から遠ざけると、ΔAbs265 の読み取り値が減少します。
- アデニンΔAbs265 をモニタして、レーザー照射後の試料中に存在するヒドロキシルラジカルの有効量を測定する。インラインUV毛管検出器によるリアルタイムモニタリングは、4.2.2に記載されているようにリアルタイムの補償を可能にします。ΔAbs265 の読み取り値が所望の読み取り値に等しくなるまで、電動ステージを使用してレンズ位置を調整します。UV分光光度計による実験後の吸光度測定も正確ですが、各効果的なラジカル線に新しいサンプルを使用する必要があります。
5. タンパク質サンプルを消化する
注:トリプシンはFPOPのタンパク質サンプルを消化するために最も一般的に使用され、このプロトコルで使用されるプロテアーゼです。N末語とC末語の両方で基本部位を有するペプチドを生成し、MSで増殖荷電ペプチドイオンを促進する信頼性の高いプロテアーゼです。さらに、リジンおよびアルギニンの後に切断し、ヒドロキシルラジカルに対して適度に反応性を有する2つのアミノ酸;したがって、検体酸化による消化パターンの変化はまれである。FPOP21では他のプロテアーゼがうまく使用されていますが、消化パターンが非酸化と酸化されたサンプルの間で比較可能であることを確認するために注意する必要があります。
- クエンチされたFPOPサンプルの最終容積を測定します。500 mM トリス、50 mM ジチオトレイトール (DTT) を含む 10 mM CaCl2 の pH 8.0 を、50 mM トリス、1 mM CaCl2、5 mM DTT の最終濃度まで吸い込んだ後のタンパク質溶液に加えます。
- タンパク質サンプルを95°Cで15分間加熱します。
- すぐに氷の上でサンプルを2分間冷却します。
- サンプルに1:20トリプシン/タンパク質量比を加えます。
- 混合で37°Cで一晩タンパク質を消化します。
- 0.1%のギ酸を加えて、10分間95°Cに加熱することにより、消化反応を停止します。
- サンプルに2 mM DTTを加え、LC-MS/MSの直前に15分間60°Cで加熱します。
注:他のグループはFPOP実験でチオールのアルキル化を報告していますが、私たちの手では酸化タンパク質のアルキル化時に副産物を指摘しています(おそらくマイナーな酸化生成物として形成された求核カルボニルとの反応によるものです)。したがって、可能な場合はチオールのアルキル化を避けることを選択します。
6. 液体クロマトグラフィータンデム質量分析(LC-MS/MS)を行う
- 0.1%のギ酸を含む水と0.1%のギ酸を含むアセトニトリルからなる移動相Bからなる移動相Aを調製する。
- サンプルを最初にC18トラップカラム(300 μm I.D.x 5 mm 100 Åの細孔サイズ、5 μmの粒子サイズ)に詰め込み、2%の溶媒Bで3分間洗浄し、塩や親水性の小分子を除去します。
- 次に、C18ナノカラム(0.75mm x 150mm、粒子径2μm、100Å孔サイズ)のペプチドを300nL/minの流量で分離します。勾配は、22分間で2〜35%の溶媒Bから線形増加し、5分間にわたって95%の溶媒Bに傾斜し、3分間保持して3分間保持し、3分間にわたって2%Bに戻し、9分間保持してカラムを再平衡化します。
注: この勾配は、ペプチドレベルの定量を行おうとするほとんどの 1 タンパク質および 2 タンパク質 FPOP 混合物の LC-MS/MS に十分です。溶媒Bのパーセントは、ペプチドが同様の保持時間とm/z値のために互いに干渉する稀なケースでペプチド分解能を高めるために変更する必要があるかもしれません。プロテオームスケールFPOP22またはペプチド酸化生成異性体1、23、24、2523,を分離しようとする実験設計は、より長いLC勾配を必要とし24、25このレポートの範囲を超えている可能性があります。1 - 導電性ナノスプレーエミッタを用いて、ペプチドを高分解能質量分析計のナノスプレー源に直接溶出する。
- 正のイオンモードでデータを取得します。噴霧電圧を2400Vに設定し、イオン転写管の温度を300°Cに設定します。
- m/z 250から2000までの完全なMSスキャンをm/z 2000の公称解像度で60,000の m/z 200で取得し、その後、35%正規化されたエネルギーで衝突誘発解離を使用して最も豊富なペプチドイオンの上位8つのデータ依存性線形イオントラップMS/MSスキャンを行い、ペプチドを同定します。ペプチドを30s以内に5回までフラグメント化し、60sの除外リストに移します。
7. ペプチドの平均酸化のデータ処理と計算
- MS/MSプロテオミクス検索エンジンを使用して、タンパク質の配列カバレッジ 、m/z 値、非酸化ペプチドの保持時間を決定します。
- 前駆体質量許容範囲を10 ppmに設定し、標準的なトリプシン切断特異性を使用して、トリプシン消化サンプルの切断部位を最大2つまで可能にします。
- ペプチド質量フラグメント質量許容範囲を0.4ダルトンに設定します。
- 主要な酸化生成物の検出された未改変ペプチドのm/z比と既知の質量シフトに基づいて、各ペプチド4、26、27、28、2926,27の様々な理論酸化産物のm/z,28を29算出する。4
- これらのm/z値の抽出されたイオンクロマトグラムを、ソフトウェアを使用して質量分析の実行を表示します(図4)。m/z、その電荷状態、および未修飾ペプチドとの溶出時間の類似性に基づいてペプチド酸化生成物を同定する。我々の手では、ペプチド酸化生成物は、上記のLC勾配を用いて未改変ペプチドの後240秒〜180秒の間に溶出する。酸化は多発異性体酸化生成物をもたらすことが多いので、図4に示すように、ペプチド酸化産物の抽出されたイオンクロマトグラム中の複数の部分的に分解されたピークを観察することが一般的である。ペプチド酸化生成物は、抽出されたイオンクロマトグラムのピークの面積に基づいて定量されます。
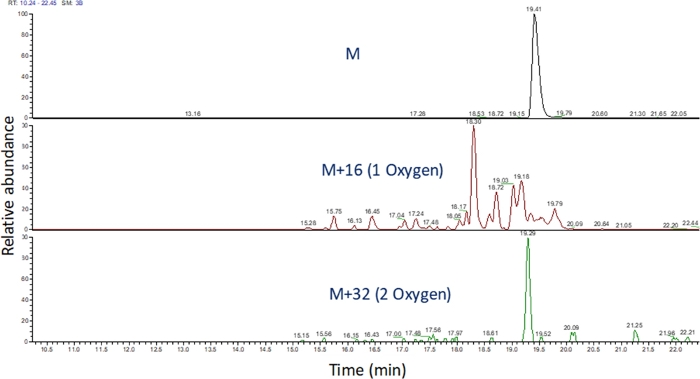
図4:FPOP後のペプチド及びその酸化産物のイオンクロマトグラムを抽出した。ペプチド酸化生成物の m/z は、非酸化ペプチドおよび既知の酸化生成物の m/z に基づいて計算されます。これらのペプチド製品の領域が決定されます。次に、ペプチド生成物の面積を、ペプチド当たりの平均酸化事象の計算に使用します。 この図の大きなバージョンを表示するには、ここをクリックしてください。
- ペプチドの平均酸化を以下の式を用いて計算する。
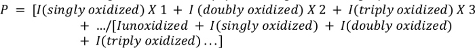
ここでPはペプチド分子あたりの平均酸化事象数を示し、Iは非酸化ペプチド(Iunoxキシ化)とn酸化事象を有するペプチドのピーク面積を表す。I(単独酸化)は、単一の酸素原子の添加だけでなく、研究者が測定することを選択できる他のあまり一般的でない単一酸化事象(例えば、酸化脱炭酸、カルボニル形成など)を含むであろうことに注意してください。4,,26,27,28,29.
結果
リン酸緩衝液中のアダリムマブバイオシミラーの重鎖ペプチド足跡と55°Cで1時間加熱した場合の比較は、興味深い結果を示す。学生のt検定は、これら2つの条件で有意に変化するペプチドの同定に使用されます(p ≤ 0.05)。ペプチド20-38、99-125、215-222、223-252、260-278、376-413、および414-420は、タンパク質が熱されて凝集体を形成する際に溶媒から有意な保護を示す(図5)
ディスカッション
水素重水素交換、化学架橋、共有標識、天然スプレー質量分析、イオン移動性など、質量分析ベースの構造技術は、その柔軟性、感度、複雑な混合物を処理する能力により急速に普及しています。FPOPは質量分析ベースの構造技術の分野での人気を高めているいくつかの利点を誇っています。ほとんどの共有標識戦略と同様に、ほとんどのポストラベリングプロセス(トリプシン消化、脱糖分?...
開示事項
ジョシュア・S・シャープは、ヒドロキシルラジカルタンパク質フットプリントを含むタンパク質高次構造解析の技術を製品化しようとする小さな会社、GenNext Technologies, Inc.に大きな財政的関心を開示しています。
謝辞
我々は、高エネルギーFPOPの標準化およびドージトリープロトコルの開発のためのベンチトップFPOP装置およびR01GM127267の商業開発を支援するために、国立一般医学研究所からの研究資金R43GM125420-01toを認める。
資料
| Name | Company | Catalog Number | Comments |
| Adenine | Acros Organics | 147440250 | Soluble in water upto 3.5 mM |
| Aperture | Edmund Optics | 39-905 | 1000 μm Aperture Diameter, Gold-Plated Copper Aperture |
| Aperture holder | Edmund Optics | 53-287 | 25.8mm Outer Diameter, Precision Pinhole Mount |
| Catalse | Sigma Aldrich | C-40 | Catalase from bovine liver, lyophilized powder, ≥10,000 units/mg protein |
| COMPex Pro laser | Coherent | 1113836 | COMPexPRO 102, F-Vversion, KrF laser, No XeCl |
| Dithiotheitol (DTT) | Promega | V3151 | DTT, Molecular Grade (DL-Dithiothreitol) |
| Fraction collector | GenNext Technologies, Inc. | N/A | Automated fraction collector |
| Fused silica capillay | Molex | 1068150023 | Polymicro Flexible Fused Silica Capillary Tubing, Inner Diameter 100 µm, Outer Diameter 375 µm, TSP100375 |
| Glutamine | Acros Organics | 119951000 | L(+)-Glutamine, 99% |
| Holder for lens | Edmund Optics | 03-668 | 53 mm Outer Diameter, Three-Screw Adjustable Ring Mount |
| Hydrogen peroxide | Fisher Scientific | H325-100 | Hydrogen Peroxide, 30% (Certified ACS), Fisher Chemical |
| LC-MS/MS system | Thermo Scientific | IQLAAEGAAPFADBMBCX | Dionex Ultimate 3000 coupled to Orbitap Fusion Tribrid mass spectrometer |
| Mas spec grade Acetonitrile | Fisher Scientific | A955-1 | Acetonitrile, Optima LC/MS Grade, Fisher Chemical |
| Mass spec grade formic acid | Fisher Scientific | A117-50 | Formic Acid, 99.0+%, Optima™ LC/MS Grade, Fisher Chemical |
| Mass spec grade water | Fisher Scientific | W6-4 | Water, Optima LC/MS Grade, Fisher Chemical |
| MES buffer | Sigma Aldrich | M0164 | MES hemisodium salt |
| Methionine amide | Bachem | 4000594.0005 | H-met-NH2.HCl |
| Micro V clamp | Thor Labs | VK250 | Micro V-clamp with stainless steel blades |
| Motorized stage | Edmund Optics | 68-638 | 50mm Travel Motorized Stage System with Manual Control |
| Nano C18 colum | Thermo Scientific | 164534 | Acclaim PepMap 100 C18 HPLC Columns |
| Optical bench | Edmund Optics | 56-935 | 18" x 18" breadboard |
| Pioneer FPOP Module System | GenNext Technologies, Inc. | N/A | Inline FPOP Radical Dosimetry System |
| Post holder | Edmund Optics | 58-979 | 3" Length, ¼-20 Thread, Post Holder |
| Sodium phosphate dibasic | Fisher Scientific | BP331-500 | Sodium Phosphate Dibasic Heptahydrate (Colorless-to-White Crystals), Fisher BioReagents |
| Sodium phosphate monobasic | Fisher Scientific | BP330-500 | Sodium Phosphate Monobasic Monohydrate (Colorless-to-white Crystals), Fisher BioReagents |
| Syringe | Hamilton | 81065 | 100 µL, Model 1710 RN SYR, Small Removable NDL, 22s ga, 2 in, point style 3 |
| Syringe pump | KD Scientific | 788101 | Legato 101 syringe pump |
| Trap C18 column | Thermo Scientific | 160454 | Thermo Scientific Acclaim PepMap 100 C18 HPLC Columns |
| Tris | Sigma Aldrich | 252859 | Tris(hydroxymethyl)aminomethane |
| Trypsin | Promega | V5111 | Sequencing Grade Modified Trypsin |
| UV plano convex lens | Edmund Optics | 84-285 | 30 mm Dia. x 120 mm FL Uncoated, UV Plano-Convex Lens |
参考文献
- Kaur, P., Kiselar, J., Yang, S., Chance, M. R. Quantitative protein topography analysis and high-resolution structure prediction using hydroxyl radical labeling and tandem-ion mass spectrometry (MS). Molecular & Cellular Proteomics. 14 (4), 1159-1168 (2015).
- Hambly, D. M., Gross, M. L. Laser flash photolysis of hydrogen peroxide to oxidize protein solvent-accessible residues on the microsecond timescale. Journal of the American Society for Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Buxton, G. V., Greenstock, C. L., Helman, W. P., Ross, A. B. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O- in Aqueous Solution. Journal of Physical and Chemical Reference Data. 17 (2), 513 (1988).
- Xu, G., Chance, M. R. Radiolytic modification and reactivity of amino acid residues serving as structural probes for protein footprinting. Analytical Chemistry. 77 (14), 4549-4555 (2005).
- Sharp, J. S., Tomer, K. B. Effects of anion proximity in peptide primary sequence on the rate and mechanism of leucine oxidation. Analytical Chemistry. 78 (14), 4885-4893 (2006).
- Huang, W., Ravikumar, K. M., Chance, M. R., Yang, S. Quantitative mapping of protein structure by hydroxyl radical footprinting-mediated structural mass spectrometry: a protection factor analysis. Biophysical Journal. 108 (1), 107-115 (2015).
- Xie, B., Sood, A., Woods, R. J., Sharp, J. S. Quantitative protein topography measurements by high resolution hydroxyl radical protein footprinting enable accurate molecular model selection. Scientific Reports. 7 (1), 4552 (2017).
- Li, Z., et al. High structural resolution hydroxyl radical protein footprinting reveals an extended Robo1-heparin binding interface. Journal of Biological Chemistry. 290 (17), 10729-10740 (2015).
- Li, X., et al. Structural analysis of the glycosylated intact HIV-1 gp120-b12 antibody complex using hydroxyl radical protein footprinting. Biochemistry. 56 (7), 957-970 (2017).
- Li, K. S., Shi, L., Gross, M. L. Mass spectrometry-based fast photochemical oxidation of proteins (FPOP) for higher order structure characterization. Accounts of Chemical Research. 51 (3), 736-744 (2018).
- Li, J., Chen, G. The use of fast photochemical oxidation of proteins coupled with mass spectrometry in protein therapeutics discovery and development. Drug Discovery Today. 24 (3), 829-834 (2019).
- Roush, A. E., Riaz, M., Misra, S. K., Weinberger, S. R., Sharp, J. S. Intrinsic buffer hydroxyl radical dosimetry using Tris(hydroxymethyl)aminomethane. Journal of the American Society for Mass Spectrometry. 31 (2), 169-172 (2020).
- Xie, B., Sharp, J. S. Hydroxyl radical dosimetry for high flux hydroxyl radical protein footprinting applications using a simple optical detection method. Analytical Chemistry. 87 (21), 10719-10723 (2015).
- Niu, B., Zhang, H., Giblin, D., Rempel, D. L., Gross, M. L. Dosimetry determines the initial OH radical concentration in fast photochemical oxidation of proteins (FPOP). Journal of the American Society for Mass Spectrometry. 26 (5), 843-846 (2015).
- Niu, B., et al. Incorporation of a reporter peptide in FPOP compensates for adventitious scavengers and permits time-dependent measurements. Journal of the American Society for Mass Spectrometry. 28 (2), 389-392 (2017).
- Garcia, N. K., Sreedhara, A., Deperalta, G., Wecksler, A. T. Optimizing hydroxyl radical footprinting analysis of biotherapeutics using internal standard dosimetry. Journal of the American Society for Mass Spectrometry. 31 (7), 1563-1571 (2020).
- Sharp, J. S., Misra, S. K., Persoff, J. J., Egan, R. W., Weinberger, S. R. Real time normalization of fast photochemical oxidation of proteins experiments by inline adenine radical dosimetry. Analytical Chemistry. 90 (21), 12625-12630 (2018).
- Zhang, B., Cheng, M., Rempel, D., Gross, M. L. Implementing fast photochemical oxidation of proteins (FPOP) as a footprinting approach to solve diverse problems in structural biology. Methods. 144, 94-103 (2018).
- Konermann, L., Stocks, B. B., Czarny, T. Laminar flow effects during laser-induced oxidative labeling for protein structural studies by mass spectrometry. Analytical Chemistry. 82 (15), 6667-6674 (2010).
- Gau, B. C., Sharp, J. S., Rempel, D. L., Gross, M. L. Fast photochemical oxidation of protein footprints faster than protein unfolding. Analytical Chemistry. 81 (16), 6563-6571 (2009).
- Li, K. S., et al. Hydrogen-Deuterium exchange and hydroxyl radical footprinting for mapping hydrophobic interactions of human bromodomain with a small molecule Inhibitor. Journal of the American Society for Mass Spectrometry. 30 (12), 2795-2804 (2019).
- Espino, J. A., Jones, L. M. Illuminating biological interactions with in vivo protein footprinting. Analytical Chemistry. 91 (10), 6577-6584 (2019).
- Charvatova, O., et al. Quantifying protein interface footprinting by hydroxyl radical oxidation and molecular dynamics simulation: application to galectin-1. Journal of the American Society for Mass Spectrometry. 19 (11), 1692-1705 (2008).
- Gau, B., Garai, K., Frieden, C., Gross, M. L. Mass spectrometry-based protein footprinting characterizes the structures of oligomeric apolipoprotein E2, E3, and E4. Biochemistry. 50 (38), 8117-8126 (2011).
- Gau, B. C., Chen, J., Gross, M. L. Fast photochemical oxidation of proteins for comparing solvent-accessibility changes accompanying protein folding: Data processing and application to barstar. Biochimica et Biophysica Acta. 1834 (6), 1230-1238 (2013).
- Garrison, W. M. Reaction mechanisms in the radiolysis of peptides, polypeptides, and proteins. Chemical Reviews. 87 (2), 381-398 (1987).
- Xu, G., Chance, M. R. Radiolytic modification of sulfur-containing amino acid residues in model peptides: fundamental studies for protein footprinting. Analytical Chemistry. 77 (8), 2437-2449 (2005).
- Xu, G., Chance, M. R. Radiolytic modification of acidic amino acid residues in peptides: probes for examining protein-protein interactions. Analytical Chemistry. 76 (5), 1213-1221 (2004).
- Xu, G., Takamoto, K., Chance, M. R. Radiolytic modification of basic amino acid residues in peptides: probes for examining protein-protein interactions. Analytical Chemistry. 75 (24), 6995-7007 (2003).
- Misra, S. K., Orlando, R., Weinberger, S. R., Sharp, J. S. Compensated hydroxyl radical protein footprinting measures buffer and excipient effects on conformation and aggregation in an adalimumab biosimilar. AAPS Journal. 21 (5), 87 (2019).
- Simmons, D. A., Konermann, L. Characterization of transient protein folding intermediates during myoglobin reconstitution by time-resolved electrospray mass spectrometry with on-line isotopic pulse labeling. Biochemistry. 41 (6), 1906-1914 (2002).
- Vahidi, S., Konermann, L. Probing the time scale of FPOP (fast photochemical oxidation of proteins): radical reactions extend over tens of milliseconds. Journal of the American Society for Mass Spectrometry. 27 (7), 1156-1164 (2016).
- Chance, M. R. Unfolding of apomyoglobin examined by synchrotron footprinting. Biochemical and Biophysical Research Communications. 287 (3), 614-621 (2001).
- Xu, G., Chance, M. R. Hydroxyl radical-mediated modification of proteins as probes for structural proteomics. Chemical Reviews. 107 (8), 3514-3543 (2007).
- Zhang, Y., Rempel, D. L., Zhang, H., Gross, M. L. An improved fast photochemical oxidation of proteins (FPOP) platform for protein therapeutics. Journal of the American Society for Mass Spectrometry. 26 (3), 526-529 (2015).
- Cornwell, O., Radford, S. E., Ashcroft, A. E., Ault, J. R. Comparing hydrogen deuterium exchange and fast photochemical oxidation of proteins: a structural characterisation of wild-type and ΔN6 β(2)-microglobulin. Journal of the American Society for Mass Spectrometry. 29 (2), 2413-2426 (2018).
- Xie, B., Sharp, J. S. Relative Quantification of sites of peptide and protein modification using size exclusion chromatography coupled with electron transfer dissociation. Journal of the American Society for Mass Spectrometry. 27 (8), 1322-1327 (2016).
- Srikanth, R., Wilson, J., Vachet, R. W. Correct identification of oxidized histidine residues using electron-transfer dissociation. Journal of Mass Spectrometry. 44 (5), 755-762 (2009).
- Li, X., Li, Z., Xie, B., Sharp, J. S. Improved identification and relative quantification of sites of peptide and protein oxidation for hydroxyl radical footprinting. Journal of the American Society for Mass Spectrometry. 24 (11), 1767-1776 (2013).
- Li, X., Li, Z., Xie, B., Sharp, J. S. Supercharging by m-NBA Improves ETD-Based Quantification of Hydroxyl Radical Protein Footprinting. Journal of the American Society for Mass Spectrometry. 26 (8), 1424-1427 (2015).
- Khaje, N. A., Sharp, J. S. Rapid quantification of peptide oxidation isomers from complex mixtures. Analytical Chemistry. 92 (5), 3834-3843 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved