Method Article
התגבשות חלבונים על שבב על ידי מיקרודיאליזה עבור In Situ רנטגן עקיפה מחקרים
In This Article
Summary
נייר זה מפרט את פרוטוקול הייצור של שבבים מיקרופלואידיים שפותחו להתגבשות חלבונים על שבב בשיטת הדיאליזה ובניסויי עקיפת קרני רנטגן. תהליך microfabrication מאפשר לשלב קרום דיאליזה תאית מתחדשת למחצה עם כל משקל מולקולרי מנותק, בין שתי שכבות של השבב.
Abstract
פרוטוקול זה מתאר את הייצור של מכשירים מיקרופלואידיים הניתנים לשחזור וזול המכסים את כל הצינור לצורך התגבשות חלבונים על השבב בשיטת הדיאליזה ומתן אפשרות בניסויים בקריסטל יחיד או קריסטלוגרפיה סדרתית בטמפרטורת החדר. הפרוטוקול מפרט את תהליך הייצור של השבבים, את המניפולציה של ניסויי התגבשות על השבב ואת הטיפול באתרו אסף נתוני עקיפת רנטגן עבור ההבהרה המבנית של דגימת החלבון. התכונה העיקרית של הליך microfabrication זה טמון על שילוב של מסחרי זמין, קרום דיאליזה תאית מתחדשת למחצה בין שתי שכבות של השבב. המשקל המולקולרי של הממברנה המוטבעת משתנה בהתאם למשקל המולקולרי של המקרומולקולה והמשקעים. המכשיר מנצל את היתרונות של טכנולוגיה מיקרופלואידית, כגון שימוש בכמויות זעירות של דגימות (<1 μL) וכוונון עדין על תופעות תחבורה. השבב צירף אותם לשיטת הדיאליזה, המספקת שליטה מדויקת והפיכה על תהליך ההתגבשות וניתן להשתמש בה לבדיקת דיאגרמות פאזה של חלבונים בסולם המיקרוליטר. המכשיר מעוצב באמצעות שרף מבוסס ת'יולן פוטו-קורלן עם ליתוגרפיה של הטבעה רכה על מצע פולימרי שקוף אופטית. יתר על כן, פיזור הרקע של החומרים המרכיבים את השבבים ויצירת רעשי רקע הוערך מה שהופכים את השבב תואם בניסויי עקיפת קרני רנטגן. ברגע שגבישי חלבון גדלים על שבב עד לגודל הולם ואחידות אוכלוסין, השבבים יכולים להיות מותקנים ישירות מול קרן הרנטגן בעזרת מחזיק מודפס בתלת-ממד. גישה זו מטפלת באתגרים העולים משימוש בהקפאה וקצירה ידנית בניסויי קריסטלוגרפיה קונבנציונליים של חלבונים באופן קל וזול. ערכות נתונים מלאות של עקיפת קרני רנטגן מגבישי ליזוזים איסומורפיים מרובים הגדלים על שבב נאספו בטמפרטורת החדר לצורך קביעת מבנה.
Introduction
הבהרת המבנה התלת מימדי (3D) של מקרומולקולות ביולוגיות היא מרדף בלתי פוסק בביולוגיה מבנית שבה קריסטלוגרפיה של קרני רנטגן נותרה טכניקת החקירה העיקרית. היא ביקשה לפענח את הפרטים המבניים של מקרומולקולות מורכבות, כגון חלבונים, במטרה להקל על הבנת מנגנוני הפעולות שלהם ומעורבותם בתפקודים ביולוגיים שונים. מקורות רנטגן רבי עוצמה בלייזרים נטולי סינכרונים ורנטגן (XFELs) מספקים את כל הכלים הדרושים לתובנה מעמיקה יותר על מבנה החלבונים ברזולוציה אטומית קרובה. למרות היתרונות שמגיעים יחד עם השימוש בצילומי רנטגן למחקרים מבניים, קיימות מגבלות מהותיות לקרינת רנטגן ולתהליך ההתגבשות עצמו. נזק לקרינה שנגרם על ידי שטף רנטגן גבוה וזמני חשיפה ארוכים של גביש החלבון מול קרן הרנטגן הם פרמטרים מגבילים כי crystallographers צריך לעלות באמצעות קירור קריוגני1. עם זאת, מציאת תנאי ההקפאה האופטימליים יכולה להיות מייגעת שכן שינויים קונפורמיים ממבנה החלבון המקומי או חפצים ניתן להסתיר2,3. יתר על כן, מחקרים שנעשו לאחרונה מצביעים על כך ביצוע ניסויים עקיפה בטמפרטורת החדר מוביל נזק קרינה ספציפי נמוךיותר 4. צוואר בקבוק נוסף בביולוגיה מבנית הוא רכישת גבישים מפוזרים היטב בגודל מספיק5. גבישים קטנים קלים יותר לייצור, במיוחד במקרה של חלבוני ממברנה, אך רגישים יותר לנזקי קרינה גם בתנאי cryocooling מכיוון שמינוןקרינהגבוה חייב להיות מופנה בנפח קטן יותר בהשוואה למקרה של גבישי חלבון גדולים יותר 6 . הגישה החדשה של קריסטלוגרפיה סדרתית7,8 ב synchrotrons ו XFELs יכול לעקוף את הריסונים של נזקי קרינה באותו זמן לנצל גבישים קטנים יותר (200 ננומטר עד 2 מיקרומטר)7 על ידי מיזוג ערכות נתונים ממספר, גבישי חלבון איזומורפיים ומכוונים באופן אקראי ומרוויחים מההתקדמות הטכנולוגית הנלווית כגון פולסים femtosecond, זמני חשיפה קצרים יותר וקרני רנטגן ממוקדות מיקרו5,7,9,10.
טכנולוגיה מיקרופלואידית היא בעלת ערך לקריסטלוגרפיה של קרני רנטגן, ומציגה יתרונות רבים להתגבשות מקרומולקולות ביולוגיות ולחקירה המבנית שלהן. ביצוע ניסויי התגבשות במכשירים מיקרופלואידיים דורש כמויות קטנות של דגימת חלבון, ובכך מגביל את עלות הייצור של מקרומולקולות ביו בעלות ערך גבוה אלה ומאפשר סינון תפוקה גבוהה ואופטימיזציה של תנאי התגבשות רבים. יתר על כן, יחס שטח הפנים הגדול הטבוע בנפח בקנה מידה מיקרופלואידי ותופעות תחבורה מוגבלות דיפוזיה מאפשרים שליטה עדינה על זרימות וטמפרטורה או שיפוע ריכוז11,12,13,14, עיבוד התקנים מיקרופלואידיים המתאימים לגידול גבישים בגודל אחיד ולחקור דיאגרמות שלב15,16,17,18,19. יתר על כן, כלים מיקרופלואידיים מציגים פוטנציאל ייחודי להתמודד עם משוכה נוספת בקריסטלוגרפיה של חלבונים, שהיא משלוח הדגימה, והצורך לטפל ולקצור גבישי חלבון לפני השימוש בהם לניסויי עקיפת קרני רנטגן. שיטת השבב ובקריסטלוגרפיית רנטגן situ מבטלת את מניפולציית הגביש ואת ההידרדרות הפוטנציאלית של איכות הגביש לפני איסוף הנתונים. מגוון רחב של שבבים מיקרופלואידיים התואמים לקריסטלוגרפיה של חלבון רנטגן situ תוכננו, פותחו ונבדקו על ידי קבוצות מחקר רבות המתמודדות עם המגבלות הקשורות הנובעות מאופי חומרי המיקרו-פבריקציה והאינטראקציות שלהם עם צילומי רנטגן14,19,20,21,22,23. חומרי הייצור חייבים להיות שקופים אופטית, אינרטיים ביולוגית ולהפגין שקיפות גבוהה לקרינת רנטגן ויחס אות לרעש אופטימלי במהלך איסוף הנתונים.
רוב שיטות ההתגבשות המיושמות בקריסטלוגרפיה קונבנציונלית של חלבונים24,25 יושמו גם בסולם המיקרופלואידי11,14 להתגבשות שבבים ובניתוח עקיפת קרני רנטגן. מנגנון מיקרופלואידי פשוט, היברידי או רב שכבתי המשלב דיפוזיה אדים26, אידוי27, דיפוזיה ממשק חינם (FID)28, microbatch26, או אפילו זריעה29 שימשו כדי לגבש חלבונים מסיסים קרום. סינון תפוקה גבוהה ואופטימיזציה של תנאי התגבשות ניתן להשיג30,31 ב מבוסס היטב32, droplet מבוסס33, או שסתום מופעל34 התקנים. במקום ניסויי עקיפת קרני רנטגן של מטרות חלבון מאתגרות בטמפרטורת החדר נערכו בשבבים מפוברק מחומרים שונים כגון PDMS (polydimethylsiloxane), COC (קופולימר אולפין מחזורי), PMMA (פולי (מתיל methacrylate))21,22,26,28,29, גרפן סרטים23, Kapton35, דבק אפוקסי6, או NOA (דבק אופטי נורלנד)19 ואת השקיפות של החומרים קרינת רנטגן ותרומתם לרעשי רקע הוערכו. יתר על כן, שבבים תוכננו כדי זוג in situ ואת אסטרטגיות איסוף נתונים סדרתיים בכלי אחד עבור ניסויים קריסטלוגרפיה חלבון רנטגן במקורות synchrotron23,35,36 ו XFELs7.
טמפרטורת החדר באיסוף נתוני situ יושמה גם בשיטות אספקה ומכשירים שונים. לדוגמה, Nogly et al.54 השתמשו במזרק שלב מעוקב ליפידי (LCP) כדי לחקור את המבנה של בקטריאורודופסין משאבת פוטון מונחה אור (bR) על ידי קריסטלוגרפיה femtosecond סדרתי (SFX) באמצעות מקור XFEL. מבנה הגביש של bR נפתר לרזולוציה של 2.3 Å, הממחישה את תאימותו של מזרק LCP עם קריסטלוגרפיה סדרתית שנפתרה בזמן (TR-SFX). בקסטר ואח '55 עיצב רשת מרובת גבישים בצפיפות גבוהה, מפוברק על ידי פלסטיק פוליקרבונט בעובי 100 או 200 מיקרומטר עם חורים חתוכים בלייזר בגדלים שונים. סרט פוליקרבונט נוסף בעובי 5 מיקרומטר ניתן לתקן לצד אחד של הרשת בעת שימוש במכשיר לניסויי התגבשות ישיבה או תלייה. רשת זו בצפיפות גבוהה ניתן להשתמש בדרכים רבות כמו גבישים ניתן לטעון ישירות על היציאות של המכשיר או גבישים ניתן לגדל על המכשיר על ידי דיפוזיה אדים או שיטת LCP. יתר על כן, הרשת יכולה להיות מותאמת בבסיס מגנטי סטנדרטי ומשמש באיסוף נתוני רנטגן situ בתנאים קריוגניים או טמפרטורת החדר. לאחרונה, Feiler et al.56 פיתחה מחזיק מדגם עבור מקרומולקולרי בקריסטלוגרפיה רנטגן situ בטמפרטורה קריוגנית והסביבה עם תרומה מינימלית רעש רקע. באופן ספציפי, המחזיק מורכב מתמיכה בפלסטיק, רדיד COC שקוף ונייר פולימיד מיקרופורי מובנה. הוא תוכנן להחליף את שקופיות הכיסוי הנפוצות להגדרת טיפות התגבשות, תוך מתן אפשרות למניפולציה במקום כגון השריית ליגנד, היווצרות מורכבת והגנה קריוגנית מבלי לפתוח את טיפת ההתגבשות או לטפל באופן ידני בגבישים. יתר על כן, מחזיק המדגם ניתן להסיר מלוח התגבשות והניח על בסיס מגנטי עבור באיסוף נתונים situ בקורות מבוססות goniometer סטנדרטי. לאיסוף נתוני טמפרטורת הסביבה, רדיד COC מוסר לפני הניסוי ורק רדיד פולימיד בעובי 21 מיקרומטר תורם לפיזור רקע, שבמקרה זה הוא מינימלי. דוגמאות אלה להלחין רק חלק קטן של המחקר המתמשך ואת שפע של שבבים רב תכליתי שפותחו עבור קריסטלוגרפיה חלבון רנטגן.
עם זאת, שיטת התגבשות חלבון הדיאליזה לא שולבה באופן נרחב בתוך microfluidics. דיאליזה היא שיטה מבוססת דיפוזיה שמטרתה שיווי משקל של ריכוז משקעים באמצעות קרום חדיר למחצה על מנת להתקרב לריכוז הנומינלי להתגבשות חלבונים ומאפשרת שליטה מדויקת והפית הפיכה על תנאי התגבשות24. ניתן לבחור את המשקל המולקולרי (MWCO) של קרום הדיאליזה החודר למחצה בהתאם למשקל המולקולרי של המקרומולקולה והמשקעים כדי לאפשר פיזור של מולקולות משקעים קטנות תוך שמירה על המקרומולקולה של העניין. בשל היפוך תהליך הדיאליזה, ניתן להשתמש בו בשילוב עם בקרת טמפרטורה כדי לנתק ולמטב את הגרעין ואת צמיחת הגביש באופן עצמאי37 לחקירת דיאגרמות שלב על ידי שינוי ריכוז המשקעים תוך שימוש באותה דגימת חלבון. שילוב של ממברנות microfluidics נבדק על ידי דה יונג ואח'38 ואת המקרים במחקרים ביולוגיים השתלת דיאליזה לתוך שבבים יכול להיות רשום בעיקר בהכנה מדגם, ריכוז או סינון יישומים39,40,41,42 או תא הקשורים מחקרים43,44. החדירה באמצעות PDMS שימשה את Shim et al.37 כדי לחקור את הגרעין והצמיחה של קסילנאז בתנאים שונים. מים חלחלו דרך קרום PDMS בעובי 15 מיקרומטר לתוך מאגר החלבון של המכשיר המיקרופלואידי, ולאחר מכן שינו את ריכוז החלבון והמשקעים.
הפרוטוקול שפותח על ידי Junius et al.19,45 לייצור שבב microfluidic תואם הן על השבב התגבשות חלבון באמצעות מיקרודיאליזה והן באתרו רנטגן עקיפה ניסויים בטמפרטורת החדר מוצג. הפרוטוקול לייצור המכשיר הוא בהשראת העבודה החלוצית שהושגה על ידי Studer ועמיתים לעבודה12,46 עבור מדבקות מיקרו בדוגמת של שרף מבוסס תיולן צילום NOA 81 הטמעה ממברנות זמינות מסחרית, באמצעות ליתוגרפיה חותם רך. שינוי חדשני של השיטה הביא שבבים המאפשרים שימוש במיקרודיאליזה כדי לנטר ולשלוט במדויק בפרמטרים הניסיוניים לצמיחה על השבב של גבישי חלבון ובו זמנית לנצל את היתרונות של microfluidics, כגון צריכה מופחתת של דגימות חלבון לכל ניסוי (<1 μL). בעבודה קודמת, העקרונות של דיאליזה להחיל על מערכת בקנה מידה מאקרו (נפח טיפוסי > 20 μL) עבור סינון ואופטימיזציה של תנאי התגבשות על ידי מיפוי דיאגרמות שלב ריכוז משקע טמפרטורה הודגמו47. בעבודה זו מתואר פרוטוקול לייצור שבבי דיאליזה המשלבים קרום דיאליזה תאית (RC) של MWCO שונים על מנת לבצע מבחני התגבשות על השבב ובאיסוף נתונים עקיפת קרני רנטגן. החומרים המרכיבים את השבבים הוערכו על השקיפות שלהם לצילומי רנטגן19 וניתן להגדיר את המכשירים ישירות מול קרן הרנטגן לטמפרטורת החדר בניסויי עקיפת situ, למעט הטיפול הידני ומזעור ההשפלה של גבישי חלבון שבירים. במחקר מקרה, גבישי lysozyme לבן ביצה תרנגולת גדלו על שבב באמצעות מיקרודיאליזה יצירת אוכלוסייה בגודל אחיד. השבב הורכב אז מול קרן הרנטגן עם תמיכה3D מודפס 19 והושלם בערכות נתונים עקיפה situ נאספו בטמפרטורת החדר מגבישים מרובים, isomorphous, המדגים את הפוטנציאל הגבוה ואת הרלוונטיות של השבבים למחקרים קריסטלוגרפיה סדרתית סינכרוטרון של מטרות מקרמולקולריות מאתגרות.
Protocol
1. עיצוב מסכה והפברקת הורים
- צייר את הגיאומטריות הרצויות של ההתקן המיקרופלואידי באמצעות כל תוכנת ציור וקטורית. לכל שכבה של הפוטו-יריסט שישמש לשלב הבא של הפומוליטוגרפיה, הכינו מסכה בודדת: מסכה אחת עם ערוצים ועמודים ומסכה אחת המכילה רק את העמודים.
- תרגם את קבצי CIF שנוצרו על-ידי תוכנת הציור לתוך פוטומסקים של סרטים. ניתן לעשות זאת באמצעות שירותים מסחריים. דרוש את הפוטומסק המתאים בהתאם לבחירת הפוטו-סטוריסט המשמש במהלך הפוטוליטוגרפיה.
הערה: עבור הפוטורסיסט SU-8, הזמינו מסכות עם תכונות שחורות על רקע שקוף. SU-8 הוא פוטורסיסט שלילי מבוסס אפוקסי, מה שאומר שבמהלך החשיפה לאור UV (365 ננומטר) החלקים החשופים ל- UV מקושרים בעוד שהשאר נשארים מסיסים. לפיכך, כל הדפוסים השחורים על המסכה לא יהיו מקושרים על ידי אור UV במהלך הפוטוליטוגרפיה. ערוצים ועמודים יהיו חרוטים על המאסטרים. - הכינו שני מאסטרים על ופלים מסיליקון לעיצוב של כל שבב באמצעות פוטוליטוגרפיה באמצעות פוטורסיסט שלילי SU-8.
הערה: שלבים 1.3.1-1.3.7 מבוצעים בחדר נקי. השלבים המתוארים להלן הם השלבים המסורתיים של פוטוליטוגרפיה ואחריו ליתוגרפיה רכה PDMS, המתוארים בספרי לימוד רבים. כל הערכים של הפרמטרים הניסיוניים (פוטורסיסט, משך זמן, טמפרטורה וכו ') תלויים בפרמטרים עדינים רבים ויש לייעלם בהתאם למנגנון השונה המשמש.- השתמש רקיק סיליקון 3 אינץ' ולטפל על פני השטח עם פלזמה במשך 90 s, על מנת להקל על התצהיר וההחזקה של PHOTORESIST SU-8.
- יוצקים בערך 3 מ"ל של התנגדות SU-8 באמצע הוופל ומסובבים את ה-SU-8 עד לעובי הרצוי (איור 1A). לעובי נומינלי של 50 מיקרומטר, השתמשו ב-SU-8 3050 ובמעיל מסתובב ל-10 שניות ב-500 סל"ד ובפעם השלישית ל-30 שניות ב-3500 סל"ד. אופים את הפוטוארסיסט על צלחת חמה במשך 15 דקות ב 368 K על מנת להיות מוצק חלקית על ידי מתן ממס הכלול בשרף להתאדות ולמנוע ממנו להידבק על photomask. לאחר מכן, השאירו את הוופל בטמפרטורת החדר למשך 2 דקות.
- חשוף את הפוטוארסיסט לאור UV (איור 1B). השתמשו במיישר מסכות בהספק של 35מגה-ואט -2 וזמן חשיפה של 8 שניות.
- המשיכו באפייה שלאחר החשיפה. מניחים את הוופל על צלחת חמה במשך 5 דקות ב 368 K כדי להשלים את photoreaction מופעל על ידי החשיפה UV.
- הסר את כל ההתנגדות SU-8 כי לא היה crosslinked על ידי הצבת הוופל באמבטיה המכילה פרופילן גליקול מתיל אתר אצטט (PGMEA) ומערבבים במשך 15 דקות. לשטוף את הוופל עם isopropanol עד אין משקעים מטושטשים ניתן לראות. יבש את הוופל עם גז חנקן ולאחסן אותו בצלחת פטרי (100 מ"מ x 15 מ"מ גודל סטנדרטי).
- לטפל על פני השטח של הוופל עם סילאן על מנת להקל על ניתוק של polydimethylsiloxane (PDMS) שישמש לייצור 2 בולים. להפקיד את הוופל על צלחת חמה טפח ב 368 K במשך 10 דקות תחת אווירת האדים של hexamethyldisilazane (HMDS).
הערה: אם קילוף את PDMS מן הוופל הופך להיות קשה לאחר מספר שימושים, פני השטח של הוופל צריך להיות מטופלים שוב עם אדי HMDS. - האדון הראשון המכיל את הערוצים והעמודים מוכן. חזור על שלבים אלה והכן את תבנית האב השנייה רק את העמודים.
הערה: במהלך פוטוליטוגרפיה, המטרה היא להשיג את הגיאומטריות של המכשיר על מאסטרים SU-8 עם גובה של 50 מיקרומטר. עם זאת, לאחר שני מאסטרים SU-8 מפוברק, למדוד את גובה הגיאומטריות חרוט על המאסטרים עם פרופיל כדי לרכוש את הערך הניסיוני. הערך הנמדד עבור שני מאסטרים SU-8 מפוברק עבור פרוטוקול זה הוא כ 45 מיקרומטר.
2. ייצור תבניות PDMS
הערה: השלבים הבאים של הפרוטוקול יכולים להתבצע בכל מעבדה כל עוד נעשה שימוש במכסה המנוע לזרימה למינארית, אור צהוב בחדר משמש בעת עבודה עם שף NOA 81 (שלבים 3.6-3.11) ומקור של אור UV זמין לפולימריזציה של ת"א 81 שף (שלבים 3.7 ו 3.11).
- הכן 50 גרם של בסיס סיליקון PDMS וסוכן הריפוי שלו ביחס מסה של 10:1.
- מערבבים את שני החומרים בקסרה עם מרית ומניחים את התערובת בתא ואקום כדי להסיר את כל בועות האוויר.
- יוצקים 25 גרם של PDMS מעורבב מראש לתוך מאסטר SU-8 (מאוחסן בצלחת פטרי) דוגמת הערוצים והעמודים עד לגובה של כ 5 מ"מ. יוצקים את 25 הגרם הנותרים של ה-PDMS לדוגמת הבסיס השנייה של SU-8 רק על העמודים עד לגובה של כ-5 מ"מ(איור 1C).
- מניחים את שתי מנות הפטרי בתנור ומרפאים את שכבות ה-PDMS ב-338 K למשך שעה.
- חותכים את שכבת ה-PDMS שנרפאה סביב התבניות של אדוני SU-8 עם אזמל ומקלפים בעדינות את תבניות ה-PDMS מהמאסטרים(איור 1D).
הערה: ההליך המתואר לעיל, הנקרא דפוס העתק, משמש לעתים קרובות להכנת תבניות של PDMS שיוצמדו למשטחי זכוכית ויהיו חלק ממכשיר מיקרופלואידי53. בפרוטוקול זה, תבניות PDMS אינן חלק מהשבב, אך הן משמשות כמתווכות לייצור השבב. עבור כל עיצוב, 2 תבניות PDMS מוכנות מן המאסטרים SU-8 בהתאמה(איורים 1D ו 1E)וישמשו בהתאם (כמתואר להלן) לייצור השבב.
3. ייצור שבב דיאליזה
- מקם את תבנית ה- PDMS בדוגמת הערוצים והעמודים בשקופית זכוכית מיקרוסקופית נוקשה (בגודל סטנדרטי של 3 x 1 אינץ') עם התבניות הפונות כלפי מעלה (איור 1F). העמוד המרכזי המתאים למאגר החלבון עולה אנכית על 45 מיקרומטר מפני השטח האופקיים של תבנית PDMS.
- חותכים ומפרידים חתיכה יבשה של קרום הדיאליזה התאית המחודשת (RC) ומפקידים אותה על העמוד המרכזי של תבנית ה-PDMS, הנתמכת במגלשת הזכוכית(איור 1F).
הערה: קרום הדיאליזה RC זמין מסחרית, ואת המשקל המולקולרי מנותק (MWCO) נבחר בהתאם עם המשקל המולקולרי של החלבון תחת המחקר ואת המשקעים המשמשים. גודל החלק של קרום הדיאליזה RC תלוי בתכנון השבב. בפרוטוקול זה, 2 אבות טיפוס מתוכננים כאשר נפח מאגר החלבון הוא 0.1 או 0.3 μL. במקרים אלה, גודלו של חתיכת קרום הדיאליזה הוא 2 x 2 מ"מ2 או 4 x 4 מ"מ2, בהתאמה. - מקם את תבנית ה- PDMS השנייה בדוגמת עמודים הפונים כלפי מטה רק מעל תבנית ה- PDMS הנתמכת בשקופית הזכוכית (איור 1F). העמוד המרכזי של תבנית זו תואם את מאגר החלבון ועולה אנכית (פונה כלפי מטה) על ידי 45 מיקרומטר מפני השטח האופקיים.
- יישרו את העמודים המרכזיים של 2 תבניות PDMS. קרום הדיאליזה של RC "דחוק" בין 2 תבניות PDMS(איור 1G).
הערה: ניתן להשיג את היישור בין המבנים הזעירים של 2 תבניות PDMS באופן חזותי, ללא כל ציוד נוסף. אחרת, מניפולציה זו יכולה להיות מושגת תחת מיקרוסקופ. שינוי קטן בין המאגרים אינו בעייתי, כל עוד הערוץ הנוזלי ונקודות הקלט או הפלט אינם מכוסים במלואם. - לייבש את ההרכבה במשך 30 דקות בתא ואקום כדי להסיר את כל בועות האוויר לכודים בתבניות PDMS כדי לקדם את החדרת בשרף במהלך השלב הבא של הייצור.
הערה: שתי תבניות PDMS נשמרות במקומן על ידי הידבקות PDMS-PDMS ואין צורך בלחץ נוסף או בדרך אחרת של מליטה זמנית. - מלאו את החלל הריק בין 2 תבניות ה-PDMS עם שרף נועה 81 על בסיס ת'יולן על ידי נימי(איור 1H ו-1I).
- לרפא את שרף על ידי חשיפה לאור UV (365 ננומטר) עבור 8 s באמצעות מנורת UV קולימי (כוח 35 mW ס"מ-2).
הערה: חשיפה ראשונה זו מאפשרת לשרף NOA 81 להיות מקושר חלקית מאז שכבה דקה של תמ"א 81 במגע עם תבניות PDMS משני הצדדים נותר uncured. - חותכים את עודף של NOA 81 מהצדדים החיצוניים של תבניות PDMS עם אזמל.
- הסר את תבנית ה- PDMS העליונה עם NOA 81 מקושר חלקית תקוע עליו מתבנית PDMS התחתונה ומגלשת הזכוכית.
- חותכים גיליון PMMA בעובי 175 מיקרומטר בממדים הסטנדרטיים של שקופית זכוכית מיקרוסקופית (3 x 1 אינץ ') ומקלפים את יריעות ההגנה מפלסטיק מכל צד של פיסת PMMA. לחצו בעדינות על ההרכבה של תבנית ה-PDMS העליונה ועל NOA 81 שנרפא חלקית על פיסת PMMA (איור 1J).
- לרפא שוב NOA 81 על ידי חשיפה לאור UV עבור 60 s ולהסיר את עובש PDMS העליון (איור 1K). התוסף דבק במצע PMMA ללא כל טיפול נוסף.
הערה: ניתן לעשות שימוש חוזר בתבניות PDMS עד 5 פעמים לאחר שטיפתן באיזופרופנול ואצטון, כל עוד התבניות אינן כפופות. קרום הדיאליזה של RC משולב במדבקת תמ"א 81 ואין צורך במניפולציה נוספת או הידוק מכני.
4. מחברים נוזליים
הערה: העיצוב של השבב המיקרופלואידי מורכב מערוץ נוזלי ליניארי לפתרון התגבשות ומאגר מרכזי לדגימת החלבון (מאגר החלבון), שניהם מוצגים ממבט עליון של שני שבבים באיור 2A. קרום דיאליזה של RC מוטבע בין שני מיקרו-מבנים אלה (איור 2D) ותהליך ההתגבשות מתפתח בעוד משקעים מתמיסת ההתגבשות מפוזרים על פני הממברנה עקב שיפוע ריכוז בין שני תאי השבב המופרדים על ידי הממברנה. הערוץ המיקרופלואידי מוטבע על תבנית ה-PDMS התחתונה (איור 1F). לאחר השלמת פרוטוקול הייצור של השבבים, הערוץ הליניארי ממוקם בשכבה התחתונה של מדבקת תמ"א 81 במגע עם מצע PMMA, כפי שמוצג באיור 1K. מפרצון ונקודת גישה לשקע עבור פתרון ההתגבשות ממוקמים בכל קצה של הערוץ הליניארי ונראים כמו חורים (גובה כולל של 90 מיקרומטר) כפי שניתן לראות באיור 2A. לטיפול בפתרון ההתגבשות, יש להוסיף מחברים בנקודות הגישה.
- מחברי אג"ח הזמינים מסחרית (NanoPort) במפרצון ובשקע של הערוץ המיקרופלואידי עם דבק אפוקסי מהיר(איור 2C).
- בחר את הקוטר המתאים של צינורות PTFE בהתבסס על גודל המחברים. צינורות PTFE ישמשו להכנסת פתרון התגבשות בערוץ הנוזלי של השבב.
הערה: ערכות הזמינות מסחרית מומלצות לשליטה קלה ומדויקת בקצב הזרימה ומשולבות בדרך כלל עם מערכות אוטומטיות מונחות לחץ או מבוקרות זרימה (משאבות מזרק) לערבוב וטיפול בנוזלים. עם זאת, פתרון התגבשות ניתן להכניס באופן ידני לתוך הערוץ הליניארי עם מזרק פלסטיק חד פעמי. במקרה זה, מוצעים שלבים 4.3 עד 4.5. - מלאו מזרק חד פעמי של 1 מ"ל בתמיסת התגבשות. עבור השבבים המוצגים בפרוטוקול זה, 400 μL מספיק כדי למלא את כל הערוץ הנוזלי.
- חותכים שני טיפים פיפטה כך קוטר הקצה בצד אחד שווה לקוטר הפנימי של צינור PTFE שישמש לטיפול הפתרון. הדבק את העצות החתוכות בנקודות הגישה של הערוץ באמצעות דבק אפוקסי מהיר(איור 2B).
- חבר את המזרק עם טיפים קצוצים עם חתיכת צינור PTFE בגודל המתאים ולהציג את הפתרון בתוך הערוץ על ידי כל הזמן דוחף את הבוכנה מזרק לאט.
5. אנקפסולציה של חלבונים
הערה: התבנית של השבב המוקדש לשימוש כמאגר החלבון נשארת עד כה פתוחה לאטמוספירה. הפרוטוקול הבא מוצע להגביל בזהירות את דגימת החלבון בתוך השבב המיקרופלואידי.
- פיפטה ידנית טיפה מדגם החלבון בתוך מאגר החלבון, הממוקמת ממש על קרום הדיאליזה של RC, כפי שמודגם באיור 2E. נפח דגימת החלבון משתנה בהתאם לעיצוב השבב ויכול להיות 0.1 או 0.3 μL.
- החל שכבה דקה של שומן סיליקון ואקום גבוה בכל רחבי מאגר החלבון.
- חותכים חתיכה קטנה של גיליון PMMA בעובי 175 מיקרומטר ומניחים אותו בעדינות מעל השכבה הדקה של גריז הסיליקון. חתיכת PMMA חייבת לכסות את כל פני השטח של מאגר החלבון שבו מופקד תמיסת החלבון.
הערה: גריז סיליקון משמש כדי לשפר את מתיחות האוויר ולמנוע את התפשטות טיפת החלבון. אין מליטה או איטום בין פיסת PMMA המשמשת לכיסוי מאגר החלבון לבין מדבקת NOA 81. הקשר ביניהם הוא ממשק מוצק/מוצק. על מנת לייצר איטום כולל ואנקפסולציה אטומה לאוויר של דגימת החלבון, חתיכת סרט קפטון משמשת כמתואר בשלב 5.4.
הערה: לפעמים קשה להגביל את דגימת החלבון בחלל הייעודי של המכשיר (מאגר חלבונים) כאשר מערכת מונחית לחץ משמשת להכנסת פתרון ההתגבשות בתוך הערוץ הנוזלי (שלב 6.4). כדי למנוע את הבעיה שהוזכרה לעיל, ערכי לחץ נמוך יחסית צריך להישמר תוך הפצת פתרון התגבשות. לחץ הזרקה של 20-60 mbar עבור פתרונות מימית או 50-150 mbar עבור פתרונות צמיגים יותר (PEGs, גליצרול) מוצע19. - חותכים חתיכת סרט קפטון (20 מיקרומטר עבה) גדול מספיק כדי לכסות את חתיכת PMMA להגדיר מעל מאגר החלבון להידבק על שבב NOA סביב כל הקצוות. דגימת החלבון עטופה בתוך המאגר והשבב מוכן לשימוש לניסוי ההתגבשות, כפי שמוצג באיור 2C.
הערה: ניתן לעשות שימוש חוזר בשבבים מספר פעמים כל עוד קרום הדיאליזה והדבקה של NOA במצע PMMA אינם מתדרדרים. אם חלקים אלה של השבב פגומים, נצפו דליפות המוודאות כי לא ניתן עוד להשתמש במכשיר. שטיפת השבבים תלויה בתמיסת ההתגבשות. במקרה של פתרונות צמיגות נמוכה (מלחים, חוצצים), ניתן לשטוף את הערוץ הנוזלי רק על ידי החדרת מים מזוקקים ולתת לו לזרום במשך כמה דקות. 400 μL הוא אמצעי האחסון הנדרש על מנת להחליף לחלוטין פתרון בתוך הערוץ עם פתרון אחר. במקרה של פתרונות צמיגים יותר (PEGs, גליצרול), שימוש חוזר בשבבים אינו מומלץ שכן שטיפת התעלה רק עם מים אינה מספיקה. החלק העליון של השבב, שבו נמצא מאגר החלבון, ניתן גם לשטוף במים מזוקקים ומיובשים באוויר בלחץ.
6. התגבשות חלבונים על השבב
- לשקול אבקת lysozyme ביצה לבן ביצה lyophilized להתמוסס במים מזוקקים כדי לקבל ריכוז סופי של 30 מ"ג מ"ל-1.
- לסנן את פתרון החלבון באמצעות מסנן 0.22 מיקרומטר וצנטריפוגה במשך 5 דקות במהירות הגבוהה ביותר ב 293 K כדי להסיר את כל החלקיקים מוצקים. השתמש supernatant לניסוי התגבשות.
- הכן 500 μL של פתרון התגבשות המכיל את החיץ ואת המשקעים בריכוזים המסופקים בטבלה 1. סנן את הפתרון באמצעות מסנן 0.22 מיקרומטר.
- הזרק את הפתרון לנקודת הכניסה של השבב עם מזרק או מערכת נוזלית אוטומטית מונחית לחץ או משאבת מזרק, כמתואר בשלבים 4.1-4.5.
הערה: ניסוי התגבשות יכול להתרחש גם במצב סטטי, אם הערוץ המיקרופלואידי מלא בתמיסת התגבשות ומניח בצד, או בתנאים זורמים, אם הוא מוזרק ברציפות בתוך הערוץ בקצב זרימה קבוע. במקרה האחרון, מומלץ להשתמש במערכת חיצונית מונחית לחץ או במשאבת מזרק. מימוש הניסוי בתנאים זורמים מספק גם את האפשרות להחליף באופן דינמי פתרונות התגבשות בתוך הערוץ הנוזלי. לכן, ניסויים מרובים יכולים להתבצע תוך שימוש באותה דגימת חלבון. - לאחר שהערוץ הנוזלי מתמלא בתמיסת התגבשות, אטום את יציאות המפרצון והשקע של השבב עם סרט שיתוק.
- פיפטה את הנפח המתאים של תמיסת החלבון בתוך מאגר החלבון ולתמצת את דגימת החלבון כמתואר בשלבים 5.1-5.4.
- אחסן את השבב ב-293 קיי.
הערה: התגבשות באמצעות דיאליזה עוקבת אחר מסלול קינטי שונה מניסויים שנערכו בשיטת פיזור האדים או התגבשות האצווה ותלויה עמוקות באופי המולקולות התלולות המעורבות בתהליך הדיפוזיה, על פי נתוניםמדודים 51, וזה עלול לקחת יותר זמן עד שהגרעין יתחיל. על מנת למנוע אידוי, אם בכלל, במהלך תקופה זו, מניחים את השבב באווירה רוויה בלחות ב 293 K.
7. באתרו ועל שבב עקיפת רנטגן
- תמיכה בהדפסה בתלת-ממד עבור קווי קרן
- הדפס את התמיכה שיכולה לשאת עד שלושה שבבים בו-זמנית. מידות התמיכה זהות לממדים של לוחות התגבשות מסחריים (תקן 96 באר /SBS) התואמים בניסויי עקיפת קרני רנטגן בלוח.
הערה: ניתן להקצות את הדפסת התמיכה לשירותים מסחריים. התמיכה תוכננה באמצעות תוכנת תכנון תלת-ממד-CAD ומוצגת באיור 3A במהלך ניסויים בגיבוש חלבונים על שבב ובאיור 3B במהלך איסוף נתוני עקיפת קרני רנטגן באתרו ב-BM30A-FIP (ESRF). - ייצבו את שבבי הדיאליזה בתמיכה באמצעות סרט חד-צדדי או דו-צדדי.
- הדפס את התמיכה שיכולה לשאת עד שלושה שבבים בו-זמנית. מידות התמיכה זהות לממדים של לוחות התגבשות מסחריים (תקן 96 באר /SBS) התואמים בניסויי עקיפת קרני רנטגן בלוח.
-
במקום עקיפת קרני רנטגן
- לאסוף נתוני עקיפת רנטגן בטמפרטורת החדר מגבישים הגדלים במאגר החלבון. לדוגמה, להשתמש בצילומי רנטגן עם אנרגיה של 12.656 keV, שטף של 3.32 x 1010 פוטונים s-1 וגודל קרן של 250 x 250 מיקרומטר2. רשום את תמונות עקיפה עם גלאי ADSC Quantum 315r עם מטריצה של 3 x 3 CCD עבור משטח פעיל של 315 x 315 מ"מ2 ו 9.4 מגה פיקסלים ברזולוציה.
הערה: נתוני עקיפה עבור גבישי lysozyme הגדלים על שבבי הדיאליזה נאספו בקרן BM30A-FIP במתקן הקרינה האירופי Synchrotron (ESRF). עם זאת, גודל הקרן, השטף וסוג הגלאי עשויים להיות שונים במקורות קרינת רנטגן אחרים. התמיכה המודפסת בתלת-ממד מאפשרת איסוף נתונים עם טווח זוויתי של -40° עד +40° סביב הגביש. מספר גבישי lysozyme שנחשפו באיסוף נתונים באתרו, מספר דפוסי עקיפה שנאספו עבור כל גביש, טווח זווית התנודות לחשיפה וזמן החשיפה מסוכמים בטבלה 2.
- לאסוף נתוני עקיפת רנטגן בטמפרטורת החדר מגבישים הגדלים במאגר החלבון. לדוגמה, להשתמש בצילומי רנטגן עם אנרגיה של 12.656 keV, שטף של 3.32 x 1010 פוטונים s-1 וגודל קרן של 250 x 250 מיקרומטר2. רשום את תמונות עקיפה עם גלאי ADSC Quantum 315r עם מטריצה של 3 x 3 CCD עבור משטח פעיל של 315 x 315 מ"מ2 ו 9.4 מגה פיקסלים ברזולוציה.
- טיפול בנתונים
- לעבד את ערכות הנתונים המלאות או החלקיות עם דפוסי עקיפה עבור גבישי lysozyme עם תוכנית XDS48.
- צור את קובץ HKL עבור כל ערכת נתונים ושנה את קנה המידה שלהם באמצעות תוכנת XSCALE48.
- השתמש בהחלפה מולקולרית עם התוכנית Phaser של חבילת CPP449 וקבע את השלבים לבניית מודל. עבור שלב זה, השתמש בקואורדינטות תלת-ממדיות ידועות של lysozyme מהערך של מאגר נתוני החלבון (PDB) 193L.
- מקד את המבנה באמצעות פניקס52 ובדוק את דגם החלבון הסופי באמצעות COOT50.
תוצאות
השבבים המיקרופלואידיים שפותחו על ידי Junius et al.19,45 תואמים הן להתגבשות חלבונים על השבב בשיטת המיקרו-דיאליזה והן באיסוף נתוני עקיפת קרני רנטגן במקום בטמפרטורת החדר. תמונות השבבים, העיצוב המפורט שלהם, המחברים הנוזליים וקרום הדיאליזה של RC מודגמים באיור 2. ניסויי התגבשות מוגדרים על ידי צינור ידני מדגם החלבון ישירות לתוך מאגר החלבון והכנסת פתרון התגבשות לתוך הערוץ הנוזלי ליניארי עם מערכת אוטומטית מונחה לחץ או משאבת מזרק או באופן ידני בעזרת מזרק. באיור 2Aניתן להבחין במאגר החלבון ובערוץ הנוזלי . עיצובים לייצור שבבים עם נפח מרבי של 0.1 μL או 0.3 μL של מאגר החלבון מוצגים באיור 2A מימין ומשמאל, בהתאמה. שבבים עם קיבולת מקסימלית של 0.2 μL או 0.7 μL עבור דגימת החלבון מוצגים במקום אחר19. גולת הכותרת של הפרוטוקול לייצור המכשיר ניתן לצמצם על השימוש של שרף מבוסס thiolene צילום NOA 81 הטמעה מסחרית זמין RC קרום דיאליזה של MWCOs שונים. במהלך ייצור המכשירים המיקרופלואידיים, הערוץ הנוזלי הליניארי מוטבע על תבנית ה-PDMS התחתונה(איור 1F),בעוד שעובש ה-PDMS העליון מורכב רק מהעמודים בדוגמת מאגר החלבון ויציאות הכניסה והשקע(איור 1F). לאחר ש-NOA 81 מקושר ותבניות ה-PDMS מוסרות מההרכבה(איור 1K),הערוץ הנוזלי ממוקם בשכבה התחתונה של השבב ויציאות ערוץ החלבון והמפרצון/מוצא ממוקמות בשתי השכבות. איור 1L מדגים סכמטי תצוגה צדדית של שבב הדיאליזה שבו כל שכבות המכשיר ועובין בהתאמה מסומנים. גובה התבניות המוטבעות בשכבה התחתונה של השבבים (ערוץ נוזלי) הוא כ 45 מיקרומטר, בעוד הגובה הכולל של יציאות כניסת ושקע הוא כ 90 מיקרומטר. מאגר החלבון (גובה 45 מיקרומטר) מאויר גם באיור 2D ו-2E. היישור של שתי השכבות נחקר תחת מיקרוסקופ אופטי ואת פיסת קרום הדיאליזה RC משולב בתוך השבב ניתן להבחין בבירור באיור 2D. באותה דמות, האוויר נלכד בתוך הערוץ הנוזלי במהלך הזרקת פתרון ההתגבשות, כפי שניתן לראות בחלק השמאלי העליון של מאגר החלבון. איור 2E הוא תצלום תקריב של מאגר החלבון לאחר התצהיר הידני של טיפת החלבון עם פיפטה ולפני אנקפסולציה של הטיפה עם פיסת סרט PMMA וקפיטון, כמתואר בשלבים 5.2 ו -5.3 של הפרוטוקול. השבב המיקרופלואידי המוכן לשימוש לניסויי התגבשות, לאחר אנקפסולציה של דגימת החלבון והדבקת המחברים הנוזליים, מתואר באיור 2C. ההרכבה ההדוקה מבטיחה שלא תתרחש דליפות. המחברים הנוזליים עבור יציאות ה-inlet והשקע של הערוץ המיקרופלואידי יכולים להיות המחברים הזמינים מסחרית כמתואר בשלב 4.1 של הפרוטוקול ומוצגים באיור 2C, או טיפים חד פעמיים לפיפטות מעבדה לאותה מטרה (איור 2B, פרוטוקול שלב 4.4).
לייצור שבבים מיקרופלואידיים, נבחרו חומרים שקופים אופטיים ולא פעילים ביולוגית, המדגימים תאימות גבוהה לניסויי עקיפת קרני רנטגן במקום בטמפרטורת החדר. האינטראקציות של צילומי רנטגן, ספיגה ופיזור, עם החומרים המרכיבים את המכשיר המיקרופלואידי ואת האטמוספירה שמסביב (אוויר) ליצור אות המכונה רעש רקע. רעש זה מסכם את אות עקיפת גבישי החלבון שנרשמו על ידי הגלאי, מפורר את יחס האות לרעש ויש לשמור עליו נמוך ככל האפשר במהלך איסוף נתוני עקיפת קרני רנטגן. הערכנו את רעשי הרקע הנוצרים על ידי החומרים המרכיבים את מאגר החלבון, שנמצא בנתיב הישיר של קרן הרנטגן. מאגר החלבון מורכב מממברנה דיאליזה RC, קלטת Kapton ושתי חתיכות PMMA, אחד משמש מצע עבור שבב ואחד המשמש אנקפסולציה של דגימת החלבון. עובי PMMA הוא 2 x 175 מיקרומטר, של קלטת קאפטון 20 מיקרומטר, וקרום הדיאליזה של RC הוא בעובי של כ-40 מיקרומטר(איור 1L). העובי הכולל של שכבות אלה הוא כ 410 מיקרומטר ואת שכבת NOA 81 אינו בנתיב רנטגן ישיר. מלבד עובי חומרי הייצור, צפיפותם חיונית גם למדידת רעשי פיזור הרקע, שכן פיזור קרני רנטגן גדל עם המספר האטומי הבסיסי. מסיבה זו, שטף הליום (תכונה שסופקה ב BM30A-FIP ב ESRF) שימש במקום אוויר במהלך איסוף הנתונים עבור אפיון חומרים עבור ניסויים עקיפת חלבון. איור 3C ממחיש את רעשי הרקע שנוצרו על ידי קלטת קאפטון, קרום הדיאליזה של RC, גיליון PMMA וההרכבה שלהם באטמוספרת הליום. כל חומר נחשף במשך 20 שניות לצילומי רנטגן של 0.98 Å אורך הגל ואת המרחק מדגם גלאי היה 200 מ"מ. הניסויים בוצעו בקו הקורה BM30A-FIP ב- ESRF, כפי שהוסבר בשלב 7 של הפרוטוקול. טבעות מפוזרות המיוחסות לאינטראקציות של קרן הרנטגן עם החומרים ניתן להבחין עבור קלטת Kapton ברזולוציה נמוכה מ 4 Å, גיליון PMMA בין 4-8 Å, ואת קרום הדיאליזה בין 4-5 Å ברזולוציה. רעש הרקע שנוצר על ידי שבב הדיאליזה נצפה בעיקר ברזולוציה נמוכה מ 6 Å שאינו משפיע על הטיפול בנתוני עקיפה ברזולוציה גבוהה של גבישי lysozyme גדולים. עוצמת פיזור הרקע כפונקציה של הרזולוציה עבור השבב והחומרים הנפרדים מוצגים במקום אחר19. במדידה שהוצגה באיור 3C, שבב הדיאליזה היה ריק מכל פתרון (חלבון או פתרון משקעים) ותרומת הנוכחות של הפתרון לרעשי הרקע לא נמדדה. השבבים הורכבו מול קרן הרנטגן עם תמיכה בהדפסת תלת מימד(איור 3B) המיועדת בניסויי עקיפה19. עם זאת, אותה תמיכה בממדים השווים לממדים של צלחת התגבשות סטנדרטית של 96 באר/SBS, יכולה לשמש לביצוע 1 עד 3 ניסויי התגבשות בו זמנית, שכן היא יכולה להכיל עד 3 שבבים בו זמנית (איור 3A).
ניסויים נערכו כדי להעריך את היעילות של התקנים microfluidic עבור התגבשות על השבב של חלבונים מסיסים מודל בשיטת microdialysis. הערוץ הנוזלי מולא כמתואר בשלב 4 של הפרוטוקול, ואילו שלבים 5 ו-6 תיארו כיצד לתמצת את דגימת החלבון במאגר החלבון הייעודי וכיצד להקים את ניסויי ההתגבשות. איור 4 מראה גבישי ליזוזים הגדלים ב-293 K תחת נתרן כלורי (NaCl) ב-1.5 מ' נתרן כלורי (NaCl) עם 0.1 מ' נתרן אצטט (CH3COONa) pH 4.0 (A)ותחת 1 M NaCl, 0.1 M CH3COONa pH 4.5 עם 30% פוליאתילן גליקול (PEG) 400 (B). אבקת lysozyme lyophilized מומס במים לריכוז הסופי של ~ 30 מ"ג מ"ל-1 או ב 20 מ"מ CH3COONa pH 4.2 חיץ לריכוז הסופי של ~ 20 מ"גמ"ל -1 עבור הניסויים מאוירים איורים 4A ו 4B, בהתאמה. נפח דגימת החלבון בשני הניסויים היה כ 0.3 μL ואת MWCO של קרום דיאליזה RC מוטבע בתוך השבבים טמון בטווח של 6-8 kDa. גבישי הליזוזים המוצגים באיור 3A גדלו תוך שעה והקריסטלים באיור 3B גדלו תוך 30 דקות מתחילת הניסוי. ניסויי ההתגבשות בוצעו בתנאים סטטיים. עם זאת, הוכח19 כי ביצוע הניסויים בתנאים זורמים מספק את האפשרות להחליף באופן דינמי את תנאי התגבשות ודיאגרמות שלב המחקר, אימות ההפיכה של שיטת המיקרו-דיאליזה.
במקום נתוני עקיפת קרני רנטגן מגבישי הליזוזים המוצגים באיור 4A נאספו כדי להדגים את התאמת שבבי הדיאליזה לניסויים כאלה. איסוף הנתונים בוצע בקו קרן BM30A-FIP (ESRF) בטמפרטורת החדר, כמתואר בשלב 7.2.1 של הפרוטוקול. השבבים הורכבו על קו הקרן בעזרת התמיכה המודפסת בתלת-ממד (איור 3B) וערכות נתונים מלאות של עקיפת קרני רנטגן נאספו משני גבישי lysozyme יחידים שגודלו על השבב בתנאים שניתנו בשורה השנייה של טבלה 1. ההשתקפויות שנצפו של ערכות הנתונים עובדו, נכללו באינדקס ושולבו באמצעות XDS48 והתחליף המולקולרי והעידון הושגו באמצעות Phaser49 ו- Phenix52, בהתאמה. הסטטיסטיקה הקריסטלוגרפית עבור ערכת הנתונים המלאה של כל גביש lysozyme ועבור המיזוג של שתי ערכות הנתונים מסופקים בטבלה 2. להחלפה מולקולרית, ערך PDB 193L שימש.
מפות צפיפות אלקטרונים מקריסטל lysozyme יחיד ואת ערכת הנתונים הממוזגת של שני גבישים הושגו ב 1.95 Å ו 1.85 Å, בהתאמה, והם מאוירים איורים 5A ו 5B. שתי מפות צפיפות האלקטרונים מראות מידע מבני מפורט שניתן להשיג על ידי ניסויי עקיפת קרני רנטגן situ שנערכו ישירות על שבב הדיאליזה בטמפרטורת החדר מגביש יחיד או מגבישים מרובים, מה שהפך את השבבים תואמים במחקרי קריסטלוגרפיה של קרני רנטגן.
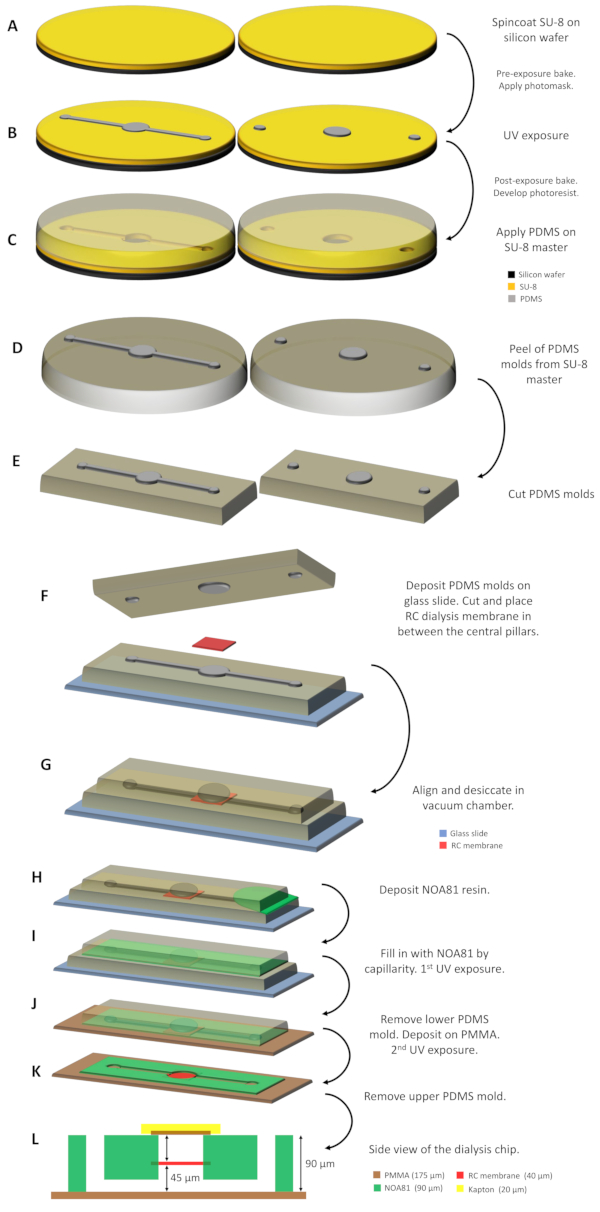
איור 1: איור סכמטי של ייצור שבב הדיאליזה. (A) שרף SU-8 מופקד על שני ופלים סיליקון מצופה ספין. (B)מאסטר SU-8 נרכש לאחר הקרנת הפוטוריסט עם אור UV באמצעות פוטומסק ופיתוח החלקים שלא נחשפו. (C)PDMS מחולק על מאסטרים SU-8 ולאחר שנרפא ב 338 K עבור 1 שעות,(D)2 תבניות PDMS המיוצר על ידי העתק דפוס והטבעת המיקרו-תבניות מקולפים של המאסטרים ו - (E) לחתוך לגודל המתאים. (ו)תבניות PDMS נתמכות על מגלשת זכוכית המשלבת את קרום הדיאליזה של RC בין שני העמודים המרכזיים. (G)2 תבניות PDMS מיושרות ומיובשות במשך ~ 30 דקות בתא ואקום. שרףNOA 81 נשפך בין שתי התבניותו-(I)ממלא את החלל בנימיות. (J)לאחר החשיפה הראשונה לאור UV, תבנית PDMS התחתונה מוסרת וההרכבה מופקדת על גיליון PMMA. (K) החשיפה השנייה UV כדלקמן על מנת ל polymerize מלא את ה-NOA 81 שף ואת שבב הדיאליזה הוא מוכן לשימוש לאחר הסרת עובש PDMS העליון הנותר. (L)סכמטי תצוגה צדדית של שבב הדיאליזה שבו כל השכבות של המכשיר ועובים בהתאמה מסומנים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
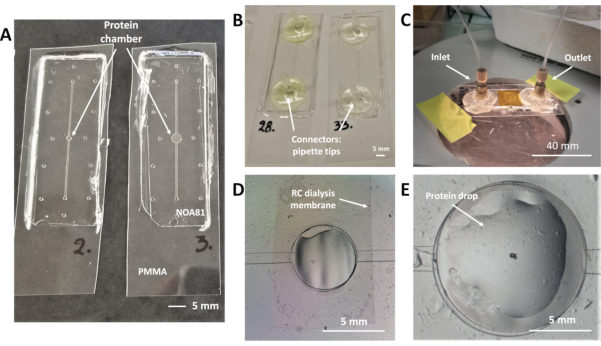
איור 2: שבבי דיאליזה המטביעים קרום דיאליזה של RC לצורך התגבשות חלבונים על-שבב ובניסויי עקיפת קרני רנטגן של situ. (A) NOA 81 שבבים על מצע PMMA בעובי 175 מיקרומטר עם מאגר חלבונים של 0.1 מיקרו-ל( משמאל) ונפח נומינלי של 0.3 מיקרו-ל( μL) (B)שבבים עם קצות פיפטה כמחברים נוזליים מודבקים על יציאות המפרצון והשקע של הערוץ הנוזלי. (C) תמונה של שבב זעיר במהלך ניסוי התגבשות. דגימת החלבון עטופה בחתיכה של גיליון PMMA בעובי 175 מיקרומטר וסרט קפטון. מחברי מבט מהיר Nanoport משמשים עבור יציאות כניסת ושקע של הערוץ הנוזלי. (D) תצוגה עליונה של מאגר החלבון במהלך זרימת פתרון ההתגבשות בתוך הערוץ הנוזלי. האוויר לכוד בחלק העליון של המאגר ממש מתחת לקרום הדיאליזה של RC, אשר ניתן לזהות בבירור. (ה)מבט עליון על מאגר הדיאליזה באמצעות מיקרוסקופ אופטי במהלך התצהיר של דגימת החלבון. טיפת החלבון מופקדת ממש מעל קרום הדיאליזה המוטבע של RC. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: התמיכה המודפסת בתלת-ממד (A) עבור השבבים המשמשים במהלך ניסויי התגבשות ו- (B) המותקנים מול קרן הרנטגן ב- BM30A-FIP ב- ESRF לניסויי עקיפת קרני רנטגן. (C) רעשי רקע הנוצרים על ידי אינטראקציה של צילומי רנטגן עם קפטון, קרום דיאליזה RC, PMMA, ואת שבב הדיאליזה (משמאל לימין). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
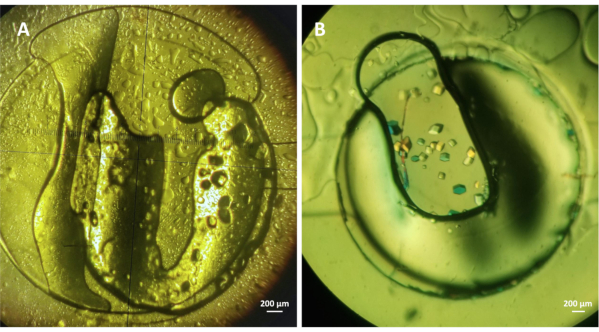
איור 4: התגבשות על השבב של lysozyme בשיטת המיקרו-דיאליזה. (A) Lysozyme (~ 30 מ"ג מ"ל-1)גבישים גדל על שבב תחת 1.5 M NaCl ו 0.1 M CH3COONa pH 4.0 ו (B) lysozyme (~ 20 מ"ג מ"ל-1) גבישים גדל בתנאי התגבשות המכילים 1 M NaCl, 0.1 M CH3COONa pH 4.5, ו-30% PEG 400. שני הניסויים נערכו ב 293 K. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: מפות צפיפות אלקטרונים של מבנה הליזוזים המעודן מ-(A) גביש יחיד ו-(B) ערכת הנתונים הממוזגת של שני גבישים הגדלים על שבב באמצעות מיקרו-דיאליזה. המפות התקבלו ב 1.95 Å ו 1.84 Å, בהתאמה, קווי מתאר ב 1μ. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| חלבון | ריכוז חלבונים (מ"ג מ"ל-1) | באפיפר חלבונים | ריכוז ראשוני של פתרון משקעים | MWCO של RC קרום דיאליזה (kDa) אני לא יכול לעשות את זה. | טמפרטורה (ק) אני לא יכול לעשות את זה. | ||
| ליזוזים (Lysozyme) | ~ 30 | מים | 1.5 M NaCl 0.1 M CH3COONa pH 4.0 | 6 - 8 | 293 | ||
| ליזוזים (Lysozyme) | ~ 20 | 20 מ"מ CH3COONa pH 4.2 | 1 M NaCl 0.1 M CH3COONa pH 4.5 30% PEG 400 | 6 - 8 | 293 | ||
טבלה 1: הרכב מאגר החלבון ותמיסת המשקעים להתגבשות על השבב של lysozyme בשיטת המיקרו-דיאליזה. גבישי lysozyme גדל על שבב עם התנאים שסופקו בשורה השנייה שימשו באיסוף נתונים עקיפת רנטגן situ.
| חלבון | ליזוזים (Lysozyme) | ליזוזים (Lysozyme) | ליזוזים (Lysozyme) |
| מספר גבישים | 1 | 1 | 2 |
| מספר מסגרות עקיפה | 40 | 30 | 70 |
| תנודה (°) לכל חשיפה | 1 | 1 | |
| זמן חשיפה (ים) | 30 | 30 | |
| טמפרטורה (K) | 293 | 293 | 293 |
| קבוצת חלל | P43212 | P43212 | P43212 |
| פרמטרי תא יחידה | 78.86 78.86 37.87 90.0 90.0 90.0 | 79.17 79.17 37.95 90.0 90.0 90.0 | 78.47 78.47 37.65 90.0 90.0 90.0 |
| טווח רזולוציה (Å) | 27.31 - 1.95 (2.02 - 1.95) | 27.39 - 1.96 (2.03 - 1.96) | 27.17 - 1.85 (1.91 - 1.85) |
| פסיפס (°) | 0.319 | 0.121 | |
| סה"כ השתקפויות (נצפו) | 25127 (3552) | 19991 (3001) | |
| השתקפויות ייחודיות (נצפו) | 8641 (1357) | 8295 (1321) | 10404 (975) |
| רדודנטיות | 2.90 (2.61) | 2.41 (2.27) | |
| שלמות (%) | 95.0 (94.8) | 91.9 (93.3) | 98.23 (93.15) |
| כלומר I/σ | 6.83 (1.16) | 7.09 (1.66) | 3.7 |
| עותק(1/2) | 99.1 (42.4) | 97.9 (37.0) | 97.0 |
| מיזוג R | 0.184 | ||
| אר-מס | 0.139 | 0.221 | 0.219 |
| ר-פים | 0.116 | ||
| השתקפויות המשמשות בעידון | 8645 (787) | 8451 (857) | 10391 (965) |
| השתקפויות המשמשות ללא R | 864 (78) | 846 (85) | 1039 (96) |
| R-עבודה | 0.1988 (0.2968) | 0.1853 (0.2872) | 0.1839 (0.3102) |
| ללא R | 0.2430 (0.3437) | 0.2297 (0.3622) | 0.2207 (0.3703) |
| מספר האטומים שאינם מימן | 1069 | 1071 | 1096 |
| מקרומולקולות | 1012 | 1012 | 1012 |
| מים | 55 | 57 | 82 |
| חיבור אותיות | 2 | 2 | 2 |
| שאריות חלבון | 131 | 131 | 131 |
| Rms (איגרות חוב, א)) | 0.008 | 0.009 | 0.005 |
| Rms (זוויות, °) | 1.17 | 1.26 | 1.05 |
| ראמצ'נדרן העדיף (%) | 98.43 | 97.64 | 99.21 |
| ראמצ'נדראן מותר (%) | 1.57 | 2.36 | 0.79 |
| חריגים של רמאצ'נדראן (%) | 0.00 | 0.00 | 0.00 |
| אווגאר בי פקטור | 34.26 | 28.54 | 24.34 |
| חלבון | 33.94 | 28.14 | 23.62 |
| מים | 40.23 | 35.57 | 33.16 |
| ליגנדים | 33.23 | 29.63 | 24.77 |
טבלה 2: פרמטרים של איסוף נתונים, סטטיסטיקות קריסטלוגרפיות ועידון של גבישי lysozyme הגדלים על שבב באמצעות שיטת המיקרו-דיאליזה. הערכים המסופקים בסוגריים תואמים למעטפת ברזולוציה הגבוהה ביותר. העמודה הרביעית תואמת לערכים שהושגו לאחר מיזוג ערכות הנתונים של העמודה השניה והשלישית.
Discussion
מכשיר מיקרופלואידי פותח להתגבשות חלבונים על שבב בשיטת המיקרו-דיאליזה ובניסויי עקיפת קרני רנטגן במקום בטמפרטורת החדר. שבבי NOA 81 המשלבים ממברנות דיאליזה של RC של כל MWCO על מנת להשתמש במיקרו-דיאליזה להתגבשות חלבונים על השבב יכולים להיות מפוברקים. נעשה שימוש בחומרי ייצור בעלי שקיפות גבוהה יחסית של קרני רנטגן, מה שהפך את השבבים לתואמים לקריסטלוגרפיה של חלבון situ. חומרי הייצור המרכיבים את התא להתגבשות חלבונים של המכשיר (PMMA, Kapton, קרום דיאליזה RC) הוערכו כדי ליצור רעשי רקע נמוכים. באופן ספציפי, רעש הרקע שנוצר על ידי שבב הדיאליזה נצפתה בעיקר ברזולוציה נמוכה (> 6 Å) ואינה משפיעה על הטיפול בנתוני עקיפה ברזולוציה גבוהה של גבישי lysozyme הגדולים הנדרשים לקביעת מבנה החלבון. האוטומציה של איסוף הנתונים מוגברת באמצעות תמיכה מודפסת בתלת-ממד שניתן להתקין ישירות בקרני קריסטלוגרפיה מקרומולקולרית ולשאת עד שלושה שבבים בו-זמנית. בדרך זו, קציר ידני ומניפולציה של גבישי חלבון שביר נמנע. יתר על כן, איסוף הנתונים מתרחש בטמפרטורת החדר, הימנעות הצורך cryoprotection אשר יכול להיות קשור לשינויים קונפורמיים ממבנה החלבון המקומי2,3.
השימוש במיקרו-דיאליזה כשיטה לגידול גבישים על השבב מאפשר לנטר ולשלוט במדויק בתהליך ההתגבשות. כפי שנדון בהקדמה, רוב שיטות התגבשות החלבון הקונבנציונליות יושמו באמצעות מכשירים מיקרופלואידיים11,14. עם זאת, היתרונות של דיאליזה להתגבשות חלבון עדיין לא נוצלו במלואם במיקרומטרי. מיקרודיאליזה על השבב מספקת את האפשרות ללמוד דיאגרמות שלב ולבצע סינון ואופטימיזציה של תנאי התגבשות עם אותה דגימת חלבון19. עבור אבות הטיפוס המוצגים בעבודה זו, צריכת החלבון לכל שבב מוגבלת עד 0.1 או 0.3 μL. בהתבסס על העבודה הניסיונית עד כה, השלבים הקריטיים ביותר של הפרוטוקול אינם נובעים מהליך הייצור של השבבים אלא מתהליך ההתגבשות. פרוטוקול הייצור כולל שלבים רבים אך הוא פשוט ומאפשר ייצור של מכשירים רבים (20 עד 30 שבבים) ביום אחד בחדר הנקי, עם חומרים זולים יחסית. עם זאת, התגבשות על השבב של חלבונים יכולה להיות הליך עדין בשל האופי הסטוקסטי המהותי של התגרענות וצמיחת הגביש, במיוחד במיקרומטרי. מקרה מבחן תואר, שבו תנאים מבוססים שימשו להתגבשות של lysozyme שהניב חזק, גבישים מוגדרים היטב מתאים באיסוף נתונים עקיפת רנטגן situ. עם זאת, קשיים עשויים להתעורר על ידי שימוש ביעדי חלבון מאתגרים יותר, כגון חלבוני ממברנה, שבהם מדיום ההתגבשות הרבה יותר מסובך, דיאגרמות פאזה אינן ידועות ותנאי התגבשות עובדים היטב עדיין אינם מבוססים היטב. שבב הדיאליזה מציע את האפשרות להתעלות על קשיים אלה וללמוד דיאגרמות שלב על השבב, מבלי להיפטר מדגם החלבון היקר ולעתים קרובות יקר, על ידי החלפת פתרון התגבשות בתוך הערוץ microfluidic.
הרבגוניות של המכשירים המיקרופלואידיים נובעת מניצול מיקרו-דיאליזה להתגבשות חלבונים על-שבב כדי לשלוט באופן הפיך בתנאי התגבשות ולמפות דיאגרמות שלב מגוונות של ריכוז וטמפרטורה באמצעות נפח חלבון נמוך. יתר על כן, המכשיר תואם בניסויים עקיפת רנטגן situ ואת אב טיפוס של המכשירים הוא זול ומהיר. ניתן לגדל על השבב גבישים איסומורפיים רבים של חלבונים מסיסים וממברנה (כהכנה) וצפויים להשתמש בכל התכונות הללו למחקרי קריסטלוגרפיה סדרתיים של קרני רנטגן של מטרות חלבון מאתגרות במתקני סינכרוטרון ו- XFEL. לבסוף, ביצוע על שבב ובמחקרים שנפתרו בזמן situ היא אפשרות עתידית שיכולה להיות עניין משמעותי לקהילה הקריסטלוגרפית. לכן, על ידי גידול גבישים על שבב הדיאליזה והכנסת ריאגנטים לתוך הערוץ המיקרופלואידי, או באופן ידני (באמצעות מזרק) או באופן אוטומטי (עם מערכת נוזל בקרת לחץ או משאבת מזרק), המאמצים העתידיים יתמקדו להוכיח כי השבבים microfluidic ניתן להשתמש בהצלחה כדי להפעיל ניסויים שנפתרו בזמן על קרני synchrotron.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
MBS מכיר בתמיכת ה-MI / CNRS במסגרת ההתקשרות מכשור במגבלות 2014-2015. ניו ג'רזי מכירה בתוכנית הבינלאומית לחקר הדוקטורט (Irtelis) של CEA עבור מלגת הדוקטורט. MBS ו-SJ מאשרים מימון מתוכנית המחקר והחדשנות Horizon 2020 של האיחוד האירופי במסגרת הסכם המענק מארי סקלודובסקי-קירי מספר 722687. MBS, SJ ו- NJ מודים ל- LIPhy (UGA) על הקמת החדר הנקי לניסויים במיקרו-פשיון. IBS מכיר בהשתלבות במכון המחקר הבינתחומי של גרנובל (IRIG, CEA).
Materials
| Name | Company | Catalog Number | Comments |
| 3 in wafer | Silicon Materials Inc. | Silicon wafer | |
| Centrifuge | Eppendorf | Minispin | Bench-top centrifuge |
| CleWin 3.0 | WieWeb software | Designing software | |
| Epoxy glue | Devcon | 5 minutes epoxy glue | |
| Fluidic connectors | Cluzeau Info Lab | N-333 | NanoPort kit for 1/16" OD tubing |
| Hen egg-white lysozyme | Roche | 10 837 059 001 | Lyophilized protein powder |
| High-vacuum silicone grease | Sigma-Aldrich | Z273554 | Dow Corning high-vacuum silicone grease |
| HMDS | Sigma-Aldrich | 440191 | Silane, chemical |
| Hot plate | Sawatec | HP-200-Z-HMDS BM | Hot plate |
| Isopropyl alcohol | Sigma-Aldrich | Solvent | |
| Kapton tape | DuPont | Polyimide tape | |
| Mask aligner | SUSS MicroTec | MJB4 | Mask aligner, UV source |
| Membrane filter | Millipore | GSWP04700 | 0.22 μm pore size filter |
| Microscope glass slide | Fisher Scientific | 12164682 | 3 x 1 in glass slides |
| NOA81 | Norland Products Inc. | NOA81 | Photocurable resin |
| Oven | Memmert | Oven | |
| Parafilm | Sigma-Aldrich | P6543 | Parafilm M roll size 20 in. × 50 ft |
| PDMS | Dow Corning | Sylgard 184 | Silicone |
| PEG 400 | Hampton Research | HR2-603 | Chemical |
| Petri dish | Sigma-Aldrich | P5731 | 100 x 15 mm |
| PGMEA | Sigma-Aldrich | 484431 | Developer |
| Plasma equipment | Diener Electronic | ZEPTO | Plasma treatment |
| PMMA | Goodfellow | 137-745-63 | PMMA sheets 150x150 mm, 0.175 mm thickness |
| Pressure driven system | Elveflow | OB1 MK3+ | Pressure/vacuum controller |
| PTFE tubing | Elveflow/Darwin microfluidics | LVF-KTU-15 | PTFE tubing roll 1/16" OD X 1/32" ID |
| RC dialysis membrane | Spectra/Por | Various MWCOs | |
| Scalpel | Swann-Morton | Carbon steel surgical blades | |
| Sodium acetate | Sigma-Aldrich | S2889 | Chemical |
| Sodium chloride | Sigma-Aldrich | 746398 | Chemical |
| Solidworks | Dassault Systemes | 3D-CAD designing software | |
| Spin coater | SPS | Spin150 | Wafer spinner |
| SU-8 3000 series | MicroChem Corp. | SU-8 3050 | Photoresist |
| Syringe | BD | 309628 | 1 mL Luer-Lok syringe |
| UV crosslinker | Uvitec | CL-508 | UV crosslinker |
References
- Garman, E. F. Radiation damage in macromolecular crystallography: what is it and why should we care. Acta Crystallographica, Section D: Biological Crystallography. 66, 339-351 (2010).
- Henderson, R. The potential and limitations of neutrons, electrons and X-rays for atomic resolution microscopy of unstained biological molecules. Quarterly Reviews of Biophysics. 28 (2), 171-193 (1995).
- Fraser, J. S., et al. Accessing protein conformational ensembles using room-temperature X-ray crystallography. Proceedings of the National Academy of Sciences of the United States of America. 108 (39), 16247-16252 (2011).
- Gotthard, G., et al. Specific radiation damage is a lesser concern at room temperature. IUCrJ. 6 (4), 665-680 (2019).
- Martin-Garcia, J. M., Conrad, C. E., Coe, J., Roy-Chowdhury, S., Fromme, P. Serial femtosecond crystallography: A revolution in structural biology. Archives of Biochemistry and Biophysics. 602, 32-47 (2016).
- Gicquel, Y., et al. Microfluidic chips for in situ crystal X-ray diffraction and in situ dynamic light scattering for serial crystallography. Journal of Visualized Experiments: JoVE. (134), e57133 (2018).
- Chapman, H. N., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470, 73-78 (2011).
- Hunter, M. S., et al. Fixed-target protein serial microcrystallography with an x-ray free electron laser. Science Reports. 4, 6026 (2014).
- Pawate, A. S., et al. Towards time-resolved serial crystallography in a microfluidic device. Acta Crystallographica, Section F: Structural Biology Communications. 71, 823-830 (2015).
- Owen, R. L., et al. Low-dose fixed-target serial synchrotron crystallography. Acta Crystallographica, Section D: Structural Biology. 73, 373-378 (2017).
- Leng, J., Salmon, J. -. B. Microfluidic crystallization. Lab on a Chip. 9, 24-34 (2009).
- Morel, M., Galas, J. -. C., Dahan, M., Studer, V. Concentration landscape generators for shear free dynamic chemical stimulation. Lab on a Chip. 12, 1340-1346 (2012).
- Miralles, V., Huerre, A., Malloggi, F., Jullien, M. -. C. A review of heating and temperature control in microfluidic systems: techniques and applications. Diagnostics. 3, 33-67 (2013).
- Sui, S., Perry, S. L. Microfluidics: from crystallization to serial time-resolved crystallography. Structural Dynamics. 4, 032202 (2017).
- Hansen, C. L., Sommer, M. O. A., Quake, S. R. Systematic investigation of protein phase behavior with a microfluidic formulator. Proceedings of the National Academy of Sciences of the United States of America. 101 (40), 14431-14436 (2004).
- Laval, P., Lisai, N., Salmon, J. -. B., Joanicot, M. A microfluidic device based on droplet storage for screening solubility diagrams. Lab on a Chip. 7, 829-834 (2007).
- Shim, J. -. U., et al. Control and measurement of the phase behavior of aqueous solutions using microfluidics. Journal of the American Chemical Society. 129, 8825-8835 (2007).
- Selimovic, S., Gobeaux, F., Fraden, S. Mapping and manipulating temperature-concentration phase diagrams using microfluidics. Lab on a Chip. 10, 1696-1699 (2010).
- Junius, N., et al. A microfluidic device for both on-chip dialysis protein crystallization and in situ X-ray diffraction. Lab on a Chip. 20, 296-310 (2020).
- Greaves, E. D., Manz, A. Towards on-chip X-ray analysis. Lab on a Chip. 5, 382-391 (2005).
- Dhouib, K., et al. Microfluidic chips for the crystallization of biomacromolecules by counter-diffusion and on-chip crystal X-ray analysis. Lab on a Chip. 9, 1412-1421 (2009).
- Guha, S., Perry, S. L., Pawate, A. S., Kenis, P. J. A. Fabrication of X-ray compatible microfluidic platforms for protein crystallization. Sensors and Actuators B. Chemical. 174, 1-9 (2012).
- Sui, S., et al. Graphene-based microfluidics for serial crystallography. Lab on a Chip. 16, 3082-3096 (2016).
- Russo Krauss, I., Merlino, A., Vergara, A., Sica, F. An overview of biological macromolecule crystallization. International Journal of Molecular Science. 14, 11643-11691 (2013).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica, Section F: Structural Biology and Crystallization Communications. 70, 2-20 (2014).
- Zheng, B., Tice, J. D., Roach, L. S., Ismagilov, R. F. A droplet-based, composite PDMS/Glass capillary microfluidic system for evaluating protein crystallization conditions by microbatch and vapor-diffusion methods with on-chip X-ray diffraction. Angewandte Chemie. 43, 2508-2511 (2004).
- Talreja, S., Kim, D. Y., Mirarefi, A. Y., Zukoski, C. F., Kenis, P. J. A. Screening and optimization of protein crystallization conditions through gradual evaporation using anovel crystallization platform. Journal of Applied Crystallography. 38, 988-995 (2005).
- Hansen, C. L., Classen, S., Berger, J. M., Quake, S. R. A microfluidic device for kinetic optimization of protein crystallization and in situ structure determination. Journal of American Chemical Society. 128, 3142-3143 (2006).
- Schieferstein, J. M., et al. X-ray Transparent microfluidic platforms for membrane protein crystallization with microseeds. Lab on a Chip. 18, 944-954 (2018).
- Ghazal, A., et al. Recent advances in X-ray compatible microfluidics for applications in soft materials and life sciences. Lab on a Chip. 16, 4263-4295 (2016).
- Li, L., Ismagilov, R. F. Protein crystallization using microfluidic technologies based on valves, droplets, and SlipChip. Annual Review of Biophysics. 39, 139-158 (2010).
- Du, W., Li, L., Nichols, K. P., Ismagilov, R. F. SlipChip. Lab on a Chip. 9, 2286-2292 (2009).
- Zhang, S., et al. Microfluidic platform for optimization of crystallization conditions. Journal of Crystal Growth. 472, 18-28 (2017).
- Abdallah, B. G., et al. Protein crystallization in an actuated microfluidic nanowell device. Crystal Growth & Design. 16, 2074-2082 (2016).
- Monteiro, D. C. F., et al. A microfluidic flow-focusing device for low sample consumption serial synchrotron crystallography experiments in liquid flow. Journal of Synchrotron Radiation. 26, 406-412 (2019).
- de Wijn, R., et al. A simple and versatile microfluidic device for efficient biomacromolecule crystallization and structural analysis by serial crystallography. IUCrJ. 6, 454-464 (2019).
- Shim, J. -. U., Cristobal, G., Link, D. R., Thorsen, T., Fraden, S. Using microfluidics to decouple nucleation and growth of protein crystals. Crystal Growth & Design. 7, 2192-2194 (2007).
- de Jong, J., Lammertink, R. G. H., Wessling, M. Membranes and microfluidics: a review. Lab on a Chip. 6, 1125-1139 (2006).
- Paustian, J. S., Nery Azevedo, R., Lundin, S. T. B., Gilkey, M. J., Squires, T. M. Microfluidic microdialysis: spatiotemporal control over solution microenvironments using integrated hydrogel membrane microwindows. Physical Review X. 3, 041010 (2013).
- Kornreich, M., Heymann, M., Fraden, S., Beck, R. Cross polarization compatible dialysis chip. Lab on a Chip. 14, 3700-3704 (2014).
- Song, S., Singh, A. K., Shepodd, T. J., Kirby, B. J. Microchip dialysis of proteins using in situ photopatterned nanoporous polymer membranes. Analytical Chemistry. 76, 2367-2373 (2004).
- Skou, M., Skou, S., Jensen, T. G., Vestergaard, B., Gillilan, R. E. In situ microfluidic dialysis for biological small-angle X-ray scattering. Journal of Applied Crystallography. 47, 1355-1366 (2014).
- Zou, L., et al. A multistage dialysis microdevice for extraction of cryoprotectants. Biomedical Microdevices. 19, 30 (2017).
- Satya Eswari, J., Naik, S. A critical analysis on various technologies and functionalized materials for manufacturing dialysis membranes. Materials Science for Energy Technologies. 3, 116-126 (2020).
- Spano, M., Salmon, J. -. B., Junius, N. FR3044685A1. UJF. , (2015).
- Bartolo, D., Degre, G., Nghe, P., Studer, V. Microfluidic stickers. Lab on a Chip. 8, 274-279 (2008).
- Junius, N., et al. A crystallization apparatus for temperature controlled flow-cell dialysis with real-time visualization. Journal of Applied Crystallography. 49, 806-813 (2016).
- Kabsch, W. XDS. Acta Crystallographica, Section D: Biological Crystallography. 66, 125-132 (2010).
- Winn, M. D., et al. Overview of the CCP4 suite and current developments. Acta Crystallographica, Section D: Biological Crystallography. 67, 235-242 (2011).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and developments of COOT. Acta Crystallographica, Section D: Biological Crystallography. 66, 486-501 (2010).
- Apostolopoulou, V., Junius, N., Sear, R. P., Budayova-Spano, M. Mixing salts and polyethylene glycol into protein solutions: The effects of diffusion across semipermeable membranes and of convection. Crystal Growth & Design. 20, 3927-3936 (2020).
- Liebschner, D., et al. Macromolecular structure determination using X-rays, neutrons and electrons: recent developments in Phenix. Acta Crystallographica, Section D: Structural Biology. 75, 861-877 (2019).
- Xia, Y., Whitesides, G. M. Soft Lithography. Annual Review of Materials Science. 28, 153-184 (1998).
- Nogly, P., et al. Lipidic cubic phase injector is a viable crystal delivery system for time-resolved serial crystallography. Nature Communications. 7, 12314 (2016).
- Baxter, E. L., et al. High-density grids for efficient data collection from multiple crystals. Acta Crystallographica, Section D: Structural Biology. 72, 2-11 (2016).
- Feiler, C. G., Wallacher, D., Weiss, M. S. An all-in-one sample holder for macromolecular X-ray crystallography with minimal background scattering. Journal of Visualized Experiments. (149), e59722 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved