Method Article
通过微透析对芯片上的蛋白质进行结晶,用于 原位 X射线衍射研究
摘要
本文详细介绍了采用透析方法和 原位 X射线衍射实验开发用于片上蛋白质结晶的微流体芯片的制造方案。微制造过程使得在芯片的两层之间将半透水再生纤维素透析膜与任何分子量切断相结合成为可能。
摘要
该协议描述了使用透析方法在芯片上结晶蛋白质的可重复和廉价微流体设备的制造,并允许在室温下 进行原位 单晶或串行晶体学实验。该协议详细介绍了微芯片的制造过程、芯片结晶实验的操作以及 现场采集的 X射线衍射数据的处理,以进行蛋白质样本的结构阐明。这种微制过程的主要特点是将商用的半透水再生纤维素透析膜集成在芯片的两层之间。嵌入膜的分子量切口因大分子分子和沉淀物的分子量而异。该设备利用微流体技术的优势,例如使用微量样品(<1μL)和对传输现象进行微调。该芯片将它们与透析方法相结合,对结晶过程提供精确和可逆的控制,可用于微光阶下蛋白质的相位图研究。该装置采用光学可光学硫林基树脂,在光学透明聚合物基板上采用软印纹光刻。此外,还评估了构成微芯片和产生背景噪声的材料的背景散射,使芯片与 原位 X射线衍射实验兼容。一旦蛋白质晶体在芯片上生长到足够的尺寸和种群均匀性,微芯片就可以在3D打印支架的帮助下直接安装在X射线束前。这种方法通过简单和廉价的方式解决在传统蛋白质晶体学实验中使用低温保护剂和人工采集所带来的挑战。在室温下收集了来自多个同位素酶晶体的完整X射线衍射数据集,以进行结构测定。
引言
阐明生物大分子的三维(3D)结构是结构生物学中一个不断的追求,其中X射线晶体学仍然是主要的研究技术。它用于解开复杂的大分子(如蛋白质)的结构细节,其目的是促进对其作用机制及其参与各种生物功能的理解。同步加速器和X射线自由电子激光器(XFELs)中强大的X射线源提供了在接近原子分辨率下更深入地了解蛋白质结构所需的所有工具。尽管使用X射线进行结构研究具有优势,但X射线辐射和结晶过程本身存在内在局限性。高X射线通量引起的辐射损伤和X射线束前蛋白质晶体的长时间暴露时间是晶体学家使用低温冷却1必须超越的限制性参数。然而,找到最佳的低温卵泡条件可能是费力的,因为从本地蛋白质结构或文物的构象变化可以隐藏2,3。此外,最近的研究表明,在室温下进行衍射实验可降低特定辐射损伤4.结构生物学的另一个瓶颈是获得足够大小为5的衍射良好的晶体。小晶体更容易产生,特别是在膜蛋白的情况下,但更容易受到辐射损害,即使在低温条件下,因为高辐射剂量必须定向在较小的体积相比,较大的蛋白质晶体6的情况。串行晶体学7、同步加速器和XFEL的新型方法可以规避辐射损伤的束缚,同时通过合并多个数据集,利用较小的晶体(200纳米至2微米)7,同位素和随机导向的蛋白质晶体,并受益于相关的技术进步,如股秒脉冲,更短的暴露时间和微聚焦X射线束5,7,9,10。
微流体技术对X射线晶体学具有重要价值,对生物大分子的结晶及其结构研究具有多重优势。在微流体装置中进行结晶实验需要少量的蛋白质样品,从而限制这些高价值生物大分子的生产成本,并促进高通量筛选和优化多种结晶条件。此外,微流体尺度和扩散有限传输现象固有的大表面积与体积比能够对流量和温度或浓度梯度进行精细控制,使微流体装置适合生长均匀大小的晶体,并探索相图 15、16、17、18、19。此外,微流体工具显示出独特的潜力,可以解决蛋白质晶体学的另一个障碍,即样品输送,以及在使用蛋白质晶体用于X射线衍射实验之前处理和收获蛋白质晶体的必要性。芯片和原位X 射线晶体学方法消除了晶体操作和数据收集前晶体质量的潜在恶化。许多研究小组针对微生产材料的性质及其与X射线14、19、20、21、22、23的相互作用产生的相关限制,设计、开发和测试了各种适合原位X射线蛋白晶体学的微流体芯片。制造材料必须在光学上透明、生物惰性,并在数据收集过程中表现出高透明度和最佳的信号噪声比。
在传统蛋白质结晶学24、25中应用的大部分结晶方法也已在微流体尺度11、14上用于芯片结晶和原位X射线衍射分析。简单,混合,或多层微流体设备,包括蒸汽扩散26,蒸发27,自由接口扩散(FID)28,微巴奇26,甚至播种29已用于结晶可溶性和膜蛋白。高通量筛选和优化结晶条件可以达到30,31在良好的32,液滴为基础的33,或阀门驱动的34个设备。就地在室温下对具有挑战性的蛋白质靶点进行了X射线衍射实验,这些实验是在由各种材料制成的微芯片中进行的,如PTMS(聚二甲基硅氧烷)、COC(环丙烯烃共聚物)、PMMA(聚(甲基甲基丙烯酸酯)21),22,26,28,29,石墨烯薄膜23,卡普顿35,环氧胶6,或 NOA (诺兰光学胶粘剂)19和材料的透明度 X 射线辐射及其对背景噪音的贡献已评估。此外,微芯片已被设计成耦合原位和串行数据收集策略在一个单一工具的X射线蛋白晶体学实验同步加速器源23,35,36和XFELs 7。
在各种递送方法和设备中也实现了原位 数据收集室温。例如,Nogly 等人54 使用脂质立方相 (LCP) 喷油器,使用 XFEL 源通过串行 femto 秒晶体学 (SFX) 研究光驱动光子泵细菌多普辛 (bR) 的结构。bR 的晶体结构被解析为 2.3 é 分辨率,表明 LCP 喷油器与时间解析的连续 femto 秒晶体学 (TR-SFX) 的兼容性。Baxter等人设计了 一个高密度多晶网格,由100或200μm厚的聚碳酸酯塑料制成,具有不同尺寸的激光切割孔。使用设备进行坐式或悬挂式结晶实验时,可将另外一层 5μm 厚的聚碳酸酯薄膜固定在网格的一侧。这种高密度网格可以以多种方式使用,因为晶体可以直接加载到设备的端口上,或者晶体可以通过蒸汽扩散或 LCP 方法在设备上生长。此外,网格可在标准磁基中进行调整,用于在低温或室温条件下 进行现场 X 射线数据收集。最近,Feiler等人研制出 一种在低温和环境温度下 进行原位X射线晶体学大分子成像的样品架,其背景噪声贡献最小。具体来说,支架由塑料支架、透明 COC 箔和微孔结构聚酰胺箔组成。它旨在取代常用的盖滑梯,用于设置结晶滴,同时允许就地操作,如配体浸泡、复杂形成和低温保护,而无需打开结晶滴或手动处理晶体。此外,样品持有人可以从结晶板中取出,并放置在磁基上,以标准的测距仪光束线 进行现场 数据收集。对于环境温度数据收集,COC 箔在实验前被移除,只有 21μm 厚的聚酰胺箔有助于背景散射,在这种情况下,背景散射是最小的。这些例子只占正在进行的研究的一小部分,以及为X射线蛋白晶体学开发的多种多功能微芯片。
然而,透析蛋白结晶法尚未广泛纳入微流体。透析是一种基于扩散的方法,旨在通过半透膜平衡沉淀物浓度,以接近蛋白质结晶的名义浓度,并能够精确和可逆地控制结晶条件24。半透析膜的分子量截止(MWCO)可以根据大分子的分子量和沉淀剂来选择,以便小沉淀分子的扩散,同时保持兴趣的大分子。由于透析过程的可逆性,它可以与温度控制相结合,分离和优化核和晶体生长独立37用于研究相位图,改变沉淀物浓度,同时使用相同的蛋白质样本。德容等人对微流体膜的整合进行了审查,将透析植入微芯片的生物学案例研究可主要列在样品制备、浓度或过滤应用39、40、41、42或细胞相关研究43、44中。Shim等人利用PDMS的渗透来研究各种条件下的西拉纳酶的核化和生长。水通过15微米厚的PDMS膜渗透到微流体装置的蛋白质储层中,随后改变蛋白质和沉淀物浓度。
提出了由Junius等人开发的方案,用于制造一种微流体芯片,通过微透析和室温下的原位X射线衍射实验,实现芯片蛋白结晶的兼容。设备制造的协议直接灵感来自 Studer 和同事12、46为光固化硫乙烯树脂 NOA 81 的微图案贴纸完成的开创性工作,这些贴纸使用软印记光刻嵌入市售膜。该方法的创新修改使微芯片能够利用微透析准确监测和控制蛋白质晶体片上生长的实验参数,同时利用微流体的优势,例如减少每个实验的蛋白质样本消耗(<1μL)。在之前的工作中,透析原理应用于宏观尺度系统(典型体积>20μL),通过映射温度沉淀浓度相图来筛选和优化结晶条件。在这项工作中,描述了一个协议,用于生产透析微芯片,结合不同MWCO的再生纤维素(RC)透析膜,以便在芯片上和原位进行结晶测定X射线衍射数据收集。包括微芯片的材料已评估其透明度X射线19和设备可以直接设置在X射线束前的空间温度原位衍射实验,不包括手动处理和尽量减少易碎蛋白质晶体的降解。在一项案例研究中,母鸡蛋清溶酶晶体通过微透析在片上生长,产生一个大小均匀的人口。微芯片随后安装在X射线束前,配备3D打印支持19,并在室温下从多个同位晶体中收集完整的原位衍射数据集,展示了用于具有挑战性的宏分子目标的同步加速器串行晶体学研究芯片的高潜力和相关性。
研究方案
1. 面具设计和主制造
- 使用任何矢量绘图软件绘制微流体设备所需的几何形状。对于用于下一步光刻的光刻器的每一层,准备一个单独的面膜:一个带通道和柱子的面罩,一个只包含柱子的面罩。
- 将绘图软件生成的 CIF 文件转换为胶片光照。这可以通过商业服务来完成。需要适当的光刻,具体取决于光刻中使用的光刻机的选择。
注:对于SU-8光防,请在透明背景上订购带有黑色特征的口罩。SU-8 是基于环氧树脂的负光电逆体,这意味着在紫外线照射(365 nm)时,暴露在紫外线下的部分是交叉链接的,而其余部分仍可溶性。因此,在光刻过程中,面罩上的所有黑色图案不会被紫外线交叉连接。通道和柱子将刻在主人身上。 - 使用SU-8负光刻技术,通过光刻技术为每个芯片的设计准备两个硅晶片大师。
注:步骤 1.3.1-1.3.7 在干净的房间里执行。下面描述的步骤是光刻的传统步骤,然后是 PDMS 软光刻,这在许多教科书中都进行了描述。实验参数的所有值(光电图、时间持续时间、温度等)都依赖于许多细微的参数,并且必须根据所使用的不同仪器进行优化。- 使用 3 英寸硅晶片,用等离子体处理表面 90 s,以方便 SU-8 光抗光片的沉积和附着。
- 将大约 3 mL 的 SU-8 电阻倒在晶圆中间,将 SU-8 旋转涂层降至所需的厚度(图 1A)。对于 50μm 名义厚度,请使用 SU-8 3050,在 500 rpm 时使用 10 s 旋转涂层,在 3500 rpm 时连续使用 30 s。在368K的热板上软烤15分钟,让树脂中所含的溶剂蒸发并防止它粘在光面具上,从而部分凝固。之后,在室温下将晶圆留出2分钟。
- 将光电图暴露在紫外线下(图1B)。使用具有 35 mW cm-2 和 8 s 曝光时间功率的面膜对齐器。
- 继续暴露后烘焙。将晶圆以 368 K 将晶圆放在热板上 5 分钟,以完成紫外线照射所调用的光反应。
- 将晶圆放入含有丙二醇甲基乙醚醋酸酯 (PGMEA) 的浴缸中,取出所有未交叉链接的 SU-8 电阻,搅拌 15 分钟。用异丙醇冲洗晶圆,直到观察到没有模糊的降水。用氮气干燥晶圆,并储存在培养皿中(100 毫米 x 15 mm 标准尺寸)。
- 用硅烷处理晶圆表面,以方便分离用于制造2枚邮票的聚二甲基硅氧烷(PDMS)。将晶圆沉积在 368 K 的轻拍热板上 10 分钟,在六甲基迪西拉赞 (HMDS) 的蒸汽大气下。
注意:如果多次使用后难以从晶圆上剥离 PDMS,则晶圆表面应再次使用 HMDS 蒸汽处理。 - 包含通道和柱子的第一个主已准备就绪。重复这些步骤,并准备第二个主图案只有支柱。
注:在光刻过程中,目标是在身高为 50μm 的 SU-8 大师身上获取设备的几何形状。然而,一旦两个SU-8大师被制造,测量刻在大师上的几何高度与熟练的仪表,以获得实验价值。为此协议制造的两个 SU-8 主值的测量值约为 45μm。
2. PDMS 模具制造
注:只要使用层压流罩,在使用 NOA 81 树脂(步骤 3.6-3.11)时使用室内的黄光,并且可用于聚合 NOA 81 树脂(步骤 3.7 和 3.11),即可在任何实验室执行协议的以下步骤。
- 以 10:1 的质量比准备 50 克 PDMS 硅胶碱及其固化剂。
- 将烧杯中的两种成分与铲子混合,并将混合物放入真空室中,以去除所有气泡。
- 将 25 克预混合 PDMS 倒入 SU-8 主菜(储存在培养皿中),将通道和柱子的高度高达约 5 毫米。将 PDMS 的剩余 25 克倒入第二个 SU-8 主图案中,仅将柱子高度高达约 5 mm(图 1C)。
- 将培养皿放在烤箱中,以 338 K 的 PDMS 层治愈 1 小时。
- 用手术刀切割 SU-8 大师图案周围的固化 PDMS 层,并轻轻地从大师身上剥下 PDMS 模具(图 1D)。
注:上述程序称为复制成型,经常用于制备 PDMS 的模具,这些模具将连接到玻璃表面,并成为微流体设备53的一部分。在此协议中,PDMS 模具不是芯片的一部分,而是用作芯片制造的中间体。对于每个设计,2个PDMS模具由各自的SU-8大师(图1D和1E)制备,并将相应地(如下所述)用于微芯片的制造。
3. 透析芯片制造
- 将 PDMS 模具图案的通道和柱子放在刚性显微镜玻璃滑梯上(标准尺寸为 3 x 1),图案朝上(图 1F)。对应蛋白质储层的中央柱子从 PDMS 模具的水平表面垂直超过 45μm。
- 切割并分离再生纤维素 (RC) 透析膜的干片,并将其存放在 PDMS 模具的中央柱子上,该柱子支持在玻璃滑梯上(图 1F)。
注:RC透析膜是商业上可用的,分子量截止(MWCO)是根据所研究的蛋白质的分子量和所使用的沉淀物相应地选择的。RC透析膜的尺寸取决于芯片的设计。在此协议中,设计了 2 个原型,其中蛋白质储层的体积为 0.1 或 0.3 μL。在这些情况下,透析膜片的大小分别为2×2毫米2或4×4毫米2。 - 将第二个 PDMS 模具仅朝下的柱子放置在玻璃滑梯上支持的 PDMS 模具顶部(图 1F)上。该模具的中心柱子对应蛋白质储层,从水平表面垂直(朝下)超过 45μm。
- 对齐 2 PDMS 模具的中心支柱。RC透析膜在2个PDMS模具(图1G)之间被"夹合"。
注:2 PDMS 模具的微观结构之间的对齐可以在视觉上完成,无需任何额外设备。否则,这种操作可以在显微镜下完成。只要不完全覆盖流畅通道和输入或输出点,水库之间的小班次是没有问题的。 - 在真空室中干燥组件 30 分钟,以清除 PDMS 模具中所有被困的气泡,并在制造的下一步促进树脂的插入。
注:2 PDMS 模具由 PDMS-PDMS 粘附保持到位,无需额外压力或其他临时粘合方式。 - 通过毛细环(图1H 和1I)填充2个PDMS模具之间的空白空间,采用光可光可治愈的、基于硫林的树脂NOA 81。
- 使用校准紫外灯(功率为 35 mWcm-2)将树脂暴露在紫外线下(365 nm)为 8 s 进行治疗。
注:此首次暴露允许 NOA 81 树脂部分交叉链接,因为与两侧 PDMS 模具接触的 NOA 81 薄层仍未被治愈。 - 用手术刀从 PDMS 模具的外部切除 NOA 81 的过量。
- 从底部 PDMS 模具和玻璃滑梯上取下部分交叉链接的 NOA 81 上部 PDMS 模具。
- 在显微镜玻璃滑梯(3 x 1 英寸)的标准尺寸中切割 175μm 厚的 PMMA 薄片,并从 PMMA 片的每一侧剥下塑料保护板。轻轻按 PMMA 件上的上 PDMS 模具和部分固化的 NOA 81 的组件(图 1J)。
- 再次治疗 NOA 81 通过暴露在紫外线下 60 s 和删除上 PDMS 模具 (图 1K)。树脂粘附在PMMA基材上,无需进一步治疗。
注:PDMS 模具在用异丙醇和丙酮清洗后可重复使用约 5 次,只要模具不弯曲。RC透析膜被纳入NOA 81贴纸,无需进一步操作或机械夹紧。
4. 流体连接器
注:微流体芯片的设计包括结晶溶液的线性流体通道和蛋白质样本(蛋白质储层)的中央储层,均从 图2A中两个微芯片的顶部视图显示。RC透析膜嵌入在这两个微结构(图2D)之间,结晶过程演变,而结晶溶液的沉淀物由于由膜分离的芯片两个隔间之间的浓度梯度而扩散到膜上。微流体通道印在底部 PDMS 模具上(图1F)。芯片的制造协议完成后,线性通道位于 NOA 81 贴纸的底层,与 PMMA 基板接触,如 图 1K所示。结晶解决方案的入口和插座接入点位于线性通道的每一端,看起来像 图 2A中可见的孔(总高度 90μm)。要处理结晶解决方案,必须在接入点上添加连接器。
- 带快速环氧胶(图2C)的微流体通道入口和出口上市售的债券连接器(NanoPort)。
- 根据连接器的大小选择适当直径的 PTFE 管。PTFE管将用于在芯片的流体通道中引入结晶溶液。
注:建议商业上可用的套件轻松精确地控制流速,通常与自动压力驱动或流量控制(注射器泵)系统相结合,用于混合和流体处理。但是,结晶溶液可使用一次性塑料注射器手动引入线性通道。在这种情况下,建议步骤 4.3 到 4.5。 - 将 1 mL 一次性注射器与结晶溶液填充。对于此协议中提出的芯片,400 μL 就足以填满整个流体通道。
- 切割两个移液器尖端,使一侧尖端的直径等于用于溶液处理的 PTFE 管的内径。用快速环氧胶(图2B)将裁剪的提示粘在通道的接入点上。
- 将注射器与裁剪的提示连接起来,使用适当尺寸的 PTFE 管,并通过不断缓慢地按压注射器柱塞来引入通道内的解决方案。
5. 蛋白质封装
注:专用于用作蛋白质储层的芯片的图案迄今仍对大气开放。建议下列方案小心地将蛋白质样本限制在微流体芯片内。
- 手动移液器蛋白质储液库内的蛋白质样本液滴,位于RC透析膜上, 如图2E所示。蛋白质样本的体积因芯片设计而异,可为 0.1 或 0.3 μL。
- 在蛋白质储层周围涂抹一层薄薄的高真空硅胶油脂。
- 切一小块 175μm 厚的 PMMA 薄片,轻轻放在硅胶油脂的薄层上方。PMMA 片必须覆盖蛋白质溶液沉积的蛋白质储层的整个表面。
注:硅胶油脂用于增强气密性,防止蛋白质液滴扩散。用于覆盖蛋白质储层的 PMMA 片与 NOA 81 贴纸之间没有粘合或密封。它们之间的接触是一个固体/固体接口。为了产生蛋白质样本的整体密封和气密封装,使用第 5.4 步中描述的一块 Kapton 胶带。
注:当压力驱动系统用于在流体通道内引入结晶溶液时(步骤 6.4),有时很难将蛋白质样本限制在设备(蛋白质储层)的专用腔内。为了避免上述问题,在循环结晶解决方案时应保持相对较低的压力值。水溶液的喷射压力为20-60mbar,水溶液的注塑压力为50-150mbar,建议注射更多粘性溶液(PEGs,甘油)19。 - 切一块卡普顿胶带(20μm 厚),足够大,足以覆盖蛋白质储层上方的 PMMA 片,并粘在 NOA 芯片上。蛋白质样本被封装在储层内,芯片准备用于结晶实验,如 图2C所示。
注:只要透析膜和 NOA 在 PMMA 基板上的粘附不变质,芯片就可以重复使用数倍。如果芯片的这些部分损坏,则会观察到泄漏,以验证设备是否不能再使用。清洗芯片取决于结晶溶液。在低粘度溶液(盐、缓冲液)的情况畅通道只需引入蒸馏水即可洗净,并让它流动几分钟。400 μL 是将通道内的解决方案与另一种解决方案完全交换所需的音量。在更粘稠的溶液(PEGs,甘油)的情况下,不建议重复使用芯片,因为只用水清洗通道是不够的。蛋白质储层所在的芯片上部也可以用蒸馏水清洗,用加压空气干燥。
6. 片上蛋白质结晶
- 称重亲血亲母鸡蛋清溶酶粉,溶解在蒸馏水中,最终浓度为30毫克mL-1。
- 通过 0.22 μm 过滤器和离心机过滤蛋白质溶液 5 分钟,最高速度为 293 K,以去除所有固体颗粒。使用超纳坦进行结晶实验。
- 准备 500 μL 的结晶溶液,其中含有 表 1中提供的浓度缓冲液和沉淀剂。通过 0.22 μm 过滤器过滤解决方案。
- 将溶液注入芯片的入口点,使用注射器或自动压力驱动的流体系统或注射器泵,如步骤 4.1-4.5 所述。
注:如果微流体通道充满结晶溶液并放在一边,或在流动条件下,如果以恒定的流速在通道内连续注入,则结晶实验可以在静态条件下进行。对于后一种情况,建议使用外部压力驱动系统或注射器泵。在流动条件下实现实验也为在流体通道内动态交换结晶溶液提供了可能性。因此,在使用同一蛋白质样本时可以进行多种实验。 - 流体通道充满结晶溶液后,用准胶带密封芯片的入口和出口端口。
- 将蛋白质溶液的适当体积分移到蛋白质储液中,并封装第 5.1-5.4 步中描述的蛋白质样本。
- 将芯片存储在293K。
注:根据测量数据51,透析的结晶遵循与用蒸汽扩散方法或批量结晶进行的实验不同的动能轨迹,并深刻地取决于参与扩散过程的沉淀分子的性质,核开始可能需要更多时间。为了防止蒸发,如果有的话,在此期间,将芯片放置在湿度饱和大气中293K。
7. 原位 和片上X射线衍射
- 光束线的 3D 打印支持
- 打印支持,可同时携带多达三个芯片。支撑的尺寸与商用结晶板(96 井/SBS 标准)的尺寸相同,与板 X 射线衍射实验相容。
注:支持打印可分配给商业服务。该支持采用 3D-CAD 设计软件设计,在芯片蛋白结晶实验期间显示图3A,在 BM30A-FIP (ESRF) 现场 X 射线衍射数据收集中显示图 3B。 - 用单面或双面胶带稳定支架上的透析芯片。
- 打印支持,可同时携带多达三个芯片。支撑的尺寸与商用结晶板(96 井/SBS 标准)的尺寸相同,与板 X 射线衍射实验相容。
-
就地 X射线衍射
- 从蛋白质储层中生长的晶体收集室温下的X射线衍射数据。例如,使用能量为 12.656 keV 的 X 射线、3.32 x 1010 光子s-1 和 250 x 250 μm2的光束大小。使用 ADSC 量子 315r 探测器记录衍射图像,矩阵为 3 x 3 CCD,活动表面分辨率为 315 x 315 mm2 和 940 万像素。
注:透析芯片上生长的溶酶晶体的衍射数据是在欧洲同步辐射设施(ESRF)的BM30A-FIP光束线采集的。但是,在其他 X 射线辐射源中,光束大小、通量和探测器类型可能有所不同。3D 打印支持使数据收集在晶体周围具有 -40° 到 +40° 的角范围。 现场 数据收集所暴露的酶晶体数量、每个晶体收集的衍射模式数量、每次暴露的振荡角度范围和暴露时间在 表2中进行汇总。
- 从蛋白质储层中生长的晶体收集室温下的X射线衍射数据。例如,使用能量为 12.656 keV 的 X 射线、3.32 x 1010 光子s-1 和 250 x 250 μm2的光束大小。使用 ADSC 量子 315r 探测器记录衍射图像,矩阵为 3 x 3 CCD,活动表面分辨率为 315 x 315 mm2 和 940 万像素。
- 数据处理
- 使用 XDS 程序48处理淋酶晶体的衍射模式的完整或部分数据集。
- 为每个数据集生成 HKL 文件,并使用 XSCALE 软件48进行缩放。
- 使用分子替换与 CPP4 套件49 的程序分阶段器,并确定模型构建的阶段。对于此步骤,请使用蛋白质数据库 (PDB) 条目 193L 中已知的酶 3D 坐标。
- 使用Phenix52 优化结构,使用COOT50检查最终蛋白质模型。
结果
Junius等人研制的微流体芯片19、45与微透析方法兼容芯片蛋白结晶,在室温下进行原位X射线衍射数据采集。微芯片的图片,他们的详细设计,流体连接器和RC透析膜在图2中说明。结晶实验通过手动将蛋白质样本直接输送到蛋白质储层中,并通过自动压力驱动系统或注射器泵将结晶溶液引入线性流体通道,或在注射器的帮助下手动进行。蛋白质储层和流体通道可在图2A中区分。用于制造蛋白质储层最大体积为 0.1 μL 或 0.3 μL 的芯片的设计分别在左图2A和右图中显示。蛋白质样本最大容量为 0.2 μL 或 0.7 μL 的芯片在19其他地方显示。设备制造的协议的亮点可以缩小,使用光致化硫乙烯为基础的树脂NOA 81嵌入各种MCO的市售RC透析膜。在微流体装置制造过程中,线性流畅通道印在底部 PDMS 模具 (图 1F),而上 PDMS 模具仅由蛋白质储层和入口和出口端口的图案柱(图 1F)组成。一旦 NOA 81 交叉链接,PDMS 模具从总成 (图 1K)中去除,流体通道位于微芯片的底层,蛋白质通道和入口/出口端口位于两层。图 1L显示了透析芯片的侧视图示意图,其中指示了设备的所有层及其各自的厚度。印在芯片底层(流体通道)上的图案高度约为 45 μm,而入口和出口端口的总高度约为 90μm。蛋白质储层(45微米高)也用图2D和2E来说明。在光学显微镜下对两层的对齐进行了研究,微芯片中整合的RC透析膜部分可在图2D中清晰区分。在同一图中,在注入结晶溶液期间,空气被包裹在流体通道内,这可以在蛋白质储液库的左上半部分看到。图2E是蛋白质储液库的特写照片,在用移液器手动沉积蛋白质液滴之后,在用一块PMMA和Kapton胶带封装液滴之前,如协议第5.2和第5.3步所述。在蛋白质样本封装和流体连接器粘合后,准备用于结晶实验的微流体芯片在图2C中进行了描述。密封组件可确保不会发生泄漏。微流道入口和出口端口的流体连接器可以是协议步骤 4.1 中描述的市售连接器,如图 2C所示,也可以用于同一目的的一次性实验室移液器提示(图 2B,协议步骤 4.4)。
为了制造微流体芯片,选择了光学透明和生物惰性材料,表明在室温下进行原位X射线衍射实验具有很高的兼容性。X射线、吸收和散射的相互作用,与构成微流体装置的材料以及周围的大气(空气)产生一种称为背景噪声的信号。这种噪声汇总到探测器记录的蛋白质晶体的衍射信号,使信号与噪声比衰减,在 X 射线衍射数据收集过程中应尽可能保持低水平。我们评估了由蛋白质储层组成的材料产生的背景噪声,该储层位于X射线束的直接路径上。蛋白质库由RC透析膜、卡普顿胶带和两个PMMA片段组成,一块用作微芯片的基材,另一块用于蛋白质样本的封装。PMMA 的厚度为 2 x 175 μm,卡普顿胶带为 20μm,RC 透析膜厚度约为 40μm(图 1L)。这些层的总厚度约为 410 μm,NOA 81 层不在直接 X 射线路径中。除了制造材料的厚度外,其密度对于测量背景散射噪声也至关重要,因为 X 射线散射随着元素原子数的增加而增加。因此,氦通量(在 ESRF 的 BM30A-FIP 上提供的一个功能)在收集数据以进行材料特征和蛋白质衍射实验时被使用,而不是空气。图 3C说明了 Kapton 胶带、RC 透析膜、PMMA 表及其在氦气中组装产生的背景噪声。每种材料都暴露在0.98×波长的X射线下20年代,样品检测距离为200毫米。实验是在ESRF的BM30A-FIP光束线进行的,协议第7步对此进行了解释。由于 X 射线束与材料的相互作用所导致的扩散环可以区分为分辨率低于 4 的 Kapton 胶带、4-8 é 之间的 PMMA 板和分辨率为 4-5 的透析膜。透析芯片产生的背景噪声主要以低于6+的分辨率观测,不影响大溶酶晶体高分辨率衍射数据的处理。背景散射强度作为微芯片和单独材料的分辨率函数,显示在其他地方19。在图3C中提出的测量中,透析芯片没有任何溶液(蛋白质或沉淀溶液),并且没有测量溶液对背景噪声的贡献。芯片安装在X射线束前,配有3D打印支架(图3B),专为19日进行原位衍射实验。但是,尺寸等于 96 井/SBS 标准结晶板尺寸的相同支持可用于同时执行 1 到 3 个结晶实验,因为它可以同时容纳多达 3 个芯片(图 3A)。
进行了实验,以评估微流体装置的效率,用微透析方法对模型可溶性蛋白进行片上结晶。流体通道按照协议第 4 步的描述填充,而步骤 5 和 6 则描述了如何在专用蛋白质储液库中封装蛋白质样本以及如何设置结晶实验。图4显示在 1.5 M 氯化钠 (NaCl) 下生长在 293 K 的酶晶体与 0.1 M 醋酸钠 (CH3COONa) pH 4.0(A)和 1 M NaCl 以下, 0.1 M CH3COONa pH 4.5 与 30% 聚乙烯乙二醇 (PEG) 400(B)。亲血酶粉末溶解在水中,最终浓度为~30毫克mL-1或在20 mM CH3COONa pH 4.2缓冲区,最终浓度为~20毫克mL-1,分别用于图4A和4B中的实验。两项实验中的蛋白质样本体积约为0.3 μL,嵌入微芯片中的RC透析膜的MWCO在6-8千达范围内。图3A中显示的酶晶体在1小时内生长,图3B中的晶体从实验开始不到30分钟就生长。结晶实验是在静态条件下进行的。然而,19日已经表明,在流动条件下进行实验提供了动态交换结晶条件和研究相图的可能性,验证了微透析方法的可逆性。
就地 收集了 图4A 中显示的溶酶晶体的X射线衍射数据,以证明透析芯片是否适合此类实验。数据收集是在室温下在 BM30A-FIP 光束线 (ESRF) 进行的,如协议第 7.2.1 步所述。微芯片在3D打印支持(图3B)的帮助下安装在光束线上,完整的X射线衍射数据集是在 表1第二行条件下从片上生长的两个单溶酶晶体中收集的。使用XDS48 处理、索引和集成了数据集的观测反射,并分别使用第49 阶段和Phenix52完成了分子置换和改进。每组酶晶体的完整数据集和两个数据集的合并的晶体统计资料均在 表2中提供。对于分子替换,使用了 PDB 条目 193L。
来自单个酶晶体的电子密度图和两个晶体的合并数据集分别以 1.95 é 和 1.85 é 获得,并以 图 5A 和 5B进行说明。两个电子密度图都显示了通过在室温下从单个晶体或多个晶体直接 在 透析微芯片上进行的X射线衍射实验获得的详细结构信息,使芯片与 原位 X射线晶体学研究兼容。
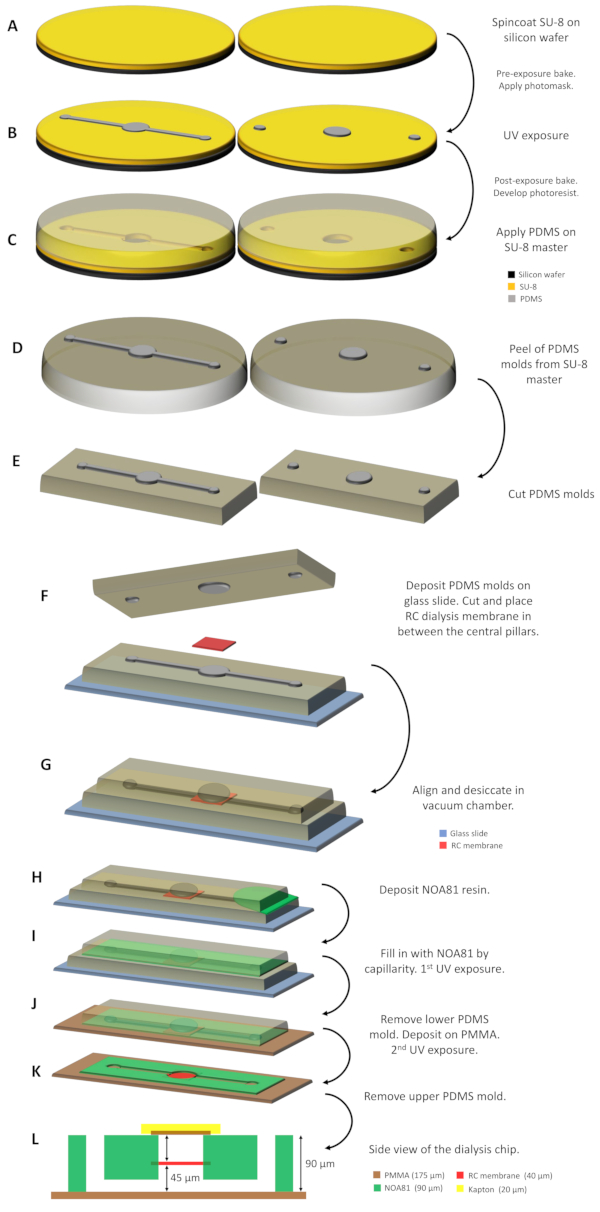
图1:透析芯片制造的示意图。(A)SU-8树脂沉积在两个硅晶片上并旋转涂层。(B) SU-8大师是在通过光罩照射光子并开发未暴露的部分后获得的。(C) PDMS 在 SU-8 大师身上配发,在 338 K 治愈后为 1 小时(D),复制成型和印记微图案产生的 2 个 PDMS 模具被剥去大师的皮,(E ) 切割到适当的尺寸。(F) PDMS 模具支持在玻璃滑梯上,将RC透析膜纳入两个中央柱子之间。(G) 2 PDMS 模具随后在真空室中对齐和干燥约 30 分钟。(H) NOA 81 树脂倒在两个模具之间,(I) 用毛细木填充空间。(J) 首次暴露在紫外线下后,底部 PDMS 模具被移除,组件存放在 PMMA 表上。(K) 第二次紫外线照射后,为了完全聚合NOA 81树脂和透析芯片是现成的后,删除剩余的上PDMS模具。(L) 透析芯片的侧视图示意图,其中指示设备的所有层及其各自的厚度。请点击这里查看此数字的较大版本。
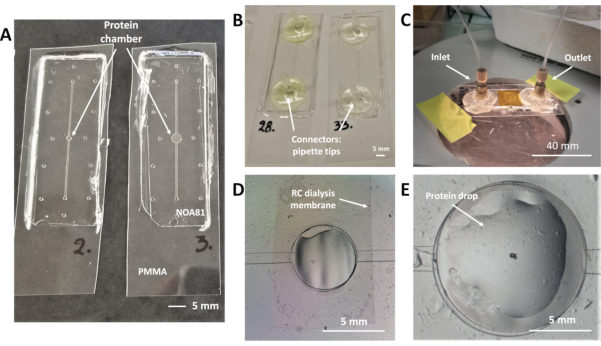
图2:透析芯片嵌入RC透析膜进行片上蛋白质结晶和 原位 X射线衍射实验。 (A)NOA 81 微芯片在 175μm 厚的 PMMA 基板上,蛋白质储层为 0.1 μL(左)和 0.3 μL(右)名义体积。(B) 带移液器尖端的微芯片作为流体连接器粘在流体通道的入口和出口端口上。(C) 在结晶实验中微芯片的图片。蛋白质样本用一块175μm厚的PMMA纸和卡普顿胶带封装。窥视纳米端口连接器用于流体通道的入口和出口端口。(D) 流体通道内结晶溶液循环过程中蛋白质储层的顶视图。空气被困在水库的上部,正好在RC透析膜下,可以清楚地探测到。(E) 在蛋白质样本沉积过程中,通过光学显微镜对透析库进行顶视。蛋白质液滴沉积在嵌入的RC透析膜上方。 请点击这里查看此数字的较大版本。

图3:在结晶实验中使用的微芯片的3D打印支持(A)和(B)安装在ESRF的BM30A-FIP光束线前的X射线束,用于原位X射线衍射实验。(C) X射线与卡普顿、RC透析膜、PMMA和透析芯片(从左到右)相互作用产生的背景噪声。请点击这里查看此数字的较大版本。
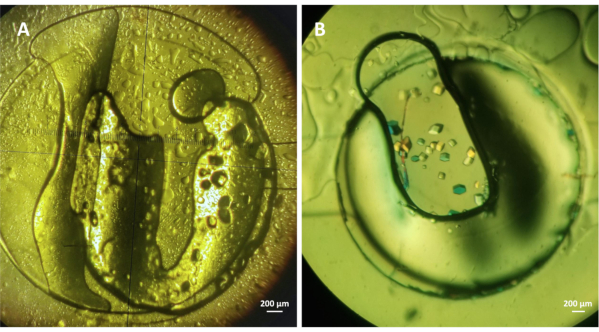
图4:用微透析方法对溶酶进行片上结晶。 (A) 酶 (约 30 毫克 mL-1) 在 1.5 M NaCl 和 0.1 M CH3COONa pH 4.0 和(B)酶 (约 20 毫克 mL-1) 晶体在含有 1 M NaCl 的结晶条件下生长, 0.1 M CH3库纳 pH 4.5, 和30%的PEG 400。这两项实验都是在293K进行 ,请点击这里查看这个数字的较大版本。

图5:从(A)单个晶体和(B)通过微透析在芯片上生长的两个晶体的合并数据集的精炼溶酶结构的电子密度图。 这些地图分别以1.95\和1.84\获得,轮廓为1σ。 请点击这里查看此数字的较大版本。
| 蛋白 | 蛋白质浓度 (毫克-1) | 蛋白质缓冲区 | 初始浓度 沉淀解决方案 | RC 的 MWCO 透析膜 (克达) | 温度 (K) | ||
| 溶菌酶 | ~30 | 水 | 1.5 M 纳克 0.1 M CH3库纳 pH 4.0 | 6 - 8 | 293 | ||
| 溶菌酶 | ~20 | 20 mM CH3库纳 pH 4.2 | 1 M 纳克 0.1 M CH3库纳 pH 4.5 30% PEG 400 | 6 - 8 | 293 | ||
表1:用微透析方法对溶酶片上结晶的蛋白质缓冲液和沉淀溶液的组成。 在芯片上生长的酶晶体与第二行提供的条件用于 原位 X射线衍射数据收集。
| 蛋白 | 溶菌酶 | 溶菌酶 | 溶菌酶 |
| 晶体数量 | 1 | 1 | 2 |
| 衍射帧数 | 40 | 30 | 70 |
| 每次暴露振荡 (°) | 1 | 1 | |
| 曝光时间 | 30 | 30 | |
| 温度 (K) | 293 | 293 | 293 |
| 空间组 | P43212 | P43212 | P43212 |
| 单元单元单元参数 | 78.86 78.86 37.87 90.0 90.0 90.0 | 79.17 79.17 37.95 90.0 90.0 90.0 | 78.47 78.47 37.65 90.0 90.0 90.0 |
| 分辨率范围(=) | 27.31 - 1.95 (2.02 - 1.95) | 27.39 - 1.96 (2.03 - 1.96) | 27.17 - 1.85 (1.91 - 1.85) |
| 马赛克 (+) | 0.319 | 0.121 | |
| 总反射(观察到) | 25127 (3552) | 19991 (3001) | |
| 独特的反射(观察到) | 8641 (1357) | 8295 (1321) | 10404 (975) |
| 冗余性 | 2.90 (2.61) | 2.41 (2.27) | |
| 完整性 (%) | 95.0 (94.8) | 91.9 (93.3) | 98.23 (93.15) |
| 意思是我/σ | 6.83 (1.16) | 7.09 (1.66) | 3.7 |
| CC(1/2) | 99.1 (42.4) | 97.9 (37.0) | 97.0 |
| R 合并 | 0.184 | ||
| R - 米亚斯 | 0.139 | 0.221 | 0.219 |
| R - 皮姆 | 0.116 | ||
| 用于精炼的反射 | 8645 (787) | 8451 (857) | 10391 (965) |
| 用于无 R 的反射 | 864 (78) | 846 (85) | 1039 (96) |
| R 工作 | 0.1988 (0.2968) | 0.1853 (0.2872) | 0.1839 (0.3102) |
| 无 R | 0.2430 (0.3437) | 0.2297 (0.3622) | 0.2207 (0.3703) |
| 非氢原子数量 | 1069 | 1071 | 1096 |
| 大分子 | 1012 | 1012 | 1012 |
| 水 | 55 | 57 | 82 |
| 配体 | 2 | 2 | 2 |
| 蛋白质残留物 | 131 | 131 | 131 |
| Rms (债券, é) | 0.008 | 0.009 | 0.005 |
| Rms(角度,°) | 1.17 | 1.26 | 1.05 |
| 拉马尚德兰青睐 (%) | 98.43 | 97.64 | 99.21 |
| 拉马尚德兰允许 (%) | 1.57 | 2.36 | 0.79 |
| 拉马尚德兰离群值 (%) | 0.00 | 0.00 | 0.00 |
| 阿韦加雷 B 因子 | 34.26 | 28.54 | 24.34 |
| 蛋白 | 33.94 | 28.14 | 23.62 |
| 水 | 40.23 | 35.57 | 33.16 |
| 配 | 33.23 | 29.63 | 24.77 |
表2:通过微透析方法在芯片上生长的溶酶晶体的数据收集参数、晶体学和精细统计。 括号中提供的值对应于分辨率最高的外壳。第四列对应于合并第二列和第三列数据集后获得的值。
讨论
已开发出一种微流体装置,用于芯片蛋白结晶,采用微透析方法,并在室温下进行原位X射线衍射实验。NOA 81 芯片集成了任何 MWCO 的 RC 透析膜,以便使用微透析进行片上蛋白质结晶。使用了X射线透明度较高的制造材料,使芯片与原位蛋白质晶体学兼容。对构成设备蛋白质结晶隔间(PMMA、卡普顿、RC透析膜)的制造材料进行了评估,以产生低背景噪声。具体来说,透析芯片产生的背景噪声主要以低分辨率(>6+)观测,不影响蛋白质结构测定所需的大溶酶晶体的高分辨率衍射数据的处理。数据收集的自动化使用 3D 打印支持放大,该支持可直接安装在大分子晶体光束线中,并同时携带多达三个微芯片。这样,避免手动采集和操作易碎的蛋白质晶体。此外,数据收集发生在室温下,避免了低温保护的需要,这可能与来自原生蛋白质结构2,3的构象变化有关。
使用微透析作为片上生长晶体的方法,可以准确监控结晶过程。据介绍,大多数传统的蛋白质结晶方法都是使用微流体装置11、14实施的。然而,透析对蛋白质结晶的优势尚未在微尺度上得到充分利用。片上微透析提供了研究相位图和进行筛选和优化结晶条件与相同的蛋白质样本19的可能性。对于本工作中提出的原型,每片蛋白质的消耗量限制在0.1或0.3微升以内。 根据迄今为止的实验工作,协议的最关键步骤不是来自芯片的制造过程,而是来自结晶过程。制造协议包括许多步骤,但它很简单,使许多设备(20至30芯片)在一天内在洁净室制造,相对便宜的材料。然而,由于细胞核和晶体生长的内在随机性,特别是在微尺度上,蛋白质的片上结晶可能是一个微妙的过程。描述了一个案例研究,其中利用了成熟的条件来结晶酶,产生坚固、定义明确的晶体,适合原位X射线衍射数据收集。然而,使用更具挑战性的蛋白质靶点(如膜蛋白)可能会产生困难,因为膜蛋白的结晶介质要复杂得多,相位图尚不为人所知,而且尚未确定良好的结晶条件。透析芯片通过在微流体通道内交换结晶溶液,提供了超越这些困难和研究片上阶段图的可能性,而无需处理价值巨大且成本高昂的蛋白质样本。
微流体装置的多功能性源于利用微透析进行片上蛋白质结晶,以便利用低蛋白质体积逆转控制结晶条件和绘制浓度和温度变化相图。此外,该设备与 原位 X 射线衍射实验兼容,设备原型化成本低且速度快。可溶性和膜蛋白的众多同构晶体(正在制备中)可以在片上生长,预计所有这些特征都可以用于同步加速器和XFEL设施中具有挑战性的蛋白质靶点的连续X射线晶体学研究。最后,进行片上和 现场 时间解决的研究是未来可能对晶体学界非常感兴趣的可能性。因此,通过在透析芯片上种植晶体,并将试剂引入微流体通道,无论是手动(使用注射器)还是自动(使用压力控制流体系统或注射器泵),未来的努力将侧重于证明微流体芯片可以成功地用于触发同步加速器光束线上的定时实验。
披露声明
作者没有什么可透露的。
致谢
MBS 确认在 2014-2015 年限额下,根据合同仪器获得 MI /CNRS 的支持。新泽西州承认东航的国际博士研究计划(Irtelis)获得博士学位。MBS和SJ承认根据玛丽·斯考多夫斯卡-居里赠款协议722687的欧盟地平线2020研究与创新方案提供的资金。MBS、SJ和NJ感谢LIPhy(UGA)为微压化实验建立的洁净室。IBS承认与格勒诺布尔跨学科研究所(IRIG,东航)合并。
材料
| Name | Company | Catalog Number | Comments |
| 3 in wafer | Silicon Materials Inc. | Silicon wafer | |
| Centrifuge | Eppendorf | Minispin | Bench-top centrifuge |
| CleWin 3.0 | WieWeb software | Designing software | |
| Epoxy glue | Devcon | 5 minutes epoxy glue | |
| Fluidic connectors | Cluzeau Info Lab | N-333 | NanoPort kit for 1/16" OD tubing |
| Hen egg-white lysozyme | Roche | 10 837 059 001 | Lyophilized protein powder |
| High-vacuum silicone grease | Sigma-Aldrich | Z273554 | Dow Corning high-vacuum silicone grease |
| HMDS | Sigma-Aldrich | 440191 | Silane, chemical |
| Hot plate | Sawatec | HP-200-Z-HMDS BM | Hot plate |
| Isopropyl alcohol | Sigma-Aldrich | Solvent | |
| Kapton tape | DuPont | Polyimide tape | |
| Mask aligner | SUSS MicroTec | MJB4 | Mask aligner, UV source |
| Membrane filter | Millipore | GSWP04700 | 0.22 μm pore size filter |
| Microscope glass slide | Fisher Scientific | 12164682 | 3 x 1 in glass slides |
| NOA81 | Norland Products Inc. | NOA81 | Photocurable resin |
| Oven | Memmert | Oven | |
| Parafilm | Sigma-Aldrich | P6543 | Parafilm M roll size 20 in. × 50 ft |
| PDMS | Dow Corning | Sylgard 184 | Silicone |
| PEG 400 | Hampton Research | HR2-603 | Chemical |
| Petri dish | Sigma-Aldrich | P5731 | 100 x 15 mm |
| PGMEA | Sigma-Aldrich | 484431 | Developer |
| Plasma equipment | Diener Electronic | ZEPTO | Plasma treatment |
| PMMA | Goodfellow | 137-745-63 | PMMA sheets 150x150 mm, 0.175 mm thickness |
| Pressure driven system | Elveflow | OB1 MK3+ | Pressure/vacuum controller |
| PTFE tubing | Elveflow/Darwin microfluidics | LVF-KTU-15 | PTFE tubing roll 1/16" OD X 1/32" ID |
| RC dialysis membrane | Spectra/Por | Various MWCOs | |
| Scalpel | Swann-Morton | Carbon steel surgical blades | |
| Sodium acetate | Sigma-Aldrich | S2889 | Chemical |
| Sodium chloride | Sigma-Aldrich | 746398 | Chemical |
| Solidworks | Dassault Systemes | 3D-CAD designing software | |
| Spin coater | SPS | Spin150 | Wafer spinner |
| SU-8 3000 series | MicroChem Corp. | SU-8 3050 | Photoresist |
| Syringe | BD | 309628 | 1 mL Luer-Lok syringe |
| UV crosslinker | Uvitec | CL-508 | UV crosslinker |
参考文献
- Garman, E. F. Radiation damage in macromolecular crystallography: what is it and why should we care. Acta Crystallographica, Section D: Biological Crystallography. 66, 339-351 (2010).
- Henderson, R. The potential and limitations of neutrons, electrons and X-rays for atomic resolution microscopy of unstained biological molecules. Quarterly Reviews of Biophysics. 28 (2), 171-193 (1995).
- Fraser, J. S., et al. Accessing protein conformational ensembles using room-temperature X-ray crystallography. Proceedings of the National Academy of Sciences of the United States of America. 108 (39), 16247-16252 (2011).
- Gotthard, G., et al. Specific radiation damage is a lesser concern at room temperature. IUCrJ. 6 (4), 665-680 (2019).
- Martin-Garcia, J. M., Conrad, C. E., Coe, J., Roy-Chowdhury, S., Fromme, P. Serial femtosecond crystallography: A revolution in structural biology. Archives of Biochemistry and Biophysics. 602, 32-47 (2016).
- Gicquel, Y., et al. Microfluidic chips for in situ crystal X-ray diffraction and in situ dynamic light scattering for serial crystallography. Journal of Visualized Experiments: JoVE. (134), e57133(2018).
- Chapman, H. N., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470, 73-78 (2011).
- Hunter, M. S., et al. Fixed-target protein serial microcrystallography with an x-ray free electron laser. Science Reports. 4, 6026(2014).
- Pawate, A. S., et al. Towards time-resolved serial crystallography in a microfluidic device. Acta Crystallographica, Section F: Structural Biology Communications. 71, 823-830 (2015).
- Owen, R. L., et al. Low-dose fixed-target serial synchrotron crystallography. Acta Crystallographica, Section D: Structural Biology. 73, 373-378 (2017).
- Leng, J., Salmon, J. -B. Microfluidic crystallization. Lab on a Chip. 9, 24-34 (2009).
- Morel, M., Galas, J. -C., Dahan, M., Studer, V. Concentration landscape generators for shear free dynamic chemical stimulation. Lab on a Chip. 12, 1340-1346 (2012).
- Miralles, V., Huerre, A., Malloggi, F., Jullien, M. -C. A review of heating and temperature control in microfluidic systems: techniques and applications. Diagnostics. 3, 33-67 (2013).
- Sui, S., Perry, S. L. Microfluidics: from crystallization to serial time-resolved crystallography. Structural Dynamics. 4, 032202(2017).
- Hansen, C. L., Sommer, M. O. A., Quake, S. R. Systematic investigation of protein phase behavior with a microfluidic formulator. Proceedings of the National Academy of Sciences of the United States of America. 101 (40), 14431-14436 (2004).
- Laval, P., Lisai, N., Salmon, J. -B., Joanicot, M. A microfluidic device based on droplet storage for screening solubility diagrams. Lab on a Chip. 7, 829-834 (2007).
- Shim, J. -U., et al. Control and measurement of the phase behavior of aqueous solutions using microfluidics. Journal of the American Chemical Society. 129, 8825-8835 (2007).
- Selimovic, S., Gobeaux, F., Fraden, S. Mapping and manipulating temperature-concentration phase diagrams using microfluidics. Lab on a Chip. 10, 1696-1699 (2010).
- Junius, N., et al. A microfluidic device for both on-chip dialysis protein crystallization and in situ X-ray diffraction. Lab on a Chip. 20, 296-310 (2020).
- Greaves, E. D., Manz, A. Towards on-chip X-ray analysis. Lab on a Chip. 5, 382-391 (2005).
- Dhouib, K., et al. Microfluidic chips for the crystallization of biomacromolecules by counter-diffusion and on-chip crystal X-ray analysis. Lab on a Chip. 9, 1412-1421 (2009).
- Guha, S., Perry, S. L., Pawate, A. S., Kenis, P. J. A. Fabrication of X-ray compatible microfluidic platforms for protein crystallization. Sensors and Actuators B. Chemical. 174, 1-9 (2012).
- Sui, S., et al. Graphene-based microfluidics for serial crystallography. Lab on a Chip. 16, 3082-3096 (2016).
- Russo Krauss, I., Merlino, A., Vergara, A., Sica, F. An overview of biological macromolecule crystallization. International Journal of Molecular Science. 14, 11643-11691 (2013).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica, Section F: Structural Biology and Crystallization Communications. 70, 2-20 (2014).
- Zheng, B., Tice, J. D., Roach, L. S., Ismagilov, R. F. A droplet-based, composite PDMS/Glass capillary microfluidic system for evaluating protein crystallization conditions by microbatch and vapor-diffusion methods with on-chip X-ray diffraction. Angewandte Chemie. 43, International Edition in English 2508-2511 (2004).
- Talreja, S., Kim, D. Y., Mirarefi, A. Y., Zukoski, C. F., Kenis, P. J. A. Screening and optimization of protein crystallization conditions through gradual evaporation using anovel crystallization platform. Journal of Applied Crystallography. 38, 988-995 (2005).
- Hansen, C. L., Classen, S., Berger, J. M., Quake, S. R. A microfluidic device for kinetic optimization of protein crystallization and in situ structure determination. Journal of American Chemical Society. 128, 3142-3143 (2006).
- Schieferstein, J. M., et al. X-ray Transparent microfluidic platforms for membrane protein crystallization with microseeds. Lab on a Chip. 18, 944-954 (2018).
- Ghazal, A., et al. Recent advances in X-ray compatible microfluidics for applications in soft materials and life sciences. Lab on a Chip. 16, 4263-4295 (2016).
- Li, L., Ismagilov, R. F. Protein crystallization using microfluidic technologies based on valves, droplets, and SlipChip. Annual Review of Biophysics. 39, 139-158 (2010).
- Du, W., Li, L., Nichols, K. P., Ismagilov, R. F. SlipChip. Lab on a Chip. 9, 2286-2292 (2009).
- Zhang, S., et al. Microfluidic platform for optimization of crystallization conditions. Journal of Crystal Growth. 472, 18-28 (2017).
- Abdallah, B. G., et al. Protein crystallization in an actuated microfluidic nanowell device. Crystal Growth & Design. 16, 2074-2082 (2016).
- Monteiro, D. C. F., et al. A microfluidic flow-focusing device for low sample consumption serial synchrotron crystallography experiments in liquid flow. Journal of Synchrotron Radiation. 26, 406-412 (2019).
- de Wijn, R., et al. A simple and versatile microfluidic device for efficient biomacromolecule crystallization and structural analysis by serial crystallography. IUCrJ. 6, 454-464 (2019).
- Shim, J. -U., Cristobal, G., Link, D. R., Thorsen, T., Fraden, S. Using microfluidics to decouple nucleation and growth of protein crystals. Crystal Growth & Design. 7, 2192-2194 (2007).
- de Jong, J., Lammertink, R. G. H., Wessling, M. Membranes and microfluidics: a review. Lab on a Chip. 6, 1125-1139 (2006).
- Paustian, J. S., Nery Azevedo, R., Lundin, S. T. B., Gilkey, M. J., Squires, T. M. Microfluidic microdialysis: spatiotemporal control over solution microenvironments using integrated hydrogel membrane microwindows. Physical Review X. 3, 041010(2013).
- Kornreich, M., Heymann, M., Fraden, S., Beck, R. Cross polarization compatible dialysis chip. Lab on a Chip. 14, 3700-3704 (2014).
- Song, S., Singh, A. K., Shepodd, T. J., Kirby, B. J. Microchip dialysis of proteins using in situ photopatterned nanoporous polymer membranes. Analytical Chemistry. 76, 2367-2373 (2004).
- Skou, M., Skou, S., Jensen, T. G., Vestergaard, B., Gillilan, R. E. In situ microfluidic dialysis for biological small-angle X-ray scattering. Journal of Applied Crystallography. 47, 1355-1366 (2014).
- Zou, L., et al. A multistage dialysis microdevice for extraction of cryoprotectants. Biomedical Microdevices. 19, 30(2017).
- Satya Eswari, J., Naik, S. A critical analysis on various technologies and functionalized materials for manufacturing dialysis membranes. Materials Science for Energy Technologies. 3, 116-126 (2020).
- Spano, M., Salmon, J. -B., Junius, N. FR3044685A1. UJF. , (2015).
- Bartolo, D., Degre, G., Nghe, P., Studer, V. Microfluidic stickers. Lab on a Chip. 8, 274-279 (2008).
- Junius, N., et al. A crystallization apparatus for temperature controlled flow-cell dialysis with real-time visualization. Journal of Applied Crystallography. 49, 806-813 (2016).
- Kabsch, W. XDS. Acta Crystallographica, Section D: Biological Crystallography. 66, 125-132 (2010).
- Winn, M. D., et al. Overview of the CCP4 suite and current developments. Acta Crystallographica, Section D: Biological Crystallography. 67, 235-242 (2011).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and developments of COOT. Acta Crystallographica, Section D: Biological Crystallography. 66, 486-501 (2010).
- Apostolopoulou, V., Junius, N., Sear, R. P., Budayova-Spano, M. Mixing salts and polyethylene glycol into protein solutions: The effects of diffusion across semipermeable membranes and of convection. Crystal Growth & Design. 20, 3927-3936 (2020).
- Liebschner, D., et al. Macromolecular structure determination using X-rays, neutrons and electrons: recent developments in Phenix. Acta Crystallographica, Section D: Structural Biology. 75, 861-877 (2019).
- Xia, Y., Whitesides, G. M. Soft Lithography. Annual Review of Materials Science. 28, 153-184 (1998).
- Nogly, P., et al. Lipidic cubic phase injector is a viable crystal delivery system for time-resolved serial crystallography. Nature Communications. 7, 12314(2016).
- Baxter, E. L., et al. High-density grids for efficient data collection from multiple crystals. Acta Crystallographica, Section D: Structural Biology. 72, 2-11 (2016).
- Feiler, C. G., Wallacher, D., Weiss, M. S. An all-in-one sample holder for macromolecular X-ray crystallography with minimal background scattering. Journal of Visualized Experiments. (149), e59722(2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。