Method Article
In Situ X線回折研究のためのマイクロダイアルシスによるチップ上のタンパク質の結晶化
要約
本論文では、透析法とX線回折実験を用いて、オンチップタンパク質結晶化のために開発されたマイクロ流体チップの製造プロトコルについて詳しく述べる。微細加工プロセスにより、半透膜再生可能なセルロース透析膜を、チップの2層間の任意の分子量カットオフと統合することが可能になります。
要約
このプロトコルは、透析法でオンチップのタンパク質を結晶化し、室温での単結晶または連続結晶学の実験を可能にするパイプライン全体をカバーする再現性と安価なマイクロ流体デバイス の 製造を記述します。プロトコルは、マイクロチップの製造プロセス、オンチップ結晶化実験の操作、およびタンパク質サンプルの構造解明のための Insitu 収集されたX線回折データの治療を詳述する。この微細加工手順の主な特徴は、チップの2層間に市販の半透析可能な再生セルロース透析膜の統合にあります。組み込み膜の分子量カットオフは、高分子の分子量および沈殿物によって異なる。このデバイスは、微量サンプル(<1 μL)の使用や輸送現象の微調整など、マイクロ流体技術の利点を活用しています。チップはそれらを透析法と組み合わせて、結晶化プロセスを正確かつ可逆的に制御し、マイクロリットルスケールでタンパク質の位相図を調査するために使用することができます。装置は光学的に透明なポリマー基質の柔らかいインプリントのリソグラフィが付いている光硬化性チオレンベースの樹脂を使用してパターン化される。また、マイクロチップを構成する材料の背景散乱とバックグラウンドノイズの発生を評価し 、その際 のX線回折実験でチップの適合性を評価した。タンパク質結晶が十分なサイズと集団の均一性までオンチップで成長すると、マイクロチップは3Dプリントホルダーの助けを借りてX線ビームの前に直接取り付けることができます。このアプローチは、従来のタンパク質結晶学実験における凍結保護剤の使用と手動収穫から生じる課題に、容易かつ安価な方法で対処します。複数のX線回折データセットを、オンチップで成長させた同形リソチーム結晶から完全に、構造決定のために室温で収集した。
概要
生体高分子の3次元(3D)構造を解明することは、X線結晶学が依然として主要な調査技術である構造生物学における絶え間ない追求である。タンパク質などの複雑な高分子の構造の詳細を解明するために応用され、それらの作用のメカニズムと様々な生物学的機能への関与の理解を促進することを目的としています。シンクロトロンとX線自由電子レーザー(XFET)の強力なX線源は、ほぼ原子分解能でタンパク質の構造をより深く洞察するために必要なすべてのツールを提供します。構造研究のためのX線の使用と一緒に来る利点にもかかわらず、X線放射および結晶化プロセス自体に本質的な制限がある。X線ビーム前の高X線フラックスおよびタンパク質結晶の長時間露光時間によって引き起こされる放射線損傷は、結晶学者が極低温冷却1を用いて上回らなければならない制限的なパラメータである。しかし、天然のタンパク質構造やアーチファクトからの立体構造変化は2,3を隠すことができるので、最適な凍結冷却条件を見つけることは面倒です。また、最近の研究では、室温で回折実験を行うと、特定の放射線損傷が低下する4が示されている。構造生物学のもう一つのボトルネックは、十分なサイズ5を有する十分に拡散結晶の獲得である。小さい結晶は、特に膜タンパク質の場合に生成しやすくなるが、より大きなタンパク質結晶の場合に比べて高い放射線量を小さな体積で向けなければならないため、凍結冷却条件下でも放射線損傷の影響を受けやすい。連続結晶学7,8のシンクロトロンおよびXFELの新しいアプローチは、放射線損傷の抑制を回避すると同時に、複数の同型およびランダム指向のタンパク質結晶からのデータセットをマージし、フェムト秒パルス、短い暴露時間およびマイクロフォーカスX-7線線などの関連技術の進歩から利益を得ることによって、より小さな結晶(200nm〜2 μm)7を利用することができる。
マイクロ流体技術はX線結晶学にとって価値があり、生物学的高分子の結晶化とその構造調査に多様な利点を示します。マイクロ流体デバイスで結晶化実験を行うには、少量のタンパク質サンプルが必要であり、これらの高価値生体高分子の製造コストを制約し、多数の結晶化条件のハイスループットスクリーニングと最適化を促進します。さらに、マイクロ流体スケールと拡散限定輸送現象における固有の大きな表面積比は、流れおよび温度または濃度勾配11、12、13、14を細かく制御することを可能にし、均一なサイズの結晶を成長させるために適した微小流体デバイスをレンダリングし、相図15、16、17、18、19を探索する。さらに、マイクロ流体ツールは、サンプルデリバリーであるタンパク質結晶学のもう一つのハードルに対処する独特の可能性を示し、X線回折実験に使用する前にタンパク質結晶を処理し、収穫する必要性を示しています。オンチップおよびIn situ X線結晶学の方法は、データ収集前に結晶の操作と結晶品質の潜在的な劣化を排除します。X線タンパク質結晶学に対応する幅広いマイクロ流体チップは、マイクロファブリケーション材料の性質とX線14、19、20、21、22、23との相互作用に起因する関連制限に直面する多くの研究グループによって設計、開発、試験されています。製造材料は、光学的に透明で生物学的に不活性であり、X線放射に対する高い透明性と、データ収集中の最適な信号対雑音比を実証する必要があります。
従来のタンパク質結晶学24,25において適用される結晶化法の大部分は、チップ結晶化およびX線回折解析においてマイクロ流体スケール11、14で実施されている。蒸気拡散26を組み込んだ単純、ハイブリッド、または多層マイクロ流体装置、蒸発27、遊離界面拡散(FID)28、マイクロバッチ26、あるいは播種29が可溶性および膜タンパク質を結晶化するために用いられている。高スループットスクリーニングと結晶化条件の最適化は、ウェルベース32、液滴ベース33、またはバルブ作動34デバイスで30、31を達成することができます。 その時PDMS(ポリジメチルシロキサン)、COC(環状オレフィン共重合体)、PMMA(メチルメタクリレート)などの様々な材料から作製されたマイクロチップで室温での難解なタンパク質標的のX線回折実験が行われている21、22、26、28、29、グラフェンフィルム23、カプトン35、エポキシ接着剤6、またはNOA(ノーランド光学接着剤)19およびX線放射に対する材料の透明性およびバックグラウンドノイズへの寄与が評価されている。さらに、マイクロチップは、シンクロトロン源23、35、36およびXFET7におけるX線タンパク質結晶学実験のための単一のツールでin in situとシリアルデータ収集戦略を結合するように設計されている。
また、その場での室温データ収集は、さまざまな配信方法や装置にも実装されています。例えば、Noglyら54は、XFEL源を用いてシリアルフェムト秒結晶学(SFX)による光駆動光子ポンプバクテリオロドプシン(bR)の構造を研究するために脂質立方相(LCP)インジェクターを用いた。BRの結晶構造は2.3Å分解に解かれ、LCPインジェクターと時間分解型順ム・フェムト秒結晶学(TR-SFX)との相溶性を実証した。Baxterら55は、さまざまなサイズのレーザーカット穴を持つ100または200 μmの厚いポリカーボネートプラスチックによって製造された高密度多結晶グリッドを設計しました。さらに5μmの厚いポリカーボネートフィルムは、座り込みまたは吊り下げ-落下結晶化実験のためにデバイスを使用する場合、グリッドの片側に固定することができます。この高密度グリッドは、水晶をデバイスのポートに直接ロードしたり、水蒸気拡散やLCP法でデバイス上で成長させることができるように、複数の方法で使用することができます。さらに、グリッドは標準的な磁気ベースで調整され、極低温または室温条件でのSitu X線データ収集に使用することができる。最近では、Feilerら.56は、低分子および周囲温度での高分子X線結晶学のサンプルホルダーを開発し、バックグラウンドノイズの寄与を最小限に抑えた。具体的には、ホルダーは、プラスチック支持体、透明COC箔及び微多孔性ポリイミド箔を備える。結晶化液を設定するために一般的に使用されるカバースライドを置き換えるように設計された一方で、結晶化ドロップを開いたり手動で結晶を処理したりすることなく、リガンド浸漬、複雑な形成、極低温保護などのインプレース操作が可能です。さらに、サンプルホルダーは結晶化板から取り出し、標準的なゴニオメータベースのビームラインでの現場データ収集用の磁気ベースに置くことができます。周囲温度データ収集の場合、COC箔は実験前に除去され、21μm厚のポリイミド箔のみがバックグラウンド散乱に寄与し、この場合は最小限に抑えられます。これらの例は、進行中の研究のほんの一部と、X線タンパク質結晶学のために開発された多彩なマイクロチップを構成しています。
しかしながら、透析タンパク質結晶化法は、マイクロ流体内に広く組み込まれていない。透析は、タンパク質結晶化のための公称濃度に近づくために半透過性膜を通して沈殿物濃度の平衡を目指し、結晶化条件24を正確かつ可逆的に制御することを目的とした拡散ベースの方法である。半透析膜の分子量カットオフ(MWCO)は、目的の高分子を保持しながら小さな沈殿分子の拡散を可能にする高分子および沈殿物の分子量に応じて選択することができる。透析プロセスの可逆性のために、同じタンパク質サンプルを使用しながら沈殿物濃度を変化させることによって相図を調査するために、個別に核化および結晶成長を分離し最適化するために温度制御と組み合わせて使用することができる。マイクロ流体学中の膜の統合は、de Jong et38によってレビューされ、マイクロチップへの透析を移植する生物学における事例研究は、主にサンプル調製、濃度または濾過アプリケーション39、40、41、42または細胞関連研究43、44に記載することができる。PDMSによる浸透気化は、種々の条件下でのキシラナーゼの核生成および成長を研究するためにShimらら37によって使用された。厚さ15μmのPDMS膜を通してマイクロ流体装置のタンパク質貯留層に水が浸透し、その後タンパク質と沈殿物濃度が変化した。
Juniusらによって開発されたプロトコルは、マイクロ透析を介したオンチップタンパク質結晶化と室温でのX線回折実験の両方に適合するマイクロ流体チップの製造のために提示される。デバイス製造のためのプロトコルは、柔らかいインプリントリソグラフィを使用して、市販の膜を埋め込む光硬化性チオレンベースの樹脂NOA 81のマイクロパターンステッカーのためのStuderと同僚12、46によって達成された先駆的な仕事に直接触発されています。この方法の革新的な改変により、マイクロダイアルシスを使用してタンパク質結晶のオンチップ成長のための実験パラメータを正確に監視および制御し、同時に実験あたりのタンパク質サンプルの消費量の減少(<1 μL)などのマイクロ流体の利点を利用することが可能となりました。これまでの研究では、温度沈殿濃度相図をマッピングすることにより結晶化条件をスクリーニングおよび最適化するためのマクロスケールシステム(典型的な容積>20μL)に適用される透析の原理が47に実証された。本研究では、異なるMWCOの再生セルロース(RC)透析膜を組み込んだ透析マイクロチップを製造するためのプロトコルを記載し、オンチップおよびSitu X線回折データ収集において結晶化アッセイを行う。マイクロチップを含む材料は、X線19に対する透明性について評価されており、装置は、手動処理を除き、脆弱なタンパク質結晶の分解を最小限に抑える、その場で室温に対してX線ビームの前に直接設定することができる。ケーススタディでは、卵白リソチーム結晶を、均一な大きさの集団を生成するマイクロ透析を介してオンチップで成長させた。その後、マイクロチップを3Dプリントされた支持体19でX線ビームの前に取り付け、その場で完全な回折データセットを複数の同型結晶から室温で収集し、挑戦的な高分子標的のシンクロトロン連続結晶学研究のためのチップの高い可能性と関連性を実証した。
プロトコル
1. マスクデザインとマスターファブリケーション
- 任意のベクトル描画ソフトウェアを使用して、マイクロ流体デバイスの所望の幾何学を描きます。フォトリソグラフィの次のステップに使用されるフォトレジストの各層について、チャンネルと柱で輪郭を描いたマスクと柱のみを含むマスクを個別に用意します。
- 描画ソフトウェアによって生成されたCIFファイルをフィルムフォトマスクに変換します。これは、商用サービスを通じて行うことができます。フォトリソグラフィ中に使用するフォトレジストの選択に応じて、適切なフォトマスクを必要とします。
メモ:SU-8フォトレジストの場合は、透明な背景に黒い特徴を持つマスクを注文します。SU-8はエポキシベースの負光抵抗であり、UV光(365nm)への曝露中にUVに曝露された部分は架橋され、残りは可溶性のままである。したがって、マスク上のすべての黒いパターンは、フォトリソグラフィ中にUV光によって架橋されません。マスターにはチャンネルと柱が刻まれています。 - SU-8陰性フォトレジストを使用したフォトリソグラフィによる各チップの設計に対して、シリコンウェーハに2人のマスターを用意します。
注: ステップ 1.3.1- 1.3.7 はクリーンルームで行われます。以下に説明するステップは、フォトリソグラフィの伝統的なステップとそれに続くPDMSソフトリソグラフィであり、多くの教科書に記載されている。実験パラメータ(フォトレジスト、時間の持続時間、温度など)のすべての値は、多くの微妙なパラメータに依存し、使用する異なる装置に応じて最適化する必要があります。- 3インチシリコンウエハを使用し、SU-8フォトレジストの堆積と取り付けが容易にするために、90 sのプラズマで表面を処理します。
- ウエハーの中央に約3mLのSU-8レジストを注ぎ、SU-8を所望の厚さに下げるスピンコートをします(図1A)。50 μmの公称厚さでは、SU-8 3050とスピンコートを500rpmで10s、3500 rpmで30sを連続して使用します。樹脂に含まれる溶媒を蒸発させてフォトマスクに貼り付けないようにして部分的に固化させるために、368Kで15分間ホットプレート上でフォトレジストをソフトベークします。その後、2分間室温でウエハーを残します。
- フォトレジストをUV光に当てる(図1B)。35 mWcm-2 と 8 s 露光時間のパワーを持つマスク アライナーを使用します。
- 露光後のベーキングを続行します。368 K で 5 分間ホットプレートにウエハーを置き、UV 露光によって呼び出される光反応を完了します。
- プロピレングリコールメチルエーテルアセテート(PGMEA)を含む浴槽にウエハーを入れて架橋しなかったSU-8レジストをすべて取り除き、15分間撹拌します。ぼやけた沈殿が見られないまでイソプロパノールでウエハをすすいすいます。ウェハを窒素ガスで乾燥させ、ペトリ皿(100mm x 15mm標準サイズ)に保管してください。
- 2つのスタンプを作製するために使用されるポリジメチルシロキサン(PDMS)の剥離を容易にするために、シランでウエハーの表面を扱います。368 K のホットプレートにウエハーを 10 分間、ヘキサメチルジシルラザン (HMDS) の蒸気雰囲気下で 10 分間蒸着します。
注:ウエハからPDMSを剥がすのが困難な場合は、ウエハの表面をHMDS蒸気で再処理する必要があります。 - チャネルと柱を含む最初のマスターが準備完了です。これらの手順を繰り返し、2 番目のマスターが柱のみをパターン化する準備をします。
メモ:フォトリソグラフィの目的は、SU-8マスター上のデバイスの形状を50μmの高さで取得することです。ただし、2 つの SU-8 マスターが製造されたら、実験値を取得するためにプロフィロメーターを使用してマスターに刻まれたジオメトリの高さを測定します。このプロトコル用に製造された両方のSU-8マスターの測定値は約45μmです。
2. PDMS金型製作
注:プロトコルの次の手順は、積層フローフードを使用している限り、部屋の黄色の光がNOA 81樹脂(ステップ3.6-3.11)を使用する場合に使用され、UV光のソースは、NOA 81樹脂を重合するために利用可能である(ステップ3.7と3.11)、任意の研究室で行うことができます。
- 50gのPDMSシリコーンベースとその硬化剤を10:1質量比で調製します。
- ビーカーの両方の成分をヘラと混ぜ、真空チャンバーに入れてすべての気泡を取り除きます。
- 25 gのプレミックス PDMS を SU-8 マスターに注ぎ、チャネルと柱を約 5 mm の高さまでパターニングします。PDMS の残りの 25 g を、約 5 mm の高さまで柱のみをパターニングする 2 番目の SU-8 マスターに注ぎます (図 1C)。
- 両方のペトリ皿をオーブンに入れ、PDMS層を338 Kで1時間硬化させます。
- 硬化したPDMS層をメスでSU-8マスターのパターンの周りに切り、マスターからPDMS金型をそっと剥がします(図1D)。
注:レプリカ成形と呼ばれる上記の手順は、ガラス表面に取り付けられ、マイクロ流体デバイス53の一部となるPDMSの金型を調製するために頻繁に使用されている。このプロトコルでは、PDMS 金型はチップの一部ではありませんが、チップ製造の中間体として使用されます。各設計に対して、2つのPDMS金型がそれぞれのSU-8マスター(図1Dおよび1E)から調製され、マイクロチップの製造に応じて(下記に説明する)使用されます。
3. 透析チップ製造
- PDMS モールド パターニングは、硬質顕微鏡のガラス スライド (3 x 1 in. 標準サイズ) 上向きのパターンを使用して、チャネルとピラーの両方を上向きに配置します (図 1F)。タンパク質貯留層に対応する中央柱は、PDMS金型の水平面から垂直に45μmを超えています。
- 再生セルロース(RC)透析膜の乾燥片を切って分離し、ガラススライドに支持されているPDMSモールドの中央柱に堆積する(図1F)。
注:RC透析膜は市販されており、それに応じて分子量カットオフ(MWCO)が、研究対象のタンパク質の分子量と使用される沈殿物に応じて選択されます。RC透析膜の部分のサイズは、チップの設計に依存します。このプロトコルでは、タンパク質貯留層の容積が0.1または0.3μLである2つのプロトタイプが設計されている。これらの場合、透析膜片のサイズはそれぞれ2 x2mm2 または4 x 4 mm2である。 - ガラススライドに対応するPDMSモールドの上に下向きの柱のみをパターン化して第2のPDMSモールドを配置します(図1F)。この金型の中央柱はタンパク質貯留層に対応し、水平面から45μmの垂直(下向き)を超えます。
- 2 つの PDMS 金型の中央柱を位置合わせします。RC透析膜は、2つのPDMS型の間に「挟まれる」(図1G)。
注: 2 つの PDMS 金型のマイクロ構造間の位置合わせは、余分な装置なしで視覚的に実現できます。それ以外の場合、この操作は顕微鏡で達成することができます。流動路と入力または出力ポイントが完全にカバーされていない限り、貯水池間の小さなシフトは問題ありません。 - PDMS金型内の閉じ込められた気泡をすべて除去し、製造の次のステップ中に樹脂の挿入を促進するために、真空チャンバーで30分間アセンブリを乾燥させます。
注:2つのPDMS金型はPDMS-PDMS接着によって所定の位置に保たれ、余分な圧力またはその他の一時的な接合方法は必要ありません。 - 2つのPDMS金型間の空きスペースを、毛細管インビビジョンで光硬化性のチオレイン系樹脂NOA 81で埋める(図1Hおよび1I)。
- コリメートUVランプ(パワー35mWcm-2)を用いて8sのUV光(365nm)に曝露して樹脂を硬化させる。
注: この最初の露出は、両側のPDMS金型に接触するNOA 81の薄い層が未硬化のままであるため、NOA 81樹脂を部分的に架橋することができます。 - PDMS金型の外部側面から、NOA 81の過剰をメスで切ります。
- 下部のPDMS金型とガラススライドから部分的に架橋されたNOA 81が貼り付けられた上部PDMSモールドを取り外します。
- 顕微鏡用ガラススライド(3 x 1インチ)の標準寸法で厚さ175μmのPMMAシートを切り取り、PMMAピースの両側からプラスチック保護シートを剥がします。上部PDMS金型のアセンブリと、部分的に硬化したNOA 81をPMMAピースにそっと押し込みます(図1J)。
- 60sのUV光に曝露して再びNOA 81を硬化させ、上部PDMS型を取り除く(図1K)。樹脂は、それ以上の処理を行うことなくPMMA基板に付着する。
注:PDMS金型は、イソプロパノールとアセトンで洗浄した後、金型が曲がっていない限り、約5回まで再利用することができます。RC透析膜はNOA 81のステッカーに組み込まれ、それ以上の操作または機械的なクランプは必要とされない。
4. 流体コネクタ
注:マイクロ流体チップの設計は、結晶化溶液用の線形流体チャネルとタンパク質サンプル(タンパク質リザーバー)の中央リザーバから構成され、いずれも 図2Aの2つのマイクロチップの上図から示されている。RC透析膜はこれら2つの微細構造(図2D)の間に埋め込まれ、結晶化プロセスは、結晶化溶液からの沈殿物が膜を横切って拡散しながら進化し、膜によって分離されたチップの2つの区画間の濃度勾配によって広がる。マイクロ流体チャネルは、下部PDMSモールド(図1F)に刻印される。チップの製造プロトコルが完成すると、図 1Kに示すように、線状チャネルは、PMMA基板と接触するNOA 81ステッカーの底層に位置する。結晶化溶液の入口と出口アクセスポイントは、線形チャネルの両端に位置し、 図2Aに示すように穴(全高さ90μm)のように見えます。結晶化液の取り扱いのためには、アクセスポイントにコネクタを追加する必要があります。
- 高速エポキシ接着剤を用いたマイクロ流体チャネルの入口および出口に市販されている結合コネクタ(NanoPort)
- コネクタのサイズに基づいて PTFE チューブの適切な直径を選択します。PTFEチューブは、チップの流動流路における結晶化溶液の導入に使用されます。
注:市販のキットは流量を容易かつ正確に制御するために推奨され、通常は混合および流体処理のための自動化された圧力駆動または流動制御(シリンジポンプ)システムと組み合わされる。しかし、結晶化溶液は、使い捨てプラスチックシリンジを用いてリニアチャネルに手動で導入することができる。この場合、手順 4.3 ~ 4.5 が推奨されます。 - 1 mL の使い捨てのシリンジに結晶化液を充填します。このプロトコルで提示されるチップの場合、400 μL で流動チャネル全体を満たします。
- 片方の先端の直径が、溶液の取り扱いに使用されるPTFEチューブの内径と等しくなるように、2つのピペットチップをカットします。チャンネルのアクセス ポイントに、切り抜いたヒントを高速エポキシグルーで接着します(図 2B)。
- 適切なサイズのPTFEチューブの一部と切り抜かれた先端とシリンジを接続し、常にゆっくりとシリンジプランジャーを押すことによって、チャネル内のソリューションを導入します。
5. タンパク質カプセル化
注:タンパク質貯蔵所として使用されるチップのパターンは、これまでのところ大気に開いたままです。以下のプロトコルは、タンパク質サンプルをマイクロ流体チップ内に慎重に閉じ込めるために提案される。
- 図2Eに示すように、RC透析膜の真上に位置するタンパク質貯蔵所の内部にタンパク質サンプルの液滴を手動でピペット。タンパク質サンプルの容量はチップの設計によって異なり、0.1 μLまたは0.3 μLになります。
- タンパク質貯留層の周りに高真空シリコーングリースの薄い層を塗布します。
- 厚さ175μmのPMMAシートの小片を切り、シリコーングリースの薄い層の上にそっと置きます。PMMAの部分は、タンパク質溶液が沈着するタンパク質貯留層の表面全体を覆わなければならない。
注:シリコーングリースは気密性を高め、タンパク質の液滴の拡散を防ぐために使用されます。タンパク質貯留層とNOA 81ステッカーをカバーするために使用されるPMMAピース間の結合またはシールはありません。それらの間の接触は固体/固体の界面である。タンパク質サンプルの全体的なシールおよび気密封入を生成するために、ステップ5.4に記載されているようにカプトンテープの一部が使用される。
注:流体チャネル内の結晶化溶液の導入に圧力駆動系を使用する場合、デバイスの専用の空洞(タンパク質貯留層)内にタンパク質サンプルを閉じ込めるのが困難な場合があります(ステップ6.4)。上記の問題を回避するために、結晶化液を循環しながら比較的低い圧力値を維持すべきである。より粘性溶液(PEGs、グリセロール)の水溶液用20〜60mbarまたは50〜150mbarの注入圧力が示唆される。 - タンパク質貯留層の上に設定されたPMMAピースを覆い、すべてのエッジの周りにNOAチップに貼り付けるのに十分な大きさのカプトンテープ(厚さ20μm)をカットします。タンパク質サンプルはリザーバ内にカプセル化され、 チップは、図2Cに示すように、結晶化実験に使用する準備ができています。
注:チップは、透析膜とPMMA基板上のNOAの接着が劣化していない限り、数回再利用することができます。チップのこれらの部分が破損している場合、デバイスが使用できなくなったことを確認するリークが発生します。チップを洗浄する場合は、結晶化液に依存します。低粘度溶液(塩、緩衝液)の場合、流体チャネルは蒸留水を導入するだけで洗浄し、数分間流し込むことができます。400 μL は、チャネル内のソリューションを別のソリューションと完全に交換するために必要なボリュームです。より粘性溶液(PEGs、グリセロール)の場合、水だけでチャネルを洗浄するだけでは十分でないため、チップの再利用は推奨されません。チップの上部は、タンパク質貯蔵所が位置し、蒸留水で洗浄し、加圧空気で乾燥させることもできます。
6. オンチップタンパク質の結晶化
- 凍結乾燥した鶏卵白溶解酵素粉末を秤量し、蒸留水に溶解して30mgmL-1の最終濃度を得た。
- 0.22 μmのフィルターと遠心分離機を通して、293 Kで最高速度で 5 分間タンパク質溶液をフィルター処理し、すべての固体粒子を除去します。結晶化実験には上清を使用します。
- バッファーと沈殿物を含む500 μLの結晶化溶液を 表1に設けた濃度で調製する。0.22 μmフィルターを使用して、溶液をフィルター処理します。
- ステップ 4.1 から 4.5 で説明されているように、シリンジまたは自動圧力駆動の流体システムまたはシリンジ ポンプを使用して、チップの入口点に溶液を注入します。
注: 結晶化実験は、マイクロ流体チャネルが結晶化溶液で満たされ、一定の流量でチャネル内に連続的に注入される場合、流れる条件下で、静的な条件下で発生する可能性があります。後者の場合は、外圧駆動システムまたはシリンジポンプの使用をお勧めします。流動条件下での実験の実現は、流体チャネル内で結晶化溶液を動的に交換する可能性も提供する。これにより、同じタンパク質サンプルを用いた間に複数の実験を行うことができる。 - 流体チャネルに結晶化液が充填されたら、チップの入口ポートと出口ポートをパラフィルムテープで密封します。
- タンパク質貯留層内のタンパク質溶液の適切な容積をピペットし、ステップ5.1〜5.4に記載されているようにタンパク質サンプルを封入する。
- チップは293 Kで保管してください。
注:透析による結晶化は、蒸気拡散法やバッチ結晶化で行われた実験とは異なる運動軌道に従い、拡散プロセスに関与する沈殿分子の性質に大きく依存し、測定データ51によれば、核形成が開始するにはより多くの時間がかかる可能性がある。蒸発を防ぐために、もしあるならば、この期間中、293Kの湿気飽和雰囲気の中にチップを置く。
7. オンチチュ およびオンチップX線回折
- ビームラインの3Dプリントサポート
- 最大3チップを同時に運ぶことができるサポートを印刷します。支持体の寸法は、プレートX線回折実験で互換性のある市販の結晶板(96ウェル/SBS標準)の寸法と同じです。
注: サポートの印刷は、商用サービスに割り当てることができます。このサポートは、3D-CAD設計ソフトウェアを使用して設計され、オンチップタンパク質結晶化実験中の図3Aと、BM30A-FIP(ESRF)でのX線回折データ収集中の図3Bに示されています。 - 単一または両面テープでサポート上の透析チップを安定させる。
- 最大3チップを同時に運ぶことができるサポートを印刷します。支持体の寸法は、プレートX線回折実験で互換性のある市販の結晶板(96ウェル/SBS標準)の寸法と同じです。
-
その時 X線回折
- タンパク質貯留層で成長した結晶から室温でX線回折データを収集します。たとえば、エネルギー 12.656 keV、3.32 x 1010 フォ トン s-1 のフラックス、ビーム サイズ 250 x 250 μm2の X 線を使用します。315 x 315 mm2 および 9.4 メガピクセル解像度のアクティブサーフェスの 3 x 3 CCD のマトリックスを持つ ADSC Quantum 315r 検出器を使用して回折画像を記録します。
注:透析チップで成長したリソチーム結晶の回折データは、欧州放射光施設(ESRF)のBM30A-FIPビームラインで収集されました。しかし、ビームサイズ、フラックスおよび検出器タイプは、他のX線放射源において異なっていてもよい。3Dプリントのサポートは、結晶の周りに-40°から+40°の角度範囲でデータ収集を可能にします。その 場で のデータ収集のために露出したリソチーム結晶の数、各結晶について収集された回折パターンの数、露光当たりの振動角範囲および露光時間を 表2にまとめた。
- タンパク質貯留層で成長した結晶から室温でX線回折データを収集します。たとえば、エネルギー 12.656 keV、3.32 x 1010 フォ トン s-1 のフラックス、ビーム サイズ 250 x 250 μm2の X 線を使用します。315 x 315 mm2 および 9.4 メガピクセル解像度のアクティブサーフェスの 3 x 3 CCD のマトリックスを持つ ADSC Quantum 315r 検出器を使用して回折画像を記録します。
- データ処理
- XDSプログラム48を使用して、リソチーム結晶の回折パターンを使用して完全または部分的なデータセットを処理します。
- 各データセットのHKLファイルを生成し、XSCALEソフトウェア48を使用してそれらをスケーリングします。
- CPP4スイート49 のプログラムPhaserで分子置換を使用し、モデル構築のフェーズを決定します。このステップでは、タンパク質データバンク(PDB)エントリ193Lからリソザイムの既知の3D座標を使用します。
- Phenix52 を使用して構造を改良し、最終的なタンパク質モデルを COOT50を使用して検査します。
結果
Juniusら19,45で開発されたマイクロ流体チップは、マイクロ透析法によるオンチップタンパク質の結晶化と、室温でのX線回折データ収集の両方に対応しています。マイクロチップ、その詳細な設計、流体コネクタ、およびRC透析膜の図を図2に示します。結晶化実験は、タンパク質サンプルをタンパク質貯蔵所に直接配管し、自動圧力駆動システムまたはシリンジポンプで線形流体チャネルに結晶化溶液を導入するか、または注射器の助けを借りて手動で導入することによって設定されます。タンパク質貯留層と流体チャネルは、図2Aで区別することができる。タンパク質貯留層の最大体積が0.1μLまたは0.3μLのチップを製造するための設計は、それぞれ左右の図2Aに示されています。タンパク質サンプルに対して0.2 μLまたは0.7 μLの最大容量のチップが他の場所に示されています 19.デバイス製造用プロトコルのハイライトは、種々のMWCOSの市販のRC透析膜を埋め込む光硬化性チオレイン系樹脂NOA 81の使用に絞り込むことができる。マイクロ流体デバイスの製造中に、直線的な流体チャネルが底部PDMS型(図1F)に刻印され、上部PDMS型はタンパク質貯留層および流入口および出口ポートのパターン化された柱のみで構成される(図1F)。NOA 81が架橋され、PDMS金型がアセンブリから取り外されると(図1K)、流体チャネルはマイクロチップの底層に位置し、タンパク質チャネルおよびインレット/出口ポートは両方の層に配置されます。図1Lは、デバイスのすべての層およびそれぞれの厚さが示されている透析チップの側面図を示す図である。チップの最下層(流動チャネル)に刻印されたパターンの高さは約45μm、入口ポートと出口ポートの全高は約90μmです。タンパク質貯留層(高さ45μm)も図2Dおよび2Eに示されている。2つの層のアライメントを光学顕微鏡下で調べたところ、マイクロチップ内に組み込まれたRC透析膜の部分を図2Dで明確に区別することができる。同じ図では、タンパク質貯留層の左上部分に見られるように、結晶化溶液の注入中に空気が流体チャネル内に閉じ込められている。図2Eは、プロトコルのステップ5.2および5.3に記載されているように、ピペットでタンパク質液滴を手動で堆積させた後、およびPMMAおよびKaptonテープで液滴をカプセル化する前のタンパク質貯留層のクローズアップ写真である。結晶化実験に使用できるマイクロ流体チップを、タンパク質試料の封入および流体コネクタの接着後、図2Cに示す。気密アセンブリは漏出が起こらないことを保障する。マイクロ流体チャネルの入口および出口ポート用の流体コネクタは、プロトコルのステップ4.1に記載されている市販のもののいずれかであり、図2Cに示すように、または使い捨て可能な実験室ピペットチップは、同じ目的に使用することができる(図2B、プロトコルステップ4.4)。
マイクロ流体チップの製造のために、光学的に透明で生物学的に不活性な材料が選ばれ、室温でのX線回折実験において高い適合性を示した。X線の相互作用、吸収および散乱、マイクロ流体装置を構成する材料と周囲の大気(空気)は、バックグラウンドノイズと呼ばれる信号を生成します。このノイズは、検出器によって記録されたタンパク質結晶の回折信号を合計し、信号対雑音比を減衰させ、X線回折データ収集中に可能な限り低く維持する必要があります。X線ビームの直接経路にあるタンパク質貯留層を含む材料によって発生するバックグラウンドノイズを評価しました。タンパク質貯留層は、RC透析膜、カプトンテープと2つのPMMAピースで構成され、1つはマイクロチップの基質として使用され、1つはタンパク質サンプルのカプセル化に使用される。PMMAの厚さは2 x 175 μm、カプトンテープは20μm、RC透析膜は約40μmの厚さ(図1L)である。これらの層の総厚さは約410μmで、NOA 81層は直接X線経路に入っていません。製造材料の厚さとは別に、X線散乱は元素原子数とともに増加するので、その密度はバックグラウンド散乱ノイズを測定するためにも重要です。このため、ヘリウムフラックス(ESRFでBM30A-FIPで提供される特徴)は、材料特性評価およびタンパク質回折実験のためにデータ収集中に空気の代わりに使用されました。図3Cは、カプトンテープ、RC透析膜、PMMAシート、およびヘリウム雰囲気中のそれらの組み立てによって発生するバックグラウンドノイズを示す。各材料を20sのX線に対して0.98Å波長、試料検出器距離は200mmであった。実験は、プロトコルのステップ7で説明したように、ESRFのBM30A-FIPビームラインで行われた。X線ビームと材料との相互作用に起因する拡散リングは、4Åより低い解像度でカプトンテープ、4-8 Å間のPMMAシート、および4〜5Å解像度間の透析膜について区別することができる。透析チップによって発生するバックグラウンドノイズは、主に6Åより低い解像度で観察され、大きなリゾチーム結晶の高分解能回折データの処理に影響を与えません。マイクロチップと個別の材料に対する解像度の関数としての背景散乱強度は、他の場所に19を示す。図3Cに示す測定では、透析チップは溶液(タンパク質または沈殿液)の空であり、バックグラウンドノイズに対する溶液の存在の寄与は測定されていない。チップは、X線ビームの前に、その場で回折実験19のために設計された3Dプリントされた支持(図3B)を用いて取り付けた。しかし、96-well/SBS標準結晶化板の寸法と同じ支持体は、同時に3個までのチップを同時に保持することができるため、1〜3個の結晶化実験を同時に行うために使用することができる(図3A)。
マイクロジアルシス法によるモデル可溶性タンパク質のオンチップ結晶化に対するマイクロ流体デバイスの効率を評価する実験を行った。この流体チャネルは、プロトコルのステップ4に記載されているように充填され、ステップ5および6は、専用タンパク質貯蔵所内にタンパク質サンプルをカプセル化する方法と、結晶化実験を設定する方法を説明した。図4は、293Kで1.5Mの塩化ナトリウム(NaCl)下で成長したリソチーム結晶を示し、0.1 M酢酸ナトリウム(CH 3COONa)pH 4.0(A)および1M NaClの下、0.1 M CH3クーナpH4.5 30%ポリエチレングリコール(PEG)400(B)を示す。凍結乾燥したライゾチーム粉末を、図4Aおよび4Bに示す実験のために、最終濃度の〜30mgmL-1または20mMCH3COONa pH 4.2緩衝液中に水に溶解した。両方の実験でタンパク質サンプルの体積は約0.3μLであり、マイクロチップ内に埋め込まれたRC透析膜のMWCOは6〜8kDaの範囲にある。図3Aに示すリソチーム結晶は1時間以内に成長し、図3Bの結晶は実験の発症から30分以内に成長した。結晶化実験は、静的条件下で行った。しかしながら、流動条件下で実験を行うことは、結晶化条件を動的に交換し、段階図を研究し、マイクロ透析法の可逆性を検証する可能性を示す19。
その時図4Aに示すリソチーム結晶からのX線回折データを収集し、このような実験に対する透析チップの適合性を実証した。データ収集は、プロトコルのステップ7.2.1に記載されているように、室温でBM30A-FIPビームライン(ESRF)で行った。マイクロチップを3Dプリントされた支持体(図3B)の助けを借りてビームラインに取り付けられ、完全なX線回折データセットを、表1の2行目で与えられた条件下でオンチップで成長させた2つの単一のリソチーム結晶から収集した。観測されたデータセットの反射は、XDS48を用いて処理、インデックス化、統合され、分子置換と改良は、それぞれPhaser49とPhenix52を使用して達成された。各リソチーム結晶の完全なデータセットと2つのデータセットのマージに関する結晶学的統計量を表2に示します。分子置換のために、PDBエントリ193Lが使用された。
単一のリゾチーム結晶からの電子密度マップと2つの結晶の結合されたデータセットはそれぞれ1.95Åおよび1.85Åで得られており、図5Aおよび5Bに示されている。どちらの電子密度マップも、単結晶または複数結晶から室温で透析マイクロチップに直接行われたSitu X線回折実験で得ることができる詳細な構造情報を示し、その場X線結晶学研究においてチップに適合する結果を示す。
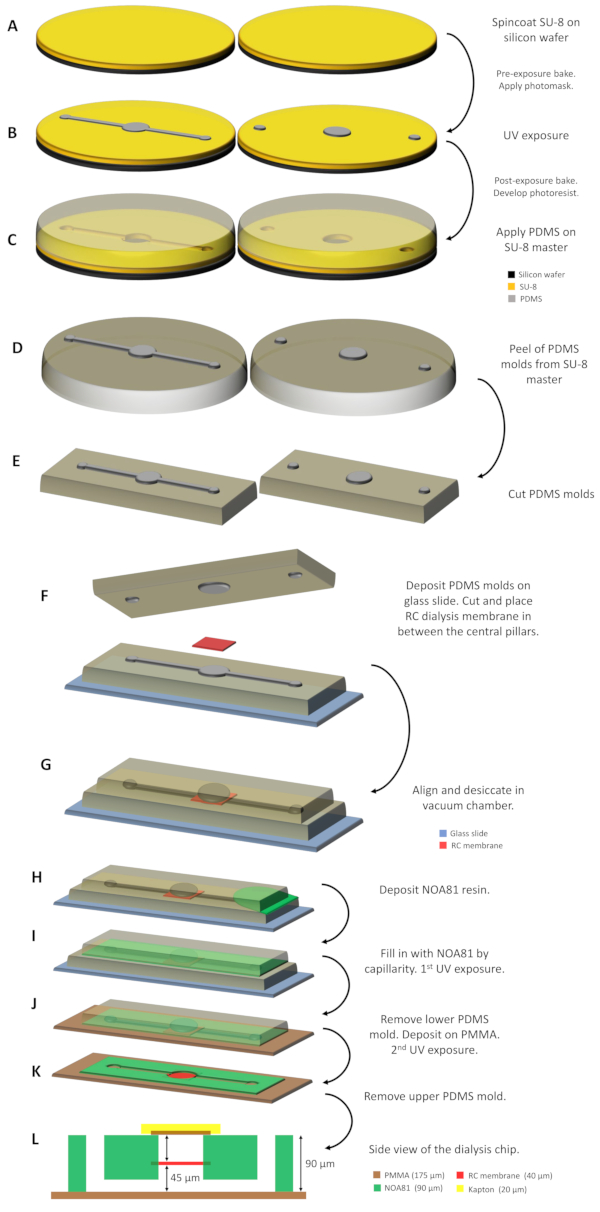
図1:透析チップ製作の模式図(A)SU-8樹脂を2つのシリコンウエハーに堆積させ、スピンコートした。(B)UV光をフォトマスクで照射し、未露光部品を開発した後、SU-8マスターを取得する。(C)PDMSはSU-8マスターに分配され、338Kで1時間硬化した後、(D)レプリカ成形とインプリンティングによって製造された2つのPDMS金型は、マスターの剥離され、(E)適切なサイズに切断される。(F)PDMS金型は、2本の中央柱の間にRC透析膜を組み込んだガラススライド上でサポートされています。(G)2つのPDMS型は真空チャンバーで30分の間、整列し、乾燥させる。(H)NOA 81樹脂は2つの金型の間に流され、(I)は毛細血管によって空間を満たす。(J)UV光への最初の露出後、底部PDMS金型を除去し、アセンブリをPMMAシートに堆積させます。(K)第2のUV露光は、NOA 81樹脂を完全に重合するために続き、残りの上部PDMS金型を除去した後、透析チップはすぐに使用できます。(L)デバイスのすべての層とそれぞれの厚さが示されている透析チップの側面図。この図の大きなバージョンを表示するには、ここをクリックしてください。
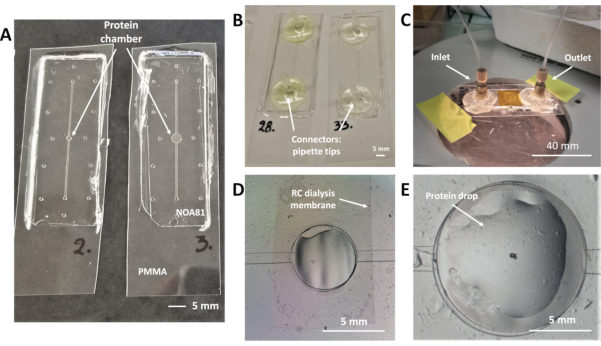
図2:オンチップタンパク質結晶化およびX線回折実験用のRC透析膜を埋め込んだ透析チップ(A)175μm厚いPMMA基質上のNOA 81マイクロチップ、タンパク質貯留部0.1μL(左)、公称体積0.3μL(右)(B) 流体チャネルの入口および出口ポートに流動コネクタが接着されたピペットチップを備えたマイクロチップ。(C) 結晶化実験中のマイクロチップの画像。タンパク質サンプルは、厚さ175μmのPMMAシートとカプトンテープでカプセル化されています。ピークナノポートコネクタは、流体チャネルの入口ポートと出口ポートに使用されます。(D) 流体チャネル内の結晶化溶液の循環中のタンパク質貯留層のトップビュー。空気はRC透析膜の下の貯水池の上部に閉じ込められ、明確に検出することができます。(E)タンパク質サンプルの蒸着中に光学顕微鏡を通した透析貯留層のトップビュー。タンパク質液滴は、埋め込まれたRC透析膜のすぐ上に堆積する。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3: 結晶化実験で用いたマイクロチップ用の3Dプリントサポート(A)と、ESRFのBM30A-FIPビームラインでのX線ビームの前に取り付けられた(B)を、その場でのX線回折実験に用いる。(C)カプトン、RC透析膜、PMMA、および透析チップ(左から右)とのX線の相互作用によって発生するバックグラウンドノイズ。この図の大きなバージョンを表示するには、ここをクリックしてください。
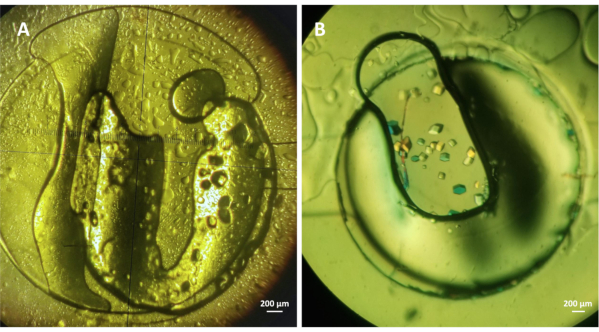
図4: マイクロ透析法によるリソザイムのオンチップ結晶化(A)1.5 M NaCl下でオンチップ成長した結晶(30mg mL-1)結晶と0.1 M CH3COONa pH 4.0および(B)リソザイム(〜20 mg mL-1)結晶は1M NaCl、0.1 M CH3COONa pH 4.5、および30%PEG40を含む結晶化条件下で成長する。両方の実験は293 Kで行われました。

図5:(A)単結晶からの精製リゾチーム構造の電子密度マップと(B)マイクロ透析を介してオンチップで成長した2つの結晶の結合データセット。 マップは、それぞれ1.95 Åと1.84 Åで得られ、1σで輪郭を描きました。 この図の大きなバージョンを表示するには、ここをクリックしてください。
| 蛋白質 | タンパク質濃度 (mg mL-1) | プロテインブッファー | 初期濃度 沈殿液 | RCのMWCO 透析膜 (kDa) | 温度 (K) | ||
| リゾチーム | 〜30 | 水 | 1.5 M ナクル 0.1 M CH3クーナ pH 4.0 | 6 - 8 | 293 | ||
| リゾチーム | 〜 20 | 20 mM CH3クーナ pH 4.2 | 1 M ナクル 0.1 M CH3クーナ pH 4.5 30% PEG 400 | 6 - 8 | 293 | ||
表1:タンパク質緩衝液と、マイクロジアルシス法によるリソザイムのオンチップ結晶化のための沈殿液の組成。 第2ラインで提供される条件でオンチップで成長したリソチーム結晶を 、situ X線回折データ収集に使用した。
| 蛋白質 | リゾチーム | リゾチーム | リゾチーム |
| 結晶の数 | 1 | 1 | 2 |
| 回折フレームの数 | 40 | 30 | 70 |
| 露出当たりの振動(°) | 1 | 1 | |
| 露光時間(複数可) | 30 | 30 | |
| 温度 (K) | 293 | 293 | 293 |
| スペースグループ | P43212 | P43212 | P43212 |
| 単位セル パラメータ | 78.86 78.86 37.87 90.0 90.0 90.0 | 79.17 79.17 37.95 90.0 90.0 90.0 | 78.47 78.47 37.65 90.0 90.0 90.0 |
| 解像度の範囲 (Å) | 27.31 - 1.95 (2.02 - 1.95) | 27.39 - 1.96 (2.03 - 1.96) | 27.17 - 1.85 (1.91 - 1.85) |
| モザイク(°) | 0.319 | 0.121 | |
| 総反射数(観測) | 25127 (3552) | 19991 (3001) | |
| 固有の反射(観察) | 8641 (1357) | 8295 (1321) | 10404 (975) |
| レデューダンシー | 2.90 (2.61) | 2.41 (2.27) | |
| 完全性 (%) | 95.0 (94.8) | 91.9 (93.3) | 98.23 (93.15) |
| 平均I/σ | 6.83 (1.16) | 7.09 (1.66) | 3.7 |
| CC(1/2) | 99.1 (42.4) | 97.9 (37.0) | 97.0 |
| R マージ | 0.184 | ||
| R-meas | 0.139 | 0.221 | 0.219 |
| R-ピム | 0.116 | ||
| 絞り込みで使用される反射 | 8645 (787) | 8451 (857) | 10391 (965) |
| R フリーに使用される反射 | 864 (78) | 846 (85) | 1039 (96) |
| Rワーク | 0.1988 (0.2968) | 0.1853 (0.2872) | 0.1839 (0.3102) |
| Rフリー | 0.2430 (0.3437) | 0.2297 (0.3622) | 0.2207 (0.3703) |
| 非水素原子数 | 1069 | 1071 | 1096 |
| 高分子 | 1012 | 1012 | 1012 |
| 水 | 55 | 57 | 82 |
| リガンド | 2 | 2 | 2 |
| タンパク質残基 | 131 | 131 | 131 |
| Rms(債券、Å) | 0.008 | 0.009 | 0.005 |
| Rms (角度、°) | 1.17 | 1.26 | 1.05 |
| ラマチャンドランが好んだ (%) | 98.43 | 97.64 | 99.21 |
| ラマチャンドラン許可 (%) | 1.57 | 2.36 | 0.79 |
| ラマチャンドランの外れ値 (%) | 0.00 | 0.00 | 0.00 |
| アベガレBファクター | 34.26 | 28.54 | 24.34 |
| 蛋白質 | 33.94 | 28.14 | 23.62 |
| 水 | 40.23 | 35.57 | 33.16 |
| 配 位 子 | 33.23 | 29.63 | 24.77 |
表2:マイクロ透析法を用いてオンチップで成長したリソチーム結晶のデータ収集パラメータ、結晶構造および精製統計。 括弧内に指定された値は、最高解像度のシェルに対応します。4 番目の列は、2 番目と 3 番目の列のデータ セットをマージした後に取得された値に対応します。
ディスカッション
マイクロ流体デバイスは、マイクロ透析法によるオンチップタンパク質結晶化、室温でのX線回折実験を行うため開発されています。オンチップタンパク質の結晶化にマイクロ透析を使用するために、任意のMWCOのRC透析膜を組み込んだNOA 81チップを製作することができます。比較的高いX線透過性を有する製造材料が使用され、その部分タンパク質結晶学においてチップに適合する。装置のタンパク質結晶化用コンパートメント(PMMA、カプトン、RC透析膜)を構成する製造材料を評価し、低いバックグラウンドノイズを発生させる。具体的には、透析チップで発生するバックグラウンドノイズは、主に低分解能(>6Å)で観察され、タンパク質構造決定に必要な大きなリゾチーム結晶の高分解能回折データの処理には影響しません。データ収集の自動化は、高分子結晶学ビームラインに直接取り付けることができ、同時に3つのマイクロチップまで運ぶことができる3Dプリントサポートを使用して増幅されます。このようにして、脆弱なタンパク質結晶の手動収穫および操作が回避される。また、データ収集は室温で行われ、天然タンパク質構造2,3からの立体構造変化に関連する凍結保護の必要性を回避する。
マイクロ透析をオンチップで結晶を成長させる方法として使用することで、結晶化プロセスを正確に監視および制御することができます。導入で議論されるように、従来のタンパク質結晶化方法のほとんどは、マイクロ流体デバイス11,14を用いて実施されている。しかし、タンパク質結晶化に対する透析の利点は、マイクロスケールではまだ十分に活用されていませんでした。オンチップマイクロ透析は、同じタンパク質サンプル19で、相図を研究し、結晶化条件のスクリーニングおよび最適化を行う可能性を提供する。この研究で紹介するプロトタイプでは、チップ当たりのタンパク質消費量は0.1 μLまたは0.3 μLに制限されています。製造プロトコルは多くのステップを含むが、それは簡単であり、比較的安価な材料と、クリーンルームで1日で多数のデバイス(20〜30チップ)の製造を可能にする。しかし、タンパク質のオンチップ結晶化は、特にマイクロスケールにおける核生成および結晶成長の本質的な確率的性質のために微妙な手順であり得る。ケーススタディでは、リソチームの結晶化に十分に確立された条件が使用され、その場でX線回折データ収集に適した堅牢で明確な結晶が得られた。しかしながら、結晶化媒体がはるかに複雑で、相図が知られておらず、十分に働く結晶化条件がまだ確立されていない膜タンパク質のような、より困難なタンパク質標的の使用によって困難が生じる可能性がある。透析チップは、マイクロ流体チャネル内の結晶化溶液を交換するだけで、貴重で頻繁に高価なタンパク質サンプルを処分することなく、これらの困難を上回る可能性を提供し、チップ上のフェーズ図を研究します。
マイクロ流体デバイスの多様性は、結晶化条件を可逆的に制御し、低タンパク質体積を使用して濃度および温度変化相図をマッピングするために、オンチップタンパク質結晶化のためのマイクロ透析を利用することから生じる。さらに、この装置は 、Situ X線回折実験において互換性があり、デバイスのプロトタイピングは安価で迅速である。可溶性タンパク質および膜タンパク質の同形結晶(調製)の多くは、オンチップで成長することができ、これらすべての特徴は、シンクロトロンおよびXFEL施設での困難なタンパク質標的の連続X線結晶学研究に利用できることが期待される。最後に、オンチップと その時点で の時間解決された研究を行うことは、結晶学コミュニティにとって大きな関心事となり得る将来の可能性です。したがって、透析チップ上の結晶を成長させ、試薬をマイクロ流体チャネルに導入することで、手動(注射器を使用)または自動的に(圧力制御流体システムまたはシリンジポンプを使用)、マイクロ流体チップがシンクロトロンビームラインの時間分解実験を正常にトリガできることを証明することに焦点を当てます。
開示事項
著者らは開示するものは何もない。
謝辞
MBSは、契約インスツルメンテーションの下でのMI / CNRSのサポートを2014-2015の制限で認めています。NJは、CEAの国際博士研究プログラム(イルテリス)の博士フェローシップを認めています。MBSとSJは、マリー・スクウォトフスカ・キュリー交付金協定番号722687の下で、欧州連合(EU)のホライゾン2020研究イノベーションプログラムからの資金提供を認めています。MBS、SJ、NJは、マイクロファブリケーション実験のためのクリーンルームの設置に対するLIPhy(UGA)に感謝します。IBSは、グルノーブル学際研究所(CEA)への統合を認めています。
資料
| Name | Company | Catalog Number | Comments |
| 3 in wafer | Silicon Materials Inc. | Silicon wafer | |
| Centrifuge | Eppendorf | Minispin | Bench-top centrifuge |
| CleWin 3.0 | WieWeb software | Designing software | |
| Epoxy glue | Devcon | 5 minutes epoxy glue | |
| Fluidic connectors | Cluzeau Info Lab | N-333 | NanoPort kit for 1/16" OD tubing |
| Hen egg-white lysozyme | Roche | 10 837 059 001 | Lyophilized protein powder |
| High-vacuum silicone grease | Sigma-Aldrich | Z273554 | Dow Corning high-vacuum silicone grease |
| HMDS | Sigma-Aldrich | 440191 | Silane, chemical |
| Hot plate | Sawatec | HP-200-Z-HMDS BM | Hot plate |
| Isopropyl alcohol | Sigma-Aldrich | Solvent | |
| Kapton tape | DuPont | Polyimide tape | |
| Mask aligner | SUSS MicroTec | MJB4 | Mask aligner, UV source |
| Membrane filter | Millipore | GSWP04700 | 0.22 μm pore size filter |
| Microscope glass slide | Fisher Scientific | 12164682 | 3 x 1 in glass slides |
| NOA81 | Norland Products Inc. | NOA81 | Photocurable resin |
| Oven | Memmert | Oven | |
| Parafilm | Sigma-Aldrich | P6543 | Parafilm M roll size 20 in. × 50 ft |
| PDMS | Dow Corning | Sylgard 184 | Silicone |
| PEG 400 | Hampton Research | HR2-603 | Chemical |
| Petri dish | Sigma-Aldrich | P5731 | 100 x 15 mm |
| PGMEA | Sigma-Aldrich | 484431 | Developer |
| Plasma equipment | Diener Electronic | ZEPTO | Plasma treatment |
| PMMA | Goodfellow | 137-745-63 | PMMA sheets 150x150 mm, 0.175 mm thickness |
| Pressure driven system | Elveflow | OB1 MK3+ | Pressure/vacuum controller |
| PTFE tubing | Elveflow/Darwin microfluidics | LVF-KTU-15 | PTFE tubing roll 1/16" OD X 1/32" ID |
| RC dialysis membrane | Spectra/Por | Various MWCOs | |
| Scalpel | Swann-Morton | Carbon steel surgical blades | |
| Sodium acetate | Sigma-Aldrich | S2889 | Chemical |
| Sodium chloride | Sigma-Aldrich | 746398 | Chemical |
| Solidworks | Dassault Systemes | 3D-CAD designing software | |
| Spin coater | SPS | Spin150 | Wafer spinner |
| SU-8 3000 series | MicroChem Corp. | SU-8 3050 | Photoresist |
| Syringe | BD | 309628 | 1 mL Luer-Lok syringe |
| UV crosslinker | Uvitec | CL-508 | UV crosslinker |
参考文献
- Garman, E. F. Radiation damage in macromolecular crystallography: what is it and why should we care. Acta Crystallographica, Section D: Biological Crystallography. 66, 339-351 (2010).
- Henderson, R. The potential and limitations of neutrons, electrons and X-rays for atomic resolution microscopy of unstained biological molecules. Quarterly Reviews of Biophysics. 28 (2), 171-193 (1995).
- Fraser, J. S., et al. Accessing protein conformational ensembles using room-temperature X-ray crystallography. Proceedings of the National Academy of Sciences of the United States of America. 108 (39), 16247-16252 (2011).
- Gotthard, G., et al. Specific radiation damage is a lesser concern at room temperature. IUCrJ. 6 (4), 665-680 (2019).
- Martin-Garcia, J. M., Conrad, C. E., Coe, J., Roy-Chowdhury, S., Fromme, P. Serial femtosecond crystallography: A revolution in structural biology. Archives of Biochemistry and Biophysics. 602, 32-47 (2016).
- Gicquel, Y., et al. Microfluidic chips for in situ crystal X-ray diffraction and in situ dynamic light scattering for serial crystallography. Journal of Visualized Experiments: JoVE. (134), e57133 (2018).
- Chapman, H. N., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470, 73-78 (2011).
- Hunter, M. S., et al. Fixed-target protein serial microcrystallography with an x-ray free electron laser. Science Reports. 4, 6026 (2014).
- Pawate, A. S., et al. Towards time-resolved serial crystallography in a microfluidic device. Acta Crystallographica, Section F: Structural Biology Communications. 71, 823-830 (2015).
- Owen, R. L., et al. Low-dose fixed-target serial synchrotron crystallography. Acta Crystallographica, Section D: Structural Biology. 73, 373-378 (2017).
- Leng, J., Salmon, J. -. B. Microfluidic crystallization. Lab on a Chip. 9, 24-34 (2009).
- Morel, M., Galas, J. -. C., Dahan, M., Studer, V. Concentration landscape generators for shear free dynamic chemical stimulation. Lab on a Chip. 12, 1340-1346 (2012).
- Miralles, V., Huerre, A., Malloggi, F., Jullien, M. -. C. A review of heating and temperature control in microfluidic systems: techniques and applications. Diagnostics. 3, 33-67 (2013).
- Sui, S., Perry, S. L. Microfluidics: from crystallization to serial time-resolved crystallography. Structural Dynamics. 4, 032202 (2017).
- Hansen, C. L., Sommer, M. O. A., Quake, S. R. Systematic investigation of protein phase behavior with a microfluidic formulator. Proceedings of the National Academy of Sciences of the United States of America. 101 (40), 14431-14436 (2004).
- Laval, P., Lisai, N., Salmon, J. -. B., Joanicot, M. A microfluidic device based on droplet storage for screening solubility diagrams. Lab on a Chip. 7, 829-834 (2007).
- Shim, J. -. U., et al. Control and measurement of the phase behavior of aqueous solutions using microfluidics. Journal of the American Chemical Society. 129, 8825-8835 (2007).
- Selimovic, S., Gobeaux, F., Fraden, S. Mapping and manipulating temperature-concentration phase diagrams using microfluidics. Lab on a Chip. 10, 1696-1699 (2010).
- Junius, N., et al. A microfluidic device for both on-chip dialysis protein crystallization and in situ X-ray diffraction. Lab on a Chip. 20, 296-310 (2020).
- Greaves, E. D., Manz, A. Towards on-chip X-ray analysis. Lab on a Chip. 5, 382-391 (2005).
- Dhouib, K., et al. Microfluidic chips for the crystallization of biomacromolecules by counter-diffusion and on-chip crystal X-ray analysis. Lab on a Chip. 9, 1412-1421 (2009).
- Guha, S., Perry, S. L., Pawate, A. S., Kenis, P. J. A. Fabrication of X-ray compatible microfluidic platforms for protein crystallization. Sensors and Actuators B. Chemical. 174, 1-9 (2012).
- Sui, S., et al. Graphene-based microfluidics for serial crystallography. Lab on a Chip. 16, 3082-3096 (2016).
- Russo Krauss, I., Merlino, A., Vergara, A., Sica, F. An overview of biological macromolecule crystallization. International Journal of Molecular Science. 14, 11643-11691 (2013).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica, Section F: Structural Biology and Crystallization Communications. 70, 2-20 (2014).
- Zheng, B., Tice, J. D., Roach, L. S., Ismagilov, R. F. A droplet-based, composite PDMS/Glass capillary microfluidic system for evaluating protein crystallization conditions by microbatch and vapor-diffusion methods with on-chip X-ray diffraction. Angewandte Chemie. 43, 2508-2511 (2004).
- Talreja, S., Kim, D. Y., Mirarefi, A. Y., Zukoski, C. F., Kenis, P. J. A. Screening and optimization of protein crystallization conditions through gradual evaporation using anovel crystallization platform. Journal of Applied Crystallography. 38, 988-995 (2005).
- Hansen, C. L., Classen, S., Berger, J. M., Quake, S. R. A microfluidic device for kinetic optimization of protein crystallization and in situ structure determination. Journal of American Chemical Society. 128, 3142-3143 (2006).
- Schieferstein, J. M., et al. X-ray Transparent microfluidic platforms for membrane protein crystallization with microseeds. Lab on a Chip. 18, 944-954 (2018).
- Ghazal, A., et al. Recent advances in X-ray compatible microfluidics for applications in soft materials and life sciences. Lab on a Chip. 16, 4263-4295 (2016).
- Li, L., Ismagilov, R. F. Protein crystallization using microfluidic technologies based on valves, droplets, and SlipChip. Annual Review of Biophysics. 39, 139-158 (2010).
- Du, W., Li, L., Nichols, K. P., Ismagilov, R. F. SlipChip. Lab on a Chip. 9, 2286-2292 (2009).
- Zhang, S., et al. Microfluidic platform for optimization of crystallization conditions. Journal of Crystal Growth. 472, 18-28 (2017).
- Abdallah, B. G., et al. Protein crystallization in an actuated microfluidic nanowell device. Crystal Growth & Design. 16, 2074-2082 (2016).
- Monteiro, D. C. F., et al. A microfluidic flow-focusing device for low sample consumption serial synchrotron crystallography experiments in liquid flow. Journal of Synchrotron Radiation. 26, 406-412 (2019).
- de Wijn, R., et al. A simple and versatile microfluidic device for efficient biomacromolecule crystallization and structural analysis by serial crystallography. IUCrJ. 6, 454-464 (2019).
- Shim, J. -. U., Cristobal, G., Link, D. R., Thorsen, T., Fraden, S. Using microfluidics to decouple nucleation and growth of protein crystals. Crystal Growth & Design. 7, 2192-2194 (2007).
- de Jong, J., Lammertink, R. G. H., Wessling, M. Membranes and microfluidics: a review. Lab on a Chip. 6, 1125-1139 (2006).
- Paustian, J. S., Nery Azevedo, R., Lundin, S. T. B., Gilkey, M. J., Squires, T. M. Microfluidic microdialysis: spatiotemporal control over solution microenvironments using integrated hydrogel membrane microwindows. Physical Review X. 3, 041010 (2013).
- Kornreich, M., Heymann, M., Fraden, S., Beck, R. Cross polarization compatible dialysis chip. Lab on a Chip. 14, 3700-3704 (2014).
- Song, S., Singh, A. K., Shepodd, T. J., Kirby, B. J. Microchip dialysis of proteins using in situ photopatterned nanoporous polymer membranes. Analytical Chemistry. 76, 2367-2373 (2004).
- Skou, M., Skou, S., Jensen, T. G., Vestergaard, B., Gillilan, R. E. In situ microfluidic dialysis for biological small-angle X-ray scattering. Journal of Applied Crystallography. 47, 1355-1366 (2014).
- Zou, L., et al. A multistage dialysis microdevice for extraction of cryoprotectants. Biomedical Microdevices. 19, 30 (2017).
- Satya Eswari, J., Naik, S. A critical analysis on various technologies and functionalized materials for manufacturing dialysis membranes. Materials Science for Energy Technologies. 3, 116-126 (2020).
- Spano, M., Salmon, J. -. B., Junius, N. FR3044685A1. UJF. , (2015).
- Bartolo, D., Degre, G., Nghe, P., Studer, V. Microfluidic stickers. Lab on a Chip. 8, 274-279 (2008).
- Junius, N., et al. A crystallization apparatus for temperature controlled flow-cell dialysis with real-time visualization. Journal of Applied Crystallography. 49, 806-813 (2016).
- Kabsch, W. XDS. Acta Crystallographica, Section D: Biological Crystallography. 66, 125-132 (2010).
- Winn, M. D., et al. Overview of the CCP4 suite and current developments. Acta Crystallographica, Section D: Biological Crystallography. 67, 235-242 (2011).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and developments of COOT. Acta Crystallographica, Section D: Biological Crystallography. 66, 486-501 (2010).
- Apostolopoulou, V., Junius, N., Sear, R. P., Budayova-Spano, M. Mixing salts and polyethylene glycol into protein solutions: The effects of diffusion across semipermeable membranes and of convection. Crystal Growth & Design. 20, 3927-3936 (2020).
- Liebschner, D., et al. Macromolecular structure determination using X-rays, neutrons and electrons: recent developments in Phenix. Acta Crystallographica, Section D: Structural Biology. 75, 861-877 (2019).
- Xia, Y., Whitesides, G. M. Soft Lithography. Annual Review of Materials Science. 28, 153-184 (1998).
- Nogly, P., et al. Lipidic cubic phase injector is a viable crystal delivery system for time-resolved serial crystallography. Nature Communications. 7, 12314 (2016).
- Baxter, E. L., et al. High-density grids for efficient data collection from multiple crystals. Acta Crystallographica, Section D: Structural Biology. 72, 2-11 (2016).
- Feiler, C. G., Wallacher, D., Weiss, M. S. An all-in-one sample holder for macromolecular X-ray crystallography with minimal background scattering. Journal of Visualized Experiments. (149), e59722 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved