Method Article
Kristallisation von Proteinen auf Chip durch Mikrodialyse für In Situ-Röntgenbeugungsstudien
In diesem Artikel
Zusammenfassung
In diesem Papier wird das Herstellungsprotokoll von mikrofluidischen Chips erläutert, das für die Proteinkristallisation auf dem Chip mit der Dialysemethode und in situ Röntgenbeugungsexperimenten entwickelt wurde. Der Mikroherstellungsprozess ermöglicht es, eine semipermeable regenerierte Zellulosedialysemembran mit einem beliebigen Molekulargewichts-Cut-off zwischen zwei Schichten des Chips zu integrieren.
Zusammenfassung
Dieses Protokoll beschreibt die Herstellung von reproduzierbaren und kostengünstigen mikrofluidischen Geräten, die die gesamte Pipeline für kristallisierende Proteine auf dem Chip mit der Dialysemethode abdecken und in situ Einkristall- oder serielle Kristallographieexperimente bei Raumtemperatur ermöglichen. Das Protokoll beschreibt den Herstellungsprozess der Mikrochips, die Manipulation der On-Chip-Kristallisationsexperimente und die Behandlung der in situ gesammelten Röntgenbeugungsdaten für die strukturelle Aufklärung der Proteinprobe. Das Hauptmerkmal dieses Mikroherstellungsverfahrens liegt in der Integration einer kommerziell erhältlichen, halbpermeablen regenerierten Zellulosedialysemembran zwischen zwei Schichten des Chips. Die Molekulargewichtsabschaltung der eingebetteten Membran variiert je nach Molekulargewicht des Makromoleküls und den Niederschlagsfaktoren. Das Gerät nutzt die Vorteile der mikrofluidischen Technologie, wie z. B. die Verwendung von Kleinsten von Proben (<1 L) und die Feinabstimmung über Transportphänomene. Der Chip koppelte sie mit der Dialysemethode, die eine präzise und reversible Kontrolle über den Kristallisationsprozess bietet und kann zur Untersuchung von Phasendiagrammen von Proteinen auf der Mikroliterskala verwendet werden. Das Gerät wird mit einem photohärierbaren Thiolenharz mit weicher Impressumslithographie auf einem optisch transparenten polymeren Substrat gemustert. Darüber hinaus wurde die Hintergrundstreuung der Materialien, die die Mikrochips bilden und Hintergrundgeräusche erzeugen, ausgewertet, wodurch der Chip für In-situ-Röntgenbeugungsexperimente kompatibel gemacht wurde. Sobald Proteinkristalle auf dem Chip bis zu einer angemessenen Größe und Gleichmäßigkeit der Bevölkerung angebaut werden, können die Mikrochips mit Hilfe eines 3D-gedruckten Halters direkt vor dem Röntgenstrahl montiert werden. Dieser Ansatz geht die Herausforderungen an, die sich aus der Verwendung von Kryoprotektoren und der manuellen Ernte in konventionellen Proteinkristallographieexperimenten auf einfache und kostengünstige Weise stellen. Komplette Röntgenbeugungsdatensätze aus mehreren isomorphen Lysozymkristallen, die auf dem Chip angebaut wurden, wurden bei Raumtemperatur zur Strukturbestimmung gesammelt.
Einleitung
Die Aufklärerin der dreidimensionalen (3D) Struktur biologischer Makromoleküle ist ein unaufhörliches Streben in der Strukturbiologie, wo die Röntgenkristallographie nach wie vor die wichtigste Untersuchungstechnik ist. Es wird zur Entschlüsselung der strukturellen Details komplexer Makromoleküle wie Proteine eingesetzt und zielt darauf ab, das Verständnis ihrer Handlungsmechanismen und ihre Beteiligung an verschiedenen biologischen Funktionen zu erleichtern. Leistungsstarke Röntgenquellen bei Synchrotronen und Röntgen-Freie-Elektronen-Lasern (XFELs) bieten alle Werkzeuge, die für einen tieferen Einblick in die Struktur der Proteine bei nahezu atomarer Auflösung erforderlich sind. Trotz der Vorteile, die mit der Verwendung von Röntgenstrahlen für Strukturstudien verbunden sind, gibt es intrinsische Einschränkungen für Röntgenstrahlung und den Kristallisationsprozess selbst. Strahlungsschäden, die durch einen hohen Röntgenfluss und lange Belichtungszeiten des Proteinkristalls vor dem Röntgenstrahl hervorgerufen werden, sind restriktive Parameter, die Kristallographen mit kryogener Kühlung übertreffen müssen1. Die Suche nach den optimalen Kryokühlbedingungen kann jedoch mühsam sein, da konforme Veränderungen aus der nativen Proteinstruktur oder Artefakte nen verborgen werden können2,3. Darüber hinaus deuten neuere Studien darauf hin, dass die Durchführung von Beugungsexperimenten bei Raumtemperatur zu geringeren spezifischen Strahlenschäden führt4. Ein weiterer Engpass in der Strukturbiologie ist der Erwerb gut diffrierender Kristalle mit einer ausreichenden Größe5. Kleine Kristalle sind einfacher zu produzieren, insbesondere bei Membranproteinen, sind aber auch unter Kryokühlbedingungen anfälliger für Strahlenschäden, da eine hohe Strahlendosis in einem kleineren Volumen gerichtet werden muss als bei größeren Proteinkristallen6. Der neuartige Ansatz der seriellen Kristallographie7,8 bei Synchrotronen und XFELs kann die Retrains von Strahlungsschäden umgehen und gleichzeitig kleinere Kristalle (200 nm bis 2 m)7 nutzen, indem Datensätze aus mehreren, isomorphen und zufällig orientierten Proteinkristallen zusammengeführt werden und von den damit verbundenen technologischen Fortschritten wie Femtosekundenpulse, kürzeren Belichtungszeiten und mikrofokussierten Röntgenstrahlen5,7,9,10, profitiert werden.
Die mikrofluidische Technologie ist wertvoll für die Röntgenkristallographie und weist vielfältige Vorteile für die Kristallisation biologischer Makromoleküle und deren Strukturuntersuchungen auf. Die Durchführung von Kristallisationsexperimenten in mikrofluidischen Geräten erfordert geringe Mengen an Proteinproben, wodurch die Produktionskosten dieser hochwertigen Biomakromoleküle eingeengt werden und ein Hochdurchsatz-Screening und die Optimierung zahlreicher Kristallisationsbedingungen ermöglicht werden. Darüber hinaus ermöglicht das inhärente große Flächen-Volumen-Verhältnis im mikrofluidischen Maßstab und diffusionsbegrenzte Transportphänomene eine feine Kontrolle über Ströme und Temperatur- oder Konzentrationsgradienten11,12,13,14, um mikrofluidische Vorrichtungen zu rendern, die für den Anbau von gleichgroßen Kristallen geeignet sind und Phasendiagramme15,16,17,18,19untersuchen. Darüber hinaus weisen mikrofluidische Werkzeuge ein ausgeprägtes Potenzial auf, um eine weitere Hürde in der Proteinkristallographie zu überwinden, die die Probenabgabe ist, und die Notwendigkeit, Proteinkristalle vor ihrer Verwendung für Röntgenbeugungsexperimente zu behandeln und zu ernten. Die Methode der On-Chip- und In-situ-Röntgenkristallographie eliminiert die Kristallmanipulation und die mögliche Verschlechterung der Kristallqualität vor der Datenerfassung. Eine breite Palette von mikrofluidischen Chips, die für die In-situ-Röntgenproteinkristallographie kompatibel sind, wurden von vielen Forschungsgruppen entwickelt, entwickelt und getestet, die sich den damit verbundenen Einschränkungen stellen, die sich aus der Natur der Mikrofabrikationsmaterialien und ihren Wechselwirkungen mit Röntgenstrahlen14,19,20,21,22,23ergeben. Die Fertigungsmaterialien müssen optisch transparent, biologisch inert sein und eine hohe Transparenz gegenüber Röntgenstrahlung und ein optimales Signal-Rausch-Verhältnis bei der Datenerfassung aufweisen.
Die meisten kristallinierenden Methoden, die in der konventionellen Proteinkristallographie24,25 angewendet werden, wurden auch im mikrofluidischen Maßstab11,14 für die Chipkristallisation und in situ Röntgenbeugungsanalyse implementiert. Einfache, hybride oder mehrschichtige mikrofluidische Geräte mit Dampfdiffusion26, Verdampfung27, freie Grenzflächendiffusion (FID)28, Microbatch26oder sogar Aussaat29 wurden verwendet, um lösliche und Membranproteine zu kristallisieren. Hochdurchsatzabsiebung und Optimierung der Kristallisationsbedingungen können30,31 in gut basierten32, Tröpfchen-basierten33oder ventilbetätigten34 Geräten erreicht werden. In situ Röntgenbeugungsexperimente von anspruchsvollen Proteinzielen bei Raumtemperatur wurden in Mikrochips durchgeführt, die aus verschiedenen Materialien wie PDMS (Polydimethylsiloxan), COC (zyklisches Olefin-Copolymer), PMMA (Poly(Methylmethacrylat)) hergestellt wurden21,22,26,28,29, Graphenfolien23, Kapton35, Epoxidkleber6oder NOA (Norland Optical Adhesive)19 und die Transparenz der Materialien zur Röntgenstrahlung und ihr Beitrag zum Hintergrundrauschen wurden bewertet. Darüber hinaus wurden Mikrochips entwickelt, um die In-situ- und die seriellen Datenerfassungsstrategien in einem einzigen Werkzeug für Röntgenproteinkristallographie-Experimente an Synchrotronquellen23,35,36 und XFELs7zu koppeln.
Die Raumtemperatur-in-situ-Datenerfassung wurde auch in verschiedenen Bereitstellungsmethoden und -geräten implementiert. Zum Beispiel verwendeten Nogly et al.54 einen Lipid-Kubikphasen-Injektor (LCP), um die Struktur des lichtgetriebenen Photonenpumpenbakteriorhodopsin (bR) durch serielle Femtosekundenkristallographie (SFX) mit einer XFEL-Quelle zu untersuchen. Die Kristallstruktur von bR wurde auf eine Auflösung von 2,3 ° gelöst, was die Kompatibilität eines LCP-Injektors mit der zeitaufgelösten seriellen Femtosekundenkristallographie (TR-SFX) demonstriert. Baxter et al.55 entwarfen ein hochdichtes Multikristallgitter, hergestellt aus einem 100 oder 200 m dicken Polycarbonat-Kunststoff mit lasergeschnittenen Löchern in verschiedenen Größen. Bei Verwendung des Geräts für Sitz- oder Hängetropfenkristallisationsexperimente kann eine zusätzliche 5'm dicke Polycarbonatfolie an einer Seite des Gitters befestigt werden. Dieses Raster mit hoher Dichte kann auf verschiedene Arten verwendet werden, da Kristalle direkt auf die Anschlüsse des Geräts geladen werden können oder Kristalle auf dem Gerät durch Dampfdiffusion oder die LCP-Methode angebaut werden können. Darüber hinaus kann das Raster in einer Standard-Magnetbasis eingestellt und für die In-situ-Röntgendatenerfassung bei kryogenen oder Raumtemperaturbedingungen verwendet werden. In jüngerer Zeit entwickelten Feiler et al.56 einen Probenhalter für die makromolekulare In-situ-Röntgenkristallographie bei kryogener und Umgebungstemperatur mit minimalem Hintergrundgeräuschbeitrag. Konkret besteht der Halter aus einer Kunststoffstütze, einer transparenten COC-Folie und einer mikroporösen strukturierten Polyimidfolie. Es wurde entwickelt, um die häufig verwendeten Deckschlitten für die Einrichtung von Kristallisationstropfen zu ersetzen, während es eine in-place-Manipulation wie Ligandeneinweichen, komplexe Bildung und kryogenen Schutz ermöglicht, ohne den Kristallisationstropfen zu öffnen oder die Kristalle manuell zu handhaben. Darüber hinaus kann der Probenhalter von der Kristallisationsplatte entfernt und auf eine magnetische Basis für die In-situ-Datenerfassung an Standard-Goniometer-basierten Strahllinien gelegt werden. Für die Erfassung der Umgebungstemperaturdaten wird die COC-Folie vor dem Experiment entfernt und nur die 21 m dicke Polyimidfolie trägt zur Hintergrundstreuung bei, was in diesem Fall minimal ist. Diese Beispiele bilden nur einen kleinen Bruchteil der laufenden Forschung und die Vielzahl von vielseitigen Mikrochips, die für die Röntgenproteinkristallographie entwickelt wurden.
Die Dialyseproteinkristallisationsmethode ist jedoch in der Mikrofluidik nicht weit verbreitet. Dialyse ist eine diffusionsbasierte Methode, die auf den Ausgleich der Niederschlagskonzentration durch eine halbdurchlässige Membran abzielt, um sich der Nominalkonzentration für die Proteinkristallisation zu nähern und eine präzise und reversible Kontrolle der Kristallisationsbedingungen zu ermöglichen24. Der Molecular Weight Cut-Off (MWCO) der halbdurchlässigen Dialysemembran kann je nach Molekulargewicht des Makromoleküls und den Niederschlagsmitteln gewählt werden, um die Diffusion kleiner Niederschlagsmoleküle zu ermöglichen und gleichzeitig das von Interesse beinterestte Makromolekül beizubehalten. Aufgrund der Reversibilität des Dialyseprozesses kann es in Kombination mit temperaturgeregelter Temperaturregelung verwendet werden, um Die Keimbildung und das Kristallwachstum unabhängig voneinander zu entkoppeln und zu optimieren37 für die Untersuchung von Phasendiagrammen, indem die Niederschlagskonzentration verändert wird, während dieselbe Proteinprobe verwendet wird. Die Integration von Membranen in die Mikrofluidik wird von de Jong et al.38 überprüft und die Fallstudien in der Biologie, die Dialyse in Mikrochips implantieren, können hauptsächlich in Probenvorbereitungs-, Konzentrations- oder Filtrationsanwendungen39,40,41,42 oder zellbezogene Studien43,44aufgeführt werden. Pervaporation durch PDMS wurde von Shim et al.37 verwendet, um die Keimbildung und das Wachstum von Xylanase unter verschiedenen Bedingungen zu untersuchen. Das Wasser durchdrang die 15 m dicke PDMS-Membran in das Proteinreservoir des mikrofluidischen Geräts und veränderte anschließend das Protein und die Niederschlagskonzentration.
Das von Junius et al.19 ,45 entwickelte Protokoll zur Herstellung eines mikrofluidischen Chips, der sowohl für die On-Chip-Proteinkristallisation über Mikrodialyse als auch für in situ-Röntgenbeugungsexperimente bei Raumtemperatur kompatibel ist, wird vorgestellt. Das Protokoll für die Gerätefertigung ist direkt von der Pionierarbeit von Studer und Kollegen12,46 für mikrogemusterte Aufkleber aus fotohärtigem Thiolenharz NOA 81 inspiriert, die handelsübliche Membranen unter Verwendung von Soft-Impressum-Lithographie einbetten. Eine innovative Modifikation der Methode führte zu Mikrochips, die den Einsatz von Mikrodialyse ermöglichten, um die experimentellen Parameter für das On-Chip-Wachstum von Proteinkristallen genau zu überwachen und zu kontrollieren und gleichzeitig die Vorteile der Mikrofluidik zu nutzen, wie z. B. den reduzierten Verbrauch von Proteinproben pro Experiment (<1 L). In einer früheren Arbeit wurden die Prinzipien der Dialyse, die auf ein Makro-Skalensystem (typisches Volumen >20 L) zum Screening und zur Optimierung der Kristallisationsbedingungen durch Kartierung temperaturüberwindungsbedingter Konzentrationsphasendiagramme angewendet wurden,47demonstriert. In dieser Arbeit wird ein Protokoll zur Herstellung von Dialyse-Mikrochips mit regenerierten Cellulose (RC) Dialysemembranen verschiedener MWCO beschrieben, um Kristallisationstests auf DemChip und in situ Röntgenbeugungsdaten zu verarbeiten. Die Materialien, die die Mikrochips umfassen, wurden auf ihre Transparenz gegenüber Röntgenstrahlen19 untersucht und die Geräte können direkt vor dem Röntgenstrahl für Raumtemperatur-In-situ-Beugungsexperimente eingestellt werden, ohne die manuelle Handhabung und die Minimierung des Abbaus empfindlicher Proteinkristalle. In einer Fallstudie wurden Hühnerei-weiße Lysozymkristalle über Mikrodialyse, die eine gleichmäßig große Population erzeugt, auf Dem Chip angebaut. Der Mikrochip wurde dann vor dem Röntgenstrahl mit einem 3D-gedruckten Stütze19 montiert und komplette In-situ-Beugungsdatensätze wurden bei Raumtemperatur aus mehreren isomorphen Kristallen gesammelt, was das hohe Potenzial und die Relevanz der Chips für Synchromtron-Seriellkristallographiestudien an anspruchsvollen makromolekularen Zielen demonstriert.
Protokoll
1. Maskendesign und Master-Fertigung
- Zeichnen Sie die gewünschten Geometrien des mikrofluidischen Geräts mit einer beliebigen vektoriellen Zeichensoftware. Für jede Ebene des Photoresist, die für den nächsten Schritt der Photolithographie verwendet wird, bereiten Sie eine individuelle Maske vor: eine Maske mit Kanälen und Säulen und eine Maske, die nur die Säulen enthält.
- Übersetzen Sie die von der Zeichensoftware erzeugten CIF-Dateien in Filmfotomasken. Dies kann durch kommerzielle Dienstleistungen erfolgen. Benötigen Sie die entsprechende Fotomaske in Abhängigkeit von der Wahl des Photoresist während der Photolithographie verwendet.
HINWEIS: Bestellen Sie für den SU-8 photoresist Masken mit schwarzen Features auf transparentem Hintergrund. SU-8 ist ein epoxybasierter negativer Photoresist, was bedeutet, dass während der Uv-Lichtexposition (365 nm) die UV-exponierten Teile vernetzt sind, während der Rest löslich bleibt. Daher werden alle schwarzen Muster auf der Maske während der Photolithographie nicht durch UV-Licht vernetzt. Kanäle und Säulen werden auf die Meister eingraviert. - Bereiten Sie zwei Master auf Siliziumwafern für das Design jedes Chips durch Photolithographie mit SU-8 negativem Photoresist vor.
HINWEIS: Die Schritte 1.3.1-1.3.7 werden in einem Reinraum durchgeführt. Die unten beschriebenen Schritte sind die traditionellen Schritte der Photolithographie gefolgt von PDMS Soft Lithographie, die in vielen Lehrbüchern beschrieben werden. Alle Werte der experimentellen Parameter (Photoresist, Zeitdauer, Temperatur, etc.) hängen von vielen subtilen Parametern ab und müssen je nach verwendetem Gerät optimiert werden.- Verwenden Sie einen 3-Zoll-Silizium-Wafer und behandeln Sie die Oberfläche mit Plasma für 90 s, um die Abscheidung und Befestigung des SU-8 Photoresist zu erleichtern.
- Gießen Sie etwa 3 ml SU-8 Widerstand in der Mitte des Wafers und drehen Sie die SU-8 bis zur gewünschten Dicke(Abbildung 1A). Verwenden Sie für eine Nenndicke von 50 'm SU-8 3050 und Spincoat für 10 s bei 500 U/min und sukzessive für 30 s bei 3500 U/min. Backen Sie den Photoresist auf einer Kochplatte 15 min bei 368 K, um teilweise erstarrt zu werden, indem das im Harz enthaltene Lösungsmittel verdampft und verhindert wird, dass es auf der Fotomaske klebt. Danach den Wafer bei Raumtemperatur für 2 min lassen.
- Setzen Sie den Photoresist UV-Licht aus (Abbildung 1B). Verwenden Sie einen Maskenausrichter mit einer Leistung von 35 mW cm-2 und 8 s Belichtungszeit.
- Fahren Sie mit dem Backen nach der Belichtung fort. Legen Sie den Wafer für 5 min bei 368 K auf eine Kochplatte, um die durch die UV-Exposition ausgelöste Photoreaktion zu vervollständigen.
- Entfernen Sie alle SU-8-Widerstände, die nicht vernetzt waren, indem Sie den Wafer in ein Bad legen, das Propylenglykolmethyletheracetat (PGMEA) enthält, und rühren Sie ihn 15 min. Spülen Sie den Wafer mit Isopropanol, bis keine verschwommenen Niederschlag beobachtet werden können. Trocknen Sie den Wafer mit Stickstoffgas und lagern Sie ihn in einer Petrischale (100 mm x 15 mm Standardgröße).
- Behandeln Sie die Oberfläche des Wafers mit einem Silan, um die Ablösung von Polydimethylsiloxan (PDMS) zu erleichtern, das zur Herstellung von 2 Stempeln verwendet wird. Legen Sie den Wafer auf einer gezapften Kochplatte bei 368 K für 10 min unter der Dampfatmosphäre von Hexamethyldisilazan (HMDS) ab.
HINWEIS: Wenn das Abziehen des PDMS aus dem Wafer nach mehreren Verwendungen schwierig wird, sollte die Oberfläche des Wafers erneut mit HMDS-Dampf behandelt werden. - Der erste Master mit den Kanälen und säulen ist fertig. Wiederholen Sie diese Schritte, und bereiten Sie den zweiten Master vor, der nur die Pfeiler mustert.
HINWEIS: Während der Photolithographie besteht das Ziel darin, die Geometrien des Geräts auf den SU-8-Mastern mit einer Höhe von 50 m zu erhalten. Sobald die beiden SU-8-Master hergestellt sind, messen Sie jedoch die Höhe der geometrien, die auf den Mastern mit einem Profilometer eingraviert sind, um den experimentellen Wert zu erhalten. Der für dieses Protokoll hergestellte Messwert für beide SU-8-Master beträgt ca. 45 m.
2. PDMS Formen Herstellung
HINWEIS: Die folgenden Schritte des Protokolls können in jedem Labor durchgeführt werden, solange eine laminare Durchflusshaube verwendet wird, gelbes Licht im Raum bei der Arbeit mit dem NOA 81 Harz (Schritte 3.6-3.11) verwendet wird und eine UV-Lichtquelle für die Polymerisation des NOA 81 Harzes zur Verfügung steht (Schritte 3.7 und 3.11).
- 50 g PDMS-Silikonbasis und sein Aushärtungsmittel im Massenverhältnis von 10:1 vorbereiten.
- Mischen Sie beide Zutaten in einem Becher mit einem Spachtel und legen Sie die Mischung in eine Vakuumkammer, um alle Luftblasen zu entfernen.
- 25 g des vorgemischten PDMS in den SU-8 Master (in einer Petrischale gelagert) gießen und die Kanäle und Säulen bis zu einer Höhe von ca. 5 mm zersäumen. Gießen Sie die restlichen 25 g des PDMS in das zweite SU-8 Master-Mustern nur die Säulen bis zu einer Höhe von ca. 5 mm(Abbildung 1C).
- Die beiden Petrischalen in einen Ofen stellen und die PDMS-Schichten bei 338 K für 1 h aushärten.
- Schneiden Sie die ausgehärtete PDMS-Schicht um die Muster der SU-8-Master mit einem Skalpell und schälen Sie die PDMS-Formen vorsichtig von den Mastern ab (Abbildung 1D).
HINWEIS: Das oben beschriebene Verfahren, das so genannte Replikformn, wird häufig verwendet, um Formen von PDMS vorzubereiten, die an Glasoberflächen befestigt werden und Teil einer mikrofluidischen Vorrichtung sein53. In diesem Protokoll sind die PDMS-Formen nicht Teil des Chips, aber sie werden als Zwischenprodukte für die Spanherstellung verwendet. Für jedes Design werden 2 PDMS-Formen aus den jeweiligen SU-8-Mastern(Abbildungen 1D und 1E) hergestellt und entsprechend (wie unten beschrieben) für die Herstellung des Mikrochips verwendet.
3. Dialyse-Chip-Fertigung
- Platzieren Sie die PDMS-Form, die sowohl die Kanäle als auch die Säulen auf einem starren Mikroskopglasschlitten (3 x 1 in. Standardgröße) mit den Nachteilen nach oben(Abbildung 1F)modelliert. Die zentrale Säule, die dem Proteinreservoir entspricht, überschreitet vertikal um 45 m von der horizontalen Oberfläche der PDMS-Form.
- Schneiden und trennen Sie ein trockenes Stück der regenerierten Zellulose (RC) Dialysemembran und legen Sie es auf der zentralen Säule der PDMS-Form ab, die auf dem Glasschlitten unterstützt wird (Abbildung 1F).
HINWEIS: Die RC-Dialysemembran ist kommerziell erhältlich, und die Molekulargewichtsabschaltung (MWCO) wird entsprechend mit dem Molekulargewicht des untersuchten Proteins und den verwendeten Fällungsmitteln ausgewählt. Die Größe des Stücks der RC-Dialysemembran hängt vom Design des Chips ab. In diesem Protokoll sind 2 Prototypen konzipiert, bei denen das Volumen des Proteinreservoirs 0,1 oder 0,3 l beträgt. In diesen Fällen beträgt die Größe des Dialysemembranstücks 2 x 2 mm2 bzw. 4 x 4 mm2. - Platzieren Sie die zweite PDMS-Form, die nur die Nachdrucksäulen nach unten auf die AUF dem Glasschlitten unterstützte PDMS-Form zeigt (Abbildung 1F). Die zentrale Säule dieser Form entspricht dem Proteinreservoir und überschreitet vertikal (nach unten gerichtet) um 45 m von der horizontalen Oberfläche.
- Richten Sie die zentralen Säulen der 2 PDMS-Formen aus. Die RC-Dialysemembran ist zwischen den 2 PDMS-Formen "sandwiched"(Abbildung 1G).
HINWEIS: Die Ausrichtung zwischen den Mikrostrukturen der 2 PDMS-Formen kann visuell und ohne zusätzliche Ausrüstung durchgeführt werden. Andernfalls kann diese Manipulation unter dem Mikroskop erreicht werden. Eine kleine Verschiebung zwischen den Reservoirs ist nicht problematisch, solange der Fluidkanal und die Ein- oder Ausgangspunkte nicht vollständig abgedeckt sind. - Entwirren Sie die Montage für 30 min in einer Vakuumkammer, um alle eingeschlossenen Luftblasen in den PDMS-Formen zu entfernen und das Einführen des Harzes während des nächsten Schritts der Herstellung zu fördern.
HINWEIS: Die 2 PDMS-Formen werden durch PDMS-PDMS-Haftung an Ort und Stelle gehalten und es ist kein zusätzlicher Druck oder eine andere Art der temporären Verklebung erforderlich. - Füllen Sie den leeren Raum zwischen den 2 PDMS-Formen mit dem fotohärierbaren, Thiolen-basierten Harz NOA 81 durch Kapillarimbibition (Abbildung 1H und 1I).
- Härten Sie das Harz durch UV-Licht (365 nm) für 8 s mit einer kollimierten UV-Lampe (Leistung 35 mW cm-2).
HINWEIS: Diese erste Belichtung ermöglicht es, NOA 81-Harz teilweise zu verlinken, da eine dünne Schicht VON NOA 81 in Kontakt mit den PDMS-Formen auf beiden Seiten ungehärtet bleibt. - Schneiden Sie den Überschuss von NOA 81 von den Außenseiten der PDMS-Formen mit einem Skalpell.
- Entfernen Sie die obere PDMS-Form mit dem teilweise vernetzten NOA 81, der darauf klebt, von der unteren PDMS-Form und dem Glasschlitten.
- Schneiden Sie ein 175 m dickes PMMA-Blech in den Standardabmessungen eines Mikroskopglasschlittens (3 x 1 Zoll) und schälen Sie die Kunststoffschutzplatten von jeder Seite des PMMA-Stücks ab. Drücken Sie vorsichtig die Montage der oberen PDMS-Form und des teilweise ausgehärteten NOA 81 auf das PMMA-Stück (Abbildung 1J).
- NOA 81 durch UV-Licht für 60 s erneut aushärten und die obere PDMS-Form entfernen (Abbildung 1K). Das Harz haftet ohne weitere Behandlung am PMMA-Substrat.
HINWEIS: Die PDMS-Formen können nach dem Waschen mit Isopropanol und Aceton etwa 5 Mal wiederverwendet werden, solange die Formen nicht gebogen sind. Die RC-Dialysemembran ist in den NOA 81-Aufkleber integriert und es ist keine weitere Manipulation oder mechanische Klemmung erforderlich.
4. Fluidische Steckverbinder
HINWEIS: Das Design des mikrofluidischen Chips besteht aus einem linearen Fluidkanal für die Kristallisationslösung und einem zentralen Reservoir für die Proteinprobe (Proteinreservoir), die beide aus einer Ansicht von zwei Mikrochips in Abbildung 2Adargestellt werden. Eine RC-Dialysemembran ist zwischen diesen beiden Mikrostrukturen (Abbildung 2D) eingebettet und der Kristallisationsprozess entwickelt sich, während Die Fällungsmittel aus der Kristallisationslösung aufgrund eines Konzentrationsgradienten zwischen den beiden durch die Membran getrennten Abteilungen des Chips über die Membran diffundieren. Der mikrofluidische Kanal ist auf der unteren PDMS-Form eingeprägt (Abbildung 1F). Sobald das Herstellungsprotokoll für die Chips abgeschlossen ist, befindet sich der lineare Kanal auf der unteren Schicht des NOA 81-Aufklebers in Kontakt mit dem PMMA-Substrat, wie in Abbildung 1Kdargestellt. Ein Einlass und ein Auslasszugangspunkt für die Kristallisationslösung befinden sich an jedem Ende des linearen Kanals und sehen wie Löcher (Gesamthöhe 90 m) aus, wie Abbildung 2Azu sehen ist. Für die Handhabung der Kristallisationslösung müssen an den Access Points Anschlüsse hinzugefügt werden.
- Im Handel erhältliche Bond-Steckverbinder (NanoPort) am Ein- und Auslass des mikrofluidischen Kanals mit schnellem Epoxidkleber (Abbildung 2C).
- Wählen Sie den geeigneten Durchmesser der PTFE-Rohre basierend auf der Größe der Steckverbinder. Die PTFE-Rohre werden für die Einführung der Kristallisationslösung im Fluidkanal des Chips verwendet.
HINWEIS: Handelsübliche Kits werden zur einfachen und präzisen Steuerung der Durchflussmenge empfohlen und werden in der Regel mit automatisierten druckgesteuerten oder strömungsgesteuerten (Spritzenpumpen) Systemen zum Mischen und Fluidhandling kombiniert. Die Kristallisationslösung kann jedoch manuell mit einer Einweg-Kunststoffspritze in den Linearkanal eingeführt werden. In diesem Fall werden die Schritte 4.3 bis 4.5 vorgeschlagen. - Füllen Sie eine 1 ml Einwegspritze mit der Kristallisationslösung. Für die in diesem Protokoll vorgestellten Chips reichen 400 l aus, um den gesamten Fluidkanal zu füllen.
- Schneiden Sie zwei Pipettenspitzen, so dass der Durchmesser der Spitze an einer Seite dem Innendurchmesser des PTFE-Rohrs entspricht, das für die Lösungshandhabung verwendet wird. Kleben Sie die abgeschnittenen Spitzen an den Zugangspunkten des Kanals mit schnellem Epoxidkleber (Abbildung 2B).
- Verbinden Sie die Spritze mit den abgeschnittenen Spitzen mit einem Stück PTFE-Rohr der entsprechenden Größe und führen Sie die Lösung in den Kanal ein, indem Sie den Spritzenkolben langsam drücken.
5. Proteinverkapselung
HINWEIS: Das Muster des Chips, der als Proteinreservoir verwendet werden soll, bleibt der Atmosphäre bisher offen. Das folgende Protokoll wird vorgeschlagen, die Proteinprobe sorgfältig innerhalb des mikrofluidischen Chips einzugrenzen.
- Führen Sie manuell ein Tröpfchen der Proteinprobe innerhalb des Proteinreservoirs, das sich direkt auf der RC-Dialysemembran befindet, wie in Abbildung 2Edargestellt. Das Volumen der Proteinprobe variiert je nach Design des Chips und kann 0,1 oder 0,3 l betragen.
- Tragen Sie eine dünne Schicht Hochvakuum-Silikonfett rund um das Proteinreservoir auf.
- Schneiden Sie ein kleines Stück eines 175 m dicken PMMA-Blechs und legen Sie es vorsichtig über die dünne Schicht des Silikonfetts. Das PMMA-Stück muss die gesamte Oberfläche des Proteinreservoirs abdecken, in dem sich die Proteinlösung ablagert.
HINWEIS: Das Silikonfett wird verwendet, um die Luftdichtheit zu verbessern und die Ausbreitung des Proteintröpfchens zu verhindern. Zwischen dem PMMA-Stück, das zur Abdeckung des Proteinreservoirs verwendet wird, und dem NOA 81-Aufkleber gibt es keine Verklebung oder Versiegelung. Der Kontakt zwischen ihnen ist eine solide/feste Schnittstelle. Um eine Gesamtversiegelung und eine luftdichte Verkapselung der Proteinprobe zu erzeugen, wird ein Stück Kaptonband verwendet, wie in Schritt 5.4 beschrieben.
HINWEIS: Es ist manchmal schwierig, die Proteinprobe innerhalb des speziellen Hohlraums des Geräts (Proteinreservoir) einzugrenzen, wenn ein druckgesteuertes System für die Einführung der Kristallisationslösung innerhalb des Fluidkanals verwendet wird (Schritt 6.4). Um das oben erwähnte Problem zu vermeiden, sollten relativ niedrige Druckwerte beibehalten werden, während die Kristallisationslösung zirkuliert. Ein Einspritzdruck von 20-60 mbar für wässrige Lösungen oder 50-150 mbar für zähflüssigere Lösungen (PEGs, Glycerin) wirdvorgeschlagen 19. - Schneiden Sie ein Stück Kapton-Band (20 m dick) groß genug, um das PMMA-Stück über dem Proteinreservoir zu bedecken und auf dem NOA-Chip um alle Kanten zu kleben. Die Proteinprobe ist im Reservoir verkapselt und der Chip ist bereit, für das Kristallisationsexperiment verwendet zu werden, wie in Abbildung 2Cdargestellt.
HINWEIS: Die Chips können mehrmals wiederverwendet werden, solange die Dialysemembran und die Haftung von NOA auf dem PMMA-Substrat nicht beeinträchtigt werden. Wenn diese Teile des Chips beschädigt sind, werden Lecks beobachtet, die überprüfen, ob das Gerät nicht mehr verwendet werden kann. Das Waschen der Späne hängt von der Kristallisationslösung ab. Bei lösungen mit niedriger Viskosität (Salze, Puffer) kann der Fluidkanal durch bloßes Einbringen von destilliertem Wasser gewaschen und für einige Minuten fließen lassen. 400 l ist das Volumen, das benötigt wird, um eine Lösung innerhalb des Kanals vollständig mit einer anderen Lösung auszutauschen. Bei zähflüssigeren Lösungen (PEGs, Glycerin) wird die Wiederverwendung der Chips nicht empfohlen, da das Waschen des Kanals nur mit Wasser nicht ausreicht. Der obere Teil des Chips, in dem sich das Proteinreservoir befindet, kann auch mit destilliertem Wasser gewaschen und mit Druckluft getrocknet werden.
6. On-Chip-Proteinkristallisation
- Wiegen Sie lyophilisiertes Hen-Ei-Weiß-Lysozym-Pulver und lösen Sie sich in destilliertem Wasser auf, um eine Endkonzentration von 30 mg ml-1zu erhalten.
- Filtern Sie die Proteinlösung durch einen 0,22 m Filter und eine Zentrifuge für 5 min bei der höchsten Geschwindigkeit bei 293 K, um alle Feststoffpartikel zu entfernen. Verwenden Sie den Überstand für das Kristallisationsexperiment.
- Bereiten Sie 500 l Kristallisationslösung vor, die den Puffer und den Niederschlag in den in Tabelle 1enthaltenen Konzentrationen enthält. Filtern Sie die Lösung durch einen 0,22-mm-Filter.
- Injizieren Sie die Lösung in den Einlasspunkt des Chips mit einer Spritze oder einem automatisierten druckbetriebenen Fluidsystem oder einer Spritzenpumpe, wie in den Schritten 4.1-4.5 beschrieben.
HINWEIS: Das Kristallisationsexperiment kann entweder unter statischem Zustand erfolgen, wenn der mikrofluidische Kanal mit der Kristallisationslösung gefüllt und beiseite gelegt wird, oder unter fließenden Bedingungen, wenn er kontinuierlich mit einer konstanten Durchflussrate in den Kanal injiziert wird. Für den letztgenannten Fall wird die Verwendung eines externen druckbetriebenen Systems oder einer Spritzenpumpe empfohlen. Die Durchführung des Experiments unter fließenden Bedingungen bietet auch die Möglichkeit, Kristallisationslösungen innerhalb des Fluidkanals dynamisch auszutauschen. So können mehrere Experimente unter Verwendung der gleichen Proteinprobe durchgeführt werden. - Sobald der Fluidkanal mit der Kristallisationslösung gefüllt ist, versiegeln Sie die Ein- und Auslassöffnungen des Chips mit Parafilmband.
- Das entsprechende Volumen der Proteinlösung innerhalb des Proteinreservoirs anführen und die Proteinprobe wie in den Schritten 5.1-5.4 beschrieben verkapseln.
- Bewahren Sie den Chip bei 293 K auf.
ANMERKUNG: Die Kristallisation mittels Dialyse folgt einer anderen kinetischen Flugbahn als Experimente, die mit der Dampfdiffusionsmethode oder Batchkristallisation durchgeführt wurden, und hängt stark von der Art der am Diffusionsprozess beteiligten Niederschlagsmoleküle ab, nach den gemessenen Daten51, und es könnte mehr Zeit in Anspruch nehmen, bis die Keimbildung beginnt. Um verdunsten zu verhindern, wenn überhaupt, während dieser Zeit, stellen Sie den Chip in einer feuchtigkeitsgesättigten Atmosphäre bei 293 K.
7. In-situ und On-Chip-Röntgenbeugung
- 3D-gedruckte Unterstützung für Beamlines
- Drucken Sie die Unterstützung, die bis zu drei Chips gleichzeitig tragen kann. Die Abmessungen der Stütze sind die gleichen wie die Abmessungen der kommerziellen Kristallisationsplatten (96 well/SBS Standard), die in Platten-Röntgenbeugungsexperimenten kompatibel sind.
HINWEIS: Der Druck des Supports kann kommerziellen Dienstleistungen zugewiesen werden. Die Unterstützung wurde mit einer 3D-CAD-Konstruktionssoftware entwickelt und ist in Abbildung 3A während On-Chip-Proteinkristallisationsexperimenten und in Abbildung 3B während der In-situ-Röntgenbeugungsdatenerfassung am BM30A-FIP (ESRF) dargestellt. - Stabilisieren Sie die Dialysechips auf der Stütze mit einem ein- oder doppelseitigen Band.
- Drucken Sie die Unterstützung, die bis zu drei Chips gleichzeitig tragen kann. Die Abmessungen der Stütze sind die gleichen wie die Abmessungen der kommerziellen Kristallisationsplatten (96 well/SBS Standard), die in Platten-Röntgenbeugungsexperimenten kompatibel sind.
-
In situ Röntgenbeugung
- Sammeln Sie Röntgenbeugungsdaten bei Raumtemperatur aus Kristallen, die im Proteinreservoir angebaut werden. Verwenden Sie z. B. Röntgenstrahlen mit einer Energie von 12.656 keV, einem Fluss von 3,32 x 1010 Photonen s-1 und einer Strahlgröße von 250 x 250 m2. Zeichnen Sie die Beugungsbilder mit einem ADSC Quantum 315r Detektor mit einer Matrix von 3 x 3 CCD für eine aktive Oberfläche von 315 x 315 mm2 und 9,4 Megapixel Auflösung auf.
HINWEIS: Die Beugungsdaten für die auf den Dialysechips angebauten Lysozymkristalle wurden an der BM30A-FIP-Beamline in der European Synchrotron Radiation Facility (ESRF) gesammelt. Die Strahlgröße, der Fluss und der Detektortyp können sich jedoch in anderen Röntgenstrahlungsquellen unterscheiden. Die 3D-gedruckte Stütze ermöglicht die Datenerfassung mit einem Winkelbereich von -40° bis +40° um den Kristall. Die Anzahl der für die In-situ-Datenerfassung exponierten Lysozymkristalle, die Anzahl der für jeden Kristall gesammelten Beugungsmuster, der Schwingungswinkelbereich pro Belichtung und die Belichtungszeit sind in Tabelle 2zusammengefasst.
- Sammeln Sie Röntgenbeugungsdaten bei Raumtemperatur aus Kristallen, die im Proteinreservoir angebaut werden. Verwenden Sie z. B. Röntgenstrahlen mit einer Energie von 12.656 keV, einem Fluss von 3,32 x 1010 Photonen s-1 und einer Strahlgröße von 250 x 250 m2. Zeichnen Sie die Beugungsbilder mit einem ADSC Quantum 315r Detektor mit einer Matrix von 3 x 3 CCD für eine aktive Oberfläche von 315 x 315 mm2 und 9,4 Megapixel Auflösung auf.
- Datenbehandlung
- Verarbeiten Sie die vollständigen oder teilweisen Datensätze mit den Beugungsmustern für die Lysozymkristalle mit dem XDS-Programm48.
- Generieren Sie die HKL-Datei für jeden Datensatz und skalieren Sie sie mit der XSCALE-Software48.
- Verwenden Sie molekularen Ersatz mit dem Programm Phaser der CPP4 Suite49 und bestimmen Sie die Phasen für den Modellbau. Verwenden Sie für diesen Schritt die bekannten 3D-Koordinaten von Lysozym aus dem Protein Data Bank (PDB)-Eintrag 193L.
- Verfeinern Sie die Struktur mit Phenix52 und inspizieren Sie das endgültige Proteinmodell mit COOT50.
Ergebnisse
Die von Junius et al.19 ,45 entwickelten mikrofluidischen Chips sind sowohl für die On-Chip-Proteinkristallisation mit der Mikrodialysemethode als auch für die In-situ-Röntgenbeugungsdatenerfassung bei Raumtemperatur kompatibel. Bilder der Mikrochips, ihres detaillierten Designs, der Fluidverbinder und der RC-Dialysemembran sind in Abbildung 2dargestellt. Die Kristallisationsexperimente werden eingerichtet, indem die Proteinprobe manuell direkt in das Proteinreservoir geleitet und die Kristallisationslösung mit einem automatisierten druckbetriebenen System oder Spritzenpumpe oder manuell mit Hilfe einer Spritze in den linearen Fluidkanal eingeführt wird. Das Proteinreservoir und der Fluidkanal können in Abbildung 2Aunterschieden werden. Die Konstruktionen für die Herstellung von Chips mit einem maximalen Volumen von 0,1 l bzw. 0,3 l des Proteinreservoirs sind in Abbildung 2A links bzw. rechts dargestellt. Chips mit einer maximalen Kapazität von 0,2 l oder 0,7 l für die Proteinprobe werden an anderer Stelle19gezeigt. Das Highlight des Protokolls für die Gerätefertigung kann auf die Verwendung des photohärierbaren Thiolen-basierten Harzes NOA 81, das handelsübliche RC-Dialysemembranen verschiedener MWCOs einbettet, eingeengt werden. Während der Herstellung der mikrofluidischen Vorrichtungen wird der lineare Fluidkanal auf der unteren PDMS-Form eingeprägt (Abbildung 1F), während die obere PDMS-Form nur aus den gemusterten Säulen für das Proteinreservoir und den Ein- und Auslassöffnungen besteht (Abbildung 1F). Sobald NOA 81 vernetzt ist und die PDMS-Formen aus der Baugruppe entfernt werden (Abbildung 1K), befindet sich der Fluidkanal an der unteren Schicht des Mikrochips und der Proteinkanal und die Ein-/Auslassöffnungen befinden sich auf beiden Schichten. Abbildung 1L zeigt einen Seitenansichtsschema des Dialysechips, in dem alle Schichten des Geräts und ihre jeweilige Dicke angegeben sind. Die Höhe der Muster, die auf der unteren Schicht der Späne (Fluidkanal) eingeprägt sind, beträgt ca. 45 m, während die Gesamthöhe der Ein- und Auslassöffnungen ca. 90 m beträgt. Das Proteinreservoir (45 m Höhe) ist auch in Abbildung 2D und 2Edargestellt. Die Ausrichtung der beiden Schichten wurde unter einem optischen Mikroskop untersucht und das In den Mikrochip integrierte Stück der RC-Dialysemembran lässt sich in Abbildung 2Ddeutlich unterscheiden. In der gleichen Abbildung wurde während der Injektion der Kristallisationslösung Luft im Fluidkanal eingeschlossen, wie im oberen linken Teil des Proteinreservoirs zu sehen ist. Abbildung 2E ist eine Nahaufnahme des Proteinreservoirs nach der manuellen Ablagerung des Proteintröpfchens mit einer Pipette und vor der Verkapselung des Tröpfchens mit einem Stück PMMA- und Kaptonband, wie in den Schritten 5.2 und 5.3 des Protokolls beschrieben. Der mikrofluidische Chip, der für Kristallisationsexperimente nach der Verkapselung der Proteinprobe und dem Verkleben der Fluidverbinder enthoben werden kann, ist in Abbildung 2Cdargestellt. Die luftdichte Montage sorgt dafür, dass keine Leckagen auftreten können. Die Fluidsteckverbinder für die Ein- und Auslassöffnungen des mikrofluidischen Kanals können entweder die handelsüblichen, wie in Schritt 4.1 des Protokolls beschrieben und in Abbildung 2Cdargestellt, oder Einweg-Laborpipettenspitzen können für denselben Zweck verwendet werden(Abbildung 2B, Protokollschritt 4.4).
Für die Herstellung der mikrofluidischen Chips wurden optisch transparente und biologisch inerte Materialien ausgewählt, die eine hohe Verträglichkeit für In-situ-Röntgenbeugungsexperimente bei Raumtemperatur nachweisen. Die Wechselwirkungen von Röntgenstrahlen, Absorption und Streuung, mit den Materialien, aus denen das mikrofluidische Gerät besteht, und der umgebenden Atmosphäre (Luft) erzeugen ein Signal, das als Hintergrundrauschen bekannt ist. Dieses Rauschen summiert sich auf das Beugungssignal der vom Detektor aufgezeichneten Proteinkristalle, wodurch das Signal-Rausch-Verhältnis verfällt und während der Erfassung der Röntgenbeugungsdaten so niedrig wie möglich gehalten werden sollte. Wir haben das Hintergrundrauschen ausgewertet, das von den Materialien des Proteinreservoirs erzeugt wird, das sich im direkten Weg des Röntgenstrahls befindet. Das Proteinreservoir besteht aus der RC-Dialysemembran, dem Kaptonband und zwei PMMA-Stücken, von dem eines als Substrat für den Mikrochip und eines für die Verkapselung der Proteinprobe verwendet wird. Die Dicke des PMMA beträgt 2 x 175 m, des Kaptonbandes 20 m, und die RC-Dialysemembran ist ca. 40 'm dick(Abbildung 1L). Die Gesamtdicke dieser Schichten beträgt ca. 410 m und die NOA 81-Schicht befindet sich nicht im direkten Röntgenpfad. Neben der Dicke der Fertigungsmaterialien ist ihre Dichte auch entscheidend für die Messung des Hintergrundstreurauschens, da die Röntgenstreuung mit der elementaren Ordnungszahl zunimmt. Aus diesem Grund wurde bei der Datenerfassung für die Materialcharakterisierung und für Proteinbeugungsexperimente der Heliumfluss (ein Feature bei BM30A-FIP bei ESRF) anstelle von Luft verwendet. Abbildung 3C zeigt das Hintergrundrauschen, das durch das Kapton-Band, die RC-Dialysemembran, das PMMA-Blatt und deren Montage in Heliumatmosphäre erzeugt wird. Jedes Material wurde für 20 s Röntgenstrahlen mit einer Wellenlänge von 0,98 ° und der Probendetektorabstand betrug 200 mm. Die Experimente wurden an der BM30A-FIP-Beamline am ESRF durchgeführt, wie in Schritt 7 des Protokolls erläutert. Diffuse Ringe, die den Wechselwirkungen des Röntgenstrahls mit den Materialien zugeschrieben werden, können für das Kapton-Band mit einer Auflösung von weniger als 4 %, das PMMA-Blatt zwischen 4-8 und die Dialysemembran zwischen 4-5 °C- und dialysemembran zwischen 4-5 °C unterschieden werden. Das vom Dialysechip erzeugte Hintergrundrauschen wird hauptsächlich bei einer Auflösung unter 6 ° beobachtet, die die Behandlung von hochauflösenden Beugungsdaten der großen Lysozymkristalle nicht beeinflusst. Die Hintergrundstreuintensität in Abhängigkeit von der Auflösung für den Mikrochip und die einzelnen Materialien werden an anderer Stelle19dargestellt. In der in Abbildung 3Cvorgestellten Messung war der Dialysechip von jeder Lösung (Protein oder Niederschlagslösung) leer und der Beitrag des Vorhandenseins einer Lösung zum Hintergrundrauschen wurde nicht gemessen. Die Chips wurden vor dem Röntgenstrahl mit einer 3D-gedruckten Stütze(Abbildung 3B) montiert, die für In-situ-Beugungsexperimente 19entwickelt wurde. Die gleiche Stütze mit Abmessungen, die den Abmessungen einer 96-Well/SBS-Standardkristallisationsplatte entsprechen, kann jedoch für die gleichzeitige Durchführung von 1 bis 3 Kristallisationsexperimenten verwendet werden, da sie bis zu 3 Chips gleichzeitig aufnehmen kann(Abbildung 3A).
Es wurden Experimente durchgeführt, um die Effizienz der mikrofluidischen Geräte zur On-Chip-Kristallisation von modelllöslichen Proteinen mit der Mikrodialysemethode zu bewerten. Der Fluidkanal wurde wie in Schritt 4 des Protokolls beschrieben gefüllt, während die Schritte 5 und 6 beschrieben wurden, wie die Proteinprobe innerhalb des dedizierten Proteinreservoirs eingekapselt und die Kristallisationsexperimente eingerichtet werden. Abbildung 4 zeigt Lysozymkristalle, die bei 293 K unter 1,5 M Natriumchlorid (NaCl) mit 0,1 M Natriumacetat (CH3COONa) pH 4,0 (A) und unter 1 M NaCl, 0,1 M CH3COONa pH 4,5 mit 30% Polyethylenglykol (PEG) 400 (B) angebaut werden. Das lyophilisierte Lysozympulver wurde in Wasser bis zu einer Endkonzentration von 30 mg ml-1 oder in 20 mM CH3COONa pH 4,2 Puffer zu einer Endkonzentration von 20 mg ml-1 für die in den Abbildungen 4A bzw. 4Bdargestellten Experimente gelöst. Das Volumen der Proteinprobe lag in beiden Experimenten bei etwa 0,3 l und der MWCO der in die Mikrochips eingebetteten RC-Dialysemembran liegt im Bereich von 6-8 kDa. Die in Abbildung 3A dargestellten Lysozymkristalle wuchsen innerhalb von 1 h und die Kristalle in Abbildung 3B innerhalb von 30 min ab Beginn des Experiments. Die Kristallisationsexperimente wurden unter statischen Bedingungen durchgeführt. Es wurde jedoch19 gezeigt, dass die Durchführung der Experimente unter fließenden Bedingungen die Möglichkeit bietet, die Kristallisationsbedingungen dynamisch auszutauschen und Phasendiagramme zu untersuchen, um die Reversibilität der Mikrodialysemethode zu überprüfen.
In situ Röntgenbeugungsdaten aus den in Abbildung 4A dargestellten Lysozymkristallen wurden gesammelt, um die Eignung der Dialysechips für solche Experimente zu demonstrieren. Die Datenerfassung erfolgte bei BM30A-FIP Beamline (ESRF) bei Raumtemperatur, wie in Schritt 7.2.1 des Protokolls beschrieben. Die Mikrochips wurden mit Hilfe der 3D-gedruckten Stütze(Abbildung 3B) an der Beamline montiert und vollständige Röntgenbeugungsdatensätze aus zwei einzelnen Lysozymkristallen gesammelt, die auf dem Chip unter den in der zweiten Zeile von Tabelle 1angegebenen Bedingungen angebaut wurden. Die beobachteten Reflexionen der Datensätze wurden mit XDS48 verarbeitet, indiziert und integriert, und die molekulare Ersetzung und Verfeinerung wurde mit Phaser49 bzw. Phenix52durchgeführt. Die kristallographischen Statistiken für den vollständigen Datensatz jedes Lysozymkristalls und für die Zusammenführung der beiden Datensätze sind in Tabelle 2enthalten. Für den molekularen Ersatz wurde der PDB-Eintrag 193L verwendet.
Elektronendichtekarten aus einem einzelnen Lysozymkristall und dem zusammengeführten Datensatz der beiden Kristalle wurden bei 1,95 % bzw. 1,85 ° erhalten und sind in den Abbildungen 5A und 5Bdargestellt. Beide Elektronendichtekarten zeigen detaillierte Strukturinformationen, die durch in situ Röntgenbeugungsexperimente gewonnen werden können, die direkt am Dialysemikrochip bei Raumtemperatur aus einem einzelnen Kristall oder aus mehreren Kristallen durchgeführt werden, wodurch die Chips für in situ-Röntgenkristallographiestudien kompatibel gemacht werden.
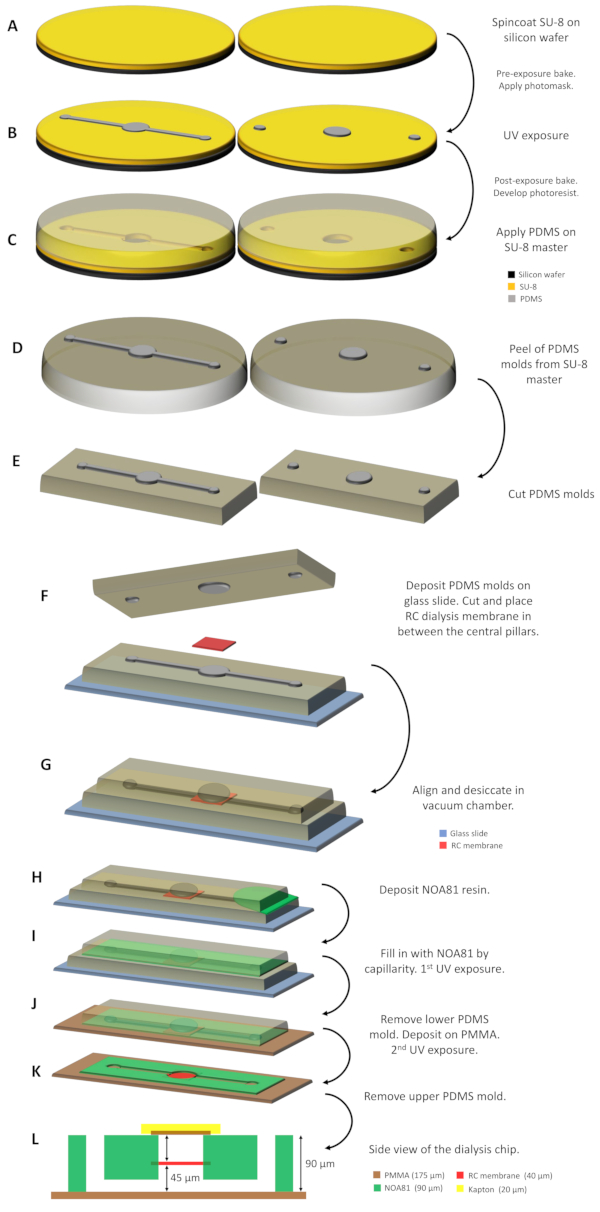
Abbildung 1: Schematische Darstellung der Dialysechip-Fertigung. (A) SU-8 Harz wird auf zwei Siliziumwafern abgelagert und spinbeschichtet. (B) Ein SU-8-Master wird erworben, nachdem der Photowiderstand durch eine Photomaske mit UV-Licht bestrahlt und die nicht belichteten Teile entwickelt wurden. (C) PDMS wird auf die SU-8-Master abgegeben und nach ausgehärteter 338 K für 1 h, (D) werden die 2 PDMS-Formen, die durch Nachführen und Nachdrucken der Mikromuster hergestellt werden, von den Mastern geschält und (E) auf die entsprechende Größe geschnitten. (F) Die PDMS-Formen werden auf einem Glasschlitten mit der RC-Dialysemembran zwischen den beiden zentralen Säulen unterstützt. (G) Die 2 PDMS-Formen werden dann in einer Vakuumkammer für ca. 30 min ausgegrümelt und ausgetrocknet. (H) Das NOA 81 Harz wird zwischen die beiden Formen gegossen und (I) füllt den Raum durch Kapillarität. (J) Nach der ersten UV-Lichteinwirkung wird die untere PDMS-Form entfernt und die Baugruppe auf einem PMMA-Blatt abgelagert. (K) Die zweite UV-Exposition folgt, um das NOA 81 Harz vollständig zu polymerisieren und der Dialysechip ist nach dem Entfernen der verbleibenden oberen PDMS-Form einsatzbereit. (L) Seitenansichtschaltplan des Dialysechips, wo alle Schichten des Geräts und ihre jeweilige Dicke angegeben sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
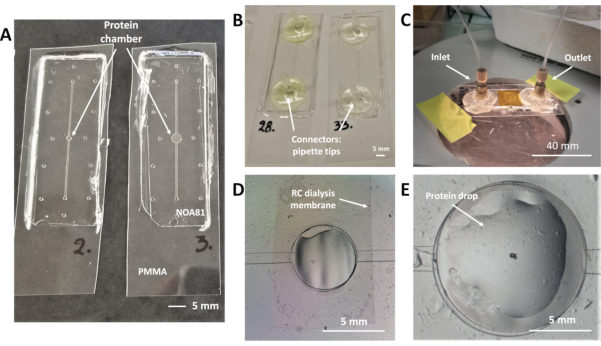
Abbildung 2: Dialysechips, die eine RC-Dialysemembran für die On-Chip-Proteinkristallisation und in situ-Röntgenbeugungsexperimente einbetten. (A) NOA 81-Mikrochips auf 175 m dickem PMMA-Substrat mit einem Proteinreservoir von 0,1 l (links) und 0,3 l (rechts) Nennvolumen. (B) Mikrochips mit Pipettenspitzen als Fluidverbinder, die an den Ein- und Auslassöffnungen des Fluidkanals geklebt werden. (C) Bild eines Mikrochips während eines Kristallisationsexperiments. Die Proteinprobe wird mit einem Stück 175 m dickem PMMA-Blatt und Kaptonband verkapselt. Peek Nanoport-Steckverbinder werden für die Ein- und Auslassanschlüsse des Fluidkanals verwendet. (D) Obere Ansicht des Proteinreservoirs während der Zirkulation der Kristallisationslösung innerhalb des Fluidkanals. Luft ist im oberen Teil des Reservoirs direkt unter der RC-Dialysemembran gefangen, die deutlich zu erkennen ist. (E) Obere Ansicht des Dialysereservoirs durch ein optisches Mikroskop während der Abscheidung der Proteinprobe. Das Proteintröpfchen wird direkt über der eingebetteten RC-Dialysemembran abgelagert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Die 3D-gedruckte Stütze (A) für die bei Kristallisationsexperimenten verwendeten Mikrochips und (B) vor dem Röntgenstrahl an der BM30A-FIP-Strahllinie am ESRF für In-situ-Röntgenbeugungsexperimente montiert. (C) Hintergrundgeräusche, die durch die Interaktion von Röntgenstrahlen mit Kapton, RC-Dialysemembran, PMMA und dem Dialysechip (von links nach rechts) erzeugt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
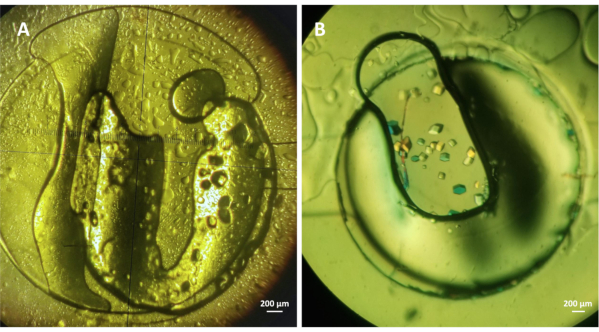
Abbildung 4: On-Chip-Kristallisation von Lysozym mit der Mikrodialysemethode. (A) Lysozym (ca. 30 mg ml-1) Kristalle, die auf dem Chip unter 1,5 M NaCl und 0,1 M CH3COONa pH 4,0 und (B) Lysozym (ca. 20 mg mL-1) Kristalle angebaut werden, die unter Kristallisationsbedingungen mit 1 M NaCl, 0,1 M CH3COONa pH 4,5 und 30% PEG 400 angebaut werden. Beide Experimente wurden bei 293 K durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Elektronendichtekarten der verfeinerten Lysozymstruktur aus (A) einem einzelnen Kristall und (B) dem zusammengeführten Datensatz von zwei Kristallen, die über die Mikrodialyse auf dem Chip angebaut werden. Die Karten wurden bei 1,95 % bzw. 1,84 ° bzw. konturiert bei 1 % erhalten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Protein | Proteinkonzentration (mg mL-1) | Protein-Bufffer | Anfängliche Konzentration von Niederschlagslösung | MWCO von RC Dialysemembran (kDa) | Temperatur (K) | ||
| Lysozym | € 30 | Wasser | 1,5 M NaCl 0,1 M CH3COONa pH 4,0 | 6 - 8 | 293 | ||
| Lysozym | € 20 | 20 mM CH3COONa pH 4,2 | 1 M NaCl 0,1 M CH3COONa pH 4,5 30% PEG 400 | 6 - 8 | 293 | ||
Tabelle 1: Zusammensetzung des Proteinpuffers und der Niederschlagslösung zur On-Chip-Kristallisation von Lysozym mit der Mikrodialysemethode. Die Lysozymkristalle, die auf dem Chip mit den in der zweiten Zeile angegebenen Bedingungen angebaut wurden, wurden für die Erfassung von In-situ-Röntgenbeugungsdaten verwendet.
| Protein | Lysozym | Lysozym | Lysozym |
| Anzahl der Kristalle | 1 | 1 | 2 |
| Anzahl der Beugungsrahmen | 40 | 30 | 70 |
| Oszillation (°) pro Belichtung | 1 | 1 | |
| Belichtungszeit (s) | 30 | 30 | |
| Temperatur (K) | 293 | 293 | 293 |
| Weltraumgruppe | P43212 | P43212 | P43212 |
| Einheitenzellenparameter | 78.86 78.86 37.87 90.0 90.0 90.0 | 79.17 79.17 37.95 90.0 90.0 90.0 | 78.47 78.47 37.65 90.0 90.0 90.0 |
| Auflösungsbereich (A) | 27.31 - 1.95 (2.02 - 1.95) | 27.39 - 1.96 (2.03 - 1.96) | 27.17 - 1.85 (1.91 - 1.85) |
| Mosaität (°) | 0.319 | 0.121 | |
| Gesamtreflexionen (beobachtet) | 25127 (3552) | 19991 (3001) | |
| Einzigartige Reflexionen (beobachtet) | 8641 (1357) | 8295 (1321) | 10404 (975) |
| Redudancy | 2.90 (2.61) | 2.41 (2.27) | |
| Vollständigkeit (%) | 95.0 (94.8) | 91.9 (93.3) | 98.23 (93.15) |
| Mittlere I/σ | 6.83 (1.16) | 7.09 (1.66) | 3.7 |
| CC(1/2) | 99.1 (42.4) | 97.9 (37.0) | 97.0 |
| R-Merge | 0.184 | ||
| R-meas | 0.139 | 0.221 | 0.219 |
| R-Pim | 0.116 | ||
| Reflexionen, die bei der Verfeinerung verwendet werden | 8645 (787) | 8451 (857) | 10391 (965) |
| Reflexionen für R-freie | 864 (78) | 846 (85) | 1039 (96) |
| R-Arbeit | 0.1988 (0.2968) | 0.1853 (0.2872) | 0.1839 (0.3102) |
| R-frei | 0.2430 (0.3437) | 0.2297 (0.3622) | 0.2207 (0.3703) |
| Anzahl der nicht-wasserstoffatomen | 1069 | 1071 | 1096 |
| Makromoleküle | 1012 | 1012 | 1012 |
| Wasser | 55 | 57 | 82 |
| Liganden | 2 | 2 | 2 |
| Proteinrückstände | 131 | 131 | 131 |
| Rms (Anleihen, B) | 0.008 | 0.009 | 0.005 |
| Rms (Winkel, °) | 1.17 | 1.26 | 1.05 |
| Ramachandran bevorzugt (%) | 98.43 | 97.64 | 99.21 |
| Ramachandran erlaubt (%) | 1.57 | 2.36 | 0.79 |
| Ramachandran Ausreißer (%) | 0.00 | 0.00 | 0.00 |
| Avegare B-Faktor | 34.26 | 28.54 | 24.34 |
| Protein | 33.94 | 28.14 | 23.62 |
| Wasser | 40.23 | 35.57 | 33.16 |
| Liganden | 33.23 | 29.63 | 24.77 |
Tabelle 2: Datenerfassungsparameter, kristallographische und verfeinernde Statistiken von Lysozymkristallen, die auf Chip über die Mikrodialysemethode angebaut werden. Die in Klammern angegebenen Werte entsprechen der Shell mit der höchsten Auflösung. Die vierte Spalte entspricht den Werten, die nach dem Zusammenführen der Datensätze der zweiten und dritten Spalte ermittelt wurden.
Diskussion
Für die Proteinkristallisation auf dem Chip mit der Mikrodialysemethode und in situ-Röntgenbeugungsexperimente bei Raumtemperatur wurde ein mikrofluidisches Gerät entwickelt. NOA 81-Chips, die RC-Dialysemembranen aller MWCO integrieren, um Mikrodialyse für die On-Chip-Proteinkristallisation zu verwenden, können hergestellt werden. Es wurden Fertigungsmaterialien mit einer relativ hohen Röntgentransparenz verwendet, wodurch die Chips für die In-situ-Proteinkristallographie kompatibel gemacht wurden. Die Herstellungsmaterialien, aus denen das Fach für die Proteinkristallisation des Geräts besteht (PMMA, Kapton, RC-Dialysemembran), wurden ausgewertet, um geringe Hintergrundgeräusche zu erzeugen. Insbesondere wird das vom Dialysechip erzeugte Hintergrundrauschen hauptsächlich bei niedriger Auflösung (> 6 °C) beobachtet und beeinflusst nicht die Behandlung von hochauflösenden Beugungsdaten der großen Lysozymkristalle, die für die Bestimmung der Proteinstruktur erforderlich sind. Die Automatisierung der Datenerfassung wird durch eine 3D-gedruckte Stütze verstärkt, die direkt in makromolekularen Kristallographiestrahllinien montiert werden kann und bis zu drei Mikrochips gleichzeitig transportieren kann. Auf diese Weise wird die manuelle Ernte und Manipulation der empfindlichen Proteinkristalle vermieden. Darüber hinaus erfolgt die Datenerfassung bei Raumtemperatur, wodurch ein Kryoschutz vermieden wird, der mit konformen Veränderungen der nativen Proteinstruktur2,3zusammenhängt.
Die Verwendung der Mikrodialyse als Methode zum Anbau von Kristallen auf dem Chip ermöglicht eine genaue Überwachung und Steuerung des Kristallisationsprozesses. Wie in der Einleitung erläutert, wurden die meisten konventionellen Proteinkristallisationsmethoden mit mikrofluidischen Geräten11,14implementiert. Die Vorteile der Dialyse für die Proteinkristallisation waren jedoch im Mikromaßstab noch nicht voll ausgeschöpft. Die On-Chip-Mikrodialyse bietet die Möglichkeit, Phasendiagramme zu untersuchen und das Screening und die Optimierung der Kristallisationsbedingungen mit der gleichen Proteinprobe19durchzuführen. Bei den in dieser Arbeit vorgestellten Prototypen ist der Proteinverbrauch pro Chip auf 0,1 oder 0,3 l begrenzt. Basierend auf den bisherigen experimentellen Arbeiten ergeben sich die kritischsten Schritte des Protokolls nicht aus dem Herstellungsverfahren der Chips, sondern aus dem Kristallisationsprozess. Das Fertigungsprotokoll umfasst viele Schritte, ist aber einfach und ermöglicht die Herstellung zahlreicher Geräte (20 bis 30 Chips) an einem einzigen Tag im Reinraum mit relativ preiswerten Materialien. Die On-Chip-Kristallisation von Proteinen kann jedoch aufgrund der intrinsischen stochastischen Natur der Keimbildung und des Kristallwachstums, insbesondere im Mikromaßstab, ein heikles Verfahren sein. Es wurde eine Fallstudie beschrieben, in der gut etablierte Bedingungen für die Kristallisation von Lysozym verwendet wurden, die robuste, klar definierte Kristalle lieferten, die für die In-situ-Röntgenbeugungsdatenerhebung geeignet waren. Dennoch können Schwierigkeiten durch die Verwendung anspruchsvollerer Proteinziele auftreten, wie z. B. Membranproteine, bei denen das Kristallisationsmedium viel komplizierter ist, Phasendiagramme nicht bekannt sind und gut funktionierende Kristallisationsbedingungen noch nicht gut etabliert sind. Der Dialysechip bietet die Möglichkeit, diese Schwierigkeiten zu übertreffen und Phasendiagramme auf dem Chip zu untersuchen, ohne die wertvolle und häufig kostspielige Proteinprobe zu entsorgen, indem er lediglich die Kristallisationslösung innerhalb des mikrofluidischen Kanals austauscht.
Die Vielseitigkeit der mikrofluidischen Geräte ergibt sich aus der Nutzung der Mikrodialyse für die Proteinkristallisation auf dem Chip, um die Kristallisationsbedingungen reversibel zu steuern und Konzentrations- und Temperaturdiagramme mit geringem Proteinvolumen zu kartieren. Darüber hinaus ist das Gerät mit In-situ-Röntgenbeugungsexperimenten kompatibel und das Prototyping der Geräte ist kostengünstig und schnell. Zahlreiche isomorphe Kristalle von löslichen und Membranproteinen (in Vorbereitung) können auf Chip angebaut werden, und es wird erwartet, dass all diese Eigenschaften für serielle Röntgenkristallographiestudien an anspruchsvollen Proteinzielen in Synchrotron- und XFEL-Anlagen genutzt werden können. Schließlich ist die Durchführung von on-chip- und in-situ-zeitaufgelösten Studien eine zukünftige Möglichkeit, die für die kristallographische Gemeinschaft von erheblichem Interesse sein könnte. Durch den Anbau von Kristallen auf dem Dialysechip und die Einführung der Reagenzien in den mikrofluidischen Kanal, entweder manuell (mit einer Spritze) oder automatisch (mit einem Druckkontrollflüssigkeitssystem oder einer Spritzenpumpe), werden sich die zukünftigen Bemühungen darauf konzentrieren, zu beweisen, dass die mikrofluidischen Chips erfolgreich eingesetzt werden können, um zeitaufgelöste Experimente an Synchrotronstrahllinien auszulösen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
MBS erkennt die Unterstützung des MI / CNRS im Rahmen des Vertrags Instrumentation an den Grenzen 2014-2015 an. NJ würdigt das International Doctoral Research Program (Irtelis) der CEA für das PhD Fellowship. MBS und SJ würdigen die Finanzierung aus dem Forschungs- und Innovationsprogramm Horizont 2020 der Europäischen Union im Rahmen der Marie-Skodowska-Curie-Zuschussvereinbarung mit der Nummer 722687. MBS, SJ und NJ danken LIPhy (UGA) für die Reinraumeinrichtung für Mikrofabrikationsexperimente. Die IBS erkennt die Integration in das Interdisziplinäre Forschungsinstitut von Grenoble (IRIG, CEA) an.
Materialien
| Name | Company | Catalog Number | Comments |
| 3 in wafer | Silicon Materials Inc. | Silicon wafer | |
| Centrifuge | Eppendorf | Minispin | Bench-top centrifuge |
| CleWin 3.0 | WieWeb software | Designing software | |
| Epoxy glue | Devcon | 5 minutes epoxy glue | |
| Fluidic connectors | Cluzeau Info Lab | N-333 | NanoPort kit for 1/16" OD tubing |
| Hen egg-white lysozyme | Roche | 10 837 059 001 | Lyophilized protein powder |
| High-vacuum silicone grease | Sigma-Aldrich | Z273554 | Dow Corning high-vacuum silicone grease |
| HMDS | Sigma-Aldrich | 440191 | Silane, chemical |
| Hot plate | Sawatec | HP-200-Z-HMDS BM | Hot plate |
| Isopropyl alcohol | Sigma-Aldrich | Solvent | |
| Kapton tape | DuPont | Polyimide tape | |
| Mask aligner | SUSS MicroTec | MJB4 | Mask aligner, UV source |
| Membrane filter | Millipore | GSWP04700 | 0.22 μm pore size filter |
| Microscope glass slide | Fisher Scientific | 12164682 | 3 x 1 in glass slides |
| NOA81 | Norland Products Inc. | NOA81 | Photocurable resin |
| Oven | Memmert | Oven | |
| Parafilm | Sigma-Aldrich | P6543 | Parafilm M roll size 20 in. × 50 ft |
| PDMS | Dow Corning | Sylgard 184 | Silicone |
| PEG 400 | Hampton Research | HR2-603 | Chemical |
| Petri dish | Sigma-Aldrich | P5731 | 100 x 15 mm |
| PGMEA | Sigma-Aldrich | 484431 | Developer |
| Plasma equipment | Diener Electronic | ZEPTO | Plasma treatment |
| PMMA | Goodfellow | 137-745-63 | PMMA sheets 150x150 mm, 0.175 mm thickness |
| Pressure driven system | Elveflow | OB1 MK3+ | Pressure/vacuum controller |
| PTFE tubing | Elveflow/Darwin microfluidics | LVF-KTU-15 | PTFE tubing roll 1/16" OD X 1/32" ID |
| RC dialysis membrane | Spectra/Por | Various MWCOs | |
| Scalpel | Swann-Morton | Carbon steel surgical blades | |
| Sodium acetate | Sigma-Aldrich | S2889 | Chemical |
| Sodium chloride | Sigma-Aldrich | 746398 | Chemical |
| Solidworks | Dassault Systemes | 3D-CAD designing software | |
| Spin coater | SPS | Spin150 | Wafer spinner |
| SU-8 3000 series | MicroChem Corp. | SU-8 3050 | Photoresist |
| Syringe | BD | 309628 | 1 mL Luer-Lok syringe |
| UV crosslinker | Uvitec | CL-508 | UV crosslinker |
Referenzen
- Garman, E. F. Radiation damage in macromolecular crystallography: what is it and why should we care. Acta Crystallographica, Section D: Biological Crystallography. 66, 339-351 (2010).
- Henderson, R. The potential and limitations of neutrons, electrons and X-rays for atomic resolution microscopy of unstained biological molecules. Quarterly Reviews of Biophysics. 28 (2), 171-193 (1995).
- Fraser, J. S., et al. Accessing protein conformational ensembles using room-temperature X-ray crystallography. Proceedings of the National Academy of Sciences of the United States of America. 108 (39), 16247-16252 (2011).
- Gotthard, G., et al. Specific radiation damage is a lesser concern at room temperature. IUCrJ. 6 (4), 665-680 (2019).
- Martin-Garcia, J. M., Conrad, C. E., Coe, J., Roy-Chowdhury, S., Fromme, P. Serial femtosecond crystallography: A revolution in structural biology. Archives of Biochemistry and Biophysics. 602, 32-47 (2016).
- Gicquel, Y., et al. Microfluidic chips for in situ crystal X-ray diffraction and in situ dynamic light scattering for serial crystallography. Journal of Visualized Experiments: JoVE. (134), e57133(2018).
- Chapman, H. N., et al. Femtosecond X-ray protein nanocrystallography. Nature. 470, 73-78 (2011).
- Hunter, M. S., et al. Fixed-target protein serial microcrystallography with an x-ray free electron laser. Science Reports. 4, 6026(2014).
- Pawate, A. S., et al. Towards time-resolved serial crystallography in a microfluidic device. Acta Crystallographica, Section F: Structural Biology Communications. 71, 823-830 (2015).
- Owen, R. L., et al. Low-dose fixed-target serial synchrotron crystallography. Acta Crystallographica, Section D: Structural Biology. 73, 373-378 (2017).
- Leng, J., Salmon, J. -B. Microfluidic crystallization. Lab on a Chip. 9, 24-34 (2009).
- Morel, M., Galas, J. -C., Dahan, M., Studer, V. Concentration landscape generators for shear free dynamic chemical stimulation. Lab on a Chip. 12, 1340-1346 (2012).
- Miralles, V., Huerre, A., Malloggi, F., Jullien, M. -C. A review of heating and temperature control in microfluidic systems: techniques and applications. Diagnostics. 3, 33-67 (2013).
- Sui, S., Perry, S. L. Microfluidics: from crystallization to serial time-resolved crystallography. Structural Dynamics. 4, 032202(2017).
- Hansen, C. L., Sommer, M. O. A., Quake, S. R. Systematic investigation of protein phase behavior with a microfluidic formulator. Proceedings of the National Academy of Sciences of the United States of America. 101 (40), 14431-14436 (2004).
- Laval, P., Lisai, N., Salmon, J. -B., Joanicot, M. A microfluidic device based on droplet storage for screening solubility diagrams. Lab on a Chip. 7, 829-834 (2007).
- Shim, J. -U., et al. Control and measurement of the phase behavior of aqueous solutions using microfluidics. Journal of the American Chemical Society. 129, 8825-8835 (2007).
- Selimovic, S., Gobeaux, F., Fraden, S. Mapping and manipulating temperature-concentration phase diagrams using microfluidics. Lab on a Chip. 10, 1696-1699 (2010).
- Junius, N., et al. A microfluidic device for both on-chip dialysis protein crystallization and in situ X-ray diffraction. Lab on a Chip. 20, 296-310 (2020).
- Greaves, E. D., Manz, A. Towards on-chip X-ray analysis. Lab on a Chip. 5, 382-391 (2005).
- Dhouib, K., et al. Microfluidic chips for the crystallization of biomacromolecules by counter-diffusion and on-chip crystal X-ray analysis. Lab on a Chip. 9, 1412-1421 (2009).
- Guha, S., Perry, S. L., Pawate, A. S., Kenis, P. J. A. Fabrication of X-ray compatible microfluidic platforms for protein crystallization. Sensors and Actuators B. Chemical. 174, 1-9 (2012).
- Sui, S., et al. Graphene-based microfluidics for serial crystallography. Lab on a Chip. 16, 3082-3096 (2016).
- Russo Krauss, I., Merlino, A., Vergara, A., Sica, F. An overview of biological macromolecule crystallization. International Journal of Molecular Science. 14, 11643-11691 (2013).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta Crystallographica, Section F: Structural Biology and Crystallization Communications. 70, 2-20 (2014).
- Zheng, B., Tice, J. D., Roach, L. S., Ismagilov, R. F. A droplet-based, composite PDMS/Glass capillary microfluidic system for evaluating protein crystallization conditions by microbatch and vapor-diffusion methods with on-chip X-ray diffraction. Angewandte Chemie. 43, International Edition in English 2508-2511 (2004).
- Talreja, S., Kim, D. Y., Mirarefi, A. Y., Zukoski, C. F., Kenis, P. J. A. Screening and optimization of protein crystallization conditions through gradual evaporation using anovel crystallization platform. Journal of Applied Crystallography. 38, 988-995 (2005).
- Hansen, C. L., Classen, S., Berger, J. M., Quake, S. R. A microfluidic device for kinetic optimization of protein crystallization and in situ structure determination. Journal of American Chemical Society. 128, 3142-3143 (2006).
- Schieferstein, J. M., et al. X-ray Transparent microfluidic platforms for membrane protein crystallization with microseeds. Lab on a Chip. 18, 944-954 (2018).
- Ghazal, A., et al. Recent advances in X-ray compatible microfluidics for applications in soft materials and life sciences. Lab on a Chip. 16, 4263-4295 (2016).
- Li, L., Ismagilov, R. F. Protein crystallization using microfluidic technologies based on valves, droplets, and SlipChip. Annual Review of Biophysics. 39, 139-158 (2010).
- Du, W., Li, L., Nichols, K. P., Ismagilov, R. F. SlipChip. Lab on a Chip. 9, 2286-2292 (2009).
- Zhang, S., et al. Microfluidic platform for optimization of crystallization conditions. Journal of Crystal Growth. 472, 18-28 (2017).
- Abdallah, B. G., et al. Protein crystallization in an actuated microfluidic nanowell device. Crystal Growth & Design. 16, 2074-2082 (2016).
- Monteiro, D. C. F., et al. A microfluidic flow-focusing device for low sample consumption serial synchrotron crystallography experiments in liquid flow. Journal of Synchrotron Radiation. 26, 406-412 (2019).
- de Wijn, R., et al. A simple and versatile microfluidic device for efficient biomacromolecule crystallization and structural analysis by serial crystallography. IUCrJ. 6, 454-464 (2019).
- Shim, J. -U., Cristobal, G., Link, D. R., Thorsen, T., Fraden, S. Using microfluidics to decouple nucleation and growth of protein crystals. Crystal Growth & Design. 7, 2192-2194 (2007).
- de Jong, J., Lammertink, R. G. H., Wessling, M. Membranes and microfluidics: a review. Lab on a Chip. 6, 1125-1139 (2006).
- Paustian, J. S., Nery Azevedo, R., Lundin, S. T. B., Gilkey, M. J., Squires, T. M. Microfluidic microdialysis: spatiotemporal control over solution microenvironments using integrated hydrogel membrane microwindows. Physical Review X. 3, 041010(2013).
- Kornreich, M., Heymann, M., Fraden, S., Beck, R. Cross polarization compatible dialysis chip. Lab on a Chip. 14, 3700-3704 (2014).
- Song, S., Singh, A. K., Shepodd, T. J., Kirby, B. J. Microchip dialysis of proteins using in situ photopatterned nanoporous polymer membranes. Analytical Chemistry. 76, 2367-2373 (2004).
- Skou, M., Skou, S., Jensen, T. G., Vestergaard, B., Gillilan, R. E. In situ microfluidic dialysis for biological small-angle X-ray scattering. Journal of Applied Crystallography. 47, 1355-1366 (2014).
- Zou, L., et al. A multistage dialysis microdevice for extraction of cryoprotectants. Biomedical Microdevices. 19, 30(2017).
- Satya Eswari, J., Naik, S. A critical analysis on various technologies and functionalized materials for manufacturing dialysis membranes. Materials Science for Energy Technologies. 3, 116-126 (2020).
- Spano, M., Salmon, J. -B., Junius, N. FR3044685A1. UJF. , (2015).
- Bartolo, D., Degre, G., Nghe, P., Studer, V. Microfluidic stickers. Lab on a Chip. 8, 274-279 (2008).
- Junius, N., et al. A crystallization apparatus for temperature controlled flow-cell dialysis with real-time visualization. Journal of Applied Crystallography. 49, 806-813 (2016).
- Kabsch, W. XDS. Acta Crystallographica, Section D: Biological Crystallography. 66, 125-132 (2010).
- Winn, M. D., et al. Overview of the CCP4 suite and current developments. Acta Crystallographica, Section D: Biological Crystallography. 67, 235-242 (2011).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and developments of COOT. Acta Crystallographica, Section D: Biological Crystallography. 66, 486-501 (2010).
- Apostolopoulou, V., Junius, N., Sear, R. P., Budayova-Spano, M. Mixing salts and polyethylene glycol into protein solutions: The effects of diffusion across semipermeable membranes and of convection. Crystal Growth & Design. 20, 3927-3936 (2020).
- Liebschner, D., et al. Macromolecular structure determination using X-rays, neutrons and electrons: recent developments in Phenix. Acta Crystallographica, Section D: Structural Biology. 75, 861-877 (2019).
- Xia, Y., Whitesides, G. M. Soft Lithography. Annual Review of Materials Science. 28, 153-184 (1998).
- Nogly, P., et al. Lipidic cubic phase injector is a viable crystal delivery system for time-resolved serial crystallography. Nature Communications. 7, 12314(2016).
- Baxter, E. L., et al. High-density grids for efficient data collection from multiple crystals. Acta Crystallographica, Section D: Structural Biology. 72, 2-11 (2016).
- Feiler, C. G., Wallacher, D., Weiss, M. S. An all-in-one sample holder for macromolecular X-ray crystallography with minimal background scattering. Journal of Visualized Experiments. (149), e59722(2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten