A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוח ניקוד שיטתי עבור דלקת מעיים במודל קוליטיס נתרן סולפט הנגרמת על ידי מורין
In This Article
Summary
ניקוד שיטתי של דלקת מעיים באמצעות מערכת חופשית בסיוע מחשב הוא כלי רב עוצמה להשוות כמותית שינויים היסטופטולוגיים במודלים קוליטיס המאופיינת על ידי נוכחות של כיבים ושינויים דלקתיים. הערכת ניקוד קוליטיס היסטולוגית מחזקת תצפיות קליניות ומאפשרת פרשנות נתונים.
Abstract
מודלים קוליטיס מורין הם כלים כי הם מועסקים בהרחבה במחקרים התמקדו בהבנת הפתוביולוגיה של הפרעות מעיים דלקתיות. עם זאת, סטנדרטים חזקים לכימות אובייקטיבי וניתן לשחזור של חומרת המחלה נשארים מוגדרים. רוב שיטות ניתוח קוליטיס מסתמכות על ניקוד היסטולוגי מוגבל של מקטעים קטנים של המעי, מה שמוביל לניתוחים חלקיים או מוטים. כאן, אנו משלבים רכישת תמונה ברזולוציה גבוהה וניתוח אורך של המעי הגס כולו כדי לכמת פגיעה במעיים וכיב במודל דקסטרן נתרן גופרתי (DSS) המושרה של קוליטיס מורין. פרוטוקול זה מאפשר יצירת תוצאות אובייקטיביות ושחזוריות ללא הכשרה נרחבת של המשתמש. כאן, אנו מספקים פרטים מקיפים על הכנת מדגם וניתוח תמונה באמצעות דוגמאות של נתונים של קוליטיס המושרה DSS. שיטה זו יכולה להיות מותאמת בקלות מודלים אחרים של קוליטיס מורין כי יש דלקת משמעותית הקשורים לפגיעה הרירית. אנו מראים כי השבר של רירית מודלקת/פצועה ושחוקה/כיבית ביחס לאורך המלא של המעי הגס מקבילה באופן הדוק לממצאים קליניים כגון ירידה במשקל בין התקדמות המחלה הנגרמת על ידי DSS. פרוטוקול היסטולוגי זה מספק זמן אמין וסיוע חסכוני לתקנן ניתוחים של פעילות המחלה בצורה לא משוחדת בניסויי קוליטיס DSS.
Introduction
מחסום האפיתל במערכת העיכול ממלא תפקיד מרכזי בהפרדת אנטיגנים ופתוגנים לומינליים מתאי הרקמות הבסיסיים1. פגיעה אפיתל ופצעים ריר לראות בתנאים פתולוגיים כגון מחלות מעי דלקתיות (IBD), איסכמיה, או פציעה כירורגית קשורים עם תסמינים קליניים הכוללים שלשולים, ירידה במשקל, דם בצואה, וכאבי בטן. בתגובה לפציעה, תאי אפיתל נודדים ומתרבים כדי לאפיתל מחדש ולתקן פגמים במחסום הרירית. רזולוציה של דלקת והחזרת שלמות הרירית חיוניים להקמה מחדש של הומאוסטזיס הרירית במעיים ולתפקד2,3,4.
מודלים שונים של בעלי חיים שימשו כדי לחקור את המנגנונים המולקולריים הבסיסיים הקשורים לפגיעה במחסום האפיתל במעיים. מודלים מבוססים היטב וישימים בקלות של קוליטיס המושרה כימית נמצאים בשימוש נרחב, במיוחד במחקרים הקשורים לפגיעה דלקתית כגון מחלות מעי דלקתיות. דגם קוליטיס מורין נפוץ, ניתן לשחזור ואמין מעסיק נתרן גופרתי (DSS) בתיווך פגיעה במעי הגס ודלקת. חומרת המחלה משתנה בהתאם לזן העכבר, מינון של DSS, אורך ניהול DSS, ומשקל מולקולרי של DSS5,6,7.
נזק ריר מעיים במהלך קוליטיס DSS מוערך בדרך כלל באמצעות מדד פעילות המחלה (DAI), ציון מרוכב שנקבע על ידי ירידה במשקל, תוכן דם צואה, ועקביות צואה. תכולת הדם בצואה יכולה להיות מיקרוסקופית (מזוהה באמצעות בדיקת חומצה guaiac צואה) או מקרוסקופי; עקביות צואה מסווגת קשה, רך, או נוזלי (כלומר, שלשול)5,8. ניקוד של פרמטרים קליניים אלה יכול להיות סובייקטיבי ועשוי להשתנות בהתאם לניסיון של המשתמש והטיה, אם כי בסך הכל, הנתונים מספקים מידע אמין ולכן נמצא בשימוש נרחב על ידי חוקרי IBD. לעומת זאת, אין שיטה מקובלת להערכה היסטולוגית של נזקי ריר. לרוב, אזורים נבחרים של המעי הגס נבדקים על ידי פתולוג מיומן וציון בהתבסס על מספר פרמטרים הכוללים בדרך כלל פגיעה בקריפטה וחדירת לויקוציטים9,10,11. עם זאת, מכיוון שמספר הפרמטרים שנחקרו וכמות הרקמות שנותחו משתנה במידה ניכרת בין דוחות בודדים, ההסתגלות של מחקרים רבים שפורסמו מוגבלת. כדי להפחית את הטיית הצופה ולשפר את הקונקורדנציה הבין-מחקרית, פרוטוקול ניקוד היסטולוגי אידיאלי צריך: 1) לכלול את כל אורך המעי הגס, שכן דלקת הרירית במעיים היא לרוב משתנה ולדלג על נגעים נפוצים, 2) להגביל ניתוח לפרמטרים ספציפיים מפתח קל לפרשנות כדי להפחית את הסובייקטיביות, 3) להקל על עיבוד מהיר ועקבי של מספר גדול של דגימות, ו 4) להשתמש בכלים זמינים ובמחיר סביר נרחב לרכישת נתונים, ניתוח ומצגת.
כאן אנו מתארים טכניקה לעבד את המעי הגס כולו או קטעים ארוכים של המעי הדק בתצורת "רול שוויצרי" יחד עם השימוש במערכת ניקוד בסיוע מחשב חינם כדי לנתח דלקת ריר מעיים ונזק בגלל קוליטיס הנגרמת על ידי DSS.
Protocol
כל הניסויים בבעלי חיים שתוארו אושרו על ידי הוועדה של אוניברסיטת מישיגן לשימוש וטיפול בבעלי חיים.
1. קציר רקמות
- המתת חסד עכברים באופן אנושי באמצעות הרדמה isoflurane ואחריו נקע בצוואר הרחם, בהתאם לפרוטוקולים שאושרו. עבור כל הניסויים בבעלי חיים, האישור התקבל על ידי ועדת בדיקה מוסמכת בהתאם להנחיות הלאומיות והמוסדיות לטיפול בבעלי חיים.
- הנח את העכבר על משטח ניתוח במצב על-חושי. לשתק את גפיים העכבר באמצעות 20 G x 1 1/2 אינץ' G מחטים.
- באמצעות מלקחיים ומספריים, לעשות חתך קטן על עור הבטן ולמשוך אותו לצד כדי לחשוף את הצפק.
- פתח את חלל הבטן עם חתך קו האמצע בצפק מעצם הערווה לצדי הבטן.
- בזהירות להסיר רקמות ואיברים עד המעי הגס הוא דמיון. חותכים את עצם האגן משני צידי המעי הגס כדי לדמיין באופן מלא את האיבר, המשתרע מפי הטבעת לכיוון cecum.
- בעדינות להסיר שומן, ורידים קטנים ועורקים המחוברים המעי הגס, תוך ניתוח זהיר של האיבר, חיתוך רק קרוב לפי הטבעת ופשוט distal כדי cecum.
הערה: המעי הגס המנותח צריך להישאר בטמפרטורת החדר תוך השלמת הליך רול שוויצרי. - בזהירות לשטוף את המעי הגס עם 1x PBS, באמצעות מחט gavage פלסטיק גמיש מוכנס דרך פי הטבעת כדי להסיר תוכן צואה.
- מקמו את המעי הגס בקו ישר, ופתחו לאורך העורק המזנטרי. חוצה את המעי הגס לאורך זמן מהדיסטלי לקצה הפרוקסימלי(איור 1A). מחצית אחת של הרקמה יכולה לשמש לניתוח היסטולוגי ואילו השני יכול להיות מעובד עבור כתם מערבי, PCR או התגלגל לתוך גליל שוויצרי שני עבור מיקרוסקופיה קפואה טרי12.
2. הכנת לחמניות שוויצריות
- לקצץ רקמה נוספת מן המעי הגס proximal באמצעות סכין גילוח עד בערך באותו רוחב לאורך המעי הגס כולו מתקבל.
- ליישר את המעי הגס כדי לחשוף את לומן פונה כלפי מעלה, ולשטח את הרקמה לחלוטין באמצעות מחט gavage גמיש. הוסף עוד PBS, במידת הצורך, כדי לשמור על הרקמה לחה לאורך כל ההליך.
- הסר את עודף PBS באמצעות ניגוב נייר. עם מזרק ומחט gavage, להוסיף 10% ניטרלי אגירה פורמלין פתרון על הרקמה במשך 2-3 דקות כדי לתקן ולשטח את הרקמה.
- השתמשו במלקחיים ישרים כדי לתפוס את קצה המעי הגס הדיסטלי ולסובב את המעי הגס לעיגולים קונצנטריים מהסופה הדיסטלית לקצה הפרוקסימלי (איור 1B).
הערה: ניתן לדחוף בחזרה את החלק הפנימי של הגליל השוויצרי תוך כדי גלגול באמצעות האבן כדי להבטיח את הרקמה היא בתוך הגליל. - הכנס מחט 27 G כדי להצמיד את המעי הגס באמצע כדי להחזיק את צורת הגליל השוויצרית שלו (איור 1C).
- מניחים את הגליל השוויצרי עם המחט לתוך קלטת הטמעה בתוך מיכל דגימה היסטולוגית.
הערה: יש לכוון את הרקמה במקביל לקלטת לפני הקיבעון (איור 1D). - לתקן את הרקמה בתמיסת פורמלין אגירה ניטרלית 10% לילה ב 4 °C(70°F 13 ).
- לאחר קיבוע לילה, לשטוף את הרקמה 3x עם PBS.
- מוסיפים 70% אתנול לרקמה לפני תהליך הטמעת הפרפין. הסר את המחט מן הגליל השוויצרי לפני שתמשיך. רקמה ניתן לאחסן אתנול בטמפרטורת החדר עד הטבעה פרפין13.
- הניחו דגימות במעבד הרקמות, הטמיבו בפרפין והכינו 4 מקטעי מיקרומטר, המותקנים על שקופיות מיקרוסקופיות טעונות חיובית (איור 1E). זו יכולה להיות נקודת עצירה אופציונלית.
הערה: כיוון רקמות תקין הוא קריטי להשגת מקטעים המתאימים לניתוח תמונה. הטמעת גליל שוויצרי מקביל בקלטת הפרפין תגרום למקטעים מלאים המתאימים לניתוח תמונה (איור 1F-1H). יש להימנע ממקטעים אלכסוניים כדי למנוע מקטעים לא שלמים (איור 1I-1K). לקבלת פרטים נוספים, עיין בסעיף דיון. - כתמים עם המטוקסילין ואאוסין (H&E)13.
3. סריקה וניתוח דיגיטליים
הערה: להערכה מדויקת של שינויים ריר, בחר רק מקטעים הכוללים לפחות 90% מאורך המעי הגס הכולל.
- סרוק מקטעים מוכתמים באמצעות סורק שקופיות או תמונה (ראה טבלת חומרים). תמונות המיוצרות זקוקות לרזולוציה של 0.25 מיקרון לפיקסל עם מטרה של פי 40 והגדלה של פי 40.
- התקן והורד תוכנה מתאימה לניתוח דיגיטלי של שקופיות סרוקות (ראה טבלת חומרים).
- פתחו תמונות סרוקות בתוכנת עיבוד התמונה (איור 2A). ודא שהמעי הגס כולו גלוי ושלא חסרים אזורים במדגם.
- הפעילו את כלי Imager ו- Scale Bar כדי לזהות כראוי שקופיות סרוקות על-ידי לחיצה על Imager Label (איור 2A).
- פתחו את כלי הביאורים בלחיצה על ביאורים,(איור 2A)ויצרו 3 שכבות שונות בלחיצה על שכבה חדשה (איור 2B)כדי לכמת את האורך הכולל של הגליל השוויצרי, דלקת/פציעה ושחיקה/כיב. בחרו צבע אחר לכל שכבה בלחיצה על 'צבע שכבה' (איור 2B).
- מדדו את אורך כל שכבה/קטגוריה בלחיצה על הכלי עט (איור 2A),תוך שימוש ברירית השרירים כהפניה:
- הצג את התמונה בזום של 400 מיקרומטר (או יותר) כדי להקל על הדמיה נאותה של רירית השרירים.
הערה: הגדלה נשלטת בקלות באמצעות גלגל הגלילה של העכבר ויהיה צורך לכוונן אותה לפי הצורך תוך כדי מעבר על פני המקטע כדי לצייר את כל הקווים. - לחצו על הכלי עט כדי למתוח קו בעקבות רירית השרירים (איור 2A). הזז את המצביע לפי הצורך כדי להציג באופן חזותי את האזור הסמוך לניתוח.
הערה: בכל פעם שהעט מופסק, ייווצר אזור שכבה חדש וקטן. ניתן להמחיש ולערוך אותו באמצעות הכרטיסייה אזורי שכבה (בחר מקטע רצוי ולחץ על מחק שכבה במקרה של טעויות או תיקונים, איור 2B).
- הצג את התמונה בזום של 400 מיקרומטר (או יותר) כדי להקל על הדמיה נאותה של רירית השרירים.
- לאחר הגדרת כל השכבות (איור 2C),יש לייצא את הנתונים באמצעות הלחצן 'ייצוא רשת לקובץ טקסט' בתוך אפשרויות אזורי השכבה (איור 2B).
הערה: שמרו קבצים לעתים קרובות בשעת יצירת השכבות כדי להבטיח שהנתונים מאוחסנים כראוי. - פתח את קבצי הטקסט והעתק את הנתונים באמצעות תוכנת גיליון אלקטרוני. סה"כ את כל המקטעים מכל אזור וחשב את אחוז הפציעה והכיב ביחס לאורך הכולל.
- כדי לחשב את ציון קוליטיס היסטולוגית (HCS) וכדי להעריך את חומרת המחלה, לשקול שלושה מאפיינים עיקריים כמפורט להלן.
- בדוק אם יש רירית מעיים בריאה המאופיינת בתאי אפיתל מאורגנים בציר הקריפטה-לומינלית, למינה פרופריה עם מעט תאי חיסון, ורירית שרירים תת-עורית המתממשקת לרירית ולתת-מוקסיה(איור 3A).
- בדוק אם יש דלקת/פציעה המאופיינת בקריפטות אפיתל מוחלשות או חסרות חלקית בתאי אפיתל ודלקת ריר עם חדירת נויטרופילים לקריפטות (איור 3B).
- בדוק אם יש נוכחות של שחיקה/כיב המאופיינת באזורים נטולי אפיתל פני השטח או באזורים שחסרים בהם לחלוטין קריפטות אפיתל עם או בלי לויקוציטים קשורים(איור 3C).
- חשב HCS של אזורים פצועים וכיבים המבוטאים כאחוז מהאורך הכולל בנוסחה הבאה:
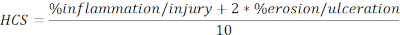
הערה: HCS משלב את אחוז הדלקת/פציעה והשחיקה/כיב ומוסיף גורם של שניים לאחרון, בהתבסס על הנחה סבירה כי אובדן מוחלט של האפיתל גורם לאובדן מרבי של שלמות המחסום ומכאן מחלה גרועה יותר. HCS מייצג באופן עקבי את השינויים המורפולוגיים הנגרמים על ידי קוליטיס ניסיונית הנגרמת על ידי DSS. מעניין, לא ראינו מתאם ברור בין המספרים של אגרגטים לימפואיד המעי הגס או זקיקים וחומרת המחלה הקלינית קוליטיס DSS, ולכן, לא כללנו את הכימות בניתוח זה. - צלם תמונה של התמונות המייצגות (לחץ על תצלום בזק, איור 2A)ושמור. כלול סרגלי קנה מידה במידת הצורך על-ידי לחיצה על הצג/הסתר סרגל קנה מידה (איור 2A).
תוצאות
כדי להמחיש את האמינות של ניתוח ניקוד קוליטיס היסטולוגי זה בהקשר של נזק ריר לאחר אתגר DSS והתאוששות לאחר מכן קוליטיס, ניהלנו 2.5% DSS במי שתייה של שמונה עכברים מסוג C57BL6 זכר בן 10 שבועות במשך 5 ימים ואחריו תקופת התאוששות עם מים רגילים במשך 5 ימים. לא חל שינוי במשקל הגוף במהלך הניהול...
Discussion
מערכת הקוליטיס ההיסטולוגית שלנו מהווה כלי אמין לכימות דלקת רקמות ונזק במעי. גישה זו מספקת הבנה משופרת של המצב ההיסטופטולוגי של האיבר כולו ללא הטיה של בחירת אזורים קטנים או קטעים לא שלמים. בין הצעדים הקריטיים לביצוע מוצלח של פרוטוקול זה ניתן למנות הכנה נכונה של לחמניות שוויצריות המאפשרות ?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מבקשים להכיר בתמיכה של NIH מימון DK055679, DK089763, DK079392, DK061739, DK072564 ושירותי סריקת שקופיות פתולוגיה של אוניברסיטת מישיגן.
Materials
| Name | Company | Catalog Number | Comments |
| Aperio AT2 – High Volume, Digital Whole Slide Scanning | Leica Biosystems | Aperio AT2 | |
| Absorbent Underpads with waterproof moisture barrier | VWR International | 56616-032 | |
| American Line 66-0089 Single Edge Blade, 100 per pkg | GT Midwest | TL5837 | |
| BD Luer-Lok Disposable Syringes without Needles | Fisher scientific | 14-823-2A | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 11103-09 | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 14084-09 | |
| Dumont #5 Forceps | Fine Science tools | 11251-20 | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501640-19L | |
| HistoPrep 70% Ea | Fisherbran | 70% denatured ethyl alcohol | |
| ImageScope | Aperio | Version 12.3.3.5039 | http://www.leicabiosystems.com/pathology-imaging/aperio-epathology/integrate/imagescope/ |
| LeakBuster Specimen Containers: Sterile | Starplex Scientific | B120210 | |
| Phosphate-Buffere Saline, without calcium & magnesium | Corning | 21-040-CV | |
| Plastic Feeding tubes, 20 GA x 30 mm | Instech | FTP2030 | |
| PrecisionGlide Needle, Size: 20 G x 1 1/2 in | BD (Becton, Dickinson and Company) | 305176 | |
| PrecisionGlide Needle, Size: 27 G x 1/2 in | BD (Becton, Dickinson and Company) | 305109 | |
| Syringe, 10 ml | BD (Becton, Dickinson and Company) | 302995 | |
| Unisette Tissue Cassettes | Simport | M505-2 |
References
- Kagnoff, M. F. The intestinal epithelium is an integral component of a communications network. Journal of Clinical Investigation. 124 (7), 2841-2843 (2014).
- Laukoetter, M. G., Nava, P., Nusrat, A. Role of the intestinal barrier in inflammatory bowel disease. World Journal of Gastroenterology. 14 (3), 401-407 (2008).
- Baumgart, D. C., Sandborn, W. J. Crohn's disease. Lancet. 380 (9853), 1590-1605 (2012).
- Ordas, I., Eckmann, L., Talamini, M., Baumgart, D. C., Sandborn, W. J. Ulcerative colitis. Lancet. 380 (9853), 1606-1619 (2012).
- Vowinkel, T., Kalogeris, T. J., Mori, M., Krieglstein, C. F., Granger, D. N. Impact of dextran sulfate sodium load on the severity of inflammation in experimental colitis. Digestive Diseases and Sciences. 49 (4), 556-564 (2004).
- Kitajima, S., Takuma, S., Morimoto, M. Histological analysis of murine colitis induced by dextran sulfate sodium of different molecular weights. Experimental Animals. 49 (1), 9-15 (2000).
- Mahler, M., et al. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. American Journal of Physiology. 274 (3), 544-551 (1998).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nature Protocols. 2 (3), 541-546 (2007).
- Kozlowski, C., et al. An entirely automated method to score DSS-induced colitis in mice by digital image analysis of pathology slides. Disease Models & Mechanisms. 6 (3), 855-865 (2013).
- Perse, M., Cerar, A. Dextran sodium sulphate colitis mouse model: traps and tricks. Journal of Biomedicine and Biotechnology. 2012, 718617 (2012).
- Mizoguchi, A. Animal models of inflammatory bowel disease. Progress in Molecular Biology and Translational Science. 105, 263-320 (2012).
- Flemming, S., et al. Desmocollin-2 promotes intestinal mucosal repair by controlling integrin-dependent cell adhesion and migration. Molecular Biology of the Cell. 31 (6), 407-418 (2020).
- Luna, L. G. . Armed Forces Institute of Pathology (U.S) & Armed Forces Institute of Pathology (U.S.). Manual of Histologic Staining Methods of the Armed Forces Institute of Pathology. 3d edn. , (1968).
- Kelm, M., et al. Targeting epithelium-expressed sialyl Lewis glycans improves colonic mucosal wound healing and protects against colitis. The Journal of Clinical Investigation Insight. 5 (12), (2020).
- Reed, M., et al. Epithelial CD47 is critical for mucosal repair in the murine intestine in vivo. Nature Communications. 10 (1), 5004 (2019).
- Laukoetter, M. G., et al. JAM-A regulates permeability and inflammation in the intestine in vivo. Journal of Experimental Medicine. 204 (13), 3067-3076 (2007).
- Khounlotham, M., et al. Compromised intestinal epithelial barrier induces adaptive immune compensation that protects from colitis. Immunity. 37 (3), 563-573 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved