Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Murine Dextran Sodyum Sülfat Kaynaklı Kolit Modelinde Bağırsak İltihabı İçin Sistematik Puanlama Analizi
Bu Makalede
Özet
Ücretsiz bilgisayar destekli bir sistem kullanılarak bağırsak iltihabının sistematik olarak puanlanması, ülser ve enflamatuar değişikliklerin varlığı ile karakterize kolit modellerindeki histopatolojik değişiklikleri nicel olarak karşılaştırmak için güçlü bir araçtır. Histolojik kolit skoru değerlendirmesi klinik gözlemleri güçlendirir ve veri yorumlamayı kolaylaştırır.
Özet
Murine kolit modelleri, enflamatuar bağırsak bozukluklarının patobiyolojisini anlamaya odaklanan çalışmalarda yoğun olarak kullanılan araçlardır. Bununla birlikte, hastalık şiddetinin objektif ve tekrarlanabilir nicelemesi için sağlam standartlar tanımlanmaya devam etmektedir. Kolit analiz yöntemlerinin çoğu, küçük bağırsak segmentlerinin sınırlı histolojik puanlamasına dayanır ve kısmi veya taraflı analizlere yol açar. Burada, dektran sodyum sülfat (DSS) kaynaklı murine kolit modelinde bağırsak yaralanması ve ülserasyonunu ölçmek için tüm kolonun yüksek çözünürlüklü görüntü alımını ve boyuna analizini birleştiriyoruz. Bu protokol, kapsamlı kullanıcı eğitimi olmadan objektif ve tekrarlanabilir sonuçların üretilmesine izin verir. Burada, DSS kaynaklı kolitten elde edilen verilerin örneklerini kullanarak numune hazırlama ve görüntü analizi hakkında kapsamlı ayrıntılar sunuyoruz. Bu yöntem, mukozal yaralanma ile ilişkili önemli inflamasyona sahip diğer murine kolit modellerine kolayca uyarlanabilir. Kolonun tam uzunluğuna göre iltihaplı/yaralı ve aşınmış/ülserli mukoza fraksiyonunun DSS kaynaklı hastalık ilerlemesi sırasında kilo kaybı gibi klinik bulgularla yakından paralellik gösterdiğini gösteriyoruz. Bu histolojik protokol, DSS kolit deneylerinde hastalık aktivitesinin analizlerini tarafsız bir şekilde standartlaştırmak için güvenilir bir zaman ve uygun maliyetli yardım sağlar.
Giriş
Gastrointestinal epitel bariyeri, luminal antijenlerin ve patojenlerin alttaki doku bölmelerinden ayrılmasında önemli bir rol oynar1. İnflamatuvar bağırsak hastalığı (IBD), iskemi veya cerrahi yaralanma gibi patolojik durumlarda görülen epitel yaralanması ve mukozal yaralar ishal, kilo kaybı, dışkıda kan ve karın ağrısı gibi klinik semptomlarla ilişkilidir. Yaralanmaya yanıt olarak, epitel hücreleri mukozal bariyer kusurlarını yeniden epitelleştirmek ve onarmak için göç eder ve çoğalır. enflamasyonun çözülmesi ve mukozal bütünlüğün iadesi, bağırsak mukozal homeostazının ve fonksiyon 2 ,3,4'ün yeniden kurulması için çok önemlidir.
Bağırsak epitel bariyerinin hasarı ile ilişkili alttaki moleküler mekanizmaları incelemek için çeşitli hayvan modelleri gütlenmiştir. Kimyasal olarak indüklenen kolitin iyi kurulmuş ve kolayca uygulanabilir modelleri, özellikle IBD gibi enflamatuar yaralanma ile ilgili çalışmalarda yaygın olarak kullanılmaktadır. Yaygın, tekrarlanabilir ve güvenilir bir murine kolit modeli, dektran sodyum sülfat (DSS) aracılı kolon yaralanması ve iltihabını kullanmaktadır. Hastalığın şiddeti fare suşuna, DSS dozu, DSS uygulama uzunluğu ve DSS5, 6,7moleküler ağırlığına bağlı olarak değişir.
DSS kolit sırasında bağırsak mukozal hasarı genellikle kilo kaybı, dışkı kan içeriği ve dışkı kıvamına göre belirlenen bileşik bir puan olan Hastalık Aktivite Endeksi (DAI) kullanılarak değerlendirilir. Dışkı kan içeriği mikroskobik (dışkı guaiac asit testi kullanılarak tespit edilebilir) veya makroskopik olabilir; dışkı kıvamı sert, yumuşak veya sıvı (yani ishal) olarak sınıflandırılır5,8. Bu klinik parametrelerin puanlaması öznel olabilir ve kullanıcının deneyimine ve önyargısına bağlı olarak değişebilir, ancak genel olarak veriler güvenilir bilgi sağlar ve bu nedenle IBD araştırmacıları tarafından yaygın olarak kullanılır. Buna karşılık, mukozal hasarın histolojik olarak değerlendirilmesi için genel olarak kabul edilen bir yöntem yoktur. En yaygın olarak, kolonun seçilen alanları eğitimli bir patolog tarafından incelenir ve genellikle kript yaralanması ve lökosit infiltrasyonunu9, 10,11içeren çeşitli parametrelere göre puanlanır. Bununla birlikte, araştırılan parametrelerin sayısı ve analiz edilen doku miktarı bireysel raporlar arasında önemli ölçüde değiştiğinden, yayınlanan birçok çalışmanın karşılaştırılabilme kabiliyeti sınırlıdır. Gözlemci önyargısını azaltmak ve çalışmalar arası uyumluluğu artırmak için ideal bir histolojik puanlama protokolü: 1) bağırsak mukoza iltihabı en sık değişken olduğu ve atlama lezyonları yaygın olduğu için kolonun tüm uzunluğunu içermelidir, 2) öznellik azaltmak için analizi belirli anahtar ve kolayca yorumlanabilir parametrelerle sınırlayın, 3) çok sayıda örneğin hızlı, tutarlı bir şekilde işlenmesini kolaylaştırmak ve 4) veri toplama, analiz ve sunum için yaygın ve uygun fiyatlı araçlar kullanmak.
Burada, ince bağırsağın tüm kolon veya uzun segmentlerini bir "İsviçre rulosu" konfigürasyonunda işlemek için bir teknik ve DSS kaynaklı kolit nedeniyle bağırsak mukozal iltihabını ve hasarını analiz etmek için ücretsiz bir bilgisayar destekli puanlama sisteminin kullanımını açıklıyoruz.
Protokol
Açıklanan tüm hayvan deneyleri Michigan Üniversitesi Hayvanların Kullanımı ve Bakımı Komitesi tarafından onaylandı.
1. Doku hasadı
- Onaylanan protokollere uygun olarak fareleri izofluran anestezisi ve ardından servikal çıkık kullanarak insanca ötenazi. Tüm hayvan deneyleri için, sertifikalı bir inceleme kurulu tarafından hayvan elleçleme için Ulusal ve Kurumsal yönergelere uygun olarak onay alındı.
- Fareyi bir diseksiyon pedi üzerine supine pozisyonunda yerleştirin. 20 G x 1 1/2 inç G iğneler kullanarak fare ekstremitelerini hareketsiz hale getir.
- Perten ve makas kullanarak, karın derisinde küçük bir kesi yapın ve peritonun ortaya çıkması için yana doğru çekin.
- Kasık kemiğinden karın kenarlarına kadar peritonda orta çizgi kesi ile karın boşluğunu açın.
- Kalın bağırsak görselleşene kadar dokuları ve organları dikkatlice çıkarın. Organı tamamen görselleştirmek için kolonun her iki tarafındaki pelvik kemiği kesin, anüsten cecum'a doğru uzanın.
- Kolona bağlı yağ, küçük damarlar ve arterleri yavaşça çıkarın, organı dikkatlice parçalara ayırın, anüse sadece proksimal kesin ve sadece obtal.
NOT: Parçalanmış kolon, İsviçre rulo prosedürünü tamamlarken oda sıcaklığında kalmalıdır. - Dışkı içeriğini çıkarmak için anüsten yerleştirilmiş esnek bir plastik gavage iğnesi kullanarak kolonu 1x PBS ile dikkatlice yıkayın.
- Kolonu düz bir çizgiye yerleştirin ve mezenterik arter boyunca uzunlamasına açın. Kolonu distalden proksimal uca boyuna ikiye ayırın (Şekil 1A). Dokunun bir yarısı histolojik analiz için kullanılabilirken, diğeri batı lekesi, PCR için işlenebilir veya taze dondurulmuş immünofolüoresans mikroskopisi için ikinci bir İsviçre rulosuna yuvarlanabilir12.
2. İsviçre rulolarının hazırlanması
- Tüm kolonun uzunluğu boyunca yaklaşık aynı genişlik elde edilene kadar bir jilet kullanarak proksimal kolondan ekstra doku kırpın.
- Lümeni yukarı bakacak şekilde hizalayın ve esnek bir gavage iğnesi kullanarak dokuyu tamamen düzleştirin. İşlem boyunca dokuyu nemli tutmak için gerekirse daha fazla PBS ekleyin.
- Kağıt mendil kullanarak PBS'nin fazlalığını çıkarın. Bir şırınga ve gavage iğnesi ile, dokuyu düzeltmek ve düzlemek için 2-3 dakika boyunca doku üzerine% 10 nötr tamponlu formalin çözeltisi ekleyin.
- Distal kolonun ucunun ucunun kavraçlarını almak ve kolonu distalden proksimal uca eşmerkezli daireler halinde bükmek için düz tokmaklar kullanın (Şekil 1B).
NOT: Dokunun rulonun içinde olduğundan emin olmak için delme kullanarak yuvarlanırken İsviçre rulosunun içini geri itmek mümkündür. - İsviçre rulo şeklini tutmak için kolonu ortaya sabitlemek için 27 G'lik bir iğne yerleştirin (Şekil 1C).
- İğne ile İsviçre rulosunu histolojik bir numune kabının içine gömme bir kasete yerleştirin.
NOT: Doku, sabitlemeden önce kasete paralel olarak yönlendirilmelidir (Şekil 1D). - Dokuyu 4 °C 13'te bir gecede %10nötr tamponlu formalin çözeltisinde sabitle.
- Gece sabitlemeden sonra, dokuyu PBS ile 3x yıkayın.
- Parafin gömme işlemi öncesinde dokuya %70 etanol ekleyin. Devam etmeden önce iğneyi İsviçre rulosundan çıkarın. Doku, parafin gömme13'ekadar oda sıcaklığında etanolde saklanabilir.
- Örnekleri doku işlemcisine yerleştirin, parafin içine gömün ve pozitif yüklü mikroskopi slaytlarına monte edilmiş 4 μm bölüm hazırlayın (Şekil 1E). Bu isteğe bağlı bir durma noktası olabilir.
NOT: Görüntü analizine uygun bölümlere ulaşmak için uygun doku yönlendirmesi kritik öneme sahiptir. Parafin kasetine paralel İsviçre rulosu gömmesi, görüntü analizi için uygun tam bölümlere neden olacaktır (Şekil 1F-1H). Eksik bölümleri önlemek için eğik bölümlerden kaçınılmalıdır (Şekil 1I-1K). Daha fazla ayrıntı için Tartışma bölümüne bakın. - Hematoksilin ve eozin (H&E)13ile leke bölümleri.
3. Dijital tarama ve analiz
NOT: Mukozal değişikliklerin doğru değerlendirilmesi için, yalnızca toplam kolon uzunluğunun en az% 90'ını içeren bölümleri seçin.
- Lekeli bölümleri slayt tarayıcısı veya görüntüleyicı kullanarak tarayın (bkz. Malzeme Tablosu). Üretilen görüntüler, 40x amaç ve 40x büyütme ile piksel başına 0,25 mikron çözünürlüğe ihtiyaç duyar.
- Taranan slaytların dijital analizi için uygun bir yazılım yükleyin ve indirin (bkz. Malzeme Tablosu).
- Taranan görüntüleri görüntü işleme yazılımında açın (Şekil 2A). İki nokta üst üste işaretinin tamamının görünür olduğunu ve örneğin eksik alanlarının olmadığını doğrulayın.
- Etiket görüntüleyicısı(Şekil 2A)öğesini tıklatarak taranan slaytları doğru şekilde tanımlamak için etiket görüntüleyicİsini ve ölçek çubuğu araçlarını etkinleştirin.
- Ek Açıklamalar aracını Ek Açıklamalar 'ı(Şekil 2A) tıklatarak açın ve İsviçre rulosuna, iltihaplanmaya/yaralanmaya ve erozyona/ülserasyona ilişkin toplam uzunluğu ölçmek için Yeni katmana ( Şekil2B) tıklayarak 3 farklı katman oluşturun. Katman rengi (Şekil 2B) öğesini tıklatarak her katman için farklı bir renk seçin.
- Referans olarak muscularis mukozasını kullanarak Kalem aracını (Şekil 2A) tıklatarak her katmanın/kategorinin uzunluğunu ölçün:
- Muscularis mukozasının yeterli görselleştirilmesini kolaylaştırmak için görüntüyü 400 μm yakınlaştırmada (veya daha fazla) görüntüleyin.
NOT: Büyütme, fare kaydırma tekerleği kullanılarak kolayca kontrol edilir ve tüm çizgileri çizmek için bölüm boyunca hareket ederken gerektiği gibi ayarlanması gerekir. - Muscularis mukozasını takiben bir çizgi çizmek için Kalem aracına tıklayın (Şekil 2A). Çözümleme için bitişik alanı görselleştirmek için işaretçiyi gerektiği gibi hareket ettirın.
NOT: Kalem her durdurulduğunda, küçük bir yeni katman bölgesi oluşturulur. Katman bölgeleri sekmesiyle görselleştirilebilir ve düzenlenebilir (istediğiniz segmenti seçin ve hata veya düzeltme durumunda Katmanı Sil'i tıklatın, Şekil 2B).
- Muscularis mukozasının yeterli görselleştirilmesini kolaylaştırmak için görüntüyü 400 μm yakınlaştırmada (veya daha fazla) görüntüleyin.
- Tüm katmanlar (Şekil 2C) tanımlandıktan sonra, katman bölgeleri seçeneklerinin içindeki Izgarayı Metin Dosyasına Aktar düğmesini kullanarak verileri dışa aktarın (Şekil 2B).
NOT: Verilerin düzgün depolandığından emin olmak için katmanları oluştururken dosyaları sık sık kaydedin. - Metin dosyalarını açın ve verileri bir elektronik tablo yazılımıyla kopyalayın. Her bölgedeki tüm segmentleri toplayın ve toplam uzunluğa göre yaralanma ve ülserasyon yüzdesini hesaplayın.
- Histolojik Kolit Skorunu (HCS) hesaplamak ve hastalığın şiddetini değerlendirmek için, üç ana özelliği aşağıda ayrıntılı olarak düşünün.
- Kripto-luminal eksende organize epitel hücreleri, az sayıda bağışıklık hücresine sahip lamina propria ve mukoza ve submucosa'yı arayüzleyen subjacent muscularis mukozası ile karakterize edilen sağlıklı bağırsak mukozasını kontrol edin (Şekil 3A).
- Zayıflatılmış veya kısmen eksik epitel hücreleri ve kriptolara nötrofil infiltrasyonlu mukozal inflamasyon ile karakterize olan iltihap/yaralanma olup olmadığını kontrol edin (Şekil 3B).
- Yüzey epitelden yoksun alanlar veya ilişkili lökositli veya ilişkili lökositsiz epitel mahzenlerinden tamamen yoksun alanlarla karakterize edilen erozyon / ülserasyon varlığını kontrol edin (Şekil 3C).
- Aşağıdaki formülde toplam uzunluğun yüzdesi olarak ifade edilen yaralı ve ülserli bölgelerin HCS'sini hesaplayın:
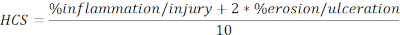
NOT: HCS, epitelin tamamen kaybedilmesinin maksimum bariyer bütünlüğü kaybına ve dolayısıyla daha kötü hastalığa neden olduğu makul bir varsayıma dayanarak, iltihaplanma / yaralanma ve erozyon / ülserasyon yüzdesini ikincisine iki faktör ekleyerek birleştirir. HCS, DSS indüklenmiş deneysel kolitin neden olduğu morfolojik değişiklikleri sürekli olarak temsil eder. İlginçtir ki, DSS kolitinde kolonik lenfoid agrega veya folikül sayısı ile klinik hastalık şiddeti arasında net bir korelasyon görmedik ve bu nedenle bu analize niceliği dahil etmedik. - Temsili görüntülerin anlık görüntüsünü alın (Anlık Görüntü, Şekil 2A'yı tıklatın) ve kaydedin. Ölçek Çubuğunu Göster/Gizle 'ye tıklayarak gerekirse ölçek çubuklarını dahil edin (Şekil 2A).
Sonuçlar
Bu Histolojik Kolit Skor Analizinin güvenilirliğini DSS meydan okuması ve daha sonra kolitten iyileşmeden sonra mukozal hasar bağlamında göstermek için, 5 gün boyunca sekiz 10 haftalık erkek C57BL6 vahşi tip farelerin içme suyunda% 2.5 DSS uyguladık ve ardından 5 gün boyunca düzenli su ile bir geri kazanım süresi uyguladık. DSS'nin akut yönetimi sırasında vücut ağırlığında 0'dan 5'e kadar bir değişiklik olmadı (Şekil 4A). Vücu...
Tartışmalar
Histolojik Kolit Skor sistemimiz doku iltihabını ve bağırsaktaki hasarı ölçmek için güvenilir bir araçtır. Bu yaklaşım, küçük alanlar veya eksik bölümler seçme önyargısı olmadan tüm organın histopatolojik durumunun daha iyi anlaşılmasını sağlar. Bu protokolü başarıyla yürütmek için kritik adımlar arasında, kolon uzunluğunun en az% 90'ının analizine izin veren İsviçre rulolarının uygun şekilde hazırlanması vardır; epitel mahzenlerinin boyuna görünümlerine sahip düz ve d?...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar NIH'nin DK055679, DK089763, DK079392, DK061739, DK072564 ve Michigan Üniversitesi Patoloji Slayt Tarama Hizmetleri'nden destek almak istemeleridir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Aperio AT2 – High Volume, Digital Whole Slide Scanning | Leica Biosystems | Aperio AT2 | |
| Absorbent Underpads with waterproof moisture barrier | VWR International | 56616-032 | |
| American Line 66-0089 Single Edge Blade, 100 per pkg | GT Midwest | TL5837 | |
| BD Luer-Lok Disposable Syringes without Needles | Fisher scientific | 14-823-2A | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 11103-09 | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 14084-09 | |
| Dumont #5 Forceps | Fine Science tools | 11251-20 | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501640-19L | |
| HistoPrep 70% Ea | Fisherbran | 70% denatured ethyl alcohol | |
| ImageScope | Aperio | Version 12.3.3.5039 | http://www.leicabiosystems.com/pathology-imaging/aperio-epathology/integrate/imagescope/ |
| LeakBuster Specimen Containers: Sterile | Starplex Scientific | B120210 | |
| Phosphate-Buffere Saline, without calcium & magnesium | Corning | 21-040-CV | |
| Plastic Feeding tubes, 20 GA x 30 mm | Instech | FTP2030 | |
| PrecisionGlide Needle, Size: 20 G x 1 1/2 in | BD (Becton, Dickinson and Company) | 305176 | |
| PrecisionGlide Needle, Size: 27 G x 1/2 in | BD (Becton, Dickinson and Company) | 305109 | |
| Syringe, 10 ml | BD (Becton, Dickinson and Company) | 302995 | |
| Unisette Tissue Cassettes | Simport | M505-2 |
Referanslar
- Kagnoff, M. F. The intestinal epithelium is an integral component of a communications network. Journal of Clinical Investigation. 124 (7), 2841-2843 (2014).
- Laukoetter, M. G., Nava, P., Nusrat, A. Role of the intestinal barrier in inflammatory bowel disease. World Journal of Gastroenterology. 14 (3), 401-407 (2008).
- Baumgart, D. C., Sandborn, W. J. Crohn's disease. Lancet. 380 (9853), 1590-1605 (2012).
- Ordas, I., Eckmann, L., Talamini, M., Baumgart, D. C., Sandborn, W. J. Ulcerative colitis. Lancet. 380 (9853), 1606-1619 (2012).
- Vowinkel, T., Kalogeris, T. J., Mori, M., Krieglstein, C. F., Granger, D. N. Impact of dextran sulfate sodium load on the severity of inflammation in experimental colitis. Digestive Diseases and Sciences. 49 (4), 556-564 (2004).
- Kitajima, S., Takuma, S., Morimoto, M. Histological analysis of murine colitis induced by dextran sulfate sodium of different molecular weights. Experimental Animals. 49 (1), 9-15 (2000).
- Mahler, M., et al. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. American Journal of Physiology. 274 (3), 544-551 (1998).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nature Protocols. 2 (3), 541-546 (2007).
- Kozlowski, C., et al. An entirely automated method to score DSS-induced colitis in mice by digital image analysis of pathology slides. Disease Models & Mechanisms. 6 (3), 855-865 (2013).
- Perse, M., Cerar, A. Dextran sodium sulphate colitis mouse model: traps and tricks. Journal of Biomedicine and Biotechnology. 2012, 718617 (2012).
- Mizoguchi, A. Animal models of inflammatory bowel disease. Progress in Molecular Biology and Translational Science. 105, 263-320 (2012).
- Flemming, S., et al. Desmocollin-2 promotes intestinal mucosal repair by controlling integrin-dependent cell adhesion and migration. Molecular Biology of the Cell. 31 (6), 407-418 (2020).
- Luna, L. G. . Armed Forces Institute of Pathology (U.S) & Armed Forces Institute of Pathology (U.S.). Manual of Histologic Staining Methods of the Armed Forces Institute of Pathology. 3d edn. , (1968).
- Kelm, M., et al. Targeting epithelium-expressed sialyl Lewis glycans improves colonic mucosal wound healing and protects against colitis. The Journal of Clinical Investigation Insight. 5 (12), (2020).
- Reed, M., et al. Epithelial CD47 is critical for mucosal repair in the murine intestine in vivo. Nature Communications. 10 (1), 5004 (2019).
- Laukoetter, M. G., et al. JAM-A regulates permeability and inflammation in the intestine in vivo. Journal of Experimental Medicine. 204 (13), 3067-3076 (2007).
- Khounlotham, M., et al. Compromised intestinal epithelial barrier induces adaptive immune compensation that protects from colitis. Immunity. 37 (3), 563-573 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır