É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Análise sistemática de pontuação para inflamação intestinal em um modelo de colite induzida por sulfato de sódio murine dextran
Neste Artigo
Resumo
A pontuação sistemática da inflamação intestinal usando um sistema gratuito assistido por computador é uma ferramenta poderosa para comparar quantitativamente alterações histopatológicas em modelos de colite caracterizados pela presença de úlceras e alterações inflamatórias. A avaliação do escore da colite histológica fortalece as observações clínicas e facilita a interpretação dos dados.
Resumo
Os modelos de colite murina são ferramentas que são amplamente empregadas em estudos focados na compreensão da patobiologia de distúrbios intestinais inflamatórios. No entanto, ainda não se devem definir normas robustas para quantificação objetiva e reprodutível da gravidade da doença. A maioria dos métodos de análise de colites baseia-se na pontuação histológica limitada de pequenos segmentos do intestino, levando a análises parciais ou tendenciosas. Aqui, combinamos aquisição de imagem de alta resolução e análise longitudinal de todo o cólon para quantificar lesões intestinais e ulceração no modelo induzido de sulfato de sódio dextran (DSS) de colite murina. Este protocolo permite a geração de resultados objetivos e reprodutíveis sem um extenso treinamento de usuários. Aqui, fornecemos detalhes abrangentes sobre a preparação da amostra e a análise de imagens usando exemplos de dados da colite induzida pelo DSS. Este método pode ser facilmente adaptado a outros modelos de colite murina que têm inflamação significativa associada à lesão mucosa. Demonstramos que a fração de mucosa inflamada/ferida e erodida/ulcerada em relação ao comprimento completo do cólon faz um paralelo com os achados clínicos, como a perda de peso em meio à progressão da doença induzida pelo DSS. Este protocolo histológico fornece um tempo confiável e um auxílio econômico para padronizar as análises da atividade da doença de forma imparcial nos experimentos de colite do DSS.
Introdução
A barreira epitelial gastrointestinal desempenha um papel fundamental na separação de antígenos luminosos e patógenos dos compartimentos de tecidosubjacentes 1. Lesões epiteliais e feridas mucosas observadas em condições patológicas como doença inflamatória intestinal (DII), isquemia ou lesão cirúrgica estão associadas a sintomas clínicos que incluem diarreia, perda de peso, sangue nas fezes e dor abdominal. Em resposta à lesão, as células epiteliais migram e proliferam para re-epitelializar e reparar defeitos da barreira mucosa. Resolução de inflamação e restituição da integridade mucosa são cruciais para restabelecer a homeostase e a função mucosa intestinal2,3,4.
Vários modelos animais têm sido empregados para estudar os mecanismos moleculares subjacentes que estão associados com os danos à barreira epitelial intestinal. Modelos bem estabelecidos e facilmente aplicáveis de colite quimicamente induzida são amplamente utilizados, particularmente em estudos relacionados a lesões inflamatórias como o DII. Um modelo comum, reprodutível e confiável de colite murina emprega sulfato de sódio dextran (DSS) mediado lesão cólon e inflamação. A gravidade da doença varia dependendo da cepa do camundongo, dose de DSS, comprimento da administração do DSS e peso molecular de DSS5,6,7.
O dano mucosa intestinal durante a colite DSS é geralmente avaliado usando o Índice de Atividade da Doença (DAI), um escore composto determinado pela perda de peso, conteúdo sanguíneo fecal e consistência das fezes. O teor de sangue fecal pode ser microscópico (detectado usando um teste de ácido guaiaco) ou macroscópico; a consistência fecal é classificada como dura, macia ou líquida (ou seja, diarreia)5,8. A pontuação desses parâmetros clínicos pode ser subjetiva e pode variar dependendo da experiência e viés do usuário, embora, no geral, os dados forneçam informações confiáveis e, portanto, amplamente utilizados pelos pesquisadores do IBD. Em contraste, não há um método geralmente aceito para avaliação histológica de danos mucosos. Mais comumente, as áreas selecionadas do cólon são inspecionadas por um patologista treinado e pontuadas com base em vários parâmetros que geralmente incluem lesão cripíplica e infiltração de leucócitos9,10,11. No entanto, como o número de parâmetros investigados e a quantidade de tecido analisado varia consideravelmente entre os relatórios individuais, a comparabilidade de muitos estudos publicados é limitada. Para reduzir o viés do observador e melhorar a concordância entre estudos, um protocolo de pontuação histológica ideal deve: 1) incluir toda a extensão do cólon, uma vez que a inflamação mucosa intestinal é mais frequentemente variável e as lesões de salto são comuns, 2) limitar a análise a parâmetros específicos de chave e facilmente interpretáveis para reduzir a subjetividade, 3) facilitar o processamento rápido e consistente de grandes números de amostras e 4) usar ferramentas amplamente disponíveis e acessíveis para aquisição, análise e apresentação de dados.
Aqui descrevemos uma técnica para processar todo o cólon ou segmentos longos do intestino delgado em uma configuração de "rolo suíço", juntamente com o uso de um sistema gratuito de pontuação assistida por computador para analisar inflamação e dano mucosal intestinal por causa de colite induzida pelo DSS.
Protocolo
Todos os experimentos em animais descritos foram aprovados pelo Comitê de Uso e Cuidado de Animais da Universidade de Michigan.
1. Colheita de tecidos
- Eutanize camundongos humanamente usando anestesia isoflurane seguida de luxação cervical, de acordo com protocolos aprovados. Para todos os experimentos em animais, a aprovação foi obtida por um conselho de revisão certificado de acordo com as diretrizes nacionais e institucionais para o manejo animal.
- Coloque o mouse em uma almofada dissecando em uma posição supina. Imobilize as extremidades do rato usando agulhas G de 20 G x 1/2 polegadas.
- Usando fórceps e tesouras, faça uma pequena incisão na pele abdominal e puxe-a para o lado para expor o peritônio.
- Abra a cavidade abdominal com uma incisão midline no peritônio do osso púbico para as laterais do abdômen.
- Remova cuidadosamente tecidos e órgãos até que o intestino grosso seja visualizado. Corte o osso pélvico em ambos os lados do cólon para visualizar totalmente o órgão, estendendo-se do ânus em direção ao ceco.
- Remova suavemente a gordura, pequenas veias e artérias presas ao cólon, ao mesmo tempo em que disseca cuidadosamente o órgão, cortando apenas proximal ao ânus e apenas distal ao ceco.
NOTA: O cólon dissecado deve permanecer em temperatura ambiente enquanto completa o procedimento de rolo suíço. - Lave cuidadosamente o cólon com 1x PBS, usando uma agulha de gavage de plástico flexível inserida através do ânus para remover o conteúdo fecal.
- Posicione o cólon em linha reta, e abra longitudinalmente ao longo da artéria mesentérica. Bissecte o cólon longitudinalmente do distal até a extremidade proximal(Figura 1A). Uma metade do tecido pode ser usada para análise histológica, enquanto a outra pode ser processada para mancha ocidental, PCR ou enrolada em um segundo rolo suíço para microscopia de imunofluorescência congelada fresca12.
2. Preparação de rolos suíços
- Corte tecido extra do cólon proximal usando uma lâmina de barbear até que aproximadamente a mesma largura ao longo do comprimento de todo o cólon seja obtida.
- Alinhe o cólon para expor o lúmen voltado para cima, e achate o tecido completamente usando uma agulha de gavage flexível. Adicione mais PBS, se necessário, para manter o tecido úmido durante todo o procedimento.
- Remova o excesso de PBS usando uma limpeza de papel. Com uma seringa e agulha de gavage, adicione 10% de solução de formalina tamponada neutra sobre o tecido por 2-3 minutos para fixar e achatar o tecido.
- Use fórceps retos para pegar a extremidade do cólon distal e torcer o cólon em círculos concêntricos do final distal ao proximal(Figura 1B).
NOTA: É possível empurrar para trás o interior do rolo suíço enquanto rola usando o dedo indicador para garantir que o tecido esteja dentro do rolo. - Insira uma agulha de 27 G para fixar o cólon no meio para manter sua forma de rolo suíço(Figura 1C).
- Coloque o rolo suíço com a agulha em um de incorporação dentro de um recipiente de espécime histológico.
NOTA: O tecido deve ser orientado em paralelo com relação ao antes da fixação(Figura 1D). - Fixar o tecido em solução de formalina tamponada 10% neutra durante a noite a 4 °C13.
- Após a fixação durante a noite, lave o tecido 3x com PBS.
- Adicione 70% de etanol ao tecido antes do processo de incorporação da parafina. Remova a agulha do rolo suíço antes de prosseguir. O tecido pode ser armazenado em etanol à temperatura ambiente até a incorporação da parafina13.
- Coloque amostras no processador de tecido, incorpore em parafina e prepare seções de 4 μm, montadas em lâminas de microscopia carregadas positivamente(Figura 1E). Este pode ser um ponto de parada opcional.
NOTA: A orientação adequada do tecido é fundamental para alcançar seções adequadas para análise de imagem. A incorporação paralela do rolo suíço no de parafina resultará em seções completas apropriadas para análise de imagem (Figura 1F-1H). As seções oblíquas devem ser evitadas para evitar seções incompletas(Figura 1I-1K). Para obter mais detalhes, consulte a seção Discussão. - Seções de manchas com hematoxilina e eosina (H&E)13.
3. Digitalização e análise digital
NOTA: Para uma avaliação precisa das alterações mucosas, selecione apenas seções que incluam pelo menos 90% do comprimento total do cólon.
- Digitalize seções manchadas usando um scanner de slides ou imager (ver Tabela de Materiais). As imagens produzidas precisam de uma resolução de 0,25 mícrons por pixel com objetivo de 40x e ampliação de 40x.
- Instale e baixe um software apropriado para análise digital de slides digitalizados (ver Tabela de Materiais).
- Abra imagens digitalizadas no software de processamento de imagens(Figura 2A). Verifique se todo o cólon é visível e se não há áreas ausentes da amostra.
- Ative o imager de etiqueta e as ferramentas de barra de escala para identificar corretamente slides digitalizados clicando em Imager Label (Figura 2A).
- Abra a ferramenta de anotações clicando em Anotações,(Figura 2A) e crie 3 camadas diferentes clicando em Nova camada (Figura 2B) para quantificar o comprimento total do rolo suíço, inflamação/lesão e erosão/ulceração. Escolha uma cor diferente para cada camada clicando na cor da camada (Figura 2B).
- Meça o comprimento de cada camada/categoria clicando na ferramenta Caneta (Figura 2A), usando a mucosa muscular como referência:
- Veja a imagem com zoom de 400 μm (ou mais) para facilitar a visualização adequada da mucosa muscular.
NOTA: A ampliação é facilmente controlada usando a roda de rolagem do mouse e precisará ser ajustada conforme necessário enquanto se move através da seção para desenhar todas as linhas. - Clique na ferramenta Caneta para desenhar uma linha seguindo a mucosa muscular (Figura 2A). Mova o ponteiro conforme necessário para visualizar a área adjacente para análise.
NOTA: Cada vez que a caneta é parada, uma pequena região de camada nova será gerada. Ele pode ser visualizado e editado com a guia Regiões de Camada (selecione segmento desejado e clique em Excluir camada em caso de erros ou correções, Figura 2B).
- Veja a imagem com zoom de 400 μm (ou mais) para facilitar a visualização adequada da mucosa muscular.
- Uma vez definidas todas as camadas(Figura 2C),exporte os dados usando o botão Exportar Grade para Arquivo de Texto dentro das opções de regiões de camada(Figura 2B).
NOTA: Salve arquivos com frequência ao criar as camadas para garantir que os dados são armazenados corretamente. - Abra os arquivos de texto e copie os dados com um software de planilha. Total de todos os segmentos de cada região e calcule o percentual de lesão e ulceração em relação ao comprimento total.
- Para calcular o Escore de Colite Histológica (SSC) e avaliar a gravidade da doença, considere três características principais como detalhadas abaixo.
- Verifique se há mucosa intestinal saudável que é caracterizada por células epiteliais organizadas no eixo cripto-luminal, lamina propria com poucas células imunes e mucosa muscular subjacente que interage a mucosa e a submucosa (Figura 3A).
- Verifique se há inflamação/lesão caracterizada por criptas epiteliais atenuadas ou parcialmente ausentes e inflamação mucosa com infiltração de neutrófilo em criptas(Figura 3B).
- Verifique se há presença de erosão/ulceração caracterizada por áreas desprovidas de epitélio superficial ou áreas completamente carentes de criptas epiteliais com ou sem leucócitos associados(Figura 3C).
- Calcular HCS de regiões feridas e ulceradas expressas em percentagem do comprimento total na seguinte fórmula:
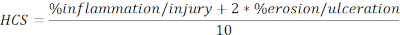
NOTA: O HCS combina o percentual de inflamação/lesão e erosão/ulceração adicionando um fator de dois a este último, com base em uma suposição razoável de que a perda completa do epitélio resulta em perda máxima de integridade da barreira e, portanto, pior doença. O HCS representa consistentemente as alterações morfológicas causadas pela colite experimental induzida pelo DSS. Curiosamente, não vimos uma correlação clara entre os números de agregados linfoides colonicos ou folículos e gravidade da doença clínica na colite do DSS e, portanto, não incluímos a quantificação nesta análise. - Tire uma foto das imagens representativas (clique em Snapshot, Figura 2A) e salve. Inclua barras de escala, se necessário, clicando em Show/Hide Scale Bar (Figura 2A).
Resultados
Para ilustrar a confiabilidade desta Análise de Pontuação de Collite Histológica no contexto de dano mucosa após o desafio dSS e posterior recuperação da colite, administramos 2,5% de DSS na água potável de oito camundongos machos C57BL6 de 10 semanas de idade por 5 dias seguidos por um período de recuperação com água regular por 5 dias. Não houve alteração no peso corporal durante a administração aguda do DSS, do dia 0 ao 5(Figura 4A). O pe...
Discussão
Nosso sistema de pontuação de colitis histológica constitui uma ferramenta confiável para quantificar inflamação tecidual e danos no intestino. Essa abordagem proporciona uma melhor compreensão do estado histopatológico de todo o órgão sem o viés de seleção de pequenas áreas ou seções incompletas. Entre as etapas críticas para executar com sucesso este protocolo estão a preparação adequada dos rolos suíços que permitem a análise de pelo menos 90% do comprimento do cólon; orientação paralela dura...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores desejam reconhecer o apoio do financiamento do NIH DK055679, DK089763, DK079392, DK061739, DK072564 e dos Serviços de Varredura de Slides da Patologia da Universidade de Michigan.
Materiais
| Name | Company | Catalog Number | Comments |
| Aperio AT2 – High Volume, Digital Whole Slide Scanning | Leica Biosystems | Aperio AT2 | |
| Absorbent Underpads with waterproof moisture barrier | VWR International | 56616-032 | |
| American Line 66-0089 Single Edge Blade, 100 per pkg | GT Midwest | TL5837 | |
| BD Luer-Lok Disposable Syringes without Needles | Fisher scientific | 14-823-2A | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 11103-09 | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 14084-09 | |
| Dumont #5 Forceps | Fine Science tools | 11251-20 | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501640-19L | |
| HistoPrep 70% Ea | Fisherbran | 70% denatured ethyl alcohol | |
| ImageScope | Aperio | Version 12.3.3.5039 | http://www.leicabiosystems.com/pathology-imaging/aperio-epathology/integrate/imagescope/ |
| LeakBuster Specimen Containers: Sterile | Starplex Scientific | B120210 | |
| Phosphate-Buffere Saline, without calcium & magnesium | Corning | 21-040-CV | |
| Plastic Feeding tubes, 20 GA x 30 mm | Instech | FTP2030 | |
| PrecisionGlide Needle, Size: 20 G x 1 1/2 in | BD (Becton, Dickinson and Company) | 305176 | |
| PrecisionGlide Needle, Size: 27 G x 1/2 in | BD (Becton, Dickinson and Company) | 305109 | |
| Syringe, 10 ml | BD (Becton, Dickinson and Company) | 302995 | |
| Unisette Tissue Cassettes | Simport | M505-2 |
Referências
- Kagnoff, M. F. The intestinal epithelium is an integral component of a communications network. Journal of Clinical Investigation. 124 (7), 2841-2843 (2014).
- Laukoetter, M. G., Nava, P., Nusrat, A. Role of the intestinal barrier in inflammatory bowel disease. World Journal of Gastroenterology. 14 (3), 401-407 (2008).
- Baumgart, D. C., Sandborn, W. J. Crohn's disease. Lancet. 380 (9853), 1590-1605 (2012).
- Ordas, I., Eckmann, L., Talamini, M., Baumgart, D. C., Sandborn, W. J. Ulcerative colitis. Lancet. 380 (9853), 1606-1619 (2012).
- Vowinkel, T., Kalogeris, T. J., Mori, M., Krieglstein, C. F., Granger, D. N. Impact of dextran sulfate sodium load on the severity of inflammation in experimental colitis. Digestive Diseases and Sciences. 49 (4), 556-564 (2004).
- Kitajima, S., Takuma, S., Morimoto, M. Histological analysis of murine colitis induced by dextran sulfate sodium of different molecular weights. Experimental Animals. 49 (1), 9-15 (2000).
- Mahler, M., et al. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. American Journal of Physiology. 274 (3), 544-551 (1998).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nature Protocols. 2 (3), 541-546 (2007).
- Kozlowski, C., et al. An entirely automated method to score DSS-induced colitis in mice by digital image analysis of pathology slides. Disease Models & Mechanisms. 6 (3), 855-865 (2013).
- Perse, M., Cerar, A. Dextran sodium sulphate colitis mouse model: traps and tricks. Journal of Biomedicine and Biotechnology. 2012, 718617 (2012).
- Mizoguchi, A. Animal models of inflammatory bowel disease. Progress in Molecular Biology and Translational Science. 105, 263-320 (2012).
- Flemming, S., et al. Desmocollin-2 promotes intestinal mucosal repair by controlling integrin-dependent cell adhesion and migration. Molecular Biology of the Cell. 31 (6), 407-418 (2020).
- Luna, L. G. . Armed Forces Institute of Pathology (U.S) & Armed Forces Institute of Pathology (U.S.). Manual of Histologic Staining Methods of the Armed Forces Institute of Pathology. 3d edn. , (1968).
- Kelm, M., et al. Targeting epithelium-expressed sialyl Lewis glycans improves colonic mucosal wound healing and protects against colitis. The Journal of Clinical Investigation Insight. 5 (12), (2020).
- Reed, M., et al. Epithelial CD47 is critical for mucosal repair in the murine intestine in vivo. Nature Communications. 10 (1), 5004 (2019).
- Laukoetter, M. G., et al. JAM-A regulates permeability and inflammation in the intestine in vivo. Journal of Experimental Medicine. 204 (13), 3067-3076 (2007).
- Khounlotham, M., et al. Compromised intestinal epithelial barrier induces adaptive immune compensation that protects from colitis. Immunity. 37 (3), 563-573 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados