Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Systematische Scoring-Analyse für Darmentzündungen in einem Murine Dextran Natriumsulfat-induzierte Colitis Modell
In diesem Artikel
Zusammenfassung
Die systematische Bewertung von Darmentzündungen mit einem freien computergestützten System ist ein leistungsfähiges Werkzeug, um histopathologische Veränderungen in Kolitismodellen, die durch das Vorhandensein von Geschwüren und entzündlichen Veränderungen gekennzeichnet sind, quantitativ zu vergleichen. Die auswertung der histologischen Colitis-Score-Bewertung stärkt klinische Beobachtungen und erleichtert die Dateninterpretation.
Zusammenfassung
Murine Colitis Modelle sind Werkzeuge, die ausgiebig in Studien verwendet werden, die auf das Verständnis der Pathobiologie von entzündlichen Darmerkrankungen konzentriert. Es müssen jedoch noch robuste Standards für eine objektive und reproduzierbare Quantifizierung der Schwere der Erkrankung festgelegt werden. Die meisten Kolitis-Analysemethoden basieren auf einer begrenzten histologischen Bewertung kleiner Darmsegmente, was zu partiellen oder voreingenommenen Analysen führt. Hier kombinieren wir hochauflösende Bildaufnahme und Längsschnittanalyse des gesamten Dickdarms, um Darmverletzungen und Ulzerationen im dextran Natriumsulfat (DSS) induzierten Modell der murinen Kolitis zu quantifizieren. Dieses Protokoll ermöglicht die Generierung objektiver und reproduzierbarer Ergebnisse ohne umfassende Benutzerschulung. Hier bieten wir umfassende Details zur Probenvorbereitung und Bildanalyse anhand von Datenbeispielen aus DSS-induzierter Kolitis. Diese Methode kann leicht an andere Modelle der murinen Kolitis angepasst werden, die erhebliche Entzündungen im Zusammenhang mit Schleimhautverletzungen haben. Wir zeigen, dass der Anteil der entzündeten/verletzten und erodierten/ulzerierten Schleimhaut im Verhältnis zur gesamten Länge des Dickdarms eng parallel zu klinischen Befunden wie Gewichtsverlust inmitten der DSS-induzierten Krankheitsprogression ist. Dieses histologische Protokoll bietet eine zuverlässige zeit- und kosteneffektive Hilfe bei der unvoreingenommenen Standardisierung von Analysen der Krankheitsaktivität in DSS-Kolitisexperimenten.
Einleitung
Die gastrointestinale Epithelbarriere spielt eine zentrale Rolle bei der Trennung von luminalen Antigenen und Krankheitserregern aus den darunter liegenden Gewebeteilen1. Epithelverletzungen und Schleimhautwunden, die bei pathologischen Erkrankungen wie entzündlicher Darmerkrankungen (IBD), Ischämie oder chirurgischen Verletzungen auftreten, sind mit klinischen Symptomen verbunden, die Durchfall, Gewichtsverlust, Blut im Stuhl und Bauchschmerzen umfassen. Als Reaktion auf Verletzungen wandern Epithelzellen und vermehren sich, um Mukohautbarrieredefekte erneut zu epithelialisieren und zu reparieren. Die Auflösung der Entzündung und die Wiederherstellung der Mukosalintegrität sind entscheidend für die Wiederherstellung der Darmschleimhauthomöostase und Funktion2,3,4.
Verschiedene Tiermodelle wurden eingesetzt, um die zugrunde liegenden molekularen Mechanismen zu untersuchen, die mit der Schädigung der Darmepithelbarriere verbunden sind. Gut etablierte und leicht anwendbare Modelle chemisch induzierter Kolitis sind weit verbreitet, insbesondere in Studien im Zusammenhang mit entzündlichen Verletzungen wie IBD. Ein gemeinsames, reproduzierbares und zuverlässiges muriner Kolitismodell verwendet Dextran-Natriumsulfat (DSS) vermittelte Darmverletzungen und Entzündungen. Der Schweregrad der Erkrankung variiert je nach Mausstamm, DSS-Dosis, Länge der DSS-Verabreichung und Molekulargewicht von DSS5,6,7.
Darmschleimhautschäden während DSS-Kolitis werden in der Regel mit dem Disease Activity Index (DAI) bewertet, einem zusammengesetzten Score, der durch Gewichtsverlust, Fäkalienblutgehalt und Stuhlkonsistenz bestimmt wird. Der Fäkalienblutgehalt kann mikroskopisch (mit einem Stuhlguainsäuretest nachgewiesen) oder makroskopisch sein; Die Fäkalienkonsistenz wird als hart, weich oder flüssig (d. h. Durchfall)5,8klassifiziert. Die Bewertung dieser klinischen Parameter kann subjektiv sein und je nach Erfahrung und Voreingenommenheit des Benutzers variieren, obwohl die Daten insgesamt zuverlässige Informationen liefern und daher von IBD-Forschern weit verbreitet sind. Im Gegensatz dazu gibt es keine allgemein anerkannte Methode zur histologischen Bewertung von Schleimhautschäden. Am häufigsten werden ausgewählte Bereiche des Dickdarms von einem ausgebildeten Pathologen untersucht und basierend auf mehreren Parametern bewertet, die in der Regel Kryptoverletzung und Leukozyteninfiltration9,10,11umfassen. Da jedoch die Anzahl der untersuchten Parameter und die Menge des analysierten Gewebes zwischen den einzelnen Berichten sehr unterschiedlich sind, ist die Vergleichbarkeit vieler veröffentlichter Studien begrenzt. Um die Voreingenommenheit der Beobachter zu verringern und die Übereinstimmung zwischen den Studien zu verbessern, sollte ein ideales histologisches Bewertungsprotokoll sein: 1) die gesamte Länge des Dickdarms umfassen, da Darmschleimhautentzündungen am häufigsten variabel sind und Übersprungläsionen häufig sind, 2) die Analyse auf bestimmte Schlüssel und leicht interpretierbare Parameter beschränken, um die Subjektivität zu reduzieren, 3) eine schnelle, konsistente Verarbeitung einer großen Anzahl von Proben zu ermöglichen und 4) weit verfügbare und erschwingliche Werkzeuge für die Datenerfassung, -analyse und -darstellung zu verwenden.
Hier beschreiben wir eine Technik zur Verarbeitung des gesamten Dickdarms oder der langen Segmente des Dünndarms in einer "Swiss Roll"-Konfiguration zusammen mit dem Einsatz eines kostenlosen computergestützten Scoring-Systems zur Analyse von Darmschleimhautentzündungen und -schäden aufgrund von DSS-induzierter Kolitis.
Protokoll
Alle beschriebenen Tierversuche wurden vom Committee on the Use and Care of Animals der University of Michigan genehmigt.
1. Gewebeernte
- Euthanisieren Sie Mäuse human mit Isoflurananästhesie gefolgt von zervikalen Dislokation, in Übereinstimmung mit zugelassenen Protokollen. Für alle Tierversuche wurde die Zulassung durch einen zertifizierten Prüfungsausschuss gemäß den nationalen und institutionellen Richtlinien für den Umgang mit Tieren eingeholt.
- Platzieren Sie die Maus auf einem Sezierenvon Pad in einer Supine-Position. Immobilisieren Sie Maus Extremitäten mit 20 G x 1 1/2-Zoll-G-Nadeln.
- Mit Zangen und Schere, machen Sie einen kleinen Schnitt auf der Bauchhaut und ziehen Sie es zur Seite, um das Peritoneum auszusetzen.
- Öffnen Sie die Bauchhöhle mit einem Mittellinienschnitt im Peritoneum vom Schambein bis zu den Seiten des Bauches.
- Entfernen Sie vorsichtig Gewebe und Organe, bis der Dickdarm visualisiert ist. Schneiden Sie den Beckenknochen auf beiden Seiten des Dickdarms, um das Organ vollständig zu visualisieren, vom Anus bis zum Cecum.
- Entfernen Sie vorsichtig Fett, kleine Venen und Arterien, die am Dickdarm befestigt sind, während Sie das Organ vorsichtig sezieren, nur proximal zum Anus schneiden und nur distal zum Cecum.
HINWEIS: Der sezierte Doppelpunkt sollte während des Schweizer Walzvorgangs bei Raumtemperatur bleiben. - Spülen Sie den Dickdarm vorsichtig mit 1x PBS, mit einer flexiblen Kunststoff-Gavage-Nadel, die durch den Anus eingeführt wird, um den Fäkalieninhalt zu entfernen.
- Positionieren Sie den Doppelpunkt in einer geraden Linie und öffnen Sie längs entlang der mesenterischen Arterie. Bisect den Kolon längs vom distalen zum proximalen Ende (Abbildung 1A). Die eine Hälfte des Gewebes kann für die histologische Analyse verwendet werden, während die andere für Western Blot, PCR oder in eine zweite Schweizer Rolle für die frisch gefrorene Immunfluoreszenzmikroskopie12gerollt werden kann.
2. Zubereitung von Schweizer Brötchen
- Schneiden Sie zusätzliches Gewebe aus dem proximalen Dickdarm mit einer Rasierklinge, bis ungefähr die gleiche Breite entlang der Länge des gesamten Dickdarms erhalten wird.
- Richten Sie den Dickdarm aus, um das Lumen nach oben zu belichten, und glätten Sie das Gewebe vollständig mit einer flexiblen Gavage-Nadel. Fügen Sie weitere PBS hinzu, falls erforderlich, um das Gewebe während des gesamten Verfahrens feucht zu halten.
- Entfernen Sie den Überschuss an PBS mit einem Papierwisch. Mit einer Spritze und einer Gavage-Nadel 10% neutral gepufferte Formalinlösung über das Gewebe für 2-3 min hinzufügen, um das Gewebe zu fixieren und abzuflachen.
- Verwenden Sie gerade Zangen, um das Ende des distalen Dickdarms zu greifen und den Dickdarm in konzentrische Kreise vom distalen zum proximalen Ende zu verdrehen (Abbildung 1B).
HINWEIS: Es ist möglich, die Innenseite der Schweizer Rolle während des Rollens mit dem Zeigefinger zurückzuschieben, um sicherzustellen, dass sich das Gewebe in der Rolle befindet. - Setzen Sie eine 27 G Nadel ein, um den Doppelpunkt in der Mitte zu fixieren, um seine Schweizer Rollenform zu halten (Abbildung 1C).
- Legen Sie die Schweizer Rolle mit der Nadel in eine Einbettkassette in einen histologischen Probenbehälter.
HINWEIS: Gewebe muss parallel zur Kassette vor der Fixierung ausgerichtet sein (Abbildung 1D). - Fixieren Sie das Gewebe in 10% neutral gepufferter Formalinlösung über Nacht bei 4 °C13.
- Waschen Sie das Gewebe nach der nächtlichen Fixierung 3x mit PBS.
- Vor dem Paraffin-Einbettungsprozess 70% Ethanol in das Gewebe geben. Entfernen Sie die Nadel von der Schweizer Rolle, bevor Sie fortfahren. Gewebe kann in Ethanol bei Raumtemperatur bis zur Paraffineinbettung13gelagert werden.
- Legen Sie Proben in den Gewebeprozessor, betten Sie sie in Paraffin ein und bereiten Sie 4 m Abschnitte vor, die auf positiv geladenen Mikroskopfolien montiert sind (Abbildung 1E). Dies kann ein optionaler Stopppunkt sein.
HINWEIS: Die richtige Gewebeorientierung ist entscheidend, um Abschnitte zu erreichen, die für die Bildanalyse geeignet sind. Die parallele Schweizer Rolleneinbettung in die Paraffinkassette führt zu vollständigen Abschnitten, die für die Bildanalyse geeignet sind (Abbildung 1F-1H). Schrägabschnitte müssen vermieden werden, um unvollständige Abschnitte zu verhindern (Abbildung 1I-1K). Weitere Informationen finden Sie im Abschnitt Diskussion. - Fleckenabschnitte mit Hämatoxylin und Eosin (H&E)13.
3. Digitales Scannen und Analysieren
HINWEIS: Für eine genaue Bewertung von Schleimhautänderungen wählen Sie nur Abschnitte aus, die mindestens 90 % der gesamten Doppelpunktlänge enthalten.
- Scannen von gebeizten Abschnitten mit einem Diascanner oder Imager (siehe Materialtabelle). Die erzeugten Bilder benötigen eine Auflösung von 0,25 Mikrometern pro Pixel mit 40-fachem Objektiv und 40-facher Vergrößerung.
- Installieren und laden Sie eine geeignete Software für die digitale Analyse gescannter Dias herunter (siehe Tabelle der Materialien).
- Öffnen Sie gescannte Bilder in der Bildverarbeitungssoftware (Abbildung 2A). Stellen Sie sicher, dass der gesamte Doppelpunkt sichtbar ist und keine Bereiche der Stichprobe fehlen.
- Aktivieren Sie die Etikettenbildr- und Skalenleistenwerkzeuge, um gescannte Dias richtig zu identifizieren, indem Sie auf Bebilder beschriften klicken (Abbildung 2A).
- Öffnen Sie das Anmerkungswerkzeug, indem Sie auf Anmerkungenklicken , (Abbildung 2A) und erstellen Sie 3 verschiedene Layer, indem Sie auf Neue Ebene (Abbildung 2B) klicken, um die Gesamtlänge der Schweizer Rolle, Entzündung/Verletzung und Erosion/Ulzeration zu quantifizieren. Wählen Sie für jede Ebene eine andere Farbe aus, indem Sie auf Layerfarbe klicken (Abbildung 2B).
- Messen Sie die Länge jeder Schicht/Kategorie, indem Sie auf das Stiftwerkzeug (Abbildung 2A) klicken, wobei die Muskulatur als Referenz verwendet wird:
- Sehen Sie sich das Bild mit einem Zoom von 400 m (oder mehr) an, um eine adäquate Visualisierung der Muskulatur zu ermöglichen.
HINWEIS: Die Vergrößerung lässt sich einfach mit dem Maus-Scrollrad steuern und muss bei Bedarf angepasst werden, während sie sich über den Abschnitt bewegt, um alle Linien zu zeichnen. - Klicken Sie auf das Stiftwerkzeug, um eine Linie nach der Muskulatur zu zeichnen (Abbildung 2A). Bewegen Sie den Zeiger nach Bedarf, um den angrenzenden Bereich für die Analyse zu visualisieren.
HINWEIS: Jedes Mal, wenn der Stift angehalten wird, wird ein kleiner neuer Layer-Bereich generiert. Es kann mit der Registerkarte Layer-Regionen visualisiert und bearbeitet werden (wählen Sie das gewünschte Segment aus und klicken Sie bei Fehlern oder Korrekturen auf Layer löschen, Abbildung 2B).
- Sehen Sie sich das Bild mit einem Zoom von 400 m (oder mehr) an, um eine adäquate Visualisierung der Muskulatur zu ermöglichen.
- Nachdem alle Layer (Abbildung 2C) definiert sind, exportieren Sie die Daten mit der Schaltfläche Raster in Textdatei exportieren innerhalb der Layer-Regionsoptionen ( Abbildung2B).
HINWEIS: Speichern Sie Dateien häufig beim Erstellen der Layer, um sicherzustellen, dass die Daten ordnungsgemäß gespeichert werden. - Öffnen Sie die Textdateien, und kopieren Sie die Daten mit einer Tabellenkalkulationssoftware. Alle Segmente aus jeder Region zusammen und berechnen den Prozentsatz der Schädigung und Ulzeration in Bezug auf die Gesamtlänge.
- Um den histologischen Colitis Score (HCS) zu berechnen und den Schweregrad der Krankheit zu bewerten, betrachten Sie drei Hauptmerkmale, wie unten beschrieben.
- Suchen Sie nach einer gesunden Darmschleimhaut, die sich durch organisierte Epithelzellen in der kryptoluminalen Achse, Lamina propria mit wenigen Immunzellen und subjacent muscularis mucosa auszeichnet, die die Schleimhaut und Submukose verbindet (Abbildung 3A).
- Überprüfen Sie auf Entzündungen/Verletzungen, die durch epitheliale Krypten gekennzeichnet sind, die abgeschwächt sind oder teilweise fehlende Epithelzellen und Schleimhautentzündungen mit neutrophiler Infiltration in Krypten (Abbildung 3B).
- Prüfen Sie das Vorhandensein von Erosion/Ulzeration, die durch Flächen ohne Oberflächenepithel oder Bereiche ohne Epithelkrypta mit oder ohne assoziierte Leukozyten gekennzeichnet ist (Abbildung 3C).
- Berechnen Sie HCS von verletzten und ulzerierten Regionen, ausgedrückt als Prozentsatz der Gesamtlänge in der folgenden Formel:
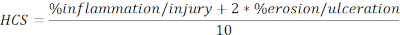
HINWEIS: HCS kombiniert den Prozentsatz von Entzündungen/Verletzungen und Erosion/Ulzeration, der dem letzteren einen Faktor von zwei hinzufügt, basierend auf einer vernünftigen Annahme, dass der vollständige Verlust des Epithels zu einem maximalen Verlust der Barriereintegrität und damit zu einer schlimmeren Erkrankung führt. HCS stellt konsequent die morphologischen Veränderungen dar, die durch DSS-induzierte experimentelle Kolitis verursacht werden. Interessanterweise haben wir keine klare Korrelation zwischen der Anzahl der kolonischen lymphoiden Aggregate oder Follikel und der schwere nalylen Erkrankung bei DSS-Kolitis gesehen, und daher haben wir die Quantifizierung nicht in diese Analyse aufgenommen. - Erstellen Sie eine Momentaufnahme der repräsentativen Bilder (klicken Sie auf Snapshot, Abbildung 2A), und speichern Sie sie. Fügen Sie bei Bedarf Maßstabsleisten ein, indem Sie auf Skalenleiste anzeigen/ausblenden klicken (Abbildung 2A).
Ergebnisse
Um die Zuverlässigkeit dieser histologischen Colitis Score Analyse im Zusammenhang mit Schleimhautschäden nach DSS-Herausforderung und anschließender Genesung von Kolitis zu veranschaulichen, verabreichten wir 2,5% DSS im Trinkwasser von acht 10 Wochen alten männlichen C57BL6 Wildtypmäusen für 5 Tage, gefolgt von einer Erholungsphase mit regelmäßigem Wasser für 5 Tage. Es gab keine Veränderung des Körpergewichts während der akuten Verabreichung von DSS, von Tag 0 bis 5 (
Diskussion
Unser histologisches Colitis Score-System stellt ein zuverlässiges Werkzeug dar, um Gewebeentzündungen und Schäden im Darm zu quantifizieren. Dieser Ansatz bietet ein besseres Verständnis des histopathologischen Zustands des gesamten Organs, ohne dass die Voreingenommenheit bei der Auswahl kleiner Bereiche oder unvollständiger Abschnitte besteht. Zu den entscheidenden Schritten zur erfolgreichen Ausführung dieses Protokolls gehören die ordnungsgemäße Aufbereitung von Schweizer Walzen, die eine Analyse von mindes...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren möchten die Unterstützung durch die NIH-Förderung DK055679, DK089763, DK079392, DK061739, DK072564 und die University of Michigan Pathology Slide Scanning Services würdigen.
Materialien
| Name | Company | Catalog Number | Comments |
| Aperio AT2 – High Volume, Digital Whole Slide Scanning | Leica Biosystems | Aperio AT2 | |
| Absorbent Underpads with waterproof moisture barrier | VWR International | 56616-032 | |
| American Line 66-0089 Single Edge Blade, 100 per pkg | GT Midwest | TL5837 | |
| BD Luer-Lok Disposable Syringes without Needles | Fisher scientific | 14-823-2A | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 11103-09 | |
| Bonn Strabismus Scissors - ToughCut | Fine Science tools | 14084-09 | |
| Dumont #5 Forceps | Fine Science tools | 11251-20 | |
| Formalin solution, neutral buffered, 10% | Sigma | HT501640-19L | |
| HistoPrep 70% Ea | Fisherbran | 70% denatured ethyl alcohol | |
| ImageScope | Aperio | Version 12.3.3.5039 | http://www.leicabiosystems.com/pathology-imaging/aperio-epathology/integrate/imagescope/ |
| LeakBuster Specimen Containers: Sterile | Starplex Scientific | B120210 | |
| Phosphate-Buffere Saline, without calcium & magnesium | Corning | 21-040-CV | |
| Plastic Feeding tubes, 20 GA x 30 mm | Instech | FTP2030 | |
| PrecisionGlide Needle, Size: 20 G x 1 1/2 in | BD (Becton, Dickinson and Company) | 305176 | |
| PrecisionGlide Needle, Size: 27 G x 1/2 in | BD (Becton, Dickinson and Company) | 305109 | |
| Syringe, 10 ml | BD (Becton, Dickinson and Company) | 302995 | |
| Unisette Tissue Cassettes | Simport | M505-2 |
Referenzen
- Kagnoff, M. F. The intestinal epithelium is an integral component of a communications network. Journal of Clinical Investigation. 124 (7), 2841-2843 (2014).
- Laukoetter, M. G., Nava, P., Nusrat, A. Role of the intestinal barrier in inflammatory bowel disease. World Journal of Gastroenterology. 14 (3), 401-407 (2008).
- Baumgart, D. C., Sandborn, W. J. Crohn's disease. Lancet. 380 (9853), 1590-1605 (2012).
- Ordas, I., Eckmann, L., Talamini, M., Baumgart, D. C., Sandborn, W. J. Ulcerative colitis. Lancet. 380 (9853), 1606-1619 (2012).
- Vowinkel, T., Kalogeris, T. J., Mori, M., Krieglstein, C. F., Granger, D. N. Impact of dextran sulfate sodium load on the severity of inflammation in experimental colitis. Digestive Diseases and Sciences. 49 (4), 556-564 (2004).
- Kitajima, S., Takuma, S., Morimoto, M. Histological analysis of murine colitis induced by dextran sulfate sodium of different molecular weights. Experimental Animals. 49 (1), 9-15 (2000).
- Mahler, M., et al. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. American Journal of Physiology. 274 (3), 544-551 (1998).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nature Protocols. 2 (3), 541-546 (2007).
- Kozlowski, C., et al. An entirely automated method to score DSS-induced colitis in mice by digital image analysis of pathology slides. Disease Models & Mechanisms. 6 (3), 855-865 (2013).
- Perse, M., Cerar, A. Dextran sodium sulphate colitis mouse model: traps and tricks. Journal of Biomedicine and Biotechnology. 2012, 718617 (2012).
- Mizoguchi, A. Animal models of inflammatory bowel disease. Progress in Molecular Biology and Translational Science. 105, 263-320 (2012).
- Flemming, S., et al. Desmocollin-2 promotes intestinal mucosal repair by controlling integrin-dependent cell adhesion and migration. Molecular Biology of the Cell. 31 (6), 407-418 (2020).
- Luna, L. G. . Armed Forces Institute of Pathology (U.S) & Armed Forces Institute of Pathology (U.S.). Manual of Histologic Staining Methods of the Armed Forces Institute of Pathology. 3d edn. , (1968).
- Kelm, M., et al. Targeting epithelium-expressed sialyl Lewis glycans improves colonic mucosal wound healing and protects against colitis. The Journal of Clinical Investigation Insight. 5 (12), (2020).
- Reed, M., et al. Epithelial CD47 is critical for mucosal repair in the murine intestine in vivo. Nature Communications. 10 (1), 5004 (2019).
- Laukoetter, M. G., et al. JAM-A regulates permeability and inflammation in the intestine in vivo. Journal of Experimental Medicine. 204 (13), 3067-3076 (2007).
- Khounlotham, M., et al. Compromised intestinal epithelial barrier induces adaptive immune compensation that protects from colitis. Immunity. 37 (3), 563-573 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten