A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שינוי פאזה מיקרו-טיפות במעטפת Dimethyldioctadecylammonium כמערכת אספקת תרופות מבטיחה: תוצאות על ספרואידים תלת מימדיים של תאי גידול יונקים
* These authors contributed equally
In This Article
Summary
מיקרו-טיפות דקפלואורופנטן שפותחו עם מעטפת של dimethyldioctadecylammonium bromide הפגינו יציבות קולואידית יוצאת דופן וממשק ביולוגי אקטרקטיבי. DDAB-MDs הוכיחו את עצמם כמאגרי תרופות יעילים המאופיינים בזיקה גבוהה לממברנות הפלזמה יחד עם ספיגה מוגברת ופעילות אנטי-גידולית של דוקסורוביצין כנגד סרטן שד טריפל נגטיב אנושי (MDA-MB-231) מודל תלת מימד.
Abstract
שיפור משמעותי של מיקרו-טיפות פרפלואורו-פחמן (MDs) לשינוי פאזה בתרחיש התרנוסטי העצום עובר דרך אופטימיזציה של הרכב ה-MDs ביחס ליעילות הסינתזה, היציבות ויכולת אספקת התרופות. למטרה זו, תוכננו MDs דקפלואורופנטן (DFP) המיוצבים על ידי מעטפת של חומר פעילי שטח קטיוני dimethyldioctadecylammonium bromide (DDAB). ריכוז גבוה של DDAB-MDs הושג בקלות תוך מספר שניות על ידי אינסונציה פועמת בעוצמה גבוהה, וכתוצאה מכך טיפות בגודל 1 מיקרומטר בגודל פוליפיזור נמוך. פוטנציאל ζ חיובי ביותר, יחד עם שרשראות פחמימנים ארוכות ורוויות של מעטפת ה-DDAB, הם גורמי מפתח לייצוב הטיפה ומטען התרופות שבה. הזיקה הגבוהה של מעטפת ה-DDAB לקרום הפלזמה של התא מאפשרת מתן כימותרפיה מקומית על ידי הגדלת ריכוז התרופה בממשק תאי הגידול והגברת הספיגה. זה יהפוך את DDAB-MDs לכלי רלוונטי להעברת תרופות המציג פעילות אנטי-גידולית גבוהה במינונים נמוכים מאוד של תרופות.
בעבודה זו, היעילות של גישה כזו הוכחה כמשפרת באופן דרמטי את ההשפעה של דוקסורוביצין נגד ספרואידים תלת מימדיים של תאי גידול יונקים, MDA-MB-231. לשימוש בתרביות תאים תלת מימדיות (תלת מימד) שפותחו בצורה של ספרואידים גידוליים רב-תאיים (כלומר, תאים צפופים בצורה כדורית) יש יתרונות רבים בהשוואה לתרביות תאים דו-ממדיות: בנוסף לפוטנציאל לגשר על הפער בין מחקרי מבחנה קונבנציונליים לניסויים בבעלי חיים, הוא ישפר את היכולת לבצע חיזוי רב יותר במבחנה בדיקות סינון לפיתוח תרופות פרה-קליניות או הערכת הפוטנציאל של תרופות מחוץ לתווית ואסטרטגיות מיקוד משותפות חדשות.
Introduction
וקטורים להעברת תרופות המסוגלים להבטיח יעילות אנטי-גידולית גבוהה ולהפחית תופעות לוואי הם מטרות עיקריות תוך שמירה על אתגר כימי-פרמצבטי חמור 1,2. נכון להיום, ההתקדמות שלהם מוגבלת בהתחלה על ידי הניגוד בין שחרור לא מספיק של תרופה במקום ורמה קריטית של רעילות לא ספציפית 3,4,5. בשנים האחרונות יושמו מספר מערכות אספקת תרופות לשיפור מתן חומרים אנטי-סרטניים, כולל ליפוזומים, מיצלות פולימריות, פולימזומים 6,7,8,9,10. למערכות אלו יש פוטנציאל להגדיל את זמן המחזור והסלקטיביות של תרופות, תוך הפחתת הפצה והצטברות באיברים ורקמות בריאים. בכל מקרה, התכשירים העטופים של תרופות כימותרפיות אנטי-ניאופלסטיות, כמו אנתרציקלינים, הובילו לירידה משמעותית ביעילות ההפנמה של התרופות. לאחרונה, נשאי מיקרון ותת-מיקרון המגיבים לגירויים כגון מיקרו-בועות11, מיקרו-טיפות, ננו-חלקיקי זהב היברידיים12, ננו-הידרוג'לים13, פיגומי PLGA ופלטפורמות מזו-נקבוביות14, זוכים לעניין פרמקולוגי בשל הרבגוניות הגבוהה שלהם במיקוד והפעלת השפעות מעכבות גידול באמצעות דוקסורוביצין (Dox) ודוסטקסל. ניסויים חלוציים להפיכת נשאים אלה לחיילים אנטי-סרטניים יעילים למשימות רב-מודאליות (כלומר, גישות כימותרפיות, פוטותרמיות וסינרגטיות גנים) והדמיה מולקולרית15 סללו את הדרך לננו-רפואה תרנוסטית מותאמת אישית.
בתרחיש זה, מיקרו-טיפות פרפלואורו-פחמן (MDs) לשינוי פאזה הוערכו באמצעות ההזדמנות העיקרית שהן מציעות להצמיד מטען תרופות גבוה, רבגוניות כימית של מעטפת ה-MDs המתייחסת למחסומים ביולוגיים, יציבות קולואידית ויעילות סינתזה11,12. כנכס נוסף, האקוגניות של ה-MDs המקודמת על ידי אידוי אקוסטי או אופטי של ליבת הפרפלואורו-פחמן (PFC) מאפשרת להשיג הדמיה באתרה ויעילות טיפולית מבטיחה. יתר על כן, ניתן לנצל את אידוי הליבה של MDs המתקבל על ידי שחרור אנרגיה של אלומות חלקיקים מייננות למעקב אחר אלומות ומינון קרינה.
המחקר הנוכחי נועד לפתח מיקרו-טיפות דקפלואורופנטן (DFP) המיוצבות על ידי מעטפת שמישה מרובה של חומר פעילי שטח קטיוני dimethyldioctadecylammonium bromide (DDAB). MDs במעטפת DDAB עומדים בציפיות הפיזיקו-כימיות והביולוגיות כאחד. מיקרו-טיפות מבוססות DFP הוכחו כחומרי ניגוד בעלי ערך לשינוי פאזה להשגת MDs פרפלואורו-פחמן תואמים ביולוגית ויציבים16. ג'ל גבישי DDAB מרווה שרשראות ארוכות בטמפרטורה פיזיולוגית, חודר עמוק לליבה ההידרופובית, מייצב את הטיפה ואת מטען התרופות בתוכה. יתר על כן, פוטנציאל ζ החיובי הגבוה בממשק המים משפר את היציבות הקולואידית של ה-MDs. האטרקטיביות הביולוגית של פני השטח של מעטפת DDAB טמונה ביכולת לגרום למוות של חיידקים ופטריות, בריכוזים שבקושי משפיעים על תאי יונקים, ולקשור ממברנות פלזמה, חלבונים אנטיגניים טעונים שלילית, נוקלאוטידים, DNA או ננו-חלקיקים. ניתן לנצל את התכונות שהוזכרו לעיל כדי ליצור אימונו-אדג'ובנט יוצא דופן, טיפול גנטי ופעולה אנטי-גידולית בתוך תאי יונקים17.
DDAB-MDs טעוני דוקס (Dox@DDAB-MDs) המתוארים כאן מקדמים את שחרור התרופה כנגד תאי סרטן שד טריפל נגטיב אגרסיביים מאוד, פולשניים ומובחנים בצורה גרועה. פרוטוקול פשוט ומהיר מתואר להלן המבוסס על אינסונציה של בדיקה בהספק גבוה להשגת DDAB-MDs יציבים וצפיפות גבוהה עם חלוקת גודל צרה עם יעילות טעינה גבוהה של Dox בניסוח שלב אחד. מאפיינים כאלה תחרותיים אפילו עבור שיטות הכנה אחרות כמו מכשירים מיקרופלואידיים והומוגניזטורים עם גזירה גבוהה16.
הנושא המגביל העיקרי הנוסף בתכנון וקטורים יעילים להעברת תרופות הוא שפעילות התרופה היא פונקציה של פרמטרים שונים (למשל, ספיגה, הפצה, ריכוזים) הניתנים להשגה במטרה ביולוגית ממשית, אשר לא ניתן לקחת בחשבון על ידי מודלים של תאים חד-שכבתיים18. מסיבה זו, ההיסטוריה של פיתוח פורמולציות אנטי-גידוליות חדשות משובצת במחקרי מבחנה שלמרבה הצער הביאו להיות לא יעילים כבר ברמת המודלים הפרה-קליניים בבעלי חיים19.
בפרט, הצורך לעבור מתרביות תאים למערכת מורכבת ואמינה יותר מאשר מחקרי in vivo ו-ex vivo קשור למגבלות האינהרנטיות של מחקרים פרמקולוגיים על תרביות דו-ממדיות. בהקשר זה נכללות מערכות התלת מימד במבחנה, כגון ספרואידים, אורגנואידים, איבר על שבב, המדמים את המורפולוגיה, הפעילות והתגובה הפיזיולוגית של מבנים מורכבים יותר מאשר החד-שכבות הדו-ממדיות20. במבט פרה-קליני, מודלים של תאים תלת מימדיים המחקים את המיקרו-סביבה התאית מציעים את האפשרות להבין טוב יותר ביולוגיה מורכבת במסגרת רלוונטית יותר מבחינה פיזיולוגית שבה תרבויות חד-שכבתיות מסורתיות אינן יעילות21,22.
לאחר שהוכח כי DDAB-MDs יכולים לקיים אינטראקציה עם קרום התא של תאי סרטן שד אנושיים, תוך העדפת הפנמת תרופות ומוות תאים בריכוז Dox נמוך מאוד (ננו-מולר), נבדקה היעילות של מתודולוגיה כזו כנגד ספרואידים תלת מימדיים של תאי גידול יונקים, MDA-MB-231.
Protocol
הערה: כל הריאגנטים והמכשירים מפורטים בטבלת החומרים.
1. ייצור ואפיון מיקרו-טיפות
- הכנת DDAB-MDs טעוני Dox
- ממיסים את אבקת ה-DDAB באתנול כדי לקבל ריכוז סופי של 10 מ"מ ונפח סופי של 1 מ"ל. הכן 1 מ"ל של תמיסת מלאי דוקס הממיסה 2 מ"ג אבקת דוקס באתנול.
זהירות: דוקס ידוע כבעל רעילות אוראלית חריפה, קטגוריה 4 ומסרטן, קטגוריה 1B. השתמש רק מתחת למכסה אדים עם כפפות ומסכת בריאות. - הוסף 250 μL של DFP ל-300 μL של תמיסת DDAB (שלב שמן) בצינור צנטריפוגה מדורג פלסטיק של 15 מ"ל.
הערה: טוהר DFP הוא 60% (GC), צפיפות 1.6 גרם/מ"ל (20 מעלות צלזיוס), נקודת רתיחה היא 55 מעלות צלזיוס. טוהר הדוקס הוא 98, 0-102, 0% (HPLC). טוהר DDAB הוא ≥98% (TLC). טוהר האתנול הוא 97%. - הוסף בעדינות 2.15 מ"ל מים נטולי יונים על שלב השמן וכתוצאה מכך תערובת מים/שמן דו-פאזית. יש להזריק בעדינות 10 מיקרוליטר של תמיסת דוקס ישירות לשלב השמן מיד לפני האינסונציה, כדי למנוע חלוקה של כמות משמעותית של דוקס לשלב המים.
- תחליב את התערובת הדו-פאזית על ידי אינסונציה של בדיקה (עם מיקרו-קצה מחודד של 1/8 בטיטניום) באמצעות ציוד מעבד נוזלי אולטראסוני בעוצמה גבוהה במצב דופק (0.7 שניות מופעל ו-0.3 שניות כבוי) ב-20 קילו-הרץ, 100 וואט למשך 10 שניות. יש לדלל מיד MDs טריים שהוכנו במים אולטרה-מסוננים ונטולי יונים (למשל, MilliQ) בפקטור של 1.8.
הערה: גורם הדילול הוא אינדיקטיבי, נבחר אמפירית. ניתן לדלל את תמיסת MDs יותר כל עוד מתקבלת מספיק גלולה מהצנטריפוגות הבאות. - קח 1 מ"ל מהתרחיף והצנטריפוגה המתקבלים פי 3, והשהה מחדש במים מסוננים במיוחד ונטולי יונים (למשל, MilliQ) כדי להסיר את עודפי הדוקס והאתנול. בצע את הצנטריפוגה הראשונה ב-25 מעלות צלזיוס, 360 x גרם למשך 3 דקות, ואת השנייה והשלישית ב-280 x גרם באותה טמפרטורה וזמן.
- לאחר השטיפה האחרונה, הסר את המים הסופרנטנטים ושאב 5 מיקרוליטר מהכדורים ופזר אותם לתוך 2 מ"ל של המדיום לטיפול בתאים, וקבל ריכוז דוקס שווה ערך Dox@DDAB של 10 ננומטר.
הערה: ריכוז Dox שווה ערך מוגדר ככמות ה-Dox החופשי הכלול באותו נפח של תרחיף של Dox@DDAB-MDs.
- ממיסים את אבקת ה-DDAB באתנול כדי לקבל ריכוז סופי של 10 מ"מ ונפח סופי של 1 מ"ל. הכן 1 מ"ל של תמיסת מלאי דוקס הממיסה 2 מ"ג אבקת דוקס באתנול.
- אפיון DDAB-MDs טעוני Dox
- מדוד את התפלגות הגודל באמצעות פוטומטר פיזור אור דינמי (DLS) ונתח את הקורלוגרמות המתקבלות עם אלגוריתם CONTIN כדי להעריך את זמני הדעיכה המשויכים. לאחר מכן השתמש בזמני הדעיכה כדי לקבוע את התפלגות מקדמי הדיפוזיה של החלקיקים (D) ולהמיר אותם בהתפלגות של קטרים הידרודינמיים (2RH) באמצעות יחסי סטוקס-איינשטיין RH = kBT/6πηD, כאשר kBT היא האנרגיה התרמית של המערכת η צמיגות הממס.
- בדוק את התפלגות הגודל והגודל גם באמצעות מיקרוסקופ שדה בהיר עם תוכנת ניתוח תמונה (למשל, תמונה J), מדידת גודל של לפחות 100 טיפות למסגרת (עבור 3 או 4 פריימים), קבלת ערך ממוצע וסטיית תקן.
הערה: עבור מדידות DLS יש לדלל את תמיסת ה-MDs במים מסוננים במיוחד, נטולי יונים (למשל, MilliQ), PBS ובמדיום תרבית תאים כדי למנוע פיזור לאחור לריכוז קבוע של 1.5 x 108 MDs /mL. עבור מים אולטרה-מסוננים, נטולי יונים ו-PBS במדיום תרבית תאים, קיבלנו ערכי גודל ממוצעים של 1.1 ± 0.1 מיקרומטר, 1.1 ± 0.25 מיקרומטר ו-1.2 ± 0.2 מיקרומטר, בהתאמה. MDs שנמצאו מהכדורים, לאחר צנטריפוגה, אינם מראים שינויי גודל בתוך השגיאות. - השתמש בשקופית תא ספירת תאים למיקרוסקופיה כדי להעריך את ריכוז ה-MDs. החדר מורכב משני אזורי ספירה שונים בעובי של 0.10 מ"מ. הנח 10 מיקרוליטר של מתלה MDs מעל החדר. ספור MDs בתוך ריבוע החדר בגודל 0.25 x 0.25 ננומטר2 באמצעות מיקרוסקופ אופטי עם מטרה למרחקים ארוכים פי 40 ונתח באמצעות תוכנה חינמית לניתוח תמונה.
- חשב את ריכוז ה-MDs, מבוטא כמספר MDs/mL, לפי המשוואה:
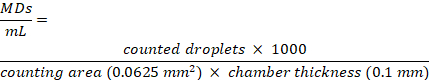
- בדוק את תמונות ה-Dox המופנמות על ידי מיקרוסקופ סריקת לייזר קונפוקלי (CLSM) המנצלות את האוטו-פלואורסצנציה של Dox ב-590 ננומטר. מדוד את תכולת ה-Dox באמצעות בדיקה פלואורמטרית, פיזור החלקיקים במים אולטרה-מסוננים, נטולי יונים או PBS, צנטריפוגה ב-25 מעלות צלזיוס, 360 x g למשך 3 דקות ולאחר מכן קביעת כמות התרופה החופשית על ידי הערכת הקרינה של הסופרנטנט ב-590 ננומטר עם עקומת כיול (טווח ליניאריות לריכוז Dox: 2-20 מיקרומול/מ"ל, R2 = 0.99).
הערה: הפחיתו את הערך המתקבל מהריכוז הכולל של Dox כדי לקבל את הכמות העטופה של Dox. בצע את הניסוי בשלוש עותקים. יעילות האנקפסולציה של Dox מביאה ל-28% ±-2%, המחושבת על ידי חלוקת כמות התרופה של Dox ב-MDs עם התוכן הכולל של Dox שנפרס. - בצע ניסויים של שחרור דוקס לאורך זמן, על ידי צנטריפוגה וחזרה על ההליך לפי שלב 1.2.3 כדי להשיג את אחוז ה-Dox המשתחרר בסופרנטנט למספר המכוסים. לאחר הקביעה הראשונה, חזור על ההליך על ידי הפחתת מהירות הצנטריפוגה ל-280 x g כדי למנוע שבירת MDs. התוויית עקומת שחרור לאורך זמן. בדוק שריכוז ה-Dox המשתחרר תוך 24 שעות בסופרנטנט מגיע למקסימום של 20%.
- מדוד את הפוטנציאל ζ ב-37 מעלות צלזיוס באמצעות מכשיר ייעודי (למשל, NanoZetaSizer) וודא שהערכים המתקבלים הם בסביבות 90-100 mV.
2. ייצור ספרואידים במצעים לא דביקים יצוקים במיקרו
- יציקת מיקרו תבניות
- מניחים תבניות תלת מימד קטנות ו -1 גרם אבקת אגרוז טהורה במיכלים המתאימים לעיקור. חיטוי אותם למשך 30 דקות במחזור יבש (121 מעלות צלזיוס).
- בארון בטיחות ביולוגית, הוסיפו 50 מ"ל של תמיסת מלח 0.9% (NaCl) לבקבוק הזכוכית המכיל אגרוז מעוקר והכניסו אותו לתנור מיקרוגל כדי להרתיח ולהמיס את האבקה. הניחו לאגרוז המותך להתקרר ל-60 מעלות צלזיוס והוסיפו 500 מיקרוליטר לכל מיקרו-תבנית תוך הימנעות מיצירת בועות בעת הפיפטינג.
אזהרה: אגרוז מותך עלול לגרום לכוויות עור קשות. יש צורך בציוד מגן אישי מתאים. - הסר את האגרוז הג'ל על ידי כיפוף זהיר של התבנית והסרת המצע החדש שנוצר. הכניסו את המצעים לצלחת של 12 בארות והוסיפו 2 מ"ל מדיום תרבית טרי לבאר. דגירה למשך 15 דקות לפחות כדי לאזן כל מצע.
הערה: הכן את מדיום התרבות מראש והעביר אותו דרך מסנן של 0.22 מיקרומטר כדי להסיר חלקיקים או מזהמים אפשריים.
- זריעת התאים
- תרבית תאי MDA-MB 231 עם מדיום שלם (DMEM בתוספת 1% עט/סטרפטוק, 10% FBS ו-1% L-Glu) באינקובטור תרבית תאים ב-37 מעלות צלזיוס, 5% CO2. כאשר התאים מגיעים לכ-80% מפגש בבקבוק T75, השליכו את המדיום, שטפו עם 4 מ"ל DPBS והוסיפו 3 מ"ל טריפסין/EDTA. הניחו את הבקבוק בחממה והמתינו עד שהתאים יתנתקו. בדוק את הניתוק במיקרוסקופ הפוך (ב-20x) כל 5 דקות.
- אסוף את התאים המנותקים עם 3 מ"ל DPBS עם 10% FBS בצינור של 15 מ"ל וצנטריפוגה ב-235 x גרם למשך 10 דקות. השליכו את הסופרנטנט המכיל גם DPBS וגם טריפסין/EDTA והשעו מחדש את כדור התאים ב-3 מ"ל של מדיום טרי. פיפטה 10 מיקרוליטר של תרחיף תאים עם 10 מיקרוליטר של טריפנבלו וספרו את התאים באמצעות תא נויבאואר.
הערה: בעת קצירת התאים, נטרל את הטריפסין/EDTA עם DPBS המכיל 10% FBS כדי למנוע מהטריפסין לפגוע בתאים במהלך שלב הצנטריפוגה. - כדי להשיג קוטר ספרואיד נומינלי של 50 מיקרומטר (~15 תאים/ספרואיד), יש לדלל את תרחיף התא לריכוז סופי של 3,840 תאים/190 מיקרוליטר, וכתוצאה מכך 256 ספרואידים בתבנית הקטנה. לחלופין, עבור קוטר ספרואיד של 200 מיקרומטר (~1,000 תאים/ספרואיד) יש לדלל לריכוז סופי של 81,000 תאים/190 מיקרוליטר, וכתוצאה מכך 81 ספרואידים בתבנית הגדולה, לפי הוראות היצרן.
- הסר את מדיום התרבות מצלחת 12 הבארות והטה את המצעים כדי להסיר בזהירות את המדיום מתא זריעת התאים. הוסף 190 מיקרוליטר של תרחיף תאים לכל מצע (בצורה טיפתית) והמתן עד שהתאים ישקעו במשך 10 דקות בחממת תרבית הרקמה.
- הוסף 2 מ"ל מהמדיום שמסביב לבאר והנח את הרב-באר בחזרה לחממה. בדוק אם יש היווצרות כדורים כל 24 שעות. מחליפים במדיום טרי בעת הצורך.
- קציר ועיבוד ספרואידים
- מניחים צלחת פטרי 35 מ"מ המכילה 2 מ"ל מדיום טרי בחממה לאיזון למשך 10-15 דקות.
- הסר את מדיום תרבית התאים המקיף את המצע. בעזרת פינצטה סטרילית מוציאים את המצע מהבאר והופכים אותו בצלחת הפטרי. הקש בעדינות על תחתית המצע כדי לגרום לכדורים ליפול על ידי כוח הכבידה.
- מניחים את צלחת הפטרי המכילה את הספרואידים בחזרה באינקובטור להמשך עיבוד. שלבי פרוטוקול לייצור ספרואידים מוצגים באיור 2.
3. טיפול בכדורים
- הסר את הסופרנטנט מהתבנית והחלף אותו ב-200 מיקרוליטר של פיזור Dox@DDAB-MDs, שהוכן כמתואר בשלב 1.1.6.
- לאחר 5 דקות, הוסף 2 מ"ל/באר של המדיום שמסביב לשיווי משקל. לאחר זמן הטיפול הרצוי, המשך לפי שלב 2.1.
4. אפיון גודל הכדור והמורפולוגיה
- בדוק את גודל הכדור לאחר זמן הדגירה הרצוי עם מטרה של פי 40 בשילוב עם תוכנת עיבוד התמונה של המיקרוסקופ.
- מדוד את הגודל של לפחות 10 ספרואידים כדי לאסוף מספיק נתונים לסטטיסטיקה מתאימה ולנתח את נפחיהם כפי שדווח בשלב 7.
5. בדיקת התפשטות/כדאיות: מיקרוסקופ פלואורסצנטי עם צביעת תאים חיים
הערה: עקוב אחר ההוראות לייצור ספרואידים עד שלב 2.2.5.
- מוציאים את הסופרנטנט מהתבנית ומחליפים אותו ב-200 מיקרוליטר של 4 מיקרומטר סידן-AM ב-PBS ודוגרים למשך 3 שעות בטמפרטורת החדר בחושך. במהלך 20 הדקות האחרונות של הדגירה, הוסף 10 מיקרוגרם/מ"ל של פרופידיום יודיד כדי לצבוע את התאים המתים.
- קצרו את הספרואידים על ידי היפוך המצע לתוך צלחת הפטרי לפי שלב 2.3.2.
- דמיין את הספרואידים בתמיסת מכתים באמצעות CLSM עם יעדים של 40x/60x ולייזר Ar+, תוך הגדרת הרווח והחור בדרכים מתאימות להשגת תמונות ממוקדות.
6. ניתוח ורכישה של תמונות
- שידור ותמונות דו-ממדיות קונפוקליות
- פתח את התוכנה הקונפוקלית (קובץ משלים א') ובחר את המטרה (60x, 40x וכו'). בחלונית הימנית לחץ על טרנס כדי לבחור את ערוץ השידור.
- לחץ על Live כדי לדמיין את התמונה ולחפש את המיקוד האופטימלי. לחץ על סינגל כדי לעצור את הרכישה.
- לתמונות קונפוקליות, לחץ על ערוצי לייזר אדומים או ירוקים בהתאם לצבע הפלואורסצנטי בו נעשה שימוש. בקטע חור הסיכה, בחר צמצם S בתפריט הנפתח והגדר את קטע הרווח ל-6.00 B.
- לחץ על Live והגדר את צמצם חור הסיכה והרווח לאופטימיזציה של הניגודיות. לחץ על סינגל כדי לעצור את הרכישה ולשמור את התמונה. חפפו את השידור ואת התמונה הקונפוקלית על ידי בחירת הערוץ הנכון בסרגל הכלים העליון.
- תמונות תלת-ממד קונפוקליות
- לחץ על Z בחלונית הימנית (קובץ משלים B). לחץ על הכפתור האדום כדי לאפס את ההגדרות.
- בחר את הקטע Ref , לחץ על Live וחפש את התוכנית החציונית בתוך האובייקט המזיז את המיקוד. בחר את המקטע העליון והעבר את המיקוד למעלה עד שהאובייקט יוצא מהמיקוד ונעלם.
- חזור על שלב 6.2.2 עבור החלק התחתון הנע במורד המוקד.
- הגדר את גודל הצעד ל-0.75 מיקרומטר. לחץ על Z-stack ולאחר מכן על יחיד כדי להתחיל בסריקה. שמור את התמונות בפורמט .ics.
- תמונות אופטיות וניתוח
- פתח את תוכנת המיקרוסקופ האופטי, צלם את התמונה עם מיקוד ארוך פי 40 או מטרה פי 20 על ידי לחיצה על הפעל בסרגל הכלים העליון. לחץ על עצור ושמור את התמונה.
- בסרגל הכלים העליון לחץ על תצוגה, בקרת ניתוח, הערות ומדידות ופתיחת פאנל עם אפשרויות שונות (קובץ משלים C). בחלונית Annotation and Measurements , בחר Semiaxis ולחץ על Ellipse.
- בחיפוש התמונות, חפש את הציר המתאים יותר לצורת האובייקט ולחץ על Enter במקלדת כדי להעביר את הערך שהתקבל בטבלת החלונית הימנית.
- חזור על שלב 6.3.3 עבור לפחות 10 אובייקטים כדי לקבל מספיק נתונים. לחץ על ייצוא לגיליון נתונים של Excel כדי לייצא את הנתונים ולשמור אותם.
- הדמיה תלת-ממדית של תמונות Z-Stack וחישוב מספרי של נפח
- פתח את תמונת התלת מימד שצולמה במיקרוסקופיה קונפוקלית בתוכנת המיקרוסקופ האופטי (קובץ משלים D).
- כדי לראות את השחזור התלת-ממדי, לחץ על הצג תצוגת נפח בסרגל הכלים של התמונה; ניתן לסובב את האובייקט לכל כיוון על ידי לחיצה על לחצן העכבר השמאלי. כדי לבחור חלק מאמצעי האחסון, המשך להקיש על ctrl + מקשי העכבר השמאלי (קובץ משלים E).
- לחץ על לחצן x במקלדת כדי לצלם תמונה של התמונה התלת-ממדית ולשמור אותה.
- כדי לחשב את נפח האובייקט, לחץ על מדידה, מדידות אובייקט תלת-ממדי הפותחות חלונית (קובץ משלים, תמונה F). לחץ על סרגל הכלים של החלונית הגדר סף תלת-ממד והגדר את הסף האופטימלי גם באמצעות המסננים החלקים והנקיים (קובץ משלים, תמונה G). לחץ על אישור וקבל בלוח מדידות אובייקטים תלת מימדיים פרמטרים שונים, כולל עוצמת הקול.
- לחץ על ייצוא לאקסל כדי לייצא נתונים ולשמור אותם.
7. ניתוח נתונים ספרואידים
- עבור חישובי נפח הספרואידים, העריכו את המבנה התלת-ממדי עם אליפסואיד פרולאט, והעריכו את הציר הראשי והמינורי באמצעות ההקרנה הדו-ממדית כפי שמוצג בתוספת של איור 3.
- אמת את קירוב האליפסואיד של פרולאט באמצעות השוואה בין הנפח המחושב מספרית כפי שמוצג בשלב 6.4 לבין נוסחת
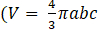 הנפח האליפסואיד של פרולאט עם b>a=c כאשר a, b ו-c הם ציר האליפסואיד).
הנפח האליפסואיד של פרולאט עם b>a=c כאשר a, b ו-c הם ציר האליפסואיד). - חשב את הנפח הממוצע של לפחות 10 ספרואידים ואת סטיות התקן המתאימות. אם התפלגות הנפח של הספרואיד תקינה, החל את מבחן דיקסון כדי לזהות ולדחות את הערך החריג. לאחר מכן, חשב את יחס הנפח בין הדגימות המטופלות לדגימות יחד עם התפשטות השגיאה כפי שדווח באיור 6A.
תוצאות
Dox@DDAB-MDs פותחו על פי פרוטוקול (סעיף 1) כמתואר באופן סכמטי באיור 1. ה-MDs המתקבלים עשויים משכבה אחת של DDAB העוטפת את ליבת DFP (איור 1A). המטען הקטיוני של DDAB והליך הסוניקציה נמנעים מהיווצרות שכבות רב-שכבתיות DDAB מוערמות בממשק DFP ומים2...
Discussion
כדי לשפר את היעילות של אנתרציקלינים כתרופות אנטי-גידוליות, עבודה זו מציגה את היווצרותן של טיפות PFC בקליפה DDAB העוטפות את התרופה הכימותרפית דוקסורוביצין (Dox) ואת ההשפעה של ניסוח כזה המקיים אינטראקציה עם תאי סרטן השד האגרסיביים ביותר, MDA-MB-231.
בניית DOX@DDAB-MDs<...
Disclosures
ניגוד עניינים: המחברים מצהירים שאין ניגוד עניינים.
זכויות אדם/בעלי חיים: מאמר זה אינו מכיל מחקרים כלשהם על נבדקים אנושיים או בעלי חיים שבוצעו על ידי מי מהמחברים.
Acknowledgements
עבודה זו קיבלה מימון מתוכנית המחקר והחדשנות של האיחוד האירופי Horizon 2020 במסגרת הסכם מענק AMPHORA (766456).
Materials
| Name | Company | Catalog Number | Comments |
| µ-Petri dish | Ibidi | 81156 | 35mm high, IbiTreat |
| 1,1,1,2,3,4,4,5,5,5-Decafluoropentane | Sigma-Aldrich | 138495-42-8 | b.p. 55°C |
| 12-well culture plate | Corning | ||
| 15 ml centrifuge tube | Falcon | 89039-664 | |
| 3D-Petri dishes 12:256 | Microtissues (Sigma-Aldrich) | Z764000-6EA | Small |
| 3D-Petri dishes 12:81 | Microtissues (Sigma-Aldrich) | Z764019-6EA | Large |
| 5%CO2 culture incubator, 37°C | Thermo Scienific | HERAcell 150i | |
| 50 ml centrifuge tube | Falcon | 352070 | |
| Biological safety cabinet, II level | |||
| Calcein | Sigma-Aldrich | ||
| Calcein-AM | Sigma-Aldrich | 148504-34-1 | 4mM stock solution in DMSO |
| cam sCMOS Andor Zyla 4.2 | Andor Instruments | ||
| Centrifuge Hettich Universal 320R | Hettich Lab. Technology | ||
| DAPI | SIgma-Aldrich | ||
| Dimethyldioctadecylammonium bromide powder | Sigma-Aldrich | 3700-67-2 | |
| DMEM (Dulbecco's Modified Eagle Medium) | Corning | 15-013-CV | |
| Doxorubicin hydrochloride | Sigma-Aldrich | 25316-40-9 | |
| DPBS (Dulbecco's Modified PBS) | Corning | 21-030-CV | pH 7,4 |
| Ethanol 70% | Sigma-Aldrich | ||
| EZ-C1 digital ecliplse | Nikon Instruments | Silver version 3.91 | |
| Fetal Bovine Serum (FBS) | Corning | 35-079-CV | |
| Goniometer BI-200SM | Brookhaven Instruments Corporations | ||
| Laser Ar+ | Spectra Physics | ||
| Laser He-Ne | Melles-Griot | ||
| L-Glutammine | Corning | 25-005-CI | |
| Mcroscope Nikon Eclipse Ti | Nikon Instruments | ||
| MDA-MB 231 cell line | ATCC | ||
| Microsoft Excel | Microsoft | ||
| Microplates reader Spark | Tecan group | ||
| NanoZetaSizer ZS | Malvern Instruments LTD | ||
| Neubauer improved chamber | 718605 | ||
| NIS Elements software | Nikon Instruments | AR 4.30 | |
| Pen/Strepto | Corning | 30-002-CI | |
| Photocorrelator BI-9000 AT | Brookhaven Instruments Corporations | 62927-1 | |
| Photometer HC120 | Brookhaven Instruments Corporations | N° 1275 | |
| Pipettors and tips, various size | Gilson | ||
| Propidium Iodide | SIgma-Aldrich | ||
| Serological pipets, various size | Corning | ||
| Solid-state laser | Suwtech Laser | N° 22368 | |
| T25 Flasks | Sarstedt | 83.3910.002 | |
| T75 Flasks | Sarstedt | 83.3911.002 | |
| Trypsin/EDTA 0.05% | EuroClone | ECB3052D | |
| Vibra-Cell VCX-400 | Sonics & Materials, inc | ||
| Water bath | 37°C |
References
- Aryal, S., Park, H., Leary, J. F., Key, J. Top-down fabrication-based nano/microparticles for molecular imaging and drug delivery. International Journal of Nanomedicine. 14, 6631-6644 (2019).
- Peng, Y., et al. Research and development of drug delivery systems based on drug transporter and nano-formulation. Asian Journal of Pharmaceutical Sciences. 15, 220-236 (2020).
- Chan, K. S., Koh, C. G., Li, H. Y. Mitosis-targeted anti-cancer therapies: Where they stand. Cell Death and Disease. 3, 411 (2012).
- Raj, S., Franco, V. I., Lipshultz, S. E. Anthracycline-induced cardiotoxicity: A review of pathophysiology, diagnosis, and treatment. Current Treatment Options in Cardiovascular Medicine. 16, 315 (2014).
- Iyer, A. K., Singh, A., Ganta, S., Amiji, M. M. Role of integrated cancer nanomedicine in overcoming drug resistance. Advanced Drug Delivery Reviews. 65, 1784-1802 (2013).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nature Biotechnology. 33, 941-951 (2015).
- Davis, M. E., Chen, Z., Shin, D. M. Nanoparticle therapeutics: An emerging treatment modality for cancer. Nature Reviews Drug Discovery. 7, 771-782 (2008).
- Lammers, T., Hennink, W. E., Storm, G. Tumour-targeted nanomedicines: Principles and practice. British Journal of Cancer. 99, 392-397 (2008).
- Couvreur, P., et al. Polycyanoacrylate nanocapsules as potential lysosomotropic carriers: preparation, morphological and sorptive properties. Journal of Pharmacy and Pharmacology. 31, 331-332 (1979).
- Yordanov, G. G., Dushkin, C. D. Preparation of poly(butylcyanoacrylate) drug carriers by nanoprecipitation using a pre-synthesized polymer and different colloidal stabilizers. Colloid and Polymer Science. 288, 1019-1026 (2010).
- Kooiman, K., Vos, H. J., Versluis, M., De Jong, N. Acoustic behavior of microbubbles and implications for drug delivery. Advanced Drug Delivery Reviews. 72, 28-48 (2014).
- Fasolato, C., et al. Antifolate SERS-active nanovectors: Quantitative drug nanostructuring and selective cell targeting for effective theranostics. Nanoscale. 11, 15224-15233 (2019).
- Cerroni, B., et al. Temperature-tunable nanoparticles for selective biointerface. Biomacromolecules. 16, 1753-1760 (2015).
- Chronopoulou, L., et al. PLGA based particles as "drug reservoir" for antitumor drug delivery: characterization and cytotoxicity studies. Colloids Surfaces B: Biointerfaces. 180, 495-502 (2019).
- Calderó, G., Paradossi, G. Ultrasound/radiation-responsive emulsions. Current Opinion in Colloid and Interface Science. 49, 118-132 (2020).
- Capece, S., et al. Complex interfaces in 'phase-change' contrast agents. Physical Chemistry Chemical Physics. 18, 8378-8388 (2016).
- Mielczarek, L., et al. In the triple-negative breast cancer MDA-MB-231 cell line, sulforaphane enhances the intracellular accumulation and anticancer action of doxorubicin encapsulated in liposomes. International Journal of Pharmaceutics. 558, 311-318 (2019).
- Ravi, M., Paramesh, V., Kaviya, S. R., Anuradha, E., Paul Solomon, F. D. 3D cell culture systems: Advantages and applications. Journal of Cellular Physiology. 230, 16-26 (2015).
- Heinonen, T. Better science with human cell-based organ and tissue models. Alternatives to Laboratory Animals. 43, 29-38 (2015).
- Thoma, C. R., Zimmermann, M., Agarkova, I., Kelm, J. M., Krek, W. 3D cell culture systems modeling tumor growth determinants in cancer target discovery. Advanced Drug Delivery Reviews. 69-70, 29-41 (2014).
- Astashkina, A., Grainger, D. W. Critical analysis of 3-D organoid in vitro cell culture models for high-throughput drug candidate toxicity assessments. Advanced Drug Delivery Reviews. 69-70, 1-18 (2014).
- Weigelt, B., Ghajar, C. M., Bissell, M. J. The need for complex 3D culture models to unravel novel pathways and identify accurate biomarkers in breast cancer. Advanced Drug Delivery Reviews. 69-70, 42-51 (2014).
- Feitosa, E., Karlsson, G., Edwards, K. Unilamellar vesicles obtained by simply mixing dioctadecyldimethylammonium chloride and bromide with water. Chemistry and Physics of Lipids. 140, 66-74 (2006).
- Cancerrxgene. Doxorubicin IC50. Genomics of drug sensitivity in cancer Available from: https://www.cancerrxgene.org/compound/Doxorubicin/133/overview/ic50 (2020)
- Boo, L., et al. Phenotypic and microRNA transcriptomic profiling of the MDA-MB-231 spheroid-enriched CSCs with comparison of MCF- 7 microRNA profiling dataset. PeerJ. 2017, 1-27 (2017).
- Domenici, F., Castellano, C., Dell'unto, F., Congiu, A. Temperature-dependent structural changes on DDAB surfactant assemblies evidenced by energy dispersive X-ray diffraction and dynamic light scattering. Colloids and Surfaces B: Biointerfaces. 95, 170-177 (2012).
- Choosakoonkriang, S., et al. Infrared spectroscopic characterization of the interaction of cationic lipids with plasmid DNA. Journal of Biological Chemistry. 276, 8037-8043 (2001).
- Yin, H., et al. Non-viral vectors for gene-based therapy. Nature Reviews Genetics. 15 (8), 541-555 (2014).
- Lentacker, I., Geers, B., Demeester, J., De Smedt, S. C., Sanders, N. N. Design and evaluation of doxorubicin-containing microbubbles for ultrasound-triggered doxorubicin delivery: Cytotoxicity and mechanisms involved. Molecular Therapy. 18, 101-108 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved