JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
유망한 약물 전달 시스템으로서의 상 변화 디메틸디옥타데실암모늄 껍질 미세방울: 포유류 종양 세포의 3D 스페로이드에 대한 결과
* 이 저자들은 동등하게 기여했습니다
요약
디메틸디옥타데실암모늄 브로마이드 껍질로 개발된 데카플루오로펜탄 미세방울은 탁월한 콜로이드 안정성과 활성성 생체 계면을 나타냈습니다. DDAB-MD는 인간 삼중음성 유방암(MDA-MB-231) 3D 모델에 대한 독소루비신의 향상된 흡수 및 항종양 활성과 함께 원형질막에 대한 높은 친화력을 특징으로 하는 효율적인 약물 저장소임이 입증되었습니다.
초록
방대한 테라노스틱 시나리오에서 상변화 과플루오로카본 미세방울(MD)의 현저한 개선은 합성 효율, 안정성 및 약물 전달 능력과 관련하여 MD 조성의 최적화를 통해 이루어집니다. 이를 위해 디메틸디옥타데실암모늄 브로마이드(DDAB) 양이온성 계면활성제 쉘로 안정화된 데카플루오로펜탄(DFP) MD를 설계했습니다. 펄스 고출력 절연에 의해 몇 초 내에 고농도의 DDAB-MD를 쉽게 얻을 수 있어 1μm 크기의 낮은 다분산 방울이 생성되었습니다. DDAB 쉘의 긴 포화 탄화수소 사슬과 함께 매우 긍정적인 ζ-전위는 액적과 그 안의 약물 화물을 안정화하는 핵심 요소입니다. DDAB 쉘과 세포 원형질막의 높은 친화력은 종양 세포 계면에서 약물 농도를 증가시키고 흡수를 촉진하여 국소 화학요법제 전달을 가능하게 합니다. 이를 통해 DDAB-MD는 매우 낮은 약물 투여량에서 높은 항종양 활성을 나타내는 관련 약물 전달 도구로 바뀔 수 있습니다.
이 연구에서 이러한 접근법의 효능은 포유류 종양 세포의 3D 스페로이드인 MDA-MB-231에 대한 독소루비신의 효과를 획기적으로 향상시키는 것으로 나타났습니다. 다세포 종양 스페로이드(즉, 구형 형태로 빽빽하게 밀집된 세포) 형태로 개발된 3차원(3D) 세포 배양액을 사용하면 2D 세포 배양에 비해 많은 이점이 있습니다: 기존의 체외 연구와 동물 실험 사이의 격차를 해소할 수 있는 잠재력이 있을 뿐만 아니라 보다 예측 가능한 체외 검사를 수행할 수 있는 능력을 향상시킬 것입니다 전임상 약물 개발을 위한 스크리닝 분석 또는 오프라벨 약물 및 새로운 공동 표적화 전략의 잠재력을 평가합니다.
서문
높은 항종양 효능을 보장하고 부작용을 줄일 수 있는 약물 전달 벡터는 심각한 화학-약학적 과제로 남아 있는 동시에 주요 목표입니다 1,2. 현재까지 이들의 진전은 처음에는 불충분한 현장 약물 방출과 임계 수준의 비특이적 독성 3,4,5의 대조로 인해 제한적이었습니다. 최근 몇 년 동안 리포좀, 고분자 미셀, 폴리머솜 6,7,8,9,10을 포함한 항암제의 투여를 개선하기 위해 여러 약물 전달 시스템이 구현되었습니다. 이러한 시스템은 약물의 순환 시간과 선택성을 증가시키는 동시에 건강한 장기 및 조직의 분포 및 축적을 줄일 수 있는 잠재력을 보여줍니다. 어쨌든, 안트라사이클린(anthracyclines)과 같은 항종양화학요법 약물의 캡슐화된 제형은 약물 내재화 효율을 현저히 감소시켰다. 최근에는 마이크로버블(microbubbles) 11, 마이크로액적(microdroplets), 하이브리드 금 나노입자(hybrid gold nanoparticles12), 나노 하이드로겔(nano-hydrogels)13, PLGA 스캐폴드(plga scaffolds) 및 메조포러스 플랫폼(mesoporous platforms) 14과 같은 자극 반응성 미크론 및 서브미크론 담체는 독소루비신(Dox) 및 도세탁셀(docetaxel)을 사용하여 종양 억제 효과를 표적으로 하고 발휘하는 높은 다용도성으로 인해 약리학적으로 주목을 받고 있습니다. 이러한 보균자를 다중 모드 작업(즉, 화학요법, 광열 및 유전자 시너지 접근법) 및 분자 이미징을 위한 효율적인 항암 군인으로 전환하기 위한 선구적인 실험15은 맞춤형 테라노스틱 나노의학을 위한 길을 열었습니다.
이 시나리오에서 상변화 과플루오로카본 마이크로액적(MD)은 높은 약물 화물 적재량, 생물학적 장벽을 해결하는 MD 쉘의 화학적 다양성, 콜로이드 안정성 및 합성 효율을 결합할 수 있는 주요 기회를 통해 평가되었습니다11,12. 추가 자산으로, PFC(과불화탄소) 코어의 음향 또는 광학 기화에 의해 촉진되는 MD의 반향성은 현장 이미징 및 유망한 치료 효능을 얻을 수 있습니다. 또한, 이온화 입자 빔의 에너지 방출에 의해 얻어진 MDS 코어 기화는 빔 추적 및 방사선 선량 측정에 활용될 수 있습니다.
본 연구는 디메틸디옥타데실암모늄 브로마이드(DDAB) 양이온성 계면활성제의 다중 사용 가능한 껍질에 의해 안정화된 데카플루오로펜탄(DFP) 미세방울을 개발하는 것을 목표로 합니다. DDAB shelled-MD는 물리화학적 및 생물학적 기대치를 모두 충족합니다. DFP 기반 미세방울은 생체 적합성 및 안정적인 과플루오로카본 MD를 달성하기 위한 귀중한 상변화 조영제인 것으로 입증되었습니다16. DDAB 결정질 겔은 생리학적 온도에서 긴 사슬을 포화시켜 소수성 코어에 깊숙이 침투하여 액적과 그 안의 약물 화물을 안정화합니다. 또한, 물 계면에서 높은 양성 ζ-전위는 MD의 콜로이드 안정성을 향상시킵니다. DDAB 껍질 표면의 생물학적 매력은 포유류 세포에 거의 영향을 미치지 않는 농도에서 박테리아와 곰팡이를 죽이고 원형질막, 음전하를 띤 항원 단백질, 뉴클레오티드, DNA 또는 나노 입자를 결합하는 능력에 있습니다. 위에서 언급한 특징은 포유류 세포 내에서 놀라운 면역 보조제, 유전자 치료 및 항종양 작용을 생성하는 데 활용될 수 있습니다17.
본원에 기술된 독스-로딩 DDAB-MD(Dox@DDAB-MD)는 매우 공격적이고, 침습적이며, 분화가 불량한 삼중음성 유방암 세포에 대한 약물 방출을 촉진합니다. 원스텝 포뮬레이션에서 Dox의 높은 로딩 효율과 좁은 크기 분포를 가진 안정적이고 고밀도 DDAB-MD를 얻기 위해 고출력 프로브 인조네이션을 기반으로 간단하고 빠른 프로토콜이 아래에 설명되어 있습니다. 이러한 특성은 미세유체 장치 및 고전단 균질기와 같은 다른 제조 방법에 대해서도 경쟁력이 있습니다16.
효율적인 약물 전달 벡터를 설계하는 데 있어 또 다른 주요 제한 문제는 약물의 활성이 실제 생물학적 표적에서 얻을 수 있는 다양한 매개변수(예: 흡수, 분포, 농도)의 함수라는 것인데, 이는 단층 세포 모델로는 고려할 수 없습니다18. 이러한 이유로, 새로운 항종양 제형의 개발 역사는 불행히도 동물의 전임상 모델 수준에서 이미 효과가 없는 결과를 낳은 시험관 내 연구로 가득 차 있습니다19.
특히, 세포 배양에서 in vivo 및 ex vivo 연구보다 더 복잡하고 신뢰할 수 있는 시스템으로 이동해야 할 필요성은 2D 배양에 대한 약리학적 연구의 내재적 한계와 관련이 있습니다. 이러한 맥락에서, 스페로이드, 오가노이드, 장기 칩과 같은 체외 3D 시스템이 포함되며, 이는 2D 단층(20)보다 더 복잡한 구조의 형태, 활성 및 생리학적 반응을 시뮬레이션합니다. 전임상 관점에서 세포 미세환경을 모방한 3D 세포 모델은 기존의 단층 배양이 효과적이지 않은 생리학적으로 더 적절한 프레임에서 복잡한 생물학을 더 잘 이해할 수 있는 가능성을 제공합니다21,22.
DDAB-MD가 인간 유방암 세포의 세포막과 상호 작용하여 매우 낮은(나노몰) Dox 농도에서 약물 내재화 및 세포 사멸을 촉진할 수 있음을 입증한 후, 포유류 종양 세포의 3D 스페로이드인 MDA-MB-231에 대한 이러한 방법론의 효능이 테스트되었습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
참고: 모든 시약과 기기는 재료 표에 나열되어 있습니다.
1. 미세방울의 제작 및 특성화
- Dox 로드 DDAB-MD 준비
- DDAB 분말을 에탄올에 용해시켜 10mM의 최종 농도와 1mL의 최종 부피를 얻습니다. Dox 분말 2mg을 에탄올에 용해시키는 Dox 스톡 용액 1mL를 준비합니다.
주의: Dox는 급성 경구 독성, 범주 4 및 발암성, 범주 1B를 가진 것으로 알려져 있습니다. 장갑과 건강 마스크가 있는 흄 후드 아래에서만 사용하십시오. - 15mL 플라스틱 눈금 원심분리기 튜브에 250μL의 DFP를 300μL의 DDAB 용액(오일 상)에 추가합니다.
참고 : DFP의 순도는 60 % (GC), 밀도 1.6g / mL (20 °C), 끓는점은 55 °C입니다. Dox 순도는 98, 0-102, 0%(HPLC)입니다. DDAB 순도는 ≥98%(TLC)입니다. 에탄올의 순도는 97%입니다. - 오일 상태에 2.15mL의 탈이온수를 부드럽게 첨가하여 2상 물/오일 혼합물을 만듭니다. 상당한 양의 Dox가 수상으로 분할되는 것을 방지하기 위해 인조네이션 직전에 10μL의 Dox 용액을 유상에 직접 부드럽게 주입합니다.
- 20kHz, 100W에서 100초 동안 펄스 모드(0.7초 켜기 및 0.3초 끄기)에서 고강도 초음파 액체 처리기 장비를 사용하여 프로브 인조네이션(티타늄 테이퍼 마이크로팁 1/8 포함)으로 이위상 혼합물을 유화합니다. 새로 준비된 MD를 한외여과된 탈이온수(예: MilliQ)로 즉시 1.8배 희석합니다.
참고: 희석 계수는 경험적으로 선택된 지표입니다. MD 용액은 후속 원심 분리에서 충분한 펠릿을 얻는 한 더 희석될 수 있습니다. - 얻어진 현탁액 1mL를 취하고 3x를 원심분리한 후 한외여과된 탈이온수(예: MilliQ)에 재현탁시켜 과도한 Dox 및 에탄올을 제거합니다. 첫 번째 원심분리는 25°C, 360 x g 에서 3분 동안 수행하고 두 번째 및 세 번째 원심분리는 동일한 온도와 시간에 280 x g 에서 수행합니다.
- 마지막 세척 후, 상등액 물을 제거하고 펠릿 5 μL를 추출하고 세포 처리를 위해 배지 2 mL에 분산시켜 10 nM의 등가 Dox 농도를 얻습니다. Dox@DDAB-MD 합성을 위한 프로토콜 단계는 그림 1에 나와 있습니다.
참고: 등가 Dox 농도는 Dox@DDAB-MD의 현탁액과 동일한 부피에 포함된 유리 Dox의 양으로 정의됩니다.
- DDAB 분말을 에탄올에 용해시켜 10mM의 최종 농도와 1mL의 최종 부피를 얻습니다. Dox 분말 2mg을 에탄올에 용해시키는 Dox 스톡 용액 1mL를 준비합니다.
- Dox 로드 DDAB-MD의 특성화
- DLS(Dynamic Light Scattering) 광도계를 사용하여 크기 분포를 측정하고 CONTIN 알고리즘으로 얻은 코렐로그램을 분석하여 관련 감쇠 시간을 외삽합니다. 그런 다음 감쇠 시간을 사용하여 입자의 확산 계수(D)의 분포를 결정하고 이를 스톡스-아인슈타인 관계 RH = kBT/6πηD를 사용하여 유체역학적 직경(2RH)의 분포로 변환합니다. 여기서 kBT는 시스템의 열 에너지이고 용매 점도를 η합니다.
- 또한 이미지 분석 소프트웨어(예: 이미지 J)와 함께 명시야 현미경을 사용하여 크기와 크기 분포를 확인하고 프레임당 최소 100개의 액적(3 또는 4 프레임의 경우)의 크기를 측정하여 평균값과 표준 편차를 얻습니다.
참고: DLS 측정의 경우 MDS 용액을 한외여과된 탈이온수(예: MilliQ), PBS 및 세포 배양 배지에서 희석하여 후방 산란을 1.5 x 108 MDs /mL의 고정 농도로 만듭니다. 세포 배양 배지 내 한외여과수, 탈이온수, PBS의 경우 각각 1.1 ± 0.1 μm, 1.1 ± 0.25 μm, 1.2 ± 0.2 μm의 평균 크기 값을 얻었습니다. 원심분리 후 펠릿에서 회수된 MD는 오류 내에서 크기 변화를 보이지 않습니다. - 현미경 검사용 세포 계수 챔버 슬라이드를 사용하여 MD 농도를 평가합니다. 챔버는 두께가 0.10mm인 두 개의 서로 다른 계수 영역으로 구성됩니다. 챔버 위에 10μL의 MD 현탁액을 놓습니다. 40x 장거리 대물렌즈가 있는 광학 현미경을 사용하여 챔버의 0.25 x 0.25nm2 제곱 내부의 MD를 계수하고 이미지 분석 프리웨어로 분석합니다.
- 다음 방정식에 따라 MD/mL 수로 표시되는 MD 농도를 계산합니다.
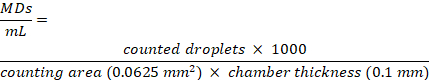
- 590nm에서 Dox 자가형광을 활용하는 CLSM(Confocal Laser Scanning Microscope) 이미지를 통해 내부화된 Dox를 확인합니다. 형광 분석을 사용하여 Dox 함량을 측정하고, 입자를 한외 여과수, 탈이온수 또는 PBS에 분산시키고, 25°C, 360 x g 에서 3분 동안 원심분리한 다음 보정 곡선으로 590nm에서 상등액의 형광을 평가하여 유리 약물의 양을 측정합니다(Dox 농도에 대한 선형성 범위: 2-20 μmol/mL, R2 = 0.99)입니다.
참고: Dox의 총 농도에서 얻은 값을 빼서 캡슐화된 Dox의 양을 구합니다. 실험을 세 번으로 수행합니다. Dox 캡슐화 효율은 28%± 2%이며, MD의 Dox의 약물 양을 배포된 Dox의 총 함량으로 나누어 계산합니다. - 1.2.3단계에 따라 원심분리하고 절차를 반복하여 시간 경과에 따른 Dox 방출 실험을 수행하여 캡슐화된 Dox의 수에 대한 상등액에서 방출된 Dox의 백분율을 구합니다. 첫 번째 측정 후 MD 파손을 방지하기 위해 원심분리 속도를 280 x g로 줄여 절차를 반복합니다. 시간 경과에 따른 이형 곡선을 플로팅합니다. 상층액에서 24시간 이내에 방출되는 Dox의 농도가 최대 20%에 도달하는지 확인하십시오.
- 전용 장치(예: NanoZetaSizer)를 사용하여 37°C에서 ζ-전위를 측정하고 얻은 값이 약 90-100mV인지 확인합니다.
2. 마이크로 성형 비접착 기판의 스페로이드 제작
- 주조 마이크로 금형
- 작은 3D 주형과 순수 아가로스 분말 1g을 살균에 적합한 용기에 넣습니다. 건조 사이클(121°C)에서 30분 동안 오토클레이브합니다.
- 생물 안전 캐비닛에서 멸균된 아가로스가 들어있는 유리병에 0.9% 식염수(NaCl) 용액 50mL를 넣고 전자레인지에 넣어 분말을 끓여 녹입니다. 용융된 아가로스를 60°C로 냉각시키고 각 마이크로 몰드에 500μL를 첨가하여 피펫팅 시 기포가 생성되지 않도록 합니다.
경고 : 용융된 아가로스는 심각한 피부 화상을 유발할 수 있습니다. 적절한 개인 보호 장비가 필요합니다. - 금형을 조심스럽게 구부리고 새로 형성된 기판을 제거하여 겔화된 아가로스를 제거합니다. 기질을 12웰 플레이트에 넣고 웰당 2mL의 신선한 배양 배지를 추가합니다. 각 기질이 평형을 이루기 위해 최소 15분 동안 배양합니다.
참고: 배양 배지를 미리 준비하고 0.22μm 필터를 통과시켜 가능한 입자 또는 오염 물질을 제거합니다.
- 세포 파종
- 37°C, 5%CO2의 세포 배양 인큐베이터에서 완전한 배지(1% Pen/Strep, 10% FBS 및 1% L-Glu가 보충된 DMEM)로 MDA-MB 231 세포를 배양합니다. 세포가 T75 플라스크에서 약 80% 합류점에 도달하면 배지를 버리고 4mL의 DPBS로 헹구고 3mL의 트립신/EDTA를 추가합니다. 플라스크를 인큐베이터에 넣고 세포가 분리될 때까지 기다립니다. 5분마다 도립 현미경(20x)으로 분리를 검사합니다.
- 15mL 튜브에 FBS 10%가 함유된 DPBS 3mL로 분리된 세포를 수집하고 235 x g 에서 10분 동안 원심분리합니다. DPBS와 트립신/EDTA를 모두 함유한 상등액을 버리고 세포 펠렛을 3mL의 새로운 배지에 재현탁합니다. 10μL의 세포 현탁액과 10μL의 트리판블루를 피펫팅하고 Neubauer 챔버를 사용하여 세포를 계수합니다.
참고: 세포를 수확할 때 FBS가 10% 함유된 DPBS로 트립신/EDTA를 중화하여 원심분리 단계에서 트립신이 세포를 손상시키는 것을 방지합니다. - 50μm(~15개 cells/spheroid)의 공칭 스페로이드 직경을 얻으려면 세포 현탁액을 3,840 cells/190 μL의 최종 농도로 희석하여 작은 금형에 256개의 스페로이드를 생성합니다. 또는 200μm 스페로이드 직경(~1,000 cells/spheroid)의 경우 81,000 cells/190 μL의 최종 농도로 희석하여 제조업체의 지침에 따라 대형 금형에 81개의 스페로이드를 생성합니다.
- 12-well 플레이트에서 배양 배지를 제거하고 기질을 기울여 세포 시딩 챔버에서 배지를 조심스럽게 제거합니다. 각 기질에 190μL의 세포 현탁액을 적하 방식으로) 추가하고 조직 배양 인큐베이터에서 세포가 10분 동안 침전될 때까지 기다립니다.
- 웰당 주변 배지 2mL를 추가하고 멀티웰을 다시 인큐베이터에 넣습니다. 24시간마다 스페로이드 형성을 검사합니다. 필요한 경우 새 매체로 교체하십시오.
- 스페로이드 수확 및 가공
- 35mL의 신선한 배지가 들어 있는 2mm 페트리 접시를 인큐베이터에 놓고 10-15분 동안 평형을 이룹니다.
- 기질을 둘러싼 세포 배양 배지를 제거합니다. 멸균 핀셋을 사용하여 우물에서 기질을 제거하고 페트리 접시에서 뒤집습니다. 기판의 바닥을 부드럽게 두드려 스페로이드가 중력에 의해 떨어지도록 합니다.
- 추가 처리를 위해 스페로이드가 들어 있는 페트리 접시를 인큐베이터에 다시 놓습니다. 스페로이드 제작을 위한 프로토콜 단계는 그림 2에 나와 있습니다.
3. 스페로이드 처리
- 금형에서 상등액을 제거하고 1.1.6단계에서 설명한 대로 준비된 200μL의 Dox@DDAB-MD 분산액으로 교체합니다.
- 5분 후 주변 배지의 2mL/웰을 추가하여 평형을 이룹니다. 원하는 시술 시간이 지나면 2.1 단계에 따라 진행합니다.
4. 스페로이드 크기 및 형태의 특성화
- 현미경 이미지 처리 소프트웨어와 결합된 40x 대물렌즈를 사용하여 원하는 배양 시간 후 스페로이드 크기를 확인합니다.
- 적절한 통계에 충분한 데이터를 수집하고 7단계에서 보고된 대로 부피를 분석하기 위해 최소 10개의 스페로이드의 크기를 측정합니다.
5. 증식/생존력 분석: 살아있는 세포 염색을 이용한 형광 현미경 검사
참고: 2.2.5단계까지 스페로이드 제작 지침을 따릅니다.
- 금형에서 상등액을 제거하고 PBS에서 200μL의 4μM calcein-AM으로 교체하고 어두운 곳에서 실온에서 3시간 동안 배양합니다. 마지막 배양 20분 동안 10μg/mL의 프로피듐 요오드화물을 첨가하여 죽은 세포를 염색합니다.
- 2.3.2 단계에 따라 기질을 페트리 접시로 뒤집어 스페로이드를 수확합니다.
- 40x/60x 대물렌즈 및 Ar+ 레이저가 장착된 CLSM을 사용하여 염색 용액의 스페로이드를 이미지화하고 게인과 핀홀을 적절한 방식으로 설정하여 초점이 맞춰진 이미지를 얻을 수 있습니다.
6. 이미지 분석 및 획득
- 투과 및 컨포칼 2D 이미지
- 컨포칼 소프트웨어(Supplementary File A)를 열고 대물렌즈(60x, 40x 등)를 선택합니다. 오른쪽 패널에서 Trans 를 클릭하여 전송 채널을 선택합니다.
- Live를 클릭하여 이미지를 시각화하고 최적화된 초점을 검색합니다. Single을 클릭하여 획득을 중지합니다.
- 컨포칼 이미지의 경우 사용된 형광 염료에 따라 빨간색 또는 녹색 레이저 채널을 클릭합니다. 핀홀 섹션의 드롭다운 메뉴에서 S-조리개 를 선택하고 게인 섹션을 6.00B로 설정합니다.
- Live를 클릭하고 대비를 최적화하기 위해 핀홀 조리개와 게인을 설정합니다. Single을 클릭하여 획득을 중지하고 이미지를 저장합니다. 투과 및 컨포칼 이미지를 겹치려면 상단 도구 모음에서 올바른 채널을 선택합니다.
- 컨포칼 3D 이미지
- 오른쪽 패널에서 Z를 클릭합니다(보충 파일 B). 빨간색 버튼을 클릭하여 설정을 재설정합니다.
- Ref 섹션을 선택하고 Live를 클릭한 다음 초점을 이동하는 개체 내부의 중앙분리대를 검색합니다. 위쪽 섹션을 선택하고 개체가 초점을 잃고 사라질 때까지 초점을 위로 이동합니다.
- 초점을 아래로 이동하는 하단 섹션에 대해 6.2.2단계를 반복합니다.
- 단계 크기를 0.75μm로 설정합니다. Z-stack 을 클릭한 다음 Single 을 클릭하여 스캔을 시작합니다. 이미지를 .ics 형식으로 저장합니다.
- 광학 이미지 및 분석
- 광학 현미경 소프트웨어를 열고 상단 도구 모음에서 재생을 눌러 40x 장초점 또는 20x 대물렌즈로 이미지를 캡처합니다. 중지 를 누르고 이미지를 저장합니다.
- 상단 도구 모음에서 View(보기), Analysis Control(분석 제어), Annotations and Measurements(주석 및 측정 )를 클릭하여 다양한 옵션이 있는 패널(보충 파일 C)을 엽니다. Annotation and Measurements 패널에서 Semiaxis 를 선택하고 Ellipse를 클릭합니다.
- 이미지 검색에서 개체 모양에 더 잘 맞는 축을 검색하고 키보드에서 Enter 키를 눌러 얻은 값을 오른쪽 패널 테이블에서 전송합니다.
- 10개 이상의 개체에 대해 6.3.3단계를 반복하여 충분한 데이터를 얻습니다. Export to Excel Data Sheet(Excel 데이터 시트로 내보내기 )를 클릭하여 데이터를 내보내고 저장합니다.
- 3D Z-Stack 이미지 시각화 및 볼륨 수치 계산
- 컨포칼 현미경으로 캡처한 3D 이미지를 광학 현미경 소프트웨어(보충 파일 D)에서 엽니다.
- 3D 재구성을 보려면 이미지 도구 모음에서 볼륨 보기 표시를 클릭합니다. 개체는 마우스 왼쪽 버튼을 클릭하여 어떤 방향으로든 회전할 수 있습니다. 볼륨의 일부를 선택하려면 ctrl + 마우스 왼쪽 버튼(보조 파일 E)을 계속 누릅니다.
- 키보드의 x 버튼을 눌러 3D 이미지의 스냅샷을 찍고 저장합니다.
- 개체 부피를 계산하려면 측정, 패널을 여는 3D 개체 측정을 클릭합니다(보충 파일, 이미지 F). 패널 도구 모음에서 3D 임계값 정의를 클릭하고 부드럽고 깨끗한 필터(보충 파일, 이미지 G)를 사용하여 최적화된 임계값을 설정합니다. 확인을 클릭하면 3D 개체 측정 패널에서 볼륨을 포함한 다른 매개 변수를 얻을 수 있습니다.
- Excel로 내보내기를 클릭하여 데이터를 내보내고 저장합니다.
7. 스페로이드 데이터 분석
- 스페로이드 부피 계산을 위해 프롤레이트 타원체로 3D 구조를 근사화하고 그림 3의 삽입물과 같이 2D 투영을 통해 장축과 단축을 추정합니다.
- 6.4단계에 표시된 대로 숫자로 계산된 부피와 b>a=c, 여기서 a, b, c는 타원체 축임)이 있는 prolate 타원 부피 공식
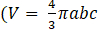 간의 비교를 통해 prolate 타원 근사치를 검증합니다.
간의 비교를 통해 prolate 타원 근사치를 검증합니다. - 최소 10개의 스페로이드의 평균 부피와 해당 표준 편차를 계산합니다. 스페로이드의 부피 분포가 정상이면 Dixon 검정을 적용하여 이상치 값을 식별하고 기각합니다. 그런 다음, 그림 6A에 보고된 대로 오류 전파와 함께 처리된 샘플과 샘플 사이의 부피 비율을 계산합니다.
Access restricted. Please log in or start a trial to view this content.
결과
Dox@DDAB-MD는 그림 1에 개략적으로 설명된 대로 프로토콜(섹션 1)에 따라 개발되었습니다. 얻어진 MD는 DFP 코어를 캡슐화하는 DDAB의 단층으로 만들어집니다(그림 1A). DDAB의 양이온 전하 및 초음파 처리 절차는 DFP 및 물 계면23에 적층 된 DDAB 다층 층의 형성을 방지합니다.
CLSM 현미?...
Access restricted. Please log in or start a trial to view this content.
토론
항종양제로서 안트라사이클린의 효능을 향상시키기 위해 본 연구에서는 화학요법제인 독소루비신(Dox)을 캡슐화한 DDAB 껍질 PFC 방울의 형성 및 이러한 제형이 공격적인 삼중음성 유방암 세포인 MDA-MB-231과 상호 작용하는 효과를 제시합니다.
DOX@DDAB-MD 구축
Dox 로드 MD는 매우 빠르고, 재현성이 뛰어나며, 사용자 친화적이고, 효율적인 프로...
Access restricted. Please log in or start a trial to view this content.
공개
이해 상충: 저자는 이해 상충이 없음을 선언합니다.
인간/동물의 권리: 이 논문에는 저자가 인간 또는 동물을 대상으로 수행한 연구가 포함되어 있지 않습니다.
감사의 말
이 작업은 보조금 계약 AMPHORA(766456)에 따라 European Union Horizon 2020 연구 및 혁신 프로그램에서 자금을 지원받았습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| µ-Petri dish | Ibidi | 81156 | 35mm high, IbiTreat |
| 1,1,1,2,3,4,4,5,5,5-Decafluoropentane | Sigma-Aldrich | 138495-42-8 | b.p. 55°C |
| 12-well culture plate | Corning | ||
| 15 ml centrifuge tube | Falcon | 89039-664 | |
| 3D-Petri dishes 12:256 | Microtissues (Sigma-Aldrich) | Z764000-6EA | Small |
| 3D-Petri dishes 12:81 | Microtissues (Sigma-Aldrich) | Z764019-6EA | Large |
| 5%CO2 culture incubator, 37°C | Thermo Scienific | HERAcell 150i | |
| 50 ml centrifuge tube | Falcon | 352070 | |
| Biological safety cabinet, II level | |||
| Calcein | Sigma-Aldrich | ||
| Calcein-AM | Sigma-Aldrich | 148504-34-1 | 4mM stock solution in DMSO |
| cam sCMOS Andor Zyla 4.2 | Andor Instruments | ||
| Centrifuge Hettich Universal 320R | Hettich Lab. Technology | ||
| DAPI | SIgma-Aldrich | ||
| Dimethyldioctadecylammonium bromide powder | Sigma-Aldrich | 3700-67-2 | |
| DMEM (Dulbecco's Modified Eagle Medium) | Corning | 15-013-CV | |
| Doxorubicin hydrochloride | Sigma-Aldrich | 25316-40-9 | |
| DPBS (Dulbecco's Modified PBS) | Corning | 21-030-CV | pH 7,4 |
| Ethanol 70% | Sigma-Aldrich | ||
| EZ-C1 digital ecliplse | Nikon Instruments | Silver version 3.91 | |
| Fetal Bovine Serum (FBS) | Corning | 35-079-CV | |
| Goniometer BI-200SM | Brookhaven Instruments Corporations | ||
| Laser Ar+ | Spectra Physics | ||
| Laser He-Ne | Melles-Griot | ||
| L-Glutammine | Corning | 25-005-CI | |
| Mcroscope Nikon Eclipse Ti | Nikon Instruments | ||
| MDA-MB 231 cell line | ATCC | ||
| Microsoft Excel | Microsoft | ||
| Microplates reader Spark | Tecan group | ||
| NanoZetaSizer ZS | Malvern Instruments LTD | ||
| Neubauer improved chamber | 718605 | ||
| NIS Elements software | Nikon Instruments | AR 4.30 | |
| Pen/Strepto | Corning | 30-002-CI | |
| Photocorrelator BI-9000 AT | Brookhaven Instruments Corporations | 62927-1 | |
| Photometer HC120 | Brookhaven Instruments Corporations | N° 1275 | |
| Pipettors and tips, various size | Gilson | ||
| Propidium Iodide | SIgma-Aldrich | ||
| Serological pipets, various size | Corning | ||
| Solid-state laser | Suwtech Laser | N° 22368 | |
| T25 Flasks | Sarstedt | 83.3910.002 | |
| T75 Flasks | Sarstedt | 83.3911.002 | |
| Trypsin/EDTA 0.05% | EuroClone | ECB3052D | |
| Vibra-Cell VCX-400 | Sonics & Materials, inc | ||
| Water bath | 37°C |
참고문헌
- Aryal, S., Park, H., Leary, J. F., Key, J. Top-down fabrication-based nano/microparticles for molecular imaging and drug delivery. International Journal of Nanomedicine. 14, 6631-6644 (2019).
- Peng, Y., et al. Research and development of drug delivery systems based on drug transporter and nano-formulation. Asian Journal of Pharmaceutical Sciences. 15, 220-236 (2020).
- Chan, K. S., Koh, C. G., Li, H. Y. Mitosis-targeted anti-cancer therapies: Where they stand. Cell Death and Disease. 3, 411(2012).
- Raj, S., Franco, V. I., Lipshultz, S. E. Anthracycline-induced cardiotoxicity: A review of pathophysiology, diagnosis, and treatment. Current Treatment Options in Cardiovascular Medicine. 16, 315(2014).
- Iyer, A. K., Singh, A., Ganta, S., Amiji, M. M. Role of integrated cancer nanomedicine in overcoming drug resistance. Advanced Drug Delivery Reviews. 65, 1784-1802 (2013).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nature Biotechnology. 33, 941-951 (2015).
- Davis, M. E., Chen, Z., Shin, D. M. Nanoparticle therapeutics: An emerging treatment modality for cancer. Nature Reviews Drug Discovery. 7, 771-782 (2008).
- Lammers, T., Hennink, W. E., Storm, G. Tumour-targeted nanomedicines: Principles and practice. British Journal of Cancer. 99, 392-397 (2008).
- Couvreur, P., et al. Polycyanoacrylate nanocapsules as potential lysosomotropic carriers: preparation, morphological and sorptive properties. Journal of Pharmacy and Pharmacology. 31, 331-332 (1979).
- Yordanov, G. G., Dushkin, C. D. Preparation of poly(butylcyanoacrylate) drug carriers by nanoprecipitation using a pre-synthesized polymer and different colloidal stabilizers. Colloid and Polymer Science. 288, 1019-1026 (2010).
- Kooiman, K., Vos, H. J., Versluis, M., De Jong, N. Acoustic behavior of microbubbles and implications for drug delivery. Advanced Drug Delivery Reviews. 72, 28-48 (2014).
- Fasolato, C., et al. Antifolate SERS-active nanovectors: Quantitative drug nanostructuring and selective cell targeting for effective theranostics. Nanoscale. 11, 15224-15233 (2019).
- Cerroni, B., et al. Temperature-tunable nanoparticles for selective biointerface. Biomacromolecules. 16, 1753-1760 (2015).
- Chronopoulou, L., et al. PLGA based particles as "drug reservoir" for antitumor drug delivery: characterization and cytotoxicity studies. Colloids Surfaces B: Biointerfaces. 180, 495-502 (2019).
- Calderó, G., Paradossi, G. Ultrasound/radiation-responsive emulsions. Current Opinion in Colloid and Interface Science. 49, 118-132 (2020).
- Capece, S., et al. Complex interfaces in 'phase-change' contrast agents. Physical Chemistry Chemical Physics. 18, 8378-8388 (2016).
- Mielczarek, L., et al. In the triple-negative breast cancer MDA-MB-231 cell line, sulforaphane enhances the intracellular accumulation and anticancer action of doxorubicin encapsulated in liposomes. International Journal of Pharmaceutics. 558, 311-318 (2019).
- Ravi, M., Paramesh, V., Kaviya, S. R., Anuradha, E., Paul Solomon, F. D. 3D cell culture systems: Advantages and applications. Journal of Cellular Physiology. 230, 16-26 (2015).
- Heinonen, T. Better science with human cell-based organ and tissue models. Alternatives to Laboratory Animals. 43, 29-38 (2015).
- Thoma, C. R., Zimmermann, M., Agarkova, I., Kelm, J. M., Krek, W. 3D cell culture systems modeling tumor growth determinants in cancer target discovery. Advanced Drug Delivery Reviews. 69-70, 29-41 (2014).
- Astashkina, A., Grainger, D. W. Critical analysis of 3-D organoid in vitro cell culture models for high-throughput drug candidate toxicity assessments. Advanced Drug Delivery Reviews. 69-70, 1-18 (2014).
- Weigelt, B., Ghajar, C. M., Bissell, M. J. The need for complex 3D culture models to unravel novel pathways and identify accurate biomarkers in breast cancer. Advanced Drug Delivery Reviews. 69-70, 42-51 (2014).
- Feitosa, E., Karlsson, G., Edwards, K. Unilamellar vesicles obtained by simply mixing dioctadecyldimethylammonium chloride and bromide with water. Chemistry and Physics of Lipids. 140, 66-74 (2006).
- Cancerrxgene. Doxorubicin IC50. Genomics of drug sensitivity in cancer. , Available from: https://www.cancerrxgene.org/compound/Doxorubicin/133/overview/ic50 (2020).
- Boo, L., et al. Phenotypic and microRNA transcriptomic profiling of the MDA-MB-231 spheroid-enriched CSCs with comparison of MCF- 7 microRNA profiling dataset. PeerJ. 2017, 1-27 (2017).
- Domenici, F., Castellano, C., Dell'unto, F., Congiu, A. Temperature-dependent structural changes on DDAB surfactant assemblies evidenced by energy dispersive X-ray diffraction and dynamic light scattering. Colloids and Surfaces B: Biointerfaces. 95, 170-177 (2012).
- Choosakoonkriang, S., et al. Infrared spectroscopic characterization of the interaction of cationic lipids with plasmid DNA. Journal of Biological Chemistry. 276, 8037-8043 (2001).
- Yin, H., et al. Non-viral vectors for gene-based therapy. Nature Reviews Genetics. 15 (8), 541-555 (2014).
- Lentacker, I., Geers, B., Demeester, J., De Smedt, S. C., Sanders, N. N. Design and evaluation of doxorubicin-containing microbubbles for ultrasound-triggered doxorubicin delivery: Cytotoxicity and mechanisms involved. Molecular Therapy. 18, 101-108 (2010).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유