このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
有望な薬物送達システムとしての相変化ジメチルジオクタデシルアンモニウム殻微小液滴:哺乳類腫瘍細胞の3Dスフェロイドでの結果
* これらの著者は同等に貢献しました
要約
ジメチルジオクタデシルアンモニウムブロマイドの殻で開発されたデカフルオロペンタン微小液滴は、優れたコロイド安定性と作用性生体界面を示しました。DDAB-MDは、ヒトトリプルネガティブ乳がん(MDA-MB-231)3Dモデルに対するドキソルビシンの取り込みと抗腫瘍活性の強化とともに、原形質膜への高い親和性を特徴とする効率的な薬物貯蔵庫であることが証明されました。
要約
広大なセラノスティックシナリオにおける相変化パーフルオロカーボン微小液滴(MD)の大幅な改善は、合成効率、安定性、および薬物送達能力に関するMD組成の最適化を経ます。この目的のために、ジメチルジオクタデシルアンモニウムブロマイド(DDAB)カチオン性界面活性剤のシェルによって安定化されたデカフルオロペンタン(DFP)MDが設計されました。パルスハイパワーインソネーションにより、数秒以内に高濃度のDDAB-MDが容易に得られ、その結果、1μmサイズの低多分散液滴が得られました。非常に正のζ電位と、DDABシェルの長く飽和した炭化水素鎖は、液滴とその中の薬物貨物を安定させるための重要な要素です。DDABシェルと細胞原形質膜の高い親和性により、腫瘍細胞界面での薬物濃度を増加させ、取り込みを促進することにより、局所的な化学療法の送達が可能になります。これにより、DDAB-MDは、非常に低い薬物用量で高い抗腫瘍活性を示す適切な薬物送達ツールに変わります。
この研究では、このようなアプローチの有効性が、哺乳類腫瘍細胞の3Dスフェロイド、MDA-MB-231に対するドキソルビシンの効果を劇的に改善することが示されています。多細胞腫瘍スフェロイド(球状に密集した細胞)の形で開発された三次元(3D)細胞培養の使用は、2D細胞培養と比較して多くの利点があります:従来の in vitro 研究と動物試験との間のギャップを埋める可能性に加えて、より予測 的なin vitro を実行する能力を向上させます前臨床医薬品開発のためのアッセイのスクリーニング、または適応外薬や新しいコターゲティング戦略の可能性の評価。
概要
高い抗腫瘍効果を確保し、副作用を低減できる薬物送達ベクターは、主要な目標ですが、依然として深刻な化学医薬品の課題です1,2。今日まで、その進行は、不十分なin situ薬物放出と臨界レベルの非特異的毒性3,4,5のコントラストによって最初は制限されています。近年、抗がん剤の投与を改善するために、リポソーム、高分子ミセル、ポリマーソーム6,7,8,9,10など、いくつかの薬物送達システムが実施されている。これらのシステムは、健康な臓器や組織への分布と蓄積を減少させながら、薬物の循環時間と選択性を高める可能性を示しています。いずれにせよ、アントラサイクリンなどの抗腫瘍性化学療法薬のカプセル化された製剤は、薬物の内在化効率を大幅に低下させました。近年、マイクロバブル11、マイクロ液滴、ハイブリッド金ナノ粒子12、ナノハイドロゲル13、PLGAスキャフォールド、メソポーラスプラットフォーム14などの刺激応答性ミクロンおよびサブミクロンの担体は、ドキソルビシン(Dox)およびドセタキセルを用いた腫瘍抑制効果の標的化および発揮における高い汎用性のために薬理学的関心を集めている。これらのキャリアをマルチモーダルタスク(すなわち、化学療法、光熱、および遺伝子相乗的アプローチ)および分子イメージング15のための効率的な抗がん剤に変える先駆的な実験は、個別化されたセラノスティックナノメディシンへの道を開いた。
このシナリオでは、相変化パーフルオロカーボン微小液滴(MD)は、高薬物貨物負荷を結合する主要な機会、生物学的障壁に対処するMDシェルの化学的多様性、コロイド安定性、および合成効率11,12を結合する主要な機会を通じて評価されています。追加の資産として、パーフルオロカーボン(PFC)コアの音響または光学気化によって促進されるMDのエコー源性により、in situイメージングと有望な治療効果を得ることができます。さらに、電離粒子ビームのエネルギー放出によって得られるMDsコア気化は、ビーム追跡や放射線量測定に利用できます。
本研究は、ジメチルジオクタデシルアンモニウムブロマイド(DDAB)カチオン性界面活性剤の複数の使用可能なシェルによって安定化されたデカフルオロペンタン(DFP)微小液滴の開発を目的としています。DDABシェルMDは、物理化学的および生物学的な期待に応えます。DFPベースの微小液滴は、生体適合性と安定性のあるパーフルオロカーボンMDを達成するための貴重な相変化造影剤であることが実証されています16。DDAB結晶性ゲルは、生理学的温度で長鎖を飽和させ、疎水性コアに深く浸透し、液滴とその中の薬物貨物を安定化させます。ζ DDABシェル表面の生物学的魅力は、哺乳類細胞にほとんど影響を与えない濃度で細菌や真菌を死滅させ、原形質膜、負に帯電した抗原性タンパク質、ヌクレオチド、DNA、またはナノ粒子に結合する能力にあります。上記の特徴は、哺乳動物細胞内で顕著な免疫アジュバント、遺伝子治療および抗腫瘍作用を生じさせるために利用することができる17。
本明細書に記載の晒し剤装填DDAB-MD(Dox@DDAB-MD)は、非常に侵攻性で侵襲性で低分化のトリプルネガティブ乳がん細胞に対する薬物放出を促進する。高出力プローブ共鳴に基づく簡単で迅速なプロトコルを以下に説明し、ワンステップの定式化でDoxの高いローディング効率を持つ狭いサイズ分布の安定した高密度DDAB-MDを取得します。このような特性は、マイクロ流体デバイスや高剪断ホモジナイザー16などの他の調製方法に対しても競争力があります。
効率的な薬物送達ベクターを設計する際の他の主要な制限問題は、薬物の活性が実際の生物学的標的で得られる様々なパラメータ(例えば、吸収、分布、濃度)の関数であり、これは単層細胞モデル18では考慮できないということである。このため、新規抗腫瘍製剤の開発の歴史には、残念ながら動物での前臨床モデルのレベルですでに効果がないという結果となった in vitro 研究がちりばめられています19。
特に、細胞培養からin vivoおよびex vivo研究よりも複雑で信頼性の高いシステムに移行する必要性は、2D培養に関する薬理学的研究に固有の制限に関連しています。これに関連して、スフェロイド、オルガノイド、オルガンオンチップなどのin vitro 3Dシステムが含まれ、これらは2D単分子膜20よりも複雑な構造の形態、活性、および生理学的応答をシミュレートする。前臨床の視点では、細胞微小環境を模倣した3D細胞モデルは、従来の単層培養が効果的でない生理学的により適切な枠組みで複雑な生物学をよりよく理解する可能性を提供する21,22。
DDAB-MDがヒト乳がん細胞の細胞膜と相互作用し、薬物の内在化と非常に低い(ナノモル)Dox濃度での細胞死を促進することを証明した後、哺乳類腫瘍細胞の3DスフェロイドであるMDA-MB-231に対するそのような方法論の有効性がテストされました。
プロトコル
注:すべての試薬と機器は 、材料の表に記載されています。
1. 微小液滴の作製と特性評価
- Dox で読み込まれた DDAB-MD の準備
- DDAB粉末をエタノールに溶解して、最終濃度10 mM、最終容量1 mLを得ます。2 mg の Dox 粉末をエタノールに溶解した 1 mL の Dox ストック溶液を調製します。
注意:Doxは急性経口毒性、カテゴリー4、発がん性、カテゴリー1Bがあることが知られています。.手袋とヘルスマスクを着用したドラフトの下でのみ使用してください。 - 15 mLのプラスチック目盛り付き遠心分離チューブに250 μLのDFPを300 μLのDDAB溶液(油相)に加えます。
注:DFPの純度は60%(GC)、密度は1.6 g / mL(20°C)、沸点は55°Cです。 DOX純度は98、0-102、0%(HPLC)です。DDABの純度は≥98%(TLC)です。エタノールの純度は97%です。 - 油相に2.15 mLの脱イオン水を穏やかに加え、水と油の二相混合物を作ります。10 μLのDox溶液をインソネーションの直前に油相に直接穏やかに注入して、大量のDoxが水相に分配されないようにします。
- 20kHz、100W、10秒間のパルスモード(0.7秒オンおよび0.3秒オフ)で高強度超音波液体処理装置を使用して、プローブ共鳴(1/8インチのチタンテーパーマイクロチップを使用)により二相混合物を乳化します。調製したばかりのMDを限外ろ過した脱イオン水(MilliQなど)で直ちに1.8倍に希釈します。
注:希釈係数は目安であり、経験的に選択されています。MDs溶液は、その後の遠心分離から十分なペレットが得られる限り、さらに希釈することができます。 - 得られた懸濁液1mLを取り、限外ろ過した脱イオン水(MilliQなど)に再懸濁して、過剰なDoxとエタノールを除去し、3回遠心分離します。最初の遠心分離は25°C、360 x g で3分間、2回目と3回目の遠心分離は280 x g で同じ温度と時間で行います。
- 最後の洗浄の後、上清水を取り除き、ペレットの5μLを吸い上げ、細胞処理のために培地の2mLにそれらを分散させ、10nMの同等のDox濃度を得るDox@DDAB-MDs合成のためのプロトコルステップを 図1に示します。
注:等価Dox濃度は、Dox@DDAB-MDの懸濁液の同じ容量に含まれる遊離Doxの量として定義されます。
- DDAB粉末をエタノールに溶解して、最終濃度10 mM、最終容量1 mLを得ます。2 mg の Dox 粉末をエタノールに溶解した 1 mL の Dox ストック溶液を調製します。
- DoxロードDDAB-MDの特性評価
- 動的光散乱(DLS)光度計を使用してサイズ分布を測定し、得られたコレログラムをCONTINアルゴリズムで解析して、関連する減衰時間を推定します。次に、崩壊時間を使用して粒子の拡散係数(D)の分布を決定し、これらをストークス-アインシュタイン関係RH = kBT / 6πηD(kBTはシステムの熱エネルギー、溶媒粘度η)を使用して流体力学的直径(2RH)の分布に変換します。
- 画像解析ソフトウェア(Image Jなど)を使用した明視野顕微鏡を使用して、サイズとサイズ分布を確認し、フレームあたり少なくとも100個の液滴のサイズ(3フレームまたは4フレーム)を測定し、平均値と標準偏差を取得します。
注:DLS測定では、MDs溶液を限外ろ過した脱イオン水(MilliQなど)、PBS、および細胞培養培地で希釈し、後方散乱が1.5 x 108 MDs / mLの固定濃度にならないようにします。細胞培養培地中の限外ろ過水、脱イオン水、およびPBSについて、それぞれ1.1 ± 0.1 μm、1.1 ± 0.25 μm、および1.2 ± 0.2 μmの平均サイズ値が得られました。遠心分離後にペレットから回収されたMDは、エラー内でサイズの変化を示していません。 - 顕微鏡検査用の細胞計数チャンバースライドを使用して、MDの濃度を評価します。チャンバーは、厚さ0.10mmの2つの異なる計数領域で構成されています。10 μLのMD懸濁液をチャンバー上に置きます。40倍の長距離対物レンズを備えた光学顕微鏡を使用して、チャンバーの0.25 x 0.25 nm2 正方形内のMDをカウントし、画像解析フリーウェアで分析します。
- 次の式に従って、MDs濃度をMDs数/mLとして計算します。
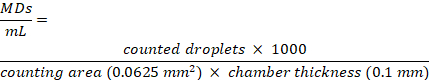
- 590 nm の Dox 自家蛍光を利用した共焦点レーザー走査型顕微鏡 (CLSM) 画像により、内在化された Dox 画像を確認します。蛍光アッセイを使用してDox含有量を測定し、粒子を限外ろ過、脱イオン水またはPBSに分散させ、25°C、360 x g で3分間遠心分離し、590 nmで上清の蛍光を検量線で評価することにより遊離薬物の量を決定します(Dox濃度の直線性範囲:2-20 μmol / mL、 R2 = 0.99)。
注:Doxの総濃度から得られた値を差し引いて、カプセル化されたDoxの量を求めます。実験を3回で行います。Doxカプセル化効率は、MD内のDoxの薬物量を展開されたDoxの総含有量で割ることによって計算される28±2%になります。 - ステップ1.2.3に従って遠心分離し、手順を繰り返すことにより、経時的なDox放出の実験を行い、カプセル化されたものの数に対する上清中に放出されるDoxの割合を取得します。最初の測定後、遠心分離速度を280 x gに下げて手順を繰り返し、MDの破損を防ぎます。時間の経過に伴うリリース曲線をプロットします。上清で24時間以内に放出されるDoxの濃度が最大20%に達することを確認してください。
- 専用の装置(NanoZetaSizerなど)を使用して37°Cでζ電位を測定し、得られた値が約90〜100mVであることを確認します。
2. マイクロモールド非接着性基板へのスフェロイドの作製
- 鋳造マイクロモールド
- 小さな3D型と1gの純粋なアガロース粉末を滅菌に適した容器に入れます。ドライサイクル(121°C)で30分間オートクレーブします。
- バイオセーフティキャビネットで、滅菌したアガロースの入ったガラス瓶に0.9%生理食塩水(NaCl)溶液50mLを加え、電子レンジに入れて粉末を沸騰させて溶解します。溶融したアガロースを60°Cまで冷却し、各マイクロモールドに500μLを添加して、ピペッティング時に気泡が発生しないようにします。
警告:溶融したアガロースは、重度の皮膚火傷を引き起こす可能性があります。適切な個人用保護具が必要です。 - ゲル化したアガロースを、型を慎重に曲げ、新しく形成された基質を取り出して取り出します。基質を12ウェルプレートに入れ、ウェルごとに2 mLの新鮮な培地を加えます。少なくとも15分間インキュベートして、各基質を平衡化します。
注:事前に培地を準備し、0.22μmフィルターに通して、可能性のある粒子や汚染物質を除去します。
- 細胞の播種
- MDA-MB 231細胞を完全培地(DMEMに1% Pen/Strep、10% FBS、および1% L-Gluを添加)で培養し、37°C、5%CO2の細胞培養インキュベーターで培養します。細胞がT75フラスコで約80%のコンフルエントに達したら、培地を廃棄し、4 mLのDPBSですすぎ、3 mLのトリプシン/ EDTAを追加します。フラスコをインキュベーターに入れ、細胞が剥がれるのを待ちます。倒立顕微鏡(20倍)で5分ごとに剥離を検査します。
- 分離した細胞を3 mLのDPBSと10%のFBSを含む15 mLチューブに集め、235 x g で10分間遠心分離します。DPBSとトリプシン/ EDTAの両方を含む上清を廃棄し、細胞ペレットを3mLの新鮮な培地に再懸濁します。10 μLの細胞懸濁液を10 μLのトリパンブルーでピペットで移し、ノイバウアーチャンバーを使用して細胞をカウントします。
注:細胞を回収するときは、遠心分離ステップ中にトリプシンが細胞を損傷するのを防ぐために、FBSの10%を含むDPBSでトリプシン/ EDTAを中和します。 - 公称スフェロイド径を50 μm(~15細胞/スフェロイド)にするには、細胞懸濁液を最終濃度3,840細胞/190 μLに希釈し、小さな型に256個のスフェロイドを注入します。あるいは、直径200 μmのスフェロイド(~1,000細胞/スフェロイド)の場合、最終濃度81,000細胞/190 μLに希釈すると、製造元の指示に従って、大きな型に81個のスフェロイドが入ります。
- 12ウェルプレートから培地を取り出し、基質を傾けて、培地を細胞播種チャンバーから慎重に取り出します。190 μLの細胞懸濁液を各基質に(滴下して)加え、細胞が組織培養インキュベーターで10分間沈殿するのを待ちます。
- ウェルごとに周囲の培地を2 mL加え、マルチウェルをインキュベーターに戻します。24時間ごとにスフェロイド形成を検査します。必要に応じて、新しいメディアと交換してください。
- スフェロイドの採取と加工
- 2 mLの新鮮な培地が入った35 mmのシャーレをインキュベーターに入れ、10〜15分間平衡化します。
- 基質を囲む細胞培養培地を取り除きます。滅菌ピンセットで、ウェルから基質を取り出し、ペトリ皿で反転させます。基板の底を軽くたたいて、スフェロイドが重力で落下するようにします。
- スフェロイドが入ったシャーレをインキュベーターに戻し、さらに処理します。スフェロイド作製のためのプロトコールステップを 図2に示します。
3. スフェロイド治療
- 上清を金型から取り出し、 ステップ1.1.6で説明したように調製した200 μLのDox@DDAB-MDs分散液と交換します。
- 5分後、周囲の培地を2 mL/ウェル加えて平衡化します。希望の治療時間が経過したら、 ステップ2.1に従って進めます。
4. スフェロイドのサイズと形態の特性評価
- 40倍対物レンズと顕微鏡画像処理ソフトウェアを組み合わせて、目的のインキュベーション時間後にスフェロイドサイズを確認します。
- 少なくとも 10 個のスフェロイドのサイズを測定して、適切な統計に十分なデータを収集し、 ステップ 7 で報告されたようにそれらの量を分析します。
5. 増殖/生存率アッセイ:生細胞染色を伴う蛍光顕微鏡法
注: ステップ2.2.5までは、スフェロイドの作製に関する指示に従ってください。
- 上清を型から取り出し、PBS中の200 μLの4 μM calcein-AMと交換し、暗所で室温で3時間インキュベートします。インキュベーションの最後の20分間に、10 μg/mLのヨウ化プロピジウムを添加して、死細胞を染色します。
- ステップ2.3.2に従って基板をペトリ皿に反転させることにより、スフェロイドを回収します。
- CLSMと40倍/60倍対物レンズ、Ar+レーザーを用いて染色溶液中のスフェロイドをイメージングし、ゲインとピンホールを適切に設定して焦点の合った画像を取得します。
6. 画像解析・取得
- 透過型および共焦点型2D画像
- 共焦点ソフトウェア(補足ファイルA)を開き、対物レンズ(60倍、40倍など)を選択します。右側のパネルで[ Trans ]をクリックして、送信チャネルを選択します。
- 「ライブ」をクリックして画像を視覚化し、最適化されたフォーカスを検索します。[Single] をクリックして、取得を停止します。
- 共焦点画像の場合は、使用する蛍光色素に応じて 、赤 または 緑の レーザーチャンネルをクリックします。ピンホールセクションで、ドロップダウンメニューから S絞り を選択し、ゲインセクションを6.00Bに設定します。
- 「Live」をクリックし、コントラストを最適化するためのピンホールアパーチャとゲインを設定します。[Single]をクリックして取得を停止し、画像を保存します。透過画像と共焦点画像を重ねるには、上部のツールバーで正しいチャンネルを選択します。
- 共焦点3D画像
- 右側のパネル(補足ファイルB)のZをクリックします。赤いボタンをクリックして設定をリセットします。
- 参照セクションを選択し、ライブをクリックして、フォーカスを移動しているオブジェクト内の中央値プランを検索します。[トップ] セクションを選択し、オブジェクトの焦点が合わなくなって消えるまでフォーカスを上に移動します。
- 下部のセクションにフォーカスを下に移動するために 、手順6.2.2 を繰り返します。
- ステップサイズを0.75μmに設定します。 Zスタック をクリックし、 次にシングル をクリックしてスキャンを開始します。画像を.ics形式で保存します。
- 光学画像と分析
- 光学顕微鏡ソフトウェアを開き、上部のツールバーの 再生 を押して、40倍の長焦点または20倍の対物レンズで画像をキャプチャします。 [停止 ]を押して、画像を保存します。
- 上部のツールバーで、 表示、 解析制御、 注釈、測定 の順にクリックし、さまざまなオプション(補足ファイルC)のパネルを開きます。 Annotation and Measurements パネルで Semiaxis を選択し、 Ellipseをクリックします。
- 画像検索で、オブジェクトの形状により適した軸を検索し、キーボードのEnterキーを押して、取得した値を右側のパネルテーブルに転送します。
- 少なくとも 10 個のオブジェクトに対して 手順 6.3.3 を繰り返して、十分なデータを取得します。[ Excel Data Sheet にエクスポート ] をクリックして、データをエクスポートして保存します。
- 3D Z-Stack画像の可視化と体積数値計算
- 共焦点顕微鏡で撮影した3D画像を光学顕微鏡ソフトウェア(補足ファイルD)で開きます。
- 3D再構築を表示するには、画像ツールバーの Show Volume View をクリックします。オブジェクトは、マウスの左ボタンをクリックすることで任意の方向に回転できます。ボリュームの一部を選択するには、 Ctrl + マウスの左 キー (補足ファイル E) を押し続けます。
- キーボードの x ボタンを押して、3D画像のスナップショットを撮り、保存します。
- オブジェクトの体積を計算するには、パネル(補足ファイル、画像F)を開く3Dオブジェクト測定の測定、測定をクリックします。パネルツールバーの[3Dしきい値の定義]をクリックし、スムーズフィルターとクリーンフィルター(補足ファイル、画像G)を使用して最適化されたしきい値を設定します。3Dオブジェクト測定パネルで、ボリュームを含むさまざまなパラメータを取得してOKをクリックします。
- [ Excelにエクスポート ]をクリックして、データをエクスポートして保存します。
7. スフェロイドデータ解析
- 回転楕円体の体積計算では、 図 3 の挿入に示すように、按分楕円体で 3D 構造を近似し、2D 投影を通じて長軸と短軸を推定します。
- 手順 6.4 に示すように数値で計算された体積と、b>a=c で a、b、b、c が楕円体軸である a、b、c の比例楕円体体積式
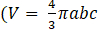 との比較を通じて、比例楕円体の近似を検証します。
との比較を通じて、比例楕円体の近似を検証します。 - 少なくとも 10 個のスフェロイドの平均体積とそれぞれの標準偏差を計算します。スフェロイドの体積分布が正規分布の場合は、ディクソン検定を適用して外れ値を特定し、棄却します。その後、 図6Aで報告されているように、処理されたサンプルとサンプルの間の体積比を、誤差の伝播とともに計算します。
結果
Dox@DDAB-MDは、図1に概略的に記述されているように、プロトコル(セクション1)に従って開発されました。得られたMDは、DFPコアをカプセル化したDDABの単層で構成されています(図1A)。DDABのカチオン電荷および超音波処理手順は、DFPおよび水界面23に積み重ねられたDDABマルチラメラ層の形成を回?...
ディスカッション
抗腫瘍薬としてのアントラサイクリンの有効性を改善するために、この研究では、化学療法薬をカプセル化するDDABシェルPFC液滴の形成を示します ドキソルビシン(Dox)と、そのような製剤が高侵攻トリプルネガティブ乳がん細胞と相互作用する効果 MDA-MB-231。
DOX@DDAB-MDの蓄積
DoxロードされたMDは、非常に高速で再現性が高く、ユーザ...
開示事項
利益相反:著者は利益相反を宣言しません。
人間/動物の権利:この記事には、著者が行った人間または動物を対象とした研究は含まれていません。
謝辞
この研究は、助成金契約AMPHORA(766456)に基づく欧州連合(EU)Horizon 2020研究・イノベーションプログラムから資金提供を受けています。
資料
| Name | Company | Catalog Number | Comments |
| µ-Petri dish | Ibidi | 81156 | 35mm high, IbiTreat |
| 1,1,1,2,3,4,4,5,5,5-Decafluoropentane | Sigma-Aldrich | 138495-42-8 | b.p. 55°C |
| 12-well culture plate | Corning | ||
| 15 ml centrifuge tube | Falcon | 89039-664 | |
| 3D-Petri dishes 12:256 | Microtissues (Sigma-Aldrich) | Z764000-6EA | Small |
| 3D-Petri dishes 12:81 | Microtissues (Sigma-Aldrich) | Z764019-6EA | Large |
| 5%CO2 culture incubator, 37°C | Thermo Scienific | HERAcell 150i | |
| 50 ml centrifuge tube | Falcon | 352070 | |
| Biological safety cabinet, II level | |||
| Calcein | Sigma-Aldrich | ||
| Calcein-AM | Sigma-Aldrich | 148504-34-1 | 4mM stock solution in DMSO |
| cam sCMOS Andor Zyla 4.2 | Andor Instruments | ||
| Centrifuge Hettich Universal 320R | Hettich Lab. Technology | ||
| DAPI | SIgma-Aldrich | ||
| Dimethyldioctadecylammonium bromide powder | Sigma-Aldrich | 3700-67-2 | |
| DMEM (Dulbecco's Modified Eagle Medium) | Corning | 15-013-CV | |
| Doxorubicin hydrochloride | Sigma-Aldrich | 25316-40-9 | |
| DPBS (Dulbecco's Modified PBS) | Corning | 21-030-CV | pH 7,4 |
| Ethanol 70% | Sigma-Aldrich | ||
| EZ-C1 digital ecliplse | Nikon Instruments | Silver version 3.91 | |
| Fetal Bovine Serum (FBS) | Corning | 35-079-CV | |
| Goniometer BI-200SM | Brookhaven Instruments Corporations | ||
| Laser Ar+ | Spectra Physics | ||
| Laser He-Ne | Melles-Griot | ||
| L-Glutammine | Corning | 25-005-CI | |
| Mcroscope Nikon Eclipse Ti | Nikon Instruments | ||
| MDA-MB 231 cell line | ATCC | ||
| Microsoft Excel | Microsoft | ||
| Microplates reader Spark | Tecan group | ||
| NanoZetaSizer ZS | Malvern Instruments LTD | ||
| Neubauer improved chamber | 718605 | ||
| NIS Elements software | Nikon Instruments | AR 4.30 | |
| Pen/Strepto | Corning | 30-002-CI | |
| Photocorrelator BI-9000 AT | Brookhaven Instruments Corporations | 62927-1 | |
| Photometer HC120 | Brookhaven Instruments Corporations | N° 1275 | |
| Pipettors and tips, various size | Gilson | ||
| Propidium Iodide | SIgma-Aldrich | ||
| Serological pipets, various size | Corning | ||
| Solid-state laser | Suwtech Laser | N° 22368 | |
| T25 Flasks | Sarstedt | 83.3910.002 | |
| T75 Flasks | Sarstedt | 83.3911.002 | |
| Trypsin/EDTA 0.05% | EuroClone | ECB3052D | |
| Vibra-Cell VCX-400 | Sonics & Materials, inc | ||
| Water bath | 37°C |
参考文献
- Aryal, S., Park, H., Leary, J. F., Key, J. Top-down fabrication-based nano/microparticles for molecular imaging and drug delivery. International Journal of Nanomedicine. 14, 6631-6644 (2019).
- Peng, Y., et al. Research and development of drug delivery systems based on drug transporter and nano-formulation. Asian Journal of Pharmaceutical Sciences. 15, 220-236 (2020).
- Chan, K. S., Koh, C. G., Li, H. Y. Mitosis-targeted anti-cancer therapies: Where they stand. Cell Death and Disease. 3, 411 (2012).
- Raj, S., Franco, V. I., Lipshultz, S. E. Anthracycline-induced cardiotoxicity: A review of pathophysiology, diagnosis, and treatment. Current Treatment Options in Cardiovascular Medicine. 16, 315 (2014).
- Iyer, A. K., Singh, A., Ganta, S., Amiji, M. M. Role of integrated cancer nanomedicine in overcoming drug resistance. Advanced Drug Delivery Reviews. 65, 1784-1802 (2013).
- Blanco, E., Shen, H., Ferrari, M. Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nature Biotechnology. 33, 941-951 (2015).
- Davis, M. E., Chen, Z., Shin, D. M. Nanoparticle therapeutics: An emerging treatment modality for cancer. Nature Reviews Drug Discovery. 7, 771-782 (2008).
- Lammers, T., Hennink, W. E., Storm, G. Tumour-targeted nanomedicines: Principles and practice. British Journal of Cancer. 99, 392-397 (2008).
- Couvreur, P., et al. Polycyanoacrylate nanocapsules as potential lysosomotropic carriers: preparation, morphological and sorptive properties. Journal of Pharmacy and Pharmacology. 31, 331-332 (1979).
- Yordanov, G. G., Dushkin, C. D. Preparation of poly(butylcyanoacrylate) drug carriers by nanoprecipitation using a pre-synthesized polymer and different colloidal stabilizers. Colloid and Polymer Science. 288, 1019-1026 (2010).
- Kooiman, K., Vos, H. J., Versluis, M., De Jong, N. Acoustic behavior of microbubbles and implications for drug delivery. Advanced Drug Delivery Reviews. 72, 28-48 (2014).
- Fasolato, C., et al. Antifolate SERS-active nanovectors: Quantitative drug nanostructuring and selective cell targeting for effective theranostics. Nanoscale. 11, 15224-15233 (2019).
- Cerroni, B., et al. Temperature-tunable nanoparticles for selective biointerface. Biomacromolecules. 16, 1753-1760 (2015).
- Chronopoulou, L., et al. PLGA based particles as "drug reservoir" for antitumor drug delivery: characterization and cytotoxicity studies. Colloids Surfaces B: Biointerfaces. 180, 495-502 (2019).
- Calderó, G., Paradossi, G. Ultrasound/radiation-responsive emulsions. Current Opinion in Colloid and Interface Science. 49, 118-132 (2020).
- Capece, S., et al. Complex interfaces in 'phase-change' contrast agents. Physical Chemistry Chemical Physics. 18, 8378-8388 (2016).
- Mielczarek, L., et al. In the triple-negative breast cancer MDA-MB-231 cell line, sulforaphane enhances the intracellular accumulation and anticancer action of doxorubicin encapsulated in liposomes. International Journal of Pharmaceutics. 558, 311-318 (2019).
- Ravi, M., Paramesh, V., Kaviya, S. R., Anuradha, E., Paul Solomon, F. D. 3D cell culture systems: Advantages and applications. Journal of Cellular Physiology. 230, 16-26 (2015).
- Heinonen, T. Better science with human cell-based organ and tissue models. Alternatives to Laboratory Animals. 43, 29-38 (2015).
- Thoma, C. R., Zimmermann, M., Agarkova, I., Kelm, J. M., Krek, W. 3D cell culture systems modeling tumor growth determinants in cancer target discovery. Advanced Drug Delivery Reviews. 69-70, 29-41 (2014).
- Astashkina, A., Grainger, D. W. Critical analysis of 3-D organoid in vitro cell culture models for high-throughput drug candidate toxicity assessments. Advanced Drug Delivery Reviews. 69-70, 1-18 (2014).
- Weigelt, B., Ghajar, C. M., Bissell, M. J. The need for complex 3D culture models to unravel novel pathways and identify accurate biomarkers in breast cancer. Advanced Drug Delivery Reviews. 69-70, 42-51 (2014).
- Feitosa, E., Karlsson, G., Edwards, K. Unilamellar vesicles obtained by simply mixing dioctadecyldimethylammonium chloride and bromide with water. Chemistry and Physics of Lipids. 140, 66-74 (2006).
- Cancerrxgene. Doxorubicin IC50. Genomics of drug sensitivity in cancer Available from: https://www.cancerrxgene.org/compound/Doxorubicin/133/overview/ic50 (2020)
- Boo, L., et al. Phenotypic and microRNA transcriptomic profiling of the MDA-MB-231 spheroid-enriched CSCs with comparison of MCF- 7 microRNA profiling dataset. PeerJ. 2017, 1-27 (2017).
- Domenici, F., Castellano, C., Dell'unto, F., Congiu, A. Temperature-dependent structural changes on DDAB surfactant assemblies evidenced by energy dispersive X-ray diffraction and dynamic light scattering. Colloids and Surfaces B: Biointerfaces. 95, 170-177 (2012).
- Choosakoonkriang, S., et al. Infrared spectroscopic characterization of the interaction of cationic lipids with plasmid DNA. Journal of Biological Chemistry. 276, 8037-8043 (2001).
- Yin, H., et al. Non-viral vectors for gene-based therapy. Nature Reviews Genetics. 15 (8), 541-555 (2014).
- Lentacker, I., Geers, B., Demeester, J., De Smedt, S. C., Sanders, N. N. Design and evaluation of doxorubicin-containing microbubbles for ultrasound-triggered doxorubicin delivery: Cytotoxicity and mechanisms involved. Molecular Therapy. 18, 101-108 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved