Method Article
הפעלה והטיאה של פוליסכרידים מסיסים באמצעות 1-Cyano-4-דימתילאמינופירידין טטרפלואורובוראט (CDAP)
In This Article
Erratum Notice
Summary
חלבונים וליגנדים המכילים אמין יכולים להיות מקושרים באופן קוולנטי לפוליסכרידים המופעלים על ידי ריאגנט ציאנילציה, 1-ציאנו-4-דימתילאמינופירידין טטרפלואורובוראט (CDAP), ליצירת הצמדת חלבון קוולנטי (ליגנד)-פוליסכריד. מאמר זה מתאר פרוטוקול משופר לביצוע הפעלת CDAP מבוקרת ב- 0 °C ו- pH משתנה וביצוע ההטיות הבאות של הפוליסכרידים הפעילים.
Abstract
חיסונים מצומדים הם התקדמות יוצאת דופן בחיסון. להכנת חיסונים מצומדים פוליסכריד, ניתן לתפקד בנוחות את הפוליסכרידים ולקשר אותם לחלבונים נושאי חיסונים באמצעות 1-ציאנו-4-דימתילאמינופירידאין טטרפלואורובוראט (CDAP), ריאגנט ציאנילציה קל לטיפול. CDAP מפעיל פוליסכרידים על ידי תגובה עם קבוצות הידרוקסיל פחמימות ב pH 7-9. היציבות והתגובה של CDAP תלויות מאוד ב- pH. ה- pH של התגובה גם פוחת במהלך ההפעלה עקב הידרוליזה של CDAP, מה שהופך את השליטה הטובה ב- pH למפתח להפעלה ניתנת לשחזור. פרוטוקול ההפעלה המקורי של CDAP בוצע בטמפרטורת החדר בפתרונות pH 9 לא מכוסים.
בשל התגובה המהירה במצב זה (<3 דקות) וצניחת ה- pH המהירה הנלווית מההידרוליזה המהירה של CDAP, היה מאתגר להתאים במהירות ולשמור על ה- pH של תגובת היעד במסגרת הזמן הקצרה. הפרוטוקול המשופר המתואר כאן מבוצע ב 0 °C (50 °F), אשר מאט הידרוליזה CDAP ומאריך את זמן ההפעלה מ 3 דקות כדי ~ 15 דקות. Dimethylaminopyridine (DMAP) שימש גם כחוצץ להתאמה מראש של פתרון הפוליסכריד ל- pH של הפעלת היעד לפני הוספת ריאגנט CDAP. זמן התגובה הארוך יותר, יחד עם הידרוליזה CDAP איטית יותר ושימוש במאגר DMAP, מקל על שמירה על pH ההפעלה במשך כל תהליך ההפעלה. הפרוטוקול המשופר הופך את תהליך ההפעלה לפחות תזזיתי, לניתן לשחזור יותר וניתן יותר לשינוי קנה מידה.
Introduction
חיסונים מצומדים, כגון אלה המורכבים מפוליסכרידים הקשורים באופן קוולנטי לחלבון נשא, הם בין ההתקדמות המדהימה בחיסון1,2. פוליסכרידים, כמו אנטיגנים עצמאיים לתאי T, הם אימונוגניים בצורה גרועה בתינוקות ואינם מעוררים זיכרון, החלפת מעמדות או התבגרות זיקה של נוגדנים3. חסרונות אלה מתגברים בחיסונים מצומדיםפוליסכריד 4. כמו רוב polysaccharides אין ידית כימית נוחה עבור הטיות, הם חייבים להיות תחילה תגובתי או "מופעל". לאחר מכן, הפוליסכריד הפעיל מקושר ישירות לחלבון (או לחלבון שעבר שינוי) או שהוא פונקציונלי לגזרות נוספות לפני ההטיה4. רוב החיסונים המצוידים בפוליסכריד משתמשים במינוי רדוקטיבי או ציאנילציה כדי להפעיל הידרוקסילים פוליסכרידים. ציאנוגן ברומיד (CNBr), ריאגנט ששימש בעבר להפעלת שרפים כרומטוגרפיים, שימש בתחילה לגזרת פוליסכריד. עם זאת, CNBr דורש pH גבוה, בדרך כלל ~ pH 10.5 או יותר, באופן חלקי deprotonate hydroxyls פוליסכריד, כך שהם נוקלאופיליים מספיק לתקוף את קבוצת cyano. ה-pH הגבוה יכול להזיק לפוליסכרידים בסיסיים, ולא CNBr ולא הציאנו-אסתר הפעיל שנוצר בתחילה יציבים מספיק ברמת חומציות גבוהה כל כך.
CDAP (1-ציאנו-4-דימתילאמינופירידין טטרפלואורובורט; איור 1) הוצג על ידי ליס ואח 'לשימוש כסוכן ציאנילטינג להפעלת פוליסכרידים5,6. CDAP, שהוא גבישי וקל לטיפול, נמצא להפעיל פוליסכרידים ברמת חומציות נמוכה יותר מאשר CNBr ועם פחות תגובות צד. שלא כמו CNBr, ניתן להטות ישירות פוליסכרידים המופעלים על ידי CDAP לחלבונים, ובכך לפשט את תהליך הסינתזה. ניתן לתפקד פוליסכרידים המופעלים על ידי CDAP עם דיאמין (למשל, דיאמין הקסאן) או דיהידרזיד (למשל, דיהידרזיד אדיפיק, ADH) כדי ליצור פוליסכרידים שמקורם באמינויות או הידרזידים. ריכוז גבוה של ריאגנט הומוביפונקציוני משמש לדיכוי הצלבה של פוליסכרידים. לאחר מכן ניתן להטות פוליסכרידים אמינו באמצעות כל אחת מהטכניקות הרבות המשמשות להטיית חלבונים. פוליסכרידים שמקורם בהידראזיד מצמידים לעתים קרובות לחלבונים המשתמשים בריאגנט קרבודימיד (למשל, 1-אתיל-3-(3-דימתילאמיל)קרבודימיד (EDAC))7. אופטימיזציה נוספת של הפעלת CDAP פוליסכריד תוארה על ידי Lees et al.8 והוא משולב בפרוטוקול המתואר כאן.
מבט כולל על הטיות CDAP
ניתן להמשיג את פרוטוקול CDAP כשני שלבים: (1) הפעלת הפוליסכריד ו-(2) ההטיה של הפוליסכריד הפעיל עם חלבון או ליגנד(איור 2). מטרת הצעד הראשון היא להפעיל ביעילות את הפוליסכריד, בעוד שהמטרה של השני היא להצדווג ביעילות לפוליסכריד המופעל. הפוליסכריד הפעיל קובר את שני השלבים יחד. תפיסה זו מסייעת להתמקד באלמנטים הקריטיים של כל שלב. איור 2 מרחיב את התפיסה הזו, ומראה את תגובות ההפעלה והצימוד הרצויות, יחד עם תגובות ההידרוליזה ותגובות הצד.
במהלך שלב ההפעלה, שלושת החששות העיקריים הם יציבות CDAP, תגובת CDAP עם הידרוקסילים פוליסכריד, ואת היציבות של פוליסכריד מופעל (איור 3). הידרוליזה CDAP עולה עם pH, כמו גם הידרוליזה של פוליסכריד מופעל ואת תגובות הצד. עם זאת, תגובת CDAP עם פוליסכריד מקלה על ידי הגדלת ה- pH. הפעלה יעילה של פוליסכרידים עם CDAP דורשת איזון בין 1) התגובה של הפוליסכריד וה- CDAP ו- 2) ההידרוליזה ותגובות הצד של ריאגנט והפוליסכריד המופעל.
בפרוטוקול ההפעלה המקורי של CDAP שתואר על ידי Lees et al.5, הפעלת CDAP של פוליסכרידים בוצעה בטמפרטורת החדר בתמיסת pH 9 לא מכווצת. קצב ההפעלה נמצא מהיר במצב זה, וההפעלה תושלם תוך 3 דקות. התגובה לוותה גם בהידרוליזה מהירה של CDAP, מה שגרם לירידה מהירה ב- pH של פתרון התגובה הבלתי מנוטרל. היה מאתגר להעלות במהירות ולשמור על רמת ה-pH של התגובה בערך היעד במסגרת זמן כה קצרה. בפרוטוקול המתואר, ההפעלה בוצעה על-ידי הוספת CDAP מפתרון מלאי של 100 מ"ג/מ"ל לפתרון הפוליסכריד הלא מנוצל. ה- pH הועלה 30 שניות מאוחר יותר עם "נפח שווה של 0.2 M טריאתילאמין". חלבון שיש להצית נוספה לאחר 2.5 דקות לתגובת ההפעלה. ראוי לציין, ה- pH של שלב ההפעלה לא היה מבוקר היטב וסביר להניח בתחילה חרג pH היעד. התגובה המהירה הדורשת התאמת pH מהירה הקשתה על תהליך ההפעלה ומאתגרת את ההרחבה.
בניגוד לפרוטוקול המקורי, לפרוטוקול שהשתנה המתואר כאן יש שני שיפורים משמעותיים. ראשית, ה- pH של פתרון הפוליסכריד מותאם מראש ל- pH של הפעלת היעד, תוך שימוש ב- DMAP כחוצץ, לפני הוספת CDAP. DMAP יש pKa של 9.5 ולכן יש כוח אגירה טוב סביב pH 9, ובניגוד למאגרים רבים אחרים, DMAP לא נמצא כדי לקדם הידרוליזה CDAP8. יתר על כן, DMAP הוא כבר תהליך ביניים ולכן אינו מוסיף רכיב חדש לתערובת התגובה. כוונון מראש של ה- pH לפני הוספת CDAP מבטל את תנופת ה- pH הגדולה בתחילת התגובה ומאפשר תחזוקה יעילה יותר של pH היעד במהלך התגובה. השיפור השני הוא לבצע את תגובת ההפעלה ב 0 °C (50 °F), שבו קצב הידרוליזה CDAP הוא איטי משמעותית מזה בטמפרטורת החדר. עם מחצית החיים של ריאגנט ארוך יותר ב 0 °C (50 °F), זמן ההפעלה גדל מ 3 דקות ל 15 דקות כדי לפצות על קצב ההפעלה האיטי בטמפרטורה הנמוכה יותר. זמן התגובה הארוך יותר, בתורו, מקל על שמירה על pH התגובה. השימוש ב 0 °C (50 °F) גם מאט את השפלה של פוליסכרידים רגישים ל- pH, מה שמאפשר להכין מצומדים מסוג זה של פוליסכריד. השיפורים בפרוטוקול הופכים את תהליך ההפעלה לפחות תזזיתי, קל יותר לשליטה, לניתן לשחזור יותר וניתן יותר לשנות את קנה המידה שלו.
מאמר זה מתאר את הפרוטוקול המשופר לביצוע הפעלת CDAP מבוקרת של פוליסכריד ב 0 °C (70 °F) וב- pH היעד שצוין וביצוע נגזרת לאחר מכן של פוליסכרידים מופעלים עם ADH. מתואר גם הוא טרינדרובנזן חומצה גופרתית (TNBS) אסאי, המבוסס על השיטה של Qi ואח'9, לקביעת רמת הידראזיד על פוליסכריד שונה. בדיקת שונה עבור hexoses המבוסס על resorcinol וחומצה גופרתית10 מתואר גם, אשר ניתן להשתמש בו לקביעת מגוון רחב יותר של פוליסכרידים. לקבלת מידע נוסף אודות הפעלת CDAP והטיה, הקורא מופנה לפרסומים קודמים5,6,8 על ידי Lees et al.
Protocol
הערה: הכן מראש את פתרון הפוליסכריד, פתרון ADH, פתרון DMAP ופתרון מלאי CDAP לפני ביצוע הליכי ההפעלה והפונקציונליזציה של הפוליסכריד. מקם את הפתרונות והציוד במיקום מאורגן, נוח והגיוני. התגובה המתוארת היא עבור 10 מ"ג של פוליסכריד וניתן לשנות את קנה המידה למעלה או למטה. מומלץ להעריך את הפרוטוקול בקנה מידה קטן לפני שינוי קנה המידה.
1. הכן פתרון פוליסכריד 5 מ"ג/מ"ל, 2 מ"ל.
- עבור פוליסכריד ליופילי
- אפשר למיכל הפוליסכריד להגיע לטמפרטורת החדר לפני הפתיחה. לשקול 10 מ"ג של פוליסכריד בתוך צינור בורג-cap באמצעות איזון אנליטי. השתמש מבטל סטטי לדגימה קלה יותר ושקילה מדויקת יותר של האבקה.
- הוסף 2 מ"ל של 0.15 M נתרן כלורי (NaCl) לצינור כדי להמיס את הפוליסכריד. כובע ומערבולת הצינור.
הערה: נתרן כלורי אינו משפיע על תגובת CDAP, אך הוא עשוי להשפיע על המבנה המשני של הפוליסכריד. כמה פוליסכרידים מסיסים יותר בריכוזים שונים של מלח. - מערבבים את הצינור על ידי סיבוב סוף סוף במשך 12-24 שעות, בהתאם למשקל המולקולרי של הפוליסכריד, כדי לאפשר לפוליסכריד לחות מלאה. במידת הצורך, לחמם בעדינות את הצינור כדי לקדם solubilization.
- עבור פוליסכריד solubilized בפתרון חוצץ
הערה: להפעלת CDAP יעילה, פתרון הפוליסכריד לא אמור להכיל כל מאגר, במיוחד יון פוספט. בצע את ההליך שלהלן כדי להחליף את המאגר עם מים או תמיסת מלח ולהתאים את ריכוז פוליסכריד ל 5 מ"ג / מ"ל.- השג מכשיר מסנן צנטריפוגלי 4 מ"ל או 15 מ"ל של ניתוק המשקל המולקולרי המתאים (MWCO).
הערה: MWCO הוא אידיאלי 5-10 פעמים קטן יותר מאשר המשקל המולקולרי של פוליסכריד. - הוסף אמצעי אחסון של פתרון פוליסכריד במאגר המכיל ~ 20 מ"ג של פוליסכריד להוספת המסנן. ממלאים לסימן המלא במים או בתמיסת מלח. מכסים את המסנן בחוזקה. מערבבים עד סוף-סוף כמה פעמים.
- צנטריפוגות התקן המסנן בכוח הצנטריפוגלי המוצע על ידי היצרן. ודא שזמן הצנטריפוגה ארוך מספיק כדי להשיג לפחות פי 5 הפחתת נפח לאחר כל סיבוב. זרוק את הזרימה דרך. הרכב מחדש את התקן המסנן.
- מלאו מחדש את המסנן לסימן המלא במים מתוקים או בתמיסת מלח. מכסים את המסנן בחוזקה. ערבבו את התוכן במסנן לפי סיבוב מקצה לקצה ~10 פעמים או על ידי מערבולת עדינה; חזור על הספין.
הערה: פוליסכריד יכול להצטבר בתחתית הכנס המסנן של המכשיר הצנטריפוגלי, ויוצר ג'ל. מומלץ לערבב מחדש את retentant בתוך המסנן להוסיף עם מילוי טרי לפני הסיבוב הבא. - חזור על מילוי וסיבוב מחזור מינימום של 3 פעמים.
- בצע את התרגיל שלהלן כדי לשחזר את retentant פוליסכריד מהוספת המסנן.
- הוסף מים מתוקים או מלוחים להוספת המסנן כך שהנפח הוא ~ 1 מ"ל. מערבבים על ידי צנרת למעלה ולמטה או על ידי מערבולת עדינה.
- מעבירים את כל המתרס המעורב לצינור 5 מ"ל. יש להוסיף 1 מ"ל של מים מתוקים או תמיסת מלח. יש לשטוף את המסנן על ידי צנרת מעלה ומטה או על ידי מערבולת עדינה. מעבירים ומשלבים את כל השטיפות עם הפוליסכריד שנמצא.
- קבע את ריכוז הפוליסכריד (ראה בדיקת פוליסכריד בסעיף 7.3). לדלל את הפוליסכריד עם מים נוספים או מלוחים ל 5 מ"ג / מ"ל.
- השג מכשיר מסנן צנטריפוגלי 4 מ"ל או 15 מ"ל של ניתוק המשקל המולקולרי המתאים (MWCO).
- כאשר פתרון פוליסכריד מוכן, לצנן את הצינור המכיל את פתרון פוליסכריד בדלי קרח.
2. הכן 0.5 M חומצה אדיפית דיהידרזיד (ADH) פתרון, 10 מ"ל.
- שקול 0.87 גרם ADH באיזון אנליטי, ו solubilize ב 8 מ"ל של 0.1 M HEPES (4-(2-הידרוקסיאתיל)-1-piperazineethanesulfonic חומצה), pH 8.
- התאימו ל-pH היעד עם 1 M נתרן הידרוקסיד (NaOH), המנוטר על ידי מד pH. הביאו ל-10 מ"ל עם חוצץ נוסף ואשרו מחדש את ה-pH.
3. הכן פתרון DMAP 2.5 M, 10 מ"ל.
הערה: DMAP רעיל ויחדר לעור. ללבוש כפפות ניטריל בעת ביצוע ההליך.
- בזהירות לשקול 3 גרם של DMAP לתוך צינור חרוט 50 מ"ל. מוסיפים 5 מ"ל מים ל- DMAP ומערבבים על ידי מערבולת במשך 5 דקות כדי להשיג פתרון מעונן (~ 7 מ"ל).
- תוך כדי ערבוב, להוסיף 50 תוספת של 50 μL של 10 N חומצה הידרוכלורית (HCl) לפתרון DMAP. מערבבים בין כל תוספת. הפסק להוסיף כאשר הפתרון מתבהר.
- הוסף 10 N NaOH במרווחים של 25 μL כדי להביא את פתרון DMAP ל- ~ pH 8.
- הביאו את פתרון DMAP ל-10 מ"ל עם מים כדי לתת פתרון של 2.5 M.
- כוונן את רמת ה-pH של פתרון DMAP של 2.5 M.
הערה: פתרון DMAP pH משתנה עם ריכוז וכוח יוני. תרגיל זה הוא לכוונן את מלאי 2.5 M DMAP ל- pH מסוים, כך שכאשר הוא מעורבב עם 10 כרכים של פוליסכריד, הפתרון המתקבל קרוב ל- pH היעד להפעלה.- הכן סדרה של צינורות 1.5 מ"ל המכילים 1 מ"ל של מים או פתרון NaCl, המוקדם מכונן להכנת פתרון פוליסכריד. תרגיע את הצינורות על קרח.
- הוסף 100 μL של DMAP לצינור צונן. מערבולת ולמדוד את ה- pH עם מד pH. לאחר מכן, להשליך את הצינור הנמדד.
- אם ה- pH הנמדד אינו קרוב לערך היעד, התאם את ה- pH של מניית DMAP עם 1 M NaOH או HCl בהתאם לצורך. חזור על שלבים 3.5.2 ו- 3.5.3 עד שה- pH הנמדד קרוב ל- pH היעד.
4. הכן 100 מ"ג / מ"ל פתרון מלאי CDAP
הערה: אבקת CDAP צריך להישמר סגור היטב ומאוחסן ב -20 °C (70 °F) מותר להגיע לטמפרטורת החדר לפני הפתיחה. ללבוש כפפות ניטריל בעת ביצוע ההליך.
- Tare a 1.5 מ"ל צינור microcentrifuge snap-cap על איזון אנליטי. באמצעות מרית קטנה, לשקול 10-140 מ"ג של CDAP לתוך הצינור. שים לב למשקל בפועל של CDAP.
- לקבוע את עוצמת הקול של acetonitrile הדרוש כדי להכין 100 CDAP mg/mL. פתח את האצטוניטריליה במכסה המנוע של האדים.
- באמצעות צינור נפח מתאים, לצייר ולשחרר את acetonitrile כדי שיווי משקל האדים שלה בקצה הצינור. המתן עד שהממס יטפטף מהקצה לאחר מספר שניות, והינו מוכנים להעביר אותו ישירות לצינור ה- CDAP. צייר את אמצעי האחסון המחושב של acetonitrile והעבר אותו ישירות לצינור CDAP. תסגור את המכסה.
הערה: Acetonitrile ניתן גם להעביר לצינור CDAP באמצעות מזרק המילטון או שווה ערך לגודל מתאים. - מערבולת כדי להפוך את CDAP באופן מלא. הנח את צינור ה- CDAP בדלי קרח.
הערה: CDAP יציב באצטוניטריל בקור. מניות מסיסות עשויות להישמר ב -20 °C (50 °F) למשך שבוע > אחד. עם זאת, עדיף להכין פתרונות CDAP טריים.
5. הפעלת פוליסכריד ופונקציונליזציה של הידראזיד
- ודא שכל הפריטים הבאים מוכנים ופתרונות מצוננים על קרח לפני תחילת ההפעלה: 2 מ"ל של פתרון פוליסכריד 5 מ"ג / מ"ל במיכל שטוח תחתון, רחב פה המכיל מוט ערבוב, מונח על גבי stirrer מגנטי; 100 מ"ג / mL פתרון מלאי CDAP; 2.5 M פתרון מניות DMAP; מד pH עם בדיקה pH חצי מיקרו, כגון בדיקה בקוטר 6 מ"מ, מכויל עבור 0 °C על פי הוראות היצרן; צינור 100 μL מוכן לשימוש; שעון שעון הים מנוקה ומוכן לשימוש; ראש מתקן אוטומטי ממוקם או 10 μL pipet מוכן לשימוש; פתרון 0.5 M ADH.
- כוונן מראש את רמת ה-pH של הפוליסכריד ל-pH היעד באמצעות DMAP.
- מניחים את בדיקת ה- pH לתוך פתרון הפוליסכריד ומשאירים אותו בפתרון במהלך כל הליך ההפעלה.
- העבר 200 μL של פתרון מלאי DMAP לפתרון פוליסכריד על ידי תוספת dropwise תחת ערבוב. התאם את ה- pH של הפתרון ל- pH של הפעלת היעד. הוסף 0.1 M HCl כדי להוריד את ה- pH ו- 0.1 M NaOH כדי להגדיל את ה- pH. הימנעו מחריגה מה-pH של היעד ביותר מיחידת pH של 0.1, ושמרתם על התגובה מקוררת באמבט מי קרח למשך ההפעלה.
- הפעלת CDAP
- Pipet 100 μL CDAP למעלה ולמטה כדי לשוות את האדים בקצה הצינור. העבר 100 μL של CDAP לפתרון פוליסכריד עם ערבוב.
הערה: הפעלה זו משתמשת 1 מ"ג של CDAP עבור 1 מ"ג של פוליסכריד כיחס התחלה. ניתן להגדיל או להקטין את היחס בעת מיטוב ההפעלה. - הפעל את שעון השעון והצג את שינוי ה- pH במהלך ההפעלה כולה. שמור על התגובה ב- pH היעד על ידי הוספת מיידית 10 רווחי μL של 0.1 M NaOH לתגובה, בעזרת מתקן autotitrator (או pipet).
הערה: זה עשוי לעזור להפחית את זמן התגובה pH לערבב עם בדיקת pH בעדינות. ה- pH יורד מהר יותר בהתחלה, וייתכן שיהיה צורך להוסיף את 0.1 M NaOH בתדירות גבוהה יותר. ככל שהתגובה מתקדמת, הירידה ב- pH הופכת איטית יותר, והתוספת הופכת פחות תכופה. ה- pH צריך להישאר כמעט ללא שינוי כאשר מתקרבים לזמן ההפעלה האופטימלי, שהוא 10-15 דקות להפעלת pH 9.
- Pipet 100 μL CDAP למעלה ולמטה כדי לשוות את האדים בקצה הצינור. העבר 100 μL של CDAP לפתרון פוליסכריד עם ערבוב.
- פונקציונליזציה של ADH
- כאשר זמן ההפעלה האופטימלי מגיע, להוסיף 2 מ"ל של 0.5 M ADH בבת אחת לפוליסכריד מופעל תחת ערבוב. בדוק כי ה- pH נמצא בטווח היעד (pH 8-9 עבור ADH).
הערה: תוספת אחת עם ערבוב מהיר ממזערת את ההסתברות ששני קצות הדיהידרזיד יגיבו עם הפוליסכריד הפעיל, ומונעת קישור פוליסכריד. - ממשיכים לערבב את תערובת התגובה לפחות 1 שעה. מעבירים את תערובת התגובה ל 4 °C (75 °F), אבל 0-20 °C מקובל.
הערה: תגובת הפונקציונליזציה של ADH אינה תלויה מאוד בטמפרטורה. כמו עודף גדול של דיהידרזיד פועל כמו ריאגנט מרווה, אין צורך להרוות עוד יותר את פוליסכריד מופעל. עם זאת, כאשר ישירות הצמדת חלבונים, התגובה צריכה להיות מרווה, בדרך כלל עם 1 M גליצין, pH 8-9.
- כאשר זמן ההפעלה האופטימלי מגיע, להוסיף 2 מ"ל של 0.5 M ADH בבת אחת לפוליסכריד מופעל תחת ערבוב. בדוק כי ה- pH נמצא בטווח היעד (pH 8-9 עבור ADH).
6. טיהור פוליסכריד בפונקציונליות ADH על ידי דיאליזה
הערה: המוצר הגולמי מתגובת הפונקציונליזציה של ADH מכיל ריכוז גבוה של ADH (0.5 M), אשר ניתן להסיר ביעילות רבה ביותר על ידי דיאליזה נרחבת. סינון ג'ל, עם עמודה או התקן התפלת ספין, אינו יעיל באותה מידה, במיוחד כאשר הוא נדרש להסיר את שאריות מזהם ADH.
- לקבוע את MWCO של קרום הדיאליזה. השתמש בחיתוך של 3 kDa עבור פוליסכרידים קטנים יותר.
הערה: MWCO של קרום הדיאליזה הוא אידיאלי 5-10 פעמים קטן יותר מאשר MW של פוליסכריד. - בחר את תבנית הדיאליזה הרצויה (קלטות או צינורות) ואת קיבולת ההתקן הנכונה. ודא שקיבולת ההתקן גדולה פי 2 מאמצעי האחסון לדוגמה. עיין בהוראות היצרנים לשימוש במכשיר.
- יש להרטיב את קרום הדיאליזה במים לפני השימוש. העבר את פתרון הפוליסכריד הגולמי שמקורו בהתקן הדיאליזה בהתאם להוראות היצרנים.
הערה: ללבוש כפפות ניטריל כדי למנוע מגע עם DMAP. - דיאליזה במיכל מלא 2-4 L של 1 M NaCl ובר ערבוב. מניחים את המיכל על צלחת ערבוב בחדר קר או בתוך מקרר. מערבבים את הדיאליזה בעדינות ובהתמדה במהלך הדיאליזה.
- לאחר חיוג למשך 4 שעות לפחות, החלף ל- 1 M NaCl טרי וחיוג למשך 12 שעות לפחות. דיאליזה נגד 2 שינויים של תמיסת מלח 0.15 M, כל אחד לפחות 12 שעות. אם תרצה, חייגו נגד 2 שינויים במים.
- ודא אם כל ה- ADH מוסר על-ידי בדיקת הדיאליזה הלילית באמצעות בדיקת TNBS מהירה.
- להשיג 3 צינורות borosilicate, לתייג אותם כמו שליטה שלילית (ctrl), ctrl חיובי, ודוגמה, בהתאמה.
- לצינור ctrl השלילי, להוסיף 975 μL של 0.1 M borate, pH 9.
- לצינור ctrl החיובי, להוסיף 100 μL של 0.05 mM ADH (0.1 mM הידרזיד) ו 875 μL של 0.1 M borate, pH 9.
- לצינור לדוגמה, להוסיף 500 μL של דיאליזה לילה ו 475 μL של 0.1 M borate, pH 9.
- הוסף 25 μL של 1% TNBS לכל שלושת הצינורות. מערבבים היטב. מניחים בחושך במשך שעה.
- השווה את עוצמת הצבע של 3 הצינורות בשעה אחת. ודא שעוצמת צבע צינור המדגם היא בין זו של ctrl החיובי לבין ctrl השלילי, המציין כי מזהם ADH הוא למטה ל 0.01 mM ומטה. חייג עוד פעם אחת.
הערה: זה נבון כדי להפחית את רמת מזהם ADH ככל האפשר, כך הידרזיד ADH מהווה פחות מ 1% של הידראזיד הכולל הידרזיד הידרזיד מטוהר הידרזיד-פוליסכריד. - לשחזר את הפוליסכריד נגזר דיאליזה. לקבוע את הריכוז של פוליסכרידים הידרזיד. חשב את יחס הידרזיד/פוליסכריד (ראה סעיף 7). אם יש לרכז את הפוליסכריד המחויג ל-5-10 מ"ג/מ"ל, יש להתייעץ עם סעיף 1.2.
7. ניתוח של פוליסכרידים שמקורם בהידראזיד
הערה: מטרת הניתוח המתואר כאן היא לקבוע את ריכוז הפוליסכריד, ריכוז ההידרזיד, ואת רמת נגזרת הידראזיד במונחים של יחס הידרזיד / פוליסכריד.
- הכנת דוגמה
הערה: פוליסכרידים שיש להיבחן צריכים להיות נקיים מפחמימות במשקל מולקולרי נמוך, אמין או זיהומים בהידראזיד. דגימות ליופיליות צריכות להיות יבשות וללא מלח כדי להבטיח מדידת משקל מדויקת. בדרך כלל, ~ 1 מ"ל של פתרון 1-2 מ"ג / מ"ל מתאים לבדיקות.- שקול לפחות 10 מ"ג של מדגם פוליסכריד ליופילי על איזון אנליטי, באמצעות מרית לא סטטית או מחסל סטטי. ממיסים את הפוליסכריד במים או מלוחים לריכוז (למשל, 2 מ"ג/מ"ל) כך שאותות ה-assay נופלים בטווח הליניארי של העקומה הסטנדרטית.
- מערבבים מקצה לקצה ומאפשרים מספיק זמן כדי שהדגימה תתמוסס לחלוטין. בצע הידרציה לילה בהתאם למשקל המולקולרי של פוליסכריד.
- בדיקת פוליסכריד: שיטת רסורצינול/חומצה גופרתית
הערה: בדיקת ה- assay המתאימה לפוליסכרידים תהיה תלויה בהרכב הפחמימות של הפולימרים. בדיקת resorcinol/חומצה גופרתית המקורית נועדה לסוכרים משוקסים10. ההסתה שונתה כאן על ידי העלאת הטמפרטורה של שלב החימום מ 90 °C (50 °F) ל 140 °C (50 °F). בטמפרטורה גבוהה יותר זו, ההסתה מאבדת קצת ספציפיות אבל יכול לשמש כדי assay סוכרים רבים. עם זאת, עדיין יש צורך לקבוע את ההתאמה של בדיקת פוליסכריד מסוים. טריפליקאטים מומלצים לכל נקודה, אך ייתכן שיהיה צורך באירוח מסוים בשל הקיבולת של בלוק החימום.- הכן 75% חומצה גופרתית
הערה: חומצה גופרתית מרוכזת היא מאכלת מאוד ויכולה לגרום לכוויות קשות. בצע הליך זה במכסה אדים כימי. תמיד לשפוך חומצה מרוכזת לתוך מים, לא להיפך!- הוסף 50 מ"ל של מים לבקבוק זכוכית 200 מ"ל. מניחים את הבקבוק באמבט מים קרים. לאט לאט להוסיף 150 מ"ל של חומצה גופרתית. מכסים את הבקבוק כך שהוא מאוורר.
- אפשר לפתרון להתכווות לטמפרטורת החדר. השתמש בפתרון תוך 3 חודשים.
- הכנת תקני פחמימות
- הכן את פתרון פוליסכריד שלא שנופץ ב 1 מ"ג / מ"ל כדי לשמש כסטנדרט. לחלופין, השתמש בתערובת של סוכרים בודדים ביחס שנמצא ביחידה החוזרת של הפוליסכריד, ב 1 מ"ג / מ"ל של ריכוז הסוכר הכולל, כסטנדרט.
הערה: למרות תערובת הסוכר בדרך כלל ייתן את אותה תוצאה כמו פולימר פחמימות של הרכב סוכר זהה, זה צריך להיות מאושר באופן ניסיוני.
- הכן את פתרון פוליסכריד שלא שנופץ ב 1 מ"ג / מ"ל כדי לשמש כסטנדרט. לחלופין, השתמש בתערובת של סוכרים בודדים ביחס שנמצא ביחידה החוזרת של הפוליסכריד, ב 1 מ"ג / מ"ל של ריכוז הסוכר הכולל, כסטנדרט.
- ודא כי בלוק החימום עם מחזיקי צינור עבור 13 x 100 מביצות בורוסיליקט מתפקד. השתמש כרית מגן מתחת וסביב בלוק החימום במקרה של שפיכות חומצה. מחממים מראש את בלוק החימום ל 140 °C (70 °F) למשך שעה לפחות כדי להשיג טמפרטורה יציבה ואחידה דרך כל הבלוקים מנוצלים.
- תווית 13 x 100 מביצות בורוסיליקט, משולש עבור כל תקן וכל מדגם. הוסף 0, 2.5, 5, 7.5, 10 מיקרוגרם (או μL) של תקן פחמימות 1 mg / mL לצינורות הסטנדרטיים המסומנים בהתאמה. הוסף מים לכל צינור כדי להביא את הנפח ל 100 μL.
הערה: הצבע שנוצר תלוי בסוכרים ספציפיים. כמו סוכרים מסוימים דורשים מסה רבה יותר כדי ליצור את טווח הספיגה המלא, הכמויות בפועל המשמשות עבור העקומה הסטנדרטית עשויות להשתנות. - הגדר בדיקות מדגם על ידי הוספת נפח המכיל ~ 5 מיקרוגרם של פוליסכריד נגזר לשלושה צינורות מדגם ולהביא את הנפח הכולל ל 100 μL עם מים. לחלופין, אם ריכוז הפוליסכריד במדגם אינו ידוע, בצע סדרה של דילול פי 4. מבחן 100 μL של כל דילול משולש.
- הכן resorcinol טרי ב 6 מ"ג / מ"ל במים deionized (dI) מיד לפני השימוש. מערבולת עד ביטול העורקים הוא בפתרון. הוסף 100 μL של 6 מ"ג / מ"ל resorcinol לכל צינור.
- יוצקים בזהירות את הכמות המשוערת של 75% חומצה גופרתית לתוך קטנה.
הערה: לבש חלוק מעבדה, כפפות ניטריל ומשקפי בטיחות. היזהר מטפטפות, שפיכות והתזות. שמור מגבות נייר רטובות בהישג יד כדי לנגב את כל טפטופים. כאשר הפעילות של החומצה הגופרתית משתנה על חשיפה ממושכת לאוויר, השתמש בתערובת אחידה של חומצה גופרתית לכל ההסתה. - באמצעות pipettor חוזר, באופן אחיד להוסיף 300 μL של 75% חומצה גופרתית לכל צינור. מערבולת הצינורות במרץ לערבב היטב, מכוון את הצינור משם תוך מערבולת. מניחים את הצינורות בבלוק תנור בקצב קבוע בסדר רציף. ברגע שכל הצינורות נמצאים, להגדיר את טיימר במשך 3 דקות מיד.
- בשעה 3 דקות, להסיר את הצינורות בקצב קבוע באותו סדר, ולהניח אותם ישירות על מתלה באמבט מי קרח. השאירו את הצינורות עד שהם קרים כקרח. הסר את הצינורות ולאפשר להם שיווי משקל לטמפרטורת החדר במשך ~ 5 דקות כדי למנוע עיבוי על cuvette במהלך הקריאה.
- הגדר ספקטרופוטומטר UV /VIS כדי לקרוא את הספיגה ב 430 ננומטר באמצעות cuvette אורך 10 מ"מ. ריק עם צינור סטנדרטי אפס. קרא את הספיגה של כל הצינורות ב 430 ננומטר.
הערה: cuvettes פלסטיק חד פעמי נוח לשימוש. - לבנות עקומה סטנדרטית על ידי התוויית מיקרוגרם של תקן פחמימות לעומתA 430. ראו איור 4 לעקומה סטנדרטית טיפוסית המשתמשת בגלוקוז כסטנדרט הייחוס.
- השתמש בצינורות בדיקת הדגימה עם ערכי A430 הנופלים בטווח הליניארי של העקומה הסטנדרטית, חשב את כמות ה- μg של הפוליסכריד הלא ידוע בצינורות בדיקת הדגימה משוואת העקומה הסטנדרטית. לקבוע את הריכוז של פוליסכריד לא ידוע מן הנפח של הלא נודע הוסיף, חשבונאות דילול. להמיר את הריכוז mg / mL או יחידות חוזרות μM כנדרש.
- הכן 75% חומצה גופרתית
- הידרזיד אסייד באמצעות חומצה גופרתית טריניטרבנזן (TNBS)
- הכן 0.9% NaCl המכיל 0.02% נתרן אזיד (חוצץ מדגם) על ידי המסת 9 גרם של NaCl ו 200 מ"ג של נתרן אזיד ב dI H2O לנפח סופי של 1 L.
- הכן 0.1 M נתרן בוראט, pH 9 (חוצץ אסאי), על ידי ערבוב 100 מ"ל של 0.5 M נתרן בוראט, pH 9, עם 400 מ"ל של dI H2O. לאשר כי pH הפתרון הוא 9 ± 0.1; להתאים במידת הצורך.
- הכן 1% TNBS על ידי דילול 200 μL של 5% 2,4,6-טריניטרבנזן פתרון חומצה גופרתית ל 1 מ"ל עם dI H2O. לסמן את הצינור כמו 1% TNBS ולאחסן ב 4 °C (5 °F) בחושך במשך שבוע.
- הכן מלאי ADH 50 mM (שווה ערך ל 100 mM הידראזיד).
- שקול 871 מ"ג של אבקת דיהיראזיד אדיפיק (ADH) באמצעות איזון אנליטי. ממיסים את האבקה בבקבוק ריאגנט על ידי הוספת חוצץ מדגם ל-100 מ"ל בעזרת איזון מטעין עליון.
- סמן את הבקבוק כ- 100 mM הידרזיד / 50 mM ADH. מכסים את הבקבוק בחוזקה ומאחסנים ב 4 °C (75 °F) במשך שנה אחת.
- הכן תקני הידראזיד (0.1, 0.2, 0.3, 0.4, 0.5 ו-0.6 מ"מ הידראזיד).
- הכן את 6 תקני הידראזיד על ידי דילול מלאי הידרזיד 100 mM עם חוצץ מדגם בעזרת איזון מטעין העליון. הכן 100 מ"ל מכל תקן כדי למזער את שגיאת הריכוז. סגור בחוזקה את הבקבוקים ולאחסן ב 4 °C (5 °F) במשך שנה אחת.
- הגדרת תגובות ת'א-סאז
הערה: TNBS assay מופעל בנפח תגובה של 1 מ"ל. כל צינור בדיקת מורכב 100 μL של מדגם (או סטנדרטי), 875 μL של חוצץ Assay, ו 25 μL של פתרון 1% TNBS. כל תגובות ההסתה (הן עבור דגימות והן עבור סטנדרטים) מוגדרות משולשות.- תווית 3 צינורות זכוכית בורוסיליקט (12 x 75 מ"מ) עבור כל תקן, כולל תקן אפס. מיין וסדר את הצינורות הסטנדרטיים בארון צינור על מנת להגדיל את הריכוז. השתמש במיקרופיט 100 μL או 200 μL מכויל כדי להוסיף במדויק 100 μL של התקנים לכל צינור מתאים. עבור תקן האפס, השתמש ב- 100 μL של מאגר לדוגמה.
- תווית 3 צינורות זכוכית בורוסיליקט (12 x 75 מ"מ) עבור כל מדגם מדולל להיבחנות. מיין וסדר את צינורות הדגימה בארון הצינורות בהתאם. השתמש 100 μL מכויל או 200 מיקרופיט μL כדי להוסיף במדויק 100 μL של המדגם לכל צינור מדגם מתאים.
- השתמש במיקרופיט 1000 μL מכויל כדי להוסיף במדויק 875 μL של חוצץ Assay לכל צינורות ה- assay: הסטנדרטים והדגימות.
- כדי להתחיל את תגובת ה- assay, השתמש במיקרופיט 100 μL מכויל כדי להוסיף במדויק 25 μL של 1% TNBS לכל צינור בדיקות. התחל מאפס צינורות סטנדרטיים, לעבור צינורות סטנדרטיים על מנת להגדיל את הריכוז, ולאחר מכן צינורות מדגם על פי הסדר שנקבע מראש. שנה טיפים בעת הפעלת תקן חדש או מדגם חדש ולשמור את הזמן בילה בהוספת TNBS לכל הצינורות בתוך 5 דקות.
- מערבולת כל צינורות assay עבור 2 s במהירות גבוהה או בהגדרת מהירות המאפשרת לנוזל בתוך צינור assay להסתובב כלפי מעלה כדי להגיע לגובה של 1/2 אינץ 'מפתיחת הצינור.
- הקלט את שעת ההתחלה של ההסרה והגדר את הטיימר ל- 2 שעות. מניחים את מתלה צינור ה- assay בחושך בטמפרטורת החדר למשך 2 שעות. בסיום הזמן, מערבולת כל הצינורות עוד פעם אחת ולהמשיך לאיסוף נתונים.
- איסוף נתונים
- תן לספקטרופוטומטר UV/VIS להתחמם וקו הבסיס יתייצב. הגדר את אורך הגל גילוי ב 500 ננומטר לבדיקת הידראזיד. השתמש בקובט קוורץ 1 מ"ל של אורך אורך פתיל של 1 ס"מ לכל מדידות הספיגה לכל ההגשה.
- התחל את איסוף הנתונים על ידי העברת מבחן סטנדרטי אפס לקובט; ריק את המכשיר (הגדר ספיגה לאפס).
- בצע קריאה בודדת בכל שפופרת ורשום את ערכי הספיגה בטבלת נתונים. הסר כל נוזל שיורית מן cuvette לפני קריאת מדגם חדש. התחל מסטנדרטים אפס, לעבור לסטנדרטים של הגדלת הריכוז, ולאחר מכן אל הדגימות. לאחר תחילת, לבצע את כל השלבים ביעילות מבלי לעצור ולקרוא את כל הצינורות בתוך 10 דקות.
- ניתוח נתונים לדוגמה
- צור עקומה סטנדרטית על ידי התוויית תקן הידראזיד mM לעומתA 500. מצא את משוואת העקומה הסטנדרטית בצורה של y =x + b, כאשר y מייצג את הידרזיד mM ו- x מייצג A500. ראו איור 4 לעקומה סטנדרטית טיפוסית.
- חשב הידרזיד mM בדגימות באמצעות משוואת העקומה הסטנדרטית, התאמה לגורמי הדילול. בחר רק את צינורות ה- assay לדוגמה עם ערכי A500 הנופלים בטווח הליניארי של העקומה הסטנדרטית לחישוב.
- חשב את יחס הטוחנת של הידרזיד/פוליסכריד באמצעות משוואה (1).
הידרזיד/פוליסכריד = h / c × MW (1)
כאשר h הוא הידרזיד mM, c הוא ריכוז mg / mL של פוליסכריד, ו MW הוא המשקל המולקולרי פוליסכריד ב kDa. - חשב את צפיפות תיוג הידראזיד לכל 100 kDa של פוליסכריד באמצעות משוואה (2).
צפיפות תיוג לכל 100 kDa פוליסכריד = h / c × 100 (2)
איפה h הוא הידראזיד mM, ו c הוא ריכוז mg / mL של פוליסכריד.
הערה: לנוחות, הפוליסכרידים יכולים להיחשב כמשקל מולקולרי של 100,000 דלטון. זה מאפשר לשקול "צפיפות תיוג" בהשוואת רמת ההפקה של פוליסכרידים שונים. - חשב את צפיפות תיוג הידראזיד כאחוז משקל ADH.
- לקבוע את הריכוז mg/mL יעיל של ADH באמצעות משוואה (3).
מ"ג/מ"ל ADH = (הידרזיד mM / 1000) × 174 (3)
איפה 174 הוא MW של ADH. - חשב את המשקל % ADH באמצעות משוואה (4).
משקל % ADH = (מ"ג / מ"ל ADH) / (מ"ג / מ"ל פוליסכריד) × 100 (4)
- לקבוע את הריכוז mg/mL יעיל של ADH באמצעות משוואה (3).
תוצאות
כדי להמחיש את ההפעלה והנגזרת של פוליסכריד באמצעות הכימיה של CDAP, דקסטרן הופעל ב 0.25 ו 0.5 מ"ג CDAP / מ"ג דקסטרן. עבור כל תגובה, תמיסה דקסטרן 10 מ"ג / מ"ל במים היה צונן על קרח, ו 1/10נפח של 2.5 M M DMAP מלאי (מוכן כמתואר בסעיף 3) נוספה. הפתרון הסופי הובא pH 9 על ידי תוספת של 0.1 M NaOH ב 10 aliquots μL. הפתרון היה צונן ומעורב, הוסיף CDAP, ואת ה- pH נשמר ב- pH 9 על ידי הוספת 10 עליקוטים μL של 0.1 M NaOH במשך 15 דקות. רק 0.25 מ"ל של 0.5 M ADH ב pH 9 נוספה (פחות מהכמות הרגילה) והתגובה מותרת להמשיך לילה ב 4 °C (5 °F).
דקסטרן שכותרתו אז היה חיוג ברצף נגד 1 M NaCl, 0.15 M NaCl, ומים כמתואר בסעיף 6. ה- ADH-dextran נטען לאחר מכן לדקסטרן באמצעות בדיקת הסרסורצינול/חומצה גופרתית (סעיף 7.2). עקומה סטנדרטית טיפוסית המשתמשת בגלוקוז כפי שמוצג בתקן הסוכר באיור 4A. תכולת ההידרזיד נקבעה באמצעות TNBS assay המתואר בסעיף 7.3. עקומת הידראזיד סטנדרטית טיפוסית המשתמשת ב-ADH, שכן התקן ניתן באיור 4B.
חישובים מייצגים מהפעלת דקסטרן בשתי רמות ההפעלה מוצגים באיור 4A, B. הנתונים מוצגים הן כהידראזידים לכל 100 kDa של פולימר דקסטרן וכאחוז משקל של ADH כדי dextran, כמתואר בסעיפים 7.9.3.4 ו 7.9.3.5, בהתאמה, באיור 4C. מידת ההפקה הוכפלה בערך עם הוכפל יחס ה- CDAP.
איור 1: מבנה כימי של CDAP. CDAP = 1-cyano-4-dimethylaminopyridine tetrafluoroborate. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
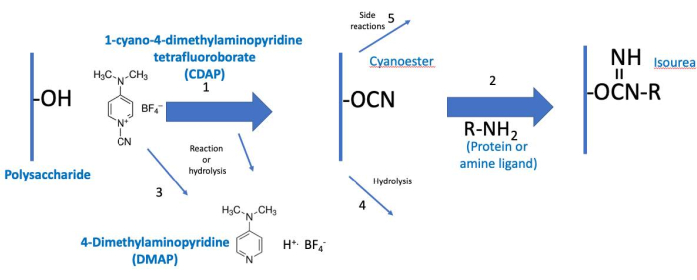
איור 2: תהליך הפעלת CDAP והטיות. התהליך מחולק מושגית לשני שלבים, כאשר הפוליסכריד הפעיל משותף לשניהם. בתנאים בסיסיים, CDAP מפעיל הידרוקסילים פוליסכריד, משחרר DMAP (תגובה 1). הידרוליזה CDAP גם משחרר DMAP (תגובה 3). למרות cyano-אסתר מוצג, זה לא יכול להיות ביניים בפועל. לפיכך, אמצעי הביניים נקרא (CDAP) "מופעל" פוליסכריד. במהלך שלב ההפעלה הראשון, הפוליסכריד הפעיל יכול הידרוליזה (תגובה 4) או לעבור תגובות צד (תגובה 5). בשלב ההטיות השני (תגובה 2), הפוליסכריד הפעיל מגיב עם אמין כדי ליצור קשר איזוריאה יציב בנוסף לתגובות 4 ו -5. קיצורים: CDAP = 1-cyano-4-דימתילאמינופירידין טטרפלואורובוראט; DMAP = 4-דימתילמינופירידין; R-NH2 = אמין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
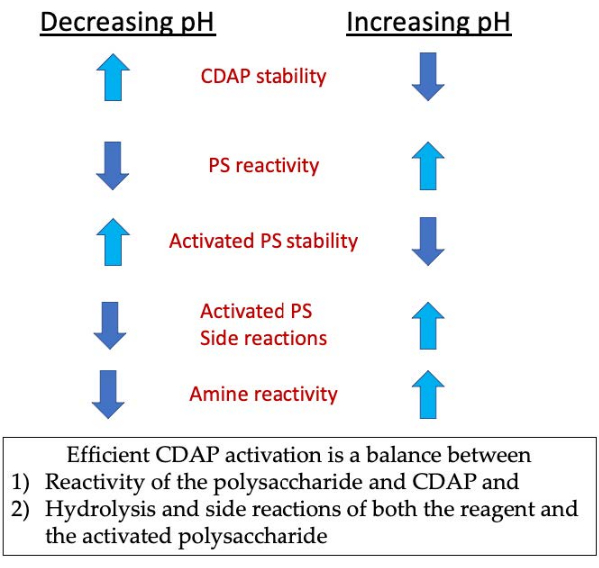
איור 3: הפעלת CDAP והטיות. התהליך דורש איזון תגובתיות CDAP עם פוליסכריד, היציבות של CDAP ופוליסכריד מופעל, כמו גם את התגובה של פוליסכריד מופעל עם זה של האמין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
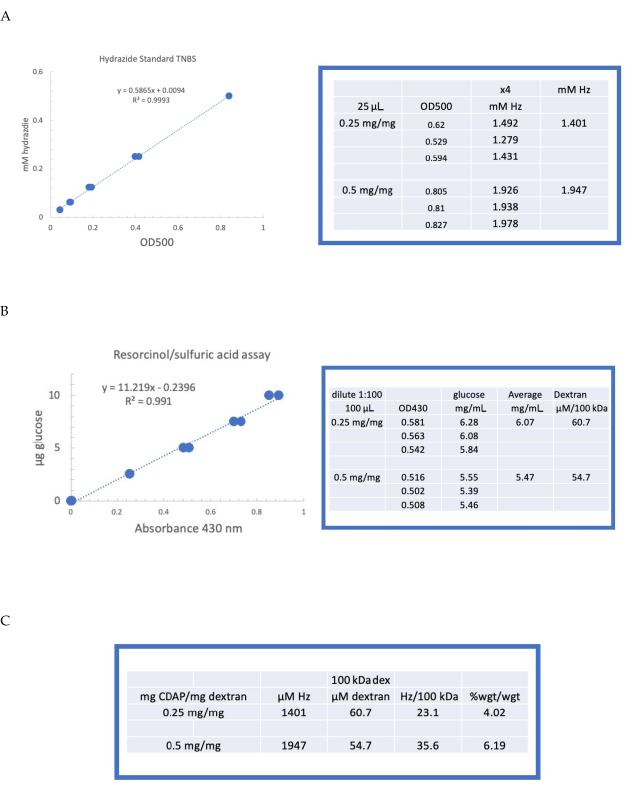
איור 4: תוצאות מייצגות להפעלת CDAP של dextran. עקומות סטנדרטיות אופייניות עבור (A)resorcinol / חומצה גופרתית ו (B) TNBS אסיונים. תוצאות הבחינה עבור דקסטרן מופעל עם 0.25 ו 0.5 מ"ג CDAP / מ"ג דקסטרן מוצגים. גלוקוז שימש כסטנדרט לבדיקת ביטול. Dextran, mg /mL, מחולק על ידי 100 kDa לתת ריכוז טוחנת. ריכוז הידראזיד נקבע באמצעות ADH כסטנדרט ואת התוצאות לידי ביטוי כמו μM הרץ. (C)חישוב של הידראזיד: יחסי dextran. רמת ההגזמה חושבה כהידרזידים לכל 100 kDa של דקסטרן כדי להקל על ההשוואה בין פולימרים במשקלים מולקולריים ממוצעים שונים. יחס המשקל % של g ADH/ g dextran חושב באמצעות MW של 174 גרם / שומה עבור ADH. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
CDAP הוא ריאגנט נוח לגזור ולצדות פוליסכרידים. מאמר זה מתאר את השיטה הכללית לשימוש ב- CDAP כדי להפיק פוליסכרידים עם הידרזידים (PS-ADH) ומשלב שיפורים שפורסמו לאחרונה8. ראשית, הטכניקה מדגישה את החשיבות של שמירה על pH היעד כדי לשלוט בתהליך ההפעלה. מצאנו כי בעוד מאגרים נפוצים רבים להפריע תגובת הפעלת CDAP, DMAP יכול לשמש בהצלחה כחוצץ לניהול pH8. יתר על כן, DMAP הוא כבר תוצר לוואי של תגובה של הפעלת CDAP. לבסוף, אגירת פתרון הפוליסכריד עם DMAP לפני הוספת ה- CDAP מקלה על פילוח ותחזוקה מדויקים של pH התגובה. כפי שאנו מתארים, כדאי להתאים את ה- pH של פתרון מלאי DMAP מרוכז כך שכאשר מדולל, הוא מגיע ל- pH היעד. שנית, ביצוע התהליך בקור האט את זמן התגובה, מה שהופך את תהליך ההפעלה לפחות תזזיתי ויותר סלחני. טמפרטורה נמוכה יותר הפחיתה את קצב ההידרוליזה של CDAP, וזמן ההפעלה האופטימלי ב- pH 9 עולה מ ~ 3 דקות לכ - 15 דקות. בנוסף, פחות CDAP נדרש כדי להשיג את אותה רמת הפעלה מאשר כאשר מבוצע בטמפרטורת החדר.
ניתן להטות פוליסכרידים שמקורם ב-ADH לחלבונים באמצעות קרבודימידים (למשל, EDAC)7. לדוגמה, מספר חיסונים מורשים של המופילוס שפעת b (Hib) משתמשים בפולירבוסילרביטבולפוספט (PRP) שמקורם ב- ADH כדי להצית לטוקסואיד טטנוס באמצעות EDAC. CNBr הועסק בתחילה, אך CDAP הוא ריאגנט הרבה יותר קל לשימוש למטרה זו. מניסיוננו, טווח יעד טוב עבור derivatization ADH הוא 10-30 הידראזידים לכל 100 kDa פוליסכריד או ~ 1-3% ADH לפי משקל.
אותו תהליך יכול לשמש כדי לגזור פוליסכרידים עם אמינים ראשוניים על ידי החלפת ADH עבור דיאמין. מומלץ להשתמש הקסאן דיאמין כדי להפיק פוליסכרידים עם אמינים8. ניתן להטות את הפוליסכריד המנוכה (PS-NH2)באמצעות ריאגנטים שפותחו להטיית חלבונים11. בדרך כלל, PS-NH2 נגזר עם maleimide (למשל, succinimidyl 4-[N-maleimidomethyl]cyclohexane-1-קרבוקסילאט (SMCC) או N-γ-maleimidobutyryl-oxysuccinimide אסתר (GMBS)), ואת החלבון הוא thiolated (למשל, עם תמציתימידיל 3-(2-pyridyldithio)propionate (SPDP)). הכימיה של תיול-מאלימייד יעילה מאוד.
חלבונים יכולים גם להיות מצמידים ישירות לפוליסכרידים המופעלים על ידי CDAP באמצעות ɛ-amine על ליזינים. בעוד פרוטוקול ההפעלה בשימוש דומה בדרך כלל לזה המתואר כאן, יש צורך לייעל את רמת ההפעלה, פוליסכריד וריכוז החלבון, כמו גם את יחס החלבון:יחס פוליסכריד5,6,8.
Dextran הוא אחד הפוליסכרידים הקלים ביותר להפעלה עם CDAP בשל הצפיפות הגבוהה יחסית של קבוצות הידרוקסיל, אבל כמה פוליסכרידים, כגון Vi אנטיגן, יכול להיות מאתגר. כתוצאה מכך, אין פרוטוקול "הטוב ביותר" יחיד עבור הטיות CDAP ישירות חלבונים. אנו מציעים תחילה לפתח פרוטוקול כדי להשיג רמות מתאימות של הפעלה, כפי שנקבע על ידי היקף נגזרת הידראזיד, ולאחר מכן להמשיך לכוון הטיות חלבון לפוליסכריד המופעל על ידי CDAP.
Disclosures
אנדרו ליס הוא המייסד והבעלים של פינה ביוסולוטיונים. הוא מחזיק במספר פטנטים הנוגעים לכימיה של CDAP ויתרונות ברישוי של ידע הכימיה וההטיה של CDAP.
Acknowledgements
העבודה המתוארת כאן מומנה על ידי Fina Biosolutions LLC.
Materials
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Sigma | 34851 | |
| Adipic acid dihydrazide | Sigma | A0638 | MW 174 |
| Amicon Ultra 15 10 kDa | Millipore | UFC901008 | MW cutoff can be 30 kDa for 200 kDa PS |
| Analytical balance | |||
| Autotitrator or electronic pipet | |||
| Beaker 2-4 L | |||
| CDAP | SAFC | RES1458C | Sigma |
| DMAP | Sigma | 107700 | MW 122.2 |
| Flake ice | |||
| HCl 1 M | VWR | BDH7202-1 | |
| Micro stir bar | VWR | 76001-878 | |
| Microfuge tube (for CDAP) | VWR | 87003-294 | |
| NaCl | VWR | BDH9286 | |
| NaOH 1 M | Sigma | 1099130001 | |
| NaOH 10 M | Sigma | SX0607N-6 | |
| pH meter | |||
| pH probe | Cole Parmer | 55510-22 | 6 mm x 110 mm Epoxy single junction |
| pH temperature probe | |||
| Pipets & tips | |||
| Saline or PBS | |||
| Small beaker 5-20 mL | VWR | 10754-696 | A 10 mL beaker allows room for pH probe & pipet |
| Small ice bucket | |||
| Small spatula | |||
| Stir plate | |||
| Resorcinol assay | |||
| Combitip | Eppendorf | 10 ml | |
| DI water | |||
| Dialysis tubing | Repligen | 132650T | Spectra/Por 6-8kDa |
| Dialysis tubing clips | Repligen | 142150 | |
| Heating block | |||
| Nitrile gloves | VWR | ||
| Repeat pipettor | Eppendorf | M4 | |
| Resorcinol | Sigma | 398047 | |
| Sugar standard | As appropriate | ||
| Sulfuric acid 75% | VWR | BT126355-1L | |
| Timer | |||
| TNBS assay | |||
| Adipic dihydrazide | Sigma | A0638 | MW 174 |
| Borosilcate test tubes 12 x 75 | VWR | 47729-570 | |
| Sodium borate, 0.5 M pH 9 | Boston Biologicals | BB-160 | |
| TNBS 5% w/v | Sigma | P2297 | MW 293.17 |
References
- Ellis, R. W., Granoff, D. M. . Development and clinical uses of Haemophilus B conjugate vaccines. , (1994).
- Goebel, W. F., Avery, O. T. Chemo-immunological studies on conjugated carbohydrate-proteins. Journal of Experimental Medicine. 50 (4), 533-550 (1929).
- Mond, J. J., Vos, Q., Lees, A., Snapper, C. M. T cell independent antigens. Current Opinion in Immunology. 7 (3), 349-354 (1995).
- Cruse, J. M., Lewis, R. E. . Conjugate Vaccines. 10, (1989).
- Lees, A., Nelson, B. L., Mond, J. J. Activation of soluble polysaccharides with 1-cyano-4-dimethylaminopyridinium tetrafluoroborate for use in protein-polysaccharide conjugate vaccines and immunological reagents. Vaccine. 14 (3), 190-198 (1996).
- Shafer, D. E., et al. Activation of soluble polysaccharides with 1-cyano-4-dimethylaminopyridinium tetrafluoroborate (CDAP) for use in protein-polysaccharide conjugate vaccines and immunological reagents. II. Selective crosslinking of proteins to CDAP-activated polysaccharides. Vaccine. 18 (13), 1273-1281 (2000).
- Schneerson, R., Barrera, O., Sutton, A., Robbins, J. B. Preparation, characterization, and immunogenicity of Haemophilus influenzae type b polysaccharide-protein conjugates. Journal of Experimental Medicine. 152 (2), 361-376 (1980).
- Lees, A., Barr, J. F., Gebretnsae, S. Activation of soluble polysaccharides with 1-cyano- 4-dimethylaminopyridine tetrafluoroborate (CDAP) for use in protein-polysaccharide conjugate vaccines and immunological reagents. III Optimization of CDAP activation. Vaccines. 8 (4), 777 (2020).
- Qi, X. -. Y., Keyhani, N. O., Lee, Y. C. Spectrophotometric determination of hydrazine, hydrazides, and their mixtures with trinitrobenzenesulfonic acid. Analytical biochemistry. 175 (1), 139-144 (1988).
- Monsigny, M., Petit, C., Roche, A. C. Colorimetric determination of neutral sugars by a resorcinol sulfuric acid micromethod. Analytical biochemistry. 175 (2), 525-530 (1988).
- Hermanson, G. . Bioconjugate Techniques. 3rd ed. , (2013).
Erratum
Formal Correction: Erratum: Activation and Conjugation of Soluble Polysaccharides using 1-Cyano-4-Dimethylaminopyridine Tetrafluoroborate (CDAP)
Posted by JoVE Editors on 7/09/2021. Citeable Link.
An erratum was issued for: Activation and Conjugation of Soluble Polysaccharides using 1-Cyano-4-Dimethylaminopyridine Tetrafluoroborate (CDAP). A figure was updated.
Figure 4 was updated from:

Figure 4: Representative results for CDAP activation of dextran. Typical standard curves for the (A) resorcinol/sulfuric acid and (B) TNBS assays. The assay results for dextran activated with 0.25 and 0.5 mg CDAP/mg dextran are shown. Glucose was used as the standard for the resorcinol assay. Dextran, in mg/mL, is divided by 100 kDa to give a molar concentration. The hydrazide concentration is determined using ADH as the standard and the results expressed as µM Hz. (C) Calculation of hydrazide: dextran ratios.The level of derivatization was calculated as hydrazides per 100 kDa of dextran to facilitate the comparison between polymers of different average molecular weights. The % weight ratio of g ADH/g dextran was calculated using a MW of 174 g/mole for ADH. Please click here to view a larger version of this figure.
to:
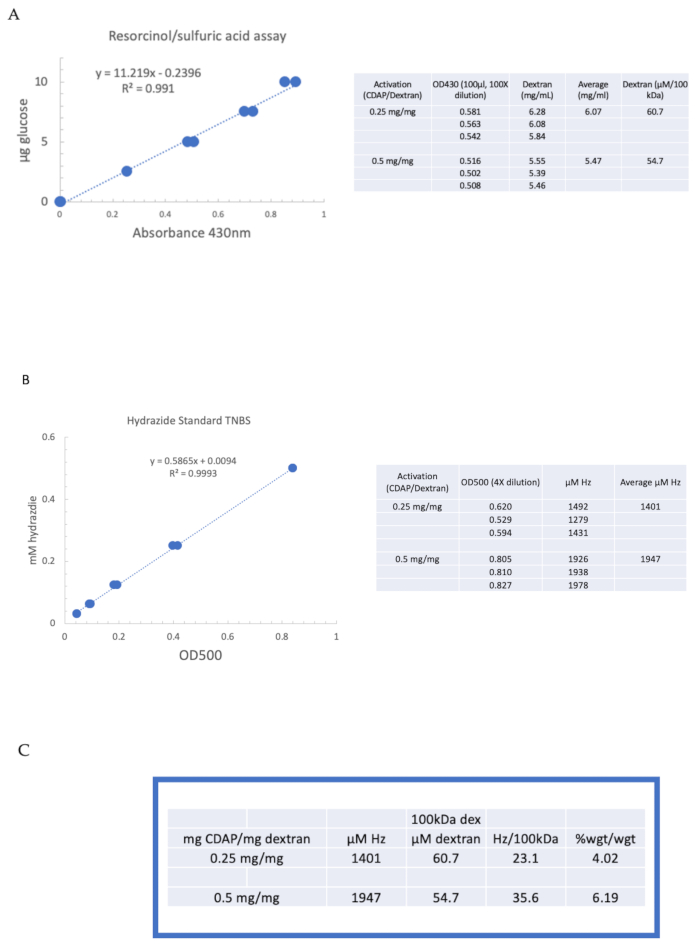
Figure 4: Representative results for CDAP activation of dextran. Typical standard curves for the (A) resorcinol/sulfuric acid and (B) TNBS assays. The assay results for dextran activated with 0.25 and 0.5 mg CDAP/mg dextran are shown. Glucose was used as the standard for the resorcinol assay. Dextran, in mg/mL, is divided by 100 kDa to give a molar concentration. The hydrazide concentration is determined using ADH as the standard and the results expressed as µM Hz. (C) Calculation of hydrazide: dextran ratios.The level of derivatization was calculated as hydrazides per 100 kDa of dextran to facilitate the comparison between polymers of different average molecular weights. The % weight ratio of g ADH/g dextran was calculated using a MW of 174 g/mole for ADH. Please click here to view a larger version of this figure.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved