Method Article
1-시아노-4-디메틸아미노피리딘 테트라플루오로보라산염(CDAP)을 이용한 용용다당류의 활성화 및 융합
Erratum Notice
요약
단백질과 아민 함유 리간드는 시안화 시약, 1-시아노-4-디메틸아미노피리딘 테트라플루오로보레이트(CDAP)에 의해 활성화된 다당류에 공유하여 공유 단백질(ligand)-다당류 컨쥬게이트를 형성할 수 있다. 이 문서에서는 0°C에서 제어된 CDAP 활성화를 수행하고 pH를 다양화하고 활성화된 다당류의 후속 컨쥬게이션을 수행하기 위한 향상된 프로토콜을 설명합니다.
초록
공주 백신은 백신학에서 놀라운 발전입니다. 다당류 컨쥬게이트 백신의 제조를 위해 다당류는 1-시아노-4-디메틸아미노피리딘 테트라플루오로보레이트(CDAP)를 사용하여 백신 담체 단백질과 편리하게 기능화되고 연결될 수 있으며, 취급하기 쉬운 시안광과식 시약제입니다. CDAP는 pH 7-9에서 탄수화물 하이드록실 그룹과 반응하여 다당류를 활성화합니다. CDAP의 안정성과 반응성은 pH에 따라 매우 의존적입니다. 반응의 pH는 또한 CDAP의 가수분해로 인해 활성화 하는 동안 감소, 좋은 pH 제어 재현 가능한 활성화에 키를 만든다. 원래 CDAP 활성화 프로토콜은 버퍼링되지 않은 pH 9 솔루션의 실온에서 수행되었습니다.
이러한 조건하에서의 신속한 반응(<3분)과 빠른 cdAP 가수분해로부터의 빠른 pH 낙하로 인해 짧은 시간 내에 표적 반응 pH를 신속하게 조정하고 유지하는 것이 어려웠다. 여기에 설명된 개선된 프로토콜은 CDAP 가수분해를 늦추고 활성화 시간을 3분에서 ~15분으로 연장하는 0°C에서 수행됩니다. 디메틸아미노피리딘(DMAP)은 CDAP 시약을 첨가하기 전에 표적 활성화 pH에 대한 다당류 용액을 미리 조정하는 버퍼로 도용하였다. 느린 CDAP 가수분해 및 DMAP 버퍼의 사용과 결합된 긴 반응 시간을 통해 활성화 프로세스의 전체 기간 동안 활성화 pH를 보다 쉽게 유지할 수 있습니다. 향상된 프로토콜을 통해 활성화 프로세스는 열광적이고 재현가능하며 확장이 더 가능합니다.
서문
담즙 단백질에 동적으로 연결된 다당류로 구성된 컨쥬게이트 백신은 박시가지1,2의놀라운 발전 중 하나이다. 다당류는 T 세포 독립적 인 항원으로서 유아의 면역 원화가 좋지 않으며 항체3의메모리, 클래스 스위칭 또는 친화성 성숙을 유도하지 않는다. 이러한 단점은 다당류 컨쥬게이트 백신4에서극복된다. 대부분의 다당류는 연상에 편리한 화학 적 손잡이가 없기 때문에 먼저 반응성 또는 "활성화"해야합니다. 활성화된 다당류는 단백질(또는 변형된 단백질)과 직접 연결되거나 컨쥬게이션4전에 추가 적인 파생을 위해 기능화된다. 대부분의 허가 된 다당류 컨쥬게이트 백신은 다당류 하이드록실을 활성화하기 위해 환원 아미네이션 또는 시안화를 사용합니다. 이전에 크로마토그래피 수지 활성화에 사용되었던 시약인 시아노겐 브로마이드(CNBr)는 처음에는 다당류 발출에 사용되었습니다. 그러나, CNBr은 높은 pH를 필요로, 전형적으로 ~ pH 10.5 이상, 부분적으로 탈화 다당류 하이드록실을 필요로하기 때문에 그들은 충분히 뉴클레오필로시아노 그룹을 공격한다. 높은 pH는 기저음 파수성 에타카라이드에 해로울 수 있으며, CNBr이나 활성 시아노 에스테르가 처음에 형성되지 않은 것은 이러한 높은 pH에서 충분히 안정되지 않는다.
CDAP (1-시아노-4-디메틸아미노피리딘 테트라플루오로보산염; 그림 1) 리외에 의해 도입된 것은 다당류의활성화를 위한 원안제제로서 사용하기 위해5,6. 결정적이고 다루기 쉬운 CDAP는 CNBr보다 낮은 pH에서 다당류를 활성화하고 측면 반응이 적다는 것을 발견했습니다. CNBr과 달리, CDAP 활성화 다당류는 단백질에 직접 컨쥬게이트되어 합성 과정을 단순화할 수 있습니다. CDAP 활성화 다당류는 아미노 또는 하이드라지드-파생다당류를 만들기 위해 디아민(예를 들어 헥산 디아민) 또는 디하이드라지드(예: 아디픽 디하이드라지드, ADH)로 기능화될 수 있다. 다당류의 교차 연결을 억제하기 위해 호모기능 시약의 고농도가 사용됩니다. 아미노 다당류는 단백질 융합에 사용되는 무수한 기술을 사용하여 공주 할 수 있습니다. 히드라지드-파생다당류는 종종 카르보디미드 시약을 사용하여 단백질과 결합된다(예를 들어, 1-에틸-3-(3-디메틸아미노프로필))carbodiimide (EDAC))7. CDAP 다당류 활성화의 추가 최적화는 Lees etal.8에 의해 설명되었으며 여기에 기재된 프로토콜에 통합된다.
CDAP 컨쥬게이션 개요
CDAP 프로토콜은 2상으로 개념화될 수 있다: (1) 단백질 또는 리간드(그림2)를가진 활성 폴리자카라이드의 다당류 활성화 및 (2) 컨쥬게이션. 첫 번째 단계의 목표는 다당류를 효율적으로 활성화하는 반면, 두 번째 단계의 목표는 활성 다당류에 효율적으로 컨쥬게이트하는 것입니다. 활성화된 다당류는 두 단계를 함께 연결합니다. 이 개념화는 각 단계의 중요한 요소에 집중하는 데 도움이 됩니다. 도 2는 가수분해 반응 및 측면 반응과 함께 원하는 활성화 및 결합 반응을 나타내며, 이러한 개념화를 확장한다.
활성화 단계에서, 3개의 주요 관심사는 CDAP 안정성, 다당화물 하이드록실을 가진 CDAP 반응, 및 활성화된 다당류의안정성(도3)이다. CDAP 가수분해는 pH로 증가하며, 활성성 다당류 및 측면 반응의 가수분해와 마찬가지로 증가합니다. 그러나, 다당류를 가진 CDAP 반응은 pH를 증가시킴으로써 촉진된다. CDAP를 통해 다당류를 효율적으로 활성화하려면 1) 다당류와 CDAP 및 2) 시약 및 활성화된 다당류의 가수 분해 및 측면 반응 사이의 균형을 필요로 한다.
Lees외. 5에의해 기술된 원래 CDAP 활성화 프로토콜에서, 다당류의 CDAP 활성화는 버퍼링되지 않은 pH 9 용액에서 실온에서 수행되었다. 활성화의 비율은이 조건 하에서 급속한 것으로 나타났습니다, 활성화는 3 분 안에 완료될 것입니다. 반응은 또한 CDAP의 급속한 가수 분해를 동반하여 완충되지 않은 반응 용액의 빠른 pH 낙하를 일으켰습니다. 이러한 짧은 시간 프레임에서 목표 값에서 반응 pH를 신속하게 올리고 유지하는 것은 어려웠습니다. 설명된 프로토콜에서, 100 mg/mL 스톡 솔루션으로부터 버퍼링되지 않은 다당류 용액에 CDAP를 추가하여 활성화를 수행하였다. pH는 "0.2 M 트리에틸라민의 동일한 볼륨"으로 30 초 후에 제기되었습니다. 수렴되는 단백질은 활성화 반응에 2.5 분 후에 첨가되었다. 특히, 활성화 단계의 pH는 잘 제어되지 않았고 대부분 처음에는 대상 pH를 초과했을 가능성이 큽분. 신속한 pH 조정이 필요한 빠른 반응으로 활성화 프로세스를 제어하기가 어렵고 확장하기가 어려웠습니다.
원래 프로토콜과 달리 여기에 설명된 수정된 프로토콜에는 두 가지 주요 개선 사항이 있습니다. 첫째, 다당류 용액의 pH는 CDAP를 첨가하기 전에 DMAP를 버퍼로 사용하여 표적 활성화 pH에 미리 조정된다. DMAP은 9.5의 pKa를 가지고 있으며 따라서 pH 9 주위에 좋은 버퍼링 전력을 가지고 있으며, 다른 많은 버퍼와달리, DMAP은 CDAP 가수 분해8을촉진하는 것으로 발견되지 않았다. 더욱이, DMAP는 이미 공정 중간이며 따라서 반응 혼합물에 새 성분을 추가하지 않습니다. CDAP를 추가하기 전에 pH를 사전 조정하면 반응 의 시작 부분에 큰 pH 스윙을 제거하고 반응 중에 대상 pH의 보다 효율적인 유지 보수를 가능하게 합니다. 두 번째 개선사항은 CDAP 가수분해의 속도가 실온에서보다 현저히 느린 0°C에서 활성화 반응을 수행하는 것입니다. 0°C에서 시약 반감기가 길어지면, 낮은 온도에서 느린 활성화 속도를 보정하기 위해 활성화 시간이 3분에서 15분으로 증가합니다. 반응 시간이 길수록 반응 pH를 보다 쉽게 유지할 수 있습니다. 0°C를 사용하면 pH 에민감한 다당류의 분해가 느려지므로 이러한 유형의 다당류의 컨쥬게이트를 준비할 수 있습니다. 프로토콜이 개선되면 활성화 프로세스가 열광적이고, 제어하기 쉬워지고, 재현가능하며, 확장이 더 쉬워집니다.
이 문서에서는 0°C에서 다당류의 제어된 CDAP 활성화를 수행하고 지정된 표적 pH에서 활성 다당류의 후속 파생을 수행하기 위한 향상된 프로토콜을 설명한다. 또한 기일루벤젠 설포닉산(TNBS) 분석법은, Qi 외9의방법에 기초하여, 수정된 다당류에 대한 히드라지드 레벨의 판정을 위한 것이다. 레소시놀 및황산(10)에 기초한 육소에 대한 변형된 분석체도 설명되어 있으며, 이는 더 넓은 범위의 다당류를 결정하는 데 사용될 수 있다. CDAP 활성화 및 컨쥬게이션에 대한 자세한 내용은 리더가 이전 간행물5,6,8 을 Lees 등으로 지칭한다.
프로토콜
참고: 다당류 활성화 및 기능화 절차를 실행하기 전에 다당해 솔루션, ADH 솔루션, DMAP 솔루션 및 CDAP 스톡 솔루션을 미리 준비합니다. 솔루션과 장비를 조직적이고 편리하며 논리적인 위치에 배치합니다. 설명된 반응은 10 mg의 다당류에 대한 것이며, 위 또는 아래로 확장될 수 있다. 확장하기 전에 작은 규모로 프로토콜을 평가하는 것이 좋습니다.
1. 5 mg / mL 다당류 용액, 2 mL을 준비하십시오.
- lyophilized 다당류용
- 다당류 용기가 열리기 전에 실온에 올 수 있도록 하십시오. 분석 균형을 사용하여 나사 캡 튜브 내부의 10 mg의 다당류를 계량하십시오. 정적 제거기는 샘플링을 더 쉽고 분말의 보다 정확한 계량을 위해 사용합니다.
- 1제15M염화나트륨(NaCl)의 2mL를 튜브에 추가하여 다당류를 용해시세요. 튜브를 뚜껑과 소용돌이.
참고: 염화나트륨은 CDAP 반응에 영향을 미치지 않지만 다당류 이차 구조에 영향을 줄 수 있습니다. 일부 다당류는 다른 염분 농도에서 더 용해됩니다. - 다당류 분자량에 따라 12-24h의 엔드 오버 엔드 회전으로 튜브를 혼합하여 다당류가 완전히 수분을 공급할 수 있도록 합니다. 필요한 경우 튜브를 부드럽게 데워 용해성 화를 촉진합니다.
- 완충액의 용해화 다당류용
참고: 효율적인 CDAP 활성화를 위해 다당류 솔루션에는 버퍼, 특히 인산염 이온이 포함되어서는 안 됩니다. 아래 절차를 따라 버퍼를 물 또는 식염수 용액으로 대체하고 다당류 농도를 5 mg/mL로 조정하십시오.- 적절한 분자량 차단(MWCO)의 4mL 또는 15mL 원심 스핀 필터 장치를 획득한다.
참고: MWCO는 다당류의 분자량보다 5-10배 더 작습니다. - 필터 삽입에 다당류의 ~20 mg을 포함하는 버퍼링 된 다당류 용액의 부피를 추가합니다. 물 또는 식염수 용액으로 전체 마크를 채웁니다. 필터를 단단히 캡합니다. 끝 오버 엔드에 의해 몇 번 혼합.
- 제조업체가 제안한 원심력에서 필터 장치를 원심분리합니다. 원심분리 시간이 충분한지 확인하여 각 스핀 후 최소 5배 의 부피 감소를 달성할 수 있습니다. 흐름을 삭제합니다. 필터 장치를 다시 조립합니다.
- 필터 인서트를 담수 또는 식염수 용액으로 전체 마크로 리필합니다. 필터를 단단히 캡합니다. 필터의 컨텐디를 종료 회전 ~10회 또는 부드러운 소용돌이로 혼합하는 행위; 스핀을 반복합니다.
참고: 다당류는 원심 장치의 필터 인서트 하단에 축적되어 겔을 형성할 수 있다. 다음 회전 전에 필터 인서트 내부의 리텐트를 신선한 리필과 다시 혼합하는 것이 좋습니다. - 리필 및 스핀 사이클을 최소 3회 반복합니다.
- 아래 운동을 따라 필터 삽입물에서 다당류 리텐트를 복구하십시오.
- 볼륨이 ~ 1mL되도록 필터 삽입에 담수 또는 식염수를 추가합니다. 위아래로 피펫팅하거나 부드러운 소용돌이로 섞는다.
- 모든 혼합 리텐트를 5mL 튜브로 옮기. 필터 인서트에 1mL의 담수 또는 식염수를 추가합니다. 위아래로 또는 부드러운 소용돌이로 필터를 헹군다. 모든 헹소를 복구된 다당류와 옮기고 결합합니다.
- 다당류 농도를 결정합니다(섹션 7.3에서 다당류 분석 참조). 추가 물 또는 식염수5 mg/mL로 다당류를 희석시.
- 적절한 분자량 차단(MWCO)의 4mL 또는 15mL 원심 스핀 필터 장치를 획득한다.
- 다당류 용액이 준비되면 얼음 양동이에 다당류 용액이 들어 있는 튜브를 식힙니다.
2. 0.5 M 아디픽 산 디하이드라지드(ADH) 용액, 10mL를 준비한다.
- 분석 균형에 0.87 g ADH의 무게, 0.1 M HEPES (4-(2-하이드록세틸)-1-piperazinethanesulfonic 산), pH 8의 8 mL에서 용해.
- pH 미터에 의해 모니터링되는 수산화 나트륨(NaOH)으로 표적 pH에 적응한다. 추가 버퍼로 10mL로 가져와 pH를 다시 확인하십시오.
3. 2.5 M DMAP 솔루션, 10 mL를 준비하십시오.
참고 : DMAP은 독성이 있으며 피부에 침투합니다. 시술을 수행할 때 니트릴 장갑을 착용하십시오.
- 조심스럽게 50mL 원문 튜브에 DMAP의 3 g의 무게. DMAP에 5 ml의 물을 넣고 5분 동안 소용돌이어 흐린 용액(~7mL)을 얻습니다.
- 혼합하는 동안 DMAP 용액에 10N 염산(HCl)의 50μL 증분을 추가합니다. 각 추가 사이에 혼합합니다. 솔루션이 명확해지면 추가를 중지합니다.
- DMAP 솔루션을 ~pH 8로 가져오기 위해 25 μL 증분에 10 N NaOH를 추가합니다.
- DMAP 솔루션을 물과 함께 10mL로 가져와 2.5M 솔루션을 제공합니다.
- 2.5 M DMAP 솔루션의 pH를 미세 조정합니다.
참고: DMAP 솔루션 pH는 농도 및 이온 강도로 변경됩니다. 본 연습은 2.5M DMAP 스톡을 특정 pH로 미세 조정하여 10권의 다당류와 혼합될 때, 그 결과 용액이 활성화를 위한 표적 pH에 가깝다.- 다당해용액을 준비하는 데 사용됐던 1mL 또는 NaCl 용액을 포함하는 1.5mL 튜브 시리즈를 준비한다. 얼음에 튜브를 진정.
- 차가운 튜브에 100 μL의 DMAP을 추가합니다. 소용돌이및 pH 미터로 pH를 측정합니다. 그런 다음 측정된 튜브를 폐기합니다.
- 측정된 pH가 목표 값에 가깝지 않은 경우 DMAP 주식의 pH를 1M NaOH 또는 HCl로 적절히 조정합니다. 측정된 pH가 대상 pH에 가까워질 때까지 3.5.2 및 3.5.3단계를 반복한다.
4. 준비 100 mg/mL CDAP 재고 솔루션
참고: CDAP 분말은 단단히 닫혀 -20 °C에 저장하고 열기 전에 실온에 와서 허용해야합니다. 시술을 수행할 때 니트릴 장갑을 착용하십시오.
- 분석 균형에 1.5 mL 스냅 캡 미세 원심 분리 기 튜브를 타고. 작은 주걱을 사용하여 튜브에 10-140 mg의 CDAP를 계량하십시오. CDAP의 실제 가중치를 기록합니다.
- 100 mg/mL CDAP를 준비하는 데 필요한 아세토나이트의 양을 결정합니다. 연기 후드에 아세토나이트를 엽니다.
- 적절한 볼륨 파이프를 사용하여 아세토닐릴을 그려 서 파이펫 팁에서 증기를 평형화합니다. 몇 초 후에 용매가 파이펫 끝에서 물방울을 떨어 뜨릴 때까지 기다렸다가 CDAP 튜브로 직접 전송할 준비를 하십시오. 계산된 아세토닐트리어를 끌어서 CDAP 튜브로 직접 이송합니다. 캡을 닫습니다.
참고: 아세토나이트는 해밀턴 주사기 또는 적절한 크기에 상응하는 것을 사용하여 CDAP 튜브로 이송될 수도 있습니다. - 소용돌이가 CDAP를 완전히 용해합니다. CDAP 튜브를 얼음 양동이에 놓습니다.
참고 : CDAP는 추위에 아세토나이트에 안정적입니다. 용해성 주식은 >1주 동안 -20°C로 유지될 수 있다. 그러나, 신선한 CDAP 솔루션을 준비하는 것이 바람직하다.
5. 다당류 활성화 및 히드라지드 기능화
- 활성화를 시작하기 전에 얼음 위에서 냉각된 모든 품목과 용액을 확인하십시오: 마그네틱 교반기 위에 놓인 스티어 바를 포함하는 평평한 바닥, 넓은 입 용기에 5 mg/mL 다당류 용액의 2mL; 100 mg/mL CDAP 재고 솔루션; 2.5 M DMAP 주식 솔루션; 제조 업체의 지시에 따라 0 °C에 대해 보정 된 6mm 직경 프로브와 같은 반 마이크로 pH 프로브를 가진 pH 미터; 사용할 준비가 된 100 μL 파이프; 타이머가 지워지고 사용할 준비가 된 경우; 자동 티타토르 디스펜서 헤드 위치 또는 10 μL 파이프를 사용할 준비가; 0.5 M ADH 솔루션.
- DMAP을 사용하여 다당류의 pH를 대상 pH로 사전 조정합니다.
- pH 프로브를 다당류 용액에 넣고 전체 활성화 절차 중에 용액에 둡니다.
- DMAP 스톡 용액의 200 μL을 교반 하에서 드롭와이즈 첨가하여 다당류 용액으로 이송합니다. 대상 활성화 pH에 대한 솔루션의 pH를 조정합니다. pH를 낮추고 0.1 M HCl을 추가하고 0.1 M NaOH를 낮추어 pH를 증가시다. 0.1 pH 이상의 단위로 목표 pH를 초과하는 것을 피하고 활성화 기간 동안 얼음 수조에서 반응을 냉각하십시오.
- CDAP 활성화
- 파이프 100 μL CDAP를 위아래로 파이프 팁의 증기를 평형화합니다. CDAP 의 100 μL을 교반시다당용액으로 옮긴다.
참고: 이 활성화는 시작 비율로 다당류 1 mg에 대한 CDAP 1 mg을 사용합니다. 활성화를 최적화할 때 비율을 늘리거나 감소시킬 수 있습니다. - 타이머를 시작하고 전체 활성화 중에 pH 변경 사항을 모니터링합니다. 자동 티타레이터 디스펜서(또는 파이펫)의 도움으로 반응에 0.1 M NaOH의 10 μL 증분을 신속하게 추가하여 대상 pH에서 반응을 유지한다.
참고: pH 프로브로 부드럽게 저어주는 pH 응답 시간을 줄이는 데 도움이 될 수 있습니다. pH는 처음에 더 빠르게 떨어지고 0.1 M NaOH를 더 자주 추가해야 할 수도 있습니다. 반응이 진행됨에 따라 pH 감소가 느려지고 추가빈도가 낮아집니다. pH 9 활성화를 위해 10-15분인 최적의 활성화 시간에 접근할 때 pH는 기본적으로 변경되지 않아야 합니다.
- 파이프 100 μL CDAP를 위아래로 파이프 팁의 증기를 평형화합니다. CDAP 의 100 μL을 교반시다당용액으로 옮긴다.
- ADH 기능화
- 최적의 활성화 시간에 도달하면 0.5 M ADH의 2mL을 한 번에 교반 하에서 활성화된 다당류에 추가합니다. pH가 목표 범위에 있는지 확인합니다(ADH의 경우 pH 8-9).
참고: 빠른 믹싱을 한 번 추가하면 활성 다당류와 반응하여 다당류 교차 연결을 방지하는 디히드라지드의 양 끝에 대한 확률을 최소화합니다. - 반응 혼합물을 1시간 이상 계속 저어줍니다. 반응 혼합물을 4°C로 전송하지만 0-20°C는 허용됩니다.
참고: ADH 기능화 반응은 온도에 크게 의존하지 않습니다. 큰 과잉의 이수드라지드는 담금질 시약의 역할을 하므로 활성 다당류를 더 담금질 할 필요가 없습니다. 그러나, 단백질을 직접 연상시키는 경우, 반응은 일반적으로 1M 글리신, pH 8-9로 담금질되어야 한다.
- 최적의 활성화 시간에 도달하면 0.5 M ADH의 2mL을 한 번에 교반 하에서 활성화된 다당류에 추가합니다. pH가 목표 범위에 있는지 확인합니다(ADH의 경우 pH 8-9).
6. 투석에 의한 ADH 기능성 다당류정화
참고: ADH 기능화 반응의 원유 제품에는 광범위한 투석으로 가장 효율적으로 제거할 수 있는 고농도ADH(0.5M)가 함유되어 있습니다. 컬럼 또는 스핀 탈염 장치와 함께 젤 여과는 특히 잔류 ADH 오염 물질을 제거해야 하는 경우 효율적이지 않습니다.
- 투석막의 MWCO를 결정합니다. 작은 다당류에 3 kDa 컷오프를 사용합니다.
참고: 투석막의 MWCO는 다당류의 MW보다 5-10배 더 작습니다. - 원하는 투석 형식(카세트 또는 튜빙)과 올바른 장치 용량을 선택합니다. 장치 용량이 샘플 볼륨보다 2배 더 큰지 확인합니다. 장치 사용에 대한 제조 자의 지침을 참조하십시오.
- 사용하기 전에 투석 막을 물에 수분처리합니다. 제조업체의 지침에 따라 투석 장치에 원유 파생 다당류 용액을 전송합니다.
참고: DMAP과의 접촉을 피하기 위해 니트릴 장갑을 착용하십시오. - 1 M NaCl의 2-4 L과 교반 바로 채워진 용기에 투석합니다. 차가운 방이나 냉장고 안에 용기를 볶습니다. 투석 중에 투석을 부드럽고 지속적으로 저어줍니다.
- 적어도 4 시간 동안 투석 한 후, 신선한 1 M NaCl로 변경하고 적어도 12 시간 동안 투석하십시오. 0.15 M 식염수의 2 변화에 대해 투석, 적어도 12 시간 각각. 원하는 경우, 물의 2 변화에 대해 투석.
- 빠른 TNBS 테스트를 사용하여 야간 투석을 테스트하여 모든 ADH가 제거되는지 확인합니다.
- 3 개의 borosilicate 튜브를 얻고 각각 음수 제어 (ctrl), 양성 ctrl 및 샘플로 레이블을 지정합니다.
- 음의 ctrl 튜브에 0.1 M 붕산염의 975 μL, pH 9를 추가하십시오.
- 양성 ctrl 튜브에 0.05 mM ADH (0.1 mM 히드라지드)의 100 μL과 0.1 M 붕산염의 875 μL, pH 9를 추가하십시오.
- 샘플 튜브에, 야간 투석의 500 μL과 0.1 M 붕산염의 475 μL, pH 9를 추가합니다.
- 세 개의 튜브에 1% TNBS의 25 μL을 추가합니다. 잘 섞으세요. 어둠 속에서 1시간 동안 놓습니다.
- 1 h의 3 튜브의 색상 강도를 비교합니다. 샘플 튜브 색상 강도가 양수 ctrl과 음수 ctrl 의 사이에 있는지 확인하여 ADH 오염 물질이 0.01 mM 이하로 내려갔음을 나타냅니다. 투석한 후투.
참고: ADH 히드라지드가 정제된 히드라지드 다당류의 총 히드라지드의 1% 미만을 차지하도록 가능한 한 ADH 오염물질의 수준을 줄이는 것이 신중하다. - 투석에서 파생 된 다당류를 복구합니다. 다당류와 히드라지드의 농도를 결정합니다. 히드라지드/다당류 비율을 계산합니다(섹션 7 참조). 투석 된 다당류가 5-10 mg /mL로 농축되어야하는 경우 섹션 1.2를 참조하십시오.
7. 히드라지드 파생 다당류 분석
참고: 여기서 설명된 분석의 목적은 히드라지드/다당류 비율의 관점에서 다당류 농도, 히드라지드 농도 및 히드라지드 의 수준을 결정하는 것이다.
- 샘플 준비
참고: 분석할 다당류는 저분자 탄수화물, 아민 또는 히드라지드 불순물이 없어야 합니다. Lyophilized 샘플은 정확한 체중 측정을 보장하기 위해 건조하고 소금이 없어야합니다. 일반적으로 1-2 mg/mL 용액의 ~1mL은 에세이에 적합합니다.- 비정정전기 주걱 또는 정적 제거제를 사용하여 분석 균형에 lyophilized polysaccharide 샘플의 적어도 10 mg의 무게. 분석 신호가 표준 곡선의 선형 범위 내에 속도록 물 또는 식염수에서 다당류를 농도(예를 들어, 2 mg/mL)로 용해하십시오.
- 엔드 오버 엔드를 혼합하고 샘플이 완전히 용해될 수 있도록 충분한 시간을 허용합니다. 다당류 분자량에 따라 밤새 수분을 섭취하십시오.
- 다당류 분석: 레소시놀/황산 방법
참고: 다당류에 대한 적절한 분석은 폴리머의 탄수화물 조성에 따라 달라집니다. 원래 의 레소시놀 / 황산 분석은 육소 설탕을위한 것이었습니다.10. 분석체는 가열 단계의 온도를 90°C에서 140°C로 높여 서 이쪽으로 수정하였다. 이 높은 온도에서, 분석은 몇 가지 특이성을 잃지만 많은 설탕을 분석하는 데 사용할 수 있습니다. 그러나, 특정 다당류에 대한 분석의 적합성을 결정하는 것은 여전히 필요하다. 트리플리카는 각 지점에 권장되지만 난방 블록의 용량으로 인해 일부 숙박 시설이 필요할 수 있습니다.- 75% 황산 준비
참고: 농축 황산은 매우 부식성이 있으며 심한 화상을 입을 수 있습니다. 화학 연기 후드에서이 절차를 수행합니다. 항상 물에 농축 산을 부어, 그 반대가아닙니다!- 200mL 유리 병에 50mL의 물을 넣습니다. 병을 차가운 수조에 놓습니다. 150mL의 황산을 천천히 넣습니다. 병에 캡을 씌서 통풍이 이시습니다.
- 용액이 실온과 평형되도록 합니다. 3개월 이내에 솔루션을 사용합니다.
- 탄수화물 표준 준비
- 수정되지 않은 다당류 용액을 표준으로 사용할 1 mg/mL에서 준비합니다. 대안적으로, 폴리사카라이드의 반복 단위에서 발견되는 비율에 개별 설탕의 혼합을 사용하, 총 설탕 농도의 1 mg/mL에서, 표준으로.
참고: 설탕 혼합물은 일반적으로 동일한 설탕 조성물의 탄수화물 폴리머와 동일한 결과를 제공하지만, 이것은 실험적으로 확인되어야 합니다.
- 수정되지 않은 다당류 용액을 표준으로 사용할 1 mg/mL에서 준비합니다. 대안적으로, 폴리사카라이드의 반복 단위에서 발견되는 비율에 개별 설탕의 혼합을 사용하, 총 설탕 농도의 1 mg/mL에서, 표준으로.
- 13 x 100 borosilicate 테스트 튜브에 대한 튜브 홀더가있는 가열 블록이 작동하는지 확인하십시오. 산이 유출되는 경우 난방 블록 아래와 주변의 보호 패드를 사용하십시오. 가열 블록을 최소 1시간 동안 140°C로 예열하여 활용된 모든 블록을 통해 안정적이고 균일한 온도를 달성한다.
- 라벨 13 x 100 borosilicate 테스트 튜브, 각 표준 및 각 샘플에 대 한 삼중. 1 mg/mL 탄수화물 표준의 0, 2.5, 5, 7.5, 10 μg(또는 μL)를 해당 로 표시된 표준 튜브에 추가합니다. 각 튜브에 물을 추가하여 부피를 100 μL로 가져옵니다.
참고: 생성된 색상은 특정 설탕에 따라 다릅니다. 일부 설탕은 전체 흡광도 범위를 생성하기 위해 더 많은 질량을 필요로하므로 표준 곡선에 사용되는 실제 양은 다를 수 있습니다. - 3개의 샘플 튜브에 파생된 다당류의 ~5 μg를 함유한 부피를 추가하여 시료 분해를 설정하고 총 부피를 물과 함께 100 μL로 가져옵니다. 대안적으로, 시료의 다당류 농도가 알려지지 않은 경우, 일련의 4배 희석을 수행한다. 삼중고에 각 희석의 100 μL을 테스트합니다.
- 사용하기 직전에 6 mg/mL에서 신선한 레소시놀을 디온화(dI) 물에 준비하십시오. 레소시놀이 용액이 될 때까지 소용돌이. 각 튜브에 6 mg/mL 레소시놀의 100 μL을 추가합니다.
- 75%의 황산을 소량의 비커에 조심스럽게 붓습니다.
참고: 실험실 코트, 니트릴 장갑, 안전 안경을 착용하십시오. 물방울, 유출 및 튀김에 주의하십시오. 젖은 종이 타월을 사용하여 물방울을 닦아 주십시오. 황산의 활성이 공기에 대한 확장된 노출에 변화함에 따라 전체 분석에 황산의 균일한 혼합물을 사용하십시오. - 반복 피펫을 사용하여 각 튜브에 75 % 황산의 300 μL을 균일하게 추가합니다. 튜브를 잘 섞기 위해 적극적으로 소용돌이치며 소용돌이치면서 튜브를 멀리 가리킵니다. 튜브를 히터 블록에 순차적으로 일정한 속도로 배치합니다. 모든 튜브가 들어오면 타이머를 즉시 3분 동안 설정합니다.
- 3분 만에 튜브를 같은 순서로 일정한 속도로 제거하고 얼음 수조의 랙에 직접 놓습니다. 얼음이 차가워지도록 튜브를 둡니다. 튜브를 제거하고 읽기 중에 큐벳의 응축을 방지하기 위해 ~ 5 분 동안 실온으로 평형할 수 있습니다.
- 10mm 경로 길이 큐벳을 사용하여 430 nm에서 흡광도를 판독하기 위해 UV/VIS 분광계를 설정합니다. 제로 표준 튜브가 있는 블랭크. 430 nm에서 모든 튜브의 흡수도를 읽으십시오.
참고: 일회용 플라스틱 큐벳은 사용하기에 편리합니다. - 탄수화물 표준 대A 430의μg를 플로팅하여 표준 곡선을 구성합니다. 포도당을 참조 표준으로 사용하는 일반적인 표준 곡선에 대한 그림 4를 참조하십시오.
- 표준 곡선의 선형 범위 내에 속하는 A430 값을 가진 샘플 분석 튜브를 사용하여 표준 곡선 방정식에서 샘플 분석 관에서 알 수없는 다당류의 μg 양을 계산합니다. 알 수 없는 첨가물의 부피로부터 알 수 없는 다당류의 농도를 결정하여 희석을 고려한다. 필요에 따라 농도를 mg/mL 또는 μM 반복 단위로 변환합니다.
- 75% 황산 준비
- 트리니트로벤젠 설포닉산을 이용한 히드라지드 분석(TNBS)
- 0.9% NaCl을 함유한 0.9% NaCl은 NaCl 9g과 200 mg의 나트륨 아지드를 dI H2O에서 1L의 최종 부피로 용해시킴으로써 0.02%의 나트륨 아지드(Sample buffer)를 함유한다.
- 0.1M 나트륨 붕산염, pH 9(분석 완충) 0.5M 나트륨 붕산염, pH 9의 100mL를 dI H2O.의 400mL로 혼합하여 pH가 9 ± 0.1임을 확인한다. 필요한 경우 조정합니다.
- dIH2 O. 1% TNBS로 튜브를 1% TNBS로 표시하고 일주일 동안 어둠 속에서 4°C에 저장하여 1mL로 5% 2,4,6-trinitrobenzene sulfonic 산 용액의 200 μL을 희석하여 1% TNBS를 준비한다.
- 50mM ADH 스톡(100mM 히드라지드에 해당)을 준비합니다.
- 분석 균형을 사용하여 871 mg의 아디픽 디히라지드(ADH) 파우더를 계량합니다. 최고 로더 밸런스를 사용하여 100mL에 샘플 버퍼를 추가하여 시약 병에 분말을 녹입니다.
- 병을 100mM 히드라지드/50mM ADH로 라벨로 지정합니다. 병을 단단히 캡하고 1 년 동안 4 °C에서 보관하십시오.
- 히드라지드 표준(0.1, 0.2, 0.3, 0.4, 0.5 및 0.6mM 히드라지드)를 준비한다.
- 최고 로더 밸런스를 지원하여 샘플 버퍼로 100mM 하이드라지드 스톡을 희석하여 6개의 히드라지드 표준을 준비합니다. 각 표준의 100mL를 준비하여 농도 오차를 최소화합니다. 병을 단단히 닫고 1 년 동안 4 ° C에서 보관하십시오.
- 분석 반응 설정
참고: TNBS 분석은 1mL의 반응 부피에서 실행됩니다. 각 분석 관은 샘플 (또는 표준) 100 μL, 분석 버퍼875 μL 및 1 % TNBS 용액의 25 μL로 구성됩니다. 모든 분석 반응 (샘플 및 표준 모두)은 triplicate에 설정됩니다.- 라벨 3 borosilicate 유리 튜브 (12 x 75 mm) 각 표준에 대 한, 제로 표준을 포함 하 여. 농도가 증가하는 순서대로 튜브 랙에 표준 튜브를 정렬하고 정렬합니다. 보정된 100 μL 또는 200 μL 마이크로파이프를 사용하여 각 해당 튜브에 표준의 100 μL을 정확하게 추가합니다. 제로 표준의 경우 100 μL의 샘플 버퍼를 사용합니다.
- 분석할 각 희석된 시료에 대해 3개의 보로실리케이트 유리 튜브(12 x 75mm)를 라벨로 표시합니다. 그에 따라 튜브 랙에 샘플 튜브를 정렬하고 정렬합니다. 보정된 100 μL 또는 200 μL 마이크로파이프를 사용하여 각 해당 샘플 튜브에 샘플의 100 μL을 정확하게 추가합니다.
- 보정된 1000 μL 마이크로파이프를 사용하여 모든 분석 관( 표준 및 샘플)에 875 μL의 분석 버퍼를 정확하게 추가합니다.
- 분석 반응을 시작하려면 보정된 100 μL 마이크로파이프를 사용하여 각 분석 관에 1% TNBS의 25 μL을 정확하게 추가합니다. 제로 표준 튜브에서 시작하여 농도를 증가시키기 위해 표준 튜브로 이동한 다음 미리 결정된 순서에 따라 샘플 튜브로 이동합니다. 새로운 표준 또는 새 샘플을 시작할 때 팁을 변경하고 모든 튜브에 TNBS를 추가하는 데 소요되는 시간을 5분 이내에 유지합니다.
- 소용돌이 모든 분석 튜브는 고속 또는 속도 설정에서 2 s에 대한 모든 분석 튜브를 통해 분석 관 내부의 액체가 튜브 개구부에서 1/2 인치높이에 도달하기 위해 위쪽으로 소용돌이치도록 합니다.
- 분석 시작 시간을 기록하고 타이머를 2h로 설정합니다. 실온에서 2시간 동안 분석 튜브 랙을 어둠 속에서 놓습니다. 시간이 끝나면 모든 튜브를 한 번 더 소용돌이시키고 데이터 수집으로 진행합니다.
- 데이터 수집
- UV/VIS 분광기계를 따뜻하게 하고 기준선이 안정시됩니다. 히드라지드 분석의 경우 검출 파장을 500 nm에서 설정합니다. 전체 분석에 대한 모든 흡광도 측정에 1cm 경로 길이의 1mL 쿼츠 큐벳을 사용하십시오.
- 0 표준 분석기를 큐벳에 전송하여 데이터 수집을 시작합니다. 계측기를 비우고(흡광도를 0으로 설정).
- 각 튜브에서 단일 읽기를 수행하고 데이터 테이블에 흡광도 값을 기록합니다. 새로운 샘플을 읽기 전에 큐벳에서 잔류 액체를 제거합니다. 제로 표준에서 시작하여 농도증가 표준으로 이동한 다음 샘플로 이동합니다. 일단 시작되면, 중지하지 않고 효율적으로 모든 단계를 수행하고 10 분 이내에 모든 튜브를 읽을 수 있습니다.
- 샘플 데이터 분석
- mM 히드라지드 표준 대 A500을플로팅하여 표준 곡선을 만듭니다. y가 mM 히드라지드를 나타내고 x가 A500을나타내는 y =x + b의 형태로 표준 곡선 방정식을 찾습니다. 일반적인 표준 곡선의 그림 4를 참조하십시오.
- 희석 계수에 맞게 조정된 표준 곡선 방정식을 사용하여 샘플에서 mM 히드라지드를 계산합니다. 계산을 위해 표준 곡선의 선형 범위 내에 속하는 A500 값이 있는 샘플 분석 튜브만 선택합니다.
- 방정식(1)을사용하여 히드라지드/다당류의 어금니 비율을 계산합니다.
히드라지데/다당류 = h/c × MW (1)
여기서 h는 mM 히드라지드이며, c는 다당류의 mg/mL 농도이고, MW는 kDa의 다당류 분자량이다. - 방정식(2)을사용하여 다당류의 100 kDa 당 히드라지드 라벨링 밀도를 계산합니다.
100 kDa 다당류 = h / c × 100 (2)당 라벨 링 밀도
여기서 h는 mM 히드라지드이며, c는 다당류의 mg/mL 농도이다.
참고: 편의를 위해 다당류는 100,000 달톤의 분자량을 갖는 것으로 간주될 수 있습니다. 이를 통해 다양한 다당류의 파생 수준을 비교할 때 "라벨링 밀도"를 고려할 수 있습니다. - 히드라지드 라벨링 밀도를 중량%ADH로 계산합니다.
- 방정식(3)을사용하여 ADH의 효과적인 mg/mL 농도를 결정합니다.
mg/mL ADH = (mM 히드라지드 / 1000) × 174(3)
여기서 174는 ADH의 MW입니다. - 방정식(4)을사용하여 중량 % ADH를 계산합니다.
체중 % ADH = (mg / mL ADH) / (mg / mL 다당류) × 100(4)
- 방정식(3)을사용하여 ADH의 효과적인 mg/mL 농도를 결정합니다.
결과
CDAP 화학을 이용한 다당류의 활성화 및 파생을 설명하기 위해, dextran은 0.25 및 0.5 mg CDAP/mg dextran에서 활성화되었다. 각 반응에 대해, 물에 10 mg/mL dextran 용액이 얼음에 냉각되었고, 2.5 M DMAP 스톡의 1/10제부(섹션 3에 설명된 대로 제조)가 추가되었다. 최종 용액은 10 μL 알리쿼트에 0.1 M NaOH를 추가하여 pH 9로 가져왔습니다. 용액은 냉각 및 교반, CDAP 첨가, pH는 pH 9에서 0.1 M NaOH의 10 μL 알리쿼트10μL 알리쿼트만 15분 동안 유지하였다.
라벨이 붙은 덱은 6항에 설명된 대로 M NaCl 1, 0.15 M NaCl 및 물에 대해 순차적으로 투석되었다. ADH-dextran은 다음 레소시놀/황산 분석(섹션 7.2)을 사용하여 dextran에 대해 분석하였다. 당 표준으로 포도당을 사용하는 전형적인 표준 곡선은 도 4A에도시된다. 상기 히드라지드 함량은 7.3항에 기재된 TNBS 분석체를 사용하여 결정되었다. 표준으로 ADH를 사용하는 전형적인 히드라지드 표준 곡선은 도 4B에부여된다.
두 단계의 활성화에서 dextran의 활성화에서 대표 계산은 그림 4A,B에표시됩니다. 이 데이터는 도 4C에서각각 7.9.3.4 및 7.9.3.5 항에 설명된 바와 같이 dextran 폴리머의 100kDa 당 히드라지드와 ADH의 중량 퍼센트로 제시된다. CDAP 비율이 두 배로 증가함에 따라 파생정도가 약 두 배로 증가하였다.
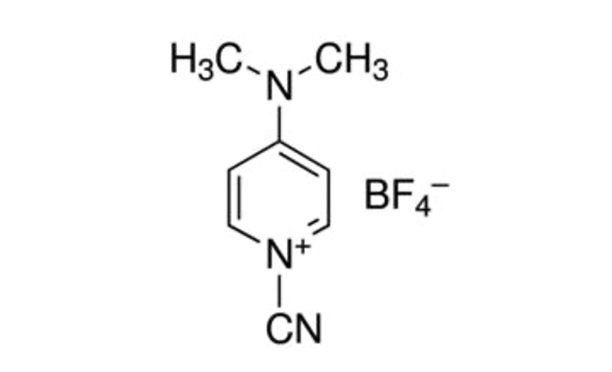
그림 1: CDAP의 화학 구조. CDAP = 1-시아노-4-디메틸아미노피리딘 테트라플루오로보레산. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
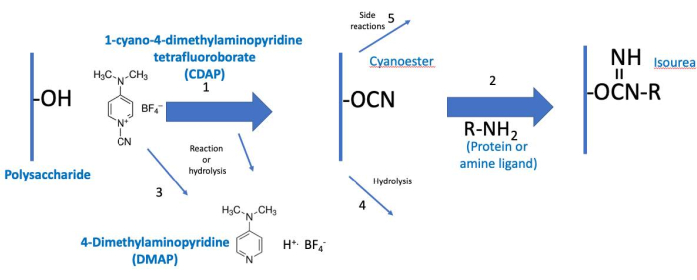
그림 2: CDAP 활성화 및 컨쥬게이션 프로세스. 이 프로세스는 개념적으로 두 단계로 나뉘며, 활성 된 다당류는 둘 다에 공통적으로 공통됩니다. 기본 조건하에서 CDAP는 다당류 하이드록실을 활성화하여 DMAP(반응 1)을 방출합니다. CDAP 가수 분해도 DMAP(반응 3)를 방출한다. 시아노 에스테르가 표시되지만, 이것은 실제 중간되지 않을 수 있습니다. 따라서 중간체는 (CDAP) "활성화된" 다당류라고 합니다. 제1 활성화 단계 동안, 활성화된 다당류는 가수분해(reaction 4) 또는 측면 반응(reaction 5)을 겪을 수 있다. 제2 발생상(reaction2)에서, 활성화된 다당류는 반응 4 및 5 이외에 안정된 이소레아 결합을 형성하기 위해 아민과 반응한다. 약어: CDAP = 1-시아노-4-디메틸아미노피리딘 테트라플루오로보산물; DMAP = 4-디메틸아미노피리딘; R-NH2 = 아민. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
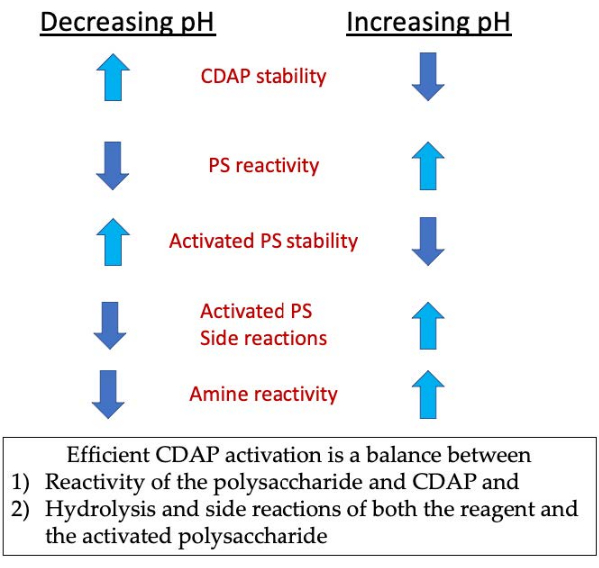
그림 3: CDAP 활성화 및 컨쥬게이션. 이 공정은 CDAP 반응성, CDAP 및 활성화된 다당류의 안정성, 그리고 활성된 다당류의 반응성아민과의 균형을 필요로 한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
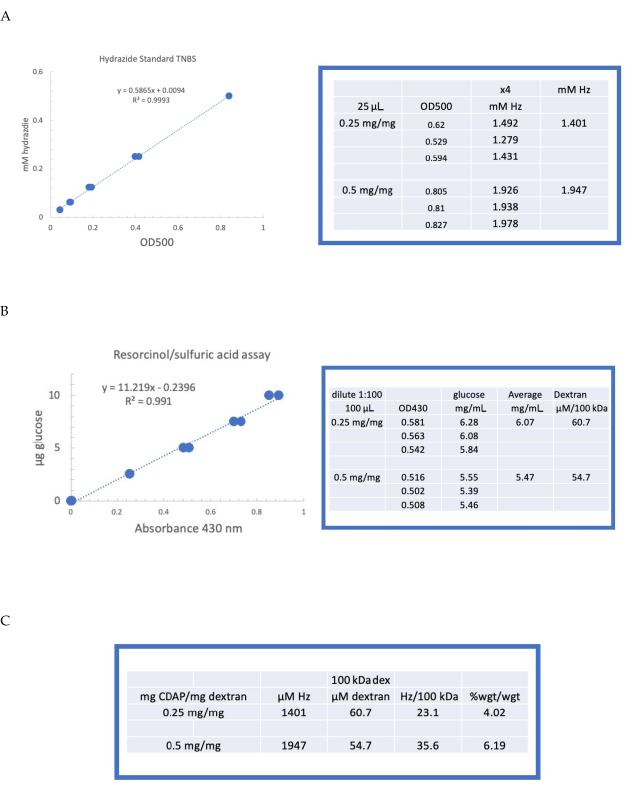
그림 4: dextran의 CDAP 활성화에 대한 대표 결과. (A)레소시놀/황산 및(B)TNBS 에 대한 전형적인 표준 곡선. 0.25 및 0.5 mg CDAP/mg dextran으로 활성화 된 dextran에 대한 분석 결과가 표시됩니다. 포도당은 레소시놀 분석의 표준으로 사용되었다. Dextran, mg/mL에서, 어금니 농도를 제공하기 위해 100 kDa로 나뉩니다. 상기 히드라지드 농도는 ADH를 표준으로 사용하여 결정되며, 상기결과는 μM Hz로 발현되고(C) 히드라지드의 계산: dextran 비율. 파생수준은 다른 평균 분자량의 폴리머 간의 비교를 용이하게 하기 위해 100kDa당 히드라지드로 계산되었다. g ADH/g dextran의 %의 중량 비는 ADH에 대한 174 g/mole의 MW를 사용하여 계산하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
CDAP는 다당류를 유도하고 컨쥬게이트하는 편리한 시약입니다. 이 문서에서는 CDAP를 사용하여 히드라지드(PS-ADH)로 다당류를 유도하고 최근에 발표된 개선사항 8을통합하는 일반적인 방법을 설명합니다. 첫째, 이 기술은 활성화 공정을 제어하기 위해 대상 pH를 유지하는 것의 중요성을 강조한다. 많은 일반적인 버퍼가 CDAP 활성화 반응을 방해하지만 DMAP을 pH 8을 관리하는 버퍼로 성공적으로 사용할 수 있음을발견했습니다. 또한 DMAP은 이미 CDAP 활성화의 반응 부산물입니다. 마지막으로 CDAP를 추가하기 전에 DMAP로 다당류 용액을 버퍼링하면 반응 pH의 정밀한 타겟팅 및 유지 관리가 용이합니다. 우리가 설명하듯이, 농축된 DMAP 스톡 솔루션의 pH를 조정하여 희석시, 표적 pH에 도달하는 것이 유용하다. 둘째, 추위 에 과정을 수행하면 반응 시간이 느려졌고 활성화 과정이 덜 열광적이고 용서합니다. 낮은 온도는 CDAP 가수분해의 속도를 감소시키고, pH 9에서 최적의 활성화 시간이 ~3분에서 ~15분으로 증가합니다. 또한 실온에서 수행될 때보다 동일한 수준의 활성화를 달성하기 위해 CDAP가 적습니다.
ADH-파생다당류는 카보디미드(예를 들어, EDAC)7을이용하여 단백질에 컨쥬게이트될 수 있다. 예를 들어, 여러 허가된 혈우병 인플루엔자 b(Hib) 백신은 EDAC를 사용하여 파상풍톡소이드를 컨쥬게이트하기 위해 ADH와 함께 파생된 폴리리보실리비톨포스페이트(PRP)를 사용한다. CNBr은 처음에 고용되었지만 CDAP는 이 목적을 위해 사용하기가 훨씬 쉽습니다. 우리의 경험에서, ADH 파생을 위한 좋은 표적 범위는 100 kDa polysaccharide 또는 ~1-3% ADH 당 10-30 히드라지드 입니다 무게에 의해.
동일한 프로세스는 디아민에 대 한 ADH를 대체 하 여 기본 아민으로 다 당 산화를 유도 하는 데 사용할 수 있습니다. 헥산 디아민을 사용하여 아민8로다당류를 유도하는 것이 좋습니다. 아미네이트 다당류(PS-NH2)는단백질유도제(11)를위해 개발된 시약을 사용하여 공주할 수 있다. 전형적으로, PS-NH2는 말레니드(예를 들어, succinimidyl 4-[N-maleimidomethyl]cyclohexane-1-carboxylate (SMCC) 또는 N-γ-maleimido부트리닐 옥시스쿠치니미드 에스테르 (GMBS) 및 단백질은 succinimidyl 3-(2-pyriddithio)로 티오(예: 2-pyriddithio)를 함유하고 있습니다. 틸-말레니드 화학은 매우 효율적입니다.
단백질은 또한 리신에 있는 아민을 통해 CDAP 활성화 된 다당류에 직접 결합 될 수 있습니다. 사용되는 활성화 프로토콜은 일반적으로 여기에 기재된 것과 유사하지만, 단백질:다당류비5,6,8뿐만아니라 활성화, 다당류 및 단백질 농도의 수준을 최적화할 필요가 있다.
Dextran은 하이드록실 그룹의 상대적으로 높은 밀도로 인해 CDAP로 활성화하는 가장 쉬운 다당류 중 하나이지만 Vi 항원과 같은 일부 다당류는 어려울 수 있습니다. 따라서, 단백질에 직접 CDAP 연상을 위한 단일 "최고" 프로토콜이 없습니다. 먼저 히드라지드 파생의 정도에 의해 결정된 바와 같이 적절한 수준의 활성화를 달성하기 위한 프로토콜을 개발한 다음 CDAP 활성화 다당류로 단백질 컨쥬게이션을 직접 진행하는 것이 좋습니다.
공개
앤드류 리스는 피나 바이오솔루션스의 창립자이자 소유주입니다. 그는 CDAP 화학과 관련된 여러 특허를 보유하고 있으며 화학 및 CDAP 융합 노하우의 라이센스혜택을 보유하고 있습니다.
감사의 말
여기에 설명 된 작품은 Fina Biosolutions LLC에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Sigma | 34851 | |
| Adipic acid dihydrazide | Sigma | A0638 | MW 174 |
| Amicon Ultra 15 10 kDa | Millipore | UFC901008 | MW cutoff can be 30 kDa for 200 kDa PS |
| Analytical balance | |||
| Autotitrator or electronic pipet | |||
| Beaker 2-4 L | |||
| CDAP | SAFC | RES1458C | Sigma |
| DMAP | Sigma | 107700 | MW 122.2 |
| Flake ice | |||
| HCl 1 M | VWR | BDH7202-1 | |
| Micro stir bar | VWR | 76001-878 | |
| Microfuge tube (for CDAP) | VWR | 87003-294 | |
| NaCl | VWR | BDH9286 | |
| NaOH 1 M | Sigma | 1099130001 | |
| NaOH 10 M | Sigma | SX0607N-6 | |
| pH meter | |||
| pH probe | Cole Parmer | 55510-22 | 6 mm x 110 mm Epoxy single junction |
| pH temperature probe | |||
| Pipets & tips | |||
| Saline or PBS | |||
| Small beaker 5-20 mL | VWR | 10754-696 | A 10 mL beaker allows room for pH probe & pipet |
| Small ice bucket | |||
| Small spatula | |||
| Stir plate | |||
| Resorcinol assay | |||
| Combitip | Eppendorf | 10 ml | |
| DI water | |||
| Dialysis tubing | Repligen | 132650T | Spectra/Por 6-8kDa |
| Dialysis tubing clips | Repligen | 142150 | |
| Heating block | |||
| Nitrile gloves | VWR | ||
| Repeat pipettor | Eppendorf | M4 | |
| Resorcinol | Sigma | 398047 | |
| Sugar standard | As appropriate | ||
| Sulfuric acid 75% | VWR | BT126355-1L | |
| Timer | |||
| TNBS assay | |||
| Adipic dihydrazide | Sigma | A0638 | MW 174 |
| Borosilcate test tubes 12 x 75 | VWR | 47729-570 | |
| Sodium borate, 0.5 M pH 9 | Boston Biologicals | BB-160 | |
| TNBS 5% w/v | Sigma | P2297 | MW 293.17 |
참고문헌
- Ellis, R. W., Granoff, D. M. . Development and clinical uses of Haemophilus B conjugate vaccines. , (1994).
- Goebel, W. F., Avery, O. T. Chemo-immunological studies on conjugated carbohydrate-proteins. Journal of Experimental Medicine. 50 (4), 533-550 (1929).
- Mond, J. J., Vos, Q., Lees, A., Snapper, C. M. T cell independent antigens. Current Opinion in Immunology. 7 (3), 349-354 (1995).
- Cruse, J. M., Lewis, R. E. . Conjugate Vaccines. 10, (1989).
- Lees, A., Nelson, B. L., Mond, J. J. Activation of soluble polysaccharides with 1-cyano-4-dimethylaminopyridinium tetrafluoroborate for use in protein-polysaccharide conjugate vaccines and immunological reagents. Vaccine. 14 (3), 190-198 (1996).
- Shafer, D. E., et al. Activation of soluble polysaccharides with 1-cyano-4-dimethylaminopyridinium tetrafluoroborate (CDAP) for use in protein-polysaccharide conjugate vaccines and immunological reagents. II. Selective crosslinking of proteins to CDAP-activated polysaccharides. Vaccine. 18 (13), 1273-1281 (2000).
- Schneerson, R., Barrera, O., Sutton, A., Robbins, J. B. Preparation, characterization, and immunogenicity of Haemophilus influenzae type b polysaccharide-protein conjugates. Journal of Experimental Medicine. 152 (2), 361-376 (1980).
- Lees, A., Barr, J. F., Gebretnsae, S. Activation of soluble polysaccharides with 1-cyano- 4-dimethylaminopyridine tetrafluoroborate (CDAP) for use in protein-polysaccharide conjugate vaccines and immunological reagents. III Optimization of CDAP activation. Vaccines. 8 (4), 777 (2020).
- Qi, X. -. Y., Keyhani, N. O., Lee, Y. C. Spectrophotometric determination of hydrazine, hydrazides, and their mixtures with trinitrobenzenesulfonic acid. Analytical biochemistry. 175 (1), 139-144 (1988).
- Monsigny, M., Petit, C., Roche, A. C. Colorimetric determination of neutral sugars by a resorcinol sulfuric acid micromethod. Analytical biochemistry. 175 (2), 525-530 (1988).
- Hermanson, G. . Bioconjugate Techniques. 3rd ed. , (2013).
Erratum
Formal Correction: Erratum: Activation and Conjugation of Soluble Polysaccharides using 1-Cyano-4-Dimethylaminopyridine Tetrafluoroborate (CDAP)
Posted by JoVE Editors on 7/09/2021. Citeable Link.
An erratum was issued for: Activation and Conjugation of Soluble Polysaccharides using 1-Cyano-4-Dimethylaminopyridine Tetrafluoroborate (CDAP). A figure was updated.
Figure 4 was updated from:

Figure 4: Representative results for CDAP activation of dextran. Typical standard curves for the (A) resorcinol/sulfuric acid and (B) TNBS assays. The assay results for dextran activated with 0.25 and 0.5 mg CDAP/mg dextran are shown. Glucose was used as the standard for the resorcinol assay. Dextran, in mg/mL, is divided by 100 kDa to give a molar concentration. The hydrazide concentration is determined using ADH as the standard and the results expressed as µM Hz. (C) Calculation of hydrazide: dextran ratios.The level of derivatization was calculated as hydrazides per 100 kDa of dextran to facilitate the comparison between polymers of different average molecular weights. The % weight ratio of g ADH/g dextran was calculated using a MW of 174 g/mole for ADH. Please click here to view a larger version of this figure.
to:
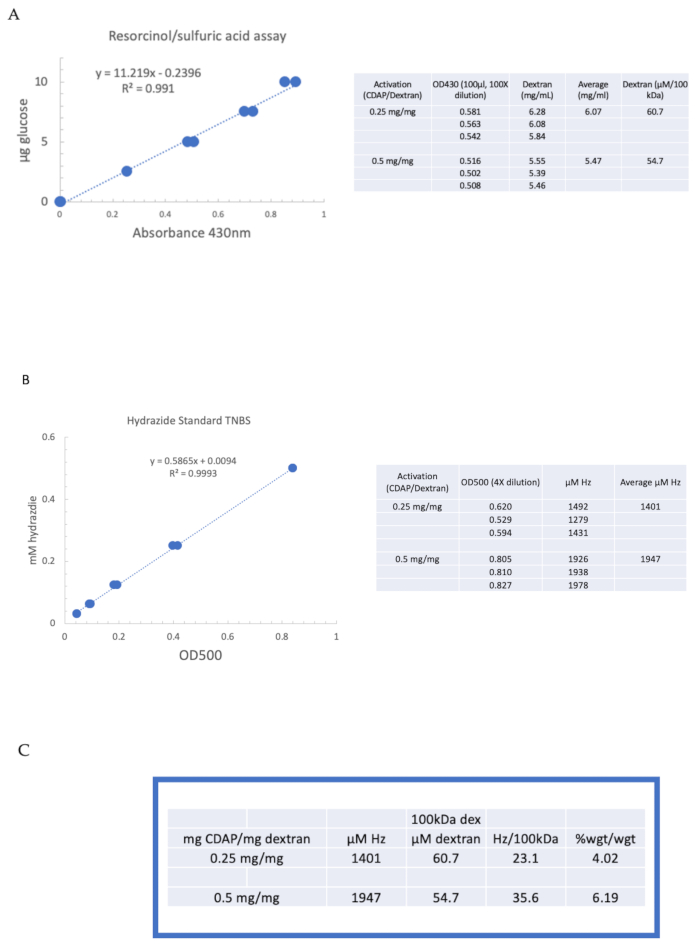
Figure 4: Representative results for CDAP activation of dextran. Typical standard curves for the (A) resorcinol/sulfuric acid and (B) TNBS assays. The assay results for dextran activated with 0.25 and 0.5 mg CDAP/mg dextran are shown. Glucose was used as the standard for the resorcinol assay. Dextran, in mg/mL, is divided by 100 kDa to give a molar concentration. The hydrazide concentration is determined using ADH as the standard and the results expressed as µM Hz. (C) Calculation of hydrazide: dextran ratios.The level of derivatization was calculated as hydrazides per 100 kDa of dextran to facilitate the comparison between polymers of different average molecular weights. The % weight ratio of g ADH/g dextran was calculated using a MW of 174 g/mole for ADH. Please click here to view a larger version of this figure.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유