Method Article
Ativação e Conjugação de Polissacarídeos Solúveis usando 1-Cyano-4-Dimethylaminopyridine Tetrafluoroborate (CDAP)
Neste Artigo
Erratum Notice
Resumo
Proteínas e ligantes contendo amina podem ser covalentemente ligados a polissacarídeos ativados pelo reagente de cianeto, 1-ciano-4-dimethylaminopyrite tetrafluoroborate (CDAP), para formar proteína covalente (ligante)-conjugados de polissacarídeos. Este artigo descreve um protocolo aprimorado para a realização da ativação de CDAP controlado a 0 °C e pH variado e a realização da subsequente conjugação dos polissacarídeos ativados.
Resumo
Vacinas conjugais são avanços notáveis na vacinação. Para a preparação de vacinas conjugadas de polissacarídeos, os polissacarídeos podem ser convenientemente funcionais e ligados a proteínas portadoras de vacinas usando tetrafluoroborate de 1-ciano-4-dimetilaminopyridina (CDAP), um reagente de cianeto fácil de lidar. O CDAP ativa polissacarídeos reagindo com grupos de hidroxil de carboidratos no pH 7-9. A estabilidade e a reatividade do CDAP são altamente dependentes do pH. O pH da reação também diminui durante a ativação devido à hidrólise do CDAP, o que faz do bom controle de pH a chave para a ativação reprodutível. O protocolo original de ativação do CDAP foi realizado à temperatura ambiente em soluções de pH 9 não oferecidas.
Devido à reação rápida sob esta condição (<3 min) e à queda rápida de pH da hidrólise rápida do CDAP, foi desafiador ajustar-se rapidamente e manter o pH de reação alvo no curto espaço de tempo. O protocolo aprimorado descrito aqui é realizado a 0 °C, o que retarda a hidrólise cdap e amplia o tempo de ativação de 3 min para ~15 min. Dimethylaminopyridina (DMAP) também foi usado como um tampão para pré-ajustar a solução de polissacarídeo ao pH de ativação de destino antes de adicionar o reagente CDAP. O maior tempo de reação, juntamente com a hidrólise CDAP mais lenta e o uso do buffer DMAP, facilita a manutenção do pH de ativação durante toda a duração do processo de ativação. O protocolo melhorado torna o processo de ativação menos frenético, mais reproduzível e mais agradável de escalar.
Introdução
As vacinas conjugadas, como as constituídas por polissacarídeos covalentemente ligados a uma proteína portadora, estão entre os avanços notáveis na vacinação1,2. Polissacarídeos, como antígenos independentes de células T, são pouco imunogênicos em bebês e não induzem memória, troca de classe ou maturação de afinidade de anticorpos3. Essas deficiências são superadas nas vacinas conjugadas de polissacarídeos4. Como a maioria dos polissacarídeos não tem uma alça química conveniente para conjugação, eles devem primeiro ser reativados ou "ativados". O polissacarídeo ativado é então ligado diretamente à proteína (ou proteína modificada) ou é funcionalizado para derivação adicional antes da conjugação4. A maioria das vacinas conjugadas de polissacarídeo licenciados usa aminação redutiva ou cianelação para ativar hidróxils de polissacarídeo. Brometo de cianogênio (CNBr), um reagente que já havia sido usado para ativar resinas cromatografias, foi inicialmente utilizado para derivação de polissacarídeo. No entanto, o CNBr requer alto pH, tipicamente ~ pH 10,5 ou superior, para desprotolar parcialmente hidróxia polisacarídeos de modo que eles são suficientemente nucleofílicos para atacar o grupo ciano. O pH alto pode ser prejudicial para polissacarídeos de laboratório base, e nem o CNBr nem o ciano-éster ativo inicialmente formado é suficientemente estável a um pH tão alto.
CDAP (1-cyano-4-dimethylaminopyrite tetrafluoroborate; Figura 1) foi introduzido por Lees et al. para uso como um agente de cianolato para a ativação de polissacarídeos5,6. CDAP, que é cristalino e fácil de manusear, foi encontrado para ativar polissacarídeos a um pH mais baixo que o CNBr e com menos reações laterais. Ao contrário do CNBr, polissacarídeos ativados pelo CDAP podem ser diretamente conjugados às proteínas, simplificando o processo de síntese. Polissacarídeos ativados pelo CDAP podem ser funcionalizados com uma diamina (por exemplo, diamina de hexano) ou um dihidrazida (por exemplo, dihidrazida adipica, ADH) para fazer polissacarídeos derivados de amino ou hidrazida. Uma alta concentração do reagente homobifuncional é usada para suprimir o crosslinking de polissacarídeos. Os polissacarídeos amino podem então ser conjugados usando qualquer uma das inúmeras técnicas utilizadas para a conjugação de proteínas. Polissacarídeos derivados de hidrazida são frequentemente acoplados a proteínas usando um reagente de carbodimídeo (por exemplo, 1-ethyl-3-(3-dimethylaminopropyl)carbodimida (EDAC))7. A otimização adicional da ativação de polissacarídeo CDAP foi descrita por Lees et al.8 e está incorporada ao protocolo descrito aqui.
Visão geral da conjugação CDAP
O protocolo CDAP pode ser conceituado como duas fases: (1) a ativação do polissacarídeo e (2) conjugação do polissacarídeo ativado com proteína ou ligante(Figura 2). O objetivo do primeiro passo é ativar eficientemente o polissacarídeo, enquanto o objetivo do segundo é conjugar eficientemente ao polissacarídeo ativado. O polissacarídeo ativado une os dois passos. Essa conceituação ajuda a focar nos elementos críticos de cada passo. A Figura 2 expande-se nessa conceituação, mostrando as reações desejadas de ativação e acoplamento, juntamente com as reações da hidrólise e reações laterais.
Durante a fase de ativação, as três principais preocupações são a estabilidade do CDAP, a reação CDAP com os hidroxis de polissacarídeo e a estabilidade do polissacarídeo ativado(Figura 3). A hidrólise CDAP aumenta com pH, assim como a hidrólise do polissacarídeo ativado e as reações laterais. No entanto, a reação cdap com o polissacarídeo é facilitada pelo aumento do pH. Ativação eficiente de polissacarídeos com CDAP requer um equilíbrio entre 1) a reatividade do polissacarídeo e CDAP e 2) a hidrólise e as reações laterais tanto do reagente quanto do polissacarídeo ativado.
No protocolo original de ativação do CDAP descrito por Lees et al.5, a ativação cdap de polissacarídeos foi realizada à temperatura ambiente em solução pH 9 não oferecida. A taxa de ativação foi considerada rápida nesta condição, e a ativação seria completa em 3 minutos. A reação também foi acompanhada pela hidrólise rápida do CDAP, causando uma rápida queda de pH da solução de reação não oferecida. Foi desafiador aumentar rapidamente e manter a reação pH no valor-alvo em um período de tempo tão curto. No protocolo descrito, a ativação foi realizada adicionando CDAP a partir de uma solução de estoque de 100 mg/mL à solução de polissacarídeo não agregada. O pH foi levantado 30 s depois com "um volume igual de trietilamina de 0,2 M". A proteína a ser conjugada foi então adicionada após 2,5 minutos à reação de ativação. Notavelmente, o pH da etapa de ativação não foi bem controlado e provavelmente excedeu inicialmente o pH alvo. A reação rápida que exigia ajuste rápido de pH dificultou o controle do processo de ativação e desafiou a escala.
Em contraste com o protocolo original, o protocolo modificado aqui descrito tem duas grandes melhorias. Primeiro, o pH da solução de polissacarídeo é pré-ajustado para o pH de ativação de alvo, usando DMAP como tampão, antes da adição do CDAP. O DMAP possui um pKa de 9.5 e, portanto, tem boa potência de buffer em torno do pH 9, e ao contrário de muitos outros buffers, o DMAP não foi encontrado para promover a hidrólise CDAP8. Além disso, o DMAP já é um processo intermediário e, portanto, não adiciona um novo componente à mistura de reação. O pré-ajuste do pH antes de adicionar CDAP elimina o grande balanço de pH no início da reação e permite uma manutenção mais eficiente do pH alvo durante a reação. A segunda melhora é realizar a reação de ativação a 0 °C, onde a taxa de hidrólise CDAP é marcadamente mais lenta do que a temperatura ambiente. Com a meia-vida do reagente mais longa a 0 °C, o tempo de ativação é aumentado de 3 min para 15 min para compensar a taxa de ativação mais lenta na temperatura mais baixa. O tempo de reação mais longo, por sua vez, facilita a manutenção do pH de reação. O uso de 0 °C também retarda a degradação de polissacarídeos sensíveis ao pH, possibilitando o preparo de conjugados deste tipo de polissacarídeo. As melhorias no protocolo tornam o processo de ativação menos frenético, mais fácil de controlar, mais reproduzível e mais agradável de escalar.
Este artigo descreve o protocolo aprimorado para a realização da ativação cdap controlada de polissacarídeo a 0 °C e em um pH alvo especificado e a realização de derivatização subsequente dos polissacarídeos ativados com ADH. Também é descrito um ensaio de ácido sulfônico trinitrobenzene (TNBS), baseado no método de Qi et al.9, para a determinação do nível de hidrazida no polissacarídeo modificado. Também é descrito um ensaio modificado para hexoses à base de ácido resorcinol e sulfúrico10, que pode ser usado para determinar uma gama mais ampla de polissacarídeos. Para obter mais informações sobre ativação e conjugação do CDAP, o leitor é encaminhado para publicações anteriores5,6,8 por Lees et al.
Protocolo
NOTA: Prepare a solução de polissacarídeo, a solução ADH, a solução DMAP e a solução de estoque CDAP com antecedência antes de executar os procedimentos de ativação e funcionalização de polissacarídeos. Coloque as soluções e equipamentos em uma localização organizada, conveniente e lógica. A reação descrita é para 10 mg de polissacarídeo e pode ser dimensionada para cima ou para baixo. Recomenda-se avaliar o protocolo em pequena escala antes de escalar.
1. Prepare a solução de polissacarídeo de 5 mg/mL, 2 mL.
- Para polissacarídeo liofilizado
- Deixe que o recipiente de polissacarídeo chegue à temperatura ambiente antes de abrir. Pesar 10 mg de polissacarídeo dentro de um tubo de tampa de parafuso usando um equilíbrio analítico. Use um eliminador estático para uma amostragem mais fácil e uma pesagem mais precisa do pó.
- Adicione 2 mL de cloreto de sódio de 0,15 M (NaCl) ao tubo para dissolver o polissacarídeo. Tampa e vórtice do tubo.
NOTA: O cloreto de sódio não afeta a reação cdap, mas pode afetar a estrutura secundária de polissacarídeo. Alguns polissacarídeos são mais solúveis em diferentes concentrações de sal. - Misture o tubo por rotação final por 12-24 h, dependendo do peso molecular de polissacarídeo, para permitir que o polissacarídeo se hidrate totalmente. Se necessário, aqueça suavemente o tubo para promover a solubilização.
- Para polissacarídeo solubilizado em solução tamponada
NOTA: Para uma ativação eficiente do CDAP, a solução de polissacarídeo não deve conter nenhum buffer, especialmente íon fosfato. Siga o procedimento abaixo para substituir o tampão por água ou solução salina e ajustar a concentração de polissacarídeo para 5 mg/mL.- Obtenha um dispositivo filtro de giro centrífuco de 4 mL ou 15 mL do corte de peso molecular apropriado (MWCO).
NOTA: O MWCO é idealmente 5-10 vezes menor do que o peso molecular do polissacarídeo. - Adicione um volume da solução de polissacarídeo tamponada contendo ~20 mg do polissacarídeo à inserção do filtro. Encha a marca completa com água ou solução salina. Tampe o filtro com força. Misture por fim-over-end algumas vezes.
- Centrifugar o dispositivo do filtro na força centrífuga sugerida pelo fabricante. Certifique-se de que o tempo de centrifugação é longo o suficiente para obter pelo menos uma redução de volume de 5 vezes após cada giro. Descarte o fluxo. Remonte o dispositivo do filtro.
- Reabastecer a inserção do filtro na marca completa com água doce ou solução salina. Tampe o filtro com força. Misture o conteúdo no filtro por rotação final -over-end ~10 vezes ou por vórtice suave; repetir o giro.
NOTA: O polissacarídeo pode se acumular na parte inferior da inserção do filtro do dispositivo centrífuga, formando um gel. Recomenda-se re mistar o retentante dentro da inserção do filtro com a recarga fresca antes do giro seguinte. - Repita o ciclo de recarga e giro por um mínimo de 3 vezes.
- Siga o exercício abaixo para recuperar o retent do polissacarídeo da inserção do filtro.
- Adicione água doce ou soro fisiológico à inserção do filtro para que o volume seja ~1 mL. Misture por pipetting para cima e para baixo ou por vórtice suave.
- Transfira todo o retentante misto para um tubo de 5 mL. Adicione 1 mL de água doce ou soro fisiológico à inserção do filtro. Enxágüe o filtro tubos para cima e para baixo ou por vórtice suave. Transfira e combine todas as enxágues com o polissacarídeo recuperado.
- Determine a concentração de polissacarídeo (consulte o ensaio de polissacarídeo na seção 7.3). Diluir o polissacarídeo com água adicional ou soro fisiológico para 5 mg/mL.
- Obtenha um dispositivo filtro de giro centrífuco de 4 mL ou 15 mL do corte de peso molecular apropriado (MWCO).
- Quando a solução de polissacarídeo estiver preparada, esfrie o tubo contendo a solução de polissacarídeo em um balde de gelo.
2. Prepare a solução de dihidrarazida de ácido adipic (ADH) de 0,5 M, 10 mL.
- Pesar 0,87 g ADH em um equilíbrio analítico, e solubilizar em 8 mL de 0,1 M HEPES (4-(2-hidroxitil)-1-piperazineethanesulfonic ácido), pH 8.
- Ajuste ao pH alvo com hidróxido de sódio de 1 M (NaOH), monitorado por um medidor de pH. Leve para 10 mL com buffer adicional e re-confirme o pH.
3. Prepare a solução DMAP de 2,5 M, 10 mL.
NOTA: O DMAP é tóxico e penetrará na pele. Use luvas de nitrito durante a realização do procedimento.
- Pesar cuidadosamente 3 g de DMAP em um tubo cônico de 50 mL. Adicione 5 ml de água ao DMAP e misture por vórtice por 5 minutos para obter uma solução nublada (~ 7 mL).
- Durante a mistura, adicione incrementos de 50 μL de ácido clorídrico de 10 N (HCl) à solução DMAP. Misture entre cada adição. Pare de adicionar quando a solução ficar clara.
- Adicione 10 N NaOH em incrementos de 25 μL para trazer a solução DMAP para ~pH 8.
- Leve a solução DMAP para 10 mL com água para dar uma solução de 2,5 M.
- Ajuste o pH da solução DMAP de 2,5 M.
NOTA: A solução DMAP muda com concentração e força iônica. Este exercício é para ajustar o estoque de 2,5 M DMAP a um pH específico para que quando misturado com 10 volumes de polissacarídeo, a solução resultante esteja próxima do pH alvo para ativação.- Prepare uma série de tubos de 1,5 mL contendo 1 mL de água ou a solução NaCl, o que foi usado para preparar a solução de polissacarídeo. Esfrie os tubos no gelo.
- Adicione 100 μL de DMAP a um tubo refrigerado. Vórtice e meça o pH com um medidor de pH. Em seguida, descarte o tubo medido.
- Se o pH medido não estiver próximo do valor-alvo, ajuste o pH do estoque DMAP com 1 M NaOH ou HCl conforme apropriado. Repetir as etapas 3.5.2 e 3.5.3 até que o pH medido esteja próximo do pH alvo.
4. Prepare a solução de estoque CDAP de 100 mg/mL
NOTA: O pó CDAP deve ser mantido bem fechado e armazenado a -20 °C e permitido chegar à temperatura ambiente antes da abertura. Use luvas de nitrito durante a realização do procedimento.
- Tare um tubo de microcentrifuge de tampa de estalo de 1,5 mL em um equilíbrio analítico. Usando uma pequena espátula, pese 10-140 mg de CDAP no tubo. Observe o peso real do CDAP.
- Determine o volume de acetonitrila necessário para preparar 100 mg/mL CDAP. Abra acetonitrilo em um capô de fumaça.
- Usando uma tubulação de volume apropriada, desenhe e solte a acetonitrila para equilibrar seu vapor na ponta da tubulação. Aguarde que o solvente escorra da ponta da tubulação após alguns segundos e esteja preparado para transferi-lo diretamente para o tubo CDAP. Desenhe o volume calculado de acetonitrila e transfira-o diretamente para o tubo CDAP. Feche a tampa.
NOTA: A acetonitrila também pode ser transferida para o tubo CDAP usando uma seringa Hamilton ou seu equivalente ao tamanho adequado. - Vórtice para solubilizar totalmente o CDAP. Coloque o tubo CDAP em um balde de gelo.
NOTA: O CDAP é estável em acetonitrila no frio. As ações solúveis podem ser mantidas a -20 °C por >1 semana. No entanto, é preferível preparar novas soluções CDAP.
5. Ativação de polissacarídeo e funcionalização de hidrazida
- Certifique-se de que todos os seguintes itens estejam prontos e soluções refrigeradas no gelo antes de iniciar a ativação: 2 mL de uma solução de polissacarídeo de 5 mg/mL em um recipiente de fundo plano e boca larga contendo uma barra de mexida, colocada em cima de um agitador magnético; Solução de estoque CDAP de 100 mg/mL; Solução de estoque DMAP de 2,5 M; um medidor de pH com uma sonda de pH semi-micro, como a sonda de 6 mm de diâmetro, calibrada para 0 °C de acordo com as instruções do fabricante; uma tubulação de 100 μL pronta para uso; um temporizador limpo e pronto para usar; uma cabeça do distribuidor de autotitrador posicionada ou tubulação de 10 μL pronta para uso; Solução 0,5 M ADH.
- Pré-ajuste o pH do polissacarídeo ao pH alvo usando DMAP.
- Coloque a sonda de pH na solução de polissacarídeo e deixe-a na solução durante todo o procedimento de ativação.
- Transfira 200 μL da solução de estoque DMAP para a solução de polissacarídeo por adição dropwise em agitação. Ajuste o pH da solução para o pH de ativação de destino. Adicione 0,1 M HCl para baixar o pH e 0,1 M NaOH para aumentar o pH. Evite exceder o pH alvo em mais de 0,1 pH unit, e mantenha a reação resfriada em um banho de água gelada durante a ativação.
- Ativação do CDAP
- Pipet 100 μL CDAP para cima e para baixo para equilibrar o vapor na ponta da tubulação. Transfira 100 μL de CDAP para a solução de polissacarídeo com agitação.
NOTA: Esta ativação utiliza 1 mg de CDAP para 1 mg de polissacarídeo como proporção inicial. A proporção pode ser aumentada ou diminuída ao otimizar a ativação. - Inicie o temporizador e monitore a mudança de pH durante toda a ativação. Mantenha a reação no pH alvo adicionando prontamente incrementos de 10 μL de 0,1 M NaOH à reação, com o auxílio de um distribuidor de autotitrador (ou pipet).
NOTA: Pode ajudar a reduzir o tempo de resposta do pH para mexer com uma sonda de pH suavemente. O pH cai mais rapidamente no início, e pode ser necessário adicionar o NaOH de 0,1 M com mais frequência. À medida que a reação prossegue, a diminuição do pH torna-se mais lenta, e a adição torna-se menos frequente. O pH deve permanecer essencialmente inalterado quando se aproxima do tempo ideal de ativação, que é de 10-15 min para ativação do pH 9.
- Pipet 100 μL CDAP para cima e para baixo para equilibrar o vapor na ponta da tubulação. Transfira 100 μL de CDAP para a solução de polissacarídeo com agitação.
- Funcionalização do ADH
- Quando o tempo ideal de ativação for atingido, adicione 2 mL de 0,5 M ADH de uma só vez ao polissacarídeo ativado em mexer. Verifique se o pH está na faixa de destino (pH 8-9 para ADH).
NOTA: Uma adição com mistura rápida minimiza a probabilidade de ambas as extremidades do dihidrazida reagirem com o polissacarídeo ativado, impedindo a ligação cruzada de polissacarídeo. - Continue mexendo a mistura de reação por pelo menos 1h. Transfira a mistura de reação para 4 °C, mas 0-20 °C é aceitável.
NOTA: A reação de funcionalização do ADH não depende fortemente da temperatura. Como o grande excesso de dihidrazida age como o reagente de saciamento, não é necessário saciar ainda mais o polissacarídeo ativado. No entanto, ao conjugar diretamente proteínas, a reação deve ser saciada, tipicamente com 1 M de glicário, pH 8-9.
- Quando o tempo ideal de ativação for atingido, adicione 2 mL de 0,5 M ADH de uma só vez ao polissacarídeo ativado em mexer. Verifique se o pH está na faixa de destino (pH 8-9 para ADH).
6. Purificação de polissacarídeo funcionalizado pela DIálise
NOTA: O produto bruto da reação de funcionalização da ADH contém uma alta concentração de ADH (0,5 M), que pode ser removido de forma mais eficiente por diálise extensiva. A filtragem de gel, seja com uma coluna ou um dispositivo de dessalagem de spin, não é tão eficiente, especialmente quando é necessário remover o contaminante adh residual.
- Determine o MWCO da membrana de diálise. Use um corte de 3 kDa para polissacarídeos menores.
NOTA: O MWCO da membrana de diálise é idealmente 5-10 vezes menor que o MW de polissacarídeo. - Escolha o formato de diálise desejado (cassetes ou tubos) e a capacidade correta do dispositivo. Certifique-se de que a capacidade do dispositivo é 2 vezes maior que o volume da amostra. Consulte as instruções dos fabricantes para o uso do dispositivo.
- Hidrate a membrana de diálise na água antes de usar. Transfira a solução de polissacarídeo derivatizada bruta para o dispositivo de diálise de acordo com as instruções dos fabricantes.
NOTA: Use luvas de nitrito para evitar contato com o DMAP. - Dialise em um recipiente cheio de 2-4 L de 1 M NaCl e uma barra de agitação. Coloque o recipiente em uma placa de mexida em uma sala fria ou dentro de uma geladeira. Mexa o dialise suave e continuamente durante a diálise.
- Depois de dialisar por pelo menos 4h, mude para 1 M NaCl fresco, e dialipto por pelo menos 12 h. Dialise contra 2 alterações de 0,15 M salina, cada uma por pelo menos 12 h. Se desejar, dilísse contra 2 trocas de água.
- Verifique se todo o ADH é removido testando o dialise durante a noite usando um teste TNBS rápido.
- Obtenha 3 tubos de borossilicato, rotule-os como controle negativo (ctrl), ctrl positivo e amostra, respectivamente.
- Ao tubo ctrl negativo, adicione 975 μL de 0,1 M de borate, pH 9.
- Ao tubo ctrl positivo, adicione 100 μL de 0,05 mM ADH (hidrazida de 0,1 mM) e 875 μL de 0,1 M de borate, pH 9.
- Ao tubo de amostra, adicione 500 μL do dialiseto noturno e 475 μL de 0,1 M de borate, pH 9.
- Adicione 25 μL de 1% de TNBS aos três tubos. Misture bem. Coloque no escuro por 1h.
- Compare a intensidade de cor dos 3 tubos em 1 h. Certifique-se de que a intensidade da cor do tubo de amostra está entre a do ctrl positivo e o ctrl negativo, o que indica que o contaminante adh está abaixo de 0,01 mM ou abaixo. Dialise mais uma vez.
NOTA: É prudente reduzir o nível do contaminante ADH o máximo possível para que o hidróxido ADH seja responsável por menos de 1% do hidróxido total no hidróxido-polisaccarídeo purificado. - Recupere o polissacarídeo derivatizado da diálise. Determine a concentração dos polissacarídeos e hidrazida. Calcule a razão hidrazida/polissacarídeo (ver seção 7). Se o polissacarídeo dialisado estiver concentrado a 5-10 mg/mL, consulte a seção 1.2.
7. Análise de polissacarídeos derivados de hidrazida
NOTA: O objetivo da análise aqui descrita é determinar a concentração de polissacarídeo, a concentração de hidrazida e o nível de derivação de hidrazida em termos da razão hidrazida/polissacarídeo.
- Preparação da amostra
NOTA: Polissacarídeos a serem avaliados precisam estar livres de impurezas de carboidratos, amina ou hidrazoida de baixo peso molecular. As amostras liofilizadas devem ser secas e sem sal para garantir uma medição precisa do peso. Normalmente, ~1 mL de uma solução de 1-2 mg/mL é adequado para ensaios.- Pesar pelo menos 10 mg da amostra de polissacarídeo liofilizada em um equilíbrio analítico, utilizando uma espátula não estática ou um eliminador estático. Dissolva o polissacarídeo na água ou soro fisiológico para uma concentração (por exemplo, 2 mg/mL) de modo que os sinais de ensaio caiam dentro da faixa linear da curva padrão.
- Misture o end-over-end e deixe tempo suficiente para a amostra se dissolver completamente. Realize a hidratação durante a noite dependendo do peso molecular do polissacarídeo.
- Ensaio de polissacarídeo: método de ácido resorcinol/sulfúrico
NOTA: O ensaio adequado para polissacarídeos dependerá da composição de carboidratos dos polímeros. O ensaio original de ácido resorcinol/sulfúrico destinava-se a açúcares de hexose10. O ensaio foi modificado aqui, elevando a temperatura do passo de aquecimento de 90 °C para 140 °C. Nesta temperatura mais alta, o ensaio perde alguma especificidade, mas pode ser usado para avaliar muitos açúcares. No entanto, ainda é necessário determinar a adequação do ensaio para um polissacarídeo particular. Triplicados são recomendados para cada ponto, mas algumas acomodações podem ser necessárias devido à capacidade do bloco de aquecimento.- Prepare 75% de ácido sulfúrico
NOTA: O ácido sulfúrico concentrado é extremamente corrosivo e pode causar queimaduras graves. Realize este procedimento em um capô de fumaça química. Despeje sempre ácido concentrado na água, não vice-versa!- Adicione 50 mL de água a uma garrafa de vidro de 200 mL. Coloque a garrafa em um banho de água fria. Adicione lentamente 150 mL de ácido sulfúrico. Tampa a garrafa para que ela seja ventilada.
- Deixe a solução equilibrar-se à temperatura ambiente. Use a solução dentro de 3 meses.
- Prepare padrões de carboidratos
- Prepare a solução de polissacarídeo não modificada a 1 mg/mL para ser usada como padrão. Alternativamente, utilize uma mistura de açúcares individuais na razão encontrada na unidade repetitiva do polissacarídeo, a 1 mg/mL da concentração total de açúcar, como padrão.
NOTA: Embora a mistura de açúcar geralmente dê o mesmo resultado que o polímero de carboidratos de composição de açúcar idêntico, isso deve ser confirmado experimentalmente.
- Prepare a solução de polissacarídeo não modificada a 1 mg/mL para ser usada como padrão. Alternativamente, utilize uma mistura de açúcares individuais na razão encontrada na unidade repetitiva do polissacarídeo, a 1 mg/mL da concentração total de açúcar, como padrão.
- Certifique-se de que o bloco de aquecimento com suportes de tubo para tubos de ensaio 13 x 100 borossilicato está funcionando. Use uma almofada protetora por baixo e ao redor do bloco de aquecimento em caso de derramamento de ácido. Pré-aqueça o bloco de aquecimento a 140 °C por uma mínima de 1h para atingir temperatura estável e uniforme através de todos os blocos utilizados.
- Rotular 13 x 100 tubos de ensaio borossilicato, triplicado para cada padrão e cada amostra. Adicione 0, 2,5, 5, 7,5, 10 μg (ou μL) do padrão de carboidratos de 1 mg/mL aos tubos padrão correspondentemente rotulados. Adicione água a cada tubo para levar o volume a 100 μL.
NOTA: A cor gerada depende de açúcares específicos. Como alguns açúcares requerem mais massa para gerar toda a gama de absorção, as quantidades reais utilizadas para a curva padrão podem variar. - Configure ensaios amostrais adicionando um volume contendo ~5 μg do polissacarídeo derivado a três tubos de amostra e leve o volume total a 100 μL com água. Alternativamente, se a concentração de polissacarídeo na amostra for desconhecida, realize uma série de diluições de 4 vezes. Teste 100 μL de cada diluição em triplicado.
- Prepare resorcinol fresco a 6 mg/mL em água desionizada (dI) imediatamente antes de usar. Vórtice até que o resorcinol esteja em solução. Adicione 100 μL de 6 mg/mL de resorcinol a cada tubo.
- Despeje cuidadosamente a quantidade estimada de 75% de ácido sulfúrico em um pequeno béquer.
NOTA: Use um jaleco, luvas de nitrilho e óculos de segurança. Tenha cuidado com gotejamentos, derramamentos e respingos. Mantenha toalhas de papel molhadas à mão para limpar qualquer gotejamento. À medida que a atividade do ácido sulfúrico muda na exposição prolongada ao ar, use uma mistura uniforme de ácido sulfúrico durante todo o ensaio. - Usando um pipettor repetitivo, adicione uniformemente 300 μL de ácido sulfúrico de 75% a cada tubo. Vórtice os tubos se misturam vigorosamente, apontando o tubo para longe enquanto o vórtice. Coloque os tubos em um bloco de aquecedor a um ritmo constante em ordem sequencial. Uma vez que todos os tubos estejam dentro, defina o temporizador para 3 minutos imediatamente.
- Em 3 min, remova os tubos em um ritmo constante na mesma ordem, e coloque-os diretamente em um rack em um banho de água gelada. Deixe os tubos até que estejam frios. Remova os tubos e deixe-os equilibrar a temperatura ambiente por ~5 minutos para evitar a condensação na cuvette durante a leitura.
- Defina um espectrofotômetro UV/VIS para ler a absorvância a 430 nm usando um cuvette de comprimento de pathlength de 10 mm. Em branco com um tubo padrão zero. Leia a absorção de todos os tubos a 430 nm.
NOTA: As cuvetas de plástico descartáveis são convenientes de usar. - Construa uma curva padrão plotando μg de padrão de carboidratos vs. A430. Consulte a Figura 4 para uma curva padrão típica usando a glicose como padrão de referência.
- Use os tubos de ensaio amostral com valores A430 que estão dentro da faixa linear da curva padrão, calcule a quantidade de μg do polissacarídeo desconhecido nos tubos de ensaio amostral da equação da curva padrão. Determinar a concentração do polissacarídeo desconhecido a partir do volume do desconhecido adicionado, contabilizando diluições. Converta a concentração em unidades de repetição mg/mL ou μM conforme necessário.
- Prepare 75% de ácido sulfúrico
- Ensaio de hidrazida usando ácido sulfônico trinitrobenzeno (TNBS)
- Prepare 0,9% NaCl contendo 0,02% de azida de sódio (tampão de amostra) dissolvendo 9 g de NaCl e 200 mgs de azida de sódio em dI H2O a um volume final de 1 L.
- Prepare 0,1 M de borato de sódio, pH 9 (tampão de ensaio), misturando 100 mL de 0,5 M de borato de sódio, pH 9, com 400 mL de dI H2O. Confirme que a solução pH é de 9 ± 0,1; ajustar se necessário.
- Prepare 1% TNBS diluindo 200 μL de 5% 2,4,6-trinitrobenzene solução de ácido sulfônico para 1 mL com dI H2O. Marque o tubo como 1% TNBS e armazene a 4 °C no escuro por uma semana.
- Prepare estoque de 50 mM ADH (equivalente a 100 mM hidrazida).
- Pese 871 mg de pó de dihirazida adiítica (ADH) utilizando um equilíbrio analítico. Dissolva o pó em uma garrafa de reagente adicionando tampão de amostra a 100 mL com o auxílio de um equilíbrio de carregador superior.
- Rotule a garrafa como hidrazida de 100 mM/50 mM ADH. Tampe a garrafa bem e armazene a 4 °C por 1 ano.
- Prepare as normas de hidrazida (0,1, 0,2, 0,3, 0,4, 0,5 e hidrazida de 0,6 mM).
- Prepare os padrões de hidrazida de 6, diluindo o estoque de hidrazida de 100 mM com tampão de amostra com o auxílio de um equilíbrio de carregador superior. Prepare 100 mL de cada padrão para minimizar o erro de concentração. Feche bem as garrafas e armazene a 4 °C por 1 ano.
- Configurando reações de ensaio
NOTA: O ensaio TNBS é executado em um volume de reação de 1 mL. Cada tubo de ensaio consiste em 100 μL de uma amostra (ou um padrão), 875 μL de tampão de ensaio e 25 μL de solução TNBS de 1%. Todas as reações de ensaio (para amostras e padrões) são configurados em triplicado.- Rotule 3 tubos de vidro borossilicato (12 x 75 mm) para cada padrão, incluindo o padrão zero. Classifique e organize os tubos padrão no rack de tubo, em ordem de maior concentração. Use uma micropipette calibrada de 100 μL ou 200 μL para adicionar com precisão 100 μL dos padrões a cada tubo correspondente. Para o padrão zero, use 100 μL de tampão de amostra.
- Rotule 3 tubos de vidro borossilicato (12 x 75 mm) para cada amostra diluída a ser avaliada. Classifique e organize os tubos de amostra no rack do tubo em conformidade. Use uma micropipette calibrada de 100 μL ou 200 μL para adicionar com precisão 100 μL da amostra a cada tubo de amostra correspondente.
- Use uma micropipette calibrada de 1000 μL para adicionar com precisão 875 μL de tampão de ensaio a todos os tubos de ensaio: os padrões e as amostras.
- Para iniciar a reação do ensaio, use uma micropipette calibrada de 100 μL para adicionar com precisão 25 μL de 1% de TNBS a cada tubo de ensaio. Comece a partir dos tubos padrão zero, mova-se para os tubos padrão em ordem de aumento da concentração, em seguida, para os tubos de amostra de acordo com a ordem pré-determinada. Mude as dicas ao iniciar um novo padrão ou uma nova amostra e mantenha o tempo gasto na adição de TNBS a todos os tubos em até 5 minutos.
- Vórtice todos os tubos de ensaio para 2 s em alta velocidade ou em uma configuração de velocidade permitindo que o líquido dentro do tubo de ensaio gire para cima para atingir uma altura de 1/2 polegada da abertura do tubo.
- Registo o tempo de início do ensaio e defina o temporizador para 2h. Coloque o rack do tubo de ensaio no escuro à temperatura ambiente por 2 h. Quando o tempo acabar, o vórtice todos os tubos mais uma vez e proceda à coleta de dados.
- Recolha de dados
- Deixe o espectrômetro UV/VIS aquecer e a linha de base estabilizar. Defina o comprimento de onda de detecção em 500 nm para o ensaio de hortênse. Use um cuvette de quartzo de 1 mL de comprimento de 1 cm para todas as medidas de absorção para todo o ensaio.
- Inicie a coleta de dados transferindo um ensaio padrão zero para o cuvette; em branco o instrumento (definir absorção a zero).
- Realize uma única leitura em cada tubo e regise os valores de absorção em uma tabela de dados. Remova qualquer líquido residual da cuvette antes de ler uma nova amostra. Comece pelos padrões zero, mude-se para os padrões de concentração crescente e, em seguida, para as amostras. Uma vez iniciado, execute todas as etapas de forma eficiente sem parar e leia todos os tubos dentro de 10 minutos.
- Analisando dados amostrais
- Crie uma curva padrão plotando o padrão mM hydrazide vs. A500. Encontre a equação de curva padrão na forma de y = ax + b, onde y representa hidrazida mM e x representa A500. Consulte a Figura 4 para uma curva padrão típica.
- Calcule o hidrazida mM nas amostras usando a equação de curva padrão, ajustando para os fatores de diluição. Escolha apenas os tubos de ensaio amostral com valores A500 que estão dentro da faixa linear da curva padrão para o cálculo.
- Calcule a razão molar de hidrazida/polissacarídeo utilizando equação (1).
Hidrazida/polissacarídeo = h / c × MW (1)
Onde h é o hidrazida mM, c é a concentração mg/mL do polissacarídeo, e MW é o peso molecular de polissacarídeo em kDa. - Calcule a densidade de rotulagem de hidrazida por 100 kDa de polissacarídeo utilizando equação (2).
Densidade de rotulagem por polissacarídeo de 100 kDa = h / c × 100 (2)
Onde h está o hidrazida mM, e c é a concentração mg/mL do polissacarídeo.
NOTA: Por conveniência, os polissacarídeos podem ser considerados com um peso molecular de 100.000 daltons. Isso permite considerar uma "densidade de rotulagem" na comparação do nível de derivatização de vários polissacarídeos. - Calcule a densidade de rotulagem de hidrazida como ADH por cento de peso.
- Determine a concentração eficaz de mg/mL de ADH usando equação(3).
mg/mL ADH = (mM hydrazide / 1000) × 174 (3)
onde 174 é o MW da ADH. - Calcule o peso % ADH usando equação(4).
peso % ADH = (mg/mL ADH) / (mg/mL polissacarídeo) × 100 (4)
- Determine a concentração eficaz de mg/mL de ADH usando equação(3).
Resultados
Para ilustrar a ativação e derivação de um polissacarídeo utilizando química CDAP, o Dextran foi ativado em 0,25 e 0,5 mg CDAP/mg dextran. Para cada reação, foi adicionada uma solução de dextran de 10 mg/mL em água no gelo e adicionado 1/10 de volume de um estoque DMAP de 2,5 M (preparado conforme descrito na seção 3). A solução final foi trazida ao pH 9 pela adição de 0,1 M NaOH em alíquotas de 10 μL. A solução foi refrigerada e agitada, acrescentou o CDAP, e o pH mantido no pH 9 adicionando alíquotas de 10 μL de 0,1 M NaOH por 15 min. Apenas 0,25 mL de 0,5 M ADH no pH 9 foi adicionado (menos do que a quantidade habitual) e a reação permitiu proceder durante a noite a 4 °C.
O dextran rotulado foi então sequencialmente dialisado contra 1 M NaCl, 0,15 M NaCl, e água como descrito na seção 6. O ADH-dextran foi então testado para dextran utilizando o ensaio de ácido resorcinol/sulfúrico (seção 7.2). Uma curva padrão típica usando glicose como padrão de açúcar é mostrada na Figura 4A. O teor de hidrazida foi determinado utilizando-se o ensaio TNBS descrito na seção 7.3. Uma curva padrão típica de hidrazida usando ADH como padrão é dada na Figura 4B.
Cálculos representativos da ativação do Dextran nos dois níveis de ativação são mostrados na Figura 4A,B. Os dados são apresentados tanto como hidrazidas por 100 kDa de polímero dextran quanto como percentual de peso de ADH para dextran, conforme descrito nas seções 7.9.3.4 e 7.9.3.5, respectivamente, na Figura 4C. O grau de derivatização aproximadamente dobrou à medida que a razão CDAP foi dobrada.
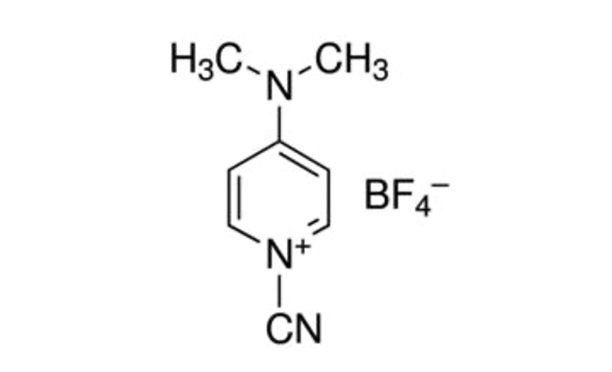
Figura 1: Estrutura química do CDAP. CDAP = 1-ciano-4-dimethylaminopyridina tetrafluoroborate. Clique aqui para ver uma versão maior desta figura.
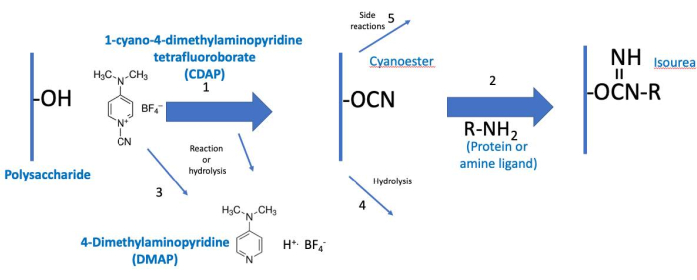
Figura 2: Processo de ativação e conjugação do CDAP. O processo é conceitualmente dividido em duas fases, com o polissacarídeo ativado comum a ambos. Em condições básicas, o CDAP ativa hidróxils de polissacarídeo, liberando DMAP (reação 1). A hidrólise CDAP também libera DMAP (reação 3). Embora um ciano-éster seja mostrado, este pode não ser o intermediário real. O intermediário é, portanto, referido como (CDAP) polissacarídeo "ativado". Durante a primeira fase de ativação, o polissacarídeo ativado pode hidratura (reação 4) ou sofrer reações laterais (reação 5). Na segunda fase de conjugação (reação 2), o polissacarídeo ativado reage com uma amina para formar uma ligação isourea estável, além das reações 4 e 5. Abreviaturas: CDAP = 1-cyano-4-dimethylaminopyridine tetrafluoroborate; DMAP = 4-dimethylaminopyridina; R-NH2 = amina. Clique aqui para ver uma versão maior desta figura.
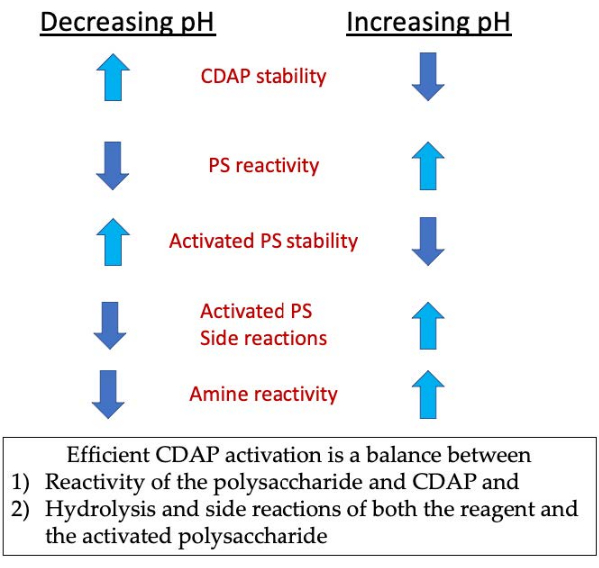
Figura 3: Ativação e conjugação do CDAP. O processo requer o equilíbrio da reatividade do CDAP com o polissacarídeo, a estabilidade do CDAP e o polissacarídeo ativado, bem como a reatividade do polissacarídeo ativado com o da amina. Clique aqui para ver uma versão maior desta figura.
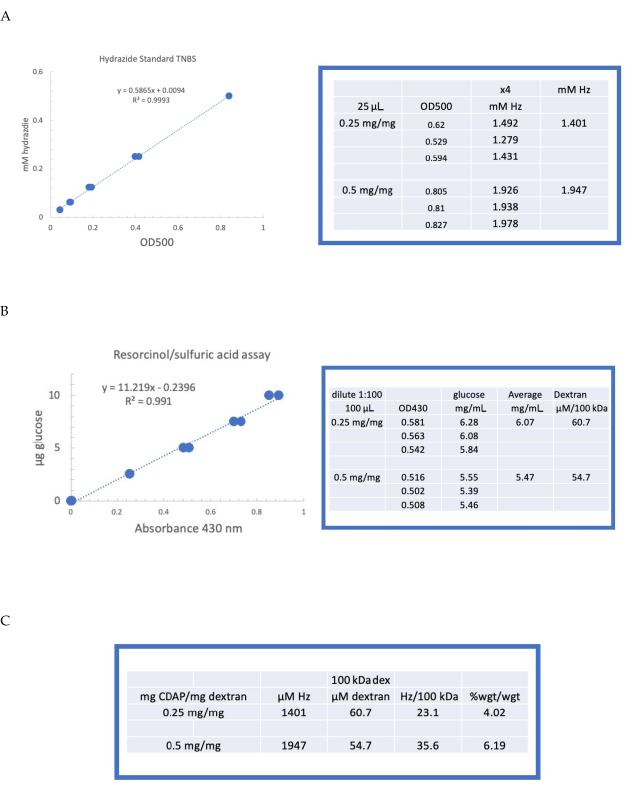
Figura 4: Resultados representativos para ativação do CDAP do Dextran. Curvas padrão típicas para o(A) ácido resorcinol/sulfúrico e(B) ensaios TNBS. Os resultados do ensaio para o Dextran ativado com 0,25 e 0,5 mg cdap/mg dextran são mostrados. A glicose foi utilizada como padrão para o ensaio resorcinol. O Dextran, em mg/mL, é dividido por 100 kDa para dar uma concentração molar. A concentração de hidrazida é determinada utilizando a TDAH como padrão e os resultados expressos como μM Hz. (C) Cálculo do hidrazida: razões dextran. O nível de derivatização foi calculado como hidrazídeos por 100 kDa de dextran para facilitar a comparação entre polímeros de diferentes pesos moleculares médios. A razão de peso de g ADH/g dextran foi calculada utilizando-se um MW de 174 g/mole para ADH. Clique aqui para ver uma versão maior desta figura.
Discussão
CDAP é um reagente conveniente para derivatizar e conjugar polissacarídeos. Este artigo descreve o método geral de uso do CDAP para derivatizar polissacarídeos com hidrazidas (PS-ADH) e incorpora melhorias publicadas recentemente8. Em primeiro lugar, a técnica enfatiza a importância de manter o pH alvo para controlar o processo de ativação. Descobrimos que, embora muitos buffers comuns interfiram na reação de ativação do CDAP, o DMAP poderia ser usado com sucesso como buffer para gerenciar o pH8. Além disso, o DMAP já é um subproduto de reação da ativação do CDAP. Finalmente, tamponar a solução de polissacarídeo com DMAP antes de adicionar o CDAP facilita a segmentação e manutenção precisas do pH de reação. Como descrevemos, é útil ajustar o pH da solução concentrada de estoque DMAP de tal forma que, quando diluído, atinge o pH alvo. Em segundo lugar, realizar o processo no frio diminuiu o tempo de reação, tornando o processo de ativação menos frenético e mais indulgente. A temperatura mais baixa diminuiu a taxa de hidrólise CDAP, e o tempo ideal de ativação no pH 9 aumenta de ~3 min para ~15 min. Além disso, menos CDAP é necessário para alcançar o mesmo nível de ativação do que quando realizado à temperatura ambiente.
Polissacarídeos derivados do TDAH podem ser conjugados a proteínas usando carbodimídeos (por exemplo, EDAC)7. Por exemplo, várias vacinas licenciadas de Haemophilus influenzae b (Hib) usam o poliribosylribitolphosphate (PRP) derivado com ADH para conjugar ao toxóide tétano usando EDAC. A CNBr foi inicialmente empregada, mas o CDAP é um reagente muito mais fácil de usar para esse fim. Em nossa experiência, uma boa faixa-alvo para derivatização de ADH é de 10-30 hidrazidas por polissacarídeo de 100 kDa ou ~1-3% ADH em peso.
O mesmo processo pode ser usado para derivatizar polissacarídeos com aminas primárias substituindo o ADH por uma diamina. Recomenda-se o uso de diamina de hexano para derivatizar polissacarídeos com aminas8. O polissacarídeo aminado (PS-NH2) pode ser conjugado utilizando reagentes desenvolvidos para conjugação proteica11. Normalmente, o PS-NH2 é derivatizado com um maleimida (por exemplo, succinimidyl 4-[N-maleimidomethyl]cyclohexane-1-carboxilato (SMCC) ou N-γ-maleimidobutyryl-oxysuccinimide ester (GMBS)), e a proteína é tialada (por exemplo, com succinimidyl 3-(2-pyridyldithio)propionato (SPDP)). A química thiol-maleimida é muito eficiente.
As proteínas também podem ser diretamente acopladas a polissacarídeos ativados pelo CDAP através da ɛ-amina em lisesinas. Embora o protocolo de ativação utilizado seja geralmente semelhante ao descrito aqui, é necessário otimizar o nível de ativação, polissacarídeo e concentração de proteínas, bem como a relação proteína:polissacarídeo5,6,8.
O Dextran é um dos polissacarídeos mais fáceis de ativar com CDAP devido à sua densidade relativamente alta de grupos hidroxil, mas alguns polissacarídeos, como o antígeno Vi, podem ser desafiadores. Consequentemente, não há um único protocolo "melhor" para a conjugação do CDAP diretamente às proteínas. Sugerimos primeiro desenvolver um protocolo para alcançar níveis adequados de ativação, determinados pela extensão da derivação de hidrazida, e depois proceder à conjugação direta de proteínas ao polissacarídeo ativado pelo CDAP.
Divulgações
Andrew Lees é fundador e proprietário da Fina Biosolutions. Ele detém várias patentes relacionadas à química do CDAP e se beneficia do licenciamento do know-how de química e conjugação do CDAP.
Agradecimentos
O trabalho aqui descrito foi financiado pela Fina Biosolutions LLC.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Sigma | 34851 | |
| Adipic acid dihydrazide | Sigma | A0638 | MW 174 |
| Amicon Ultra 15 10 kDa | Millipore | UFC901008 | MW cutoff can be 30 kDa for 200 kDa PS |
| Analytical balance | |||
| Autotitrator or electronic pipet | |||
| Beaker 2-4 L | |||
| CDAP | SAFC | RES1458C | Sigma |
| DMAP | Sigma | 107700 | MW 122.2 |
| Flake ice | |||
| HCl 1 M | VWR | BDH7202-1 | |
| Micro stir bar | VWR | 76001-878 | |
| Microfuge tube (for CDAP) | VWR | 87003-294 | |
| NaCl | VWR | BDH9286 | |
| NaOH 1 M | Sigma | 1099130001 | |
| NaOH 10 M | Sigma | SX0607N-6 | |
| pH meter | |||
| pH probe | Cole Parmer | 55510-22 | 6 mm x 110 mm Epoxy single junction |
| pH temperature probe | |||
| Pipets & tips | |||
| Saline or PBS | |||
| Small beaker 5-20 mL | VWR | 10754-696 | A 10 mL beaker allows room for pH probe & pipet |
| Small ice bucket | |||
| Small spatula | |||
| Stir plate | |||
| Resorcinol assay | |||
| Combitip | Eppendorf | 10 ml | |
| DI water | |||
| Dialysis tubing | Repligen | 132650T | Spectra/Por 6-8kDa |
| Dialysis tubing clips | Repligen | 142150 | |
| Heating block | |||
| Nitrile gloves | VWR | ||
| Repeat pipettor | Eppendorf | M4 | |
| Resorcinol | Sigma | 398047 | |
| Sugar standard | As appropriate | ||
| Sulfuric acid 75% | VWR | BT126355-1L | |
| Timer | |||
| TNBS assay | |||
| Adipic dihydrazide | Sigma | A0638 | MW 174 |
| Borosilcate test tubes 12 x 75 | VWR | 47729-570 | |
| Sodium borate, 0.5 M pH 9 | Boston Biologicals | BB-160 | |
| TNBS 5% w/v | Sigma | P2297 | MW 293.17 |
Referências
- Ellis, R. W., Granoff, D. M. . Development and clinical uses of Haemophilus B conjugate vaccines. , (1994).
- Goebel, W. F., Avery, O. T. Chemo-immunological studies on conjugated carbohydrate-proteins. Journal of Experimental Medicine. 50 (4), 533-550 (1929).
- Mond, J. J., Vos, Q., Lees, A., Snapper, C. M. T cell independent antigens. Current Opinion in Immunology. 7 (3), 349-354 (1995).
- Cruse, J. M., Lewis, R. E. . Conjugate Vaccines. 10, (1989).
- Lees, A., Nelson, B. L., Mond, J. J. Activation of soluble polysaccharides with 1-cyano-4-dimethylaminopyridinium tetrafluoroborate for use in protein-polysaccharide conjugate vaccines and immunological reagents. Vaccine. 14 (3), 190-198 (1996).
- Shafer, D. E., et al. Activation of soluble polysaccharides with 1-cyano-4-dimethylaminopyridinium tetrafluoroborate (CDAP) for use in protein-polysaccharide conjugate vaccines and immunological reagents. II. Selective crosslinking of proteins to CDAP-activated polysaccharides. Vaccine. 18 (13), 1273-1281 (2000).
- Schneerson, R., Barrera, O., Sutton, A., Robbins, J. B. Preparation, characterization, and immunogenicity of Haemophilus influenzae type b polysaccharide-protein conjugates. Journal of Experimental Medicine. 152 (2), 361-376 (1980).
- Lees, A., Barr, J. F., Gebretnsae, S. Activation of soluble polysaccharides with 1-cyano- 4-dimethylaminopyridine tetrafluoroborate (CDAP) for use in protein-polysaccharide conjugate vaccines and immunological reagents. III Optimization of CDAP activation. Vaccines. 8 (4), 777 (2020).
- Qi, X. -. Y., Keyhani, N. O., Lee, Y. C. Spectrophotometric determination of hydrazine, hydrazides, and their mixtures with trinitrobenzenesulfonic acid. Analytical biochemistry. 175 (1), 139-144 (1988).
- Monsigny, M., Petit, C., Roche, A. C. Colorimetric determination of neutral sugars by a resorcinol sulfuric acid micromethod. Analytical biochemistry. 175 (2), 525-530 (1988).
- Hermanson, G. . Bioconjugate Techniques. 3rd ed. , (2013).
Erratum
Formal Correction: Erratum: Activation and Conjugation of Soluble Polysaccharides using 1-Cyano-4-Dimethylaminopyridine Tetrafluoroborate (CDAP)
Posted by JoVE Editors on 7/09/2021. Citeable Link.
An erratum was issued for: Activation and Conjugation of Soluble Polysaccharides using 1-Cyano-4-Dimethylaminopyridine Tetrafluoroborate (CDAP). A figure was updated.
Figure 4 was updated from:

Figure 4: Representative results for CDAP activation of dextran. Typical standard curves for the (A) resorcinol/sulfuric acid and (B) TNBS assays. The assay results for dextran activated with 0.25 and 0.5 mg CDAP/mg dextran are shown. Glucose was used as the standard for the resorcinol assay. Dextran, in mg/mL, is divided by 100 kDa to give a molar concentration. The hydrazide concentration is determined using ADH as the standard and the results expressed as µM Hz. (C) Calculation of hydrazide: dextran ratios.The level of derivatization was calculated as hydrazides per 100 kDa of dextran to facilitate the comparison between polymers of different average molecular weights. The % weight ratio of g ADH/g dextran was calculated using a MW of 174 g/mole for ADH. Please click here to view a larger version of this figure.
to:
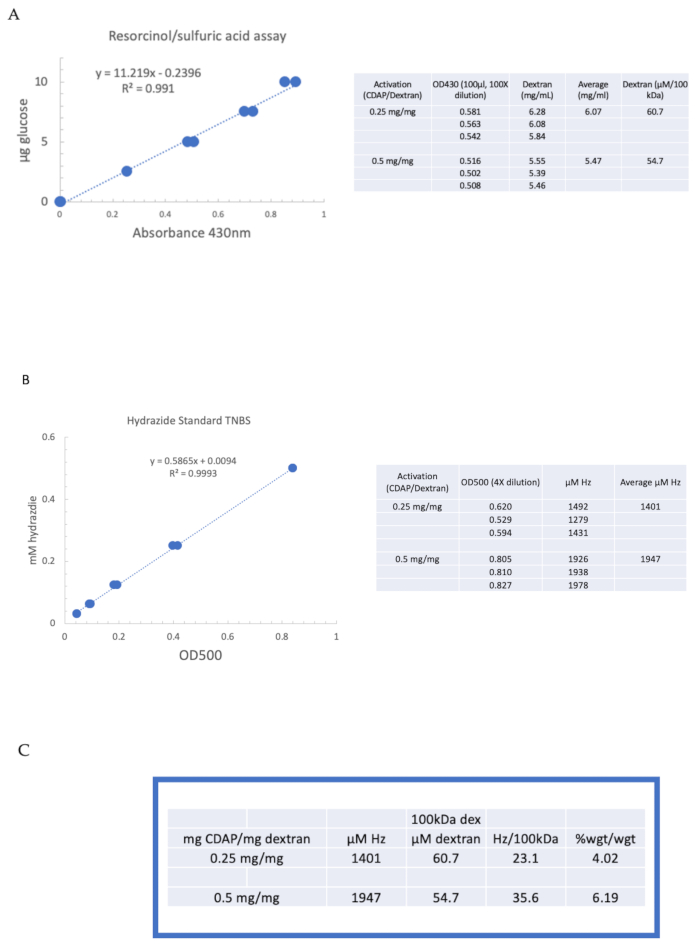
Figure 4: Representative results for CDAP activation of dextran. Typical standard curves for the (A) resorcinol/sulfuric acid and (B) TNBS assays. The assay results for dextran activated with 0.25 and 0.5 mg CDAP/mg dextran are shown. Glucose was used as the standard for the resorcinol assay. Dextran, in mg/mL, is divided by 100 kDa to give a molar concentration. The hydrazide concentration is determined using ADH as the standard and the results expressed as µM Hz. (C) Calculation of hydrazide: dextran ratios.The level of derivatization was calculated as hydrazides per 100 kDa of dextran to facilitate the comparison between polymers of different average molecular weights. The % weight ratio of g ADH/g dextran was calculated using a MW of 174 g/mole for ADH. Please click here to view a larger version of this figure.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados