A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
במבחנה בדיקת סמים נגד כל שלבי מחזור החיים של טריפנוזומה קרוזי באמצעות טפילים המבטאים β-גלקטוזידאז
In This Article
Summary
אנו מתארים בדיקה קולורימטרית בתפוקה גבוהה המודדת את פעילות β-גלקטוזידאז בשלושה שלבי מחזור חיים של טריפנוזומה קרוזי, הגורם הסיבתי של מחלת צ'אגאס. ניתן להשתמש בבדיקה זו כדי לזהות תרכובות טריפנוצידיות בצורה קלה, מהירה וניתנת לשחזור.
Abstract
טריפנוזומה קרוזי היא הסוכן הסיבתי של מחלת צ'אגאס (ChD), מחלה אנדמית בעלת חשיבות לבריאות הציבור באמריקה הלטינית המשפיעה גם על מדינות רבות שאינן אנדמיות בשל העלייה בהגירה. מחלה זו משפיעה על כמעט 8 מיליון בני אדם, כאשר מספר הנדבקים החדשים מוערך ב-50,000 בשנה. בשנות ה-60 וה-70 של המאה ה-20 הוצגו שתי תרופות לטיפול ב-ChD: ניפורטימוקס ובנזנידזול (BZN). שניהם יעילים בתינוקות ובשלב החריף של המחלה אך לא בשלב הכרוני, והשימוש בהם קשור לתופעות לוואי חשובות. עובדות אלה מדגישות את הצורך הדחוף להגביר את החיפוש אחר תרופות חדשות נגד T. cruzi.
T. cruzi מועבר דרך וקטורים של חרקים hematophagous של משפחות Reduviidae ו- Hemiptera. ברגע שהוא נמצא בפונדקאי היונקים, הוא מתרבה באופן תוך-תאי כצורת האמאסטיגוטה הלא-מודבקת ומבדיל לתוך הטריפומסטיגטה, הצורה ההדבקה הלא-מכפילה את זרם הדם. בתוך וקטור החרקים, טריפומסטיגוטים הופכים לשלב האפימסטיגוטה ומתרבים באמצעות ביקוע בינארי.
מאמר זה מתאר בדיקה המבוססת על מדידת הפעילות של הציטופלסמית β-גלקטוזידאז המשתחררת לתרבית עקב ליזה של טפילים באמצעות המצע, כלורופנול אדום β-D-גלקטופירנוזיד (CPRG). לשם כך, זן T. cruzi Dm28c עבר טרנספקטציה עם פלסמיד בעל ביטוי יתר של β-גלקטוזידאז ומשמש לבדיקה פרמקולוגית במבחנה בשלבי אפימסטיגוטה, טריפומסטיגוטה ואמאסטיגוטה. מאמר זה מתאר גם כיצד למדוד את הפעילות האנזימטית באפימסטיגוטים בתרבית, בתאי Vero נגועים ב-amastigotes ובטריפומסטיגוטים ששוחררו מהתאים בתרבית באמצעות תרופת הייחוס, benznidazole, כדוגמה. בדיקה קולורימטרית זו מבוצעת בקלות וניתן לשנות את קנה המידה שלה לתבנית בתפוקה גבוהה ולהחיל אותה על זנים אחרים של T. cruzi .
Introduction
מחלת צ'אגאס (ChD), או טריפנוסומיאזיס אמריקאית, היא מחלה טפילית הנגרמת על ידי הפרוטוזואן המופלג, טריפנוסומה קרוזי (T. cruzi). ChD מתחיל עם שלב אקוטי אסימפטומטי או אוליגוסימפטומטי שבדרך כלל אינו מאובחן, ואחריו שלב כרוני לכל החיים. בכרוניות, כ-30% מהחולים מתגלים עשרות שנים לאחר ההדבקה - מגוון מצבים מתישים, כולל שריר הלב, תסמונות מגה-עיכוליות או שניהם, עם שיעור תמותה שנע בין 0.2% ל-20%1,2,3. חולים כרוניים אסימפטומטיים עשויים להיות ללא סימנים קליניים, אך הם נשארים סרופוסיטיים לאורך כל חייהם.
ההערכות מצביעות על כך שכ-7 מיליון בני אדם נדבקו ברחבי העולם, רובם מאמריקה הלטינית, שם ChD אנדמי. במדינות אלה, T. cruzi מועבר בעיקר באמצעות חרקי טריאטומין מוצצי דם נגועים (העברה הנישאת על ידי וקטורים) ופחות על ידי העברה דרך הפה דרך בליעה של מזון מזוהם בצואה triatomine המכילה את הטפילים2. בנוסף, הטפיל יכול להיות מועבר דרך השליה מאמהות chagasic לילודים, באמצעות עירויי דם, או במהלך השתלת איברים. דרכים בלתי תלויות וקטורים אלה לרכישת הזיהום וההגירה האנושית תרמו להתפשטות העולמית של המחלה, עדות למספר גדל והולך של מקרים בצפון אמריקה, אירופה, ובכמה מדינות אפריקאיות, מזרח ים תיכוניות ומערב האוקיינוס השקט4. ChD נחשבת למחלה מוזנחת שכן העברה הנישאת על ידי וקטורים קשורה קשר הדוק לעוני והיא נושא מוביל לבריאות הציבור, במיוחד במדינות בעלות הכנסה נמוכה באמריקה הלטינית. למרות שישנם טיפולים זמינים, התמותה עקב ChD באמריקה הלטינית היא הגבוהה ביותר בקרב מחלות טפיליות, כולל מלריה2.
ישנן שתי תרופות רשומות לטיפול ChD שהוצגו בסוף שנות ה-60 ותחילת שנות ה-70 של המאה ה-20: ניפורטימוקס ובנזנידזול5. שתי התרופות יעילות בשלב החריף של המחלה במבוגרים, ילדים ותינוקות נגועים מולדת, כמו גם בילדים עם זיהום כרוני, שם בדרך כלל מושגת תרופה. עם זאת, רק אנשים מעטים מאובחנים מוקדם מספיק כדי להיות מטופלים בזמן. על פי הניסויים הקליניים האחרונים, לשתי התרופות יש מגבלות חשובות במבוגרים והן לא היו יעילות בהפחתת הסימפטומים אצל אנשים עם מחלות כרוניות; לפיכך, השימוש בהם בשלב זה שנוי במחלוקת. חסרונות אחרים הם תקופות הטיפול הממושכות הנדרשות (60-90 יום) ותופעות הלוואי השכיחות והחמורות שנצפו, המובילות להפסקת הטיפול אצל חלק מהאנשים הנגועים 6,7. ההערכה היא כי פחות מ -10% מהאנשים עם ChD אובחנו, ועוד פחות מהם יש גישה לטיפול, שכן אנשים מושפעים רבים חיים באזורים כפריים ללא גישה או גישה נדירה לשירותי בריאות8. עובדות אלה מדגישות את הצורך הדחוף במציאת תרופות חדשות נגד T. cruzi כדי לאפשר טיפולים יעילים, בטוחים וישימים יותר בשטח, במיוחד עבור השלב הכרוני. בהקשר זה, אתגר נוסף בפיתוח תרכובות יעילות יותר הוא הגבלת המערכות להערכת יעילות התרופה במבחנה וב-in vivo9.
אף על פי שביולוגיה כימית וגישות גנומיות לזיהוי מטרות פוטנציאליות של תרופות שימשו בטפילים קינטופלסטיים, הכלים הגנומיים הזמינים ב- T. cruzi מוגבלים בניגוד ל - T. brucei או Leishmania. לפיכך, סינון של תרכובות עם פעילות טריפנוצידלית הוא עדיין הגישה הנפוצה ביותר בחיפוש אחר מועמדים חדשים לתרופות כימותרפיות נגד ChD. בדרך כלל, גילוי תרופות ב - T. cruzi חייב להתחיל בבדיקת ההשפעות של תרופה חדשה בבדיקה חוץ גופית נגד שלב האפימסטיגוטה. במשך עשרות שנים, הדרך היחידה למדוד את ההשפעות המעכבות של תרכובות מועמדות על T. cruzi הייתה ספירה מיקרוסקופית ידנית, שהיא מייגעת, גוזלת זמן ותלויה במפעיל. יתר על כן, גישה זו מתאימה לבדיקת מספר קטן של תרכובות, אך אינה מקובלת על סינון בתפוקה גבוהה של ספריות תרכובות גדולות. כיום, מחקרים רבים מתחילים בניתוח של מספר עצום של תרכובות ממקורות שונים שנבדקו במבחנה, ובודקים את יכולתם לעכב את צמיחת הטפילים. הן שיטות קולורימטריות והן שיטות פלואורומטריות פותחו כדי להגדיל את התפוקה במבחנים אלה, לשפר את האובייקטיביות של ההקרנה ולהפוך את התהליך כולו לפחות מייגע9.
אחת השיטות הקולורימטריות הנפוצות ביותר מבוססת על פעילות β-גלקטוזידאז של טפילים טרנספקטים שתוארו לראשונה על ידי Bucknet ומשתפי פעולה10. האנזים β-גלקטוזידאז המבוטא על ידי הטפילים הרקומביננטיים עושה הידרוליזה של המצע הכרומוגני, כלורופנול אדום β-D-גלקטופירנוזיד (CPRG), לכלורופנול אדום, שניתן למדוד בקלות בצבע באמצעות ספקטרופוטומטר מיקרו-פלטה. לפיכך, צמיחת טפיל בנוכחות מגוון של תרכובות ניתן להעריך בו זמנית וכמות בלוחות microtiter. שיטה זו יושמה לבדיקת תרופות בצורות אפימסטיקוטה (הקיימות בווקטור החרקים), טריפומסטיגוטים, ואמאסטיגוטים תוך תאיים, שלבי היונקים של הטפיל. יתר על כן, מספר זני T. cruzi רקומביננטיים שעברו טרנספקטציה עם pBS:CL-Neo-01/BC-X-10 פלסמיד (pLacZ)10 כדי לבטא את האנזים Escherichia coli β-galactosidase כבר זמינים (וניתן לבנות חדשים), המאפשר הערכה של טפילים מיחידות הקלדה נפרדות שונות (DTUs) שאולי לא יתנהגו באופן שווה כלפי אותן תרכובות 10,11,12,13 . שיטה זו כבר שימשה בהצלחה להערכת תרכובות לפעילות מול T. cruzi בסינון בתפוקה נמוכה וגבוהה12,13. גישות דומות שימשו גם בטפילים פרוטוזואנים אחרים, כולל טוקסופלזמה גונדי ולישמניה מקסיקנה14,15.
מאמר זה מתאר ומראה שיטה מפורטת לבדיקת תרופות במבחנה כנגד כל שלבי מחזור החיים של T. cruzi באמצעות טפילים המבטאים β-גלקטוזידאז. הבדיקות המוצגות כאן בוצעו עם קו T. cruzi מבטא β-galactosidase המתקבל על ידי טרנספקציה של זן T. cruzi Dm28c מ- DTU I13 עם פלסמיד pLacZ (Dm28c/ pLacZ). בנוסף, ניתן היה להתאים את אותו פרוטוקול בקלות לזנים אחרים כדי להשוות את הביצועים בין תרכובות ובין זני T. cruzi או DTUs.
Protocol
הערה: סקירה כללית של כל התכנון הניסיוני מתוארת באיור 1.
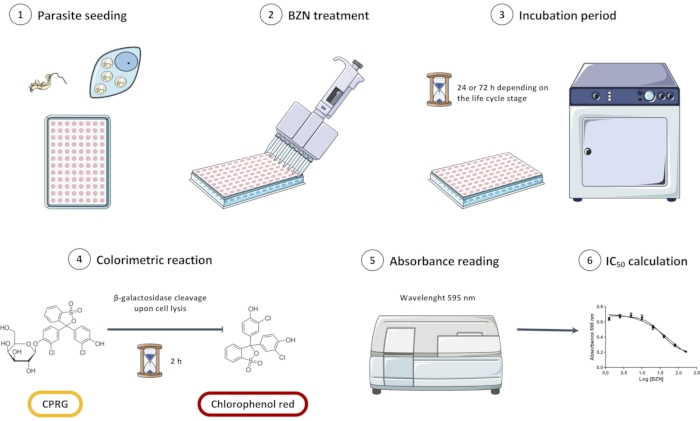
איור 1: סקירה כללית של בדיקת הסינון במבחנה של קו Tripanosoma cruzi Dm28c/pLacZ תוך שימוש ב-CPRG כמצע לתגובה הקולורימטרית. הבדיקה מורכבת מזריעת הטפילים (1), דגירה שלהם עם BZN (2 ו-3), ולאחר מכן הוספת המצע הקולורימטרי (4). כאשר טפילים משתחררים, β-גלקטוזידאז משתחרר ומבקע את CPRG לאדום כלורופנול; ניתן למדוד את השינוי הזה בצבע באופן ספקטרופוטומטרי (5). ניתן לנתח נתונים בתוכנת ניתוח סטטיסטי כדי לקבל את הריכוז המעכב למחצה (IC50) של BZN. קיצורים: CPRG = כלורופנול אדום β-D-גלקטופירנוזיד; BZN = benznidazole. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
1. הכנת פתרונות מלאי
- הכנת מדיה ופתרונות
- תמיסת ההמין (טבלה משלימה S1)
- מוסיפים את כל הרכיבים לצינור צנטריפוגה של 50 מ"ל בסדר שניתן במתכון והומוגניזציה על ידי היפוך מספר פעמים.
- עיקור על ידי סינון באמצעות מסנן 0.22 מיקרומטר.
- הכינו 1 מ"ל aliquots בצינורות מיקרוצנטריפוג 1.5 מ"ל ולשמור אותם בטמפרטורה של -80 מעלות צלזיוס עד לשימוש.
- טריפטוז בעירוי כבד (LIT) בינוני (טבלה משלימה S1)
- שקלו את כל הרכיבים וערבבו כדי ליצור הומוגניזציה בטמפרטורת החדר בכוס 1 ליטר המכילה לפחות 700 מ"ל של מים מזוקקים.
- התאימו את ה-pH ל-7.2 והגדילו את הנפח ל-900 מ"ל בצילינדר מדורג 1 ליטר עם מים מזוקקים; לעקר על ידי סינון או autoclaving (121 °C (121 °C (76 °F) למשך 20 דקות).
- השלימו את המדיום על ידי הוספת 100 מ"ל של סרום עגל עוברי (FCS), (10% FCS, סטרילי ומושבת בחום ב-56 מעלות צלזיוס למשך 45 דקות), 20 מ"ל של תמיסת גלוקוז סטרילית של 40% (מעוקרת על ידי אוטוקלבינג, 121 מעלות צלזיוס למשך 20 דקות), ו-5 מ"ל של תמיסת המין (ריכוז סופי 5 מיקרומטר) ל-900 מ"ל של מדיום LIT.
- הכינו את מדיום הנשרים המתוקן (DMEM) של Dulbecco מהאבקה בהתאם להוראות היצרן.
- מי מלח עם מאגר פוספט (PBS) (טבלה משלימה S1)
- ממיסים את כל הרכיבים המוצקים על ידי ערבוב התמיסה בטמפרטורת החדר בכוס של 1 ליטר.
- התאם את ה- pH ל- 7.2, רמה של עד 1 L בצילינדר מדורג 1 L עם מים מזוקקים, ועקר על ידי סינון או אוטוקלביזציה (121 °C (121 °C (20 דקות).
- תמיסת ההמין (טבלה משלימה S1)
- פתרונות מלאי ודילולים של Benznidazole (BZN)
הערה: טווח ריכוז ה-BZN ששימש בעבודה זו היה 2.5 עד 80 מיקרומטר.- הכן תמיסת מלאי של 1 M BZN על ידי המסת 13 מ"ג של התרופה ב 50 μL של דימתילסולפוקסיד (DMSO). בתנאים אספטיים, הכינו דילולים סדרתיים מתמיסת מלאי זו של 1 M BZN בריכוז הרצוי כפול מהריכוז הסופי הרצוי (2x solutions) בנפח סופי המתאים למספר הבארות שיש לבדוק.
הערה: חשב עבור 100 μL לבאר עם עודף של 10-20%. יש להכין את תמיסת המניות של BZN ואת כל דילולי ה- BZN מיד לפני השימוש בבדיקה בשל המסיסות הנמוכה של התרופה במדיום. - הכן 2x דילולים BZN של 160, 80, 40, 20, 10 ו- 5 μM.
- דילול 1 M BZN תמיסת מלאי בדילול של פי 100 (10 μL של 1 M BZN + 990 μL של בינוני) כדי לקבל פתרון של 10 mM במדיום המתאים המשמש לכל שלב מחזור חיים של T. cruzi. מערבבים ברציפות כדי ליצור הומוגניזציה של ההשעיה.
- דילול 10 mM BZN פתרון להכנת 320 μM BZN בתווך המתאים: 32 μL של 10 mM BZN + 968 μL של בינוני. מערבבים ברציפות כדי ליצור הומוגניזציה של ההשעיה.
- דילול 320 μM BZN פי 2 כדי לקבל ריכוז של 160 μM (500 μL של 320 μM BZN + 500 μL של בינוני). מערבבים ברציפות כדי ליצור הומוגניזציה של ההשעיה. חזור על דילול זה פי 2 עם כל פתרון שנוצר כדי לקבל פתרונות של 80, 40, 20, 10 ו- 5 μM.
- דילול DMSO פי 1,000 במדיום המתאים לשימוש כבקרה לא מטופלת (100% בקרת הישרדות).
הערה: אפימסטיגוטים סובלים מדילול של עד פי 100 של DMSO, בעוד שתאי Vero סובלים רק מדילול של עד פי 1,000 של DMSO. במידת הצורך, ניתן לכלול בקרת מוות עם 50% DMSO כתנאי ההישרדות של 0%.
- הכן תמיסת מלאי של 1 M BZN על ידי המסת 13 מ"ג של התרופה ב 50 μL של דימתילסולפוקסיד (DMSO). בתנאים אספטיים, הכינו דילולים סדרתיים מתמיסת מלאי זו של 1 M BZN בריכוז הרצוי כפול מהריכוז הסופי הרצוי (2x solutions) בנפח סופי המתאים למספר הבארות שיש לבדוק.
- פתרון מצע
- ממיסים את CPRG בריכוז של 1 מ"מ במים מזוקקים. לצלחת של 96 בארות, הוסיפו 2.4 מ"ג של CPRG ל-4 מ"ל מים.
הערה: יש להכין פתרון CPRG מיד לפני הבדיקה.
- ממיסים את CPRG בריכוז של 1 מ"מ במים מזוקקים. לצלחת של 96 בארות, הוסיפו 2.4 מ"ג של CPRG ל-4 מ"ל מים.
- פתרון ליסיס
- הכן תמיסת v/v של 2.5% של חומר ניקוי לא-יוני, שאינו מתפרק 2-[4-(2,4,4-trimethylpentan-2-yl)פנוקסי]אתנול (ראה טבלת החומרים) ב-1x PBS. הכן 1 מ"ל של התמיסה לכל צלחת 96-באר מיד לפני הבדיקה.
2. הכנת תרבית טפילים
- הכנת אפימסטיגוטה
הערה: T. cruzi Dm28c/pLacZ שורה13 משמש לאורך דוח זה.- לגדל את β-galactosidase-מבטא T. cruzi epimastigotes באופן אקסני ב 28 °C בצלוחיות תרבית תאים עם שטח צמיחה של 25 ס"מ2 (צלוחיות T-25). שמרו על התרביות בשלב הלוג על ידי תת-תרבות כל 48-72 שעות (ב-5 מ"ל) במדיום LIT בתוספת 10% FCS (טבלה משלימה S1) וגנטיקאין סולפט (G418) בריכוז סופי של 200 מיקרוגרם/מ"ל. לכמת את צמיחת הטפילים על ידי ספירת תאים בתא נויבאואר לפני תת-התרבות. סגרו היטב את המכסה ושמרו על בקבוקון התרבות (לא מאוורר) בטמפרטורה של 28 מעלות צלזיוס במצב אנכי.
הערה: G418 מבטיח מבחר ותחזוקה של פלסמידי pLacZ. לתרביות פאזה של יומן יש ריכוז אפימסטיגוטה של 1-5 × 107 טפילים/מ"ל עבור קו Dm28c/pLacZ. - הכינו השעיה של 2 × 105 אפימסטיגוטות/מ"ל מתרבית שלב יומן ב-LIT בתוספת אנטיביוטיקה G418. יש להיפטר מ-100 μL של מתלי האפימסטיגוטה לכל באר (20,000 אפימסטיגוטים ב-100 μL של LIT) של מיקרו-לוחית של 96 בארות ולהוות את הנפח הסופי ל-200 μL לבאר עם המדיום.
- לגדל את β-galactosidase-מבטא T. cruzi epimastigotes באופן אקסני ב 28 °C בצלוחיות תרבית תאים עם שטח צמיחה של 25 ס"מ2 (צלוחיות T-25). שמרו על התרביות בשלב הלוג על ידי תת-תרבות כל 48-72 שעות (ב-5 מ"ל) במדיום LIT בתוספת 10% FCS (טבלה משלימה S1) וגנטיקאין סולפט (G418) בריכוז סופי של 200 מיקרוגרם/מ"ל. לכמת את צמיחת הטפילים על ידי ספירת תאים בתא נויבאואר לפני תת-התרבות. סגרו היטב את המכסה ושמרו על בקבוקון התרבות (לא מאוורר) בטמפרטורה של 28 מעלות צלזיוס במצב אנכי.
- הכנת Amastigote
- השתמש בטריפומסטיגוטים מטא-מחזוריים ספונטניים המתקבלים מתרבית אפימסטיגוטה מיושנת (במשך 7 ימים בפרוטוקול זה) כדי לבצע זיהום ראשוני בבקבוק T-25 עם 2 × 105 תאי Vero שנזרעו בעבר ב- DMEM בתוספת 2% FCS.
- ספרו את מספר הטריפומסטיגוטים המטאזיקליים בתא נויבאואר, הדביקו את חד-שכבת תאי ה-Vero בריבוי של זיהום (MOI) של 10 ב-5 מ"ל של DMEM עם 2% FCS, ודגרו ב-37 מעלות צלזיוס ו-5% CO2 למשך 16 שעות. שטפו את הטריפומסטיגוטים הנותרים על ידי הסרת המדיום מהבקבוקון עם פיפטה סטרילית של 5 מ"ל, ואז הוסיפו 5 מ"ל של 1x PBS ושאפו. לבסוף, הוסף 5 מ"ל של DMEM עם 2% FCS ודגירה באותם תנאים.
- השתמש בטריפומסטיגוטים המתעוררים מהחד-שכבתית של תאי Vero הנגועים כדי לשמור על הזיהום בבקבוקי T-25 עם 2 × 105 תאי Vero ב- DMEM עם 2% FCS, מה שיוצר בקבוק נגוע חדש מדי שבוע.
הערה: לאחר 5-7 ימים, טריפומסטיגוטים מתחילים לצוץ והם נראים בסופרנאטנט. אין להוסיף G418 לטריפומסטיגוטים המשמשים להדבקת התאים או התאים הנגועים, מכיוון שקו תאי Vero אינו עמיד בפני G418.
- הכינו תרחיף של 1 × 105 תאי Vero/mL ב-DMEM בתוספת 2% FCS וזרע 100 μL של ההשעיה לכל באר בצלחות תרבית רקמה של 96 באר (10,000 תאים לבאר). דגירה למשך הלילה (12-16 שעות) בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 כדי להבטיח היצמדות לתאים בתחתית הבארות.
- לאחר הדגירה של הלילה, יש לשטוף את חד שכבת תאי Vero שלוש פעמים עם 100 μL של PBS סטרילי 1x. הוסף T. cruzi Dm28c/pLacZ trypomastigotes (שהתקבל מזיהום קודם בבקבוק T-25, שלב 2.2.1) ב- MOI של 10 ב- 100 μL של DMEM בתוספת 2% FCS לבאר (100,000 טריפומסטיגוטות לבאר).
- דגירה של הצלחות למשך 6 שעות ב-37 מעלות צלזיוס ו-5% CO2. לאחר תקופת דגירה זו, שטפו את הצלחות פעמיים עם 1x PBS, והוסיפו 100 μL של DMEM ללא פנול אדום בתוספת 2% FCS.
הערה: לאחר 48 שעות (יומיים לאחר ההדבקה), ניתן לראות אמסטיגוטים תוך-ציטופלסמיים באמצעות מיקרוסקופ אופטי. פנול אדום, מחוון pH ב-DMEM ובמדיה אחרת של תרביות תאים, עלול להפריע למדידת הספיגה של CPRG. אם DMEM ללא אדום פנול אינו זמין, ראה חלופות המוזכרות להלן בסעיף 3.2.1.
- השתמש בטריפומסטיגוטים מטא-מחזוריים ספונטניים המתקבלים מתרבית אפימסטיגוטה מיושנת (במשך 7 ימים בפרוטוקול זה) כדי לבצע זיהום ראשוני בבקבוק T-25 עם 2 × 105 תאי Vero שנזרעו בעבר ב- DMEM בתוספת 2% FCS.
- הכנת טריפומסטיגטה
- הכינו תרחיף של 1 × 106 תאי Vero/mL ב-DMEM בתוספת 2% FCS וזרע 800,000 תאים ב-5 מ"ל מהמדיום בצלוחיות T-25. דגירה למשך הלילה (12-16 שעות) ב-37 מעלות צלזיוס ו-5% CO2 כדי להבטיח את דבקות התאים.
הערה: עבור בקבוק T-75, זרע 2 × 106 תאים בנפח סופי של 15 מ"ל. - לאחר הדגירה, יש לשטוף פעמיים עם 3 מ"ל של PBS סטרילי 1x. הוסף T. cruzi Dm28c/pLacZ trypomastigotes ב- MOI של 10 ב-5 מ"ל של DMEM עם 2% FCS (8 × 106 טריפומסטיגוטים עבור בקבוקון T-25).
הערה: עבור בקבוקון T-75, הוסף 20 × 106 טריפומסטיגוטות בנפח סופי של 15 מ"ל של DMEM עם 2% FCS. - דגירה למשך הלילה (12-16 שעות) ב-37 מעלות צלזיוס ו-5% CO2. שטפו את הבקבוקון פעמיים עם 3 מ"ל של 1x PBS, והוסיפו 5 מ"ל של DMEM טרי בתוספת 2% FCS. דגירה ב-37 מעלות צלזיוס ו-5% CO2 למשך ארבעה ימים.
- בדוק את הסופרנטנט עבור טריפומסטיגוטים תחת מיקרוסקופ אופטי. לכמת את הטריפומסטיגוטים על ידי ספירתם בתא נויבאואר. אספו את הסופרנט בצינור 15 מ"ל וצנטריפוגה ב-7,000 × גרם למשך 10 דקות בטמפרטורת החדר.
- יש להשליך את הסופרנטנט ולבצע החייאה של הכדור כדי לקבל ריכוז של 1 × 106 טריפומסטיגוטים/מ"ל ב-DMEM ללא פנול אדום בתוספת 2% FCS. זרע 100 μL של מתלה טריפומסטיגוט (100,000 טריפומסטיגוטות לבאר) בצלחת של 96 באר.
הערה: אם DMEM ללא פנול אדום אינו זמין, ראה חלופות להלן בסעיף 3.2.1.
- הכינו תרחיף של 1 × 106 תאי Vero/mL ב-DMEM בתוספת 2% FCS וזרע 800,000 תאים ב-5 מ"ל מהמדיום בצלוחיות T-25. דגירה למשך הלילה (12-16 שעות) ב-37 מעלות צלזיוס ו-5% CO2 כדי להבטיח את דבקות התאים.
3. בדיקת β-גלקטוזידאז
הערה: כמות הפעילות של β-galactosidase משמשת כדרך עקיפה לקביעת מספר הטפילים. צפוי כי הצמיחה תעוכב בנוכחות תרכובת טריפנוצידלית, מה שיוביל למספר נמוך יותר של טפילים בהשוואה לבקרה הלא מטופלת, אשר יבוא לידי ביטוי בפעילות נמוכה יותר של β-גלקטוזידאז ולכן ספיגה נמוכה יותר.
- דגירה של הטפילים עם BZN.
- הוסף 100 μL של תמיסת BZN 2x מתאימה לכל באר כדי להגיע לריכוז סופי של BZN של 80, 40, 20, 10, 5 ו- 2.5 μM עד 100 μL של תרחיף אפימסטיגוטה (משלב 2.1), תאי Vero עם amastigotes (2 ימים לאחר ההדבקה) (שלב 2.2), או tripomastigotes (שלב 2.3) בצלחת של 96 בארות.
- הדגירה של האפימסטיגוטים בטמפרטורה של 28 מעלות צלזיוס למשך 72 שעות, והטריפומסטיגוטים או תאי Vero נגועים עם אמסטיגוטים במשך 24 שעות ב-37 מעלות צלזיוס ו-5% CO2.
הערה: יש להעריך כל ריכוז תרופה לפחות במשולש ולכלול תרביות בקרה של אפימסטיגוטים, טריפומסטיגוטים ותאי Vero נגועים ב-DMSO (ראו שלב 1.2.2.2.4).
- תגובה קולורימטרית
- לאחר תקופת הדגירה של הטיפול, אם תאי Vero נגועים או טריפומסטיגוטים נמצאים ב- DMEM עם אדום פנול, החלף את המדיום ב- 100 μL של 1x PBS כדי למנוע הפרעה. בצע בארות ריקות משולשות המכילות רק 100 μL של תווך מתאים (או 1x PBS לפי הצורך).
הערה: אין צורך להסיר את מדיום התרבות עבור אפימסטיגוטים במקרה של מדיום LIT או DMEM ללא פנול אדום. DMEM עם אדום פנול עדיין ניתן להשתמש; להכין באר ריקה עם DMEM בלבד כדי למדוד את ספיגת הבסיס ולאחר מכן להפחית ערך זה במהלך ניתוח נתונים (שלב 3.3.). מדיום החרקים של שניידר, שהוא חסר צבע, הוא אלטרנטיבה לאפימסטיגוטים. - הוסף 40 μL של תמיסת מצע CPRG ו- 10 μL של תמיסת חומרי הניקוי לכל באר, וקבל ריכוז סופי של 200 μM CPRG ודטרגנט של 0.1% בנפח סופי של 250 μL בכל באר.
הערה: ניתן לחבר את תמיסת ה-CPRG וחומרי הניקוי יחד בנפח סופי של 50 μL לבאר. - דגירה בטמפרטורה של 37 מעלות צלזיוס למשך 2 שעות ומדוד את הספיגה ב-595 ננומטר בספקטרופוטומטר מיקרו-פלטה.
הערה: שינוי הצבע הצפוי הוא צהוב עד חום-אדמדם על ביקוע אנזימטי β-גלקטוזידאז (איור 2A). ניתן להאריך את זמן הדגירה עד 4 שעות, וניתן לקרוא את ספקטרום הספיגה של כלורופנול אדום בין 570 ל-595 ננומטר עם אביזרי עקומה דומים (איור משלים S1A,B). דגירה של עד 24 שעות בנוכחות מצע CPRG הראתה אביזרי עקומה דומים (איור משלים S1C).- בספקטרופוטומטר מיקרו-פלטה עם בורר מונוכרומטורים, צור פרוטוקול חדש בתוכנת הציוד (איור משלים S2).
- לחץ על ספיגה כשיטת זיהוי | נקודת קצה כסוג קריאה | בסדר (איור משלים S2A). הוסף שלב קריאה, הקלד את אורך הגל שנבחר ולחץ על אישור (איור משלים S2B).
- במקטע פריסת לוח , סמנו את הבארות לקריאה ולחצו על 'אישור' (איור משלים S2C). כדי לקרוא את הצלחת, הכנס אותה למגש ולחץ על קרא צלחת. המתן עד שהערכים יופיעו על המסך (איור משלים S2D) וייצא אותם לגיליון אלקטרוני כדי לנתח את התוצאות.
- לאחר תקופת הדגירה של הטיפול, אם תאי Vero נגועים או טריפומסטיגוטים נמצאים ב- DMEM עם אדום פנול, החלף את המדיום ב- 100 μL של 1x PBS כדי למנוע הפרעה. בצע בארות ריקות משולשות המכילות רק 100 μL של תווך מתאים (או 1x PBS לפי הצורך).
- ניתוח נתונים וחישוב ריכוז מעכבי מדיה (IC50)
- הפחת את הערך הנמדד הריק, המתאים רק למדיום LIT, 1x PBS או DMEM עם או בלי אדום פנול בתוספת תמיסת דטרגנט CPRG. בעת בדיקת הפעילות הטריפנוצידלית של תרכובות צבעוניות, מדוד את הספיגה של בקרות ריקות נוספות עם LIT או DMEM עם כל ריכוז של תרופה בשימוש ולאחר מכן הפחת ערכים אלה מערכי הספיגה המתקבלים עם הטפילים בכל ריכוז.
הערה: טבלה משלימה S2 מציגה ערכים אופייניים המתקבלים בבדיקה זו עם מדיה זו ללא טפילים בתוספת תמיסת דטרגנט CPRG. ההבדלים לפני ואחרי הוספת CPRG הם משמעותיים אך אינם מפריעים לבדיקה עם טפילים (טבלה משלימה S2). - בתוכנת ניתוח סטטיסטי, שרטטו את הריכוז של BZN (ב-μM) לעומת הספיגה ב-595 ננומטר בטבלת xy. המיר את ריכוזי ה-BZN לערכים לוגריתמיים על-ידי לחיצה על הלחצן 'נתח', בחירה באפשרות 'שינוי צורה' | להמיר את ערכי ה-x באמצעות x=log(x) ולחיצה על הלחצן 'אישור'.
- קבל את ערכי IC50 מתוכנת הניתוח הסטטיסטי.
הערה: ה- IC50 מוגדר כריכוז התרופה המפחית את צמיחת הטפילים ב -50% בהשוואה לבקרה הלא מטופלת ומחושב כנקודת הניפוח של הפונקציה הסיגמואידלית המתאימה לעקומה.- בתוכנת הניתוח הסטטיסטי, לחץ על לחצן נתח , בחר רגרסיה לא ליניארית (התאמת עקומה) ברשימת ניתוח xy ולחץ על אישור.
- בכרטיסיית המודל של חלון הפרמטרים , בקבוצת המינון-תגובה - עיכוב של משוואות מובנות, בחר את שיטת מינון-התגובה של האופציה: log(inhibitor) לעומת תגובה - שיפוע משתנה (ארבעה פרמטרים). השאר את כל הכרטיסיות האחרות בערכי ברירת המחדל; לחץ על אישור.
- לחץ על סעיף התוצאות של תוכנת הניתוח הסטטיסטי כדי למצוא את הערך IC50, את ה- SD ואת טובת ההתאמה.
- לחץ על קטע הגרף כדי למצוא את גרף xy של הריכוז הלוגריתמי של התרופה לעומת ערכי הספיגה . חפש את התאמת העקומה הוא גם בגרף בצבע אחר.
הערה: ניתן למצוא כלי חישוב מקוון חינם של IC50 בכתובת https://www.aatbio.com/tools/ic50-calculator.
- הפחת את הערך הנמדד הריק, המתאים רק למדיום LIT, 1x PBS או DMEM עם או בלי אדום פנול בתוספת תמיסת דטרגנט CPRG. בעת בדיקת הפעילות הטריפנוצידלית של תרכובות צבעוניות, מדוד את הספיגה של בקרות ריקות נוספות עם LIT או DMEM עם כל ריכוז של תרופה בשימוש ולאחר מכן הפחת ערכים אלה מערכי הספיגה המתקבלים עם הטפילים בכל ריכוז.
תוצאות
בעקבות הפרוטוקול שתואר לעיל, β-galactosidase-מבטאי Dm28c epimastigotes היו דגירה עם 6 ריכוזים של BZN (2.5, 5, 10, 20, 40, 80 μM) (או תרכובות עניין) (או תרכובות עניין) במשך 72 שעות. לאחר תקופה זו נוסף ריאגנט CPRG יחד עם חומר ניקוי, אשר מזיז את התאים ומשחרר β-גלקטוזידאז. CPRG נבקע על ידי β-גלקטוזידאז כדי לייצר כלורופנול אדום, מה ש...
Discussion
מאמר זה מתאר בדיקה המבוססת על קביעת הפעילות הציטופלסמית β-גלקטוזידאז ששוחררה עקב תזה של T. cruzi epimastigotes, טריפומסטיגוטים, או תאים נגועים עם amastigotes בנוכחות המצע CPRG. השתמשנו בטפילי T. cruzi Dm28c/pLacZ, זן טפיל יציב המתקבל לאחר טרנספקציה עם פלסמיד נושא β-גלקטוזידאז שנבנה על ידי באקנר ומחבריו המ?...
Disclosures
למחברים אין ניגוד עניינים לחשוף.
Acknowledgements
אנו מודים לד"ר באקנר על שסיפק בחביבות את הפלסמיד pLacZ. עבודה זו נתמכה על ידי הסוכנות Nacional de Promoción Científica y Tecnológica, Ministerio de Ciencia e Innovación Productiva מארגנטינה (PICT2016-0439, PICT2019-0526, PICT2019-4212), ומועצת המחקר של בריטניה [MR/P027989/1]. אמנות רפואית Servier שימשה ליצירת איור 1 (https://smart.servier.com).
Materials
| Name | Company | Catalog Number | Comments |
| 1 L beaker | Schott Duran | 10005227 | |
| 10 mL serological pipette sterile | Jet Biofil | GSP211010 | |
| 5 mL serological pipette sterile | Jet Biofil | GSP010005 | |
| 96-well plates | Corning | 3599 | |
| Benznidazole | Sigma Aldrich | 419656 | N-Benzyl-2-nitro-1H-imidazole-1-acetamide |
| Biosafty Cabinet | Telstar | Bio II A/P | |
| Centrifuge tube 15 mL conical bottom sterile | Tarson | 546021 | |
| Centrifuge tube 50 mL conical bottom sterile | Tarson | 546041 | |
| CO2 Incubator | Sanyo | MCO-15A | |
| CPRG | Roche | 10 884308001 | Chlorophenol Red-β-D-galactopyranoside |
| DMEM, High Glucose | Thermo Fisher Cientific | 12100046 | Powder |
| DMSO | Sintorgan | SIN-061 | Dimethylsulfoxid |
| Fetal Calf Serum | Internegocios SA | FCS FRA 500 | Sterile and heat-inactivated |
| G418 disulphate salt solution | Roche | G418-RO | stock concentration: 50 mg/mL |
| Glucose D(+) | Cicarelli | 716214 | |
| Graduated cylinder | Nalgene | 3663-1000 | |
| Hemin | Frontier Scientific | H651-9 | |
| KCl | Cicarelli | 867212 | |
| Liver Infusion | Difco | 226920 | |
| Microcentrifuge tube 1.5 mL | Tarson | 500010-N | |
| Microplate Spectrophotometer | Biotek | Synergy HTX | |
| Na2HPO4 | Cicarelli | 834214 | |
| NaCl | Cicarelli | 750214 | |
| Neubauer chamber | Boeco | BOE 01 | |
| Nonidet P-40 | Antrace | NIDP40 | 2-[4-(2,4,4-trimethylpentan-2-yl)phenoxy]ethanol |
| Prism | Graphpad | Statistical Analysis software | |
| Sodium Bicarbonate | Cicarelli | 929211 | NaHCO3 |
| Sorvall ST 16 Centrifuge | Thermo Fisher Cientific | 75004380 | |
| T-25 flasks | Corning | 430639 | |
| Tryptose | Merck | 1106760500 | |
| Vero cells | ATCC | CRL-1587 |
References
- Rassi, A., Rassi, A., Rassi, S. G. Predictors of mortality in chronic Chagas disease: a systematic review of observational studies. Circulation. 115 (9), 1101-1108 (2007).
- Pérez-Molina, J. A., Molina, I. Chagas disease. The Lancet. 391 (10115), 82-94 (2018).
- Messenger, L. A., Miles, M. A., Bern, C. Between a bug and a hard place: Trypanosoma cruzi genetic diversity and the clinical outcomes of Chagas disease. Expert Review of Anti-infective Therapy. 13 (8), 995-1029 (2015).
- Steverding, D. The history of Chagas disease. Parasites & Vectors. 7, 317 (2014).
- Viotti, R., et al. Towards a paradigm shift in the treatment of chronic Chagas disease. Antimicrobial Agents and Chemotherapy. 58 (2), 635-639 (2014).
- Bern, C. Chagas’ Disease. The New England Journal of Medicine. 373 (19), 1882 (2015).
- Bustamante, J. M., Tarleton, R. L. Methodological advances in drug discovery for Chagas disease. Expert Opinion on Drug Discovery. 6 (6), 653-661 (2011).
- Buckner, F. S., Verlinde, C. L., La Flamme, A. C., Van Voorhis, W. C. Efficient technique for screening drugs for activity against Trypanosoma cruzi using parasites expressing beta-galactosidase. Antimicrobial Agents and Chemotherapy. 40 (11), 2592-2597 (1996).
- Vega, C., Rolón, M., Martínez-Fernández, A. R., Escario, J. A., Gómez-Barrio, A. A new pharmacological screening assay with Trypanosoma cruzi epimastigotes expressing beta-galactosidase. Parasitology Research. 95 (4), 296-298 (2005).
- Bettiol, E., et al. Identification of three classes of heteroaromatic compounds with activity against intracellular Trypanosoma cruzi by chemical library screening. PLoS Neglected Tropical Diseases. 3 (2), 384 (2009).
- Gulin, J. E. N., et al. Optimization and biological validation of an in vitro assay using the transfected Dm28c/pLacZ Trypanosoma cruzi strain. Biology Methods and Protocols. 6 (1), 004 (2021).
- da Silva Santos, A. C., Moura, D. M. N., Dos Santos, T. A. R., de Melo Neto, O. P., Pereira, V. R. A. Assessment of Leishmania cell lines expressing high levels of beta-galactosidase as alternative tools for the evaluation of anti-leishmanial drug activity. Journal of Microbiological Methods. 166, 105732 (2019).
- McFadden, D. C., Seeber, F., Boothroyd, J. C. Use of Toxoplasma gondii expressing beta-galactosidase for colorimetric assessment of drug activity in vitro. Antimicrobial Agents and Chemotherapy. 41 (9), 1849-1853 (1997).
- Moreno-Viguri, E., et al. In vitro and in vivo anti-Trypanosoma cruzi activity of new arylamine Mannich base-type derivatives. Journal of Medicinal Chemistry. 59 (24), 10929-10945 (2016).
- García, P., Alonso, V. L., Serra, E., Escalante, A. M., Furlan, R. L. E. Discovery of a biologically active bromodomain inhibitor by target-directed dynamic combinatorial chemistry. ACS Medicinal Chemistry Letters. 9 (10), 1002-1006 (2018).
- Vela, A., et al. In vitro susceptibility of Trypanosoma cruzi discrete typing units (DTUs) to benznidazole: A systematic review and meta-analysis. PLoS Neglected Tropical Diseases. 15 (3), 0009269 (2021).
- Alonso-Padilla, J., Rodríguez, A. High throughput screening for anti-Trypanosoma cruzi drug discovery. PLoS Neglected Tropical Diseases. 8 (12), 3259 (2014).
- Martinez-Peinado, N., et al. Amaryllidaceae alkaloids with anti-Trypanosoma cruzi activity. Parasites & Vectors. 13 (1), 299 (2020).
- Puente, V., Demaria, A., Frank, F. M., Batlle, A., Lombardo, M. E. Anti-parasitic effect of vitamin C alone and in combination with benznidazole against Trypanosoma cruzi. PLoS Neglected Tropical Diseases. 12 (9), 0006764 (2018).
- Muelas-Serrano, S., Nogal-Ruiz, J. J., Gómez-Barrio, A. Setting of a colorimetric method to determine the viability of Trypanosoma cruzi epimastigotes. Parasitology Research. 86 (12), 999-1002 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved