É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
In vitro Triagem de drogas contra todas as etapas do ciclo de vida de Trypanosoma cruzi usando parasitas expressando β-galactosidase
Neste Artigo
Resumo
Descrevemos um ensaio colorimétrico de alta produtividade medindo β-galactosidase atividade em três estágios do ciclo de vida de Trypanosoma cruzi, o agente causador da doença de Chagas. Este ensaio pode ser usado para identificar compostos trypanocidas de forma fácil, rápida e reprodutível.
Resumo
Trypanosoma cruzi é o agente causador da doença de Chagas (ACS), uma doença endêmica de importância da saúde pública na América Latina que também afeta muitos países não endêmicas devido ao aumento da migração. Essa doença afeta cerca de 8 milhões de pessoas, com novos casos estimados em 50.000 por ano. Nas décadas de 1960 e 1970, foram introduzidos dois medicamentos para tratamento de ChD: nifurtimox e benznidazol (BZN). Ambos são eficazes em recém-nascidos e durante a fase aguda da doença, mas não na fase crônica, e seu uso está associado a efeitos colaterais importantes. Esses fatos ressaltam a necessidade urgente de intensificar a busca por novas drogas contra T. cruzi.
T. cruzi é transmitido através de vetores de insetos hematófagos das famílias Reduviidae e Hemiptera. Uma vez no hospedeiro mamífero, multiplica-se intracelularmente como a forma amastigote não sinalizada e se diferencia no trippomastigote, a corrente sanguínea não-replicativa forma infecciosa. Dentro do vetor de insetos, os tripuladores se transformam no estágio de epimastigote e se multiplicam através da fissão binária.
Este artigo descreve um ensaio baseado na medição da atividade do β-galactosidase citoplasmático lançado na cultura devido à lise de parasitas usando o substrato, clorofenol vermelho β-D-galactopyranoside (CPRG). Para isso, a cepa T. cruzi Dm28c foi transfeinada com um plasmídeo de β-galactosidase-sobreexpresso e usado para triagem farmacológica in vitro em estágios de epimastigote, tripomastigote e amastigote. Este artigo também descreve como medir a atividade enzimática em epimastigotes cultivados, células Vero infectadas com amastigotes, e tripulações liberadas das células cultivadas usando a droga de referência, benznidazol, como exemplo. Este ensaio colorimétrico é facilmente executado e pode ser dimensionado para um formato de alto rendimento e aplicado a outras cepas T. cruzi .
Introdução
A doença de Chagas (CHD), ou trippanosomiase americana, é uma doença parasitária causada pelo protozoário flagelado, Trypanosoma cruzi (T. cruzi). A CD começa com uma fase aguda assintomática ou oligossintomática que geralmente não é diagnosticada, seguida de uma fase crônica ao longo da vida. Na cronidade, ~30% dos pacientes se manifestam décadas após a infecção - uma variedade de condições debilitantes, incluindo miocardiopatia, síndromes mega-digestivas, ou ambos, com uma taxa de mortalidade variando de 0,2% a 20%1,2,3. Pacientes crônicos assintomáticos podem não ter sinais clínicos, mas permanecem soropositivos ao longo de sua vida.
Estimativas sugerem que ~7 milhões de pessoas estão infectadas em todo o mundo, principalmente da América Latina, onde o ChD é endêmico. Nesses países, t. cruzi é transmitido principalmente através de insetos de triatomina sugadores de sangue infectados (transmissão transmitida por vetores) e menos frequentemente pela transmissão oral através da ingestão de alimentos contaminados com fezes de triatomina contendo os parasitas2. Além disso, o parasita pode ser transmitido através da placenta de mães chagásicas para recém-nascidos, através de transfusões de sangue, ou durante o transplante de órgãos. Essas formas independentes de adquirir a infecção e a migração humana contribuíram para a disseminação mundial da doença, evidenciada por um número crescente de casos na América do Norte, Europa e alguns países africanos, do Mediterrâneo Oriental e do Pacífico Ocidental4. A ACS é considerada uma doença negligenciada, pois a transmissão transmitida por vetores está intimamente associada à pobreza e é um dos principais problemas de saúde pública, especialmente nos países latino-americanos de baixa renda. Embora existam tratamentos disponíveis, a mortalidade por AC Na América Latina é a mais alta entre as doenças parasitárias, incluindo a malária2.
Existem dois medicamentos registrados para o tratamento de ChD introduzidos no final da década de 1960 e início da década de 1970: nifurtimox e benznidazol5. Ambas as drogas são eficazes na fase aguda da doença em adultos, crianças e recém-nascidos infectados congênitas, bem como em crianças com infecção crônica, onde a cura é geralmente alcançada. No entanto, apenas algumas pessoas são diagnosticadas precocemente o suficiente para serem tratadas a tempo. De acordo com os últimos ensaios clínicos, ambos os fármacos têm limitações importantes em adultos e foram ineficazes na redução de sintomas em pessoas com doença crônica; portanto, seu uso nesta fase é controverso. Outras desvantagens são os períodos prolongados de tratamento exigidos (60-90 dias) e os efeitos adversos frequentes e graves observados, que levam à interrupção da terapia em proporção de pessoas infectadas 6,7. Estima-se que menos de 10% das pessoas com ACS foram diagnosticadas, e ainda menos têm acesso ao tratamento, já que muitos indivíduos afetados vivem em áreas rurais sem acesso ou pouco acesso à saúde8. Esses fatos destacam a necessidade urgente de encontrar novas drogas contra t. cruzi para permitir tratamentos mais eficientes, seguros e aplicáveis ao campo, especialmente para a fase crônica. Nesse sentido, outro desafio no desenvolvimento de compostos mais eficazes é a limitação de sistemas para avaliação da eficácia da droga in vitro e in vivo9.
Embora a biologia química e abordagens genômicas para a identificação de potenciais alvos de drogas tenham sido usadas em parasitas cinetoplastídeos, as ferramentas genômicas disponíveis em T. cruzi são limitadas em contraste com T. brucei ou Leishmania. Assim, a triagem de compostos com atividade tripanocida ainda é a abordagem mais utilizada na busca de novos candidatos a drogas quimioterápicas contra ChD. Geralmente, a descoberta de drogas em T. cruzi deve começar com o teste dos efeitos de uma nova droga em um ensaio in vitro contra a fase de epimastigote. Durante décadas, a única maneira de medir os efeitos inibitórios dos compostos candidatos em T. cruzi foi a contagem microscópica manual, que é trabalhosa, demorada e dependente do operador. Além disso, essa abordagem é adequada para avaliar um pequeno número de compostos, mas é inaceitável para a triagem de alto rendimento de grandes bibliotecas compostas. Hoje em dia, muitas investigações começam com a análise de um grande número de compostos de diferentes origens que são avaliados in vitro, testando sua capacidade de inibir o crescimento de parasitas. Tanto métodos colorimétricos quanto fluorométricos foram desenvolvidos para aumentar o rendimento nesses ensaios, melhorando a objetividade da triagem e tornando todo o processo menos tedioso9.
Um dos métodos colorimétricos mais utilizados é baseado na atividade β-galactosidase de parasitas transfeinados descritos pela primeira vez por Bucknet e colaboradores10. A enzima β-galactosidase expressa pelos parasitas recombinantes hidrolisa o substrato cromogênico, clorofenol vermelho β-D-galactopyranoside (CPRG), para o vermelho clorofenol, que pode ser facilmente medido colorimetricamente usando um espectógrafo microplato. Assim, o crescimento de parasitas na presença de uma variedade de compostos pode ser avaliado simultaneamente e quantitado em placas de microtátrica. Este método tem sido aplicado para testar drogas em formas de epimastigote (presentes no vetor de insetos), tripulações e amastigotes intracelulares, os estágios mamíferos do parasita. Além disso, vários T recombinante. cepas cruzi transfectadas com a enzima pBS:CL-Neo-01/BC-X-10 plasmid (pLacZ)10 para expressar a enzima Escherichia coli β-galactosidase já estão disponíveis (e novos podem ser construídos), o que permite a avaliação de parasitas de diferentes unidades de digitação discretas (DTUs) que podem não se comportar igualmente em direção aos mesmos compostos 10,11,12,13 . Este método já foi utilizado com sucesso para avaliar compostos para atividade contra T. cruzi na triagem de baixo e alto rendimento12,13. Abordagens semelhantes também têm sido usadas em outros parasitas protozoários, incluindo Toxoplasma gondii e Leishmania mexicana14,15.
Este artigo descreve e mostra um método detalhado para uma triagem in vitro de drogas contra todas as etapas do ciclo de vida de T. cruzi usando parasitas expressando β-galactosidase. Os ensaios aqui apresentados foram realizados com uma linha T. cruzi expressa β-galactosidase obtida pela transfecção da cepa T. cruzi Dm28c da DTU I13 com plasmid pLacZ (Dm28c/pLacZ). Além disso, o mesmo protocolo poderia ser facilmente adaptado a outras cepas para comparar o desempenho entre compostos e entre cepas de T. cruzi ou DTUs.
Protocolo
NOTA: Uma visão geral de todo o design experimental é retratada na Figura 1.
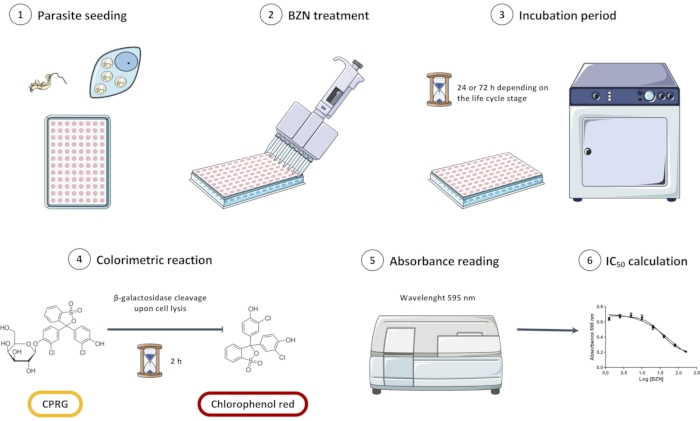
Figura 1: Visão geral do ensaio de triagem in vitro da linha Trypanosoma cruzi Dm28c/pLacZ usando CPRG como substrato para a reação colorimétrica. O ensaio consiste em semear os parasitas (1), incuba-los com BZN (2 e 3), e depois adicionar o substrato colorimétrico (4). Quando os parasitas são diluidos, β-galactosidase é liberado e crava CPRG para vermelho clorofenol; essa mudança de cor pode ser medida espectrofotometmetricamente (5). Os dados podem ser analisados em software de análise estatística para obter a concentração semiibitória (IC50) do BZN. Abreviaturas: CPRG = clorofenol vermelho β-D-galactopyranoside; BZN = benznidazol. Clique aqui para ver uma versão maior desta figura.
1. Elaboração de soluções de estoque
- Elaboração de mídia e soluções
- Solução hemin (Tabela Suplementar S1)
- Adicione todos os componentes a um tubo de centrífuga de 50 mL na ordem dada na receita e homogeneize por inversão várias vezes.
- Esterilize por filtragem através de um filtro de 0,22 μm.
- Prepare 1 mL aliquots em tubos de microcentrifus de 1,5 mL e mantenha-os a -80 °C até usar.
- Tripta de infusão hepática (LIT) Médio (Tabela Suplementar S1)
- Pese todos os componentes e mexa para homogeneizar à temperatura ambiente em um béquer de 1 L contendo pelo menos 700 mL de água destilada.
- Ajuste o pH para 7,2 e reescou o volume para 900 mL em um cilindro graduado em 1 L com água destilada; esterilizar por filtragem ou autoclavagem (121 °C por 20 min).
- Suplemente o meio adicionando 100 mL de soro de bezerro fetal (FCS), (10% FCS, estéril e inativado a 56 °C por 45 min), 20 mL de solução de glicose estéril de 40% (esterilizada por autoclavagem, 121 °C por 20 min) e 5 mL de solução hemin (concentração final de 5 μM) a 900 mL de meio LIT.
- Prepare o DMEM (Modified Eagle Medium, meio de águia modificada) da Dulbecco a partir do pó seguindo as instruções do fabricante.
- Soro fisiológico tamponado com fosfato (PBS) (Tabela Suplementar S1)
- Dissolva todos os componentes sólidos agitando a solução à temperatura ambiente em um béquer de 1 L.
- Ajuste o pH para 7,2, nível até 1 L em um cilindro graduado de 1 L com água destilada, e esterilize por filtragem ou autoclaving (121 °C, 20 min).
- Solução hemin (Tabela Suplementar S1)
- Soluções e diluições de benznidazol (BZN)
NOTA: A faixa de concentração de BZN utilizada neste trabalho foi de 2,5 a 80 μM.- Prepare uma solução de estoque de 1 M BZN dissolvendo 13 mg da droga em 50 μL de dimetilsulfoxida (DMSO). Em condições assépticas, prepare diluições seriais desta solução de estoque de 1 M BZN com o dobro da concentração final desejada (soluções 2x) em um volume final adequado para o número de poços a serem avaliados.
NOTA: Calcule para 100 μL por poço com um excesso de 10-20%. A solução de estoque BZN e todas as diluições BZN devem ser preparadas imediatamente antes do uso no ensaio devido à baixa solubilidade da droga no meio. - Prepare diluições BZN de 160, 80, 40, 20, 10 e 5 μM.
- Diluir 1 M BZN solução de estoque em uma diluição de 100 vezes (10 μL de 1 M BZN + 990 μL de médio) para obter uma solução de 10 mM no meio apropriado utilizado para cada estágio de ciclo de vida de T. cruzi. Misture continuamente para homogeneizar a suspensão.
- Diluir solução BZN de 10 mM para preparar 320 μM BZN no meio apropriado: 32 μL de 10 mM BZN + 968 μL de médio. Misture continuamente para homogeneizar a suspensão.
- Diluir 320 μM BZN 2 vezes para obter uma concentração de 160 μM (500 μL de 320 μM BZN + 500 μL de médio). Misture continuamente para homogeneizar a suspensão. Repita esta diluição de 2 vezes com cada solução resultante para obter 80, 40, 20, 10 e 5 soluções μM.
- Diluir DMSO 1.000 vezes no meio apropriado para uso como controle não tratado (controle de sobrevivência 100%).
NOTA: Epimastigotes toleram até uma diluição de 100 vezes do DMSO, enquanto as células Vero toleram apenas até uma diluição de 1.000 vezes de DMSO. Se necessário, um controle de morte com 50% de DMSO pode ser incluído como condição de sobrevivência de 0%.
- Prepare uma solução de estoque de 1 M BZN dissolvendo 13 mg da droga em 50 μL de dimetilsulfoxida (DMSO). Em condições assépticas, prepare diluições seriais desta solução de estoque de 1 M BZN com o dobro da concentração final desejada (soluções 2x) em um volume final adequado para o número de poços a serem avaliados.
- Solução de substrato
- Dissolver o CPRG na concentração de 1 mM em água destilada. Para uma placa de 96 poços, adicione 2,4 mg de CPRG a 4 mL de água.
NOTA: A solução CPRG deve ser preparada imediatamente antes do ensaio.
- Dissolver o CPRG na concentração de 1 mM em água destilada. Para uma placa de 96 poços, adicione 2,4 mg de CPRG a 4 mL de água.
- Solução de lise
- Prepare uma solução de 2,5% v/v de detergente noniônico e não desnaturado 2-[4-(2,4,4-trimetilpentano-2-yl)phenoxy]etanol (ver a Tabela de Materiais) em 1x PBS. Prepare 1 mL da solução por placa de 96 poços imediatamente antes do ensaio.
2. Preparação da cultura parasita
- Preparação de epimastigote
NOTA: A linha13 T. cruzi Dm28c/pLacZ é utilizada ao longo deste relatório.- Cresça o β-galactosidase-expressando T. cruzi epimastigotes axenicamente a 28 °C em frascos de cultura celular com uma área de crescimento de 25 cm2 (frascos T-25). Manter as culturas em fase de registro subculturando a cada 48-72 h (em 5 mL) em meio LIT complementado com 10% de FCS (Tabela Suplementar S1) e sulfato de geneticina (G418) em uma concentração final de 200 μg/mL. Quantifique o crescimento dos parasitas por contagem de células em uma câmara de Neubauer antes de subculturar. Feche firmemente a tampa e mantenha o frasco de cultura (não ventilado) a 28 °C em uma posição vertical.
NOTA: G418 garante a seleção e manutenção plasmid pLacZ. As culturas de fase de registro têm uma concentração de epimastigote de 1-5 × 107 parasitas/mL para a linha Dm28c/pLacZ. - Prepare uma suspensão de 2 × 105 epimastigotes/mL a partir de uma cultura de fase de registro em LIT complementada com antibiótico G418. Dispense 100 μL da suspensão de epimastigote por poço (20.000 epimastigotes em 100 μL de LIT) de uma microplaca de 96 poços e compense o volume final até 200 μL por poço com o meio.
- Cresça o β-galactosidase-expressando T. cruzi epimastigotes axenicamente a 28 °C em frascos de cultura celular com uma área de crescimento de 25 cm2 (frascos T-25). Manter as culturas em fase de registro subculturando a cada 48-72 h (em 5 mL) em meio LIT complementado com 10% de FCS (Tabela Suplementar S1) e sulfato de geneticina (G418) em uma concentração final de 200 μg/mL. Quantifique o crescimento dos parasitas por contagem de células em uma câmara de Neubauer antes de subculturar. Feche firmemente a tampa e mantenha o frasco de cultura (não ventilado) a 28 °C em uma posição vertical.
- Preparação de amastigote
- Use tripmonstigotes metacíclicos espontâneos obtidos de uma cultura de epimastigote envelhecido (durante 7 dias neste protocolo) para realizar uma infecção inicial em um frasco T-25 com 2 × 105 células Vero semeadas anteriormente em DMEM suplementadas com 2% de FCS.
- Conte o número de tripmonstigotes metacíclicos em uma câmara de Neubauer, infecte a monocamada celular Vero com uma multiplicidade de infecção (MOI) de 10 em 5 mL de DMEM com 2% de FCS, e incubar a 37 °C e 5% de CO2 por 16 h. Lave os trypomastigotes restantes removendo o meio do frasco com uma pipeta estéril de 5 mL, depois adicione 5 mL de PBS 1x e aspire. Por fim, adicione 5 mL de DMEM com 2% de FCS e incuba nas mesmas condições.
- Use os tripmonotes emergindo da monocamada de células Vero infectadas para manter a infecção em frascos T-25 com 2 × 105 células Vero no DMEM com 2% de FCS, gerando um novo frasco infectado a cada semana.
NOTA: Após 5-7 dias, tripulações começam a surgir e são visíveis no supernatante. Não adicione G418 aos trippamastigotes usados para infectar as células ou as células infectadas, pois a linha celular Vero não é resistente ao G418.
- Prepare uma suspensão de 1 × 105 células Vero/mL em DMEM suplementadas com 2% de FCS e sementes 100 μL da suspensão por poço em placas de cultura tecidual de 96 poços (10.000 células por poço). Incubar durante a noite (12-16 h) a 37 °C e 5% de CO2 para garantir a adesão celular à parte inferior dos poços.
- Após a incubação durante a noite, enxágue a monocamada celular Vero três vezes com 100 μL de PBS 1x estéril. Adicione tripmonsigatos T. cruzi Dm28c/pLacZ (obtidos de uma infecção anterior em um frasco T-25, passo 2.2.1) em um MOI de 10 em 100 μL de DMEM complementado com 2% de FCS por poço (100.000 trypomastigotes por poço).
- Incubar as placas por 6h a 37 °C e 5% de CO2. Após este período de incubação, lave as placas duas vezes com 1x PBS e adicione 100 μL de DMEM sem vermelho fenol complementado com 2% de FCS.
NOTA: Após 48h (2 dias após infecção), amastigotes intracytoplasmáticos são visíveis com um microscópio óptico. O vermelho fenol, um indicador de pH no DMEM e em outros meios de cultura celular, poderia interferir na medição de absorvência do CPRG. Se o DMEM sem fenol vermelho não estiver disponível, consulte as alternativas mencionadas abaixo na seção 3.2.1.
- Use tripmonstigotes metacíclicos espontâneos obtidos de uma cultura de epimastigote envelhecido (durante 7 dias neste protocolo) para realizar uma infecção inicial em um frasco T-25 com 2 × 105 células Vero semeadas anteriormente em DMEM suplementadas com 2% de FCS.
- Preparação de tripulação
- Prepare uma suspensão de 1 × 106 células Vero/mL em DMEM suplementadas com 2% de FCS e 800.000 células em 5 mL do meio em frascos T-25. Incubar durante a noite (12-16 h) a 37 °C e 5% de CO2 para garantir a adesão celular.
NOTA: Para um frasco T-75, a semente 2 × 106 células em um volume final de 15 mL. - Após a incubação, enxágue duas vezes com 3 mL de PBS estéril 1x. Adicione T. cruzi Dm28c/pLacZ trypomastigotes em um MOI de 10 em 5 mL de DMEM com 2% de FCS (8 × 106 trypomastigotes para um frasco T-25).
NOTA: Para um frasco T-75, adicione 20 × 106 trypomastigotes em um volume final de 15 mL de DMEM com 2% de FCS. - Incubar durante a noite (12-16 h) a 37 °C e 5% de CO2. Lave o frasco duas vezes com 3 mL de 1x PBS, e adicione 5 mL de DMEM fresco suplementado com 2% de FCS. Incubar a 37 °C e 5% de CO2 por quatro dias.
- Verifique o supernatante para tripulações sob um microscópio óptico. Quantifique os trypomastigotes contando-os em uma câmara de Neubauer. Colete o supernatante em um tubo de 15 mL e centrífuga a 7.000 × g por 10 minutos à temperatura ambiente.
- Descarte o supernasce e resuspenque a pelota para obter uma concentração de 1 × 106 tripmonotes/mL em DMEM sem vermelho fenol complementado com 2% de FCS. Semente 100 μL da suspensão trypomastigote (100.000 trippomastigotes por poço) em uma placa de 96 poços.
NOTA: Se o DMEM sem vermelho fenol não estiver disponível, consulte alternativas abaixo na seção 3.2.1.
- Prepare uma suspensão de 1 × 106 células Vero/mL em DMEM suplementadas com 2% de FCS e 800.000 células em 5 mL do meio em frascos T-25. Incubar durante a noite (12-16 h) a 37 °C e 5% de CO2 para garantir a adesão celular.
3. ensaio β-galactosidase
NOTA: A quantitação da atividade β-galactosidase é usada como uma forma indireta de determinar o número de parasitas. Espera-se que o crescimento seja inibido na presença de um composto trypanocida, levando a um menor número de parasitas em comparação com o controle não tratado, o que se refletirá em uma atividade de β-galactosidase menor e, portanto, menor absorvência.
- Incubar os parasitas com BZN.
- Adicione 100 μL de solução BZN correspondente por poço para alcançar uma concentração final de BZN de 80, 40, 20, 10, 5 e 2,5 μM a 100 μL de suspensão epimastigote (a partir da etapa 2.1), células Vero com amastigotes (2 dias após infecção) (passo 2.2), ou tripulamstigotes (passo 2.3) em uma placa de 96 poços.
- Incubar os epimastigotes a 28 °C por 72 h, e os tripulações ou células Vero infectadas com amastigotes por 24 h a 37 °C e 5% de CO2.
NOTA: Cada concentração de medicamentos deve ser avaliada pelo menos em triplicado e incluir culturas de controle de epimastigotes, tripulações e células Vero infectadas com DMSO (ver passo 1.2.2.4).
- Reação colorimétrica
- Após o período de incubação do tratamento, se as células vero infectadas ou tripmonotes estiverem em DMEM com vermelho fenol, substitua o meio por 100 μL de 1x PBS para evitar interferências. Realize poços em branco triplicados contendo apenas 100 μL de meio correspondente (ou 1x PBS conforme apropriado).
NOTA: Não é necessário remover o meio de cultura para epimastigotes em caso de meio LIT ou DMEM sem vermelho fenol. O DMEM com fenol vermelho ainda pode ser usado; preparar um poço em branco apenas com DMEM para medir a absorvância base e, em seguida, subtrair esse valor durante a análise de dados (etapa 3.3.). O meio inseto de Schneider, que é incolor, é uma alternativa para epimastigotes. - Adicione 40 μL de solução de substrato CPRG e 10 μL da solução de detergente para cada poço, obtendo uma concentração final de 200 μM CPRG e 0,1% de detergente em um volume final de 250 μL em cada poço.
NOTA: A solução CPRG e o detergente podem ser adicionados em um volume final de 50 μL por poço. - Incubar a 37 °C por 2 h e medir a absorvância a 595 nm em um espectrômetro de microplape.
NOTA: A mudança de cor esperada é amarela para marrom-avermelhado em β-galactosidase decote enzimático (Figura 2A). O tempo de incubação pode ser estendido até 4h, e os espectros de absorção do vermelho clorofenol podem ser lidos entre 570 e 595 nm com encaixes de curva semelhantes (Figura Suplementar S1A,B). A incubação por até 24 horas na presença do substrato CPRG mostrou encaixes de curva semelhantes (Figura Suplementar S1C).- Em um espectrofotômetro de microplaca com um seletor monocromático, crie um novo protocolo no software de equipamento (Figura Suplementar S2).
- Clique em Absorvância como método de detecção | Ponto final como tipo de leitura | Ok (Figura Suplementar S2A). Adicione uma etapa de leitura, digite o comprimento de onda selecionado e clique em Ok (Figura Suplementar S2B).
- Na seção Layout da placa , marque os poços a serem lidos e clique em Ok (Figura Suplementar S2C). Para ler a placa, insira-a na bandeja e clique em Read Plate. Aguarde que os valores apareçam na tela (Figura Suplementar S2D) e exporte-os para uma planilha para analisar os resultados.
- Após o período de incubação do tratamento, se as células vero infectadas ou tripmonotes estiverem em DMEM com vermelho fenol, substitua o meio por 100 μL de 1x PBS para evitar interferências. Realize poços em branco triplicados contendo apenas 100 μL de meio correspondente (ou 1x PBS conforme apropriado).
- Cálculo de análise de dados e concentração de inibidores de mídia (IC50)
- Subtraia o valor medido em branco, correspondendo apenas ao meio LIT, 1x PBS ou DMEM com ou sem vermelho fenol mais a solução CPRG-detergente. Ao testar a atividade trypanocida de compostos coloridos, meça a absorção de controles adicionais em branco com LIT ou DMEM a cada concentração de droga utilizada e, em seguida, subtraia esses valores dos valores de absorção obtidos com os parasitas em cada concentração.
NOTA: A Tabela Suplementar S2 mostra valores típicos obtidos neste ensaio com essas mídias sem parasitas mais a solução de detergente CPRG. As diferenças antes e depois de adicionar CPRG são significativas, mas não interferem no ensaio com parasitas (Tabela Suplementar S2). - Em software de análise estatística, plote a concentração de BZN (em μM) versus a absorvância em 595 nm em uma tabela xy. Transforme as concentrações do BZN em valores logarítmicos clicando no botão Analisar, selecionando a opção Transformar | transformar os valores x usando a opção x=log(x) e clicar no botão Ok.
- Obtenha os valores ic50 do software de análise estatística.
NOTA: O IC50 é definido como a concentração de drogas que reduz o crescimento do parasita em 50% em comparação com o controle não tratado e é calculado como o ponto de inflexão da função sigmoidal que se encaixa na curva.- No software de análise estatística, clique no botão Analisar , selecione regressão não linear (ajuste de curva) na lista de análise de xy e clique em Ok.
- Na guia modelo da janela Parâmetros , no grupo de dose-resposta - grupo de inibição de equações incorporadas, selecione o método de dose-resposta opção: log(inibidor) vs. resposta - Inclinação Variável (quatro parâmetros). Deixe todas as outras guias nos valores padrão; clique em Ok.
- Clique na seção de resultados do software de análise estatística para encontrar o valor IC50, o SD e a bondade do ajuste.
- Clique na seção gráfico para encontrar o gráfico xy da concentração logarítmica da droga versus os valores de absorvância . Procure o ajuste de curva também é grafado em uma cor diferente.
NOTA: Uma ferramenta de cálculo IC50 online gratuita pode ser encontrada em https://www.aatbio.com/tools/ic50-calculator.
- Subtraia o valor medido em branco, correspondendo apenas ao meio LIT, 1x PBS ou DMEM com ou sem vermelho fenol mais a solução CPRG-detergente. Ao testar a atividade trypanocida de compostos coloridos, meça a absorção de controles adicionais em branco com LIT ou DMEM a cada concentração de droga utilizada e, em seguida, subtraia esses valores dos valores de absorção obtidos com os parasitas em cada concentração.
Resultados
Seguindo o protocolo descrito acima, os epimastigotes Dm28c expressos β-galactose foram incubados com 6 concentrações de BZN (2,5, 5, 10, 20, 40, 80 μM) (ou compostos de interesse) por 72 h. Após esse período, foi adicionado reagente CPRG junto com detergente, que lise as células e libera β-galactosidase. CPRG é cortado pelo β-galactosidase para produzir clorofenol vermelho, levando a uma mudança de cor de amarelo para avermelhado (Figura 2A). O vermelho clorofenol foi medido pela...
Discussão
Este artigo descreve um ensaio baseado na determinação da atividade citoplasmática β-galactosidase liberada devido à lise de membrana de epimastigotes T. cruzi, trippomastigotes ou células infectadas com amastigotes na presença do substrato CPRG. Utilizamos parasitas T. cruzi Dm28c/pLacZ, uma cepa de parasita estável obtida após a transfecção com um plasmídeo de β-galactosidase construído por Buckner e coautores10. Este ensaio tem sido usado para procurar compostos ...
Divulgações
Os autores não têm conflito de interesses para divulgar.
Agradecimentos
Agradecemos ao Dr. Buckner por gentilmente fornecer o plasmídeo pLacZ. Este trabalho contou com o apoio da Agência Nacional de Promoción Científica y Tecnológica, Ministerio de Ciencia e Innovación Productiva da Argentina (PICT2016-0439, PICT2019-0526, PICT2019-4212) e Conselho de Pesquisa Reino Unido [MR/P027989/1]. Servier Medical Art foi usado para produzir figura 1 (https://smart.servier.com).
Materiais
| Name | Company | Catalog Number | Comments |
| 1 L beaker | Schott Duran | 10005227 | |
| 10 mL serological pipette sterile | Jet Biofil | GSP211010 | |
| 5 mL serological pipette sterile | Jet Biofil | GSP010005 | |
| 96-well plates | Corning | 3599 | |
| Benznidazole | Sigma Aldrich | 419656 | N-Benzyl-2-nitro-1H-imidazole-1-acetamide |
| Biosafty Cabinet | Telstar | Bio II A/P | |
| Centrifuge tube 15 mL conical bottom sterile | Tarson | 546021 | |
| Centrifuge tube 50 mL conical bottom sterile | Tarson | 546041 | |
| CO2 Incubator | Sanyo | MCO-15A | |
| CPRG | Roche | 10 884308001 | Chlorophenol Red-β-D-galactopyranoside |
| DMEM, High Glucose | Thermo Fisher Cientific | 12100046 | Powder |
| DMSO | Sintorgan | SIN-061 | Dimethylsulfoxid |
| Fetal Calf Serum | Internegocios SA | FCS FRA 500 | Sterile and heat-inactivated |
| G418 disulphate salt solution | Roche | G418-RO | stock concentration: 50 mg/mL |
| Glucose D(+) | Cicarelli | 716214 | |
| Graduated cylinder | Nalgene | 3663-1000 | |
| Hemin | Frontier Scientific | H651-9 | |
| KCl | Cicarelli | 867212 | |
| Liver Infusion | Difco | 226920 | |
| Microcentrifuge tube 1.5 mL | Tarson | 500010-N | |
| Microplate Spectrophotometer | Biotek | Synergy HTX | |
| Na2HPO4 | Cicarelli | 834214 | |
| NaCl | Cicarelli | 750214 | |
| Neubauer chamber | Boeco | BOE 01 | |
| Nonidet P-40 | Antrace | NIDP40 | 2-[4-(2,4,4-trimethylpentan-2-yl)phenoxy]ethanol |
| Prism | Graphpad | Statistical Analysis software | |
| Sodium Bicarbonate | Cicarelli | 929211 | NaHCO3 |
| Sorvall ST 16 Centrifuge | Thermo Fisher Cientific | 75004380 | |
| T-25 flasks | Corning | 430639 | |
| Tryptose | Merck | 1106760500 | |
| Vero cells | ATCC | CRL-1587 |
Referências
- Rassi, A., Rassi, A., Rassi, S. G. Predictors of mortality in chronic Chagas disease: a systematic review of observational studies. Circulation. 115 (9), 1101-1108 (2007).
- Pérez-Molina, J. A., Molina, I. Chagas disease. The Lancet. 391 (10115), 82-94 (2018).
- Messenger, L. A., Miles, M. A., Bern, C. Between a bug and a hard place: Trypanosoma cruzi genetic diversity and the clinical outcomes of Chagas disease. Expert Review of Anti-infective Therapy. 13 (8), 995-1029 (2015).
- Steverding, D. The history of Chagas disease. Parasites & Vectors. 7, 317 (2014).
- Viotti, R., et al. Towards a paradigm shift in the treatment of chronic Chagas disease. Antimicrobial Agents and Chemotherapy. 58 (2), 635-639 (2014).
- Bern, C. Chagas’ Disease. The New England Journal of Medicine. 373 (19), 1882 (2015).
- Bustamante, J. M., Tarleton, R. L. Methodological advances in drug discovery for Chagas disease. Expert Opinion on Drug Discovery. 6 (6), 653-661 (2011).
- Buckner, F. S., Verlinde, C. L., La Flamme, A. C., Van Voorhis, W. C. Efficient technique for screening drugs for activity against Trypanosoma cruzi using parasites expressing beta-galactosidase. Antimicrobial Agents and Chemotherapy. 40 (11), 2592-2597 (1996).
- Vega, C., Rolón, M., Martínez-Fernández, A. R., Escario, J. A., Gómez-Barrio, A. A new pharmacological screening assay with Trypanosoma cruzi epimastigotes expressing beta-galactosidase. Parasitology Research. 95 (4), 296-298 (2005).
- Bettiol, E., et al. Identification of three classes of heteroaromatic compounds with activity against intracellular Trypanosoma cruzi by chemical library screening. PLoS Neglected Tropical Diseases. 3 (2), 384 (2009).
- Gulin, J. E. N., et al. Optimization and biological validation of an in vitro assay using the transfected Dm28c/pLacZ Trypanosoma cruzi strain. Biology Methods and Protocols. 6 (1), 004 (2021).
- da Silva Santos, A. C., Moura, D. M. N., Dos Santos, T. A. R., de Melo Neto, O. P., Pereira, V. R. A. Assessment of Leishmania cell lines expressing high levels of beta-galactosidase as alternative tools for the evaluation of anti-leishmanial drug activity. Journal of Microbiological Methods. 166, 105732 (2019).
- McFadden, D. C., Seeber, F., Boothroyd, J. C. Use of Toxoplasma gondii expressing beta-galactosidase for colorimetric assessment of drug activity in vitro. Antimicrobial Agents and Chemotherapy. 41 (9), 1849-1853 (1997).
- Moreno-Viguri, E., et al. In vitro and in vivo anti-Trypanosoma cruzi activity of new arylamine Mannich base-type derivatives. Journal of Medicinal Chemistry. 59 (24), 10929-10945 (2016).
- García, P., Alonso, V. L., Serra, E., Escalante, A. M., Furlan, R. L. E. Discovery of a biologically active bromodomain inhibitor by target-directed dynamic combinatorial chemistry. ACS Medicinal Chemistry Letters. 9 (10), 1002-1006 (2018).
- Vela, A., et al. In vitro susceptibility of Trypanosoma cruzi discrete typing units (DTUs) to benznidazole: A systematic review and meta-analysis. PLoS Neglected Tropical Diseases. 15 (3), 0009269 (2021).
- Alonso-Padilla, J., Rodríguez, A. High throughput screening for anti-Trypanosoma cruzi drug discovery. PLoS Neglected Tropical Diseases. 8 (12), 3259 (2014).
- Martinez-Peinado, N., et al. Amaryllidaceae alkaloids with anti-Trypanosoma cruzi activity. Parasites & Vectors. 13 (1), 299 (2020).
- Puente, V., Demaria, A., Frank, F. M., Batlle, A., Lombardo, M. E. Anti-parasitic effect of vitamin C alone and in combination with benznidazole against Trypanosoma cruzi. PLoS Neglected Tropical Diseases. 12 (9), 0006764 (2018).
- Muelas-Serrano, S., Nogal-Ruiz, J. J., Gómez-Barrio, A. Setting of a colorimetric method to determine the viability of Trypanosoma cruzi epimastigotes. Parasitology Research. 86 (12), 999-1002 (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados