Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
В пробирке Медикаментозный скрининг на всех стадиях жизненного цикла Trypanosoma cruzi с использованием паразитов, экспрессирующих β-галактозидазу
В этой статье
Резюме
Описан высокопроизводительный колориметрический анализ, измеряющий активность β-галактозидазы на трех стадиях жизненного цикла Trypanosoma cruzi, возбудителя болезни Шагаса. Этот анализ может быть использован для идентификации трипаноцидных соединений простым, быстрым и воспроизводимым способом.
Аннотация
Trypanosoma cruzi является возбудителем болезни Шагаса (ИБС), эндемического заболевания, имеющего значение для общественного здравоохранения в Латинской Америке, которое также поражает многие неэндемические страны из-за увеличения миграции. Это заболевание поражает почти 8 миллионов человек, причем новые случаи оцениваются в 50 000 в год. В 1960-х и 70-х годах были введены два препарата для лечения ИБС: нифуртимокс и бензнидазол (БЗН). Оба эффективны у новорожденных и во время острой фазы заболевания, но не в хронической фазе, и их использование связано с важными побочными эффектами. Эти факты подчеркивают настоятельную необходимость активизации поиска новых препаратов против T. cruzi.
T. cruzi передается через гематофаговых насекомых-переносчиков семейств Reduviidae и Hemiptera. Попав в хозяина млекопитающих, он размножается внутриклеточным образом как небигеллированная амастиготная форма и дифференцируется в трипомастигот, нерепликативную инфекционную форму кровотока. Внутри насекомого-переносчика трипомастиготы превращаются в стадию эпимастигота и размножаются посредством бинарного деления.
В данной работе описан анализ, основанный на измерении активности цитоплазматической β-галактозидазы, высвобождаемой в культуру вследствие лизиса паразитов с использованием субстрата хлорфенола красного β-D-галактопиранозида (CPRG). Для этого штамм T. cruzi Dm28c трансфектировался β-галактозидазой-сверхэкспрессирующей плазмидой и использовался для фармакологического скрининга in vitro на стадиях эпимастигота, трипомастигота и амастигота. В этой статье также описывается, как измерить ферментативную активность в культивируемых эпимастиготах, инфицированных клетках Vero амастиготами и трипомастиготах, высвобождаемых из культивируемых клеток, используя в качестве примера референтный препарат бензнидазол. Этот колориметрический анализ легко выполняется и может быть масштабирован до высокопроизводительного формата и применен к другим штаммам T. cruzi .
Введение
Болезнь Шагаса (ChD), или американский трипаносомоз, является паразитарным заболеванием, вызванным жгутиковым простейшим, Trypanosoma cruzi (T. cruzi). ИБС начинается с бессимптомной или олигосимптомной острой фазы, которая обычно не диагностируется, за которой следует пожизненная хроническая фаза. При хроничности ~ 30% пациентов проявляются через десятилетия после заражения различные изнурительные состояния, включая миокардиопатию, мега-пищеварительные синдромы или и то, и другое, с коэффициентом смертности от 0,2% до 20%1,2,3. Бессимптомные хронические пациенты могут не иметь клинических признаков, но оставаться серопозитивными на протяжении всей своей жизни.
Оценки показывают, что ~ 7 миллионов человек инфицированы во всем мире, в основном из Латинской Америки, где ИБС является эндемичным. В этих странах T. cruzi в основном передается через инфицированных кровососущих триатоминовых насекомых (трансмиссивная передача) и реже перорально через прием пищи, загрязненной триатоминовыми фекалиями, содержащими паразитов2. Кроме того, паразит может передаваться через плаценту от чагасических матерей новорожденным, через переливание крови или во время трансплантации органов. Эти независимые от переносчиков способы заражения инфекцией и миграции людей способствовали всемирному распространению болезни, о чем свидетельствует увеличение числа случаев заболевания в Северной Америке, Европе и некоторых странах Африки, Восточного Средиземноморья и Западной части Тихогоокеана4. ИБС считается забытой болезнью, поскольку трансмиссивная передача тесно связана с нищетой и является ведущей проблемой общественного здравоохранения, особенно в странах Латинской Америки с низким уровнем дохода. Несмотря на наличие доступных методов лечения, смертность от ИБС в Латинской Америке является самой высокой среди паразитарных заболеваний, включая малярию2.
Существует два зарегистрированных препарата для лечения ИБС, введенных в конце 1960-х и начале 1970-х годов: нифуртимокс и бензнидазол5. Оба препарата эффективны в острой фазе заболевания у взрослых, детей и врожденно инфицированных новорожденных, а также у детей с хронической инфекцией, где обычно достигается излечение. Тем не менее, только несколько человек диагностируются достаточно рано, чтобы вовремя лечиться. Согласно последним клиническим испытаниям, оба препарата имеют важные ограничения у взрослых и были неэффективны в уменьшении симптомов у людей с хроническими заболеваниями; следовательно, их использование на данном этапе является спорным. Другими недостатками являются длительные сроки лечения (60-90 дней) и наблюдаемые частые, тяжелые побочные эффекты, которые приводят к прекращению терапии у доли инфицированных людей 6,7. По оценкам, менее 10% людей с ИБС были диагностированы, и еще меньше людей имеют доступ к лечению, поскольку многие пострадавшие люди живут в сельских районах без или с ограниченным доступом к здравоохранению8. Эти факты подчеркивают настоятельную необходимость поиска новых лекарств против T. cruzi, чтобы обеспечить более эффективные, безопасные и применимые к полевым методам лечения, особенно для хронической фазы. В связи с этим еще одной проблемой в разработке более эффективных соединений является ограничение систем оценки эффективности препарата in vitro и in vivo9.
Хотя химическая биология и геномные подходы для идентификации потенциальных мишеней лекарств использовались у кинетопластидных паразитов, доступные геномные инструменты у T. cruzi ограничены в отличие от T. brucei или Leishmania. Таким образом, скрининг соединений с трипаноцидной активностью по-прежнему является наиболее используемым подходом в поиске новых химиотерапевтических препаратов-кандидатов против ИПК. Обычно открытие препарата у T. cruzi должно начинаться с тестирования эффектов нового препарата в анализе in vitro против стадии эпимастигота. В течение десятилетий единственным способом измерения ингибирующего воздействия соединений-кандидатов на T. cruzi был ручной микроскопический подсчет, который является трудоемким, трудоемким и зависящим от оператора. Кроме того, этот подход подходит для анализа небольшого количества соединений, но неприемлем для высокопроизводительного скрининга больших библиотек соединений. В настоящее время многие исследования начинаются с анализа огромного количества соединений различного происхождения, которые анализируются in vitro, проверяя их способность ингибировать рост паразитов. Как колориметрические, так и флуорометрические методы были разработаны для увеличения пропускной способности в этих анализах, повышения объективности скрининга и делая весь процесс менее утомительным9.
Один из наиболее широко используемых колориметрических методов основан на β-галактозидазной активности трансфекторазных паразитов, впервые описанной Бакнетом и соавторами10. Фермент β-галактозидазы, экспрессируемый рекомбинантными паразитами, гидролизует хромогенный субстрат, хлорфенол красный β-D-галактопиранозид (CPRG), до хлорфенол-красного, который можно легко измерить колориметрически с помощью микропластичного спектрофотометра. Таким образом, рост паразитов в присутствии различных соединений может быть одновременно оценен и количественно определен в микротитрных пластинах. Этот метод был применен для тестирования лекарств в формах эпимастигот (присутствующих в насекомом переносчике), трипомастиготах и внутриклеточных амастиготах, стадиях млекопитающих паразита. Кроме того, несколько рекомбинантных штаммов T. cruzi, трансфектированных плазмидой pBS:CL-Neo-01/BC-X-10 (pLacZ)10 для экспрессии фермента Escherichia coli β-галактозидазы, уже доступны (и могут быть построены новые), что позволяет оценивать паразитов из разных дискретных типографских единиц (DTU), которые могут не вести себя одинаково по отношению к одним и тем же соединениям 10,11,12,13 . Этот метод уже успешно использовался для оценки активности соединений в отношении T. cruzi при низко- и высокопроизводительном скрининге12,13. Аналогичные подходы также использовались у других простейших паразитов, включая Toxoplasma gondii и Leishmania mexicana14,15.
В этой статье описан и показан подробный метод скрининга препарата in vitro против всех стадий жизненного цикла T. cruzi с использованием паразитов, экспрессирующих β-галактозидазу. Представленные здесь анализы были выполнены с β-галактозидазой-экспрессирующей линией T. cruzi , полученной путем трансфекции штамма T. cruzi Dm28c из DTU I13 с плазмидой pLacZ (Dm28c/pLacZ). Кроме того, тот же протокол может быть легко адаптирован к другим штаммам для сравнения производительности между соединениями и между штаммами T. cruzi или DTU.
протокол
ПРИМЕЧАНИЕ: Обзор всего экспериментального проекта показан на рисунке 1.
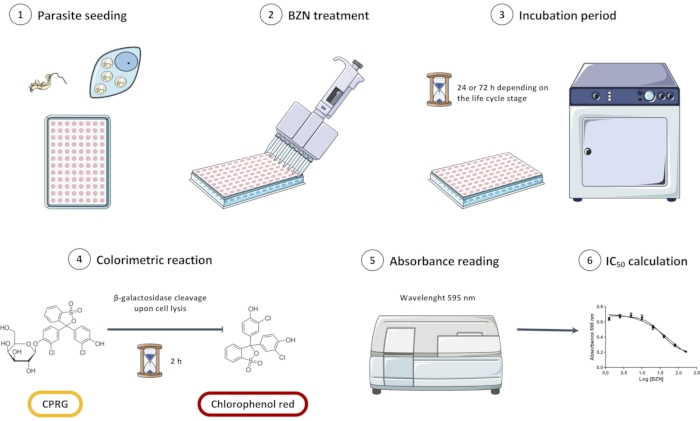
Рисунок 1: Обзор скринингового анализа in vitro линии Trypanosoma cruzi Dm28c/pLacZ с использованием CPRG в качестве подложки для колориметрической реакции. Анализ состоит из посева паразитов (1), инкубации их с BZN (2 и 3), а затем добавления колориметрического субстрата (4). Когда паразиты лизируются, высвобождается β-галактозидаза и расщепляет CPRG до хлорфенол-красного цвета; это изменение цвета может быть измерено спектрофотометрически (5). Данные могут быть проанализированы в программном обеспечении статистического анализа для получения полуингибирующей концентрации (IC50) BZN. Сокращения: CPRG = хлорфенол красный β-D-галактопиранозид; BZN = бензнидазол. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Подготовка стоковых решений
- Подготовка носителей и растворов
- Раствор гемина (Дополнительная таблица S1)
- Добавьте все компоненты в 50 мл центрифужной трубки в порядке, указанном в рецепте, и гомогенизируйте путем инверсии несколько раз.
- Стерилизуют путем фильтрации через фильтр 0,22 мкм.
- Приготовьте 1 мл аликвоты в микроцентрифужных пробирках объемом 1,5 мл и держите их при -80 °C до использования.
- Инфузия печени триптоза (LIT) Среда (Дополнительная таблица S1)
- Взвесьте все компоненты и перемешайте для гомогенизации при комнатной температуре в стакане объемом 1 л, содерущем не менее 700 мл дистиллированной воды.
- Отрегулируйте pH до 7,2 и добавьте объем до 900 мл в градуированном цилиндре объемом 1 л с дистиллированной водой; стерилизовать путем фильтрации или автоклавирования (121 °C в течение 20 мин).
- Дополнить среду добавлением 100 мл сыворотки для телят плода (FCS) (10% FCS, стерильной и термоинактивированной при 56 °C в течение 45 мин), 20 мл 40% стерильного раствора глюкозы (стерилизованного автоклавированием, 121 °C в течение 20 мин) и 5 мл раствора гемина (конечная концентрация 5 мкМ) до 900 мл ЛИТ-среды.
- Приготовьте модифицированную орлиную среду (DMEM) от Dulbecco из порошка, следуя инструкциям производителя.
- Фосфатно-буферный физиологический раствор (PBS) (Дополнительная таблица S1)
- Растворите все твердые компоненты, перемешав раствор при комнатной температуре в стакане объемом 1 л.
- Отрегулируйте рН до 7,2, выровняйте до 1 л в градуированном цилиндре объемом 1 л с дистиллированной водой и стерилизуйте фильтрацией или автоклавированием (121 °C, 20 мин).
- Раствор гемина (Дополнительная таблица S1)
- Исходные растворы и разведения бензнидазола (BZN)
ПРИМЕЧАНИЕ: Диапазон концентрации BZN, использованный в этой работе, составлял от 2,5 до 80 мкМ.- Готовят готовый раствор 1 М БЗН путем растворения 13 мг препарата в 50 мкл диметилсульфоксида (ДМСО). В асептических условиях подготавливают серийные разбавления из этого запасного раствора размером 1 млн БЗН с удвоенной конечной желаемой концентрацией (2-кратные растворы) в конечном объеме, достаточном для количества скважин, подлежащих анализу.
ПРИМЕЧАНИЕ: Рассчитать за 100 мкл на скважину с превышением 10-20%. Исходный раствор БЗН и все разведения БЗН необходимо приготовить непосредственно перед применением в анализе из-за низкой растворимости препарата в среде. - Приготовьте 2 разведения BZN по 160, 80, 40, 20, 10 и 5 мкМ.
- Разбавляют 1 М БЗН в 100-кратном разведении (10 мкл 1 М БЗН + 990 мкл среды) для получения раствора 10 мМ в соответствующей среде, используемой для каждой стадии жизненного цикла T. cruzi. Непрерывно перемешивать, чтобы гомогенизировать суспензию.
- Развести 10 мМ раствора БЗН для приготовления 320 мкМ БЗН в соответствующей среде: 32 мкл 10 мМ БЗН + 968 мкл среды. Непрерывно перемешивать, чтобы гомогенизировать суспензию.
- Разбавляют 320 мкМ BZN в 2 раза до получения концентрации 160 мкМ (500 мкл 320 мкМ BZN + 500 мкл среды). Непрерывно перемешивать, чтобы гомогенизировать суспензию. Повторите это 2-кратное разведение с каждым полученным раствором для получения 80, 40, 20, 10 и 5 мкМ растворов.
- Развести ДМСО в 1000 раз в соответствующей среде для использования в качестве необработанного контроля (100% контроль выживаемости).
ПРИМЕЧАНИЕ: Эпимастиготы переносят до 100-кратного разведения ДМСО, тогда как клетки Веро переносят только до 1000-кратного разведения ДМСО. При необходимости контроль смертности с 50% ДМСО может быть включен в качестве состояния выживаемости 0%.
- Готовят готовый раствор 1 М БЗН путем растворения 13 мг препарата в 50 мкл диметилсульфоксида (ДМСО). В асептических условиях подготавливают серийные разбавления из этого запасного раствора размером 1 млн БЗН с удвоенной конечной желаемой концентрацией (2-кратные растворы) в конечном объеме, достаточном для количества скважин, подлежащих анализу.
- Решение для подложки
- Растворить CPRG в концентрации 1 мМ в дистиллированной воде. Для 96-луночной пластины добавьте 2,4 мг CPRG к 4 мл воды.
ПРИМЕЧАНИЕ: Раствор CPRG должен быть приготовлен непосредственно перед анализом.
- Растворить CPRG в концентрации 1 мМ в дистиллированной воде. Для 96-луночной пластины добавьте 2,4 мг CPRG к 4 мл воды.
- Раствор лизиса
- Готовят 2,5% v/v раствор неионного, неденатурирующего детергента 2-[4-(2,4,4-триметилпентана-2-ил)фенокси]этанола (см. Таблицу материалов) в 1x PBS. Подготовьте 1 мл раствора на 96-луночную пластину непосредственно перед анализом.
2. Подготовка культуры паразитов
- Приготовление эпимастигота
ПРИМЕЧАНИЕ: В настоящем докладе используется строка13 T. cruzi Dm28c/pLacZ.- Выращивают β-галактозидазо-экспрессирующий T. cruzi epimastigotes аксенически при 28 °C в колбах клеточной культуры с площадью роста 25см2 (колбы Т-25). Поддерживать культуры в бревенчатой фазе путем субкультурации каждые 48-72 ч (в 5 мл) в ЛИТ среде, дополненной 10% FCS (дополнительная таблица S1) и генетинсульфатом (G418) в конечной концентрации 200 мкг/мл. Количественная оценка роста паразита путем подсчета клеток в камере Нойбауэра перед субкультурой. Надежно закройте колпачок и держите колбу для культивирования (не вентилируемую) при температуре 28 °C в вертикальном положении.
ПРИМЕЧАНИЕ: G418 обеспечивает выбор и поддержание плазмиды pLacZ. Культуры логарифмической фазы имеют концентрацию эпимастигота 1-5 × 107 паразитов/мл для линии Dm28c/pLacZ. - Готовят суспензию 2 × 105 эпимастиготов/мл из культуры логарифмической фазы в ЛИТ, дополненной антибиотиком G418. Дозируют 100 мкл суспензии эпимастигота на лунку (20 000 эпимастиготов в 100 мкл LIT) 96-луночной микропластины и составляют конечный объем до 200 мкл на скважину со средой.
- Выращивают β-галактозидазо-экспрессирующий T. cruzi epimastigotes аксенически при 28 °C в колбах клеточной культуры с площадью роста 25см2 (колбы Т-25). Поддерживать культуры в бревенчатой фазе путем субкультурации каждые 48-72 ч (в 5 мл) в ЛИТ среде, дополненной 10% FCS (дополнительная таблица S1) и генетинсульфатом (G418) в конечной концентрации 200 мкг/мл. Количественная оценка роста паразита путем подсчета клеток в камере Нойбауэра перед субкультурой. Надежно закройте колпачок и держите колбу для культивирования (не вентилируемую) при температуре 28 °C в вертикальном положении.
- Приготовление Амастиготе
- Используйте спонтанные метациклические трипомастиготы, полученные из старой культуры эпимастигота (в течение 7 дней в этом протоколе), для выполнения первоначальной инфекции в колбе Т-25 с 2 × 105 клетками Vero, посеянными ранее в DMEM, дополненной 2% FCS.
- Подсчитайте количество метациклических трипомастиготов в камере Нойбауэра, заразите монослой клеток Веро кратностью инфекции (MOI) 10 в 5 мл DMEM с 2% FCS и инкубируйте при 37 °C и 5% CO2 в течение 16 ч. Вымойте оставшиеся трипомастиготы, удалив среду из колбы стерильной пипеткой объемом 5 мл, затем добавьте 5 мл 1x PBS и аспират. Наконец, добавьте 5 мл DMEM с 2% FCS и инкубируйте в тех же условиях.
- Используйте трипомастиготы, возникающие из инфицированного монослоя клеток Vero, для поддержания инфекции в колбах Т-25 с 2 × 105 клетками Vero в DMEM с 2% FCS, генерируя новую инфицированную бутылку каждую неделю.
ПРИМЕЧАНИЕ: Через 5-7 дней трипомастиготы начинают появляться и видны в надводном веществе. Не добавляйте G418 к трипомастиготам, используемым для заражения клеток или инфицированных клеток, так как клеточная линия Vero не устойчива к G418.
- Готовят суспензию из 1 × 105 клеток Vero/мл в DMEM, дополненную 2% FCS, и семена 100 мкл суспензии на лунку в 96-луночных тканевых культуральных пластинах (10 000 клеток на лунку). Инкубировать в течение ночи (12-16 ч) при 37 °C и 5% CO2 для обеспечения прилипания клеток ко дну скважин.
- После ночной инкубации промыть клеточный монослой Vero три раза 100 мкл стерильного 1x PBS. Добавьте трипомастиготы T. cruzi Dm28c/pLacZ (полученные из предыдущей инфекции в колбе Т-25, стадия 2.2.1) при MOI 10 на 100 мкл DMEM, дополненного 2% FCS на лунку (100 000 трипомастиготов на лунку).
- Инкубировать пластины в течение 6 ч при 37 °C и 5% CO2. После этого инкубационного периода дважды промыть пластины 1x PBS и добавить 100 мкл DMEM без фенольного красного с добавлением 2% FCS.
ПРИМЕЧАНИЕ: Через 48 ч (2 дня после заражения) интрацитоплазматические амастиготы видны с помощью оптического микроскопа. Фенол красный, индикатор рН в DMEM и других клеточных культуральных средах, может мешать измерению абсорбции CPRG. Если DMEM без фенольного красного цвета недоступен, см. альтернативы, упомянутые ниже в разделе 3.2.1.
- Используйте спонтанные метациклические трипомастиготы, полученные из старой культуры эпимастигота (в течение 7 дней в этом протоколе), для выполнения первоначальной инфекции в колбе Т-25 с 2 × 105 клетками Vero, посеянными ранее в DMEM, дополненной 2% FCS.
- Приготовление трипомастигота
- Готовят суспензию из 1 × 106 клеток Vero/мл в DMEM, дополненную 2% FCS, и семена 800 000 клеток в 5 мл среды в колбах Т-25. Инкубировать в течение ночи (12-16 ч) при 37 °C и 5% CO2 для обеспечения адгезии клеток.
ПРИМЕЧАНИЕ: Для колбы Т-75 семена 2 × 106 клеток в конечном объеме 15 мл. - После инкубации промыть два раза 3 мл стерильного 1x PBS. Добавьте трипомастиготы T. cruzi Dm28c/pLacZ при MOI 10 в 5 мл DMEM с 2% FCS (8 × 106 трипомастиготов для колбы T-25).
ПРИМЕЧАНИЕ: Для колбы Т-75 добавьте 20 × 106 трипомастиготов в конечный объем 15 мл DMEM с 2% FCS. - Инкубировать в течение ночи (12-16 ч) при 37 °C и 5% CO2. Дважды вымойте колбу 3 мл 1x PBS и добавьте 5 мл свежего DMEM, дополненного 2% FCS. Инкубировать при 37 °C и 5% CO2 в течение четырех дней.
- Проверьте супернатант на трипомастиготы под оптическим микроскопом. Количественно оцените трипомастиготы, подсчитав их в камере Нойбауэра. Соберите супернатант в пробирку объемом 15 мл и центрифугу по 7000 × г в течение 10 мин при комнатной температуре.
- Откажитесь от супернатанта и повторно суспендируйте гранулу до получения концентрации 1 × 106 трипомастиготов/мл в ДМЭМ без фенолового красного, дополненного 2% FCS. Посейте 100 мкл суспензии трипомастигота (100 000 трипомастиготов на лунку) в 96-луночную пластину.
ПРИМЕЧАНИЕ: Если DMEM без фенольного красного цвета недоступен, см. альтернативы ниже в разделе 3.2.1.
- Готовят суспензию из 1 × 106 клеток Vero/мл в DMEM, дополненную 2% FCS, и семена 800 000 клеток в 5 мл среды в колбах Т-25. Инкубировать в течение ночи (12-16 ч) при 37 °C и 5% CO2 для обеспечения адгезии клеток.
3. анализ β-галактозидазы
ПРИМЕЧАНИЕ: Количественное определение активности β-галактозидазы используется как косвенный способ определения количества паразитов. Ожидается, что рост будет ингибироваться в присутствии трипаноцидного соединения, что приведет к меньшему количеству паразитов по сравнению с необработанным контролем, что будет отражаться в более низкой активности β-галактозидазы и, следовательно, более низкой абсорбции.
- Инкубируйте паразитов с помощью BZN.
- Добавьте 100 мкл соответствующего 2x раствора BZN на лунку для достижения конечной концентрации BZN 80, 40, 20, 10, 5 и 2,5 мкМ до 100 мкл суспензии эпимастигота (со стадии 2.1), клеток Vero с амастиготами (через 2 дня после заражения) (стадия 2.2) или трипомастиготов (стадия 2.3) в 96-луночной пластине.
- Инкубируют эпимастиготы при 28 °C в течение 72 ч, а трипомастиготы или инфицированные клетки Vero с амастиготами в течение 24 ч при 37 °C и 5% CO2.
ПРИМЕЧАНИЕ: Каждая концентрация лекарственного средства должна оцениваться, по крайней мере, в трех экземплярах и включать контрольные культуры эпимастиготов, трипомастиготов и инфицированных клеток Веро с ДМСО (см. этап 1.2.2.4).
- Колориметрическая реакция
- После инкубационного периода лечения, если инфицированные клетки Vero или трипомастиготы находятся в DMEM с феноловым красным, замените среду 100 мкл 1x PBS, чтобы избежать вмешательства. Выполняйте тройной заготовка скважин, содержащих только 100 мкл соответствующей среды (или 1x PBS в зависимости от обстоятельств).
ПРИМЕЧАНИЕ: Нет необходимости удалять культуральную среду для эпимастиготов в случае LIT среды или DMEM без фенольного красного цвета. DMEM с феноловым красным все еще можно использовать; подготовьте пустой колодец только с DMEM для измерения поглощения основания, а затем вычтите это значение во время анализа данных (шаг 3.3.). Насекомая среда Шнайдера, которая бесцветна, является альтернативой эпимастиготам. - Добавляют в каждую скважину 40 мкл раствора субстрата CPRG и 10 мкл раствора моющего средства, получая конечную концентрацию 200 мкМ CPRG и 0,1% моющего средства в конечном объеме 250 мкл в каждой скважине.
ПРИМЕЧАНИЕ: Раствор CPRG и моющее средство могут быть добавлены вместе в конечном объеме 50 мкл на лунку. - Инкубируют при 37 °C в течение 2 ч и измеряют поглощение при 595 нм в микропластинчатом спектрофотометре.
ПРИМЕЧАНИЕ: Ожидаемое изменение цвета от желтого до красновато-коричневого при ферментативном расщеплении β-галактозидазы (рисунок 2A). Время инкубации может быть увеличено до 4 ч, а спектры поглощения хлорфенола красного могут быть считаны между 570 и 595 нм с аналогичными кривыми фитингами (дополнительный рисунок S1A, B). Инкубация в течение 24 ч в присутствии подложки CPRG показала аналогичные кривые фитинги (дополнительный рисунок S1C).- В микропластинчатом спектрофотометре с селектором монохроматора создайте новый протокол в программном обеспечении оборудования (дополнительный рисунок S2).
- Щелкните Поглощение в качестве метода обнаружения | Конечная точка как | типа чтения Ok (дополнительный рисунок S2A). Добавьте шаг чтения, введите выбранную длину волны и нажмите ok (дополнительный рисунок S2B).
- В разделе Компоновка плит отметьте скважины для считывания и нажмите ok (дополнительный рисунок S2C). Чтобы прочитать пластину, вставьте ее в лоток и нажмите « Прочитать пластину». Дождитесь появления значений на экране (Дополнительный рисунок S2D) и экспортируйте их в электронную таблицу для анализа результатов.
- После инкубационного периода лечения, если инфицированные клетки Vero или трипомастиготы находятся в DMEM с феноловым красным, замените среду 100 мкл 1x PBS, чтобы избежать вмешательства. Выполняйте тройной заготовка скважин, содержащих только 100 мкл соответствующей среды (или 1x PBS в зависимости от обстоятельств).
- Анализ данных и расчет концентрации ингибиторов среды (IC50)
- Вычтите пустое измеренное значение, соответствующее только среде LIT, 1x PBS или DMEM с фенольным красным или без него плюс раствор CPRG-моющего средства. При тестировании трипаноцидной активности окрашенных соединений измеряют абсорбцию дополнительных пустых контрольных элементов с LIT или DMEM с каждой концентрацией используемого лекарственного средства, а затем вычитают эти значения из значений абсорбции, полученных с паразитами при каждой концентрации.
ПРИМЕЧАНИЕ: В дополнительной таблице S2 приведены типичные значения, полученные в этом анализе с этими средами без паразитов плюс раствор CPRG-моющего средства. Различия до и после добавления CPRG значительны, но не мешают анализу паразитов (Дополнительная таблица S2). - В программном обеспечении для статистического анализа построить график концентрации BZN (в мкМ) по сравнению с поглощением при 595 нм в таблице xy. Преобразуйте концентрации BZN в логарифмические значения, нажав кнопку «Анализ», выбрав опцию «Преобразовать» | преобразовать x-значения с помощью параметра x=log(x) и нажав кнопку «ОК».
- Получите значения IC50 из программного обеспечения для статистического анализа.
ПРИМЕЧАНИЕ: IC50 определяется как концентрация лекарственного средства, которая уменьшает рост паразитов на 50% по сравнению с необработанным контролем, и рассчитывается как точка перегиба сигмоидальной функции, которая соответствует кривой.- В программном обеспечении для статистического анализа нажмите кнопку «Анализировать », выберите «Нелинейная регрессия (соответствие кривой)» в списке анализа xy и нажмите « ОК».
- Во вкладке модель окна Параметры, в группе встроенных уравнений доза-реакция - ингибирование , выберите вариант метода доза-ответ: log(ингибитор) vs. response - Variable Slope (четыре параметра). Оставьте все остальные вкладки со значениями по умолчанию; нажмите кнопку ОК.
- Нажмите на раздел результатов программного обеспечения для статистического анализа, чтобы найти значение IC50, SD и качество соответствия.
- Нажмите на раздел графика , чтобы найти график xy логарифмической концентрации лекарственного средства по сравнению со значениями абсорбции . Ищите кривую, подгонка также отображается в другом цвете.
ПРИМЕЧАНИЕ: Бесплатный онлайн-инструмент расчета IC50 можно найти на https://www.aatbio.com/tools/ic50-calculator.
- Вычтите пустое измеренное значение, соответствующее только среде LIT, 1x PBS или DMEM с фенольным красным или без него плюс раствор CPRG-моющего средства. При тестировании трипаноцидной активности окрашенных соединений измеряют абсорбцию дополнительных пустых контрольных элементов с LIT или DMEM с каждой концентрацией используемого лекарственного средства, а затем вычитают эти значения из значений абсорбции, полученных с паразитами при каждой концентрации.
Результаты
Следуя описанному выше протоколу, β-галактозидазо-экспрессирующие Dm28c эпимастиготы инкубировали с 6 концентрациями BZN (2,5, 5, 10, 20, 40, 80 мкМ) (или представляющих интерес соединений) в течение 72 ч. По истечении этого периода вместе с моющим средством добавляли реагент CPRG, который лизирует кле?...
Обсуждение
В данной работе описан анализ, основанный на определении активности цитоплазматической β-галактозидазы, высвобождаемой в результате мембранного лизиса T. cruzi epimastigotes, трипомастиготов или инфицированных клеток амастиготами в присутствии субстрата CPRG. Мы использовали паразитов T...
Раскрытие информации
У авторов нет конфликта интересов для раскрытия.
Благодарности
Мы благодарим доктора Бакнера за любезное предоставление плазмиды pLacZ. Эта работа была поддержана Agencia Nacional de Promoción Científica y Tecnológica, Ministerio de Ciencia e Innovación Productiva из Аргентины (PICT2016-0439, PICT2019-0526, PICT2019-4212) и Исследовательским советом Соединенного Королевства [MR/P027989/1]. Медицинское искусство Сервье было использовано для создания рисунка 1 (https://smart.servier.com).
Материалы
| Name | Company | Catalog Number | Comments |
| 1 L beaker | Schott Duran | 10005227 | |
| 10 mL serological pipette sterile | Jet Biofil | GSP211010 | |
| 5 mL serological pipette sterile | Jet Biofil | GSP010005 | |
| 96-well plates | Corning | 3599 | |
| Benznidazole | Sigma Aldrich | 419656 | N-Benzyl-2-nitro-1H-imidazole-1-acetamide |
| Biosafty Cabinet | Telstar | Bio II A/P | |
| Centrifuge tube 15 mL conical bottom sterile | Tarson | 546021 | |
| Centrifuge tube 50 mL conical bottom sterile | Tarson | 546041 | |
| CO2 Incubator | Sanyo | MCO-15A | |
| CPRG | Roche | 10 884308001 | Chlorophenol Red-β-D-galactopyranoside |
| DMEM, High Glucose | Thermo Fisher Cientific | 12100046 | Powder |
| DMSO | Sintorgan | SIN-061 | Dimethylsulfoxid |
| Fetal Calf Serum | Internegocios SA | FCS FRA 500 | Sterile and heat-inactivated |
| G418 disulphate salt solution | Roche | G418-RO | stock concentration: 50 mg/mL |
| Glucose D(+) | Cicarelli | 716214 | |
| Graduated cylinder | Nalgene | 3663-1000 | |
| Hemin | Frontier Scientific | H651-9 | |
| KCl | Cicarelli | 867212 | |
| Liver Infusion | Difco | 226920 | |
| Microcentrifuge tube 1.5 mL | Tarson | 500010-N | |
| Microplate Spectrophotometer | Biotek | Synergy HTX | |
| Na2HPO4 | Cicarelli | 834214 | |
| NaCl | Cicarelli | 750214 | |
| Neubauer chamber | Boeco | BOE 01 | |
| Nonidet P-40 | Antrace | NIDP40 | 2-[4-(2,4,4-trimethylpentan-2-yl)phenoxy]ethanol |
| Prism | Graphpad | Statistical Analysis software | |
| Sodium Bicarbonate | Cicarelli | 929211 | NaHCO3 |
| Sorvall ST 16 Centrifuge | Thermo Fisher Cientific | 75004380 | |
| T-25 flasks | Corning | 430639 | |
| Tryptose | Merck | 1106760500 | |
| Vero cells | ATCC | CRL-1587 |
Ссылки
- Rassi, A., Rassi, A., Rassi, S. G. Predictors of mortality in chronic Chagas disease: a systematic review of observational studies. Circulation. 115 (9), 1101-1108 (2007).
- Pérez-Molina, J. A., Molina, I. Chagas disease. The Lancet. 391 (10115), 82-94 (2018).
- Messenger, L. A., Miles, M. A., Bern, C. Between a bug and a hard place: Trypanosoma cruzi genetic diversity and the clinical outcomes of Chagas disease. Expert Review of Anti-infective Therapy. 13 (8), 995-1029 (2015).
- Steverding, D. The history of Chagas disease. Parasites & Vectors. 7, 317 (2014).
- Viotti, R., et al. Towards a paradigm shift in the treatment of chronic Chagas disease. Antimicrobial Agents and Chemotherapy. 58 (2), 635-639 (2014).
- Bern, C. Chagas’ Disease. The New England Journal of Medicine. 373 (19), 1882 (2015).
- Bustamante, J. M., Tarleton, R. L. Methodological advances in drug discovery for Chagas disease. Expert Opinion on Drug Discovery. 6 (6), 653-661 (2011).
- Buckner, F. S., Verlinde, C. L., La Flamme, A. C., Van Voorhis, W. C. Efficient technique for screening drugs for activity against Trypanosoma cruzi using parasites expressing beta-galactosidase. Antimicrobial Agents and Chemotherapy. 40 (11), 2592-2597 (1996).
- Vega, C., Rolón, M., Martínez-Fernández, A. R., Escario, J. A., Gómez-Barrio, A. A new pharmacological screening assay with Trypanosoma cruzi epimastigotes expressing beta-galactosidase. Parasitology Research. 95 (4), 296-298 (2005).
- Bettiol, E., et al. Identification of three classes of heteroaromatic compounds with activity against intracellular Trypanosoma cruzi by chemical library screening. PLoS Neglected Tropical Diseases. 3 (2), 384 (2009).
- Gulin, J. E. N., et al. Optimization and biological validation of an in vitro assay using the transfected Dm28c/pLacZ Trypanosoma cruzi strain. Biology Methods and Protocols. 6 (1), 004 (2021).
- da Silva Santos, A. C., Moura, D. M. N., Dos Santos, T. A. R., de Melo Neto, O. P., Pereira, V. R. A. Assessment of Leishmania cell lines expressing high levels of beta-galactosidase as alternative tools for the evaluation of anti-leishmanial drug activity. Journal of Microbiological Methods. 166, 105732 (2019).
- McFadden, D. C., Seeber, F., Boothroyd, J. C. Use of Toxoplasma gondii expressing beta-galactosidase for colorimetric assessment of drug activity in vitro. Antimicrobial Agents and Chemotherapy. 41 (9), 1849-1853 (1997).
- Moreno-Viguri, E., et al. In vitro and in vivo anti-Trypanosoma cruzi activity of new arylamine Mannich base-type derivatives. Journal of Medicinal Chemistry. 59 (24), 10929-10945 (2016).
- García, P., Alonso, V. L., Serra, E., Escalante, A. M., Furlan, R. L. E. Discovery of a biologically active bromodomain inhibitor by target-directed dynamic combinatorial chemistry. ACS Medicinal Chemistry Letters. 9 (10), 1002-1006 (2018).
- Vela, A., et al. In vitro susceptibility of Trypanosoma cruzi discrete typing units (DTUs) to benznidazole: A systematic review and meta-analysis. PLoS Neglected Tropical Diseases. 15 (3), 0009269 (2021).
- Alonso-Padilla, J., Rodríguez, A. High throughput screening for anti-Trypanosoma cruzi drug discovery. PLoS Neglected Tropical Diseases. 8 (12), 3259 (2014).
- Martinez-Peinado, N., et al. Amaryllidaceae alkaloids with anti-Trypanosoma cruzi activity. Parasites & Vectors. 13 (1), 299 (2020).
- Puente, V., Demaria, A., Frank, F. M., Batlle, A., Lombardo, M. E. Anti-parasitic effect of vitamin C alone and in combination with benznidazole against Trypanosoma cruzi. PLoS Neglected Tropical Diseases. 12 (9), 0006764 (2018).
- Muelas-Serrano, S., Nogal-Ruiz, J. J., Gómez-Barrio, A. Setting of a colorimetric method to determine the viability of Trypanosoma cruzi epimastigotes. Parasitology Research. 86 (12), 999-1002 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены