Method Article
מיקרופריקציה ביולוגית בסיוע מיקרוסקופיית חמצן במחיר סביר של ספרואידים רב-תאיים
* These authors contributed equally
In This Article
Summary
הפרוטוקול מתאר יצירת כדוריות בתפוקה גבוהה להדפסה ביולוגית באמצעות ניתוח רב-פרמטרי של החמצון שלהם ומוות התאים שלהם במיקרוסקופ פלואורסצנטי סטנדרטי. ניתן ליישם גישה זו כדי לשלוט בכדאיות הספרואידים ולבצע סטנדרטיזציה, החשובה במידול רקמה תלת-ממדית, מיקרו-סביבה של הגידול וביו-פבריקציה מוצלחת (מיקרו)של רקמות.
Abstract
ספרואידים רב-תאיים הם כלים חשובים לחקר פיזיולוגיה של רקמות וסרטן בתלת-ממד ומשמשים לעתים קרובות בהנדסת רקמות כיחידות להרכבת רקמות לביו-פבריקציה. בעוד שהכוח העיקרי של מודל הספרואידים הוא בחיקוי גרדיאנטים פיזיקליים-כימיים בקנה מידה זעיר של הרקמה, בדרך כלל מתעלמים מהסביבה הפיזיולוגית האמיתית (כולל דינמיקה של פעילות מטבולית, חמצון, מוות תאי והתפשטות) בתוך הספרואידים. יחד עם זאת, ההשפעות של הרכב מדיום הצמיחה ושיטת ההיווצרות על הפנוטיפ הספרואידי שנוצר מתועדות היטב. לפיכך, אפיון וסטנדרטיזציה של פנוטיפ ספרואידי נדרשים כדי להבטיח את יכולת השכפול והשקיפות של תוצאות המחקר. הניתוח של חמצון ספרואידי ממוצע והערך של שיפועי O2 בשלושה ממדים (3D) יכול להיות דרך פשוטה ואוניברסלית לאפיון פנוטיפ ספרואידי, ולהצביע על הפעילות המטבולית שלהם, על הכדאיות הכוללת שלהם ועל הפוטנציאל לסיכום מיקרו-סביבה של רקמות in vivo . ניתן לשלב בקלות את ההדמיה של חמצון תלת-ממדי עם ניתוח מולטי-פאראמטרי של פרמטרים פיזיולוגיים נוספים (כגון מוות תאי, התפשטות והרכב תאים) וליישם אותה לניטור חמצון רציף ו/או למדידות נקודת קצה. ההעמסה של הגשושית O2 מתבצעת במהלך שלב היווצרות הספרואידים ותואמת לפרוטוקולים שונים של יצירת ספרואידים. הפרוטוקול כולל שיטת תפוקה גבוהה של יצירת ספרואידים עם הצגת ננו-סנסורים פלואורסצנטיים של O2 פלואורסצנטיים אדומים וקרובים לאדום ואינפרה-אדום ותיאור של הערכה מרובת פרמטרים של חמצון ספרואידים ומוות תאים לפני ואחרי ההדפסה הביולוגית. הדוגמאות הניסיוניות מראות ניתוח גרדיאנטים השוואתי של O2 בספרואידים הומו-תאיים והטרו-תאיים, כמו גם במבנים מודפסים ביולוגית מבוססי-ספרואידים. הפרוטוקול תואם למיקרוסקופ פלואורסצנטי קונבנציונלי בעל מספר מסננים פלואורסצנטיים ודיודה פולטת אור כמקור אור.
Introduction
חמצן מולקולרי (O2) הוא אחד המטבוליטים המרכזיים המווסתים את הכדאיות, התפקוד והמוות של תאים ורקמות. בתנאים פיזיולוגיים, חמצון רקמות מקומיות מווסת באופן דינמי על ידי כלי דם של רקמות, זרימת דם וחילוף חומרים של תאים, ובמקרים מסוימים מובילים להיווצרות של גרדיאנטים O2, מיקרו-סביבה היפוקסית ו/או עקה חמצונית 1,2. התאים חשים את גרדיאנטים O2 באמצעות מעורבות ישירה של ה-O2 המולקולרי בתפקוד האיתות (באמצעות איתות בתיווך גורם היפוקסיה (HIF), איתות בתיווך היסטון ליזין דמתילאזות KDM, ובאמצעים אחרים), שינויים בפוטנציאל החמצן מחדש התאי (חישת מינים תגובתיים של O2 באמצעות איתות Nrf2/Keap1 או חלבונים מווסתי ברזל), ויכולים לאחר מכן להתאים את חילוף החומרים שלהם, התפשטות, עוצמה, והבחנה3. לפיכך, הטרוגניות של חמצון תאים ורקמות, גרדיאנטים שלה ותופעות נלוות הם שחקנים חשובים בהתפתחות רקמות והומאוסטזיס. רקמות וסוגי תאים שונים דורשים לעתים קרובות רמות שונות של O2 פיזיולוגיות 'נורמליות', המגדירות את ארכיטקטורת הרקמה המיוחדת עם תאים הממוקמים על פי הרקמה O2 microgradients4. סוגי תאים מסוימים רגישים לירידה ב-O2 (למשל, נוירונים, הפטוציטים, תאי איון הלבלב או תאי שריר)5,6, בעוד שאחרים יכולים לעמוד בהיפוקסיה קיצונית וליצור שיפועים תלולים של O2 (למשל, באפיתליה של המעיים והמעי הגס)7. עם ההתקדמות בביו-הנדסה של רקמות ובביו-פבריקציה, הצורך בכימות O2 במיקרו-אגרגטים ובמבנים תלת-ממדיים של רקמות תלת-ממדיות כדוריות הופך להיות חשוב. אחד החששות הוא סטנדרטיזציה של הפרמטרים הפיזיולוגיים של המודל הספרואידי הרב-תאי, התלויים בשיטת יצירת הספרואידים ותנאי התרבית8. בנוסף, יישום בלתי מבוקר של O2 המשחרר ביו-חומרים או O2 פרפוזיה במיקרוטיסים ללא כלי דם פונקציונליים יכול להיות רעיל לתאים, להוביל לתכנות מחדש של חילוף החומרים שלהם, ולפגיעה בהישרדות בתקופה שלאחר ההשתלה 9,10. האמינות של גישת המדידה O2 והאופטימיזציה של סביבת החמצון כדי להגיע לתרבית היעילה של מיקרו-אגרגטים רלוונטיים מבחינה פיזיולוגית הוכחה לאחרונה על ידי מודלים מתמטיים של כדוריות כבד שמקורן בתאי גזע פלוריפוטנטיים המשמשים כדוגמה11. תחום נוסף בו מוכר הידע של רמות O2 של רקמות הוא טיפול בסרטן12,13. היפוקסיה של גידול הטרוגני עלולה לפגוע בטיפול מוצלח נגד סרטן. מדידה ובקרה של רמות החמצון המדויקות במהלך טיפול בחולה או מודלים של היפוקסיה בגידול יאפשרו שיפור של אסטרטגיות טיפול פרטניות ומותאמות אישית14. לפיכך, ניטור כמותי של חמצון דינמי במבנים ביו-פבריקטים ובמודלים של גידולים תלת-ממדיים הוא כלי בולט לניתוח פיזיולוגי של פעילות הנשימה שלהם, חילוף החומרים והאופטימיזציה של תרבית רקמה, תנאי ייצור או מחקרים בסיסיים של התגובה הטיפולית המתווכת בהיפוקסיה.
מספר שיטות מאפשרות ניתוח מרובה (או מרובה פרמטרים) של חמצון תאים במבני רקמות כדוריות ומיקרו-אגרגרטיות. חלוצה עם נוירוספרות וספרואידים של גידולים 15,16,17, הגישה המבוססת על מיקרוסקופיית הדמיה לכל החיים של זרחן (PLIM) מאפשרת כימות ישיר של חמצון תאים במיקרוטיסים חיים ולבסס את המתאם שלו עם כדאיות התאים, התפשטות או התפלגות סוגי התאים הפונקציונליים. למרות כוחה של הגישה, שדרוג המיקרוסקופיה של PLIM עדיין אינו זמין באופן נרחב אפילו בקרב ספקי המיקרוסקופיה הפופולריים18,19. למרבה המזל, מספר לא מבוטל של ננו-חלקיקים רגישים לתא O2 יכולים לשמש גם למצב מדידה יחסמטרי מבוסס עוצמה פלואורסצנטית 15,17,20,21,22,23,24. בדרך כלל, הגשושית תציג שני אורכי גל של פליטה, כלומר, O2-רגישים וחסרי רגישות (ייחוס), שניתן למדוד אותם במיקרוסקופ פלואורסצנטי, במצלמת סינון בעלת תוכן גבוה או בקורא מיקרו-פלטה. ננו-חלקיקים בעלי חישה של O2 יכולים להיות מיוצרים על ידי טכניקת משקעים עם הפולימרים הניתנים להתאמה ביולוגית, חישת O2 וצבעי ייחוס המשתרעים על ספקטרום גלוי ואינפרה-אדום קרוב, או שניתן לרכוש אותם באופן מסחרי 2,25. מאחר שניתוח של מיקרוטיזות תלת-ממדיות עבות ייהנה משימוש בצבעים פלואורסצנטיים בעלי תזוזה אדומה, נבנתה הגשושית הננו-חלקיקית היחסית O2-חישה רב-מודאלית אינפרה-אדום מספר 1 (MMIR1), המורכבת מ-PtTPTBPF 26 בעל חישה של O26 ומצביעי ייחוס aza-BODIPY27 הספוגים בקופולימר מבוסס פולימתקרילט טעון חיובית, נבנתה28. עם תכנון זה, אות O2 רגיש (קרוב אינפרא אדום, עירור (exc.) = 635 ננומטר, פליטה (em.) = 760 ננומטר; Isens) מושפע מהריכוז [O2] באמצעות תהליך מרווה של זרחן, בעוד שעוצמת צבע הייחוס האדום (exc. = 580 ננומטר, em. = 650 ננומטר; Iref) נשאר לא מושפע (איור 1A). לפיכך, יחסחישה Iref / I (R) בתאים מוכתמים יכול לאפשר כיול O2 22.
כאן, אנו מתארים גישה כמותית למחצה לניטור חמצון תאים חיים בספרואידים ובמבנים מודפסים ביולוגית, ומסייעים להעריך את שיפועי O 2 במדידות נקודתקצה וקינטיות. הדמיית O2 כזו יכולה להתבצע עם סוגים אחרים של בדיקות O2 יחסמטריות (איור 1B) ובהתאם למספר מקורות האור הזמינים ומסנני הפלואורסצנציה, ניתן להשתמש בה עם צבעים אחרים כדי לקבל מידע על תאים חיים/מתים, על תפקוד המיטוכונדריה ולעקוב אחר סוגי תאים אחרים. ניתן להשתמש גם במצבי מדידה מתקדמים כגון מיקרוסקופיית הדמיה פלואורסצנטית לכל החיים (FLIM)19. האתגר הגדול ביותר בשימוש בצבעי צביעת תאים ובננו-חלקיקים רגישים ל-O2 הוא האופטימיזציה של פרוטוקול ההכתמה. במקרה של הגשושית MMIR1 וננו-חלקיקים קשורים, התאים מוכתמים מראש או דוגרים יחד במהלך תהליך היווצרות הספרואידים. בפרוטוקול המתואר, ספרואידים מוכתמים בגשושית O2 נוצרו על משטח אגרוז בעל דבק נמוך 29,30,31,32 (איור 1C), מה שמאפשר הדפסה ביולוגית מבוססת-ספרואידים וניתוח מרובה פרמטרים של O2 ומוות תאים. כדי להמחיש את תחולת הגישה, הושוו רמות החמצון בספרואידים של תאי עיסת הומו-או הטרו-תאיים (שנוצרו עם תוספת של תאי אנדותל של וריד טבור אנושי, HUVEC) של תאי גזע של תאי עיסת שיניים אנושיים (hDPSC) לפני ואחרי ההדפסה הביולוגית, באמצעות מיקרוסקופ פלואורסצנטי קונבנציונלי.
Protocol
1. יצירת תפוקה גבוהה של ספרואידים עם בדיקה משולבת O2 רגישה
- הכנת צלחת תרבית רקמה מצופה אגרוז בדוגמת מיקרו
הערה: לוחות תרבית רקמה מצופים אגרוז בדוגמת מיקרו משמשים ליצירה סימולטנית של מספר גבוה של ספרואידים (1585 לכל חותמת PDMS, ראה טבלת חומרים) להדפסה ביולוגית וליישומים אחרים, שבהם יש צורך בשכפולים ניסיוניים מרובים או במספרים גדולים של ספרואידים.- הכינו את כל החומרים והמכשירים הסטריליים (מריתות ופינצטה) על ידי אוטוקלבים במידת האפשר או על ידי עיקור מסנן. נקו את חותמות ה-PDMS הניתנות למחזור33 מאגרוז ואחסנו אותן באופן אספטי ב-70% אתנול. עשו זאת לפחות יום אחד לפני יצירת הספרואידים.
- העבר חותמות PDMS בדוגמת מיקרו מבקבוקון אחסון לצלחת פטרי סטרילית ויבש באוויר עם המשטח החלק כלפי מעלה בתנאי זרימת האוויר הלמינרית הסטריליים למשך 10 דקות.
- שים כל חותמת עם משטח בדוגמת מיקרו למעלה (ומשטח חלק למטה) באמצע הבאר של צלחת תרבית רקמה סטרילית בת 12 בארות. אוויר יבש במשך 1-2 דקות עם מכסה פתוח.
הערה: חשוב מאוד לאדות את הנוזל העודף מכיוון שרק חותמות יבשות נדבקות בצורה מושלמת למשטח הפלסטיק ונשארות מחוברות במהלך ההליך. - שוקלים 1.5 גרם אגרוז לתוך בקבוק זכוכית נקי של 200 מ"ל, מוסיפים 50 מ"ל של מים מזוקקים סטריליים, מכסים במכסה ונמסים במיקרוגל כדי ליצור 50 מ"ל של תמיסת אגרוז הומוגנית של 3%.
אזהרה: תמיסת האגרוס חמה במיוחד ויש לטפל בה בזהירות. אם מזועזעים מיד לאחר הליך ההיתוך, תמיסת האגרוס החמה יכולה להתחיל לבעבע ולהתפרץ מתוך הכלי. כדי למנוע טראומות מזדמנות, השתמש בכלים גדולים מספיק מלאים במקסימום 50% מהנפח עם תמיסת האגרוס. - באמצעות פיפטה סרולוגית סטרילית מוסיפים מיד כ-2 מ"ל של תמיסת אגרוז חם לכל באר של 12 לוחות תרבית התאים כדי לכסות לחלוטין את חותמת ה-PDMS שהוכנסה. השאירו את האגרוז להתמצק למשך 20 דקות על ידי דגירה מתחת לזרימת האוויר הסטרילית עם מכסה הצלחת פתוח.
הערה: שכבת האגרוס צריכה להיות עבה לפחות פי שניים מחובל PDMS כדי להבטיח את שלמות המיקרווולים האגרוזים לאחר הסרת חותמת PDMS (איור 1C). - באמצעות מרית קטנה וסטרילית, סובבו במדויק את האגרוז עם חותמת ה-PDMS המוטבעת במהופך בכל באר כדי לקבל את משטח ההטבעה החלק למעלה. מוסיפים כ-200 μL של מים סטריליים בצד העליון החלק של הבול, מנתקים אותו בעדינות מהאגרוז בעזרת מרית, ומוציאים אותו מהבאר. הימנעו מפגיעה במיקרווולים.
- הוסיפו 1 מ"ל של מדיה תואמת של תרבית תאים סטרילית לבולים האגרוזים לשימוש ישיר. כסו את הצלחת במכסה ודגרו למשך הלילה בטמפרטורה של 4 מעלות צלזיוס. השתמש בפתרון PBS (במקום בינוני) לאחסון לטווח ארוך (עד שבועיים ב-4 °C (4 °C). אל תתנו לאגרוזה להתייבש. לפני השימוש, מחממים את הצלחות המיקרו-תבניתיות של אגרוז למשך שעה אחת בטמפרטורה של 37 מעלות צלזיוס באינקובטור CO2 .
הערה: יש צורך בדגירה כדי לשקם ולהסיר בועות אוויר ממיקרווולים אגרוזים. המשך עם שלב הפרוטוקול 1.2.
- הכנת O2 ספרואידים טעונים בבדיקה
- השתמש במדיום חיוני α מינימלי (MEM) בתוספת 10% סרום בקר עוברי (FBS), וגורמי גדילה משלימים את מדיום צמיחת תאי האנדותל 2 לטיפוח קווי תאים hDPSC ו- HUVEC, בהתאמה. הכן את מדיום הגדילה הספרואידית ההטרוצלולרית hDPSC / HUVEC על ידי הוספת מדיית גדילה של HUVEC ו- hDPSC ביחס של 1:1.
- הכינו 70%-90% תרבית תאים מתמזגת (כ-3-4 ימי הכנה). ליצירת כדוריות הטרו-תאיות, הכינו תרביות hDPSC ו-HUVEC בהתאמה.
הערה: מספר המעבר של HUVEC ו- hDPSC לא יעלה על 8. כדי להבטיח צמיחה מהירה של תרביות תאים תמיד יתפצלו ב-1/3 מכלל תרבית התאים (ב-70%-80% מפגש) באמצעות בקבוקון חדש כל 3 עד 4 ימים. - יש לשטוף 70%-90% מתרבית תאים מתמזגת עם PBS (37°C) (10 מ"ל לכל 75 ס"מ2 בקבוקונים). הוסיפו תמיסת אנזים דיסוציאציה (0.05% טריפסין ו-1 mM EDTA; 1 מ"ל לכל 75 ס"מ2 צלוחית) ודגרו למשך 3-5 דקות ב-37 מעלות צלזיוס ב-5% CO2, 95% לחות לניתוק תאים ובדיקת ניתוק התאים מתחת למיקרוסקופ. לאחר שתסיים, נטרל את הטריפסין עם מדיה מלאה של תרבית תאים המכילה 10% FBS (5 מ"ל של מדיה לכל 1 מ"ל של תמיסת דיסוציאציה).
הערה: מנע חשיפת יתר של תאים לתמיסת האנזים המתנתק מכיוון שהדבר עלול להשפיע על הכדאיות שלהם. - עבור HUVEC בתרבית במדיום FBS נמוך, בצע נטרול טריפסין על ידי הוספת 0.5 מ"ל של 100% FBS לתרבית התאים שטופלה בטריפסין, ולאחר מכן צנטריפוגה כדי להעביר תאים למדיום הגדילה שלהם.
הערה: תרחיפי התאים המתקבלים צריכים להכיל כ-1 מיליון תאים לכל 1 מ"ל. במידת הצורך, ניתן להוסיף לפרוטוקול שלב צנטריפוגה נוסף כדי לרכז את מתלי התא. - ניתוק אגרגטים של תאים על ידי צנרת באמצעות קצה פיפטה של 1000 μL בחלק העליון של פיפטה סרולוגית של 10 מ"ל כדי לקבל תרחיף חד-תאי. השתמש בתא ספירה (המוציטומטר מסוג נויבאואר או חלופות) כדי לספור את מספר התאים לכל 1 מ"ל של תרחיף התא34. דיללו את תרחיף התא ל-500,000 תאים למ"ל. עבור hDPSC הטרו-תאי / HUVEC ביחס ספרואידי של 1:1, הוסף נפחים שווים של תרחיפי תאים תואמים כדי לקבל ריכוז תאים סופי של 500,000 תאים למ"ל.
הערה: וריאציה של ריכוז התאים בתרחיף המתווספת לחותמת אגרוז במיקרו-תבנית מאפשרת לשנות את הגודל הממוצע של הספרואידים המיוצרים, התלוי במספר התא לכל מיקרווול של חותמת אגרוז. במערך המתואר, ספרואידים של כ-300 תאים נוצרים מ-1 מ"ל המכילים 500,000 תאים על בול אגרוז עם 1585 מיקרו-וולים. - הוסיפו תמיסת גשושית O2 מרוכזת (ננו-חלקיקים, מלאי של 1 מ"ג/מ"ל) לתרחיף התא המוכן לריכוז סופי של 5 מיקרוגרם/מ"ל.
הערה: היווצרות ספרואידים בנוכחות ננו-חלקיקים בעלי חישת O2 מספקת צביעה יעילה, שנשמרת למשך 5 ימים לפחות (איור 1D). לעומת זאת, צביעה של ספרואידים רב-תאיים מוכנים מראש עם ננו-חלקיקים תהיה פחותיעילה 15. - החליפו 1 מ"ל של מדיה ישנה בבאר מיקרו-פטרוסה של לוחות תרבית תאים מצופים אגרוז ב-12 בארות (ראו שלב 1.1.7) עבור 1 מ"ל של תרחיף התא המוכן (500,000 תאים ל-1 מ"ל, עם בדיקה של 5 מיקרוגרם/מ"ל O2 ). תרבית את הספרואידים בחממת CO2 במשך 2-5 ימים בנוכחות רציפה של הגשושית O2 כדי להבטיח את העמסתה במהלך היווצרות ודחיסת כדוריות.
הערה: הימנעו מהתאדות בינונית מוגזמת בתרבית הספרואידית. במידת הצורך, בזהירות (אל תפריעו לספרואידים במיקרווולים) הוסיפו 0.2-0.5 מ"ל של מדיית תרבות עם דילול הבדיקה הנוסף O2 . - לאחר היווצרות הספרואידים, החליפו את מדיית הגדילה בחדשה ללא הגשושית. צביעת הגשושית תישמר בספרואידים הנוצרים למשך 7-14 ימים או יותר, מה שיאפשר ניטור ארוך טווח של האותות שלה בספרואידים.
2. הדפסה ביולוגית של ספרואידים
הערה: ספרואידים מודפסים ביולוגית בביו-אינק מבוסס ג'לטין שעבר שינוי בתקרילאמיד (GelMA). להלן תיאור של מרכיבי הביו-אינק, הליך הכנת הביו-אינק וההדפסה הביולוגית.
- הכנת ביואינק
- הכינו תמיסת GelMA של 10% (w/v) (2 מ"ל) בתווך תחת זרימת אווירלמינרית 35 באופן הבא: שקלו 0.2 גרם של GelMA סטרילי עם דרגת החלפה של 78 בצינור 15 מ"ל, הוסיפו 1.9 מ"ל של α-MEM ותנו לו להתמוסס על ידי ערבוב על שייקר סיבובי ב-37 מעלות צלזיוס (~2 שעות).
הערה: אל תוסיף את מלוא כמות המדיום, מכיוון שתרכובות אחרות כגון ספרואידים ו- Li-TPO-L יוזם תמונה יתווספו מאוחר יותר. - משחזרים את הספרואידים בבארות המיקרו-פטריות על ידי צנרת ואוספים אותם בצינור של 15 מ"ל. בצע שטיפה נוספת עם PBS כדי להבטיח שכל הספרואידים נאספים ממיקרווולים אגרוזים. הימנעו מלגעת/פגיעה במיקרווולים האגרוזיים, שכן פתיתי אגרוז יכולים לחסום את המחט במהלך ההדפסה הביולוגית.
- לאסוף ספרואידים על ידי צנטריפוגה בצינור 15 מ"ל ב 300 x g במשך 5 דקות ב 20 מעלות צלזיוס. לשאוף את הסופרנאטנט עם פיפטה, להוסיף 50 μL של תווך לספרואידים ולהחיות אותם על ידי צנרת עדינה.
- מוסיפים את התערובת הספרואידית לתמיסת ה-GelMA החמימה ומערבבים על ידי צנרת עדינה. שמרו על ריכוז הספרואידים ל-6340-12860 ספרואידים (מ-4-8 מיקרו-פטרנים) לכל מ"ל של ביואינק להדפסה ביולוגית. הימנעו מריכוזים גבוהים יותר של ספרואידים מכיוון שהם גורמים בקלות לחסימה של מחט ההדפסה.
- הוסיפו תמיסת Li-TPO-L (32 מ"ג/מ"ל) שעברה עיקור מסנן בריכוז סופי של 2 מול% ביחס למספר האג"ח הכפולות וערבבו על ידי צנרתעדינה של 36,37.
הערה: ניתן לחשב את כמות Li-TPO-L בהתאם למשוואה:
נפח הפוטו-יניטיטור (PI) = (0.000385 מול NH2- קבוצות / g של GelMA x 294.10 גרם Li-TPO-L / מול x 0.78 x 0.02) / 0.032 גרם Li-TPO-L / mL x 0.2 גרם GelMA = 0.0107 mL Li-TPO-L stock
- הכינו תמיסת GelMA של 10% (w/v) (2 מ"ל) בתווך תחת זרימת אווירלמינרית 35 באופן הבא: שקלו 0.2 גרם של GelMA סטרילי עם דרגת החלפה של 78 בצינור 15 מ"ל, הוסיפו 1.9 מ"ל של α-MEM ותנו לו להתמוסס על ידי ערבוב על שייקר סיבובי ב-37 מעלות צלזיוס (~2 שעות).
- הליך הדפסה ביולוגית
- ראה את השלבים בפרוטוקול משלים 1 לתכנון פיגומים ב- CAD. כדי להדפיס את העיצוב, בצע את השלבים הבאים.
- סגור את הקצה של מחסנית 3 סמ"ק סטרילית עם מכסה קצה (מנעול לואר) ומלא בביואינק על ידי צנרת. הכנס בוכנה למחסנית. החזיקו את המחסנית במהופך והסירו את מכסה הקצה, דחפו את הבוכנה לכיוון הביואינק עד שכל האוויר מהמחסנית יוסר.
הערה: הימנעו מהמגע בין הביואינק של GelMA לבין דפנות המחסנית, שכן הדבר עלול לעכב את תנועת הבוכנה עקב ג'לציה של הביואינק. - תנו לביואינק להתקרר במעטפת החימום של הביופרינטר בטמפרטורה של 23 מעלות צלזיוס (20-30 דקות). בורג במתאם לחץ בחלק העליון של המחסנית. סגור את התפס על צינור הכניסה כדי למנוע מהביואינק לדלוף, הרכיב מחט PE חרוטית של 22 G על המחסנית. התאימו את גודל המחט ואת קוטרה לתכנון הפיגום ולקוטר וריכוז הספרואידים.
הערה: ללבוש מסכת פה וכפפות מרוססות כדי למנוע זיהום. - מרססים את הביופרינטר ב-70% אתנול ומנגבים אותו יבש בנייר סופג. התקן את המחסנית במעטפת החימום על ראש ההדפסה המבוסס על שחול. חבר את כניסת הלחץ ופתח את התפס בכניסה. טען את קובץ ה- G-code של העיצוב שלך לתוכנת ההדפסה.
- התחל במדידת אורך המחט. לווסת את לחץ ההדפסה על ידי חלוקת מעט ביואינק בצלחת פטרי סטרילית. לחץ הדפסה של 0.025-0.045 MPa אופייני להדפסת ביו-אינקים מבוססי GelMA38.
- התקינו צלחת של 6 בארות, פתחו את לוח הבאר, סגרו את מכסה המנוע והתחילו להדפיס. לאחר ההדפסה, הנח לפיגומים להיות מקושרים פיזית למשך 10 דקות בטמפרטורה של 5 מעלות צלזיוס ולהקרין את הפיגומים המודפסים במשך 60 שניות עם מנורת LED UV (365 ננומטר; 500 mW על פי היצרן).
הערה: זמן ההצלבה של UV תלוי בתכונות של אור ה- UV, סוג יוזם הצילום והריכוז, דרגת הקישור הצולב הרצוי של הפיגום, הנפיחות ומודולוס האלסטיות. - הוסיפו מיד את מדיית הגדילה המתאימה המכילה 100 U/mL של פניצילין ו-100 מיקרוגרם/מ"ל של סטרפטומיצין (P/S) לכל הבארות עם רשתות מודפסות ביולוגית (2 מ"ל לכל באר של צלחת תרבית תאים בת 6 בארות).
- תרבית בחממת CO2 של 37 מעלות צלזיוס עד שתתחילו במיקרוסקופיה. עבור מיקרוסקופיית בנייה מודפסת ביולוגית, העבירו רשת וופל מודפסת לתוך צלחת מיקרוסקופיה, כסו במדיית הדמיה והמשיכו עם שלבים 3.2 ו-3.3.
הערה: במקרה של מבנים צפים שהודפסו ביולוגית, הם צריכים להיות קבועים בצלחת המיקרוסקופיה ללא השפעה על כדאיות התא, למשל, עם דבק ציטו-קומפטבילי. עבור העברת מיקרוסקופ הפוך, ההדפסה הביולוגית לתוך צלחת מיקרוסקופיה עם תחתית זכוכית וכיסוי במדיית הדמיה (~200-500 μL, ראה הערה לשלב 3.1 להרכב מדיית ההדמיה) כדי למנוע ציפה לא רצויה של הדגימה. ניתן לבצע צביעה בבדיקות פלואורסצנטיות נוספות בצלחת תרביות התאים לפני העברת מבנים מודפסים ביולוגית לצלחות מיקרוסקופיה (ראו שלב 3.1.6).
3. מיקרוסקופיה חיה פלואורסצנטית רציומטרית של חמצון ספרואידים ברקמה הביו-פבריקטית
הערה: כדי להמיר את תגובת העוצמה היחסית (R) של הגשושית O2 לרמות ההיפוקסיה בפועל, יש לכייל את תגובת הבדיקה באמצעות הליכים המתואריםב-24. עם זאת, מכיוון שהכיול היחסי הוא ספציפי למכשיר ומחייב התקנה של חממה מבוקרת T/O2/CO2 (לא תמיד זמינה), השימוש בזיהוי יחסים חצי-כמותיים הוא האפשרות המועדפת.
- הכנת ספרואידים לניתוח הדמיה חיה
- לחיבור ספרואידים במהלך שלב זה, יש לצפות מראש את מנות המיקרוסקופיה הסטריליות בקולגן IV ו/או פולי-D-ליזין או להשתמש בכלי39 הזמינים מסחרית. בדוק את התאימות של צלחות מיקרוסקופיה עם מרחק העבודה ומאפיינים אחרים של מטרת המיקרוסקופ שלך.
הערה: במקרה של הדמיה מרובת פרמטרים, כל הליכי ההכתמה הנוספים צריכים להיעשות במנות צלחת התרבית עם כמות מספקת של מדיה המגנה על התאים מפני אידוי, הלם אוסמוטי או מתח אחר. מכינים ומלחמים את מדיום ההדמיה לפני השימוש: DMEM בתוספת נתרן ביקרבונט (1.2 גרם/ל'), HEPES-Na, pH 7.2 (10 מ"מ), נתרן פירובט (1 מ"מ), L-גלוטמין (2 מ"מ) וגלוקוז (5 מ"מ), ללא פנול אדום. - באמצעות פיפטה של 1 מ"ל, שטפו בעדינות את הספרואידים המוכתמים מראש של הגשושית O2 מהמיקרוולים האגרוזים. בעוד הספרואידים עדיין צפים בתקשורת, מעבירים אותם לצינור תחתונה חרוטי של 15 מ"ל.
- כדי להבטיח את איסוף כל הספרואידים מבאר מיקרו-פטרואידית, שטפו את הבאר 1-3 פעמים עם תוספת של 1 מ"ל של מדיית תרבית, תוך שילוב כל ההשעיות הספרואידיות בבקבוקון אחד. השאירו את הבקבוקון במצב אנכי למשך עד 10 דקות כדי לאפשר לספרואידים להתיישב בתחתית הבקבוקון וליצור כדור נראה לעין.
- יש להסיר בזהירות את המדיה מהצינור ולהשאיר את הספרואידים ללא הפרעה. יש להחיות אותם בעדינות בכמות מדיום התרבית הטרייה שתספיק לפחות ל-20 ספרואידים לכל צלחת דגימת מיקרוסקופיה. זה ימזער את השימוש במדיה התרבותית ויפשט את איתור הספרואידים במהלך ההדמיה.
הערה: השתמש בחלק הסיליקון הניתן להתאמה האוטומטית של צלחת 12 הבארות של μ-תאי (ראה טבלת חומרים) המחוברת לזכוכית הכיסוי כצלחת דגימה של מיקרוסקופיה (24 x 60 מ"מ, עובי #1) עם נפח מדיה מקסימלי של 300 μL לכל באר. ניתן לעקר את חלק הסיליקון של תא התרבית הזה ולעשות בו שימוש חוזר עם כל משטחי פלסטיק וזכוכית אחרים כאשר הם נצמדים למנה. - יש להוסיף מיד נפח שווה של תרחיף ספרואידי לכל צלחת/באר מיקרוסקופיה. השאירו את הספרואידים למשך שעה אחת בטמפרטורה של 37 מעלות צלזיוס בחממת CO2 כדי להתחבר לפני השטח של צלחת המיקרוסקופיה. עבור ניתוח חמצון יחד עם השימוש בצבעים אחרים להמשיך עם שלב 3.1.6. לניתוח חמצון פשוט המשך עם שלב 3.1.7.
הערה: זמן דגירה לא מספיק (<1 שעות) עלול להוביל להסרה ואובדן של ספרואידים מדי פעם במהלך חילופי המדיה, ובכך לבטל את הניסוי. יחד עם זאת, דגירה מוגזמת (>3 שעות) עלולה להוביל לאובדן חלקי או מלא של הארגון התלת-ממדי שלהם עקב נדידת תאים מספרואידים למשטח צלחת המיקרוסקופיה ולהשפיע על החמצון שלהם בזמן אמת. - (אופציונלי) החליפו בזהירות את המדיום באחת המכילה בדיקות פלואורסצנטיות המדוללות לריכוז מכתים והמשיכו בדגירה במשך שעה אחת נוספת כדי להגיע לעוצמה אופטימלית. כדי למנוע הסרה של ספרואידים במהלך חילופי מדיה, שאפו בזהירות את המדיום עם פיפטה של 200 μL משולי כלי המיקרוסקופיה ובצעו תוספת בינונית בצד בצלחת המיקרוסקופיה. המשך עם שלב 3.1.7.
הערה: לצביעה יעילה עם בדיקות בעלות דיפוזיה לקויה באגרגטים רב-תאיים, יש להאריך את ריכוז ההעמסה ו/או את זמן ההעמסה. לפני השימוש, קבעו את הפרמטרים האופציונליים לטעינת גשושית בניסויים ראשוניים. - מוציאים את המדיום מצלחת המיקרוסקופיה ושוטפים פעם אחת במדיית הדמיה. הוסיפו את הכמות המדויקת של מדיית ההדמיה לדגימה (לדוגמה, 300 μL לכל מיקרווול של תא μ של צלחת תרבית בת 12 בארות). המשך עם שלב 3.2.
- לחיבור ספרואידים במהלך שלב זה, יש לצפות מראש את מנות המיקרוסקופיה הסטריליות בקולגן IV ו/או פולי-D-ליזין או להשתמש בכלי39 הזמינים מסחרית. בדוק את התאימות של צלחות מיקרוסקופיה עם מרחק העבודה ומאפיינים אחרים של מטרת המיקרוסקופ שלך.
- רכישת תמונה
- הפעל את המיקרוסקופ והתקנים מחוברים (כלומר, מקור אור עירור, מצלמה, מחשב, אינקובטור ובלוקים אלקטרוניים אחרים הפועלים) 30 דקות לפני ההדמיה כדי להתחמם ולהיות שיווי משקל לתנאי המדידה (טמפרטורה, ערכים שונים של O2, 5% CO2, לחות במידת הצורך). הפעל את תוכנת ההפעלה של המיקרוסקופיה המסופקת עם הגדרת המיקרוסקופ המדויקת.
הערה: הפרוטוקול המתואר מותאם לתוכנת CellSens Dimension v.3. - בחר את מסנני העירור (מקור, הספק) ופליטת המזהמים המתאימים ואת זמן החשיפה עבור בדיקות פלורסנטיות (או זרחניות) נבחרות. עבור ניתוחי מיקרוסקופיה מרובי פרמטרים, תלת-ממדים וזמן- קצוב, כתוב את פרוטוקולי רצף המדידה האוטומטיים בתוכנת המיקרוסקופים הפועלים.
- קבעו באופן אמפירי את הגדרות ההדמיה האופטימליות עבור כל גשושית, מודל ניסיוני וקו תאים בניסויים ראשוניים. ודא שלההגדרות יש מינימום פוטו-הלבנה בתעלות ייחוס (Iref) ו-O2 חישה (Isens) והשפעה מינימלית על יחס העוצמה (R = Iref / Isens), במיוחד בניסויי מדידה תלת-ממדיים וזמן-חלוף.
- הגדירו את צלחת המיקרוסקופיה עם ספרואידים מוכתמים בשלב המיקרוסקופיה. באמצעות מטרת ההגדלה הנמוכה, צפו בתצוגה מקדימה של הדגימה באור השידור, עשו התמקדות ראשונית בספרואידים ואתרו אותם במרכז התמונה.
הערה: יעדי אוויר סטנדרטיים של הגדלה של 4x עד 10x יספיקו למיקוד מראש, בעוד שלמדידה בפועל אנו ממליצים על 20x עד 40x עם צמצם מספרי (NA) של 0.6 ומעלה (טבילה באוויר או במים) מטרות בעלות מרחק עבודה מספיק עבור ספרואידים המחוברים לצלחת. - הביאו את המטרה עם ההגדלה הגבוהה הנדרשת לעמדת העבודה. התמקדו במצב אור שידור בחתך האמצעי (המשווני) של הספרואיד. חמצון בעצמים תלת-ממדיים תלוי ישירות בעומק קטע ההדמיה. כדי להבטיח זאת, נתחו חתכים דומים בתוך ובין קבוצות, למשל, חתכים אמצעיים ועליונים/תחתונים של ספרואידים.
הערה: לצורך ניתוח ושחזור מפורטים ומדויקים של מעברי צבע O2 , אנו ממליצים לסרוק ולייצר ערימות Z באמצעות מיקרוסקופים קונפוקליים, יריעות אור או שני פוטונים (האפשרות הטובה ביותר). עבור מיקרוסקופיית שדה רחב קונבנציונלית, שבה האות מכל חתכי הרוחב ייאסף בו זמנית, ניתן לבצע הערכה ממוצעת על ידי חתך הביניים ולא ניתוח מדויק של גרדיאנטים O2 . במקרה זה, החתך האמצעי מוגדר כחתך מוקד, שבו לספרואידים יש קוטר מקסימלי עם התמקדות חדה בגבולותיהם. - התאם הגדרות לאיסוף אותות ייחוס פלואורסצנטיים/זרחניים וערוצים ספקטרליים רגישים של הגשושית O2 ובדיקות פלואורסצנטיות אחרות המיושמות להדמיה רב-פאראמטרית.
- לצורך השוואה מבוססת עוצמה כמותית, יש להחיל את אותן הגדרות הדמיה שנבחרו של זמן החשיפה, עוצמת מקור האור של העירור, הרזולוציה, מהירות הסריקה וגודל חור הפין עבור כל העצמים הנמדדים בקבוצות.
הערה: גרסאות רבות של תוכנות מיקרוסקופיה המסופקות על-ידי הספק מאפשרות חישובים אוטומטיים של יחס העוצמה. החל מיזוג פונקציות על מדידות עוצמה של ייחוס וערוצים רגישים של גשושית O2 , בעת כתיבת תוכנית רכישת ההדמיה במנהל הניסוי בתוכנת ההדמיה המשמשת כאן. - אסוף תמונות מאותו קטע אופטי לצורך ייחוס וערוצים ספקטרליים רגישים של הגשושית O2 , ובמידת הצורך, ערוצים פלואורסצנטיים נוספים. עבור פרוטוקול זה, השתמש בבדיקה MMIR1 עם הייחוס האדום (exc. = 580 ננומטר, em. = 650 ננומטר) ובסמוך אינפרא אדום O2-רגיש (exc. = 635 ננומטר, em. = 760 ננומטר) ספקטרה.
- חזור על שלבים 3.2.5-3.2.8 כדי לאסוף מספר מספיק של נקודות נתונים לניתוח סטטיסטי. לצורך ניתוח דינמי של התגובות התאית המתפתחות במהירות עם טיפול בתרופות שונות, מעכבי מיטוכונדריאליים או מעכבים של שרשרת הובלת אלקטרונים ותרכובות אחרות הפועלות במהירות, השתמש במצב מדידת קיטועי הזמן (שלב 3.2.10).
- בצע את המדידות במדיית ההדמיה, בטמפרטורה של 37 מעלות צלזיוס עם תאורה מחזורית של הדגימה ואסוף אותות של הפלואורופורים המעניינים (למשל, ערוצי ייחוס וחישה של גשושית O2 ), למשל, כל 10 שניות למשך יותר מ-2 דקות.
- בצע בדיקת מיקוד עבור כל ספרואיד לאחר ביצוע המדידה התקופתית כדי לוודא שלא היה סחף מיקוד במהלך ההדמיה. חזור על הפעולה במידת הצורך. המשך עם שלב 3.3 לניתוח נתונים.
הערה: ללא גירוי תאים ותוספת סמים, ניתן לבצע מדידת קיטועי זמן כדי להעריך את יכולת הצילום, בהשוואה לצבע הייחוס, למשל, פלואורסצין, קלצין ירוק AM או טטרה-מתיל-רהודמין מתיל אסטר.
- הפעל את המיקרוסקופ והתקנים מחוברים (כלומר, מקור אור עירור, מצלמה, מחשב, אינקובטור ובלוקים אלקטרוניים אחרים הפועלים) 30 דקות לפני ההדמיה כדי להתחמם ולהיות שיווי משקל לתנאי המדידה (טמפרטורה, ערכים שונים של O2, 5% CO2, לחות במידת הצורך). הפעל את תוכנת ההפעלה של המיקרוסקופיה המסופקת עם הגדרת המיקרוסקופ המדויקת.
- מצגת תמונה
הערה: כאן אנו מתארים כיצד לחשב באופן אוטומטי O2 יחס עוצמת בדיקה (R) בספרואידים באמצעות פונקציית ניתוח יחסים בתוכנת ההדמיה והחלת חישוב פיקסל אחר פיקסל R כדי ליצור תמונות התפלגות R בצבע כוזב של מקטע מיקרוסקופיה ספרואידית. ניתן גם לחשב את R באופן ידני מנתוני העוצמה של ייחוס וערוצים ספקטרליים רגישים שנאספו מאותו אזור עניין (ROI) של התמונה הספרואידית על ידי יישום הנוסחה הפשוטה R = Iref/אניסנס24,34. אם לא ניתן לחלץ את נתוני העוצמה מהתמונה הגולמית בתוכנת המיקרוסקופיה המתאימה, ניתן לקבל את נתוני העוצמה באמצעות תוכנות כגון ImageJ או Fiji (ראה דיון).- פתח את קובץ ה- .vsi עם נתוני עוצמת בדיקה של O2 מתוך ייחוס וערוצים ספקטרליים רגישים שנעשו במצב ממוזג. פתח את חלון פונקציית ניתוח היחס מתפריט המדידה. בחר את עוצמת ערוץ הייחוס כנומרטור ואת עוצמת הערוץ הרגיש כמכנה לחישוב R.
הערה: היחס ההפוך של ייחוס ואותות רגישים לחישוב R אפשרי גם הוא, אך במקרה זה, R יקטן עם העלייה ב- O2. - החל את הגדרות סף העוצמה המתאימות על כל ערוץ ספקטרלי כדי להחסיר את הרקע מתמונת העוצמה הממוזגת. המשך להגדיל את ערכי הסף עד שרקע התמונה יהיה שחור באופן אחיד. החל את פרמטר הסף באופן שווה על כל התמונות הספרואידיות בערכת הנתונים המשמשת בניתוח השוואתי.
הערה: השתמש בחלון התצוגה המקדימה כדי למטב את הגדרות הסף על-ידי תצפית בתמונת ה-R בצבע הכוזב המחושב הראשוני של ספרואידים. כל הפיקסלים בעוצמה נמוכה מהערך הנוכחי בשדה הסף יוסרו מניתוח R ויוצגו ככתמים שחורים. לאחר יישום הסף, יש לדמיין רק את האזור המתאים לפלואורסצנציה כדורית. ההערכה הראשונית של עוצמת הרקע הממוצעת (אזורים ללא ספרואידים) של הערוצים הספקטרליים הבלתי תלויים מפשטת את הבחירה של סף מתאים לתמונה. בנוסף, יישום של גבולות ROI כדוריים, המזוהים מתמונת כדורי האור המתאימה לתמונת הפלואורסצנציה הממוזגת מסייע בקביעה מדויקת של פרמטרי הסף כדי למנוע חיסור מוגזם של עוצמות האות שאינן ברקע. - שמור את הגדרות הרקע עבור עוצמות הנומרטור והמכנה ב- 0, מכיוון שהרקע כבר הוחמר באמצעות יישום סף.
- התאם את גורם שינוי קנה המידה (שינוי קנה המידה) לתמונת היחס עד שתמונת התצוגה המקדימה תספק את הרזולוציה הרצויה של מעבר הצבע R. החל את פרמטר קנה המידה באופן שווה על כל התמונות הספרואידיות במערך הנתונים המשמש בניתוח השוואתי.
הערה: פרמטר שינוי קנה המידה צריך להיות גדול מספיק (לפחות 1,000) כדי להבטיח שתמונת R תכיל מידע רב ככל האפשר וניתן יהיה להציג אותה כגורם רזולוציה עבור נתונים מספריים R. - החל פרמטרים מותאמים על התמונה הספרואידית, על-ידי לחיצה על החל. התאם את הבהירות והניגודיות של התמונה בחלון התצוגה 'כוונן' מתפריט חלונות הכלים.
- קבע באופן ידני את גבולות הקישור והניתוק של היסטוגרמה של התפלגות יחס באמצעות אפשרות שינוי קנה המידה הקבועה בחלון התאם תצוגה. פעולה זו תקבע את הטווח של סרגל הצבעים המזויף עבור הצגת הפרמטר R.
הערה: כדי להשוות תמונות ספרואידיות בין קבוצות שונות, חשוב לשמור על טווח סרגל צבעים דומה עבור כל הדגימות האנליטיות. מכיוון שטווח השינויים של פרמטר R יכול להיות שונה בין קבוצות, טווח סרגל הצבעים הכוזב שנבחר צריך להיות אוניברסלי עבור היסטוגרמות התפלגות בכל הקבוצות האנליטיות. - כדוריות אינן לעתים קרובות כדוריות באופן אידיאלי, נניח שקוטר הספרואיד הוא הקו הארוך ביותר המשורטט דרך המרכז (לעתים קרובות ליבה היפוקסית) של הספרואיד. באמצעות פונקציית הסרגל הליניארי מתפריט המדידה, קבע את קוטר הספרואיד. ייצוא נתונים כקובץ טבלת גיליון אלקטרוני.
- בחר את ההחזר על ההשקעה של גודל נדרש (קטן ככל האפשר) וצורה (למשל, עגול) והחיל אותו על הפריפריה ועל הליבה ההיפוקקסית של הספרואיד. הפוך את החזר ההשקעה לאובייקט המדידה כדי לנתח את ה-R הממוצע (R-R-Rp היקפי ו-R-R-Rc) בתוך החזר ההשקעה שנבחר. ייצא נתונים בתבנית טבלה תואמת לגיליון אלקטרוני.
הערה: לספרואידים אין התפלגות O2 זהה בקרב הקבוצה והליבות ההיפוקסיקליות אינן מתמזגות באופן מושלם עם מרכזי הספרואידים. כדי לפשט ולתקנן את הניתוח אנו מניחים כי האזורים היפוקסיים ביותר תואמים את הליבה האידיאלית במרכז הספרואיד. Rc הנמדד באזורים אלה מיושם עבור חישובים של טווח גרדיאנט O2 (Rp-R c) ותלילות (Rp-R c) /r, כאשר r (באופן אידיאלי, מרחק בין ROIs פריפריה לליבה היפוקסית) הוא רדיוס משוער של הספרואיד ב- μm המחושב ממדידות הקוטר. לחלופין, ניתן להציג את מעברי הצבע של Spheroid O2 כפרופילי קו ליניאריים של שינוי פרמטר R (חלון פרופיל שורה בתפריט מדידה) שנעשו לאורך קוטר הספרואיד. ניתן לייצא נתונים אלה גם כקובץ טבלת גיליון אלקטרוני. - החל מדידות על כל מקטע מיקרוסקופיה של ספרואידים כדי לקבל את מערך הנתונים של קוטרי הספרואידים, Rc ו- Rp כדי לבצע חישובים נוספים והשוואה סטטיסטית. שלב את כל הנתונים בקובץ גיליון אלקטרוני אחד.
- לניתוח בהילוך מהיר של הלבנת תמונות או תגובות דינמיות לגירויים שונים, החל את ההחזר על ההשקעה שנבחרה על אותן קואורדינטות בכל תמונה בקבוצה. כדי להשוות פרמטרים של R, הצג אותם כאחוז מה- R של המחזור הראשון בערכת תמונות של קיטועי זמן.
- לניתוח הלבנת תמונות, השתמש ב-R מכמה ROIs כדי לחשב את ה-R הממוצע באחוזים עבור כל מחזור של הקפאת זמן ולעקוב אחר השינויים.
- נניח שאפקט ההלבנה של הפוטו אינו קריטי אם הייתה ירידה של פחות מ-5% בעוצמה הראשונית לאחר 12 מחזורים של תאורה רציפה. השווה תמיד שינויים דינמיים עם עקומת הלבנת תמונות כבקרה כדי להבטיח את המשמעות של תגובת קיטועי זמן יחסית (ראו איור 2A,B).
- מהפרמטרים שהתקבלו לחשב r, (Rp-R c) ו- (Rp-R c) / r עבור ספרואידים בודדים בערכת נתונים. לנתח את הנורמליות של התפלגות הנתונים על ידי קולמוגורוב-סמירנוב או בדיקות רלוונטיות. בחר את השיטה הסטטיסטית המתאימה לניתוח נתונים והמשך עם נתוני הצגת נתונים.
הערה: הנתונים שהוצגו כאן התפלגו באופן נורמלי ובדיקת t עצמאית ב- p = 0.05 יושמה לצורך השוואה סטטיסטית בין קבוצות ספרואידיות.
- פתח את קובץ ה- .vsi עם נתוני עוצמת בדיקה של O2 מתוך ייחוס וערוצים ספקטרליים רגישים שנעשו במצב ממוזג. פתח את חלון פונקציית ניתוח היחס מתפריט המדידה. בחר את עוצמת ערוץ הייחוס כנומרטור ואת עוצמת הערוץ הרגיש כמכנה לחישוב R.
תוצאות
ייצור התפוקה הגבוהה של כדוריות מוכתמות מראש של גשושית O2 באמצעות שיטת אגרוז מיקרו-פטרוס מודגם באופן סכמטי באיור 1C ומראה דוגמאות של מיקרווולים אגרוזים ללא ועם הספרואידים המוכתמים מראש. היעילות של היווצרות ספרואידים על ציפוי אגרוז וצורתם/כדוריותם יכולה להיות ספציפית לתא. לדוגמה, תאי HCT116 של המעי הגס האנושי מעולם לא יצרו מבנים כדוריים אידיאליים בשיטת מיקרווול אגרוז, בניגוד למשטח מצופה שומנים17, בעוד שתאי hDPSCs לבדם ובתרבית משותפת עם HUVEC ייצרו תמיד כדוריים בעלי צורה וגודל הניתנים לשחזור באופן פרופורציונלי להרכב התא, מספר התא ההתחלתי ומשך היווצרות/גדילת הספרואידים. כל סוגי התאים שנבדקו הצטברו ביעילות ננו-חלקיקי גשושית O2 במהלך היווצרות ספרואידים (איור 1B) ושמרו על הכתם הזה במשך 5 ימים לפחות, מה שאפשר את השימוש בהם להדפסה ביולוגית ולניטור לאחר מכן של חמצון הרקמה המודפסת ביולוגית (איור 1D).
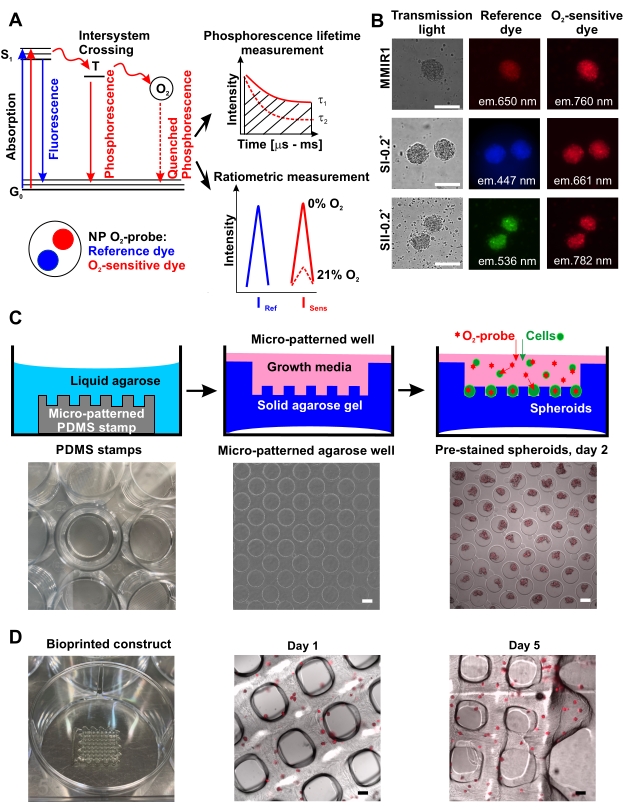
איור 1: עקרון תפקוד הגשושית O2 ויישומו עבור צביעה והדפסה ביולוגית של ספרואידים. (A) דיאגרמת יבלונסקי פשוטה, המסבירה את העיקרון של חישת O2 על ידי הגשושיות הננו-חלקיקיות הזרחניות (NP). העברת האנרגיה ל-O2 המולקולרי במהלך המצב הנרגש של השלישייה האסורה (T) מובילה לירידה בעוצמת הזרחן ביחס הפוך ל-21% O2, שהוא הזמן שבין עירור למצב אורך חיים של זרחן טאו, τ (שינויים מ-τ1 ב-0% O2 ל-τ2), שהוא הזמן שבין עירור למצב סינגלט (S1) לבין חזרתו למצב הקרקע (G0)42. מדידה כמותית של O2 יכולה להיעשות על ידי מדידה יחסית או על ידי מדידת τ (מדידות אורך חיים של זרחן). (B) דוגמה לצביעה של כדוריות תאי גזע של עיסת שיניים אנושית (hDPSC) המוכתמות בסוגים שונים של גשושיות ננו-חלקיקיות O2, המוצגות בתעלות פלואורסצנציה של אור שידור, ייחוס וצבע O2. סרגל קנה המידה הוא 100 μm. (C) סכמות של גשושית O2 בתפוקה גבוהה גשושית מוכתמת מראש יצירת ספרואידים בשיטת אגרוז מיקרו-פטרית. משמאל לימין: חותמת סיליקון PDMS המונחת בבאר של צלחת התרבית, דוגמה לתבנית מיקרווול באגרוז (הגדלה של פי 4), ודוגמה לספרואידים מוכתמים מראש MMIR1 שהופקו מתאי סרטן המעי הגס האנושי HCT116 ביום השני לאחר זריעה על אגרוז מיקרו-פטרוזי (הגדלה של פי 4). סרגל קנה המידה הוא 100 מיקרומטר( D) משמאל לימין: מבנה וופל מודפס ביולוגית וניתוח מיקרוסקופיה של מבנה ספרואידי מוכתם מראש MMIR1 בימים 1 ו-5 לאחר ההדפסה הביולוגית. האות הפלואורסצנטי מתאים לצבע זרחני רגיש ל-O2 בננו-חלקיקי MMIR1 (exc. = 635 ננומטר/em. = 760 ננומטר). סרגל קנה המידה הוא 400 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
במערך המיקרוסקופי המתואר (מיקרוסקופ פלואורסצנטי קונבנציונלי בשדה רחב המצויד בדיודה פולטת האור (LED) כמקור אור) נמצאה הגשושית MMIR1 האדומה/קרובה-אינפרה-אדומה כטובה ביותר מבחינת יציבות הצילום של הייחוס שלה וצבעים רגישים עם ירידה של פחות מ-5% בבהירות יחס העוצמה ההתחלתי שלהם (R = Iref/Isens ) לאחר 12 מחזורים של תאורה רציפה. זה איפשר שימוש בגשושית MMIR1 למחקר דינמי בזמן אמת של תגובה נשימתית מהירה בספרואידים hDPSC עם טיפול ב-uncoupler מיטוכונדריאלי (FCCP) ומעכב של קומפלקס I של שרשרת הובלת אלקטרונים (רוטנון) (איור 2A,B). מצאנו שבספרואידים שמקורם בתאי גזע, FCCP הראה רק השפעה קלה של אי-שיתוף פעולה עם ירידה קלה בנשימה של התאים תוך כ-80 שניות לאחר הוספת תרופה זו, בהתאם לתכונות מטבוליות שדווחו בעבר של DPSC40. מצד שני, רוטנון עיכב מאוד את הנשימה והוביל לתיאוקסיגנציה של הספרואידים (המשתקפת כעלייה של יחס הפריפריה של Rp - ספרואיד ו-Rc - יחס הליבה של הספרואידים) ולפיזור של גרדיאנטים מהפריפריה לליבה O2 בטווח של כ-80 שניות לאחר הגירוי (איור 2A). כיול למחצה דו-נקודתי של יחס הבדיקה MMIR1 (R) ברמה גבוהה (אטמוספרית) ונמוכה (בנוכחות נתרן סולפיט ואוקסידאז גלוקוז במדיית ההדמיה) רמות O2 אישרו את הירידה ב-R, הקשורה לירידה בחמצון בספרואידים עם נשימה מעוכבת ראשונית על ידי טיפול בקוקטייל אנטימיצין A/רוטנון (איור 2C ), הממחיש כיצד ניתן ליישם את המדידה של גשושית MMIR1 R לניטור כמותי למחצה של תגובות מצב יציב וחמצון מהיר לטווח ארוך בתלת-ממד.

איור 2: ניתוח קינטי של תגובת גשושית O2 לגירויים שונים. (A) תוצאה מייצגת של הדמיית חמצון ספרואידי hDPSC במנוחה ובתגובה לטיפולי FCCP ורוטנון. סרגל קנה המידה הוא 100 μm. (B) תגובה קינטית של יחס עוצמת MMIR1 לטיפול ב- FCCP ורוטנון בהשוואה לקינטיקה של יחס עוצמת ההלבנה הראשונית (%). (C) שינויים בתמונות יחס העוצמה של גשושית MMIR1 בספרואידים hDPSC במצבים מחומצנים (תוספת אנטימיצין A + רוטנון) ו deoxygenated (תוספת גלוקוז אוקסידאז). סרגל הצבע מייצג את התפלגות יחס עוצמת הבדיקה O2 (R = Iref / Isens) על פני התמונה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
כדי להמחיש את יישום הבדיקה של MMIR1 להדמיה מטבולית חיה, בוצע הניתוח ההשוואתי של גרדיאנטים O2 ב-hDPSC הומו-תאי לעומת כדוריות hDPSC/HUVEC הטרו-תאיות (1:1). ניצול הזמינות של ערוצים ספקטרליים פלואורסצנטיים כחולים וירוקים חופשיים עם Hoechst 34580 (HXT) ו-SYTOX Green (SYTOX) בוצע כדי להדגים את היישום של גשושית O2 למחקרים מולטי-פאראמטריים (איור 3). באמצעות הפרוטוקול האוטומטי של חישובי יחס העוצמה בין פיקסל לפיקסל שסופקו על ידי תוכנת ההדמיה תמונות יחס צבע כוזב של התפלגות R בספרואידים הופקו, והדמיינו את מעברי הצבע של O2 שזוהו בזמן אמת בפריפריה לליבה בכל סוגי הספרואידים: עם הפריפריה המחומצנת והנישות ההיפוקסיקיות במרכז (איור 2 ואיור 3A). עם זאת, ערכי Rp ו-R c, כמו גם התלילות של גרדיאנט O2 בחתכי הרוחב האמצעיים, השתנו עבור סוגים שונים של ספרואידים: ראו את פרופילי הקווים של חתכי הרוחב האמצעיים ב-hDPSC לעומת הספרואידים hDPSC/HUVEC ו-hDPSC לעומת כדוריות hDPSC המודפסות ביולוגית (איור 3B,C). מכיוון שלא הייתה דרך מקובלת לתאר גרדיאנטים של O2, הצגנו מספר פרמטרים המאפשרים השוואה קלה ותיאור מפורט של חמצון ספרואידי כללי: Rp ו- Rc, ומאפיינים כאלה של שיפועים O2 כהבדל בין האזורים המחומצנים וההיפוקסיים כמו (Rp-R c), ושינויים ממוצעים של חמצון למיקרומטר כמו (Rp-R c) / r, כאשר r הוא מרחק בין פריפריה לליבה היפוקסית, המתאם בחתך האמצעי עם רדיוס ספרואידי (איור 3D). השוואה סטטיסטית של פרמטרים אלה יחד עם הנתונים של תאים מתים נמקיים שהודמיינו על ידי SYTOX בספרואידים, סייעו לנו להסיק מסקנות ראשוניות על מקורם של גרדיאנטים של התפלגות O2 הספציפיים לתא כדורי.

איור 3: ניתוח השוואתי של גרדיאנטים של חמצון בספרואידים. (A) דוגמאות מייצגות של מיקרוסקופיה חיה של חמצון (מיקרוסקופיה פלואורסצנטית יחסית של MMIR1) וכתמי תאים חיים/מתים (Hoechst 34580, HXT, כחול ו-SYTOX Green, SYTOX) בכדורי hDPSC הומו-תאיים לפני ואחרי ההדפסה, ובספרואידים hDPSC/HUVEC הטרוצלולריים (1:1). hDPSCs בכל סוגי הספרואידים היו מאותה תרבית תאים. הספרואידים הוכתמו מראש ב-5 מיקרוגרם/מ"ל של גשושית MMIR1 במשך יומיים במהלך היווצרותם, ולאחר מכן שימשו להדמיה או להדפסה ביולוגית (רק כדוריות hDPSC), עם ניתוח הדמיה מאוחר יותר ביום הראשון לאחר ההדפסה הביולוגית. תמונות בצבע כוזב של יחסי העוצמה (Iref/Isens) של תמונות של כדוריות מוכתמות MMIR1 תואמות את מעברי הצבע O2 הפריפריה לליבה שלהן. סרגל קנה המידה הוא 100 מיקרומטר. סרגל הצבעים מייצג את התפלגות יחס עוצמת הבדיקה O2 (R = Iref/Isens) על פני התמונה. מספרים 1 ו-2 של חתכי רוחב בקוטר תואמים לפרופילי העוצמה המוצגים ב-B וב-C. (B,C) השוואת פרופילי יחס העוצמה בין hDPSC הומוגני לעומת כדורי hDPSC/HUVEC הטרוגניים (B) לבין כדוריות hDPSC הומוגניות לפני ואחרי הדפסה ביולוגית (C). הפרופילים נמדדו עבור חתכי רוחב של ספרואידים המוצגים ב-(A). (D) ייצוג סכמטי של פרמטרים המשמשים לתיאור גרדיאנטים של O 2-גרדיאנטים מהפריפריה לליבה בספרואידים, כאשר r הוא רדיוס של ספרואיד ו-Rp ו-Rc הם יחסי העוצמה של הפריפריה ואזור הליבה של הספרואיד בהתאמה. סרגל הצבעים מייצג באופן סכמטי את ההתפלגות של מעבר O2 מרמות גבוהות (אדומות) לנמוכות (כחולות) בספרואיד כדורי אידיאלי. (ה,ו) ניתוח השוואתי של ערכי פריפריה-לליבה O 2-גרדיאנטים (Rp-R c) / r ערכים בספרואידים hDPSC/HUVEC ו-hDPSC (E) ובספרואידים hDPSC לפני וביום הראשון לאחר ההדפסה הביולוגית (F). ניתוח סטטיסטי נעשה עבור חזרה ניסיונית אחת (n = 18-23). תיבות מתאימות לסטיות תקן. כוכביות מציינות את ההבדל הסטטיסטי בין הקבוצות (ב- p = 0.05); ** = עמ' < 0.0005. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
בהשוואה לספרואידים hDPSC הומו-תאיים, לספרואידים hDPSC/HUVEC היו שיפועים תלולים יותר באופן משמעותי: ערכים גבוהים יותר של (Rp-R c c) / r פרמטר וטווח (Rp-R c; איור 3F). במקביל, הם הציגו חמצון גבוה יותר של הפריפריה (Rp) והליבה (Rc) (איור 4A, טבלה 1). באופן מעניין, הם גם היו גדולים יותר מבחינה סטטיסטית (איור 4A, טבלה 1), מה שמרמז על כך שהבדלים כאלה בחמצון נגרמו על ידי הפרופילים הביו-אנרגטיים התאיים השונים שלהם. נתונים אלה תואמים את התכונות המטבוליות הידועות של תאי HUVEC בעלי פעילות נשימה נמוכה יותר בדרך כלל של תאים עם הסתמכות חזקה על מסלולי גליקוליזה ופנטוז-פוספט כמקורות הביו-אנרגטיים העיקריים של ATP ו-NAD(P)H41. יחד עם זאת, גרדיאנט O2 המובהק מהפריפריה לליבה שנוצר בספרואידים הטרוגניים נוצר ככל הנראה על ידי hDPSC בהרכבם, המאופיין במיטוכונדריה היפר-קוטבית ובשרשרת הובלת אלקטרונים פעילה40 , ועל פי התוצאות על חמצון ספרואידים hDPSC, בעל פעילות נשימה חזקה (איור 3, איור 4A וטבלה 1 ). לפיכך, בדרך כלל כדאיות גבוהה יותר של כדורי hDPSC/HUVEC המאושרת על ידי העוצמה הנמוכה יותר של כתמי התאים המתים שלהם ב-SYTOX (איור 3A) קשורה באופן פוטנציאלי לרמות החמצון הגבוהות יותר שלהם.
כדי להמחיש את הישימות של הדמיית מיקרוסקופיה חיה של חמצון ספרואידים בביו-פבריקציה, נעשה שימוש בספרואידים מוכתמים מראש של MMIR1 O2-probe להדפסה ביולוגית בביו-אינק של GelMA עם ההשוואה הבאה של שיפועי O2 בספרואידים hDPSC לפני וביום הראשון לאחר ההדפסה הביולוגית (איור 3A,C,F, איור 4B וטבלה 2). לספרואידים hDPSC שהודפסו ביולוגית היו פריפריה מחומצנת באופן משמעותי (Rp גבוה יותר) בהשוואה לספרואידים, שנמדדו לפני ההדפסה הביולוגית, בעוד שלחמצון הליבה שלהם היו ערכים דומים (איור 4B). שינויים בחמצון הפריפריה שלהם משפיעים על הטווח (עלייה של (Rp-R c) והתלילות (מוגברת (Rp-R c)/r) של שיפועי ה-O2 מהפריפריה לליבה שלהם, שהיו שונים סטטיסטית מספרואידים של hDPSC שנמדדו לפני ההדפסה הביולוגית (איור 3F ואיור 4B). צביעת התאים המתים הייתה בדרך כלל בהירה יותר בספרואידים מודפסים ביולוגית, מה שמרמז על כך שהפחתת הכדאיות של הספרואידים מעורבת בשינוי של חמצון ספרואידים (איור 3A).

איור 4: ניתוח השוואתי של ספרואידים מוכתמים ב-MMIR1 בקוטר וביחס העוצמה. (B) השוואה בין כדורי hDPSC הומו-תאיים לפני ואחרי ההדפסה הביולוגית. Rp ו-Rc - יחס העוצמה בפריפריה ובליבה של הספרואידים בהתאמה; (Rp-R c) - ההבדל ביחס העוצמה, המתאים לטווח של גרדיאנט O2 בספרואידים. ניתוח סטטיסטי נעשה עבור שכפול ניסיוני אחד (n = 18-23). תיבות מתאימות לסטיות תקן. כוכביות מציינות את ההבדל הסטטיסטי בין קבוצות (ב- p = 0.05), כאשר * = p < 0.005 ו- ** = p < 0.0005. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| סוג ספרואיד (N) | קוטר [μm] | Rp [a.u.] | Rc [a.u.] | Rp-R c [a.u.] | (Rp-R c)/r [a.u./μm] |
| hDPSC / HUVEC (18) | 113.2 ± 10.6 | 0.779 ± 0.034 | 0.398 ± 0.055 | 0.982 ± 0.051 | 0.00677 ± 0.00091 |
| hDPSC (18) | 88.1 ± 9.9 | 0.558 ± 0.025 | 0.331 ± 0.034 | 0.227 ± 0.032 | 0.00520 ± 0.00090 |
| ערך p | 1.5 x 10-8 * | 1.5 x 10-21 * | 1.3 x 10-4 * | 1.4 x 10-12 * | 9.2 x 10-6 * |
טבלה 1. קוטר הספרואידים, יחס העוצמה בליבה (Rc) והפריפריה (Rp) של הספרואידים, ההבדל ביחס העוצמה (Rp-R c) ו-(Rp-R c c) / r ערך ב-hDPSC/HUVEC הטרוגניים ובספרואידים hDPSC הומוגניים. ערך p של מבחן t על N ספרואידים מדגים הבדל סטטיסטי ומסומן גם בכוכבית.
| סוג ספרואיד (N) | קוטר [μm] | Rp [a.u.] | Rc [a.u.] | Rp-R c [a.u.] | (Rp-R c)/r [a.u./μm] |
| hDPSC (18) | 88.1 ± 9.9 | 0.558 ± 0.025 | 0.331 ± 0.034 | 0.227 ± 0.032 | 0.00520 ± 0.00090 |
| hDPSC מודפס ביולוגית (23) | 80.9 ± 12.5 | 0.584 ± 0.023 | 0.323 ± 0.038 | 0.261 ± 0.039 | 0.00658 ± 0.00144 |
| ערך p | 0.054 | 0.0024 * | 0.46 | 9.9 x 10-4 * | 6.3 x 10-6 * |
טבלה 2. קוטר הספרואידים, יחס העוצמה בליבה (Rc) והפריפריה (Rp) של הספרואידים, ההבדל ביחס העוצמה (Rp-R c) ו-(Rp-R c) / r ערך בספרואידים הומוגניים hDPSC לפני ואחרי ההדפסה הביולוגית. ערך p של ניתוח סטטיסטי (N spheroids). ההבדל הסטטיסטי מצוין בכוכבית.
Discussion
משמעות. מדידת חמצון רקמות מספקת תובנה על חילוף חומרים ספציפי לתאים ולרקמות, צמיחה והתפתחות של רקמות, כדאיות, גידולים סרטניים ונדידת תאים, ואינטראקציה עם חיידקים ופתוגנים אחרים. השיטה המוצגת נותנת כלי חדש להבנה טובה יותר של הפיזיולוגיה של תרביות ספרואידים רב-תאיות: ניתוח חמצון עם בדיקות ננו-חלקיקים יחסמטריות O2 ומספקת אמצעים להערכת היפוקסיה, המדמה את ההסתמכות על מסלולי ייצור אנרגיה מסוימים ומשלימה מחקרי מידול וגישות הדמיה מטבוליות חלופיות43,44 על מיקרוסקופ פלואורסצנטי בעלות נמוכה הזמין באופן נרחב. מדידות רציומטריות יכולות להתבצע על שדה רחב פלואורסצנטי (עדיף עירור LED פועם), קונפוקל לסריקת לייזר, יריעת אור ומיקרוסקופים דו-פוטונים, המצוידים באופן אידיאלי בתאי אינקובטור T ו- O2. חשוב לציין שמדידת המיקרוסקופיה O2 המוצגת ניתנת לשילוב בקלות עם ניתוח רב-פרמטרים חיים של פרמטרים פיזיולוגיים שונים ומעקבי תאים (במקרה של תרביות כדוריות הטרו-תאיות), כדאיות (צביעה חיה/מתה), חילוף חומרים של שומנים (בדיקות פלואורסצנטיות עם חישת שומנים), דינמיקה של pH (צבעים, ננו-חלקיקים וחלבונים פלואורסצנטיים) או [Ca2+ ], מבוצע בתעלות ספקטרליות פלואורסצנטיות זמינות או במקביל, תוך מתן מבט מורחב על תפקוד התא בזמן אמת בספרואידים, מבנים מודפסים ביולוגית והשתלות רקמות פוטנציאליות.
תרביות ספרואידיות מוצאות שימוש במחקרים על תאים סרטניים, מיקרו-סביבה של נישה של גידולים ותאי גזע, גידולים סרטניים, יעילות תרופות ובדיקת רעילות, ואכן כאבני בניין רקמה לביו-פבריקציה של רקמות והרכבה עצמית45. הם יכולים להיווצר ממספר סוגי תאים על ידי מגוון גישות שונות46. הפופולריות של המודל הספרואידי מחייבת את הסטנדרטיזציה שלהם מנקודת המבט של שלמות המחקר ושיפור ניתוח הנתונים, אשר נוסה לאחרונה על ידי פיתוח של מסד הנתונים הספרואידי הראשון8.
הפרוטוקול שלנו צפוי לעזור להבין טוב יותר את חילוף החומרים של הספרואידים החיים, לתקנן את המודל הניסיוני הזה, ובהמשך לשפר את היציבות, יכולת השכפול והכדאיות שלהם לטווח הארוך בתוך חומרים מודפסים ביולוגיים ומושתלים.
שינויים. פרוטוקול זה מתאר את השימוש במשטח אגרוז בעל דבקות נמוכה (היווצרות מבוססת מיקרומולד29) לייצור תפוקה גבוהה של ספרואידים עמוסי גשושיות O2 לניתוח חמצון. השיטות החלופיות לייצור כדוריות כגון טיפה תלויה, יישום של לוחות חיבור נמוכים במיוחד, ציפוי שומנים או היווצרות צפה בחופשיות תואמות גם הן לפרוטוקול העמסת הגשושית O2 המוצע. הפרוטוקול שהוצג היה מותאם לספרואידים hDPSC ולספרואידים מתרבית משותפת של hDPSC עם HUVEC (1:1). קווי תאים אחרים בהחלט ישימים 15,17,47,48; עם זאת, ייתכן שתידרש אופטימיזציה מסוימת של הפרוטוקול בשל תכונות הידבקות התא השונות, תנאי התרבית, דרישות המצע המטבולי ותאימות התאים עם צביעת ננו-חלקיקים. הבחירה בגשושית מתאימה מבוססת ננו-חלקיקים יחסית O2-רגישה צריכה להיעשות בהתאם למודל התא הספציפי ועל פי תכונות הפוטו-הלבנה של הגשושית במערך המיקרוסקופיה המשומש (עוצמת וסוג מקור האור, הרגישות הספקטרלית של המצלמה) וזמינותם של מסנני עירור/פליטה מתאימים לייחוס תואם וערוצים ספקטרליים רגישים ל-O2 של הגשושית.
חלק מהגשושיות היחסיות O2 זמינות מסחרית2. לחלופין, ניתן להכין אותם בתוך הבית על ידי משקעים משותפים של ייחוס וצבעים רגישים ל-O2 עם פולימר כמתואר במקום אחר 24,25,49. עבור כל מודל בנפרד, הבדיקות הראשוניות צריכות להיעשות על מנת לקבוע את הבדיקה המתאימה ואת תנאי המיקרוסקופיה האופטימליים ולמזער את ההשפעה של הלבנת תמונות של בדיקה או צריכת O2 פוטואינדוצית במהלך מדידות יחסמטריות. מחקרים קודמים על ננו-חלקיקים בעלי חישת O2 הדגימו את רעילותם הנמוכה של התאים, ואפשרו יישום במגוון רחב של ריכוזי צביעה (1-20 מיקרוגרם/מ"ל). מכיוון שחלק מהננו-חלקיקים הקטיוניים יכולים לצבור את עצמם במהלך האחסון, אנו ממליצים לשמור על ריכוז ההעמסה שלהם נמוך ככל האפשר כדי למזער את ההשפעה הפוטנציאלית שלהם על היווצרות הספרואידים. לחלופין, ניתן לסנן את תרחיף הננו-חלקיקים (0.2 מיקרומטר) או לנקותו על ידי צנטריפוגה (10,000 x גרם, 5 דקות) לפני השימוש כדי להסיר את כל האגרגטים מההשעיה.
למרות שתוכנת BioCAD ו- HMI הן ספציפיות עבור הביופרינטר המוצג, פרוטוקול זה חל על מדפיסים ביולוגיים אחרים, שכן מסופקים הכנת הביואינק, ההרכבה, מילוי מחסנית סטנדרטית והתכנון של פיגום הידרוג'ל נקבובי. יתר על כן, הפרמטרים של הדפסה ביולוגית כגון קצב הדפסה וטמפרטורה צריכים להיות דומים עבור מדפיסים ביולוגיים שונים המבוססים על שחול. לחץ ההדפסה וקוטר התמוכת תלויים בסוג המחט ובקוטר, בהרכב הביואינק, בטמפרטורה ובצמיגות הנובעת מכך, אך הם יכולים להוות נקודת התחלה לאופטימיזציה של פרמטרי ההדפסה לביו-אינקים מבוססי GelMA עם ביו-פרינטרים שונים, אם כי חלק מהביו-פרינטרים משתמשים בצירים במקום בלחץ אוויר כדי להוציא את הביופיאנק50.
שלבים קריטיים ופתרון בעיות. אחד השלבים הקריטיים הוא הבחירה בגשושית O2 , המבוססת על השיקולים הבאים: ראשית, מערך המיקרוסקופ הפלואורסצנטי הזמין (כלומר, מקור אור עירור תואם, מסננים לעירור ופליטה, רגישות למצלמה ושידור ספקטרלי וצמצם מספרי של המטרה), שיכול להגביל את מספר הגשושיות הזמינות ביחס ליציבות הצילום שלהן, בהירות ופוטוטוקסיות פוטנציאלית. חשוב גם לציין כי סוגים מסוימים של שמן טבילה (במקרה של מטרות טבילת שמן) יכולים להפריע לאותות פלואורסצנטיים אדומים ואינפרה-אדומים. אנו רואים את מבחני הצילום כחשובים ביותר וכי יש לבצע אותם במהלך ההקמה הראשונית והבדיקות המקדימות. יש לקחת בחשבון הצלבה ספקטרלית פוטנציאלית בין הערוצים הפלואורסצנטיים לצבעים שונים. ואכן, יש להעריך את הרעילות הכהה והפוטו-אינדוקטיבית הפוטנציאלית של הגשושית O2 ושל צבעים נבחרים אחרים, ביחס למודל התא הספציפי, במהלך אופטימיזציה של פרוטוקול51. הבעיה הספציפית עבור ננו-חלקיקים יכולה להיות הצבירה העצמית שלהם, אותה ניתן למתן על ידי אופטימיזציה של ריכוז העבודה שלהם, הרכב מדיום הכתם (למשל, תכולת הסרום), סוניזציה של ננו-חלקיקים לפני ערבוב עם תווך או על ידי שימוש בתאים מוכתמים ושטופים מראש של גשושית O2 להיווצרות ספרואידים במקום העמסת גשושית במהלך היווצרות הספרואידים והליך הדחיסה.
לא הבחנו בבעיות הקשורות לעומק חדירת האור עם מודלים ספרואידיים מתוארים, אך יש לקחת זאת בחשבון בעת בחירת אותות עוצמה יחסמטריים, גודל של מבנים ספרואידיים וביו-פבריקטים (שתלי רקמות) ואופטימיזציה של צביעת תאים בצבעים המתאימים. גשושית MMIR1 בעלת אורכי גל של פליטת אדום וקרוב-אינפרה-אדום תואמים היטב צפויה לספק את הרקע הנמוך ביותר ואת חדירת אור הרקמות הטובה ביותר, בהשוואה לבדיקות ביוסנסור פלואורסצנטיות אחרות הפולטות אדום/כחול או ירוק.
ייצור וטיפול בתמונות יחס (וייתכן שביטול ספקטרלי או דה-קונבולוציה) יכולים להיעשות בתוכנה המסופקת על ידי ספק או באפשרויות openource כגון ImageJ, פיג'י52,53, napari (https://napari.org), MATLAB ואחרים. שלב קריטי יהיה בהפחתת הרקע ובמדידת שינויים בעוצמת האות בטווח ליניארי.
כיול של גשושית O2: רוטנון ואנטימיצין A הם מעכבים של קומפלקסים I ו-III של שרשרת הובלת האלקטרונים המיטוכונדרית, בהתאמה, חוסמים את הנשימה שלהתאים 54,55,15 וגורמים לפיזור של שיפועים O 2-גרדיאנטים בספרואידים ושיווי משקלם עם O 2 הסביבתי. לפיכך, שינוי הריכוז הסביבתי O2 (כלומר, 20%, 15%, 10%, 5%, 2.5%, 1%, 0% O2) יאפשר כיול עוצמה יחסית או כיול חיי זרחן של הגשושית הרגישה O2 בתאים. בדרך כלל, חממות מבוקרות O2 אינן מסוגלות להשיג 0% O2 מוחלט ובמצבים מסוימים, נדרשת בדיקה מהירה של תגובה של בדיקה לדיאוקסיגנציה. במקרים כאלה, 25-100 מיקרוגרם / מ"ל של גלוקוז אוקסידאז או Na2SO3/K2HPO4 תערובת (50 מ"ג / מ"ל עבור כל תרכובת עבור תמיסה 10x במים מזוקקים) יש להוסיף לדגימה. חשוב לציין שאם לקו התאים יש מידה משמעותית של צריכת O2 שאינה מיטוכונדריאלית, קחו זאת בחשבון בעת ביצוע עיכוב של ניסויי נשימה וכיול.
מגבלות ומחקר עתידי. המגבלה העיקרית של השיטה המוצעת והזיהוי היחסי באופן כללי, היא הכיול וההמרה של רמות היחס הנצפות לרמות O2 בפועל, אשר בשל הבדלים מהותיים בהגדרות רכישת החומרה ותמונת המשתמש יהפכו את כיול היחס למכשיר ספציפי לתא. חשוב לציין, עבור מיקרוסקופ פלואורסצנטי רחב שדה והגדרה מתוארת, תמונות היחס משקפות הקרנות משולבות ולא מקטעים אופטיים אידיאליים וכיול O2 לא יהיה הגיוני. מאידך גיסא, אנו מראים כי מדידות יחסים כמותיות למחצה מספקות פנוטיפ השוואתי מובהק סטטיסטית וקל למדידה של ספרואידים המופקים ממקורות שונים ויש להם הבדלים בחמצון.
המחקר העתידי ביצירת גישות מיקרוסקופיה נגישות ומשתלמות יותר המיועדות לעצמים תלת-ממדיים חיים כגון SPIM, יריעת אור, תטא, הדמיה לכל החיים של שני פוטונים ולומינסנציות בשילוב עם למידת מכונה 56,57,58,59,19, יסייעו בהבאת הדמיית O 2 רב-פרמטרית ליישומים כמותיים עוד יותר.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענק קרן המחקר המיוחדת של אוניברסיטת גנט (BOF / STA / 202009 / 003) ותוכנית FP7 ITN של האיחוד האירופי "Chebana", הסכם מענק מס '264772 (עבור AVK). הנתונים זמינים על פי בקשה. קוד G להדפסה ביולוגית זמין לשיתוף.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | Gibco | 25300-054 | Also available from Sigma |
| 12 well cell-culture plates, sterile | Greiner bio-one | 665-180 | Similar products are also available from Sarstedt, Corning and other companies. |
| 12 Well Chamber slide, removable | Ibidi | 81201 | Also available from Grace Bio-Labs, ThermoFisher Scientific and others |
| 15 mL centrifuge tubes | Nerbe plus | 02-502-3001 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| 3cc Cartridge, UV secure, luer lock | RegenHU | C-033CC-UV | Also available from CelIink and others |
| 3D Discovery Bioprinter | RegenHU | N/A | Bioprinter equiped with an extrusion based printhead, heating mantle, UV-LED curing lamp, 3D Discovery HMI software (CAD/CAM software with direct machine control) and BioCAD software (version 1.1-12) |
| 6 well cell-culture plates, sterile | Greiner bio-one | 657160 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Antimycin A from Streptomyces sp. | Sigma-Aldrich | A8674-25MG | Used as inhibitor of complex III of the mitochondrial electron transport chain, blocking cell respiration |
| B-Braun Tip Cap, luer lock | RegenHU | TC-BB-B | Also available from Regemat, Cellink and others |
| Cell view cell culture dish, PS, 35/10mm, glass bottom, 1 compartment, sterile | Greiner bio-one | 627861 | For microscopy of bioprinted spheroids |
| Collagen from human placenta, type IV | Sigma | C5533 | For the preparation of 0.07mg/mL Collagen and 0.03mg/mL Poly-D-lysine coated microscopy dishes |
| D(+)-Glucose | Merck | 8342 | Prepare 1M stock solution, 1/100 for preparation of imaging medium (final concentration 10mM) |
| Dulbecco's modified Eagle's medium (DMEM), phenol red-, glucose-, pyruvate- and glutamine-free | Sigma-Aldrich | D5030-10X1L | For preparation of imaging medium |
| Endothelial Cell Growth Medium 2 | PromoCell | C-22011 | Also available from Lonza and others |
| Endothelial Growth SupplementMix | PromoCell | C-39216 | Also available from Lonza and others |
| FCCP, Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma-Aldrich | C2920-10MG | Used as mitochondrial uncoupler |
| Fetal Bovine Serum | Gibco | 10270-098 | Also available from Sigma |
| GelMA | N/A | N/A | GelMA was synthesized by the PBM group (Prof Dr Peter Dubruel and Sandra Van Vlierberghe, University of Gent) [https://www.sciencedirect.com/science/article/pii/S0142961213011782] but are also available from Xpect Inx |
| Glucose-oxidase from Aspergillus nige (10000 u) | Sigma-Aldrich | G7141 | Used to test the response of probe to deoxygenation |
| GlutaMAX 100x Supplement | Gibco | 35050-038 | Dilution 1/100 for preparation of imaging medium (final concentration 2mM) |
| HEPES (1M) | Gibco | 15630-080 | Dilution 1/100 for preparation of imaging medium (final concentration 10mM) |
| Hoechst 34580 | Invitrogen (Life Technologies) | H21486 | Also available from Sigma, BDBiosciences and others |
| Human dental pulp stem cells (hDPSC) | Lonza | PT-5025 | Also available from ATCC or other vendors |
| Human umbilical vein endothelial cells (HUVEC) | Lonza | CC-2517 | Also available from ATCC or other vendors |
| KH2PO4 (potassium dihydrogen phosphate) | Merck | 4873 | For preparation of sodium sulfite solution (5 mg / mL Na2SO3 and 5 mg / mL KH2PO4). Prepare fresh from 10x concentrated stock solution daily. |
| Li-TPO | N/A | N/A | Li-TPO-L was synthesized by the PBM group (Prof Dr Peter Dubruel and Sandra Van Vlierberghe, University of Gent) [https://link.springer.com/referenceworkentry/10.1007%2F97 8-3-319-45444-3_15) , https://asmedigitalcollection.asme.org/nanoengineeringmedical/article/6/2/021001/376814/Hybrid-Tissue-Engineering-Scaffolds-by-Combination] but comparable photo-initiators are available from Sigma |
| MEM Alpha Medium + Glutamax Minimum essential medium | Gibco | 32561-029 | Also available from Sigma and others |
| Micro-patterned 3D-printed PDMS stamps, wells with a diameter 400 µm, thickness, total well numbers 1585 | Self-fabricated | These stamps were self-fabricated by the Centre for Microsystems Technology (Professor Dr Jan Vanfleteren, University of Gent) but can also be obtained commercially from Merck (Z764094, Microtissues 3D Petri Dish micro-mold mixed spheroid kit) | |
| Na2SO3 (sodium sulfite) | Sigma-Aldrich | 239321-500G | For preparation of sodium sulfite solution (5 mg / mL Na2SO3 and 5 mg / mL KH2PO4). Prepare fresh from 10x concentrated stock solution daily. |
| O2 probes: MMIR1, SI-0.2+, SII-0.2+ | N/A | N/A | Can be prepared ‘in-house’ using commercially available dyes, polymers and precipitation method [https://pubs.acs.org/doi/abs/10.1021/nn200807g https://onlinelibrary.wiley.com/doi/abs/10.1002/adfm.201201387 ]. Some nanoparticles are available commercially as discussed in [https://link.springer.com/article/10.1007/s00018-018-2840-x ] |
| Pen Strep :Penicillin (10,000 U/mL) / streptomycin (10,000 μg/mL) 100x solution | Gibco | 15140-122 | Also available from Sigma . Apply in dilution 1:100 |
| Petri dishes, sterile | Greiner bio-one | 633181 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Piston for 3cc cartridge | RegenHU | P-03CC-UV | Also available from Cellink, Regemat and others |
| Poly-D-lysine | Sigma | P6407-5mg | For the preparation of 0.07mg/mL Collagen and 0.03mg/mL Poly-D-lysine coated microscopy dishes |
| PVDF syringe filter 0.22 µm | Novolab | A35149 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Rotenone | Sigma-Aldrich | R8875-1G | Used as inhibitor of complex I of the mitochondrial electron transport chain, blocking cell respiration |
| Sodium pyruvate (100 mM) | Gibco | 11360-070 | Dilution 1/100 for preparation of imaging medium (final concentration 1mM) |
| SYTOX Green | Invitrogen (Life Technologies) | S7559 | Also available from Sigma, Promega and others |
| Taper tip 22 gauge (conical PE needle | Amada Myachi Europe | 22K62222 | Similar products are also available from RegenHU, Cellink, Regemat and others |
| Tissue culture flask (75 cm2) | VWR | 734-2313 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Ultrapure Agarose | Invitrogen (Life Technologies) | 16500-500 | Other types of Agarose such as Agarose low melting point (A-9414, Sigma), Agarose for routine use (A-9539, Sigma) |
| Widefield fluorescence inverted microscope | Olympus | N/A | Inverted fluorescence microscope IX81, with motorised Z-axis control, CoolLED pE4000 (16 channels, 365-770 nm), ORCA-Flash4.0LT (Hamamatsu) cMOS camera, glass warming plate Okolab, CellSens Dimension v.3 software and air objectives 4x/0.13 UPlanFLN and 40x/0.6 LUCPlanFLN. (Optional, for high-resolution imaging) 60x/1.0 LUMPLFLN water |
References
- Papkovsky, D. B., Dmitriev, R. I. Biological detection by optical oxygen sensing. Chemical Society Reviews. 42 (22), 8700-8732 (2013).
- Papkovsky, D. B., Dmitriev, R. I. Imaging of oxygen and hypoxia in cell and tissue samples. Cellular and Molecular Life Sciences. 75 (16), 2963-2980 (2018).
- Cordeiro, I. R., Tanaka, M. Environmental oxygen is a key modulator of development and evolution: From molecules to ecology: Oxygen-sensitive pathways pattern the developing organism, linking genetic and environmental components during the evolution of new traits. BioEssays. 42 (9), 2000025 (2020).
- Wenger, R. H., Kurtcuoglu, V., Scholz, C. C., Marti, H. H., Hoogewijs, D. Frequently asked questions in hypoxia research. Hypoxia. 3, 35 (2015).
- Erecińska, M., Silver, I. A. Tissue oxygen tension and brain sensitivity to hypoxia. Respiration Physiology. 128 (3), 263-276 (2001).
- Gholipourmalekabadi, M., Zhao, S., Harrison, B. S., Mozafari, M., Seifalian, A. M. Oxygen-generating biomaterials: a new, viable paradigm for tissue engineering. Trends in Biotechnology. 34 (12), 1010-1021 (2016).
- Zheng, L., Kelly, C. J., Colgan, S. P. Physiologic hypoxia and oxygen homeostasis in the healthy intestine. A review in the theme: cellular responses to hypoxia. American Journal of Physiology-Cell Physiology. 309 (6), 350-360 (2015).
- Peirsman, A., et al. MISpheroID: a knowledgebase and transparency tool for minimum information in spheroid identity. Nature Methods. 18 (11), 1294-1303 (2021).
- Suvarnapathaki, S., Wu, X., Lantigua, D., Nguyen, M. A., Camci-Unal, G. Breathing life into engineered tissues using oxygen-releasing biomaterials. NPG Asia Materials. 11 (1), 1-18 (2019).
- Salazar-Noratto, G. E., et al. Understanding and leveraging cell metabolism to enhance mesenchymal stem cell transplantation survival in tissue engineering and regenerative medicine applications. Stem Cells. 38 (1), 22-33 (2020).
- Leedale, J. A., et al. Mathematical modelling of oxygen gradients in stem cell-derived liver tissue. Plos One. 16 (2), 0244070 (2021).
- Sutherland, R., et al. Oxygenation and differentiation in multicellular spheroids of human colon carcinoma. Cancer Research. 46 (10), 5320-5329 (1986).
- Walenta, S., Dötsch, J., Bourrat-Flöck, B., Mueller-Klieser, W. Size-dependent oxygenation and energy status in multicellular tumor spheroids. Oxygen Transport to Tissue XII. , (1990).
- Hompland, T., Fjeldbo, C. S., Lyng, H. Tumor hypoxia as a barrier in cancer therapy: Why levels matter. Cancers. 13 (3), 499 (2021).
- Dmitriev, R. I., Zhdanov, A. V., Nolan, Y. M., Papkovsky, D. B. Imaging of neurosphere oxygenation with phosphorescent probes. Biomaterials. 34 (37), 9307-9317 (2013).
- Dmitriev, R. I., Borisov, S. M., Jenkins, J., Papkovsky, D. B. Multi-parametric imaging of tumor spheroids with ultra-bright and tunable nanoparticle O2 probes. Imaging, manipulation, and analysis of biomolecules, cells, and tissues XIII. , (2015).
- Dmitriev, R. I., et al. Versatile conjugated polymer nanoparticles for high-resolution O2 imaging in cells and 3D tissue models. ACS Nano. 9 (5), 5275-5288 (2015).
- Okkelman, I. A., Puschhof, J., Papkovsky, D. B., Dmitriev, R. I. Visualization of Stem Cell Niche by Fluorescence Lifetime Imaging Microscopy. Intestinal Stem Cells. , 65-97 (2020).
- Dmitriev, R. I., Intes, X., Barroso, M. M. Luminescence lifetime imaging of three-dimensional biological objects. Journal of Cell Science. 134 (9), 1-17 (2021).
- Yasukagawa, M., Yamada, K., Tobita, S., Yoshihara, T. Ratiometric oxygen probes with a cell-penetrating peptide for imaging oxygen levels in living cells. Journal of Photochemistry and Photobiology A: Chemistry. 383, 111983 (2019).
- Xie, B. -. R., et al. A near infrared ratiometric platform based π-extended porphyrin metal-organic framework for O2 imaging and cancer therapy. Biomaterials. 272, 120782 (2021).
- Düssmann, H., Perez-Alvarez, S., Anilkumar, U., Papkovsky, D. B., Prehn, J. H. Single-cell time-lapse imaging of intracellular O 2 in response to metabolic inhibition and mitochondrial cytochrome-c release. Cell Death & Disease. 8 (6), 2853 (2017).
- Roussakis, E., et al. Theranostic biocomposite scaffold membrane. Biomaterials. 212, 17-27 (2019).
- Kondrashina, A. V., et al. A phosphorescent nanoparticle-based probe for sensing and imaging of (intra) cellular oxygen in multiple detection modalities. Advanced Functional Materials. 22 (23), 4931-4939 (2012).
- Borisov, S. M., et al. Precipitation as a simple and versatile method for preparation of optical nanochemosensors. Talanta. 79 (5), 1322-1330 (2009).
- Borisov, S., Nuss, G., Klimant, I. Red light-excitable oxygen sensing materials based on platinum (II) and palladium (II) benzoporphyrins. Analytical Chemistry. 80 (24), 9435-9442 (2008).
- Strobl, M., Rappitsch, T., Borisov, S. M., Mayr, T., Klimant, I. NIR-emitting aza-BODIPY dyes-new building blocks for broad-range optical pH sensors. Analyst. 140 (21), 7150-7153 (2015).
- Tsytsarev, V., et al. In vivo imaging of brain metabolism activity using a phosphorescent oxygen-sensitive probe. Journal of Neuroscience Methods. 216 (2), 146-151 (2013).
- Fukuda, J., et al. Micromolding of photocrosslinkable chitosan hydrogel for spheroid microarray and co-cultures. Biomaterials. 27 (30), 5259-5267 (2006).
- Thomsen, A. R., et al. A deep conical agarose microwell array for adhesion independent three-dimensional cell culture and dynamic volume measurement. Lab on a Chip. 18 (1), 179-189 (2018).
- Gevaert, E., et al. High throughput micro-well generation of hepatocyte micro-aggregates for tissue engineering. PloS One. 9 (8), 105171 (2014).
- De Moor, L., et al. High-throughput fabrication of vascularized spheroids for bioprinting. Biofabrication. 10 (3), 035009 (2018).
- Rivron, N. C., et al. Tissue deformation spatially modulates VEGF signaling and angiogenesis. Proceedings of the National Academy of Sciences of the United States of America. 109 (18), 6886-6891 (2012).
- Nunes, P., Guido, D., Demaurex, N. Measuring phagosome pH by ratiometric fluorescence microscopy. Journal of Visualized Experiments:JoVE. (106), e53402 (2015).
- Billiet, T., Gevaert, E., De Schryver, T., Cornelissen, M., Dubruel, P. The 3D printing of gelatin methacrylamide cell-laden tissue-engineered constructs with high cell viability. Biomaterials. 35 (1), 49-62 (2014).
- Tytgat, L., Ovsianikov, A., Yoo, J., Mironov, V., et al. Photopolymerizable materials for cell encapsulation. 3D Printing and Biofabrication. , 353-396 (2018).
- Markovic, M., et al. Hybrid tissue engineering scaffolds by combination of three-dimensional printing and cell photoencapsulation. Journal of Nanotechnology in Engineering and Medicine. 6 (2), 0210011 (2015).
- De Moor, L., et al. Hybrid bioprinting of chondrogenically induced human mesenchymal stem cell spheroids. Frontiers in Bioengineering and Biotechnology. 8, 484 (2020).
- Zhdanov, A. V., Dmitriev, R. I., Hynes, J., Papkovsky, D. B. Kinetic analysis of local oxygenation and respiratory responses of mammalian cells using intracellular oxygen-sensitive probes and time-resolved fluorometry. Methods in Enzymology. 542, 183-207 (2014).
- Uribe-Etxebarria, V., Agliano, A., Unda, F., Ibarretxe, G. Wnt signaling reprograms metabolism in dental pulp stem cells. Journal of Cellular Physiology. 234 (8), 13068-13082 (2019).
- Vizán, P., et al. Characterization of the metabolic changes underlying growth factor angiogenic activation: identification of new potential therapeutic targets. Carcinogenesis. 30 (6), 946-952 (2009).
- Dmitriev, R. I., Papkovsky, D. B. Quenched-phosphorescence detection of molecular oxygen: applications in life sciences. Royal Society of Chemistry. , (2018).
- Perottoni, S., et al. Intracellular label-free detection of mesenchymal stem cell metabolism within a perivascular niche-on-a-chip. Lab on a Chip. 21 (7), 1395-1408 (2021).
- Okkelman, I. A., Neto, N., Papkovsky, D. B., Monaghan, M. G., Dmitriev, R. I. A deeper understanding of intestinal organoid metabolism revealed by combining fluorescence lifetime imaging microscopy (FLIM) and extracellular flux analyses. Redox Biology. 30, 101420 (2020).
- Mironov, V., et al. Organ printing: tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14 (127), 20160877 (2017).
- Dmitriev, R. I., et al. Imaging oxygen in neural cell and tissue models by means of anionic cell-permeable phosphorescent nanoparticles. Cellular and Molecular Life Sciences. 72 (2), 367-381 (2015).
- Jenkins, J., Borisov, S. M., Papkovsky, D. B., Dmitriev, R. I. Sulforhodamine nanothermometer for multiparametric fluorescence lifetime imaging microscopy. Analytical Chemistry. 88 (21), 10566-10572 (2016).
- Fercher, A., Borisov, S. M., Zhdanov, A. V., Klimant, I., Papkovsky, D. B. Intracellular O2 sensing probe based on cell-penetrating phosphorescent nanoparticles. ACS Nano. 5 (7), 5499-5508 (2011).
- Wagner, M., Karner, A., Gattringer, P., Buchegger, B., Hochreiner, A. A super low-cost bioprinter based on DVD-drive components and a raspberry pi as controller. Bioprinting. 23, 00142 (2021).
- Golub, A. S., Pittman, R. N. Monitoring parameters of Oxygen transport to cells in the microcirculation. Quenched-Phosphorescence Detection of Molecular Oxygen. , 193-204 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Huang, C., Becker, M. F., Keto, J. W., Kovar, D. Annealing of nanostructured silver films produced by supersonic deposition of nanoparticles. Journal of Applied Physics. 102 (5), 054308 (2007).
- Foster, K. A., Galeffi, F., Gerich, F. J., Turner, D. A., Müller, M. Optical and pharmacological tools to investigate the role of mitochondria during oxidative stress and neurodegeneration. Progress in Neurobiology. 79 (3), 136-171 (2006).
- Schmidt, C. A., Fisher-Wellman, K. H., Neufer, P. D. From OCR and ECAR to energy: perspectives on the design and interpretation of bioenergetics studies. The Journal of Biological Chemistry. 297 (4), 101140 (2021).
- Stelzer, E. H., Lindek, S. Fundamental reduction of the observation volume in far-field light microscopy by detection orthogonal to the illumination axis: confocal theta microscopy. Optics Communications. 111 (5-6), 536-547 (1994).
- Pitrone, P. G., et al. OpenSPIM: an open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Legant, W. R., et al. High-density three-dimensional localization microscopy across large volumes. Nature Methods. 13 (4), 359-365 (2016).
- von Chamier, L., et al. Democratising deep learning for microscopy with ZeroCostDL4Mic. Nature Communications. 12 (1), 1-18 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved