Method Article
Erschwingliche Sauerstoffmikroskopie-unterstützte Biofabrikation von mehrzelligen Sphäroiden
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das Protokoll beschreibt die Hochdurchsatz-Sphäroiderzeugung für Bioprinting unter Verwendung der multiparametrischen Analyse ihrer Oxygenierung und ihres Zelltods auf einem Standardfluoreszenzmikroskop. Dieser Ansatz kann angewendet werden, um die Lebensfähigkeit der Sphäroide zu kontrollieren und eine Standardisierung durchzuführen, die für die Modellierung von 3D-Gewebe, Tumormikroumgebung und erfolgreicher (Mikro-) Gewebebiofabrikation wichtig ist.
Zusammenfassung
Mehrzellige Sphäroide sind wichtige Werkzeuge zur Untersuchung der Gewebe- und Krebsphysiologie in 3D und werden häufig im Tissue Engineering als Gewebemontageeinheiten für die Biofabrikation eingesetzt. Während die Hauptstärke des Sphäroidmodells in der Nachahmung physikalisch-chemischer Gradienten auf der Gewebemikroskala liegt, wird die reale physiologische Umgebung (einschließlich der Dynamik der Stoffwechselaktivität, der Oxygenierung, des Zelltods und der Proliferation) innerhalb der Sphäroide im Allgemeinen ignoriert. Gleichzeitig sind die Auswirkungen der Zusammensetzung des Wachstumsmediums und der Formationsmethode auf den resultierenden Sphäroidphänotyp gut dokumentiert. Daher ist eine Charakterisierung und Standardisierung des Sphäroidphänotyps erforderlich, um die Reproduzierbarkeit und Transparenz der Forschungsergebnisse zu gewährleisten. Die Analyse der durchschnittlichen Sphäroidoxygenierung und des Wertes von O2-Gradienten in drei Dimensionen (3D) kann eine einfache und universelle Möglichkeit zur Charakterisierung des Sphäroidphänotyps sein, die auf ihre metabolische Aktivität, ihre Gesamtlebensfähigkeit und ihr Potenzial zur Rekapitulation in vivo Gewebemikroumgebung hinweist. Die Visualisierung der 3D-Oxygenierung kann leicht mit der multiparametrischen Analyse zusätzlicher physiologischer Parameter (wie Zelltod, Proliferation und Zellzusammensetzung) kombiniert und für die kontinuierliche Sauerstoffüberwachung und/oder Endpunktmessungen eingesetzt werden. Die Belastung derO2-Sonde erfolgt während der Phase der Sphäroidbildung und ist mit verschiedenen Protokollen der Sphäroiderzeugung kompatibel. Das Protokoll umfasst eine Hochdurchsatzmethode der Sphäroiderzeugung mit eingeführten rot- und nahinfrarot-emittierenden ratiometrischen fluoreszierendenO2-Nanosensoren und die Beschreibung der Multiparameterbewertung der Sphäroidoxygenierung und des Zelltods vor und nach dem Bioprinting. Die experimentellen Beispiele zeigen vergleichende O2-Gradientenanalysen in homo- und heterozellulären Sphäroiden sowie sphäroidbasierten biogedruckten Konstrukten. Das Protokoll ist kompatibel mit einem herkömmlichen Fluoreszenzmikroskop mit mehreren Fluoreszenzfiltern und einer Leuchtdiode als Lichtquelle.
Einleitung
Molekularer Sauerstoff (O2) ist einer der wichtigsten Metaboliten, der die Lebensfähigkeit, Funktion und den Tod von Zellen und Geweben reguliert. Unterphysiologischen Bedingungen wird die lokale Sauerstoffversorgung des Gewebes dynamisch durch Gewebevaskularisation, Blutfluss und Zellstoffwechsel reguliert, was in einigen Fällen zur Bildung von O2-Gradienten, hypoxischer Mikroumgebung und / oder oxidativem Stressführt 1,2. Zellen erfassen die O2-Gradienten durch die direkte Beteiligung des molekularen O2 an der Signalfunktion (über Hypoxie-induzierbare Faktoren (HIF)-vermittelte Signale, Histon-Lysin-Demethylasen KDM und auf andere Weise), Veränderungen des zellulären Redoxpotentials (reaktiveO2-Spezies, die durchNrf2/Keap1-Signale oder eisenregulatorische Proteine erfasst werden) und können anschließend ihren Stoffwechsel, ihre Proliferation, Potenz und Differenzierung3. Daher sind die Heterogenität der Zell- und Gewebeoxygenierung, ihre Gradienten und die damit verbundenen Phänomene wichtige Akteure in der Gewebeentwicklung und Homöostase. Unterschiedliche Gewebe und Zelltypen erfordern oft unterschiedliche "normale" physiologische O2-Spiegel, die die spezielle Gewebearchitektur mit Zellen definieren, die entsprechend denO2-Mikrogradienten des Gewebes4 positioniert sind. Einige Zelltypen reagieren empfindlich auf O2-Abnahmen (z. B. Neuronen, Hepatozyten, Pankreas-Inselzellen oder Muskelzellen)5,6, während andere extremer Hypoxie standhalten und steileO2-Gradienten bilden können (z. B. in den Darm- und Dickdarmepithelien)7. Mit den Fortschritten im Tissue Bioengineering und der Biofabrikation wird die Notwendigkeit derO2-Quantifizierung in Mikroaggregaten und sphäroiden 3D-Gewebekonstrukten wichtig. Eines der Anliegen ist die Standardisierung der physiologischen Parameter des multizellulären Sphäroidmodells, die von der Methode der Sphäroiderzeugung und den Kulturbedingungen abhängen8. Darüber hinaus kann die unkontrollierte Anwendung von O2-freisetzenden Biomaterialien oderO2-Perfusion in Mikrogeweben ohne funktionelle Vaskularisation für Zellen toxisch sein, zu einer Reprogrammierung ihres Stoffwechsels führen und das Überleben in der Zeit nach der Transplantation verringern 9,10. Die Glaubwürdigkeit desO2-Messansatzes und die Optimierung der Oxygenierungsumgebung, um die effiziente Kultur physiologisch relevanter Mikroaggregate zu erreichen, wurde kürzlich durch die mathematische Modellierung von pluripotenten Stammzellen-abgeleiteten Lebersphäroiden bewiesen, die als Beispiel11 verwendet wurden. Ein weiteres Gebiet, in dem das Wissen über den O2-Gewebespiegel anerkannt ist, ist die Krebstherapie12,13. Heterogene Tumorhypoxie kann eine erfolgreiche Krebstherapie beeinträchtigen. Die Messung und Kontrolle der genauen Sauerstoffgehalte während der Patientenbehandlung oder der Tumorhypoxie-Modellierung würde eine Verbesserung der individuellen und personalisierten Therapiestrategienermöglichen 14. Daher ist die quantitative Überwachung der dynamischen Oxygenierung in biofabrizierten Konstrukten und 3D-Tumormodellen ein herausragendes Werkzeug für die physiologische Analyse ihrer Atmungsaktivität, ihres Stoffwechsels und der Optimierung der Gewebekultur, der Herstellungsbedingungen oder der grundlegenden Studien der hypoxievermittelten therapeutischen Reaktion.
Eine Reihe von Methoden ermöglicht die multixte (oder Multiparameter-) Analyse der Zelloxygenierung in Sphäroid- und Mikroaggregatgewebekonstrukten. Der PLIM-basierte Ansatz, der mit Neurosphären und Tumorsphäroiden 15,16,17 entwickelt wurde, ermöglicht die direkte Quantifizierung der Zelloxygenierung in lebenden Mikrogeweben und die Herstellung ihrer Korrelation mit der Lebensfähigkeit, Proliferation oder Verteilung der funktionellen Zelltypen. Trotz der Leistungsfähigkeit des Ansatzes ist das PLIM-Mikroskopie-Upgrade selbst unter den beliebten Mikroskopieanbietern immer noch nicht weit verbreitet18,19. Glücklicherweise kann eine gute Anzahl von zelldurchdringenden O2-empfindlichen Nanopartikelsonden auch für den fluoreszenzintensitätsbasierten ratiometrischen Messmodus 15,17,20,21,22,23,24 verwendet werden. Typischerweise würde die Sonde zwei Emissionswellenlängen anzeigen, d. H.O2-empfindlich und unempfindlich (Referenz), die mit einem Fluoreszenzmikroskop, einem High-Content-Screening-Imager oder einem Mikroplattenleser gemessen werden können. Solche O2-Sensor-Nanopartikel können durch Fällungstechnik mit den biokompatiblen Polymeren,O2-Sensing und Referenzfarbstoffen, die sichtbare und Nahinfrarot-Spektren umfassen, hergestellt werden, oder sie können kommerziell erworben werden 2,25. Da die Analyse dicker 3D-Mikrogewebe von der Verwendung rotverschobener Fluoreszenzfarbstoffe profitieren würde, wurde die ratiometrische O2-sensorische Nanopartikelsonde multimodale Infrarotzahl 1 (MMIR1), bestehend aus O2-Sensing-PtTPTBPF 26 und Referenzfarbstoffen aza-BODIPY27, die in einem positiv geladenen Polymethacrylat-basierten Copolymer imprägniert sind, konstruiert 28. Bei dieser Konstruktion wird einO2-empfindliches Signal (nahes Infrarot, Anregung (exkl.) = 635 nm, Emission (em.) = 760 nm; Isens) wird durch die [O2]-Konzentration über den Phosphoreszenz-Quenching-Prozess beeinflusst, während die rote Referenzfarbstoffintensität (exz. = 580 nm, em. = 650 nm; Iref) bleibt davon unberührt (Abbildung 1A). Somit kann Iref / Isens ratio (R) in gefärbten Zellen dieO2-Kalibrierung 22 ermöglichen.
Hier beschreiben wir einen semi-quantitativen Ansatz zur Überwachung der Oxygenierung lebender Zellen in Sphäroiden und biogedruckten Konstrukten, der zur Abschätzung von O2-Gradienten in Endpunkt- und kinetischen Messungen beiträgt. Eine solche O2-Bildgebung kann mit anderen Arten von ratiometrischenO2-Sonden durchgeführt werden (Abbildung 1B) und kann abhängig von der Anzahl der verfügbaren Lichtquellen und Fluoreszenzfilter mit anderen Farbstoffen verwendet werden, um Informationen über lebende/tote Zellen, die mitochondriale Funktion und die Rückverfolgung anderer Zelltypen zu erhalten. Erweiterte Messmodi wie die Fluoreszenz-Lifetime-Imaging-Mikroskopie (FLIM) können ebenfalls verwendetwerden 19. Die größte Herausforderung bei der Verwendung von Zellfärbungsfarbstoffen undO2-empfindlichen Nanopartikeln ist die Optimierung des Färbeprotokolls. Im Falle der MMIR1-Sonde und verwandter Nanopartikel werden Zellen während des Prozesses der Sphäroidbildung entweder vorgefärbt oder co-inkubiert. Im beschriebenen Protokoll wurden O2-Sonden-gefärbte Sphäroide auf der niedrig anhaftenden Agaroseoberfläche 29,30,31,32 erzeugt (Abbildung 1C), was ein anschließendes Sphäroid-basiertes Bioprinting und eine Multiparameteranalyse vonO2 und Zelltod ermöglicht. Um die Anwendbarkeit des Ansatzes zu veranschaulichen, wurden die Oxygenierungswerte in homo- oder heterozellulären (gebildet unter Zugabe von humanen Nabelvenen-Endothelzellen, HUVEC) humanen Zahnpulpa-Stammzell-Sphäroiden (hDPSC) vor und nach dem Bioprinting unter Verwendung eines herkömmlichen Fluoreszenzmikroskops verglichen.
Protokoll
1. Erzeugung von Sphäroiden mit integrierterO2-empfindlicher Sonde mit hohem Durchsatz
- Herstellung einer mikrogemusterten Agarose-beschichteten Gewebekulturplatte
HINWEIS: Mikrogemusterte Agarose-beschichtete Gewebekulturplatten werden zur gleichzeitigen Erzeugung einer hohen Anzahl von Sphäroiden (1585 pro PDMS-Stempel, siehe Materialtabelle) für Bioprinting und andere Anwendungen verwendet, bei denen mehrere experimentelle Replikate oder große Sphäroidzahlen benötigt werden.- Bereiten Sie alle sterilen Materialien und Instrumente (Spatel und Pinzette) nach Möglichkeit durch Autoklavieren oder durch Filtersterilisation vor. Reinigen Sie die recycelbaren PDMS-Stempel33 von Agarose und lagern Sie sie aseptisch in 70% Ethanol. Tun Sie dies mindestens 1 Tag vor der Sphäroidgeneration.
- Übertragen Sie mikrogemusterte PDMS-Stempel von einem Lagerfläschchen auf eine sterile Petrischale und trocknen Sie sie mit der glatten Oberfläche unter den sterilen laminaren Luftströmungsbedingungen für 10 min an der Luft.
- Legen Sie jeden Stempel mit einer mikrogemusterten Oberfläche nach oben (und glatte Oberfläche nach unten) in die Mitte des Brunnens einer sterilen Gewebekulturplatte mit 12 Bohrlöchern. 1-2 min mit offenem Deckel an der Luft trocknen.
HINWEIS: Es ist sehr wichtig, die überschüssige Flüssigkeit zu verdampfen, da nur trockene Stempel perfekt an der Kunststoffoberfläche haften und während des Verfahrens haften. - Wiegen Sie 1,5 g Agarose in eine saubere 200 ml Glasflasche, fügen Sie 50 ml steriles destilliertes Wasser hinzu, bedecken Sie es mit einem Deckel und schmelzen Sie in einer Mikrowelle, um 50 ml 3% homogene Agaroselösung herzustellen.
ACHTUNG: Die Agaroselösung ist extrem heiß und muss mit Vorsicht gehandhabt werden. Wenn sie unmittelbar nach dem Schmelzvorgang geschüttelt wird, kann die heiße Agaroselösung anfangen zu sprudeln und aus dem Gefäß platzen. Um gelegentliche Traumata zu vermeiden, verwenden Sie ausreichend große Gefäße, die mit maximal 50% des Volumens mit der Agaroselösung gefüllt sind. - Mit einer sterilen serologischen Pipette sofort ~ 2 ml heiße Agaroselösung in jede Vertiefung der 12-Well-Zellkulturplatten geben, um den eingefügten PDMS-Stempel vollständig abzudecken. Lassen Sie die Agarose 20 Minuten erstarren, indem Sie unter dem sterilen Luftstrom mit geöffnetem Plattendeckel inkubieren.
HINWEIS: Die Agaroseschicht sollte mindestens zweimal dicker sein als der PDMS-Stempel, um die Integrität der Agarose-Mikrovertiefungen nach der Entfernung des PDMS-Stempels sicherzustellen (Abbildung 1C). - Drehen Sie mit einem sterilen kleinen Spatel die Agarose mit dem eingebetteten PDMS-Stempel in jedem Vertiefungsraum genau auf den Kopf, um die glatte Stempeloberfläche nach oben zu bringen. Fügen Sie ~ 200 μL steriles Wasser auf die glatte Oberseite des Stempels ein, lösen Sie es vorsichtig mit einem Spatel von der Agarose und entfernen Sie es aus dem Brunnen. Vermeiden Sie es, die Mikrowellen zu beschädigen.
- Geben Sie 1 ml entsprechender steriler Zellkulturmedien zu den Agarosestempeln für die direkte Verwendung. Den Teller mit dem Deckel abdecken und über Nacht bei 4 °C inkubieren. Verwenden Sie PBS-Lösung (anstelle von mittel) für die Langzeitlagerung (bis zu 2 Wochen bei 4 °C). Lassen Sie die Agarose nicht trocknen. Vor Gebrauch die mikrogemusterten Agaroseplatten in einem CO2 Inkubator 1 h bei 37 °C erwärmen.
HINWEIS: Die Inkubation ist erforderlich, um Luftblasen aus Agarose-Mikrowellen auszugleichen und zu entfernen. Fahren Sie mit Protokollschritt 1.2 fort.
- O vorbereiten2 Sondenbelastete Sphäroide
- Verwenden Sie α-minimales essentielles Medium (MEM), ergänzt mit 10% fetalem Rinderserum (FBS), und Wachstumsfaktoren ergänzt Endothelzellwachstumsmedium 2 für die Kultivierung von hDPSC- bzw. HUVEC-Zelllinien. Bereiten Sie hDPSC / HUVEC heterozelluläres Sphäroid-Wachstumsmedium vor, indem Sie HUVEC- und hDPSC-Wachstumsmedien im Verhältnis 1:1 hinzufügen.
- Bereiten Sie 70% -90% konfluente Zellkultur vor (~ 3-4 Tage der Zubereitung). Für die Erzeugung heterozellulärer Sphäroide bereiten Sie hDPSC- bzw. HUVEC-Kulturen vor.
HINWEIS: Die Durchgangsnummer von HUVEC und hDPSC darf 8 nicht überschreiten. Um ein schnelles Wachstum der Zellkulturen zu gewährleisten, teilen Sie sich immer bei 1/3 der gesamten Zellkultur (bei 70% -80% Konfluenz) mit einem neuen Kolben alle 3 bis 4 Tage. - 70%-90% konfluente Zellkultur mit vorgewärmtem (37 °C) PBS (10 ml pro 75 cm2 Kolben) abspülen. Dissoziierende Enzymlösung (0,05% Trypsin und 1 mM EDTA; 1 mL pro 75 cm 2 Kolben) zugeben und für 3-5 min bei 37 °C bei 5% CO2, 95% Feuchtigkeit zur Zellablösung inkubieren und die Zellablösung unter dem Mikroskop überprüfen. Sobald dies geschehen ist, neutralisieren Sie Trypsin mit vollständigen Zellkulturmedien, die 10% FBS (5 ml Medien pro 1 ml Dissoziationslösung) enthalten.
HINWEIS: Verhindern Sie eine übermäßige Exposition der Zellen gegenüber der dissoziierenden Enzymlösung, da dies ihre Lebensfähigkeit beeinträchtigen kann. - Für HUVEC, das in einem Medium mit niedrigem FBS-Gehalt kultiviert wird, führen Sie eine Trypsinneutralisation durch, indem Sie der mit Trypsin behandelten Zellkultur 0,5 ml 100% FBS hinzufügen, gefolgt von einer Zentrifugation, um die Zellen in ihr Wachstumsmedium zu übertragen.
HINWEIS: Die erhaltenen Zellsuspension(en) sollten ~ 1 Million Zellen pro 1 ml enthalten. Bei Bedarf kann dem Protokoll ein zusätzlicher Zentrifugationsschritt hinzugefügt werden, um die Zellsuspension zu konzentrieren. - Dissoziieren Sie Zellaggregate durch Pipettieren mit einer 1000 μL Pipettenspitze auf der Oberseite einer serologischen 10-ml-Pipette, um eine Einzelzellsuspension zu erhalten. Verwenden Sie eine Zählkammer (Hämozytometer vom Neubauer-Typ oder Alternativen), um die Anzahl der Zellen pro 1 ml der Zellsuspension34 zu zählen. Verdünnen Sie die Zellsuspension auf 500.000 Zellen pro ml. Für heterozelluläres hDPSC / HUVEC im Sphäroidverhältnis 1:1 fügen Sie gleiche Volumina entsprechender Zellsuspensionen hinzu, um eine endgültige Zellkonzentration von 500.000 Zellen pro ml zu erhalten.
HINWEIS: Die Variation der Zellkonzentration in der Suspension, die zu einem mikrogemusterten Agarosestempel hinzugefügt wird, ermöglicht die Änderung der durchschnittlichen Größe der produzierten Sphäroide, die von einer Zellzahl pro Mikrovertiefung eines Agarosestempels abhängt. In der beschriebenen Anordnung werden Sphäroide von ~300 Zellen aus 1 ml mit 500.000 Zellen auf einem Agarosestempel mit 1585 Mikrowellen erzeugt. - KonzentrierteO2-Sondenlösung (Nanopartikel, 1 mg/ml Stammstoff) zu der vorbereiteten Zellsuspension bis zu einer Endkonzentration von 5 μg/ml hinzufügen.
HINWEIS: Die Sphäroidbildung in Gegenwart vonO2-sensorischen Nanopartikeln sorgt für eine effiziente Färbung, die für mindestens 5 Tage erhalten bleibt (Abbildung 1D). Im Gegensatz dazu ist die Färbung von vorgeformten mehrzelligen Sphäroiden mit Nanopartikeln weniger effizient15. - Tauschen Sie 1 ml Altmedien in einer mikrostrukturierten Vertiefung von 12-Well-Agarose-beschichteten Zellkulturplatten (siehe Schritt 1.1.7) gegen 1 ml der vorbereiteten Zellsuspension (500.000 Zellen pro 1 ml, mit 5 μg/mlO2-Sonde ) aus. Kultur der Sphäroide imCO2-Inkubator für 2-5 Tage in ständiger Anwesenheit derO2-Sonde , um ihre Belastung während der Sphäroidbildung und -verdichtung sicherzustellen.
HINWEIS: Vermeiden Sie übermäßige mittlere Verdunstung in Sphäroidkultur. Bei Bedarf vorsichtig (die Sphäroide in Mikrowellen nicht stören) 0,2-0,5 ml Kulturmedium mit der zusätzlichen O2-Sondenverdünnung hinzufügen. - Tauschen Sie nach der Sphäroidbildung die Wachstumsmedien durch ein frisches ohne Sonde aus. Die Sondenfleckung bleibt in erzeugten Sphäroiden für 7-14 Tage oder länger erhalten, was eine langfristige Überwachung ihrer Signale in Sphäroiden ermöglicht.
2. Sphäroide Bioprinting
HINWEIS: Sphäroide werden in einer auf Methacrylamid-modifizierter Gelatine (GelMA) basierenden Biotinte biogedruckt. Im Folgenden finden Sie eine Beschreibung der Bioink-Inhaltsstoffe, des Verfahrens der Bioink-Zubereitung und des Bioprinting.
- Bioink-Zubereitung
- Eine 10%ige (w/v) GelMA-Lösung (2 ml) in Medium unter einem laminaren Luftstrom 35 wird wie folgt hergestellt: 0,2 g steriles GelMA mit einem Substitutionsgrad von 78 in einem 15-ml-Röhrchen wiegen, 1,9 ml α-MEM zugeben und durch Mischen auf einem Rotationsschüttler bei37 °C (~2 h) auflösen lassen.
HINWEIS: Fügen Sie nicht die volle Menge an Medium hinzu, da andere Verbindungen wie Sphäroide und Photoinitiator Li-TPO-L später hinzugefügt werden. - Suspendieren Sie Sphäroide in den mikrostrukturierten Vertiefungen durch Pipettieren und sammeln Sie sie in einem 15-ml-Rohr. Führen Sie eine zusätzliche Spülung mit PBS durch, um sicherzustellen, dass alle Sphäroide aus den Agarosemikrowellen gesammelt werden. Vermeiden Sie es, die Agarose-Mikrowellen zu berühren / zu beschädigen, da Agaroseflocken die Nadel während des Bioprintings blockieren können.
- Sammeln Sie Sphäroide durch Zentrifugation in einem 15-ml-Röhrchen bei 300 x g für 5 min bei 20 °C. Den Überstand mit einer Pipette abspritzen, 50 μL Medium zu den Sphäroiden geben und durch leichtes Pipettieren wieder aussetzen.
- Die Sphäroidmischung in die warme GelMA-Lösung geben und durch leichtes Pipettieren mischen. Halten Sie die Sphäroidkonzentration auf 6340-12860 Sphäroide (von 4-8 Mikromustern) pro ml Biotinte für das Bioprinting. Vermeiden Sie höhere Konzentrationen von Sphäroiden, da dies leicht zu einer Blockierung der Drucknadel führt.
- Filtersterilisierte Photoinitiator-Li-TPO-L-Stammlösung (32 mg/ml) in einer Endkonzentration von 2 Mol-% in Bezug auf die Anzahl der Doppelbindungen zugeben und durch leichtes Pipettierenmischen 36,37.
HINWEIS: Die Menge an Li-TPO-L kann nach folgender Gleichung berechnet werden:
Volumen des Photoinitiators (PI) = (0,000385 mol NH2- Gruppen / g GelMA x 294,10 g Li-TPO-L / mol x 0,78 x 0,02) / 0,032 g Li-TPO-L / ml x 0,2 g GelMA = 0,0107 mL Li-TPO-L Stamm
- Eine 10%ige (w/v) GelMA-Lösung (2 ml) in Medium unter einem laminaren Luftstrom 35 wird wie folgt hergestellt: 0,2 g steriles GelMA mit einem Substitutionsgrad von 78 in einem 15-ml-Röhrchen wiegen, 1,9 ml α-MEM zugeben und durch Mischen auf einem Rotationsschüttler bei37 °C (~2 h) auflösen lassen.
- Bioprinting-Verfahren
- Siehe die Schritte im Zusatzprotokoll 1 für die Konstruktion von Gerüsten in CAD. Führen Sie die folgenden Schritte aus, um das Design zu bioprinten.
- Verschließen Sie das Ende einer sterilen 3 ccm Kartusche mit einer Tip Cap (Luer Lock) und füllen Sie sie mit Bioink durch Pipettieren. Setzen Sie einen Kolben in die Patrone ein. Halten Sie die Patrone auf den Kopf und entfernen Sie die Spitzenkappe, drücken Sie den Kolben in Richtung Bioink, bis die gesamte Luft aus der Patrone entfernt ist.
HINWEIS: Vermeiden Sie den Kontakt zwischen GelMA Bioink und den Seiten der Kartusche, da dies die Bewegung des Kolbens aufgrund der Gelierung der Biotinte hemmen kann. - Lassen Sie die Biotinte im Heizmantel des Bioprinters bei 23 °C (20-30 min) abkühlen. Schrauben Sie einen Druckadapter an der Oberseite der Kartusche ein. Schließen Sie den Clip am Einlassrohr, um zu verhindern, dass die Biotinte ausläuft, und montieren Sie eine konische 22-G-PE-Nadel auf der Kartusche. Passen Sie die Nadelgröße und den Durchmesser an das Gerüstdesign und den Sphäroiddurchmesser und die Konzentration an.
HINWEIS: Tragen Sie eine Mundmaske und gesprühte Handschuhe, um eine Kontamination zu vermeiden. - Besprühen Sie den Bioprinter mit 70% Ethanol und wischen Sie ihn mit absorbierendem Papier trocken. Setzen Sie die Kartusche in den Heizmantel des extrusionsbasierten Druckkopfes ein. Schließen Sie den Druckeinlass an und öffnen Sie den Clip am Einlass. Laden Sie die G-Code-Datei Ihres Designs in die Drucksoftware.
- Starten Sie die Nadellängenmessung. Regulieren Sie den Druckdruck, indem Sie etwas Biotinte in eine sterile Petrischale geben. Ein Druckdruck von 0,025-0,045 MPa ist typisch für den Druck von GelMA-basierten Biotinten38.
- Installieren Sie eine 6-Well-Platte, öffnen Sie die Well-Platte, schließen Sie die Haube und beginnen Sie mit dem Drucken. Lassen Sie nach dem Druck die Gerüste für 10 min bei 5 °C physikalisch vernetzt und bestrahlen Sie die bedruckten Gerüste für 60 s mit einer UV-LED-Lampe (365 nm; 500 mW laut Hersteller).
HINWEIS: Die UV-Vernetzungszeit hängt von den Eigenschaften des UV-Lichts, der Art und Konzentration des Photoinitiators, dem gewünschten Gerüstvernetzungsgrad, der Quellung und dem Elastizitätsmodul ab. - Geben Sie sofort die entsprechenden Wachstumsmedien mit 100 U/ml Penicillin und 100 μg/ml Streptomycin (P/S) zu allen Vertiefungen mit biogedruckten Gittern (2 ml pro Vertiefung einer 6-Well-Zellkulturplatte).
- Kultur in einem 37 °C CO 2 Inkubator, bis Sie mit der Mikroskopie beginnen. Für die biogedruckte Konstruktmikroskopie übertragen Sie ein gedrucktes Waffelgitter in eine Mikroskopieschale, bedecken Sie es mit bildgebenden Medien und fahren Sie mit den Schritten 3.2 und 3.3 fort.
HINWEIS: Bei schwimmenden biogedruckten Konstrukten müssen diese ohne Auswirkungen auf die Zelllebensfähigkeit in der Mikroskopieschale fixiert werden, z.B. mit zytokompatiblem Klebstoff. Für den inversen Mikroskoptransfer wird der Bioprint in eine mikroskopische Glasbodenschale gegeben und mit einem bildgebenden Medium (~ 200-500 μL, siehe Hinweis zu Schritt 3.1 für die Zusammensetzung der Bildgebungsmedien) abgedeckt, um ein unerwünschtes Floaten der Probe zu vermeiden. Die Färbung mit zusätzlichen Fluoreszenzsonden kann in der Zellkulturschale vor dem Transfer von biogedruckten Konstrukten in Mikroskopieschalen erfolgen (siehe Schritt 3.1.6).
3. Ratiometrische Fluoreszenz-Lebendmikroskopie der Sphäroidoxygenierung im biofabrizierten Gewebe
HINWEIS: Um die ratiometrische Intensitätsantwort (R) derO2-Sonde in die tatsächlichen Hypoxiewerte umzuwandeln, muss die Sondenantwort mit den in24 beschriebenen Verfahren kalibriert werden. Da die ratiometrische Kalibrierung jedoch gerätespezifisch ist und die Installation eines T/O2/CO2-gesteuerten Inkubators erfordert (nicht immer verfügbar), ist die Verwendung der semiquantitativen Verhältnisdetektion die bevorzugte Option.
- Herstellung von Sphäroiden für die Live-Bildgebungsanalyse
- Für die Sphäroidbefestigung während dieses Schrittes beschichten Sie das sterile Mikroskopiegeschirr mit Kollagen IV und/oder Poly-D-Lysin oder verwenden Sie handelsübliche39. Überprüfen Sie die Kompatibilität von Mikroskopieschalen mit dem Arbeitsabstand und anderen Eigenschaften des Ziels Ihres Mikroskops.
HINWEIS: Im Falle der Multiparameter-Bildgebung müssen alle zusätzlichen Färbeverfahren in den Kulturplattenschalen mit ausreichender Menge an Medien durchgeführt werden, die die Zellen vor Verdunstung, osmotischem Schock oder anderem Stress schützen. Bildgebungsmedium vor Gebrauch vorbereiten und vorwärmen: DMEM ergänzt mit Natriumbicarbonat (1,2 g/L), HEPES-Na, pH 7,2 (10 mM), Natriumpyruvat (1 mM), L-Glutamin (2 mM) und Glucose (5 mM), ohne Phenolrot. - Mit einer 1-ml-Pipette die vorgefärbten Säuresphäroide derO2-Sonde vorsichtig aus den Agarose-Mikrovertiefungen auswaschen. Während die Sphäroide noch in den Medien schwimmen, übertragen Sie sie in ein 15 ml konisches Bodenrohr.
- Um die Sammlung aller Sphäroide aus einer mikrostrukturierten Vertiefung sicherzustellen, spülen Sie die Vertiefung 1 bis 3 Mal mit den zusätzlichen 1 ml Kulturmedien aus und kombinieren Sie alle Sphäroidsuspensionen in einer Durchstechflasche. Lassen Sie die Durchstechflasche bis zu 10 Minuten in vertikaler Position, damit sich die Sphäroide auf dem Boden der Durchstechflasche absetzen und ein sichtbares Pellet bilden.
- Entfernen Sie vorsichtig das Medium aus dem Schlauch, so dass die Sphäroide ungestört bleiben. Suspendieren Sie sie vorsichtig in der Menge an frischem Kulturmedium, die für mindestens 20 Sphäroide pro Mikroskopie-Probenschale ausreicht. Dies minimiert die Verwendung der Kulturmedien und vereinfacht die Lokalisierung von Sphäroiden während der Bildgebung.
HINWEIS: Verwenden Sie den autoklavierbaren Siliziumteil der 12-Well-Platte mit μ Kammer (siehe Materialtabelle), der am Deckglas befestigt ist, als Mikroskopie-Probenschale (24 x 60 mm, Dicke #1) mit einem maximalen Medienvolumen von 300 μL pro Well. Der Siliziumteil dieser Kulturkammer kann sterilisiert und mit anderen Kunststoff- und Glasoberflächen wiederverwendet werden, wenn er an der Schale haftet. - Fügen Sie sofort das gleiche Volumen der Sphäroidsuspension zu jeder Mikroskopieschale / -vertiefung hinzu. Lassen Sie die Sphäroide für 1 h bei 37 °C in einem CO 2 -Inkubator, um sie an der Oberfläche der Mikroskopieschale zu befestigen. Für die Oxygenierungsanalyse in Verbindung mit der Verwendung anderer Farbstoffe fahren Sie mit Schritt 3.1.6 fort. Für eine einfache Oxygenierungsanalyse fahren Sie mit Schritt 3.1.7 fort.
HINWEIS: Eine unzureichende Inkubationszeit (<1 h) kann zu gelegentlicher Sphäroidentfernung und -verlust während des Medienaustauschs führen, wodurch Ihr Experiment abgebrochen wird. Gleichzeitig kann eine Überinkubation (>3 h) zum teilweisen oder vollständigen Verlust ihrer 3D-Organisation aufgrund der Migration von Zellen von Sphäroiden zur Oberfläche der Mikroskopieschale führen und ihre Echtzeit-Oxygenierung beeinflussen. - (fakultativ) Tauschen Sie das Medium vorsichtig gegen eine Fluoreszenzsonde aus, die auf Färbungskonzentration verdünnt ist, und setzen Sie die Inkubation für weitere 1 Stunde fort, um eine optimale Intensität zu erreichen. Um die Entfernung von Sphäroiden während des Medienaustauschs zu vermeiden, saugen Sie das Medium vorsichtig mit einer 200 μL-Pipette von den Rändern der Mikroskopieschalen ab und führen Sie die mittlere Zugabe seitlich in der Mikroskopieschale durch. Fahren Sie mit Schritt 3.1.7 fort.
HINWEIS: Für eine effiziente Färbung mit Sonden mit schlechter Diffusion in mehrzelligen Aggregaten verlängern Sie die Belastungskonzentration und/oder -zeit. Bestimmen Sie vor der Verwendung die optionalen Sondenbelastungsparameter in Vorversuchen. - Entfernen Sie das Medium aus der Mikroskopieschale und spülen Sie es einmal mit bildgebenden Medien ab. Geben Sie der Probe die genaue Menge an bildgebenden Medien hinzu (z. B. 300 μl pro Mikrovertiefung einer μ-Kammer einer 12-Well-Kulturplatte). Fahren Sie mit Schritt 3.2 fort.
- Für die Sphäroidbefestigung während dieses Schrittes beschichten Sie das sterile Mikroskopiegeschirr mit Kollagen IV und/oder Poly-D-Lysin oder verwenden Sie handelsübliche39. Überprüfen Sie die Kompatibilität von Mikroskopieschalen mit dem Arbeitsabstand und anderen Eigenschaften des Ziels Ihres Mikroskops.
- Bildaufnahme
- Schalten Sie das Mikroskop und die angeschlossenen Geräte (d. h. Anregungslichtquelle, Kamera, Computer, Inkubator und andere elektronische Betriebsblöcke) 30 Minuten vor der Bildgebung ein, um sich aufzuwärmen und sich an die Messbedingungen anzupassen (Temperatur, unterschiedliche Werte von O 2, 5% CO2, Luftfeuchtigkeit, falls erforderlich). Starten Sie die mitgelieferte Mikroskopie-Betriebssoftware mit dem exakten Mikroskop-Setup.
HINWEIS: Das beschriebene Protokoll ist für die CellSens Dimension Software v.3 angepasst. - Wählen Sie die geeigneten Anregungs- (Quelle, Leistung) und Emissionsfilter sowie die Belichtungszeit für ausgewählte Fluoreszenz- (oder phosphoreszierende) Sonden. Für Multiparameter-, 3D- und Zeitraffer-Mikroskopieanalysen schreiben Sie das/die Protokoll(e) für die automatisierte Messsequenz in die Betriebsmikroskopsoftware.
- Ermitteln Sie empirisch die optimalen Bildgebungseinstellungen für jede Sonde, jedes experimentelle Modell und jede Zelllinie in vorläufigen Experimenten. Stellen Sie sicher, dass die Einstellungen nur minimales Photobleaching in Referenz- (I ref) und O2-Sensing-Kanälen (ISens) und minimale Auswirkungen auf dasIntensitätsverhältnis (R = Iref / I sens) haben, insbesondere in 3D- und Zeitraffer-Messexperimenten.
- Stellen Sie die Mikroskopieschale mit gefärbten Sphäroiden auf der Mikroskopiestufe auf. Zeigen Sie mit dem Objektiv mit geringer Vergrößerung eine Vorschau der Probe im Transmissionslicht an, fokussieren Sie sich vorab auf Sphäroide und lokalisieren Sie sie in der Mitte des Bildes.
HINWEIS: Standardmäßige 4-fache bis 10-fache Vergrößerungsluftobjektive reichen für die Vorfokussierung aus, während wir für die eigentliche Messung 20x bis 40x mit numerischer Apertur (NA) von 0,6 oder höher (Luft- oder Wasserimmersion) Objektiven mit ausreichendem Arbeitsabstand für an der Schale befestigte Sphäroide empfehlen. - Bringen Sie das Objektiv mit der erforderlichen hohen Vergrößerung in die Arbeitsposition. Konzentrieren Sie sich auf den Transmissionslichtmodus im mittleren (äquatorialen) Querschnitt des Sphäroides. Die Oxygenierung in 3D-Objekten hängt direkt von der Tiefe des Bildausschnitts ab. Um dies zu gewährleisten, analysieren Sie ähnliche Querschnitte in und zwischen Gruppen, z. B. mittlere und obere/untere Querschnitte von Sphäroiden.
HINWEIS: Für eine detaillierte und präzise Analyse und Rekonstruktion vonO2-Gradienten empfehlen wir das Scannen und Herstellen von Z-Stacks mit Konfokal-, Lichtblatt- oder Zwei-Photonen-Mikroskopen (beste Option). Für die konventionelle Weitfeldmikroskopie, bei der das Signal aller Querschnitte gleichzeitig erfasst wird, kann eine durchschnittliche Schätzung durch den mittleren Querschnitt anstelle einer genauen Analyse derO2-Gradienten durchgeführt werden. In diesem Fall wird der mittlere Querschnitt als Fokusschnitt definiert, wobei die Sphäroide einen maximalen Durchmesser mit einem scharfen Fokus auf ihre Grenzen haben. - Passen Sie die Einstellungen für die Erfassung von Fluoreszenz-/Phosphoreszenzsignalen von Referenz- und empfindlichen Spektralkanälen derO2-Sonde und anderer Fluoreszenzsonden an, die für die multiparametrische Bildgebung verwendet werden.
- Für den quantitativen intensitätsbasierten Vergleich wenden Sie die gleichen gewählten Bildeinstellungen der Belichtungszeit, der Leistung der Anregungslichtquelle, der Auflösung, der Scangeschwindigkeit und der Lochgröße für alle gemessenen Objekte in Gruppen an.
HINWEIS: Viele vom Hersteller bereitgestellte Mikroskopie-Softwareversionen ermöglichen automatische Berechnungen des Intensitätsverhältnisses. Wenden Sie die Funktionszusammenführung auf Intensitätsmessungen von Referenz- und empfindlichen Kanälen derO2-Sonde an, wenn Sie das Bilderfassungsprogramm im experimentellen Manager in der hier verwendeten Bildgebungssoftware schreiben. - Sammeln Sie Bilder aus demselben optischen Abschnitt für Referenz- und empfindliche Spektralkanäle derO2-Sonde und bei Bedarf zusätzliche Fluoreszenzkanäle. Verwenden Sie für dieses Protokoll die MMIR1-Sonde mit der roten Referenz (exc. = 580 nm, em. = 650 nm) und Nahinfrarot-O2-empfindlichen (exc. = 635 nm, em. = 760 nm) Spektren.
- Wiederholen Sie die Schritte 3.2.5-3.2.8, um eine ausreichende Anzahl von Datenpunkten für die statistische Analyse zu sammeln. Für die dynamische Analyse der sich schnell entwickelnden zellulären Reaktionen bei der Behandlung mit verschiedenen Medikamenten, mitochondrialen Entkopplern oder Inhibitoren der Elektronentransportkette und anderen schnell wirkenden Verbindungen ist der Zeitraffer-Messmodus (Schritt 3.2.10) zu verwenden.
- Führen Sie die Messungen in bildgebenden Medien bei 37 °C mit periodischer Beleuchtung der Probe durch und sammeln Sie Signale der interessierenden Fluorophore (z. B.O2-Sondenreferenz - und Sensorkanäle), z. B. alle 10 s für mehr als 2 min.
- Führen Sie nach der periodischen Messung eine Fokusprüfung für jedes Sphäroid durch, um sicherzustellen, dass während der Bildgebung keine Fokusdrift aufgetreten ist. Wiederholen Sie den Vorgang, falls erforderlich. Fahren Sie mit Schritt 3.3 für die Datenanalyse fort.
HINWEIS: Ohne Zellstimulation und Medikamentenzugabe kann eine Zeitraffermessung durchgeführt werden, um die Photostabilität im Vergleich zum Referenzfarbstoff zu beurteilen, z. B. Fluorescein, Calceingrün AM oder Tetramethylrhodaminmethylester.
- Schalten Sie das Mikroskop und die angeschlossenen Geräte (d. h. Anregungslichtquelle, Kamera, Computer, Inkubator und andere elektronische Betriebsblöcke) 30 Minuten vor der Bildgebung ein, um sich aufzuwärmen und sich an die Messbedingungen anzupassen (Temperatur, unterschiedliche Werte von O 2, 5% CO2, Luftfeuchtigkeit, falls erforderlich). Starten Sie die mitgelieferte Mikroskopie-Betriebssoftware mit dem exakten Mikroskop-Setup.
- Bildpräsentation
HINWEIS: Hier beschreiben wir, wie Sie O automatisch berechnen2 Sondenintensitätsverhältnis (R) in Sphäroiden unter Verwendung der Verhältnisanalysefunktion in der Bildgebungssoftware und Anwendung der Pixel-für-Pixel-R-Berechnung, um Falschfarben-R-Verteilungsbilder des Sphäroidmikroskopieschnitts zu erzeugen. R kann auch manuell aus den Intensitätsdaten von Referenz- und empfindlichen Spektralkanälen berechnet werden, die aus demselben Bereich von Interesse (ROI) des Sphäroidbildes durch Anwendung der einfachen Formel R = I gesammelt wurden.Schiri/ISens24,34. Wenn es nicht möglich ist, die Intensitätsdaten aus dem Rohbild in der entsprechenden Mikroskopie-Software zu extrahieren, können die Intensitätsdaten mit Programmen wie ImageJ oder Fiji erhalten werden (siehe Diskussion).- Öffnen Sie die VSI-Datei mit Intensivdaten derO2-Sonde aus Referenz- und empfindlichen Spektralkanälen, die im zusammengeführten Modus erstellt wurden. Öffnen Sie das Funktionsfenster für die Verhältnisanalyse über das Menü "Maßnahme". Wählen Sie die Intensität des Referenzkanals als Zähler und die Intensität des empfindlichen Kanals als Nenner für die R-Berechnung.
HINWEIS: Das umgekehrte Verhältnis von Referenz- und empfindlichen Signalen zur Berechnung von R ist ebenfalls möglich, aber in diesem Fall nimmt R mit dem Anstieg vonO2 ab. - Wenden Sie die entsprechenden Intensitätsschwellenwerteinstellungen auf jeden Spektralkanal an, um den Hintergrund vom zusammengeführten Intensitätsbild zu subtrahieren. Erhöhen Sie die Schwellenwerte so lange, bis der Bildhintergrund gleichmäßig schwarz ist. Wenden Sie den Schwellenwertparameter gleichmäßig auf alle Sphäroidbilder in dem Datensatz an, der in der vergleichenden Analyse verwendet wird.
HINWEIS: Verwenden Sie das Vorschaufenster, um die Schwellenwerteinstellungen zu optimieren, indem Sie das vorläufig berechnete Falschfarben-R-Bild von Sphäroiden beobachten. Alle Pixel mit einer Intensität, die unter dem aktuellen Wert im Schwellenwertfeld liegt, werden aus der R-Analyse entfernt und als schwarze Flecken dargestellt. Nach der Schwellenanwendung sollte nur der Bereich visualisiert werden, der der Sphäroidfluoreszenz entspricht. Die vorläufige Abschätzung der durchschnittlichen Hintergrundintensität (Bereiche ohne Sphäroide) der unabhängigen Spektralkanäle vereinfacht die Wahl eines geeigneten Schwellenwertes zum Bild. Darüber hinaus hilft die Anwendung von Sphäroid-ROI-Grenzen, die aus dem entsprechenden Transmissionslicht-Sphäroidbild auf das zusammengeführte Fluoreszenzbild identifiziert wurden, eine genaue Bestimmung der Schwellenwertparameter, um eine übermäßige Subtraktion der Nicht-Hintergrundsignalintensitäten zu verhindern. - Behalten Sie die Hintergrundeinstellungen für die Zähler- und Nennerintensität bei 0 bei, da der Hintergrund bereits mit der Schwellenwertanwendung subtrahiert wurde.
- Passen Sie den Skalierungsfaktor (Skalierung) an das Verhältnisbild an, bis das Vorschaubild die gewünschte Auflösung des R-Farbverlaufs liefert. Wenden Sie den Skalierungsparameter gleichmäßig auf alle Sphäroidbilder in dem Datensatz an, der in der vergleichenden Analyse verwendet wird.
HINWEIS: Der Skalierungsparameter sollte groß genug sein (mindestens 1.000), um sicherzustellen, dass das R-Bild so viele Informationen wie möglich enthält und als Auflösungsfaktor für numerische R-Daten angesehen werden kann. - Wenden Sie angepasste Parameter auf das Sphäroidbild an, indem Sie auf Übernehmen klicken. Passen Sie die Helligkeit und den Kontrast des Bildes im Anzeigefenster anpassen über das Menü der Werkzeugfenster an.
- Bestimmen Sie manuell die Verknüpfungs- und Entlinkungsgrenzen eines Histogramms für die Verhältnisverteilung, indem Sie die Option für die feste Skalierung im Fenster Anzeige anpassen verwenden. Dadurch wird der Bereich des Falschfarbenbalkens für die Darstellung des R-Parameters bestimmt.
HINWEIS: Um Sphäroidbilder zwischen verschiedenen Gruppen zu vergleichen, ist es wichtig, einen ähnlichen Farbbalkenbereich für alle analytischen Proben beizubehalten. Da eine Reihe von Änderungen des R-Parameters zwischen Gruppen unterschiedlich sein kann, sollte der gewählte Falschfarbenbalkenbereich für Verteilungshistogramme in allen analytischen Gruppen universell sein. - Sphäroide sind oft nicht ideal kugelförmig, nehmen wir an, dass der Sphäroiddurchmesser die längste Linie ist, die durch das Zentrum (oft ein hypoxischer Kern) des Sphäroides gezogen wird. Bestimmen Sie mit der linearen Linealfunktion aus dem Measuremenü den Sphäroiddurchmesser. Exportieren Sie Daten als Tabellenkalkulationstabellendatei.
- Wählen Sie den ROI einer gewünschten Größe (so klein wie möglich) und Form (z. B. rund) und wenden Sie ihn auf die Peripherie und den hypoxischen Kern des Sphäroid an. Transformieren Sie den ROI in das Messobjekt, um das durchschnittliche R (peripheres R-Rp und CoreR-R c) innerhalb des gewählten ROI zu analysieren. Exportieren Sie Daten in einem Tabellenkalkulations-kompatiblen Tabellenformat.
HINWEIS: Sphäroide haben keine identischeO2-Verteilung innerhalb der Gruppe und die hypoxischen Kerne kolokalisieren nicht perfekt mit den Sphäroidzentren. Um die Analyse zu vereinfachen und zu standardisieren, gehen wir davon aus, dass die hypoxischsten Bereiche dem idealen Kern im Zentrum des Sphäroides entsprechen. R c, gemessen in diesen Zonen, wird für Berechnungen des O2-Gradientenbereichs (R p-R c) und der Steilheit (Rp-R c) /r verwendet, wobei r (idealerweise ein Abstand zwischen peripheren und hypoxischen Kern-ROIs) ein ungefährer Radius des Sphäroids in μm ist, der aus den Durchmessermessungen berechnet wird. Optional können sphäroideO2-Gradienten als lineare Linienprofile der R-Parameteränderung (Linienprofilfenster im Maßmenü) entlang des Sphäroiddurchmessers dargestellt werden. Diese Daten können auch als Tabellenkalkulationstabellendatei exportiert werden. - Wenden Sie Messungen auf jeden Mikroskopieabschnitt von Sphäroiden an, um den Datensatz der Sphäroiddurchmesser, Rc undR p zu erhalten, um weitere Berechnungen und statistische Vergleiche durchzuführen. Kombinieren Sie alle Daten in einer Tabellenkalkulationsdatei.
- Für die Zeitrafferanalyse von Photobleaching oder dynamischen Reaktionen auf verschiedene Reize wenden Sie den gewählten ROI auf die gleichen Koordinaten auf jedem Bild in einem Set an. Um R-Parameter zu vergleichen, stellen Sie sie als Prozentsatz aus dem R des ersten Zyklus in einem Zeitraffer-Bildsatz dar.
- Für die Photobleichanalyse verwenden Sie R aus mehreren ROIs, um das durchschnittliche R in Prozent für jeden Zeitrafferzyklus zu berechnen und die Änderungen zu verfolgen.
- Angenommen, der Photobleicheffekt ist nicht kritisch, wenn die Anfangsintensität nach 12 Zyklen kontinuierlicher Beleuchtung weniger als 5% abnimmt. Vergleichen Sie dynamische Änderungen immer mit einer Photobleichkurve als Steuerelement, um die Signifikanz der ratiometrischen Zeitrafferreaktion sicherzustellen (siehe Abbildung 2A,B).
- Aus den erhaltenen Parametern berechnen sich r, (R p-R c) und (Rp-R c)/r für einzelne Sphäroide in einem Datensatz. Analysieren Sie die Normalität der Datenverteilung durch die Kolmogorov-Smirnov oder relevante Tests. Wählen Sie die geeignete statistische Methode für die Datenanalyse und fahren Sie mit den Datendarstellungszahlen fort.
HINWEIS: Die hier dargestellten Daten waren normalverteilt und ein unabhängiger t-Test bei p = 0,05 wurde für den statistischen Vergleich zwischen Sphäroidgruppen implementiert.
- Öffnen Sie die VSI-Datei mit Intensivdaten derO2-Sonde aus Referenz- und empfindlichen Spektralkanälen, die im zusammengeführten Modus erstellt wurden. Öffnen Sie das Funktionsfenster für die Verhältnisanalyse über das Menü "Maßnahme". Wählen Sie die Intensität des Referenzkanals als Zähler und die Intensität des empfindlichen Kanals als Nenner für die R-Berechnung.
Ergebnisse
Die Hochdurchsatzproduktion von O2-Sonden-vorgefärbten Sphäroiden unter Verwendung der mikrostrukturierten Agarosemethode ist in Abbildung 1C schematisch dargestellt und zeigt Beispiele für Agarose-Mikrotöpfe ohne und mit den vorgefärbten Sphäroiden. Die Effizienz der Sphäroidbildung auf Agarosebeschichtung und deren Form/Sphärizität kann zellspezifisch sein. Zum Beispiel bildeten menschliche Dickdarm-HCT116-Zellen nie ideale sphärische Strukturen mit der Agarose-Mikrowell-Methode, im Gegensatz zu lipidbeschichteter Oberfläche17, während hDPSCs allein und zusammen mit HUVEC immer Sphäroide von hochreproduzierbarer Form und Größe produzierten, die proportional zur Zellzusammensetzung, zur anfänglichen Zellzahl und zur Dauer der Sphäroidbildung / des Sphäroidwachstums waren. Alle getesteten Zelltypen akkumulierten effizient O2-Sonden-Nanopartikel während der Sphäroidbildung (Abbildung 1B) undkonservierten diese Färbung über mindestens 5 Tage, so dass sie für das Bioprinting und die anschließende Überwachung der Sauerstoffversorgung des biogedruckten Gewebes verwendet werden konnten (Abbildung 1D).
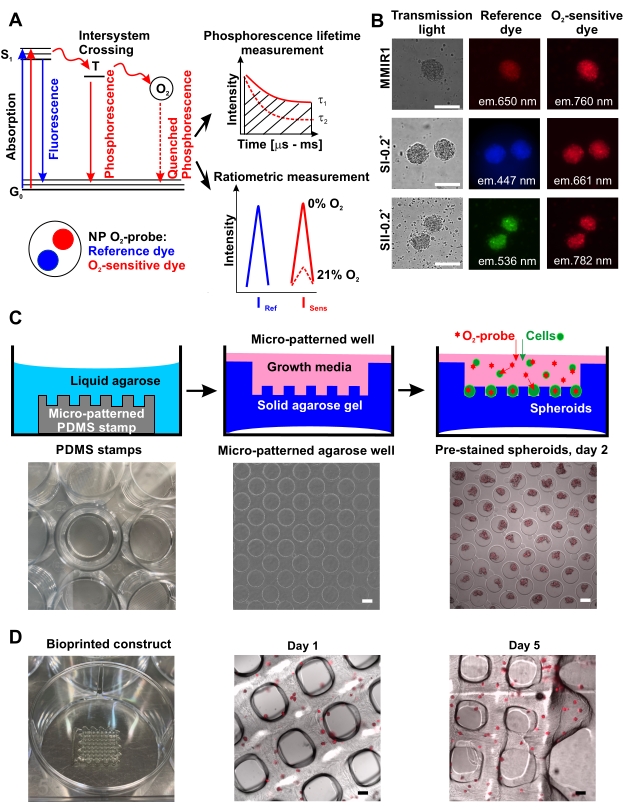
Abbildung 1: Prinzip derO2-Sondenfunktion und ihre Anwendung für die Sphäroidfärbung und das Bioprinting. (A) Ein vereinfachtes Yablonski-Diagramm, das das Prinzip derO2-Erfassung durch die phosphoreszierenden Nanopartikelsonden (NP) erklärt. Die Übertragung von Energie auf molekulares O2 während des verbotenen Triplett-angeregten Zustands (T) führt zu einer Abnahme der Phosphoreszenzintensität, die umgekehrt proportional zur Phosphoreszenzlebensdauer tau, τ ist (Änderungen von τ 1 bei 0% O2 zu τ2 bei 21% O2), was die Zeit zwischen der Anregung zum Singulettzustand (S1) und ihrer Rückkehr in den Grundzustand (G0) 42 ist. Die quantitativeO2-Messung kann durch ratiometrische Messung oder durch Messung von τ (Phosphoreszenzlebensdauermessungen) erfolgen. (B) Ein Beispiel für die Färbung von humanen Zahnpulpa-Stammzell-Sphäroiden (hDPSC), die mit verschiedenen Arten von Nanopartikel-O2-Sonden angefärbt sind, dargestellt in Transmissionslicht-, Referenz- undO2-empfindlichen Farbstofffluoreszenzkanälen. Der Skalenbalken beträgt 100 μm. (C) Schematische Darstellung der vorgefärbten Sphäroiderzeugung mit hohem Durchsatz derO2-Sonde unter Verwendung der mikrostrukturierten Agarosemethode. Von links nach rechts: PDMS-Siliziumstempel in einer Vertiefung der Kulturplatte, ein Beispiel für ein Mikrowellenmuster in Agarose (4-fache Vergrößerung) und ein Beispiel für vorgefärbte MMIR1-Sphäroide, die aus HCT116-menschlichen Darmkrebszellen am Tag 2 nach der Aussaat auf mikrostrukturierter Agarose (4-fache Vergrößerung) hergestellt wurden. Der Maßstabsbalken beträgt 100 μm. (D) Von links nach rechts: ein biogedrucktes Waffelkonstrukt und eine mikroskopische Analyse von MMIR1 vorgefärbtem Sphäroid Bioprint-Konstrukt an den Tagen 1 und 5 nach dem Bioprinting. Das Fluoreszenzsignal entspricht demO2-empfindlichen phosphoreszierenden Farbstoff in MMIR1-Nanopartikeln (exc. = 635 nm/em. = 760 nm). Der Maßstabsbalken beträgt 400 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Auf dem beschriebenen mikroskopischen Aufbau (herkömmliches Weitfeld-Fluoreszenzmikroskop mit der Leuchtdiode (LED) als Lichtquelle) wurde die rote/nahinfrarote MMIR1-Sonde als die beste in Bezug auf die Photostabilität ihrer Referenz und empfindliche Farbstoffe mit der weniger als 5% igen Helligkeitsabnahme ihres anfänglichenIntensitätsverhältnisses (R = Iref/I sens) gefunden. ) nach 12 Zyklen kontinuierlicher Beleuchtung. Dies ermöglichte die Verwendung der MMIR1-Sonde für die dynamische Echtzeituntersuchung der schnellen Atemreaktion in hDPSC-Sphäroiden bei Behandlung mit mitochondrialem Entkoppler (FCCP) und Inhibitor des Komplexes I der Elektronentransportkette (Rotenon) (Abbildung 2A, B). Wir fanden heraus, dass FCCP in den aus Stammzellen gewonnenen Sphäroiden nur einen milden Entkopplungseffekt mit einer leichten Abnahme der Zellatmung innerhalb von ~ 80 s nach Zugabe dieses Arzneimittels zeigte, in Übereinstimmung mit zuvor berichteten metabolischen Merkmalen von DPSC40. Auf der anderen Seite hemmte Rotenon stark die Atmung, was zu einer Reoxygenierung der Spheroide (die sich als Anstieg des R-p-Sphäroid-Peripherie-Verhältnissesund des RC-Sphäroidkern-Verhältnisses widerspiegelt) und zur Dissipation der Peripherie-zu-Kern-O2-Gradienten innerhalb von ~ 80 s nach der Stimulation führte (Abbildung 2A). Zwei-Punkt-Semikalibrierung des MMIR1-Sondenverhältnisses (R) bei hoch (atmosphärisch) und niedrig (in Gegenwart von Natriumsulfit und Glucoseoxidase in bildgebenden Medien)O2-Spiegel bestätigten die Abnahme von R, die mit der Abnahme der Oxygenierung in Sphäroiden mit vorläufig gehemmter Atmung durch Antimycin A / Rotenon-Cocktailbehandlung zusammenhängt (Abbildung 2C ), die veranschaulicht, wie die Messung der MMIR1-Sonde R für die semi-quantitative Überwachung von langfristigen stationären und schnellen Oxygenierungsreaktionen in 3D eingesetzt werden kann.

Abbildung 2: Kinetische Analyse derO2-Sondenreaktion auf verschiedene Reize. (A) Repräsentatives Ergebnis der hDPSC-Sphäroidoxygenierungsbildgebung in Ruhe und als Reaktion auf FCCP- und Rotenonbehandlungen. Der Skalenbalken beträgt 100 μm. (B) Kinetische Reaktion des MMIR1-Intensitätsverhältnisses auf die FCCP- und Rotenonbehandlung im Vergleich zur Kinetik des anfänglichen Photobleichintensitätsverhältnisses (%). (C) Änderungen im Intensitätsverhältnis von Bildern der MMIR1-Sonde in hDPSC-Sphäroiden in sauerstoffhaltigen (Antimycin A + Rotenonaddition) und desoxygenierten (Glucoseoxidase-Addition) Zuständen. Der Farbbalken stellt die Verteilung des O2-Sondenintensitätsverhältnisses (R = I ref / Isens) über das Bild dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Zur Veranschaulichung der Anwendung der MMIR1-Sonde für die metabolische Live-Bildgebung wurde die vergleichende Analyse vonO2-Gradienten in homozellulärem hDPSC im Vergleich zu heterozellulären hDPSC/HUVEC (1:1)-Sphäroiden durchgeführt. Unter Ausnutzung der Verfügbarkeit freier blauer undgrüner Fluoreszenzspektralkanäle wurde eine Co-Färbung mit Hoechst 34580 (HXT) und SYTOX Green (SYTOX) durchgeführt, um die Anwendung der O2-Sonde für multiparametrische Studien zu demonstrieren (Abbildung 3). Unter Verwendung des automatisierten Protokolls der Pixel-für-Pixel-Intensitätsverhältnisberechnungen, die von der Bildgebungssoftware bereitgestellt werden, wurden Falschfarbenverhältnisbilder der R-Verteilung in Sphäroiden erzeugt, die in Echtzeit erkannte Peripherie-zu-Kern-O2-Gradienten in allen Arten von Sphäroiden visualisierten: mit der oxygenierten Peripherie und hypoxischen Nischen in der Mitte (Abbildung 2 und Abbildung 3A). Die R-p- undR-c-Werte sowie die Steilheit desO2-Gradienten in den mittleren Querschnitten variierten jedoch für verschiedene Sphäroidtypen: siehe die Linienprofile der mittleren Querschnitte in hDPSC versus hDPSC/HUVEC-Sphäroiden und hDPSC versus biogedruckten hDPSC-Sphäroiden (Abbildung 3B,C). Da es keine allgemein akzeptierte Methode zur Beschreibung von O2-Gradienten gab, führten wir mehrere Parameter ein, die einen einfachen Vergleich und eine detaillierte Beschreibung der allgemeinen Sphäroidoxygenierung ermöglichten: R p und R c sowie solche Eigenschaften vonO2-Gradienten als Unterschied zwischen den oxygenierten und hypoxischen Zonen wie (Rp-R c) und durchschnittliche Änderungen der Oxygenierung pro μm als (Rp-R c) / r, wobei r ein Abstand zwischen Peripherie und hypoxischem Kern ist, der im mittleren Querschnitt mit dem Sphäroidradius korreliert (Abbildung 3D). Der statistische Vergleich dieser Parameter zusammen mit den von SYTOX in Sphäroiden visualisierten Daten von nekrotischen toten Zellen half uns, erste Rückschlüsse auf die Entstehung der sphäroidzelltypspezifischen O2-Verteilungsgradienten zu ziehen.

Abbildung 3: Vergleichende Analyse von Oxygenierungsgradienten in Sphäroiden. (A) Repräsentative Beispiele für die Lebendmikroskopie der Oxygenierung (ratiometrische Fluoreszenzmikroskopie von MMIR1) und Lebend-/Totenzellfärbung (Hoechst 34580, HXT, blau und SYTOX Green, SYTOX) in homozellulären hDPSC-Sphäroiden vor und nach dem Drucken und heterozellulären hDPSC/HUVEC (1:1)-Sphäroiden. hDPSCs in allen Arten von Sphäroiden stammten aus derselben Zellkultur. Sphäroide wurden während ihrer Bildung 2 Tage lang mit 5 μg / ml MMIR1-Sonde vorgefärbt und dann entweder für die Bildgebung oder das Bioprinting (nur hDPSC-Sphäroide) verwendet, mit anschließender Bildgebungsanalyse am Tag 1 nach dem Bioprinting. Falschfarbenbilder des Intensitätsverhältnisses (Iref/I sens) Bilder von MMIR1-gefärbtenSphäroiden entsprechen ihren Peripherie-zu-Kern-O2-Gradienten. Der Skalenbalken beträgt 100 μm. Der Farbbalken stellt die Verteilung des O2-Sondenintensitätsverhältnisses (R = I ref/Isens) über das Bild dar. Die Nummern 1 und 2 der Durchmesserquerschnitte entsprechen den in B und C dargestellten Intensitätsprofilen. (B,C) Vergleich von Intensitätsverhältnisprofilen zwischen homogenen hDPSC- und heterogenen hDPSC/HUVEC-Sphäroiden (B) und homogenen hDPSC-Sphäroiden vor und nach dem Bioprinting (C). Die Profile wurden für Querschnitte von Sphäroiden gemessen, die auf (A) dargestellt sind. (D) Schematische Darstellung der Parameter, die für die Beschreibung der O2-Peripheriegradienten in Sphäroiden verwendet werden, wobei r ein Radius von Sphäroid und Rp undR c Intensitätsverhältnisse der Peripherie und der Kernregion des Sphäroids entsprechend sind. Der Farbbalken stellt schematisch die Verteilung desO2-Verlaufs von hohen (rot) zu niedrigen (blauen) Werten in ideal sphärischem Sphäroid dar. (E,F) Vergleichende Analyse von Peripherie-zu-Kern-O2-Gradienten (Rp-R c) / r-Werten in hDPSC/HUVEC- und hDPSC-Sphäroiden (E) und in hDPSC-Sphäroiden vor und am Tag 1 nach dem Bioprinting (F). Die statistische Analyse wurde für eine experimentelle Wiederholung durchgeführt (n = 18-23). Boxen entsprechen Standardabweichungen. Sternchen zeigen den statistischen Unterschied zwischen den Gruppen an (bei p = 0,05); ** = p < 0,0005. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Im Vergleich zu homozellulären hDPSC-Sphäroiden wiesen hDPSC/HUVEC-Sphäroide deutlich steilere Gradienten auf: höhere Werte von (R p-R c) / r Parameter und Bereich (Rp-R c; Abbildung 3F). Gleichzeitig zeigten sie eine höhere Oxygenierung der Peripherie (Rp) und des Kerns (R c) (Abbildung 4A, Tabelle 1). Interessanterweise waren sie auch statistisch größer (Abbildung 4A, Tabelle 1), was darauf hindeutet, dass solche Unterschiede in der Oxygenierung durch ihre unterschiedlichen zellulären bioenergetischen Profile verursacht wurden. Diese Daten stimmen mit den bekannten metabolischen Merkmalen von HUVEC-Zellen überein, die im Allgemeinen eine geringere Atmungsaktivität von Zellen aufweisen, wobei die starke Abhängigkeit von Glykolyse- und Pentose-Phosphat-Signalwegen als den wichtigsten bioenergetischen Quellen von ATP und NAD(P)H41 besteht. Gleichzeitig wird der ausgeprägte Peripherie-zu-Kern-O2-Gradient, der in heterogenen Sphäroiden gebildet wird, wahrscheinlich durch hDPSC in ihrer Zusammensetzung erzeugt, gekennzeichnet durch hyperpolarisierte Mitochondrien und aktive Elektronentransportkette40 und, nach den Ergebnissen zu hDPSC-Sphäroiden Oxygenierung, mit starker Atmungsaktivität (Abbildung 3, Abbildung 4A und Tabelle 1 ). Daher ist eine im Allgemeinen höhere Lebensfähigkeit von hDPSC/HUVEC-Sphäroiden, die durch die geringere Intensität der Färbung ihrer toten Zellen mit SYTOX bestätigt wird (Abbildung 3A), möglicherweise mit ihren höheren Sauerstoffgehalten verbunden.
Um die Anwendbarkeit der Live-Mikroskopie-Bildgebung der Sphäroidoxygenierung in der Biofabrikation zu veranschaulichen, wurden MMIR1 O2-Sonden-vorgefärbte Sphäroide für das Bioprinting in GelMA-Biotinte mit dem folgenden Vergleich vonO2-Gradienten in hDPSC-Sphäroiden vor und am Tag 1 nach dem Bioprinting verwendet (Abbildung 3A, C, F, Abbildung 4B und Tabelle 2). Biogedruckte hDPSC-Sphäroide wiesen im Vergleich zu Sphäroiden, gemessen vor dem Bioprinting, eine signifikant oxygenierte Peripherie (höhere Rp) auf, während ihre Kernoxygenierung ähnliche Werte aufwies (Abbildung 4B). Änderungen ihrer peripheren Oxygenierung beeinflussen den Bereich (eine Zunahme von (Rp-R c) und Steilheit (erhöht (Rp-R c)/r) ihrer Peripherie-zu-Kern-O2-Gradienten, die sich statistisch von hDPSC-Sphäroiden unterschieden, die vor dem Bioprinting gemessen wurden (Abbildung 3F und Abbildung 4B). Die Färbung toter Zellen war in biogedruckten Sphäroiden im Allgemeinen heller, was darauf hindeutet, dass eine verminderte Sphäroidlebensfähigkeit an der Veränderung der Sphäroidoxygenierung beteiligt ist (Abbildung 3A).

Abbildung 4: Vergleichende Analyse des Durchmesser- und Intensitätsverhältnisses von MMIR1-gefärbten Sphäroiden. (A) Vergleich zwischen hetero- hDPSC/HUVEC und homozellulären hDPSC-Sphäroiden. (B) Vergleich homozellulärer hDPSC-Sphäroide vor und nach dem Bioprinting. Rp und Rc - Intensitätsverhältnis an der Peripherie und dem Kern der Sphäroide entsprechend; (Rp-R c) - die Differenz im Intensitätsverhältnis, die dem Bereich desO2-Gradienten in Sphäroiden entspricht. Die statistische Analyse wurde für eine experimentelle Replikation durchgeführt (n = 18-23). Boxen entsprechen Standardabweichungen. Sternchen geben die statistische Differenz zwischen den Gruppen an (bei p = 0,05), wobei * = p < 0,005 und ** = p < 0,0005. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Art des Sphäroids (N) | Durchmesser [μm] | Rp [a.u.] | Rc [a.u.] | Rp-R c [a.u.] | (Rp-R c)/r [a.u./μm] |
| hDPSC / HUVEC (18) | 113,2 ± 10,6 | 0,779 ± 0,034 | 0,398 ± 0,055 | 0,982 ± 0,051 | 0,00677 ± 0,00091 |
| hDPSC (18) | 88,1 ± 9,9 | 0,558 ± 0,025 | 0,331 ± 0,034 | 0,227 ± 0,032 | 0,00520 ± 0,00090 |
| p-Wert | 1,5 x 10-8 * | 1,5 x 10-21 * | 1,3 x 10-4 * | 1,4 x 10-12 * | 9,2 x 10-6 * |
Tabelle 1. Sphäroiddurchmesser, Intensitätsverhältnis am Kern (R c) und der Peripherie (R p) der Sphäroide, die Differenz im Intensitätsverhältnis (R p-R c) und (R p-R c) / r-Wert in heterogenen hDPSC/HUVEC und homogenen hDPSC-Sphäroiden. Der p-Wert eines t-Tests an N-Sphäroiden zeigt statistische Unterschiede und ist ebenfalls mit einem Sternchen gekennzeichnet.
| Art des Sphäroids (N) | Durchmesser [μm] | Rp [a.u.] | Rc [a.u.] | Rp-R c [a.u.] | (Rp-R c)/r [a.u./μm] |
| hDPSC (18) | 88,1 ± 9,9 | 0,558 ± 0,025 | 0,331 ± 0,034 | 0,227 ± 0,032 | 0,00520 ± 0,00090 |
| Bioprinted hDPSC (23) | 80,9 ± 12,5 | 0,584 ± 0,023 | 0,323 ± 0,038 | 0,261 ± 0,039 | 0,00658 ± 0,00144 |
| p-Wert | 0.054 | 0.0024 * | 0.46 | 9,9 x 10-4 * | 6,3 x 10-6 * |
Tabelle 2. Sphäroiddurchmesser, Intensitätsverhältnis am Kern (R c) und der Peripherie (R p) der Sphäroide, die Differenz im Intensitätsverhältnis (Rp-R c) und (R p-R c) / R-Wert in homogenen hDPSC-Sphäroiden vor und nach dem Bioprinting. p-Wert der statistischen Analyse (N-Sphäroide). Die statistische Differenz ist mit einem Sternchen gekennzeichnet.
Diskussion
Bedeutung. Die Messung der Gewebeoxygenierung gibt einen Einblick in den zell- und gewebespezifischen Stoffwechsel, das Wachstum und die Entwicklung von Geweben, die Lebensfähigkeit, die Tumorgenese und Zellmigration sowie die Interaktion mit Mikroben und anderen Krankheitserregern. Die vorgestellte Methode bietet ein neues Werkzeug für ein besseres Verständnis der Physiologie multizellulärer Sphäroidkulturen: Analyse der Oxygenierung mit ratiometrischen Nanopartikel-O2-Sonden und bietet Mittel zur Beurteilung der Hypoxie, Visualisierung der Abhängigkeit von bestimmten Energieproduktionspfaden und ergänzt Modellierungsstudien und alternative metabolische Bildgebungsansätze 43,44 auf einem weit verbreiteten, kostengünstigen Fluoreszenzmikroskop. Ratiometrische Messungen können an einem fluoreszenzweiten (gepulste LED-Anregung bevorzugt), laserscannenden Konfokal-, Lichtblatt- und Zwei-Photonen-Mikroskopen durchgeführt werden, die ideal mit T- undO2-Inkubatorkammern ausgestattet sind. Wichtig ist, dass die vorgestellteO2-Mikroskopiemessung leicht mit der Live-Multiparameteranalyse verschiedener physiologischer Parameter und Zelltracer (im Falle von heterozellulären Sphäroidkulturen), Lebensfähigkeit (Lebend- / Totfärbung), Fettstoffwechsel (lipidempfindliche Fluoreszenzsonden), Dynamik des pH-Werts (Farbstoffe, Nanopartikel und fluoreszierende Proteine) oder [Ca2+ ], die in verfügbaren Fluoreszenzspektralkanälen oder parallel durchgeführt werden und einen erweiterten Überblick über die Echtzeit-Zellfunktion in Sphäroiden, biogedruckten Konstrukten und potenziellen Gewebetransplantaten bieten.
Sphäroidkulturen finden Verwendung in Studien von Krebszellen, Tumor- und Stammzellnischenmikroumgebungen, Tumoroiden, Wirkstoffeffizienz und Toxizitätsscreening sowie als Gewebebausteine für die Biofabrikation und Selbstorganisation von Geweben45. Sie können aus mehreren Zelltypen durch eine Vielzahl von verschiedenen Ansätzen erzeugtwerden 46. Die Popularität des Sphäroidmodells erfordert ihre Standardisierung unter dem Gesichtspunkt der Forschungsintegrität und der Verbesserung der Datenanalyse, die kürzlich durch die Entwicklung der ersten Sphäroiddatenbank8 versucht wurde.
Es wird erwartet, dass unser Protokoll dazu beiträgt, den Lebendstoffwechsel von Sphäroiden besser zu verstehen, dieses experimentelle Modell zu standardisieren und anschließend seine Langzeitstabilität, Reproduzierbarkeit und Lebensfähigkeit in biogedruckten und implantierbaren Materialien zu verbessern.
Änderungen. Dieses Protokoll beschreibt die Verwendung einer mikrostrukturierten Agarose-Low-Adherent-Oberfläche (Mikroform-basierte Formation29) zur Erzeugung von O2-Sonden-belasteten Sphäroiden für die Oxygenierungsanalyse. Die alternativen Methoden der Sphäroidproduktion wie hängender Tropfen, Auftragen von extrem niedrigen Befestigungsplatten, Lipidbeschichtung oder freischwebende Bildung sind ebenfalls mit dem vorgeschlagenen O2-Sondenladeprotokoll kompatibel. Das vorgestellte Protokoll wurde für hDPSC-Sphäroide und Co-Kultur-Sphäroide von hDPSC mit HUVEC (1:1) optimiert. Andere Zelllinien sind sicherlich anwendbar 15,17,47,48; Aufgrund der unterschiedlichen Zelladhäsionseigenschaften, Kulturbedingungen, metabolischen Substratanforderungen und Zellkompatibilität mit der Nanopartikelfärbung kann jedoch eine gewisse Protokolloptimierung erforderlich sein. Die Wahl einer geeigneten ratiometrischen nanopartikelbasierten O2-sensitiven Sonde muss in Abhängigkeit vom spezifischen Zellmodell und entsprechend den Photobleicheigenschaften der Sonde am verwendeten mikroskopischen Aufbau (Intensität und Art der Lichtquelle, spektrale Empfindlichkeit der Kamera) und der Verfügbarkeit geeigneter Anregungs-/Emissionsfilter für entsprechende Referenz- undO2-empfindliche Spektralkanäle der Sonde erfolgen.
Einige ratiometrischeO2-Sonden sind im Handelerhältlich 2. Alternativ können sie im Haus durch Co-Ausfällung von Referenz- undO2-empfindlichen Farbstoffen mit einem Polymer hergestellt werden, wie an anderer Stellebeschrieben 24,25,49. Für jedes einzelne Modell sollten die Vorversuche durchgeführt werden, um die geeigneten Sonden- und optimalen Mikroskopiebedingungen zu bestimmen und den Effekt von Sondenphotobleichen oder photoinduziertemO2-Verbrauch bei ratiometrischen Messungen zu minimieren. Frühere Studien mit O2-Sensor-Nanopartikeln zeigten ihre geringe Zelltoxizität, die eine Anwendung in einem breiten Bereich von Färbekonzentrationen (1-20 μg / ml) ermöglicht. Da sich einige kationische Nanopartikel während der Lagerung selbst aggregieren können, empfehlen wir, ihre Belastungskonzentration so niedrig wie möglich zu halten, um ihre potenziellen Auswirkungen auf die Sphäroidbildung zu minimieren. Optional kann die Nanopartikelsuspension vor der Verwendung gefiltert (0,2 μm) oder durch Zentrifugation (10.000 x g, 5 min) gereinigt werden, um alle Aggregate aus der Suspension zu entfernen.
Obwohl die BioCAD- und HMI-Software spezifisch für den vorgestellten Bioprinter sind, ist dieses Protokoll auf andere Bioprinter anwendbar, da die Vorbereitung der Biotinte, die Montage, das Befüllen einer Standardpatrone und das Design eines porösen Hydrogel-Gerüsts bereitgestellt werden. Darüber hinaus sollten die Bioprinting-Parameter wie Druckrate und Temperatur für verschiedene extrusionsbasierte Bioprinter vergleichbar sein. Der Druckdruck und der Federbeindurchmesser hängen von der Nadelart und dem Durchmesser, der Bioink-Zusammensetzung, der Temperatur und der resultierenden Viskosität ab, können jedoch ein Ausgangspunkt für die Optimierung der Druckparameter für Bioprint-GelMA-basierte Biotinten mit verschiedenen Bioprintern sein, obwohl einige Bioprinter Spindeln anstelle von Luftdruck verwenden, um die Bioink50 zu extrudieren.
Kritische Schritte und Fehlerbehebung. Einer der kritischen Schritte ist die Wahl derO2-Sonde , die auf folgenden Überlegungen basiert: erstens der verfügbare Aufbau des Fluoreszenzmikroskops (d. h. kompatible Anregungslichtquelle, Filter für Anregung und Emission, Kameraempfindlichkeit und spektrale Durchlässigkeit sowie numerische Apertur des Objektivs), wodurch die Anzahl der verfügbaren Sonden in Bezug auf ihre Photostabilität begrenzt werden kann, Helligkeit und potenzielle Phototoxizität. Es ist auch wichtig zu beachten, dass einige Arten von Tauchöl (im Falle von Öl-Tauchobjektiven) rote und infrarote Fluoreszenzsignale stören können. Wir sehen die Photostabilitätstests als sehr wichtig an und dass sie bei der Ersteinrichtung und den Vorversuchen durchgeführt werden müssen. Potentielle spektrale Übersprechen zwischen den Fluoreszenzkanälen und verschiedenen Farbstoffen müssen berücksichtigt werden. Tatsächlich muss die potenzielle dunkle und photoinduzierte Toxizität derO2-Sonde und anderer ausgewählter Farbstoffe in Bezug auf das spezifische Zellmodell während der Protokolloptimierungbewertet werden 51. Das spezifische Problem für Nanopartikel kann ihre Selbstaggregation sein, die durch Optimierung ihrer Arbeitskonzentration, Zusammensetzung des Färbemediums (z. B. Serumgehalt), Beschallung von Nanopartikeln vor dem Mischen mit Medium oder durch Verwendungvon vorgefärbten und gewaschenen O2-Sondenzellen für die Sphäroidbildung anstelle der Sondenbelastung während des Sphäroidbildungs- und Kompaktisierungsverfahrens gemildert werden kann.
Wir haben keine Probleme im Zusammenhang mit der Lichteindringtiefe bei beschriebenen Sphäroidmodellen beobachtet, aber dies muss bei der Auswahl von ratiometrischen Intensitätssignalen, der Größe von Sphäroid und biofabrizierten Konstrukten (Gewebetransplantaten) und der Optimierung der Zellfärbung mit entsprechenden Farbstoffen berücksichtigt werden. Es wird erwartet, dass die MMIR1-Sonde mit eng verwandten roten und nahinfraroten Emissionswellenlängen im Vergleich zu anderen rot/blauen oder grün emittierenden fluoreszierenden Biosensorsonden den niedrigsten Hintergrund und die beste Gewebelichtdurchdringung bietet.
Die Produktion und Verarbeitung von Verhältnisbildern (und möglicherweise spektraler Entmischung oder Dekonvolution) kann in einer vom Hersteller bereitgestellten Software oder in den Open-Source-Optionen wie ImageJ, Fiji 52,53, napari (https://napari.org), MATLAB und anderen erfolgen. Ein kritischer Schritt wird darin bestehen, den Hintergrund zu subtrahieren und Signalintensitätsänderungen in einem linearen Bereich zu messen.
Kalibrierung der O2-Sonde: Rotenon und Antimycin A sind Inhibitoren der Komplexe I und III der mitochondrialen Elektronentransportkette, die die Zellatmung54,55,15 blockieren und die Dissipation von O2-Gradienten in Sphäroiden und deren Gleichgewicht mit demUmwelt-O2 induzieren. Eine Änderung der O2-Konzentration in der Umwelt (d. h. 20 %, 15 %, 10 %, 5 %, 2,5 %, 1 %, 0 % O2) ermöglicht somit eine ratiometrische Intensitäts- oder Phosphoreszenzlebensdauerkalibrierung derO2-empfindlichen Sonde in Zellen. Typischerweise sind O2-gesteuerte Inkubatoren nicht in der Lage, absolute 0%O2 zu erreichen, und in bestimmten Situationen ist ein schneller Test der Reaktion der Sonde auf Desoxygenierung erforderlich. In solchen Fällen müssen der Probe 25-100 μg/ml Glucoseoxidase oderNa2SO3/K2HPO4-Gemisch (50 mg/ml für jede Verbindung für 10x Lösung in destilliertem Wasser) zugesetzt werden. Wenn die Zelllinie einen signifikanten Grad an nicht-mitochondrialemO2-Verbrauch aufweist, sollten Sie dies bei der Durchführung von Atemschutz- und Kalibrierungsexperimenten berücksichtigen.
Einschränkungen und zukünftige Forschung. Die Haupteinschränkung der vorgeschlagenen Methode und der ratiometrischen Detektion im Allgemeinen ist die Kalibrierung und Umwandlung der beobachteten Verhältnispegel in die tatsächlichenO2-Werte , was aufgrund der intrinsischen Unterschiede in den Hardware- und Benutzerbildaufnahmeeinstellungen das Verhältnis zur Kalibrierung geräte- und zellspezifisch machen würde. Wichtig ist, dass für ein Weitfeld-Fluoreszenzmikroskop und den beschriebenen Aufbau die Verhältnisbilder eher kombinierte Projektionen als ideale optische Abschnitte widerspiegeln und eineO2-Kalibrierung keinen Sinn machen würde. Auf der anderen Seite zeigen wir, dass semi-quantitative Verhältnismessungen eine statistisch signifikante und leicht zu messende vergleichende Phänotypisierung von Sphäroiden liefern, die aus verschiedenen Quellen hergestellt werden und Unterschiede in der Oxygenierung aufweisen.
Die zukünftige Forschung zur Herstellung zugänglicherer und erschwinglicherer Mikroskopieansätze für Live-3D-Objekte wie SPIM, Lichtblatt, Theta, Zwei-Photonen- und Lumineszenz-Lebensdauerbildgebung in Kombination mit dem maschinellen Lernen 56,57,58,59,19 wird dazu beitragen, die multiparametrischeO2-Bildgebung für noch mehr quantitative Anwendungen zu nutzen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde durch den Sonderforschungsfonds der Universität Gent (BOF/STA/202009/003) und das EU-FP7-ITN-Programm "Chebana", Zuschussvereinbarung Nr. 264772 (für AVK), unterstützt. Daten sind auf Anfrage erhältlich. Der G-Code für das Bioprinting kann freigegeben werden.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | Gibco | 25300-054 | Also available from Sigma |
| 12 well cell-culture plates, sterile | Greiner bio-one | 665-180 | Similar products are also available from Sarstedt, Corning and other companies. |
| 12 Well Chamber slide, removable | Ibidi | 81201 | Also available from Grace Bio-Labs, ThermoFisher Scientific and others |
| 15 mL centrifuge tubes | Nerbe plus | 02-502-3001 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| 3cc Cartridge, UV secure, luer lock | RegenHU | C-033CC-UV | Also available from CelIink and others |
| 3D Discovery Bioprinter | RegenHU | N/A | Bioprinter equiped with an extrusion based printhead, heating mantle, UV-LED curing lamp, 3D Discovery HMI software (CAD/CAM software with direct machine control) and BioCAD software (version 1.1-12) |
| 6 well cell-culture plates, sterile | Greiner bio-one | 657160 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Antimycin A from Streptomyces sp. | Sigma-Aldrich | A8674-25MG | Used as inhibitor of complex III of the mitochondrial electron transport chain, blocking cell respiration |
| B-Braun Tip Cap, luer lock | RegenHU | TC-BB-B | Also available from Regemat, Cellink and others |
| Cell view cell culture dish, PS, 35/10mm, glass bottom, 1 compartment, sterile | Greiner bio-one | 627861 | For microscopy of bioprinted spheroids |
| Collagen from human placenta, type IV | Sigma | C5533 | For the preparation of 0.07mg/mL Collagen and 0.03mg/mL Poly-D-lysine coated microscopy dishes |
| D(+)-Glucose | Merck | 8342 | Prepare 1M stock solution, 1/100 for preparation of imaging medium (final concentration 10mM) |
| Dulbecco's modified Eagle's medium (DMEM), phenol red-, glucose-, pyruvate- and glutamine-free | Sigma-Aldrich | D5030-10X1L | For preparation of imaging medium |
| Endothelial Cell Growth Medium 2 | PromoCell | C-22011 | Also available from Lonza and others |
| Endothelial Growth SupplementMix | PromoCell | C-39216 | Also available from Lonza and others |
| FCCP, Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma-Aldrich | C2920-10MG | Used as mitochondrial uncoupler |
| Fetal Bovine Serum | Gibco | 10270-098 | Also available from Sigma |
| GelMA | N/A | N/A | GelMA was synthesized by the PBM group (Prof Dr Peter Dubruel and Sandra Van Vlierberghe, University of Gent) [https://www.sciencedirect.com/science/article/pii/S0142961213011782] but are also available from Xpect Inx |
| Glucose-oxidase from Aspergillus nige (10000 u) | Sigma-Aldrich | G7141 | Used to test the response of probe to deoxygenation |
| GlutaMAX 100x Supplement | Gibco | 35050-038 | Dilution 1/100 for preparation of imaging medium (final concentration 2mM) |
| HEPES (1M) | Gibco | 15630-080 | Dilution 1/100 for preparation of imaging medium (final concentration 10mM) |
| Hoechst 34580 | Invitrogen (Life Technologies) | H21486 | Also available from Sigma, BDBiosciences and others |
| Human dental pulp stem cells (hDPSC) | Lonza | PT-5025 | Also available from ATCC or other vendors |
| Human umbilical vein endothelial cells (HUVEC) | Lonza | CC-2517 | Also available from ATCC or other vendors |
| KH2PO4 (potassium dihydrogen phosphate) | Merck | 4873 | For preparation of sodium sulfite solution (5 mg / mL Na2SO3 and 5 mg / mL KH2PO4). Prepare fresh from 10x concentrated stock solution daily. |
| Li-TPO | N/A | N/A | Li-TPO-L was synthesized by the PBM group (Prof Dr Peter Dubruel and Sandra Van Vlierberghe, University of Gent) [https://link.springer.com/referenceworkentry/10.1007%2F97 8-3-319-45444-3_15) , https://asmedigitalcollection.asme.org/nanoengineeringmedical/article/6/2/021001/376814/Hybrid-Tissue-Engineering-Scaffolds-by-Combination] but comparable photo-initiators are available from Sigma |
| MEM Alpha Medium + Glutamax Minimum essential medium | Gibco | 32561-029 | Also available from Sigma and others |
| Micro-patterned 3D-printed PDMS stamps, wells with a diameter 400 µm, thickness, total well numbers 1585 | Self-fabricated | These stamps were self-fabricated by the Centre for Microsystems Technology (Professor Dr Jan Vanfleteren, University of Gent) but can also be obtained commercially from Merck (Z764094, Microtissues 3D Petri Dish micro-mold mixed spheroid kit) | |
| Na2SO3 (sodium sulfite) | Sigma-Aldrich | 239321-500G | For preparation of sodium sulfite solution (5 mg / mL Na2SO3 and 5 mg / mL KH2PO4). Prepare fresh from 10x concentrated stock solution daily. |
| O2 probes: MMIR1, SI-0.2+, SII-0.2+ | N/A | N/A | Can be prepared ‘in-house’ using commercially available dyes, polymers and precipitation method [https://pubs.acs.org/doi/abs/10.1021/nn200807g https://onlinelibrary.wiley.com/doi/abs/10.1002/adfm.201201387 ]. Some nanoparticles are available commercially as discussed in [https://link.springer.com/article/10.1007/s00018-018-2840-x ] |
| Pen Strep :Penicillin (10,000 U/mL) / streptomycin (10,000 μg/mL) 100x solution | Gibco | 15140-122 | Also available from Sigma . Apply in dilution 1:100 |
| Petri dishes, sterile | Greiner bio-one | 633181 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Piston for 3cc cartridge | RegenHU | P-03CC-UV | Also available from Cellink, Regemat and others |
| Poly-D-lysine | Sigma | P6407-5mg | For the preparation of 0.07mg/mL Collagen and 0.03mg/mL Poly-D-lysine coated microscopy dishes |
| PVDF syringe filter 0.22 µm | Novolab | A35149 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Rotenone | Sigma-Aldrich | R8875-1G | Used as inhibitor of complex I of the mitochondrial electron transport chain, blocking cell respiration |
| Sodium pyruvate (100 mM) | Gibco | 11360-070 | Dilution 1/100 for preparation of imaging medium (final concentration 1mM) |
| SYTOX Green | Invitrogen (Life Technologies) | S7559 | Also available from Sigma, Promega and others |
| Taper tip 22 gauge (conical PE needle | Amada Myachi Europe | 22K62222 | Similar products are also available from RegenHU, Cellink, Regemat and others |
| Tissue culture flask (75 cm2) | VWR | 734-2313 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Ultrapure Agarose | Invitrogen (Life Technologies) | 16500-500 | Other types of Agarose such as Agarose low melting point (A-9414, Sigma), Agarose for routine use (A-9539, Sigma) |
| Widefield fluorescence inverted microscope | Olympus | N/A | Inverted fluorescence microscope IX81, with motorised Z-axis control, CoolLED pE4000 (16 channels, 365-770 nm), ORCA-Flash4.0LT (Hamamatsu) cMOS camera, glass warming plate Okolab, CellSens Dimension v.3 software and air objectives 4x/0.13 UPlanFLN and 40x/0.6 LUCPlanFLN. (Optional, for high-resolution imaging) 60x/1.0 LUMPLFLN water |
Referenzen
- Papkovsky, D. B., Dmitriev, R. I. Biological detection by optical oxygen sensing. Chemical Society Reviews. 42 (22), 8700-8732 (2013).
- Papkovsky, D. B., Dmitriev, R. I. Imaging of oxygen and hypoxia in cell and tissue samples. Cellular and Molecular Life Sciences. 75 (16), 2963-2980 (2018).
- Cordeiro, I. R., Tanaka, M. Environmental oxygen is a key modulator of development and evolution: From molecules to ecology: Oxygen-sensitive pathways pattern the developing organism, linking genetic and environmental components during the evolution of new traits. BioEssays. 42 (9), 2000025 (2020).
- Wenger, R. H., Kurtcuoglu, V., Scholz, C. C., Marti, H. H., Hoogewijs, D. Frequently asked questions in hypoxia research. Hypoxia. 3, 35 (2015).
- Erecińska, M., Silver, I. A. Tissue oxygen tension and brain sensitivity to hypoxia. Respiration Physiology. 128 (3), 263-276 (2001).
- Gholipourmalekabadi, M., Zhao, S., Harrison, B. S., Mozafari, M., Seifalian, A. M. Oxygen-generating biomaterials: a new, viable paradigm for tissue engineering. Trends in Biotechnology. 34 (12), 1010-1021 (2016).
- Zheng, L., Kelly, C. J., Colgan, S. P. Physiologic hypoxia and oxygen homeostasis in the healthy intestine. A review in the theme: cellular responses to hypoxia. American Journal of Physiology-Cell Physiology. 309 (6), 350-360 (2015).
- Peirsman, A., et al. MISpheroID: a knowledgebase and transparency tool for minimum information in spheroid identity. Nature Methods. 18 (11), 1294-1303 (2021).
- Suvarnapathaki, S., Wu, X., Lantigua, D., Nguyen, M. A., Camci-Unal, G. Breathing life into engineered tissues using oxygen-releasing biomaterials. NPG Asia Materials. 11 (1), 1-18 (2019).
- Salazar-Noratto, G. E., et al. Understanding and leveraging cell metabolism to enhance mesenchymal stem cell transplantation survival in tissue engineering and regenerative medicine applications. Stem Cells. 38 (1), 22-33 (2020).
- Leedale, J. A., et al. Mathematical modelling of oxygen gradients in stem cell-derived liver tissue. Plos One. 16 (2), 0244070 (2021).
- Sutherland, R., et al. Oxygenation and differentiation in multicellular spheroids of human colon carcinoma. Cancer Research. 46 (10), 5320-5329 (1986).
- Walenta, S., Dötsch, J., Bourrat-Flöck, B., Mueller-Klieser, W. Size-dependent oxygenation and energy status in multicellular tumor spheroids. Oxygen Transport to Tissue XII. , (1990).
- Hompland, T., Fjeldbo, C. S., Lyng, H. Tumor hypoxia as a barrier in cancer therapy: Why levels matter. Cancers. 13 (3), 499 (2021).
- Dmitriev, R. I., Zhdanov, A. V., Nolan, Y. M., Papkovsky, D. B. Imaging of neurosphere oxygenation with phosphorescent probes. Biomaterials. 34 (37), 9307-9317 (2013).
- Dmitriev, R. I., Borisov, S. M., Jenkins, J., Papkovsky, D. B. Multi-parametric imaging of tumor spheroids with ultra-bright and tunable nanoparticle O2 probes. Imaging, manipulation, and analysis of biomolecules, cells, and tissues XIII. , (2015).
- Dmitriev, R. I., et al. Versatile conjugated polymer nanoparticles for high-resolution O2 imaging in cells and 3D tissue models. ACS Nano. 9 (5), 5275-5288 (2015).
- Okkelman, I. A., Puschhof, J., Papkovsky, D. B., Dmitriev, R. I. Visualization of Stem Cell Niche by Fluorescence Lifetime Imaging Microscopy. Intestinal Stem Cells. , 65-97 (2020).
- Dmitriev, R. I., Intes, X., Barroso, M. M. Luminescence lifetime imaging of three-dimensional biological objects. Journal of Cell Science. 134 (9), 1-17 (2021).
- Yasukagawa, M., Yamada, K., Tobita, S., Yoshihara, T. Ratiometric oxygen probes with a cell-penetrating peptide for imaging oxygen levels in living cells. Journal of Photochemistry and Photobiology A: Chemistry. 383, 111983 (2019).
- Xie, B. -. R., et al. A near infrared ratiometric platform based π-extended porphyrin metal-organic framework for O2 imaging and cancer therapy. Biomaterials. 272, 120782 (2021).
- Düssmann, H., Perez-Alvarez, S., Anilkumar, U., Papkovsky, D. B., Prehn, J. H. Single-cell time-lapse imaging of intracellular O 2 in response to metabolic inhibition and mitochondrial cytochrome-c release. Cell Death & Disease. 8 (6), 2853 (2017).
- Roussakis, E., et al. Theranostic biocomposite scaffold membrane. Biomaterials. 212, 17-27 (2019).
- Kondrashina, A. V., et al. A phosphorescent nanoparticle-based probe for sensing and imaging of (intra) cellular oxygen in multiple detection modalities. Advanced Functional Materials. 22 (23), 4931-4939 (2012).
- Borisov, S. M., et al. Precipitation as a simple and versatile method for preparation of optical nanochemosensors. Talanta. 79 (5), 1322-1330 (2009).
- Borisov, S., Nuss, G., Klimant, I. Red light-excitable oxygen sensing materials based on platinum (II) and palladium (II) benzoporphyrins. Analytical Chemistry. 80 (24), 9435-9442 (2008).
- Strobl, M., Rappitsch, T., Borisov, S. M., Mayr, T., Klimant, I. NIR-emitting aza-BODIPY dyes-new building blocks for broad-range optical pH sensors. Analyst. 140 (21), 7150-7153 (2015).
- Tsytsarev, V., et al. In vivo imaging of brain metabolism activity using a phosphorescent oxygen-sensitive probe. Journal of Neuroscience Methods. 216 (2), 146-151 (2013).
- Fukuda, J., et al. Micromolding of photocrosslinkable chitosan hydrogel for spheroid microarray and co-cultures. Biomaterials. 27 (30), 5259-5267 (2006).
- Thomsen, A. R., et al. A deep conical agarose microwell array for adhesion independent three-dimensional cell culture and dynamic volume measurement. Lab on a Chip. 18 (1), 179-189 (2018).
- Gevaert, E., et al. High throughput micro-well generation of hepatocyte micro-aggregates for tissue engineering. PloS One. 9 (8), 105171 (2014).
- De Moor, L., et al. High-throughput fabrication of vascularized spheroids for bioprinting. Biofabrication. 10 (3), 035009 (2018).
- Rivron, N. C., et al. Tissue deformation spatially modulates VEGF signaling and angiogenesis. Proceedings of the National Academy of Sciences of the United States of America. 109 (18), 6886-6891 (2012).
- Nunes, P., Guido, D., Demaurex, N. Measuring phagosome pH by ratiometric fluorescence microscopy. Journal of Visualized Experiments:JoVE. (106), e53402 (2015).
- Billiet, T., Gevaert, E., De Schryver, T., Cornelissen, M., Dubruel, P. The 3D printing of gelatin methacrylamide cell-laden tissue-engineered constructs with high cell viability. Biomaterials. 35 (1), 49-62 (2014).
- Tytgat, L., Ovsianikov, A., Yoo, J., Mironov, V., et al. Photopolymerizable materials for cell encapsulation. 3D Printing and Biofabrication. , 353-396 (2018).
- Markovic, M., et al. Hybrid tissue engineering scaffolds by combination of three-dimensional printing and cell photoencapsulation. Journal of Nanotechnology in Engineering and Medicine. 6 (2), 0210011 (2015).
- De Moor, L., et al. Hybrid bioprinting of chondrogenically induced human mesenchymal stem cell spheroids. Frontiers in Bioengineering and Biotechnology. 8, 484 (2020).
- Zhdanov, A. V., Dmitriev, R. I., Hynes, J., Papkovsky, D. B. Kinetic analysis of local oxygenation and respiratory responses of mammalian cells using intracellular oxygen-sensitive probes and time-resolved fluorometry. Methods in Enzymology. 542, 183-207 (2014).
- Uribe-Etxebarria, V., Agliano, A., Unda, F., Ibarretxe, G. Wnt signaling reprograms metabolism in dental pulp stem cells. Journal of Cellular Physiology. 234 (8), 13068-13082 (2019).
- Vizán, P., et al. Characterization of the metabolic changes underlying growth factor angiogenic activation: identification of new potential therapeutic targets. Carcinogenesis. 30 (6), 946-952 (2009).
- Dmitriev, R. I., Papkovsky, D. B. Quenched-phosphorescence detection of molecular oxygen: applications in life sciences. Royal Society of Chemistry. , (2018).
- Perottoni, S., et al. Intracellular label-free detection of mesenchymal stem cell metabolism within a perivascular niche-on-a-chip. Lab on a Chip. 21 (7), 1395-1408 (2021).
- Okkelman, I. A., Neto, N., Papkovsky, D. B., Monaghan, M. G., Dmitriev, R. I. A deeper understanding of intestinal organoid metabolism revealed by combining fluorescence lifetime imaging microscopy (FLIM) and extracellular flux analyses. Redox Biology. 30, 101420 (2020).
- Mironov, V., et al. Organ printing: tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14 (127), 20160877 (2017).
- Dmitriev, R. I., et al. Imaging oxygen in neural cell and tissue models by means of anionic cell-permeable phosphorescent nanoparticles. Cellular and Molecular Life Sciences. 72 (2), 367-381 (2015).
- Jenkins, J., Borisov, S. M., Papkovsky, D. B., Dmitriev, R. I. Sulforhodamine nanothermometer for multiparametric fluorescence lifetime imaging microscopy. Analytical Chemistry. 88 (21), 10566-10572 (2016).
- Fercher, A., Borisov, S. M., Zhdanov, A. V., Klimant, I., Papkovsky, D. B. Intracellular O2 sensing probe based on cell-penetrating phosphorescent nanoparticles. ACS Nano. 5 (7), 5499-5508 (2011).
- Wagner, M., Karner, A., Gattringer, P., Buchegger, B., Hochreiner, A. A super low-cost bioprinter based on DVD-drive components and a raspberry pi as controller. Bioprinting. 23, 00142 (2021).
- Golub, A. S., Pittman, R. N. Monitoring parameters of Oxygen transport to cells in the microcirculation. Quenched-Phosphorescence Detection of Molecular Oxygen. , 193-204 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Huang, C., Becker, M. F., Keto, J. W., Kovar, D. Annealing of nanostructured silver films produced by supersonic deposition of nanoparticles. Journal of Applied Physics. 102 (5), 054308 (2007).
- Foster, K. A., Galeffi, F., Gerich, F. J., Turner, D. A., Müller, M. Optical and pharmacological tools to investigate the role of mitochondria during oxidative stress and neurodegeneration. Progress in Neurobiology. 79 (3), 136-171 (2006).
- Schmidt, C. A., Fisher-Wellman, K. H., Neufer, P. D. From OCR and ECAR to energy: perspectives on the design and interpretation of bioenergetics studies. The Journal of Biological Chemistry. 297 (4), 101140 (2021).
- Stelzer, E. H., Lindek, S. Fundamental reduction of the observation volume in far-field light microscopy by detection orthogonal to the illumination axis: confocal theta microscopy. Optics Communications. 111 (5-6), 536-547 (1994).
- Pitrone, P. G., et al. OpenSPIM: an open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Legant, W. R., et al. High-density three-dimensional localization microscopy across large volumes. Nature Methods. 13 (4), 359-365 (2016).
- von Chamier, L., et al. Democratising deep learning for microscopy with ZeroCostDL4Mic. Nature Communications. 12 (1), 1-18 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten