Method Article
다세포 구상체의 저렴한 산소 현미경 보조 생물 제조
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 표준 형광 현미경 상에서 그들의 산소화 및 세포 사멸에 대한 다중 파라메트릭 분석을 사용하여 바이오프린팅을 위한 고처리량 스페로이드 생성을 기술한다. 이러한 접근법은 구상체 생존력을 제어하고 표준화를 수행하기 위해 적용될 수 있으며, 이는 3D 조직, 종양 미세환경 및 성공적인 (마이크로)조직 생물제작을 모델링하는데 중요하다.
초록
다세포 구상체는 3D로 조직 및 암 생리학을 연구하는 데 중요한 도구이며 조직 공학에서 생물 제조를위한 조직 조립 단위로 자주 사용됩니다. 스페로이드 모델의 주요 힘은 조직 마이크로 스케일에서 물리화학적 구배를 모방하는 것이지만, 구상체 내부의 실제 생리 환경 (대사 활성, 산소화, 세포 사멸 및 증식의 역학 포함)은 일반적으로 무시됩니다. 동시에, 생성된 스페로이드 표현형에 대한 성장 배지 조성물 및 형성 방법의 효과는 잘 문서화되어 있다. 따라서, 스페로이드 표현형의 특성화 및 표준화는 연구 결과의 재현성 및 투명성을 보장하기 위해 요구된다. 3차원(3D)에서의 평균 스페로이드 산소화 및O2 구배의 값의 분석은 스페로이드 표현형 특성화를 위한 간단하고 보편적인 방법이 될 수 있으며, 이들의 대사 활성, 전반적인 생존력 및 생체내 조직 미세환경을 재편성할 수 있는 잠재력을 지적한다. 3D 산소화의 시각화는 추가적인 생리학적 파라미터(예: 세포 사멸, 증식 및 세포 조성)에 대한 다모수 분석과 쉽게 결합될 수 있으며 연속 산소화 모니터링 및/또는 종점 측정에 적용될 수 있습니다. O2 프로브의 로딩은 스페로이드 형성 단계 동안 수행되며 스페로이드 생성의 다양한 프로토콜과 호환됩니다. 이 프로토콜은 도입된 적색 및 근적외선 방출 비율계량 형광O2 나노센서를 사용한 스페로이드 생성의 고처리량 방법 및 바이오프린팅 전후의 스페로이드 산소화 및 세포 사멸의 다중 파라미터 평가에 대한 설명을 포함한다. 실험예는 호모- 및 헤테로세포 구상체 뿐만 아니라 구상-기반 생체인쇄 작제물에서의 비교O2 구배 분석을 보여준다. 이 프로토콜은 광원으로서 다중 형광 필터 및 발광 다이오드를 갖는 종래의 형광 현미경과 호환된다.
서문
분자 산소(O2)는 세포 및 조직의 생존력, 기능 및 사멸을 조절하는 주요 대사산물 중 하나이다. 생리학적 조건 하에서, 국소 조직 산소화는 조직 혈관화, 혈류 및 세포 대사에 의해 동적으로 조절되며, 일부 경우에는O2 구배, 저산소 미세환경, 및/또는 산화 스트레스(1,2)의 형성을 유도한다. 세포는 신호전달 기능에서 분자 O2의 직접적인 관여를 통해O2 구배를 감지하고(저산소증-유도성 인자(HIF)-매개 신호전달, 히스톤 리신 데메틸라제 KDM 및 다른 수단을 통해), 세포 산화환원 전위의 변화(Nrf2/Keap1 신호전달 또는 철-조절 단백질을 통한 반응성O2 종 감지), 후속적으로 이들의 대사, 증식을 조절할 수 있고, 효능 및 분화3. 따라서, 세포 및 조직 산소화의 이질성, 그의 구배, 및 관련 현상은 조직 발달 및 항상성에 중요한 선수이다. 상이한 조직 및 세포 유형은 종종 상이한 '정상적인' 생리학적 O2 수준을 필요로 하며, 이는 조직O2 미세구배4에 따라 위치된 세포를 갖는 특별한 조직 구조를 정의한다. 일부 세포 유형은 O2 감소(예를 들어, 뉴런, 간세포, 췌장섬 세포, 또는 근육 세포)5,6에 민감하고, 다른 것들은 극심한 저산소증을 견디고 가파른O2 구배를 형성할 수 있다(예를 들어, 장 및 결장 상피에서)7. 조직 생명 공학 및 생물 제조의 진행과 함께, 미세 응집체 및 스페로이드 3D 조직 구축물에서O2 정량화의 필요성이 중요해진다. 우려 중 하나는 스페로이드 생성 및 배양 조건의 방법에 의존하는 다세포 스페로이드 모델 생리학적 파라미터의 표준화이다8. 또한, 기능적 혈관화가 결여된 미세조직에서의 O2 방출 생체물질 또는O2 관류의 제어되지 않은 적용은 세포에 독성이 될 수 있고, 그들의 대사의 리프로그래밍을 유도하고, 이식 후 기간 9,10에서 생존을 감소시킬 수 있다. 생리학적으로 관련된 미세응집체의 효율적인 배양에 도달하기 위한O2 측정 접근법 및 산소화 환경의 최적화의 신뢰성은 최근 실시예11로서 사용된 만능 줄기 세포 유래 간 구상체의 수학적 모델링에 의해 입증되었다. 조직 O2 수준에 대한 지식이 인식되는 또 다른 분야는 암 치료12,13이다. 이질적인 종양 저산소증은 성공적인 항암 요법을 손상시킬 수 있습니다. 환자 치료 또는 종양 저산소증 모델링 동안 정확한 산소화 수준을 측정하고 제어하는 것은 개인적이고 개인화된 치료 전략(14)의 개선을 허용할 것이다. 따라서, 생체 조작된 구축물 및 3D 종양 모델에서의 동적 산소화의 정량적 모니터링은 그들의 호흡 활성, 대사 및 조직 배양, 제조 조건, 또는 저산소증 매개 치료 반응의 기본 연구의 최적화의 생리학적 분석을 위한 중요한 도구이다.
다수의 방법은 스페로이드 및 미세응집체 조직 구축물에서 세포 산소화의 다중화된(또는 다중 파라미터) 분석을 가능하게 한다. 신경구 및 종양 구상체15,16,17로 개척된 인광 수명 이미징 현미경(PLIM) 기반 접근 방식은 살아있는 미세조직에서 세포 산소화를 직접 정량화하고 기능적 세포 유형의 세포 생존력, 증식 또는 분포와의 상관관계를 확립할 수 있게 합니다. 이 접근법의 힘에도 불구하고, PLIM 현미경 업그레이드는 여전히 널리 사용되는 현미경 공급 업체(18,19) 사이에서도 널리 제공되지 않습니다. 다행스럽게도, 다수의 세포-침투O2-감응성 나노입자 프로브가 형광 강도-기반 비율계량 측정 모드 15,17,20,21,22,23,24에 대해서도 사용될 수 있다. 전형적으로, 프로브는 2개의 방출 파장, 즉,O2-감응성 및 비감응성(reference)을 디스플레이할 것이고, 이는 형광 현미경, 고함량 스크리닝 이미저, 또는 마이크로플레이트 판독기 상에서 측정될 수 있다. 이러한 O2 감지 나노입자는 가시광선 및 근적외선 스펙트럼에 걸친 생체적합성 고분자,O2 감지, 및 기준 염료를 이용한 침전 기술에 의해 제조될 수 있거나, 또는 이들은 상업적으로 구입될 수 있다 2,25. 두꺼운 3D 미세조직의 분석이 적색 편이 형광 염료의 사용으로부터 이익을 얻을 것이기 때문에, 비측정계O2-감지 나노입자 프로브는O2-센싱 PtTPTBPF 26 및 기준 아자-BODIPY27 염료로 구성된 멀티모달 적외선 넘버 1(MMIR1), 양전하를 띤 폴리메타크릴레이트계 공중합체(28)에 함침되어 구성되었다. 이 설계에 의해,O2 민감성 신호(근적외선, 여기(exc.) = 635nm, 방출(em.) = 760nm; Isens)는 인광 담금질 과정을 통한 [O2] 농도에 의해 영향을 받는 반면, 적색 기준 염료 강도(exc. = 580 nm, em. = 650 nm; Iref)는 영향을 받지 않은 상태로 남아 있습니다(그림 1A). 따라서, 염색된 세포에서 Iref/I센스 비(R)는 O2 교정(22)을 가능하게 할 수 있다.
여기에서는 구상체 및 생체 인쇄 된 구조에서 살아있는 세포 산소화를 모니터링하기위한 반 정량적 접근법을 설명하여 종점 및 운동 측정에서O2 구배를 추정하는 데 도움을줍니다. 이러한 O2 이미징은 다른 유형의 비율계량O2 프로브(그림 1B)와 함께 수행할 수 있으며, 사용 가능한 광원 및 형광 필터의 수에 따라 다른 염료와 함께 사용하여 생/사형 세포, 미토콘드리아 기능 및 다른 세포 유형 추적에 대한 정보를 얻을 수 있습니다. 형광 수명 이미징 현미경(FLIM)과 같은 고급 측정 모드도 사용할 수 있습니다(19). 세포 염색 염료 및O2 민감성 나노입자의 사용으로 인한 가장 큰 과제는 염색 프로토콜의 최적화이다. MMIR1 프로브 및 관련 나노입자의 경우, 세포는 스페로이드 형성 과정 동안 사전 염색되거나 공동-인큐베이션된다. 기술된 프로토콜에서, O2 프로브-염색된 구상체는 저부착성 아가로스 표면 29,30,31,32 (도 1C) 상에서 생성되었고, 이는 후속 구상-기반 바이오프린팅 및O2 및 세포 사멸의 다중 파라미터 분석을 가능하게 한다. 접근법의 적용성을 예시하기 위해, 호모- 또는 헤테로세포(인간 탯줄 정맥 내피 세포, HUVEC의 첨가와 함께 형성됨) 인간 치과용 펄프 줄기 세포(hDPSC) 스페로이드에서의 산소화 수준을 종래의 형광 현미경을 사용하여 바이오프린팅 전과 후에 비교하였다.
프로토콜
1.O2 민감성 프로브가 통합된 구상체의 높은 처리량 생성
- 마이크로 패터닝된 아가로스 코팅 조직 배양 플레이트 준비
참고: 마이크로 패턴화된 아가로스 코팅 조직 배양 플레이트는 바이오프린팅 및 기타 용도를 위해 많은 수의 구상체(PDMS 스탬프당 1585개, 재료 표 참조)를 동시에 생성하는 데 사용되며, 여러 실험 반복실험 반복실험 또는 큰 스페로이드 수가 필요합니다.- 가능한 경우 오토클레이빙 또는 필터 멸균으로 모든 멸균 재료 및 기구(스파툴라 및 핀셋)를 준비합니다. 재활용 가능한 PDMS 스탬프(33 )를 아가로스로부터 청소하고 70% 에탄올에 무균적으로 보관한다. 스페로이드 생성 최소 1 일 전에이 작업을 수행하십시오.
- 마이크로 패턴화된 PDMS 스탬프를 저장 바이알에서 멸균 페트리 접시로 옮기고 멸균된 층류 기류 조건 하에서 매끄러운 표면을 10분 동안 위로 공기 건조시킨다.
- 마이크로 패터닝된 표면을 가진 각 스탬프를 12-웰 멸균 조직 배양 플레이트의 웰의 중앙에 위(및 매끄러운 표면 아래로)에 놓는다. 뚜껑을 열어 1-2 분 동안 공기 건조하십시오.
참고 : 건조한 우표 만 플라스틱 표면에 완벽하게 달라 붙고 절차 중에 부착 된 상태로 유지되므로 과도한 액체를 증발시키는 것이 매우 중요합니다. - 아가로스 1.5g을 깨끗한 200mL 유리병에 넣고 멸균증류수 50mL를 넣고 뚜껑으로 덮은 다음 전자레인지에서 녹여 50mL의 3% 균질 아가로스 용액을 만든다.
주의: 아가로스 용액은 매우 뜨겁기 때문에 조심스럽게 다루어야 합니다. 용융 절차 직후에 흔들리면 뜨거운 아가로스 용액이 버블 링을 시작하고 용기 밖으로 파열 될 수 있습니다. 간헐적 인 외상을 피하려면 아가로스 용액으로 부피의 최대 50 %로 채워진 충분히 큰 용기를 사용하십시오. - 멸균 혈청학적 피펫을 사용하여 즉시 12-웰 세포 배양 플레이트의 각 웰에 고온 아가로스 용액 ∼2 mL를 첨가하여 삽입된 PDMS 스탬프를 완전히 덮는다. 플레이트 뚜껑이 열린 상태에서 멸균 공기 흐름 하에서 인큐베이션함으로써 20분 동안 응고되도록 아가로스를 방치한다.
참고: 아가로스 층은 PDMS 스탬프 제거 후 아가로스 마이크로웰의 무결성을 보장하기 위해 PDMS 스탬프보다 적어도 두 배 더 두꺼워야 합니다(그림 1C). - 멸균된 작은 주걱을 사용하여, 매립된 PDMS 스탬프가 있는 아가로스를 각 웰에서 거꾸로 정확하게 돌려 매끄러운 스탬프 표면을 위로 향하게 한다. 스탬프의 부드러운 윗면에 ~ 200 μL의 멸균수를 넣고 주걱으로 아가로오스에서 부드럽게 분리한 다음 웰에서 제거하십시오. 마이크로웰을 손상시키지 마십시오.
- 직접 사용을 위해 상응하는 멸균 세포 배양 배지 1 mL를 아가로스 스탬프에 첨가한다. 플레이트를 뚜껑으로 덮고 4°C에서 밤새 인큐베이션한다. 장기간 보관(4°C에서 최대 2주)을 위해 PBS 용액(중간 대신)을 사용하십시오. 아가로스를 말리지 마십시오. 사용 전에, 아가로스 마이크로패터닝된 플레이트를CO2 인큐베이터에서 37°C에서 1시간 동안 가온한다.
참고 : 인큐베이션은 아가로스 마이크로 웰에서 기포를 평형화하고 제거하기 위해 필요합니다. 프로토콜 단계 1.2로 진행하십시오.
- O 준비2 프로브가 탑재된 구상체
- hDPSC 및 HUVEC 세포주의 배양을 위해 각각 10% 태아 소 혈청(FBS) 및 성장 인자가 보충된 내피 세포 성장 배지 2로 보충된 α-최소 필수 배지(MEM)를 사용하십시오. HUVEC 및 hDPSC 성장 배지를 1:1 비율로 첨가하여 hDPSC/HUVEC 헤테로세포 스페로이드 성장 배지를 제조하였다.
- 70 % -90 % 합류 세포 배양 (~ 3-4 일 준비)을 준비하십시오. 이종세포 구상체의 생성을 위해, hDPSC 및 HUVEC 배양물을 각각 준비한다.
참고: HUVEC 및 hDPSC의 통과 번호는 8을 초과할 수 없습니다. 세포 배양물의 급속한 성장을 보장하기 위해 항상 3 내지 4 일마다 새로운 플라스크를 사용하여 전체 세포 배양물의 1/3 (70 % -80 % 컨플루언시에서)으로 분할합니다. - 70%-90% 컨플루언트 세포 배양물을 예열된(37°C) PBS(75cm2 플라스크 당 10 mL)로 헹구었다. 해리 효소 용액 (0.05% 트립신 및 1 mM EDTA; 75 cm2 플라스크 당 1 mL)을 첨가하고, 세포 박리를 위해 5%CO2, 95% 습도에서 37°C에서 3-5분 동안 인큐베이션하고, 현미경으로 세포 분리를 확인하였다. 완료되면 트립신을 10% FBS(해리 용액 1mL당 배지 5mL)를 함유하는 완전한 세포 배양 배지로 중화시킨다.
참고 : 해리 효소 용액에 대한 세포의 과다 노출을 방지하십시오.이 효소는 생존력에 영향을 줄 수 있습니다. - 낮은 FBS 배지에서 배양된 HUVEC의 경우, 트립신 처리된 세포 배양물에 0.5 mL의 100% FBS를 첨가하여 트립신 중화를 수행하고, 그 후 원심분리하여 세포를 그들의 성장 배지로 옮긴다.
참고 : 얻은 세포 현탁액은 1 mL 당 ~ 1 백만 개의 세포를 포함해야합니다. 필요한 경우, 추가의 원심분리 단계가 세포 현탁액을 농축하기 위해 프로토콜에 추가될 수 있다. - 세포 응집체를 10 mL 혈청학적 피펫의 상부에 있는 1000 μL 피펫 팁을 사용하여 피펫팅하여 해리시켜 단일 세포 현탁액을 얻었다. 카운팅 챔버(노이바우어형 혈구계 또는 대안)를 사용하여 세포 현탁액(34)의 1 mL당 세포 수를 계수한다. 세포 현탁액을 mL 당 500,000 세포로 희석한다. 1:1 스페로이드 비율의 이종세포 hDPSC/HUVEC의 경우, 동일한 부피의 상응하는 세포 현탁액을 첨가하여 mL당 500,000 세포의 최종 세포 농도를 갖는다.
참고: 마이크로 패턴화된 아가로스 스탬프에 첨가된 현탁액에서의 세포 농도의 변화는 생성된 구상체의 평균 크기를 변경할 수 있게 하며, 이는 아가로스 스탬프의 마이크로웰당 세포 수에 의존한다. 기술된 셋업에서, ∼300 세포의 구상체는 1585개의 마이크로웰을 갖는 아가로스 스탬프 상에 500,000개의 세포를 함유하는 1 mL로부터 생성된다. - 농축된 O2 프로브(나노입자, 1mg/mL 스톡) 용액을 준비된 세포 현탁액에 최종 농도 5μg/mL로 첨가합니다.
참고:O2 감지 나노입자의 존재 하에서의 스페로이드 형성은 효율적인 염색을 제공하며, 이는 최소 5일 동안 보존된다(그림 1D). 대조적으로, 미리 형성된 다세포 구상체를 나노입자로 염색하는 것은 덜 효율적일 것이다(15). - 1 mL의 오래된 배지를 12-웰 아가로스 코팅된 세포 배양 플레이트 (단계 1.1.7 참조)의 마이크로패터닝된 웰에서 1 mL의 준비된 세포 현탁액 (1 mL 당 500,000 세포, 5 μg/mLO2 프로브 포함)에 교환한다. 구상체를O2 프로브의 연속 존재 하에 2-5일 동안CO2 인큐베이터에서 배양하여 스페로이드 형성 및 압축 동안 그의 로딩을 보장한다.
참고: 스페로이드 배양에서 과도한 배지 증발을 피하십시오. 필요한 경우, 조심스럽게 (마이크로웰에서 구상체를 교란시키지 마십시오) 추가적인 O2 프로브 희석액과 함께 0.2-0.5 mL의 배양 배지를 첨가하십시오. - 스페로이드 형성 후, 성장 배지를 프로브가없는 신선한 것으로 교환하십시오. 프로브 염색은 생성 된 구상체에서 7-14 일 이상 보존되어 구상체에서 신호를 장기간 모니터링 할 수 있습니다.
2. 구상체 바이오 프린팅
참고: 스페로이드는 메타크릴아미드 개질 젤라틴(GelMA) 기반 바이오잉크로 생체인쇄됩니다. 아래는 바이오잉크 성분, 바이오잉크 준비 절차 및 바이오프린팅에 대한 설명이다.
- 바이오잉크 준비
- 층류 35 하에서 배지에 10%(w/v) GelMA 용액(2 mL)을 다음과 같이 준비한다: 15 mL 튜브에서 78의 치환도를 갖는 멸균 GelMA 0.2 g을 칭량하고, α-MEM 1.9 mL를 첨가하고,37 °C(∼2 h)의 회전식 진탕기에서 혼합하여 용해시킨다.
참고: 구상체 및 광개시제 Li-TPO-L과 같은 다른 화합물이 나중에 첨가될 것이므로 배지 전체를 첨가하지 마십시오. - 피펫팅을 통해 미세패턴화된 웰에 구상체를 재현탁하고 15mL 튜브에 수집합니다. PBS로 추가 헹굼을 수행하여 모든 구상체가 아가로스 마이크로웰로부터 수집되도록 한다. 아가로스 미세 웰을 만지거나 손상시키지 마십시오.아가로스 조각은 바이오 프린팅 중에 바늘을 막을 수 있습니다.
- 20°C에서 5 분 동안 300 x g의 15 mL 튜브에서 원심분리하여 구상체를 수집한다. 피펫으로 상층액을 흡인하고, 50μL의 배지를 구상체에 첨가하고, 부드러운 피펫팅으로 재현탁시킨다.
- 따뜻한 GelMA 용액에 스페로이드 혼합물을 추가하고 부드러운 피펫팅으로 혼합하십시오. 스페로이드 농도를 바이오 프린팅용 바이오잉크 mL당 6340-12860 구상체(4-8 마이크로패턴에서)로 유지하십시오. 구상체의 농도가 높을수록 인쇄 바늘이 쉽게 막히지 않도록하십시오.
- 필터 멸균된 광개시제 Li-TPO-L 원액(32 mg/mL)을 이중 결합의 수에 대하여 최종 농도 2 몰%에 첨가하고 부드러운 피펫팅36,37로 혼합한다.
참고: Li-TPO-L의 양은 방정식에 따라 계산할 수 있습니다.
광개시제의 부피 (PI) = (0.000385 mol NH2-기/g의 GelMA x 294.10 g Li-TPO-L/mol x 0.78 x 0.02) / 0.032 g Li-TPO-L/mL x 0.2 g GelMA = 0.0107 mL Li-TPO-L 스톡
- 층류 35 하에서 배지에 10%(w/v) GelMA 용액(2 mL)을 다음과 같이 준비한다: 15 mL 튜브에서 78의 치환도를 갖는 멸균 GelMA 0.2 g을 칭량하고, α-MEM 1.9 mL를 첨가하고,37 °C(∼2 h)의 회전식 진탕기에서 혼합하여 용해시킨다.
- 바이오 프린팅 절차
- CAD에서 스캐폴드 설계에 대한 보충 프로토콜 1 의 단계를 참조하십시오. 디자인을 바이오 프린트하려면 아래 단계를 따르십시오.
- 팁 캡 (루어 잠금)으로 멸균 3cc 카트리지의 끝을 닫고 피펫팅으로 바이오 잉크로 채 웁니다. 카트리지에 플런저를 삽입합니다. 카트리지를 거꾸로 잡고 팁 캡을 분리한 다음 카트리지의 모든 공기가 제거될 때까지 플런저를 바이오잉크 쪽으로 밀어 넣습니다.
참고: GelMA 바이오잉크와 카트리지의 측면 사이의 접촉은 바이오잉크의 겔화로 인한 플런저의 이동을 억제할 수 있으므로 피하십시오. - 바이오잉크를 바이오프린터의 가열맨틀에서 23°C(20-30분)로 냉각시킨다. 카트리지 상단의 압력 어댑터에 끼워 넣습니다. 바이오 잉크가 새지 않도록 입구 튜브의 클립을 닫고 카트리지에 22G 원뿔형 PE 바늘을 장착하십시오. 바늘 크기와 직경을 스캐폴드 디자인과 스페로이드 직경 및 농도에 맞게 조정하십시오.
참고: 오염을 방지하기 위해 입 마스크와 스프레이 장갑을 착용하십시오. - 바이오 프린터에 70 % 에탄올을 뿌리고 흡수 종이로 닦으십시오. 카트리지를 압출 기반 프린트 헤드의 가열 맨틀에 설치합니다. 압력 입구를 연결하고 입구의 클립을 엽니다. 설계의 G 코드 파일을 인쇄 소프트웨어에 로드합니다.
- 바늘 길이 측정을 시작합니다. 멸균 된 Petri 접시에 약간의 바이오 잉크를 분배하여 인쇄 압력을 조절하십시오. 0.025-0.045 MPa의 인쇄 압력은 GelMA 기반 바이오 잉크38 인쇄에 일반적입니다.
- 6웰 플레이트를 설치하고, 웰 플레이트를 열고, 후드를 닫고, 인쇄를 시작합니다. 인쇄 후, 스캐폴드를 5°C에서 10분 동안 물리적으로 가교시키고, 인쇄된 스캐폴드를 UV LED 램프(제조사에 따라 365 nm; 500 mW)로 60초 동안 조사한다.
참고: UV 가교 시간은 UV 광의 특성, 광개시제 유형 및 농도, 원하는 스캐폴드 가교 정도, 팽윤도 및 탄성 계수에 따라 달라집니다. - 페니실린 100 U/mL와 스트렙토마이신 100 μg/mL(P/S)를 함유하는 상응하는 성장 배지를 바이오프린트된 격자(6-웰 세포 배양 플레이트의 웰당 2 mL)가 있는 모든 웰에 즉시 첨가한다.
- 현미경 검사를 시작할 때까지 37°CCO2 배양기에서 배양한다. 생체 인쇄 된 구조 현미경의 경우 인쇄 된 와플 그리드를 현미경 접시로 옮기고 이미징 매체로 덮은 다음 3.2 및 3.3 단계를 진행하십시오.
참고 : 부유 한 생체 인쇄 된 구조물의 경우, 세포 생존력에 영향을 미치지 않고 현미경 접시에 고정해야합니다 (예 : 세포 적합성 접착제). 반전 현미경 전달을 위해, 바이오프린트를 현미경 유리 바닥 접시에 넣고 샘플의 바람직하지 않은 부유를 피하기 위해 이미징 매체 (∼200-500 μL, 이미징 미디어 조성에 대한 단계 3.1 참고 사항 참조)로 덮는다. 추가적인 형광 프로브를 사용한 염색은 생체인쇄 구축물을 현미경 접시로 옮기기 전에 세포 배양 접시에서 수행할 수 있다(단계 3.1.6 참조).
3. 생체 제작 된 조직에서 스페로이드 산소화의 비율 측정 형광 살아있는 현미경 검사
참고:O2 프로브의 비율계량 강도 반응(R)을 실제 저산소증 수준으로 변환하기 위해, 프로브 반응은24에 설명된 절차를 사용하여 교정되어야 한다. 그러나 비율계량 보정은 계측기에 따라 다르며 T/O2/CO2 제어 인큐베이터(항상 사용 가능한 것은 아님)를 설치해야 하므로 반정량적 비율 검출을 사용하는 것이 바람직한 옵션입니다.
- 라이브 이미징 분석을 위한 구상체 준비
- 이 단계 동안의 스페로이드 부착을 위해, 멸균 현미경 접시를 콜라겐 IV 및/또는 폴리-D-라이신으로 미리 코팅하거나 시판되는 것들(39)을 사용한다. 현미경 접시와 작동 거리 및 현미경 목적의 다른 특성과의 호환성을 확인하십시오.
참고: 다중 파라미터 이미징의 경우, 증발, 삼투압 쇼크 또는 기타 스트레스로부터 세포를 보호하는 충분한 양의 배지를 사용하여 배양 플레이트 접시에서 모든 추가 염색 절차를 수행해야 합니다. 사용 전에 준비 및 예온 이미징 배지: 페놀 레드 없이 중탄산나트륨(1.2 g/L), HEPES-Na, pH 7.2(10 mM), 피루베이트 나트륨(1 mM), L-글루타민(2 mM) 및 글루코스(5 mM)로 보충된 DMEM. - 1 mL 피펫을 사용하여,O2-프로브 사전 염색된 구상체를 아가로스 마이크로웰로부터 부드럽게 세척한다. 구상체가 여전히 매체에 떠있는 동안 15mL 원뿔형 바닥 튜브로 옮깁니다.
- 마이크로패턴화된 웰로부터 모든 구상체를 수집하려면 웰을 추가 1 mL의 배양 배지로 1 내지 3회 헹구고 모든 스페로이드 현탁액을 하나의 바이알에 결합시킨다. 바이알을 최대 10분 동안 수직 위치에 두어 구상체가 바이알의 바닥에 정착하여 가시적인 펠릿을 형성하게 한다.
- 조심스럽게 튜브에서 매체를 제거하여 구상체를 방해받지 않도록하십시오. 현미경 샘플 접시 당 적어도 20 개의 구상체에 충분할 신선한 배양 배지의 양으로 부드럽게 재현탁하십시오. 이것은 배양 배지의 사용을 최소화하고 이미징 중에 구상체를 찾는 것을 단순화 할 것입니다.
참고: 커버 글래스에 부착된 μ-챔버 12웰 플레이트( 재료 표 참조)의 오토클레이브 가능한 실리콘 부분을 웰당 최대 매체 부피가 300μL인 현미경 샘플 접시(24 x 60mm, 두께 #1)로 사용하십시오. 이 배양 챔버의 실리콘 부분은 접시에 부착 될 때 멸균되고 다른 플라스틱 및 유리 표면과 함께 재사용 될 수 있습니다. - 즉시 각 현미경 접시 / 우물에 동일한 부피의 스페로이드 현탁액을 추가하십시오. 구상체를CO2 인큐베이터에서 37°C에서 1시간 동안 방치하여 현미경 접시의 표면에 부착한다. 다른 염료의 사용과 결합된 산소화 분석을 위해 단계 3.1.6으로 진행한다. 간단한 산소화 분석을 위해 3.1.7 단계로 진행하십시오.
참고 : 불충분 한 배양 시간 (<1 시간)은 미디어 교환 중에 때때로 스페로이드 제거 및 손실을 초래할 수 있으며 실험을 중단 할 수 있습니다. 동시에, 과다 인큐베이션 (>3 h)은 구상체에서 현미경 접시 표면으로의 세포 이동으로 인해 3D 조직의 부분적 또는 완전한 손실을 초래할 수 있으며 실시간 산소화에 영향을 줄 수 있습니다. - (선택 사항) 배지를 염색 농도로 희석된 형광 프로브(들)를 함유하는 배지와 조심스럽게 교환하고, 최적의 강도에 도달하기 위해 추가로 1시간 동안 인큐베이션을 계속한다. 미디어 교환 중에 구상체가 제거되지 않도록하려면 현미경 접시의 가장자리에서 200 μL 피펫으로 배지를 조심스럽게 흡인하고 현미경 접시에서 배지 첨가를 옆으로 수행하십시오. 3.1.7단계로 진행하십시오.
참고: 다세포 응집체에서 확산이 불량한 프로브를 사용한 효율적인 염색을 위해서는 로딩 농도 및/또는 시간을 연장하십시오. 사용하기 전에, 예비 실험에서 선택적인 프로브 로딩 파라미터를 결정하십시오. - 현미경 접시에서 배지를 제거하고 이미징 미디어로 한 번 헹구십시오. 정확한 양의 이미징 배지를 샘플에 첨가한다 (예를 들어, 12-웰 배양 플레이트의 마이크로웰 당 300 μL의 μ-챔버). 3.2단계로 진행하십시오.
- 이 단계 동안의 스페로이드 부착을 위해, 멸균 현미경 접시를 콜라겐 IV 및/또는 폴리-D-라이신으로 미리 코팅하거나 시판되는 것들(39)을 사용한다. 현미경 접시와 작동 거리 및 현미경 목적의 다른 특성과의 호환성을 확인하십시오.
- 이미지 수집
- 현미경 및 연결된 장치(즉, 여기 광원, 카메라, 컴퓨터, 인큐베이터 및 기타 작동 전자 블록)를 켠 후 30분 전에 예열하고 측정 조건(필요한 경우 온도,O2의 다른 값, 5%CO2, 습도)에 평형화됩니다. 정확한 현미경 설정과 함께 제공된 현미경 검사 운영 소프트웨어를 시작하십시오.
참고: 설명된 프로토콜은 CellSens Dimension 소프트웨어 v.3에 맞게 조정되었습니다. - 적절한 여기(소스, 전력) 및 방출 필터와 선택한 형광(또는 인광) 프로브의 노출 시간을 선택합니다. 다중 파라미터, 3D 및 타임랩스 현미경 분석의 경우 운영 현미경 소프트웨어에 자동화된 측정 시퀀스 프로토콜을 작성하십시오.
- 예비 실험에서 각 프로브, 실험 모델 및 세포주에 대한 최적의 이미징 설정을 경험적으로 결정합니다. 설정이 기준(I ref) 및O2 감지(I sens) 채널에서 최소한의 광표백을 가지며 특히 3D 및 타임랩스 측정 실험에서 강도비(R = Iref/Isens)에 미치는 영향이 최소화되는지 확인하십시오.
- 현미경 검사 단계에서 얼룩진 구상체로 현미경 접시를 설치하십시오. 낮은 배율 목표를 사용하여 투과광에서 샘플을 미리보고 구상체에 초점을 맞추고 이미지의 중앙에 배치하십시오.
참고: 표준 4x ~ 10x 배율 공기 목표는 사전 초점 조정에 충분하지만, 실제 측정의 경우 0.6 이상의 수치 조리개(NA)(공기 또는 침수) 목표치로 접시에 부착된 구상체에 대한 충분한 작동 거리가 있는 경우 20x ~ 40x를 권장합니다. - 필요한 높은 배율로 목표를 작업 위치로 가져 오십시오. 구상체의 중간(적도) 단면의 투과광 모드에 초점을 맞춥니다. 3D 물체의 산소화는 이미징 섹션의 깊이에 직접적으로 의존합니다. 이를 보장하기 위해, 그룹 안팎의 유사한 횡단면, 예를 들어, 구상체의 중간 및 상단/하단 단면을 분석한다.
참고:O2 그라디언트의 상세하고 정밀한 분석 및 재구성을 위해서는 공초점, 라이트 시트 또는 2광자(최상의 옵션) 현미경을 사용하여 Z-스택을 스캔하고 제작하는 것이 좋습니다. 모든 단면으로부터의 신호가 동시에 수집되는 종래의 와이드필드 현미경의 경우,O2 구배의 정확한 분석보다는 중간 단면에 의한 평균 추정이 수행될 수 있다. 이 경우 중간 횡단면은 초점 섹션으로 정의되며, 구상체는 경계에 날카로운 초점으로 최대 직경을 갖습니다. - O2 프로브 및 다중 모수 이미징에 적용되는 다른 형광 프로브의 참조 및 민감한 스펙트럼 채널의 형광/인광 신호 수집에 대한 설정을 조정합니다.
- 정량적 강도 기반 비교를 위해 그룹의 모든 측정 대상에 대해 노출 시간, 여기 광원 전력, 해상도, 스캔 속도 및 핀홀 크기에 대해 선택한 것과 동일한 이미징 설정을 적용합니다.
참고: 많은 공급업체에서 제공하는 현미경 소프트웨어 버전에서는 강도비를 자동으로 계산할 수 있습니다. O2 프로브의 기준 및 민감 채널의 강도 측정에 함수 병합을 적용하고, 여기에 사용된 이미징 소프트웨어에서 실험 관리자에 이미징 획득 프로그램을 작성할 때 적용한다. - O2 프로브의 참조 및 민감한 스펙트럼 채널에 대해 동일한 광학 섹션으로부터 이미지를 수집하고, 필요한 경우 추가적인 형광 채널을 수집한다. 이 프로토콜의 경우 적색 기준(제외 = 580 nm, em. = 650 nm) 및 근적외선O2 민감도(exc. = 635 nm, em. = 760 nm) 스펙트럼이 있는 MMIR1 프로브를 사용하십시오.
- 3.2.5-3.2.8단계를 반복하여 통계 분석을 위한 충분한 수의 데이터 요소를 수집합니다. 상이한 약물, 미토콘드리아 언커플러 또는 전자 수송 사슬 및 다른 속효성 화합물의 억제제로 치료시 빠르게 진화하는 세포 반응의 동적 분석을 위해, 타임랩스 측정 모드를 이용한다(단계 3.2.10).
- 샘플의 주기적 조명으로 37°C에서 이미징 매체에서 측정을 수행하고, 관심있는 형광단의 신호들(예를 들어,O2 프로브 기준 및 감지 채널들)을 수집하고, 예를 들어, 매 10초마다 2분 이상 동안 수집한다.
- 주기적 측정이 완료되면 모든 스페로이드에 대해 초점 검사를 수행하여 이미징 중에 초점 드리프트가 없는지 확인합니다. 필요한 경우 반복하십시오. 데이터 분석을 위해 3.3단계로 진행하십시오.
참고: 세포 자극 및 약물 첨가 없이, 시간 경과 측정은 기준 염료, 예를 들어, 플루오레세인, 칼세인 그린 AM 또는 테트라메틸로다민 메틸 에스테르와 비교하여 광안정성을 평가하기 위해 수행될 수 있다.
- 현미경 및 연결된 장치(즉, 여기 광원, 카메라, 컴퓨터, 인큐베이터 및 기타 작동 전자 블록)를 켠 후 30분 전에 예열하고 측정 조건(필요한 경우 온도,O2의 다른 값, 5%CO2, 습도)에 평형화됩니다. 정확한 현미경 설정과 함께 제공된 현미경 검사 운영 소프트웨어를 시작하십시오.
- 이미지 프리젠 테이션
참고: 여기서는 O를 자동으로 계산하는 방법을 설명합니다.2 스페로이드의 프로브 강도비(R)는 이미징 소프트웨어에서 비율 분석 기능을 사용하고 픽셀 R 계산을 적용하여 스페로이드 현미경 섹션의 오색 R 분포 이미지를 생성합니다. R은 또한 간단한 식 R=I의 적용에 의해 스페로이드 이미지의 동일한 관심 영역(ROI)으로부터 수집된 기준 및 민감한 스펙트럼 채널들의 강도 데이터로부터 수동으로 계산될 수 있다.참고문헌/I센스24,34. 해당 현미경 소프트웨어에서 원시 이미지로부터 강도 데이터를 추출할 수 없는 경우, ImageJ 또는 피지와 같은 프로그램을 사용하여 강도 데이터를 얻을 수 있습니다(토론 참조).- 병합 모드에서 만들어진 참조 및 민감한 스펙트럼 채널의O2 프로브 강도 데이터로 .vsi 파일을 엽니다. 측정 메뉴에서 비율 분석 함수 창을 엽니다. 참조 채널의 강도를 분자로 선택하고 민감 채널의 강도를 R 계산의 분모로 선택합니다.
참고: R을 계산하기 위한 참조 신호와 민감한 신호의 역전된 비율도 가능하지만, 이 경우 R은O2의 증가에 따라 감소합니다. - 각 스펙트럼 채널에 해당 강도 임계값 설정을 적용하여 병합된 강도 이미지에서 배경을 뺍니다. 이미지 배경이 균일하게 검은색이 될 때까지 임계값을 계속 늘립니다. 임계 파라미터를 비교 분석에 사용되는 데이터 세트의 모든 스페로이드 이미지에 동등하게 적용한다.
참고: 미리 보기 창을 사용하여 구상체의 예비 계산된 거짓 색상 R 이미지를 관찰하여 임계값 설정을 최적화합니다. 임계값 필드의 현재 값보다 낮은 강도를 갖는 모든 픽셀은 R 분석에서 제거되고 블랙 스폿으로 표시됩니다. 역치 적용 후, 스페로이드 형광에 상응하는 영역만이 가시화되어야 한다. 독립적인 스펙트럼 채널들의 평균 배경 강도(구상체가 없는 영역)의 예비 추정은 이미지에 대한 적절한 임계치의 선택을 단순화한다. 추가적으로, 병합된 형광 이미지에 대응하는 투과광 스페로이드 이미지로부터 식별된 스페로이드 ROI 경계의 적용은 비배경 신호 강도의 과도한 감산을 방지하기 위해 임계 파라미터의 정확한 결정을 돕는다. - 분자와 분모 강도에 대한 배경 설정을 0으로 유지하면 배경이 이미 임계값 적용으로 뺀 상태입니다.
- 미리 보기 이미지가 R 그라디언트의 원하는 해상도를 제공할 때까지 비율 이미지의 배율(Scale)을 조정합니다. 비교 분석에 사용되는 데이터 세트의 모든 스페로이드 이미지에 스케일링 파라미터를 동일하게 적용합니다.
참고: 배율 조정 매개 변수는 R 이미지에 가능한 한 많은 정보가 포함되어 있고 R 숫자 데이터의 해상도 계수로 볼 수 있도록 충분히 커야 합니다(최소 1,000개). - 적용(Apply)을 눌러 스페로이드 이미지에 조정된 매개변수를 적용합니다. 도구 창 메뉴에서 디스플레이 창 조정 창에서 이미지의 밝기와 대비를 조정합니다.
- 디스플레이 조정 창에서 고정 배율 옵션을 사용하여 비율 분포 히스토그램의 연결 및 연결 해제 한계를 수동으로 결정합니다. 이렇게 하면 R 매개 변수 프레젠테이션의 가색 막대 범위가 결정됩니다.
참고: 서로 다른 그룹 간의 스페로이드 이미지를 비교하려면 모든 분석 샘플에 대해 유사한 색상 막대 범위를 유지하는 것이 중요합니다. R 매개 변수의 변경 범위는 그룹마다 다를 수 있으므로 선택한 거짓 색상 막대 범위는 모든 분석 그룹의 분포 히스토그램에 대해 보편적이어야 합니다. - 구상체는 종종 이상적으로 구형이 아니며, 구형 직경이 구상체의 중심 (종종 저산소 코어)을 통해 그려진 가장 긴 선이라고 가정합니다. 측정값 메뉴의 선형 눈금자 함수를 사용하여 스페로이드 직경을 결정합니다. 데이터를 스프레드시트 테이블 파일로 내보냅니다.
- 필요한 크기 (가능한 한 작음)와 모양 (예 : 둥근)의 ROI를 선택하고 구상체의 주변부 및 저산소 코어에 적용하십시오. ROI를 측정 대상으로 변환하여 선택한 ROI 내부의 평균 R(주변R-Rp 및 코어R-Rc)을 분석합니다. 스프레드시트 호환 테이블 형식으로 데이터를 내보냅니다.
참고: 구상체는 그룹 간에 동일한O2 분포를 갖지 않으며 저산소 코어는 스페로이드 중심과 완벽하게 공동 국소화되지 않습니다. 분석을 단순화하고 표준화하기 위해 우리는 가장 저산소 영역이 구상체 중심의 이상적인 코어와 일치한다고 가정합니다. 이들 구역에서 측정된 Rc는O2 기울기 범위(Rp-Rc) 및 가파름(Rp-Rc)/r의 계산에 적용되며, 여기서 r(이상적으로는 주변부와 저산소 코어 ROI 사이의 거리)은 직경 측정으로부터 계산된 스페로이드의 대략적인 반지름(μm)이다. 선택적으로, 스페로이드O2 구배는 스페로이드 직경을 따라 만들어진 R 파라미터 변경(측정 메뉴의 라인 프로파일 윈도우)의 선형 라인 프로파일로서 제시될 수 있다. 이 데이터는 스프레드시트 테이블 파일로 내보낼 수도 있습니다. - 스페로이드의 각 현미경 섹션에 측정을 적용하여 스페로이드 직경의 데이터 세트를 얻고,Rc 와Rp 는 추가 계산 및 통계적 비교를 수행한다. 모든 데이터를 하나의 스프레드시트 파일로 결합합니다.
- 광표백 또는 다른 자극에 대한 동적 반응의 타임랩스 분석을 위해서는 선택한 ROI를 한 세트의 각 이미지에 있는 동일한 좌표에 적용합니다. R 매개 변수를 비교하려면 타임랩스 이미지 집합에서 첫 번째 주기의 R에서 백분율로 표시합니다.
- 광표백 분석의 경우 여러 ROI의 R을 사용하여 각 타임랩스 주기에 대한 백분율의 평균 R을 계산하고 변경 사항을 추적합니다.
- 연속 조명의 12 사이클 후에 초기 강도가 5 % 미만으로 감소한 경우 광 표백 효과가 중요하지 않다고 가정합니다. 항상 동적 변화를 대조군으로 광표백 곡선과 비교하여 비율계량 타임랩스 응답의 중요성을 확인합니다(그림 2A,B 참조).
- 획득된 파라미터 계산 r로부터, (Rp-Rc) 및 (Rp-Rc)/r 데이터 세트에서 개별 구상체에 대한 계산. Kolmogorov-Smirnov 또는 관련 테스트를 통해 데이터 분포의 정상성을 분석합니다. 데이터 분석에 적합한 통계 방법을 선택하고 데이터 프레젠테이션 수치를 진행하십시오.
참고: 여기에 제시된 데이터는 정상적으로 분포되었으며 스페로이드 그룹 간의 통계적 비교를 위해 p = 0.05에서 독립적인 t-검정이 구현되었습니다.
- 병합 모드에서 만들어진 참조 및 민감한 스펙트럼 채널의O2 프로브 강도 데이터로 .vsi 파일을 엽니다. 측정 메뉴에서 비율 분석 함수 창을 엽니다. 참조 채널의 강도를 분자로 선택하고 민감 채널의 강도를 R 계산의 분모로 선택합니다.
결과
마이크로패턴화된 아가로스 방법을 사용하여 미리 염색된O2 프로브의 높은 처리량 생산은 사전 염색된 구상체가 없는 아가로스 마이크로웰의 예를 나타내는 도 1C 에 개략적으로 도시되어 있다. 아가로스 코팅에 대한 스페로이드 형성의 효율과 그 모양 / 구형도는 세포 특이적 일 수 있습니다. 예를 들어, 인간 결장 HCT116 세포는 지질 코팅 표면17과 달리 아가로스 마이크로웰 방법을 사용하여 이상적인 구형 구조를 형성하지 않은 반면, hDPSC는 단독으로 HUVEC와 공동 배양하여 항상 세포 조성, 초기 세포 수 및 스페로이드 형성 / 성장 기간에 비례하여 재현 가능한 모양과 크기의 구상체를 생산했습니다. 시험된 모든 세포 유형은 스페로이드 형성 동안O2 프로브 나노입자를 효율적으로 축적하고(도 1B), 적어도 5일에 걸쳐 이러한 염색을 보존하여, 바이오프린팅 및 바이오프린팅된 조직 산소화의 후속 모니터링에 이들을 사용할 수 있게 하였다(도 1D).
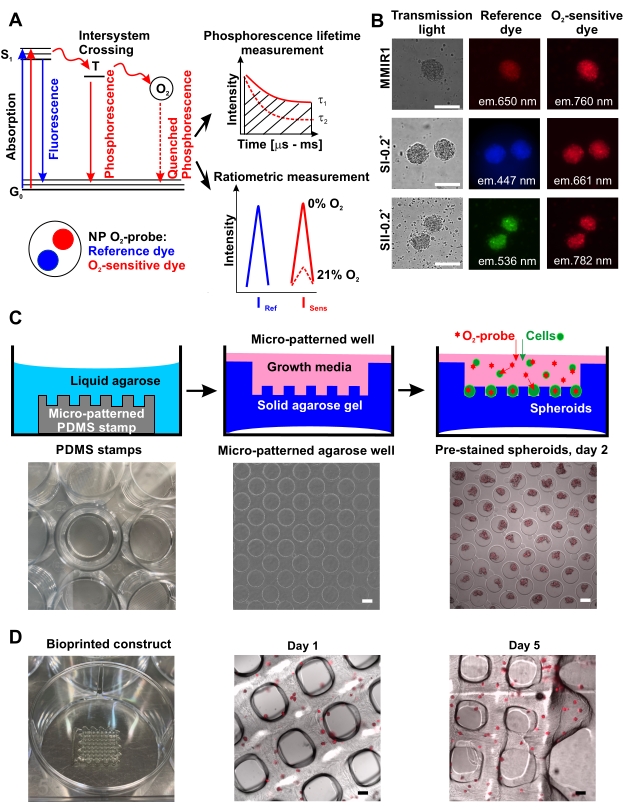
그림 1 :O2 프로브 기능의 원리와 스페로이드 염색 및 바이오 프린팅을위한 응용 프로그램. (A) 인광 나노입자(NP) 프로브에 의한O2 감지의 원리를 설명하는 단순화된 야블론스키 다이어그램. 금지된 삼중항 여기된 상태(T) 동안 분자 O2로의 에너지의 전달은 인광 수명 타우에 반비례하는 인광 강도의 감소를 유도하며, τ(0% O2에서 τ1에서21% O2에서의 τ2로의변화), 이는 일중항 상태로의 여기(S1)와 그의 기저 상태(G0)42로의 복귀 사이의 시간이다. 정량적O2 측정은 비율계량 측정 또는 τ 측정(인광 수명 측정)을 측정하여 수행할 수 있습니다. (b) 상이한 유형의 O2 프로브로 염색된 인간 치과용 펄프 줄기세포(hDPSC) 구상체의 염색의 예를, 투과광, 참조 및O2 민감성 염료 형광 채널에 나타내었다. 스케일 바는 100 μm이다. (C) 마이크로패턴화된 아가로스 방법을 이용한 고처리량O2 프로브 사전 염색된 스페로이드 생성의 회로도. 왼쪽에서 오른쪽으로: PDMS 실리콘 스탬프를 배양 플레이트의 웰에 위치시키고, 마이크로웰 패턴의 일례로 아가로오스(4x 배율), 및 일례로 HCT116 인간 결장암 세포로부터 생성된 MMIR1 사전 염색된 구상체를 2일째에 마이크로패턴화된 아가로오스(4x 배율)에 시딩한 후, 시딩하였다. 스케일 바는 100 μm이다. (D) 왼쪽에서 오른쪽으로: 바이오프린팅 후 1일 및 5일째에 MMIR1 사전 염색된 스페로이드 생물인쇄 작제물의 생체인쇄 와플 컨스트럭트 및 현미경 분석. 형광 신호는 MMIR1 나노입자에서O2 민감성 인광 염료에 상응한다(제외 = 635 nm/em. = 760 nm). 스케일 바는 400 μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
설명 된 현미경 검사 설정 (광원으로 발광 다이오드 (LED)을 장착 한 기존의 광역 형광 현미경)에서 적색 / 근적외선 MMIR1 프로브는 초기 강도 비율 (R = Iref / Isens)의 밝기가 5 % 미만으로 감소한 기준 및 민감한 염료의 광안정성 측면에서 가장 우수한 것으로 나타났습니다. ) 연속 조명의 12 사이클 후. 이를 통해 MMIR1 프로브를 사용하여 미토콘드리아 언커플러(FCCP) 및 전자 수송 사슬(로테논)의 콤플렉스 I의 억제제로 치료할 때 hDPSC 구상체에서 신속한 호흡 반응에 대한 동적 실시간 연구를 수행할 수 있었습니다(도 2A, B). 우리는 줄기 세포 유래 구상체에서 FCCP가 DPSC40의 이전에 보고된 대사 특징과 일치하여이 약물을 첨가 한 후 ~ 80 초 이내에 세포 호흡이 약간 감소하여 가벼운 결합 결합 효과 만 나타냈다는 것을 발견했습니다. 한편, 로테논은 구상체 재산소화 (Rp-스페로이드 주변비 및Rc-스페로이드 코어 비율의 증가로서 반영됨) 및 자극 후 ∼80 s 이내의 주변부 대 코어O2 구배의 소산으로 이어지는 호흡을 강하게 억제하였다 (도 2A). 높은 (대기권) 및 낮음 (이미징 배지에서 아황산나트륨 및 글루코스 옥시다제의 존재시)에서 MMIR1 프로브 비율 (R)의 2 점 반 보정은 안티 마이신 A / 로테논 칵테일 처리에 의한 예비 호흡 억제와 함께 구상체의 산소 생성 감소와 관련된 R의 감소를 확인했습니다 (그림 2C ), MMIR1 프로브 R의 측정이 3D에서 장기 정상 상태 및 빠른 산소화 반응의 반정량적 모니터링에 어떻게 적용될 수 있는지를 보여줍니다.

도 2: 상이한 자극에 대한O2 프로브 반응의 동역학적 분석. (A) 휴지 및 FCCP 및 로테논 치료에 반응하여 hDPSC 스페로이드 산소화 영상화의 대표적인 결과. 스케일 바는 100 μm이다. (B) 초기 광표백 강도비와 비교하여 FCCP 및 로테논 처리에 대한 MMIR1 강도비의 동역학적 반응 동역학(%). (c) 산소화 (안티마이신 A + 로테논 첨가) 및 탈산소화 (글루코스 옥시다제 첨가) 상태에서 hDPSC 스페로이드에서의 MMIR1 프로브의 강도비 이미지의 변화. 컬러 막대는O2 프로브 강도비(R=Iref /Isens) 이미지를 가로지르는 분포를 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
살아있는 대사 영상화를 위한 MMIR1 프로브 적용을 설명하기 위해, 동세포 hDPSC 대 이종세포 hDPSC/HUVEC(1:1) 구상체에서의O2 구배의 비교 분석이 수행되었다. 자유 청색 및 녹색 형광 스펙트럼 채널의 이용가능성을 이용하여 Hoechst 34580 (HXT) 및 SYTOX Green (SYTOX)과의 공동 염색을 수행하여 다모수 연구를 위한O2 프로브의 적용을 입증하였다 (도 3). 이미징 소프트웨어에 의해 제공된 픽셀별 강도비 계산의 자동화된 프로토콜을 사용하여 구상체에서의 R 분포의 오색비 이미지가 생성되었고, 모든 유형의 구상체에서 실시간으로 검출된 주변부-코어O2 구배를 시각화하였다: 중앙에 산소화된 주변부 및 저산소 틈새를 가지고 있다(도 2 및 도 3A). 그러나,Rp 및Rc 값뿐만 아니라 중간 단면에서의O2 구배의 가파름은 상이한 스페로이드 유형에 따라 다양하였다: hDPSC 대 hDPSC/HUVEC 구상체 및 hDPSC 대 생체인쇄된 hDPSC 구상체에서 중간 단면의 선 프로파일을 참조한다(도 3B,C). O2 구배를 기술하는 널리 받아들여진 방법이 없었기 때문에, 우리는 일반적인 스페로이드 산소화에 대한 쉬운 비교 및 상세한 설명을 가능하게 하는 몇 가지 파라미터들을 도입하였다:Rp와 Rc, 그리고 산소화 및 저산소 구역 사이의 차이로서O2 구배의 이러한 특성들(Rp-Rc), 및 μm당 산소화의 평균 변화(Rp-Rc)/r, 여기서 r은 주변부와 저산소 코어 사이의 거리로, 중간 단면과 스페로이드 반지름의 상관 관계가 있습니다(그림 3D). 구상체에서 SYTOX에 의해 시각화 된 괴사 성 죽은 세포로부터의 데이터와 함께 이러한 매개 변수의 통계적 비교는 스페로이드 세포 유형 특이적O2 분포 구배의 기원에 대한 예비 결론을 도출하는 데 도움이되었습니다.

그림 3: 구상체의 산소화 구배의 비교 분석. (A) 인쇄 전후의 동종세포 hDPSC 구상체에서의 산소화(MMIR1의 비율계량 형광 현미경) 및 생/사형 세포 염색(Hoechst 34580, HXT, 청색 및 SYTOX Green, SYTOX)의 살아있는 현미경 검사의 대표적인 예, 및 이종세포 hDPSC/HUVEC(1:1) 구상체. 모든 유형의 구상체에서 hDPSCs는 동일한 세포 배양물로부터 나왔다. 스페로이드는 형성 기간 동안 5 μg/mL의 MMIR1 프로브로 2일 동안 사전 염색한 다음, 이미징 또는 바이오프린팅(hDPSC 스페로이드만)에 사용하였고, 바이오프린팅 후 1일째에 후속 이미징 분석을 하였다. MMIR1-염색된 구상체의 강도비(Iref/Isens) 이미지의 거짓 컬러 이미지는 그들의 주변-코어 대 코어O2 구배에 대응한다. 스케일 바는 100 μm이다. 컬러 막대는 이미지에 걸친O2 프로브 강도비(R = Iref/Isens) 분포를 나타냅니다. 직경 단면의 숫자 1 및 2는 B와 C에 표시된 강도 프로파일에 해당합니다. (B,C) 바이오 프린팅 전후의 동종 hDPSC 대 이종 hDPSC / HUVEC 구상체 (B) 및 균질 hDPSC 구상체 (C) 간의 강도 비율 프로파일 비교. 프로파일은 (A)에 나타낸 구상체의 단면에 대해 측정되었다. (d) 스페로이드에서의 주변-코어O2 구배의 설명에 사용되는 파라미터의 개략적인 표현이며, 여기서 r은 스페로이드의 반경이고Rp 및Rc는 그에 상응하는 스페로이드의 주변부 및 코어 영역의 강도비이다. 컬러 바는 이상적으로 구형 구상체에서 높은(적색)에서 낮은(파란색) 수준까지의O2 구배의 분포를 개략적으로 나타낸다. (E, F) hDPSC/HUVEC 및 hDPSC 구상체(E) 및 바이오프린팅 전과 1일째에 hDPSC 구상체에서의 주변-코어O2-구배(Rp-Rc)/r 값의 비교 분석. 통계적 분석은 하나의 실험 반복에 대해 수행되었다(n=18-23). 상자는 표준 편차에 해당합니다. 별표는 그룹 간의 통계적 차이를 나타냅니다 (p = 0.05에서); ** = p < 0.0005. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
동종세포 hDPSC 구상체와 비교하여, hDPSC/HUVEC 구상체는 상당히 가파른 구배를 가졌다: (Rp-Rc)/r 파라미터 및 범위(Rp-Rc; 도 3F). 동시에, 그들은 주변부 (Rp) 및 코어 (Rc)의 더 높은 산소화를 나타내었다 (도 4A, 표 1). 흥미롭게도, 그들은 또한 통계적으로 더 컸으며(도 4A, 표 1), 이는 산소화의 이러한 차이가 그들의 상이한 세포 생물에너지 프로파일에 의해 야기되었다는 것을 시사한다. 이들 데이터는 ATP 및 NAD(P)H41의 주요 생물에너지 공급원으로서 당분해 및 펜토스-포스페이트 경로에 대한 강한 의존도를 갖는 세포의 일반적으로 낮은 호흡 활성을 갖는 HUVEC 세포의 잘 알려진 대사 특징과 일치한다. 동시에, 이종 구상체에서 형성된 뚜렷한 주변부-코어O2 구배는 그들의 조성에서 hDPSC에 의해 생성될 가능성이 높으며, 이는 과분극된 미토콘드리아 및 활성 전자-수송 사슬(40)을 특징으로 하고, hDPSC 스페로이드에 대한 결과에 따르면, 강한 호흡 활성을 갖는 산소화(도 3, 도 4A, 및 표 1) ). 따라서, 일반적으로 SYTOX로 염색된 죽은 세포의 낮은 강도에 의해 확인된 hDPSC/HUVEC 구상체의 더 높은 생존력(도 3A)은 잠재적으로 그들의 더 높은 산소화 수준과 연관된다.
생체 제조에서 스페로이드 산소화의 살아있는 현미경 이미징의 적용 가능성을 설명하기 위해, MMIR1O2-프로브 사전 염색된 구상체는 GelMA 바이오잉크에서 바이오프린팅에 사용되었고, 바이오프린팅 전과 1일째에 hDPSC 구상체에서의O2 구배를 다음과 같이 비교하였다(도 3A, C, F, 도 4B 및 표 2). 생체 인쇄 된 hDPSC 구상체는 바이오 프린팅 전에 측정 된 구상체와 비교하여 상당히 산소화 된 주변 (더 높은Rp)을 가졌지 만 코어 산소화는 비슷한 값을 가졌습니다 (그림 4B). 그들의 주변 산소화의 변화는 그들의 주변부-코어 O2 구배의 범위((Rp-Rc)의 증가) 및 가파름(증가(Rp-Rc)/r)에 영향을 미치며, 이는 바이오프린팅 전에 측정된 hDPSC 구상체와 통계적으로 상이하였다(도 3F 및 도 4B). 염색된 죽은 세포는 일반적으로 생체인쇄된 구상체에서 더 밝았고, 이는 감소된 스페로이드 생존력이 스페로이드 산소화의 변경에 관여한다는 것을 시사한다(도 3A).

도 4: MMIR1 염색된 구상체 직경 및 강도비의 비교 분석. (A) 헤테로-hDPSC/HUVEC와 동종세포 hDPSC 구상체 간의 비교. (b) 바이오프린팅 전후의 동종세포 hDPSC 구상체의 비교. Rp 및Rc-에 상응하여 구상체의 주변부 및 코어에서의 강도비; (Rp-Rc)-강도비의 차이는, 구상체에서 O2 구배의 범위에 상응한다. 통계적 분석은 하나의 실험적 반복실험에 대해 수행되었다(n=18-23). 상자는 표준 편차에 해당합니다. 별표는 그룹 간의 통계적 차이(p = 0.05)를 나타내며, 여기서 * = p는 0.005이고 ** = p는 0.0005< <다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 스페로이드의 종류(N) | 직경 [μm] | Rp [a.u.] | Rc[a.u.] | Rp-Rc[a.u.] | (Rp-Rc)/r [a.u./μm] |
| hDPSC / HUVEC (18) | 113.2 ± 10.6 | 0.779 ± 0.034 | 0.398 ± 0.055 | 0.982 ± 0.051 | 0.00677 ± 0.00091 |
| hDPSC (18) | 88.1 ± 9.9 | 0.558 ± 0.025 | 0.331 ± 0.034 | 0.227 ± 0.032 | 0.00520 ± 0.00090 |
| p-값 | 1.5 x 10-8 * | 1.5 x 10-21 * | 1.3 x 10-4 * | 1.4 x 10-12 * | 9.2 x 10-6 * |
표 1. 스페로이드 직경, 구상체의 코어(Rc) 및 주변부(Rp)에서의 강도비, 이종 hDPSC/HUVEC 및 균질 hDPSC 스페로이드에서의 강도비(Rp-Rc) 및 (Rp-Rc)/r 값의 차이. N 구상체에 대한 t-검정의 p-값은 통계적 차이를 나타내며 별표로도 표시됩니다.
| 스페로이드의 종류(N) | 직경 [μm] | Rp [a.u.] | Rc[a.u.] | Rp-Rc[a.u.] | (Rp-Rc)/r [a.u./μm] |
| hDPSC (18) | 88.1 ± 9.9 | 0.558 ± 0.025 | 0.331 ± 0.034 | 0.227 ± 0.032 | 0.00520 ± 0.00090 |
| 생체 인쇄 hDPSC (23) | 80.9 ± 12.5 | 0.584 ± 0.023 | 0.323 ± 0.038 | 0.261 ± 0.039 | 0.00658 ± 0.00144 |
| p-값 | 0.054 | 0.0024 * | 0.46 | 9.9 x 10-4 * | 6.3 x 10-6 * |
표 2. 스페로이드 직경, 구상체의 코어(Rc) 및 주변부(Rp)에서의 강도비, 바이오프린팅 전후의 균질한 hDPSC 구상체에서의 강도비(Rp-Rc) 및(Rp-Rc)/r 값의 차이. 통계 분석의 p-값 (N 구상체). 통계적 차이는 별표로 표시됩니다.
토론
중요성. 조직 산소화 측정은 세포 및 조직 특이적 신진 대사, 조직 성장 및 발달, 생존력, 종양 발생 및 세포 이동, 미생물 및 기타 병원체와의 상호 작용에 대한 통찰력을 제공합니다. 제시된 방법은 다세포 스페로이드 배양의 생리학을 더 잘 이해하기위한 새로운 도구를 제공합니다 : 비율계량 나노 입자O2 프로브를 사용한 산소화 분석 및 저산소증을 평가하고, 특정 에너지 생산 경로에 대한 의존도를 시각화하고, 모델링 연구 및 대체 대사 이미징 접근법을 보완하는 수단을 제공합니다43,44 널리 이용 가능한 저비용 형광 현미경에. 비율계량 측정은 형광 광장(펄스 LED 여기 선호), 레이저 스캐닝 공초점, 라이트 시트 및 2광자 현미경에서 수행할 수 있으며, 이상적으로는 T 및O2 인큐베이터 챔버가 장착되어 있습니다. 중요하게도, 제시된O2 현미경 측정은 다양한 생리적 파라미터 및 세포 추적기 (이종 세포 스페로이드 배양의 경우), 생존력 (라이브 / 데드 염색), 지질 대사 (지질 감지 형광 프로브), pH의 역학 (염료, 나노 입자 및 형광 단백질) 또는 [Ca2+]의 라이브 다중 파라미터 분석과 쉽게 결합 될 수 있습니다. ], 사용 가능한 형광 스펙트럼 채널에서 또는 병렬로 수행되어, 구상체, 생체인쇄 구축물 및 잠재적 조직 이식에서의 실시간 세포 기능에 대한 확장된 보기를 제공한다.
스페로이드 배양은 암 세포, 종양 및 줄기 세포 틈새 미세 환경, 종양, 약물 효율 및 독성 스크리닝에 대한 연구에서 사용되며, 실제로 조직 생물 제조 및 자기 조립을위한 조직 빌딩 블록으로사용됩니다 45. 이들은 다양한 상이한 접근법(46)에 의해 다수의 세포 유형으로부터 생성될 수 있다. 스페로이드 모델의 인기는 연구 무결성과 데이터 분석의 개선의 관점에서 표준화를 필요로하며, 이는 최근 첫 번째 스페로이드 데이터베이스8의 개발에 의해 시도되었습니다.
우리의 프로토콜은 살아있는 스페로이드 대사를 더 잘 이해하고,이 실험 모델을 표준화하며, 생체 인쇄 및 이식 가능한 재료 내에서 장기적인 안정성, 재현성 및 생존력을 향상시키는 데 도움이 될 것으로 기대됩니다.
수정. 이 프로토콜은 산소화 분석을 위한O2 프로브 로딩된 구상체의 고수율 생성을 위한 마이크로패턴화된 아가로스 저부착성 표면(마이크로몰드 기반 형성29)의 사용을 기술한다. 매달린 방울, 초저 부착 플레이트의 적용, 지질 코팅 또는 자유 부유 형성과 같은 스페로이드 생산의 대안적인 방법은 또한 제안된O2 프로브 로딩 프로토콜과 양립가능하다. 제시된 프로토콜은 hDPSC 구상체 및 hDPSC와 HUVEC (1:1)의 공동 배양 구상체에 대해 최적화되었다. 다른 세포주는 확실히 적용 가능하다 15,17,47,48; 그러나, 일부 프로토콜 최적화는 상이한 세포 부착 특성, 배양 조건, 대사 기질 요건 및 나노입자 염색과의 세포 상용성으로 인해 요구될 수 있다. 적합한 비율계량 나노입자 기반 O2 민감성 프로브의 선택은 특정 세포 모델에 따라, 그리고 사용된 현미경 설정에서의 프로브 광표백 특성(광원의 강도 및 유형, 카메라의 스펙트럼 감도) 및 프로브의 상응하는 기준 및O2 민감성 스펙트럼 채널에 대한 적절한 여기/방출 필터의 가용성에 따라 수행되어야 한다.
일부 비측정법O2 프로브는 상업적으로 입수가능한2. 대안적으로, 이들은 다른 곳에 기재된 바와 같은 중합체를 갖는 기준 및O2 민감성 염료의 공침에 의해 사내에서 제조될 수 있다24,25,49. 각 개별 모델에 대해 적절한 프로브 및 최적의 현미경 조건을 결정하고 비율계량 측정 중에 프로브 광표백 또는 광유도O2 소비의 영향을 최소화하기 위해 예비 테스트를 수행해야합니다. O2 감지 나노 입자에 대한 이전의 연구는 낮은 세포 독성을 입증하여 광범위한 염색 농도 (1-20 μg / mL)에 적용 할 수있었습니다. 일부 양이온성 나노 입자는 저장 중에 자체 응집 될 수 있으므로 스페로이드 형성에 대한 잠재적 영향을 최소화하기 위해 로딩 농도를 가능한 한 낮게 유지하는 것이 좋습니다. 임의로, 나노입자 현탁액은 현탁액으로부터 모든 응집체를 제거하기 위해 사용 전에 여과 (0.2 μm) 또는 원심분리 (10,000 x g, 5 분)에 의해 클리어링될 수 있다.
BioCAD 및 HMI 소프트웨어는 제시된 바이오 프린터에 대해 특이적이지만,이 프로토콜은 바이오 잉크의 제조, 조립, 표준 카트리지의 충전 및 다공성 하이드로 겔 스캐폴드의 설계가 제공되므로 다른 바이오 프린터에 적용 할 수 있습니다. 또한, 인쇄 속도 및 온도와 같은 바이오 프린팅 파라미터는 다른 압출 기반 바이오 프린터에 대해 필적해야합니다. 인쇄 압력과 스트럿 직경은 바늘 유형 및 직경, 바이오잉크 조성, 온도 및 결과 점도에 따라 다르지만 일부 바이오 프린터는 바이오 잉크50을 압출하기 위해 공기 압력 대신 스핀들을 사용하지만 다른 바이오 프린터를 사용하는 Bioprint GelMA 기반 바이오 잉크에 대한 인쇄 매개 변수를 최적화하는 출발점이 될 수 있습니다.
중요한 단계 및 문제 해결. 중요한 단계 중 하나는O2 프로브의 선택이며, 이는 다음과 같은 고려 사항에 기초합니다 : 첫째, 사용 가능한 형광 현미경 설정 (즉, 호환 가능한 여기 광원, 여기 및 방출을위한 필터, 카메라 감도 및 스펙트럼 투과율 및 목표의 수치 개구), 이는 광안정성과 관련하여 사용 가능한 프로브의 수를 제한 할 수 있습니다. 밝기 및 잠재적 인 광독성. 또한 일부 유형의 침지 오일 (오일 침지 목표의 경우)이 적색 및 적외선 형광 신호를 방해 할 수 있다는 점에 유의해야합니다. 우리는 광안정성 테스트가 매우 중요하며 초기 설정 및 예비 테스트 중에 수행되어야한다고 생각합니다. 형광 채널과 다른 염료 사이의 잠재적 인 스펙트럼 누화를 고려해야합니다. 실제로,O2 프로브 및 다른 선택된 염료의 잠재적인 암흑 및 광유도 독성은, 특정 세포 모델과 관련하여, 프로토콜 최적화(51) 동안 평가되어야 한다. 나노입자에 대한 구체적인 문제점은 그들의 자기 응집일 수 있으며, 이는 그들의 작동 농도, 염색 배지의 조성 (예를 들어, 혈청 함량), 배지와 혼합하기 전에 나노입자의 초음파 처리 또는O2-프로브를 사용하여 스페로이드 형성 및 압축화 절차 동안 프로브 로딩 대신에 스페로이드 형성을 위해 세포를 미리 염색하고 세척함으로써 완화될 수 있다.
우리는 설명 된 스페로이드 모델과 함께 광 침투 깊이와 관련된 문제를 관찰하지 못했지만 비율 측정 강도 신호, 스페로이드 및 생체 제작 된 구조물 (조직 이식편)의 크기를 선택하고 각 염료로 세포 염색을 최적화 할 때 고려해야합니다. 적색 및 근적외선 방출 파장이 밀접하게 일치하는 MMIR1 프로브는 다른 적색 / 청색 또는 녹색 방출 형광 바이오 센서 프로브에 비해 가장 낮은 배경과 최상의 조직 광 침투를 제공 할 것으로 예상됩니다.
비율 이미지(및 잠재적으로 스펙트럼 언믹싱 또는 디컨볼루션)의 생산 및 처리는 소프트웨어를 제공하는 공급업체 또는 ImageJ, Fiji52,53, napari(https://napari.org), MATLAB 등과 같은 오픈 소스 옵션에서 수행할 수 있습니다. 중요한 단계는 배경을 빼고 선형 범위에서 신호 강도 변화를 측정하는 것입니다.
O2 프로브의 교정: 로테논 및 안티마이신 A는 각각 미토콘드리아 전자 수송 사슬의 복합체 I 및 III의 억제제이며, 세포 호흡 54,55,15를 차단하고 구상체에서 O2 구배의 소산을 유도하고 환경 O2와의 평형을 유도한다. 따라서, 환경 O2 농도(즉, 20%, 15%, 10%, 5%, 2.5%, 1%, 0%O2)의 변화는 세포에서O2 민감성 프로브의 비율계량 강도 또는 인광 수명 교정을 허용할 것이다. 전형적으로, O2-제어 인큐베이터는 절대 0%O2를 달성할 수 없고, 특정 상황에서, 탈산소화에 대한 프로브의 반응의 신속한 테스트가 요구된다. 이러한 경우, 25-100 μg/mL의 글루코스 옥시다제 또는Na2SO3/K2HPO4 혼합물(증류수 중의 10x 용액에 대해 각 화합물에 대해 50 mg/mL)을 샘플에 첨가해야 합니다. 중요하게도, 세포주가 상당한 정도의 비미토콘드리아O2 소비량을 갖는다면, 호흡 억제 및 교정 실험을 수행할 때 이를 고려한다.
한계와 미래 연구. 제안된 방법 및 비율계량 검출의 주요 한계는 일반적으로 관찰된 비율 레벨을 실제O2 레벨로 캘리브레이션 및 변환하는 것이며, 이는 하드웨어 및 사용자 이미지 획득 설정의 본질적인 차이로 인해 비율 캘리브레이션 계측기- 및 셀 특이적을 만들 것이다. 중요하게도, 광시야 형광 현미경 및 설명된 셋업의 경우, 비율 이미지들은 이상적인 광학 섹션들보다는 결합된 돌출부를 반사하고O2 캘리브레이션은 이치에 맞지 않을 것이다. 반면에, 우리는 반 정량적 비율 측정이 통계적으로 유의미하고 측정하기 쉬운 다양한 소스에서 생산되고 산소화에 차이가 있는 구상체의 비교 표현형을 제공한다는 것을 보여준다.
SPIM, 라이트 시트, 세타, 2광자 및 발광 수명 이미징과 같은 라이브 3D 물체를 위해 설계된 보다 접근하기 쉽고 저렴한 현미경 접근 방식을 기계 학습 56,57,58,59,19와 결합한 미래의 연구는 다중 모수O2 이미징을 훨씬 더 정량적 응용 분야에 적용하는 데 도움이 될 것입니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작업은 겐트 대학 (BOF/STA / 202009/003)의 특별 연구 기금 보조금과 EU FP7 ITN 프로그램 "Chebana", 보조금 계약 번호 264772 (AVK의 경우)에 의해 지원되었습니다. 요청시 데이터를 사용할 수 있습니다. 바이오 프린팅을위한 G 코드는 공유에 사용할 수 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | Gibco | 25300-054 | Also available from Sigma |
| 12 well cell-culture plates, sterile | Greiner bio-one | 665-180 | Similar products are also available from Sarstedt, Corning and other companies. |
| 12 Well Chamber slide, removable | Ibidi | 81201 | Also available from Grace Bio-Labs, ThermoFisher Scientific and others |
| 15 mL centrifuge tubes | Nerbe plus | 02-502-3001 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| 3cc Cartridge, UV secure, luer lock | RegenHU | C-033CC-UV | Also available from CelIink and others |
| 3D Discovery Bioprinter | RegenHU | N/A | Bioprinter equiped with an extrusion based printhead, heating mantle, UV-LED curing lamp, 3D Discovery HMI software (CAD/CAM software with direct machine control) and BioCAD software (version 1.1-12) |
| 6 well cell-culture plates, sterile | Greiner bio-one | 657160 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Antimycin A from Streptomyces sp. | Sigma-Aldrich | A8674-25MG | Used as inhibitor of complex III of the mitochondrial electron transport chain, blocking cell respiration |
| B-Braun Tip Cap, luer lock | RegenHU | TC-BB-B | Also available from Regemat, Cellink and others |
| Cell view cell culture dish, PS, 35/10mm, glass bottom, 1 compartment, sterile | Greiner bio-one | 627861 | For microscopy of bioprinted spheroids |
| Collagen from human placenta, type IV | Sigma | C5533 | For the preparation of 0.07mg/mL Collagen and 0.03mg/mL Poly-D-lysine coated microscopy dishes |
| D(+)-Glucose | Merck | 8342 | Prepare 1M stock solution, 1/100 for preparation of imaging medium (final concentration 10mM) |
| Dulbecco's modified Eagle's medium (DMEM), phenol red-, glucose-, pyruvate- and glutamine-free | Sigma-Aldrich | D5030-10X1L | For preparation of imaging medium |
| Endothelial Cell Growth Medium 2 | PromoCell | C-22011 | Also available from Lonza and others |
| Endothelial Growth SupplementMix | PromoCell | C-39216 | Also available from Lonza and others |
| FCCP, Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma-Aldrich | C2920-10MG | Used as mitochondrial uncoupler |
| Fetal Bovine Serum | Gibco | 10270-098 | Also available from Sigma |
| GelMA | N/A | N/A | GelMA was synthesized by the PBM group (Prof Dr Peter Dubruel and Sandra Van Vlierberghe, University of Gent) [https://www.sciencedirect.com/science/article/pii/S0142961213011782] but are also available from Xpect Inx |
| Glucose-oxidase from Aspergillus nige (10000 u) | Sigma-Aldrich | G7141 | Used to test the response of probe to deoxygenation |
| GlutaMAX 100x Supplement | Gibco | 35050-038 | Dilution 1/100 for preparation of imaging medium (final concentration 2mM) |
| HEPES (1M) | Gibco | 15630-080 | Dilution 1/100 for preparation of imaging medium (final concentration 10mM) |
| Hoechst 34580 | Invitrogen (Life Technologies) | H21486 | Also available from Sigma, BDBiosciences and others |
| Human dental pulp stem cells (hDPSC) | Lonza | PT-5025 | Also available from ATCC or other vendors |
| Human umbilical vein endothelial cells (HUVEC) | Lonza | CC-2517 | Also available from ATCC or other vendors |
| KH2PO4 (potassium dihydrogen phosphate) | Merck | 4873 | For preparation of sodium sulfite solution (5 mg / mL Na2SO3 and 5 mg / mL KH2PO4). Prepare fresh from 10x concentrated stock solution daily. |
| Li-TPO | N/A | N/A | Li-TPO-L was synthesized by the PBM group (Prof Dr Peter Dubruel and Sandra Van Vlierberghe, University of Gent) [https://link.springer.com/referenceworkentry/10.1007%2F97 8-3-319-45444-3_15) , https://asmedigitalcollection.asme.org/nanoengineeringmedical/article/6/2/021001/376814/Hybrid-Tissue-Engineering-Scaffolds-by-Combination] but comparable photo-initiators are available from Sigma |
| MEM Alpha Medium + Glutamax Minimum essential medium | Gibco | 32561-029 | Also available from Sigma and others |
| Micro-patterned 3D-printed PDMS stamps, wells with a diameter 400 µm, thickness, total well numbers 1585 | Self-fabricated | These stamps were self-fabricated by the Centre for Microsystems Technology (Professor Dr Jan Vanfleteren, University of Gent) but can also be obtained commercially from Merck (Z764094, Microtissues 3D Petri Dish micro-mold mixed spheroid kit) | |
| Na2SO3 (sodium sulfite) | Sigma-Aldrich | 239321-500G | For preparation of sodium sulfite solution (5 mg / mL Na2SO3 and 5 mg / mL KH2PO4). Prepare fresh from 10x concentrated stock solution daily. |
| O2 probes: MMIR1, SI-0.2+, SII-0.2+ | N/A | N/A | Can be prepared ‘in-house’ using commercially available dyes, polymers and precipitation method [https://pubs.acs.org/doi/abs/10.1021/nn200807g https://onlinelibrary.wiley.com/doi/abs/10.1002/adfm.201201387 ]. Some nanoparticles are available commercially as discussed in [https://link.springer.com/article/10.1007/s00018-018-2840-x ] |
| Pen Strep :Penicillin (10,000 U/mL) / streptomycin (10,000 μg/mL) 100x solution | Gibco | 15140-122 | Also available from Sigma . Apply in dilution 1:100 |
| Petri dishes, sterile | Greiner bio-one | 633181 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Piston for 3cc cartridge | RegenHU | P-03CC-UV | Also available from Cellink, Regemat and others |
| Poly-D-lysine | Sigma | P6407-5mg | For the preparation of 0.07mg/mL Collagen and 0.03mg/mL Poly-D-lysine coated microscopy dishes |
| PVDF syringe filter 0.22 µm | Novolab | A35149 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Rotenone | Sigma-Aldrich | R8875-1G | Used as inhibitor of complex I of the mitochondrial electron transport chain, blocking cell respiration |
| Sodium pyruvate (100 mM) | Gibco | 11360-070 | Dilution 1/100 for preparation of imaging medium (final concentration 1mM) |
| SYTOX Green | Invitrogen (Life Technologies) | S7559 | Also available from Sigma, Promega and others |
| Taper tip 22 gauge (conical PE needle | Amada Myachi Europe | 22K62222 | Similar products are also available from RegenHU, Cellink, Regemat and others |
| Tissue culture flask (75 cm2) | VWR | 734-2313 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Ultrapure Agarose | Invitrogen (Life Technologies) | 16500-500 | Other types of Agarose such as Agarose low melting point (A-9414, Sigma), Agarose for routine use (A-9539, Sigma) |
| Widefield fluorescence inverted microscope | Olympus | N/A | Inverted fluorescence microscope IX81, with motorised Z-axis control, CoolLED pE4000 (16 channels, 365-770 nm), ORCA-Flash4.0LT (Hamamatsu) cMOS camera, glass warming plate Okolab, CellSens Dimension v.3 software and air objectives 4x/0.13 UPlanFLN and 40x/0.6 LUCPlanFLN. (Optional, for high-resolution imaging) 60x/1.0 LUMPLFLN water |
참고문헌
- Papkovsky, D. B., Dmitriev, R. I. Biological detection by optical oxygen sensing. Chemical Society Reviews. 42 (22), 8700-8732 (2013).
- Papkovsky, D. B., Dmitriev, R. I. Imaging of oxygen and hypoxia in cell and tissue samples. Cellular and Molecular Life Sciences. 75 (16), 2963-2980 (2018).
- Cordeiro, I. R., Tanaka, M. Environmental oxygen is a key modulator of development and evolution: From molecules to ecology: Oxygen-sensitive pathways pattern the developing organism, linking genetic and environmental components during the evolution of new traits. BioEssays. 42 (9), 2000025 (2020).
- Wenger, R. H., Kurtcuoglu, V., Scholz, C. C., Marti, H. H., Hoogewijs, D. Frequently asked questions in hypoxia research. Hypoxia. 3, 35 (2015).
- Erecińska, M., Silver, I. A. Tissue oxygen tension and brain sensitivity to hypoxia. Respiration Physiology. 128 (3), 263-276 (2001).
- Gholipourmalekabadi, M., Zhao, S., Harrison, B. S., Mozafari, M., Seifalian, A. M. Oxygen-generating biomaterials: a new, viable paradigm for tissue engineering. Trends in Biotechnology. 34 (12), 1010-1021 (2016).
- Zheng, L., Kelly, C. J., Colgan, S. P. Physiologic hypoxia and oxygen homeostasis in the healthy intestine. A review in the theme: cellular responses to hypoxia. American Journal of Physiology-Cell Physiology. 309 (6), 350-360 (2015).
- Peirsman, A., et al. MISpheroID: a knowledgebase and transparency tool for minimum information in spheroid identity. Nature Methods. 18 (11), 1294-1303 (2021).
- Suvarnapathaki, S., Wu, X., Lantigua, D., Nguyen, M. A., Camci-Unal, G. Breathing life into engineered tissues using oxygen-releasing biomaterials. NPG Asia Materials. 11 (1), 1-18 (2019).
- Salazar-Noratto, G. E., et al. Understanding and leveraging cell metabolism to enhance mesenchymal stem cell transplantation survival in tissue engineering and regenerative medicine applications. Stem Cells. 38 (1), 22-33 (2020).
- Leedale, J. A., et al. Mathematical modelling of oxygen gradients in stem cell-derived liver tissue. Plos One. 16 (2), 0244070 (2021).
- Sutherland, R., et al. Oxygenation and differentiation in multicellular spheroids of human colon carcinoma. Cancer Research. 46 (10), 5320-5329 (1986).
- Walenta, S., Dötsch, J., Bourrat-Flöck, B., Mueller-Klieser, W. Size-dependent oxygenation and energy status in multicellular tumor spheroids. Oxygen Transport to Tissue XII. , (1990).
- Hompland, T., Fjeldbo, C. S., Lyng, H. Tumor hypoxia as a barrier in cancer therapy: Why levels matter. Cancers. 13 (3), 499 (2021).
- Dmitriev, R. I., Zhdanov, A. V., Nolan, Y. M., Papkovsky, D. B. Imaging of neurosphere oxygenation with phosphorescent probes. Biomaterials. 34 (37), 9307-9317 (2013).
- Dmitriev, R. I., Borisov, S. M., Jenkins, J., Papkovsky, D. B. Multi-parametric imaging of tumor spheroids with ultra-bright and tunable nanoparticle O2 probes. Imaging, manipulation, and analysis of biomolecules, cells, and tissues XIII. , (2015).
- Dmitriev, R. I., et al. Versatile conjugated polymer nanoparticles for high-resolution O2 imaging in cells and 3D tissue models. ACS Nano. 9 (5), 5275-5288 (2015).
- Okkelman, I. A., Puschhof, J., Papkovsky, D. B., Dmitriev, R. I. Visualization of Stem Cell Niche by Fluorescence Lifetime Imaging Microscopy. Intestinal Stem Cells. , 65-97 (2020).
- Dmitriev, R. I., Intes, X., Barroso, M. M. Luminescence lifetime imaging of three-dimensional biological objects. Journal of Cell Science. 134 (9), 1-17 (2021).
- Yasukagawa, M., Yamada, K., Tobita, S., Yoshihara, T. Ratiometric oxygen probes with a cell-penetrating peptide for imaging oxygen levels in living cells. Journal of Photochemistry and Photobiology A: Chemistry. 383, 111983 (2019).
- Xie, B. -. R., et al. A near infrared ratiometric platform based π-extended porphyrin metal-organic framework for O2 imaging and cancer therapy. Biomaterials. 272, 120782 (2021).
- Düssmann, H., Perez-Alvarez, S., Anilkumar, U., Papkovsky, D. B., Prehn, J. H. Single-cell time-lapse imaging of intracellular O 2 in response to metabolic inhibition and mitochondrial cytochrome-c release. Cell Death & Disease. 8 (6), 2853 (2017).
- Roussakis, E., et al. Theranostic biocomposite scaffold membrane. Biomaterials. 212, 17-27 (2019).
- Kondrashina, A. V., et al. A phosphorescent nanoparticle-based probe for sensing and imaging of (intra) cellular oxygen in multiple detection modalities. Advanced Functional Materials. 22 (23), 4931-4939 (2012).
- Borisov, S. M., et al. Precipitation as a simple and versatile method for preparation of optical nanochemosensors. Talanta. 79 (5), 1322-1330 (2009).
- Borisov, S., Nuss, G., Klimant, I. Red light-excitable oxygen sensing materials based on platinum (II) and palladium (II) benzoporphyrins. Analytical Chemistry. 80 (24), 9435-9442 (2008).
- Strobl, M., Rappitsch, T., Borisov, S. M., Mayr, T., Klimant, I. NIR-emitting aza-BODIPY dyes-new building blocks for broad-range optical pH sensors. Analyst. 140 (21), 7150-7153 (2015).
- Tsytsarev, V., et al. In vivo imaging of brain metabolism activity using a phosphorescent oxygen-sensitive probe. Journal of Neuroscience Methods. 216 (2), 146-151 (2013).
- Fukuda, J., et al. Micromolding of photocrosslinkable chitosan hydrogel for spheroid microarray and co-cultures. Biomaterials. 27 (30), 5259-5267 (2006).
- Thomsen, A. R., et al. A deep conical agarose microwell array for adhesion independent three-dimensional cell culture and dynamic volume measurement. Lab on a Chip. 18 (1), 179-189 (2018).
- Gevaert, E., et al. High throughput micro-well generation of hepatocyte micro-aggregates for tissue engineering. PloS One. 9 (8), 105171 (2014).
- De Moor, L., et al. High-throughput fabrication of vascularized spheroids for bioprinting. Biofabrication. 10 (3), 035009 (2018).
- Rivron, N. C., et al. Tissue deformation spatially modulates VEGF signaling and angiogenesis. Proceedings of the National Academy of Sciences of the United States of America. 109 (18), 6886-6891 (2012).
- Nunes, P., Guido, D., Demaurex, N. Measuring phagosome pH by ratiometric fluorescence microscopy. Journal of Visualized Experiments:JoVE. (106), e53402 (2015).
- Billiet, T., Gevaert, E., De Schryver, T., Cornelissen, M., Dubruel, P. The 3D printing of gelatin methacrylamide cell-laden tissue-engineered constructs with high cell viability. Biomaterials. 35 (1), 49-62 (2014).
- Tytgat, L., Ovsianikov, A., Yoo, J., Mironov, V., et al. Photopolymerizable materials for cell encapsulation. 3D Printing and Biofabrication. , 353-396 (2018).
- Markovic, M., et al. Hybrid tissue engineering scaffolds by combination of three-dimensional printing and cell photoencapsulation. Journal of Nanotechnology in Engineering and Medicine. 6 (2), 0210011 (2015).
- De Moor, L., et al. Hybrid bioprinting of chondrogenically induced human mesenchymal stem cell spheroids. Frontiers in Bioengineering and Biotechnology. 8, 484 (2020).
- Zhdanov, A. V., Dmitriev, R. I., Hynes, J., Papkovsky, D. B. Kinetic analysis of local oxygenation and respiratory responses of mammalian cells using intracellular oxygen-sensitive probes and time-resolved fluorometry. Methods in Enzymology. 542, 183-207 (2014).
- Uribe-Etxebarria, V., Agliano, A., Unda, F., Ibarretxe, G. Wnt signaling reprograms metabolism in dental pulp stem cells. Journal of Cellular Physiology. 234 (8), 13068-13082 (2019).
- Vizán, P., et al. Characterization of the metabolic changes underlying growth factor angiogenic activation: identification of new potential therapeutic targets. Carcinogenesis. 30 (6), 946-952 (2009).
- Dmitriev, R. I., Papkovsky, D. B. Quenched-phosphorescence detection of molecular oxygen: applications in life sciences. Royal Society of Chemistry. , (2018).
- Perottoni, S., et al. Intracellular label-free detection of mesenchymal stem cell metabolism within a perivascular niche-on-a-chip. Lab on a Chip. 21 (7), 1395-1408 (2021).
- Okkelman, I. A., Neto, N., Papkovsky, D. B., Monaghan, M. G., Dmitriev, R. I. A deeper understanding of intestinal organoid metabolism revealed by combining fluorescence lifetime imaging microscopy (FLIM) and extracellular flux analyses. Redox Biology. 30, 101420 (2020).
- Mironov, V., et al. Organ printing: tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14 (127), 20160877 (2017).
- Dmitriev, R. I., et al. Imaging oxygen in neural cell and tissue models by means of anionic cell-permeable phosphorescent nanoparticles. Cellular and Molecular Life Sciences. 72 (2), 367-381 (2015).
- Jenkins, J., Borisov, S. M., Papkovsky, D. B., Dmitriev, R. I. Sulforhodamine nanothermometer for multiparametric fluorescence lifetime imaging microscopy. Analytical Chemistry. 88 (21), 10566-10572 (2016).
- Fercher, A., Borisov, S. M., Zhdanov, A. V., Klimant, I., Papkovsky, D. B. Intracellular O2 sensing probe based on cell-penetrating phosphorescent nanoparticles. ACS Nano. 5 (7), 5499-5508 (2011).
- Wagner, M., Karner, A., Gattringer, P., Buchegger, B., Hochreiner, A. A super low-cost bioprinter based on DVD-drive components and a raspberry pi as controller. Bioprinting. 23, 00142 (2021).
- Golub, A. S., Pittman, R. N. Monitoring parameters of Oxygen transport to cells in the microcirculation. Quenched-Phosphorescence Detection of Molecular Oxygen. , 193-204 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Huang, C., Becker, M. F., Keto, J. W., Kovar, D. Annealing of nanostructured silver films produced by supersonic deposition of nanoparticles. Journal of Applied Physics. 102 (5), 054308 (2007).
- Foster, K. A., Galeffi, F., Gerich, F. J., Turner, D. A., Müller, M. Optical and pharmacological tools to investigate the role of mitochondria during oxidative stress and neurodegeneration. Progress in Neurobiology. 79 (3), 136-171 (2006).
- Schmidt, C. A., Fisher-Wellman, K. H., Neufer, P. D. From OCR and ECAR to energy: perspectives on the design and interpretation of bioenergetics studies. The Journal of Biological Chemistry. 297 (4), 101140 (2021).
- Stelzer, E. H., Lindek, S. Fundamental reduction of the observation volume in far-field light microscopy by detection orthogonal to the illumination axis: confocal theta microscopy. Optics Communications. 111 (5-6), 536-547 (1994).
- Pitrone, P. G., et al. OpenSPIM: an open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Legant, W. R., et al. High-density three-dimensional localization microscopy across large volumes. Nature Methods. 13 (4), 359-365 (2016).
- von Chamier, L., et al. Democratising deep learning for microscopy with ZeroCostDL4Mic. Nature Communications. 12 (1), 1-18 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유