Method Article
Çok Hücreli Sferoidlerin Uygun Fiyatlı Oksijen Mikroskobu Destekli Biyofabrikasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Protokol, standart bir floresan mikroskobunda oksijenasyonlarının ve hücre ölümlerinin çok parametrik analizini kullanarak biyobaskı için yüksek verimli sferoid üretimini tanımlar. Bu yaklaşım, sferoidlerin yaşayabilirliğini kontrol etmek ve 3D doku, tümör mikroçevresi ve başarılı (mikro) doku biyofabrikasyonunun modellenmesinde önemli olan standardizasyonu gerçekleştirmek için uygulanabilir.
Özet
Çok hücreli sferoidler, doku ve kanser fizyolojisini 3D olarak incelemek için önemli araçlardır ve doku mühendisliğinde biyofabrikasyon için doku montaj birimleri olarak sıklıkla kullanılır. Küresel modelin ana gücü, doku mikro ölçeğindeki fiziksel-kimyasal gradyanları taklit etmek olsa da, sferoidlerin içindeki gerçek fizyolojik ortam (metabolik aktivite, oksijenasyon, hücre ölümü ve proliferasyon dinamikleri dahil) genellikle göz ardı edilir. Aynı zamanda, büyüme ortamı bileşiminin ve oluşum yönteminin ortaya çıkan küresel fenotipler üzerindeki etkileri iyi belgelenmiştir. Bu nedenle, araştırma sonuçlarının tekrarlanabilirliğini ve şeffaflığını sağlamak için sferoid fenotipin karakterizasyonu ve standardizasyonu gereklidir. Ortalama sferoid oksijenasyonun analizi veO2 gradyanlarının üç boyutlu (3D) değeri, metabolik aktivitelerine, genel canlılıklarına ve in vivo doku mikroortamını özetleme potansiyeline işaret eden sferoid fenotip karakterizasyonu için basit ve evrensel bir yol olabilir. 3D oksijenasyonun görselleştirilmesi, ek fizyolojik parametrelerin (hücre ölümü, proliferasyon ve hücre bileşimi gibi) multiparametrik analizi ile kolayca birleştirilebilir ve sürekli oksijenasyon izleme ve / veya son nokta ölçümleri için uygulanabilir. O2 probunun yüklenmesi sferoid oluşum aşamasında gerçekleştirilir ve çeşitli sferoid üretim protokolleri ile uyumludur. Protokol, tanıtılan kırmızı ve yakın kızılötesi yayma oranımetrik floresanO2 nanosensörleri ve biyobaskı öncesi ve sonrası küresel oksijenasyon ve hücre ölümünün çok parametreli değerlendirmesinin tanımı ile yüksek verimli bir küresel üretim yöntemini içerir. Deneysel örnekler, homo- ve hetero-hücresel sferoidlerde ve ayrıca sferoid bazlı biyobaskılı yapılarda karşılaştırmalıO2 gradyanları analizini göstermektedir. Protokol, birden fazla floresan filtreye ve ışık kaynağı olarak ışık yayan bir diyota sahip geleneksel bir floresan mikroskobu ile uyumludur.
Giriş
Moleküler oksijen (O2), hücre ve doku canlılığını, fonksiyonunu ve ölümünü düzenleyen anahtar metabolitlerden biridir. Fizyolojik koşullar altında, lokal doku oksijenasyonu, doku vaskülarizasyonu, kan akışı ve hücre metabolizması tarafından dinamik olarak düzenlenir, bazı durumlardaO2 gradyanlarının, hipoksik mikro çevrenin ve / veya oksidatif stresin oluşumuna yol açar 1,2. Hücreler, O2 gradyanlarını, molekülerO2'nin sinyal fonksiyonuna doğrudan katılımı yoluyla (hipoksi ile indüklenebilir faktör (HIF) aracılı sinyalleme, histon lizin demetilatazlar KDM ve diğer yollarla), hücresel redoks potansiyelindeki değişiklikleri (Nrf2 / Keap1 sinyallemesi veya demir düzenleyici proteinler yoluyla algılayan reaktifO2 türleri) algılar ve daha sonra metabolizmalarını, çoğalmalarını, potens ve farklılaşma3. Bu nedenle, hücre ve doku oksijenasyonunun heterojenliği, gradyanları ve ilişkili fenomenler doku gelişimi ve homeostazda önemli oyunculardır. Farklı dokular ve hücre tipleri genellikle doku O2 mikrogradyanlarına göre konumlandırılmış hücrelerle özel doku mimarisini tanımlayan farklı 'normal' fizyolojikO2 seviyeleri gerektirir4. Bazı hücre tipleri O2 azalmasına duyarlıdır (örneğin, nöronlar, hepatositler, pankreas adacık hücreleri veya kas hücreleri)5,6, diğerleri aşırı hipoksiye dayanabilir ve dikO2 gradyanları oluşturabilir (örneğin, bağırsak ve kolon epitelinde)7. Doku biyomühendisliği ve biyofabrikasyonundaki ilerlemeyle birlikte, mikro agregalarda ve küresel 3D doku yapılarındaO2 nicelleştirmesinin gerekliliği önem kazanmaktadır. Endişelerden biri, sferoid üretim yöntemine ve kültür koşullarına bağlı olan çok hücreli sferoid model fizyolojik parametrelerinin standardizasyonudur8. Ek olarak, fonksiyonel vaskülarizasyondan yoksun mikro dokulardakontrolsüz olarak salınan biyomateryallerin veyaO2 perfüzyonunun kontrolsüz uygulanması, hücreler için toksik olabilir, metabolizmalarının yeniden programlanmasına ve transplantasyon sonrası dönemde sağkalımın azalmasına neden olabilir 9,10. O2 ölçüm yaklaşımının güvenilirliği ve fizyolojik olarak ilgili mikroagregaların verimli kültürüne ulaşmak için oksijenasyon ortamının optimizasyonu, örnek11 olarak kullanılan pluripotent kök hücre kaynaklı karaciğer sferoidlerinin matematiksel modellemesi ile yakın zamanda kanıtlanmıştır. Doku O2 düzeylerinin bilindiği bir diğer alan ise kanser tedavisi 12,13'tür. Heterojen tümör hipoksisi başarılı antikanser tedavisini bozabilir. Hasta tedavisi veya tümör hipoksi modellemesi sırasında kesin oksijenasyon seviyelerinin ölçülmesi ve kontrol edilmesi, bireysel ve kişiselleştirilmiş tedavi stratejilerinin iyileştirilmesine olanak sağlayacaktır14. Bu nedenle, biyofabrikasyon yapılarda ve 3D tümör modellerinde dinamik oksijenasyonun kantitatif olarak izlenmesi, solunum aktivitelerinin, metabolizmalarının fizyolojik analizi ve doku kültürünün, üretim koşullarının optimizasyonu veya hipoksi aracılı terapötik yanıtın temel çalışmaları için önemli bir araçtır.
Bir dizi yöntem, küresel ve mikroagrega doku yapılarında hücre oksijenasyonunun çoklanmış (veya çok parametreli) analizini sağlar. Nörosferler ve tümör sferoidleri15,16,17 ile öncülük eden fosforesans ömür boyu görüntüleme mikroskobu (PLIM) tabanlı yaklaşım, canlı mikrodokularda hücre oksijenasyonunun doğrudan ölçülmesini ve fonksiyonel hücre tiplerinin hücre canlılığı, proliferasyonu veya dağılımı ile korelasyonunun kurulmasını sağlar. Yaklaşımın gücüne rağmen, PLIM mikroskopi yükseltmesi, popüler mikroskopi satıcıları arasında bile yaygın olarak mevcut değildir18,19. Neyse ki, floresan yoğunluğuna dayalı oranmetrik ölçüm modu 15,17,20,21,22,23,24 için çok sayıda hücreye nüfuz eden O2-duyarlı nanopartikül probu da kullanılabilir. Tipik olarak, prob iki emisyon dalga boyu, yani bir floresan mikroskobu, yüksek içerikli tarama görüntüleyicisi veya mikroplaka okuyucu üzerinde ölçülebilenO2'ye duyarlı ve duyarsız (referans) gösterecektir. Bu tür O2-algılayıcı nanopartiküller, biyouyumlu polimerler,O2-algılama ve görünür ve yakın kızılötesi spektrumları kapsayan referans boyalar ile çökeltme tekniği ile üretilebilir veya ticari olarak2,25 satın alınabilir. Kalın 3D mikrodokuların analizi, kırmızıya kaymış floresan boyaların kullanımından fayda sağlayacağından, O 2 algılayıcı PtTPTBPF 26 ve pozitif yüklü bir polimetakrilat bazlı kopolimer içinde emprenye edilmiş referans aza-BODIPY27 boyalarından oluşan oranmetrik O2-algılayıcı nanopartikül probu multi-modal kızılötesi sayı 1 (MMIR1) 28 inşa edilmiştir. Bu tasarımla,O2'ye duyarlı bir sinyal (kızılötesine yakın, uyarma (hariç) = 635 nm, emisyon (em.) = 760 nm; Isens) fosforesans söndürme işlemi yoluyla [O2] konsantrasyonundan etkilenirken, kırmızı referans boya yoğunluğu (exc. = 580 nm, em. = 650 nm; Iref) etkilenmeden kalır (Şekil 1A). Böylece lekeli hücrelerde Iref/Isens oranı (R)O2 kalibrasyonunu22 ile sağlayabilir.
Burada, sferoidlerde ve biyobaskılı yapılarda canlı hücre oksijenasyonunu izlemek için yarı kantitatif bir yaklaşım açıklayarak, son nokta ve kinetik ölçümlerdeO2 gradyanlarının tahmin edilmesine yardımcı oluyoruz. Bu tür O2 görüntüleme, diğer oranmetrikO2 probları (Şekil 1B) ile yapılabilir ve mevcut ışık kaynaklarının ve floresan filtrelerinin sayısına bağlı olarak, canlı / ölü hücreler, mitokondriyal fonksiyon ve diğer hücre tiplerinin izlenmesi hakkında bilgi edinmek için diğer boyalarla birlikte kullanılabilir. Floresan ömür boyu görüntüleme mikroskobu (FLIM) gibi gelişmiş ölçüm modları da kullanılabilir19. Hücre boyama boyalarının veO2'ye duyarlı nanopartiküllerin kullanımıyla ilgili en büyük zorluk, boyama protokolünün optimizasyonudur. MMIR1 probu ve ilgili nanopartiküller söz konusu olduğunda, hücreler küresel oluşum sürecinde ya önceden boyanır ya da birlikte inkübe edilir. Tarif edilen protokolde, O2 prob boyalı sferoidler, düşük yapışkan agaroz yüzeyi 29,30,31,32 (Şekil 1C) üzerinde üretildi ve bu da daha sonra sferoid bazlı biyobaskı veO2 ve hücre ölümünün çok parametreli analizini mümkün kıldı. Yaklaşımın uygulanabilirliğini göstermek için, homo- veya hetero-sellüler (insan göbek damarı endotel hücreleri, HUVEC'in eklenmesiyle oluşan) insan diş pulpası kök hücre (hDPSC) sferoidlerindeki oksijenasyon seviyeleri, geleneksel floresan mikroskobu kullanılarak biyobaskı öncesi ve sonrası karşılaştırılmıştır.
Protokol
1. EntegreO2'ye duyarlı prob ile yüksek verimli sferoidlerin üretimi
- Mikro desenli agaroz kaplı doku kültür plakasının hazırlanması
NOT: Mikro desenli agaroz kaplı doku kültürü plakaları, çoklu deneysel replikasyonların veya büyük küresel sayıların gerekli olduğu biyobaskı ve diğer uygulamalar için çok sayıda sferoidin (PDMS damgası başına 1585, Malzeme Tablosuna bakınız) eşzamanlı olarak üretilmesi için kullanılır.- Tüm steril malzemeleri ve aletleri (spatula ve cımbız) mümkün olduğunca otoklavlama veya filtre sterilizasyonu ile hazırlayın. Geri dönüştürülebilir PDMS pulları33'ü agarozdan temizleyin ve% 70 etanol içinde aseptik olarak saklayın. Bunu sferoid üretimden en az 1 gün önce yapın.
- Mikro desenli PDMS damgalarını bir saklama şişesinden steril bir Petri kabına aktarın ve pürüzsüz yüzeyi steril laminer hava akımı koşulları altında 10 dakika boyunca hava ile kurutun.
- Her damgayı, 12 delikli steril doku kültürü plakasının kuyusunun ortasına mikro desenli bir yüzeye (ve pürüzsüz bir yüzeye sahip) yerleştirin. Açık kapakla 1-2 dakika hava ile kurutun.
NOT: Fazla sıvının buharlaştırılması son derece önemlidir, çünkü sadece kuru pullar plastik yüzeye mükemmel bir şekilde yapışır ve işlem sırasında bağlı kalır. - 1,5 g agarozu temiz bir 200 mL cam şişeye tartın, 50 mL steril damıtılmış su ekleyin, bir kapakla örtün ve 50 mL% 3 homojen agaroz çözeltisi yapmak için bir mikrodalgada eritin.
DİKKAT: Agaroz çözeltisi aşırı sıcaktır ve dikkatle kullanılmalıdır. Eritme işleminden hemen sonra çalkalanırsa, sıcak agaroz çözeltisi köpürmeye başlayabilir ve damardan patlayabilir. Ara sıra travmalardan kaçınmak için, agaroz çözeltisi ile hacmin maksimum% 50'si ile doldurulmuş yeterince büyük damarlar kullanın. - Steril bir serolojik pipet kullanarak, yerleştirilen PDMS damgasını tamamen örtmek için 12 delikli hücre kültürü plakalarının her bir kuyucuğuna hemen ~ 2 mL sıcak agaroz çözeltisi ekleyin. Plaka kapağı açıkken steril hava akımının altında inkübe ederek agarozu 20 dakika katılaşması için bırakın.
NOT: PDMS damgasının çıkarılmasından sonra agaroz mikrokuyucuklarının bütünlüğünü sağlamak için agaroz tabakası PDMS damgasından en az iki kat daha kalın olmalıdır (Şekil 1C). - Steril küçük bir spatula kullanarak, pürüzsüz damga yüzeyini yukarı kaldırmak için gömülü PDMS damgası ile agarozu her bir kuyucukta baş aşağı doğru bir şekilde çevirin. Damganın pürüzsüz üst tarafına ~ 200 μL steril su ekleyin, agarozdan bir spatula ile yavaşça ayırın ve kuyudan çıkarın. Mikro kuyucuklara zarar vermekten kaçının.
- Doğrudan kullanım için agaroz pullarına 1 mL'lik karşılık gelen steril hücre kültürü ortamı ekleyin. Plakayı kapakla örtün ve gece boyunca 4 ° C'de inkübe edin. Uzun süreli depolama için PBS çözeltisini (orta yerine) kullanın (4 °C'de 2 haftaya kadar). Agarozun kurumasına izin vermeyin. Kullanmadan önce, agaroz mikro desenli plakaları bir CO2 inkübatöründe 37 ° C'de 1 saat ısıtın.
NOT: Agaroz mikro kuyularından hava kabarcıklarını dengelemek ve çıkarmak için inkübasyon gereklidir. Protokol adım 1.2 ile devam edin.
- Hazırlık O2 prob yüklü sferoidler
- Sırasıyla hDPSC ve HUVEC hücre hatlarının yetiştirilmesi için %10 fetal sığır serumu (FBS) ile desteklenmiş α-minimal esansiyel ortam (MEM) ve endotel hücre büyüme ortamı 2 ile desteklenmiş büyüme faktörleri kullanın. 1:1 oranında HUVEC ve hDPSC büyüme ortamı ekleyerek hDPSC / HUVEC heterosellüler sferoid büyüme ortamı hazırlayın.
- % 70-90 oranında akıcı hücre kültürü hazırlayın (~ 3-4 günlük hazırlık). Heterosellüler sferoidlerin üretimi için sırasıyla hDPSC ve HUVEC kültürlerini hazırlayın.
NOT: HUVEC ve hDPSC'nin geçiş numarası 8'i geçmemelidir. Hücre kültürlerinin hızlı büyümesini sağlamak için, her 3 ila 4 günde bir yeni bir şişe kullanılarak toplam hücre kültürünün 1 / 3'ünde (% 70 -% 80 akıcılıkta) bölünür. - Önceden ısıtılmış (37 ° C) PBS (75cm2 şişe başına 10 mL) ile% 70-90 birleşik hücre kültürünü durulayın. Ayrıştırıcı enzim çözeltisi (% 0.05 tripsin ve 1 mM EDTA; 75cm2 şişe başına 1 mL) ekleyin ve% 5 CO 2'de% 5 CO2'de,% 95 nemde 3-5 dakika boyunca inkübe edin ve mikroskop altında hücre ayrılmalarını kontrol edin. Bir kez yapıldıktan sonra, tripsini% 10 FBS içeren tam hücre kültürü ortamı ile nötralize edin (1 mL ayrışma çözeltisi başına 5 mL medya).
NOT: Hücrelerin ayrışan enzim çözeltisine aşırı maruz kalmasını önleyin, çünkü bu onların yaşayabilirliğini etkileyebilir. - Düşük bir FBS ortamında kültürlenen HUVEC için, tripsin ile muamele edilen hücre kültürüne 0.5 mL% 100 FBS ekleyerek tripsin nötralizasyonu gerçekleştirin, ardından hücreleri büyüme ortamlarına aktarmak için santrifüjleme yapın.
NOT: Elde edilen hücre süspansiyonları 1 mL başına ~ 1 milyon hücre içermelidir. Gerekirse, hücre süspansiyonunu konsantre etmek için protokole ek bir santrifüjleme adımı eklenebilir. - Tek hücreli süspansiyon elde etmek için 10 mL'lik serolojik pipetin üstünde 1000 μL'lik pipet ucu kullanarak pipetleme yaparak hücre agregalarını ayrıştırın. Hücre süspansiyonunun 1 mL'si başına hücre sayısını saymak için bir sayım odası (Neubauer tipi hemositometre veya alternatifleri) kullanın34. Hücre süspansiyonunu mL başına 500.000 hücreye seyreltin. 1: 1 sferoid oranındaki heterosellüler hDPSC / HUVEC için, mL başına 500.000 hücrelik bir nihai hücre konsantrasyonuna sahip olmak için eşit hacimlerde karşılık gelen hücre süspansiyonları ekleyin.
NOT: Mikro desenli bir agaroz damgasına eklenen süspansiyondaki hücre konsantrasyonunun değişimi, bir agaroz damgasının mikrokuyusu başına bir hücre sayısına bağlı olarak, üretilen sferoidlerin ortalama boyutunun değiştirilmesine izin verir. Tarif edilen kurulumda, ~ 300 hücreli sferoidler, 1585 mikrokuyucuklu bir agaroz damgası üzerinde 500.000 hücre içeren 1 mL'den üretilir. - Hazırlanan hücre süspansiyonuna konsantreO2 probu (nanopartiküller, 1 mg / mL stok) çözeltisini 5 μg / mL'lik bir son konsantrasyona ekleyin.
NOT:O2 algılayıcı nanopartiküllerin varlığında sferoid oluşumu, en az 5 gün boyunca korunan verimli boyama sağlar (Şekil 1D). Buna karşılık, önceden oluşturulmuş çok hücreli sferoidlerin nanopartiküllerle boyanması daha az verimli olacaktır15. - Hazırlanan hücre süspansiyonunun 1 mL'si (5 μg / mLO2 probu ile 1 mL başına 500.000 hücre) için 12 kuyucuklu agaroz kaplı hücre kültürü plakalarının mikro desenli bir kuyusunda (bkz. adım 1.1.7) 1 mL eski ortamı değiştirin. Sferoid oluşumu vesıkıştırması sırasında yüklenmesini sağlamak için O2 probunun sürekli varlığında CO 2 inkübatöründesferoidleri 2-5 gün boyunca kültürleyin.
NOT: Küresel kültürde aşırı orta buharlaşmadan kaçının. Gerekirse, dikkatli bir şekilde (mikro kuyucuklardaki sferoidleri rahatsız etmeyin), ek O2 probu seyreltmesi ile 0.2-0.5 mL kültür ortamı ekleyin. - Küresel oluşumdan sonra, büyüme ortamını prob olmadan taze bir taneyle değiştirin. Prob boyaması, üretilen sferoidlerde 7-14 gün veya daha uzun süre korunacak ve sferoidlerdeki sinyallerinin uzun süreli izlenmesine izin verecektir.
2. Spheroids biyo-baskı
NOT: Sferoidler, metakrilamit modifiye jelatin (GelMA) bazlı bir biyomürekkep içinde biyo-baskılıdır. Aşağıda biyomürekkep bileşenlerinin, biyomürekkep hazırlama prosedürünün ve biyobaskının bir açıklaması bulunmaktadır.
- Biyomürekkep hazırlama
- Aşağıdaki gibi laminer hava akışı 35 altında ortamda% 10'luk (w / v) bir GelMA çözeltisi (2 mL) hazırlayın: 15 mL'lik bir tüpte 78 ikame derecesi ile 0.2 g steril GelMA'yı tartın, 1.9 mL α-MEM ekleyin ve37 ° C'de (~ 2 saat) döner bir çalkalayıcı üzerinde karıştırarak çözünmesine izin verin.
NOT: Tam miktarda ortam eklemeyin, çünkü sferoidler ve foto-başlatıcı Li-TPO-L gibi diğer bileşikler daha sonra eklenecektir. - Mikro desenli kuyucuklardaki sferoidleri pipetle yeniden askıya alın ve 15 mL'lik bir tüpte toplayın. Tüm sferoidlerin agaroz mikrokuyularından toplandığından emin olmak için PBS ile ek bir durulama işlemi gerçekleştirin. Agaroz mikrokuyularına dokunmaktan / zarar vermekten kaçının, çünkü agaroz pulları biyobaskı sırasında iğneyi tıkayabilir.
- 20 ° C'de 5 dakika boyunca 300 x g'de 15 mL'lik bir tüpte santrifüjleme yoluyla sferoidleri toplayın. Süpernatantı bir pipetle aspire edin, sferoidlere 50 μL orta ekleyin ve nazik pipetleme ile onları yeniden askıya alın.
- Seroid karışımı ılık GelMA çözeltisine ekleyin ve nazik pipetleme ile karıştırın. Biyobaskı için sferoid konsantrasyonunu mL biyomürekkep başına 6340-12860 sferoidlere (4-8 mikrodesenden) kadar koruyun. Baskı iğnesinin kolayca tıkanmasına neden olduğu için daha yüksek sferoid konsantrasyonlarından kaçının.
- Filtreyle sterilize edilmiş foto-başlatıcı Li-TPO-L stok çözeltisini (32 mg/mL) çift bağ sayısına göre %2 mollük son konsantrasyonda ekleyin ve36,37 numaralı hafif pipetle karıştırın.
NOT: Li-TPO-L miktarı denkleme göre hesaplanabilir:
Fotobaşlatıcı hacmi (PI) = (0.000385 mol NH 2- grupları / g GelMA x 294.10 g Li-TPO-L / mol x 0.78 x 0.02) / 0.032 g Li-TPO-L / mL x0.2 g GelMA = 0.0107 mL Li-TPO-L stok
- Aşağıdaki gibi laminer hava akışı 35 altında ortamda% 10'luk (w / v) bir GelMA çözeltisi (2 mL) hazırlayın: 15 mL'lik bir tüpte 78 ikame derecesi ile 0.2 g steril GelMA'yı tartın, 1.9 mL α-MEM ekleyin ve37 ° C'de (~ 2 saat) döner bir çalkalayıcı üzerinde karıştırarak çözünmesine izin verin.
- Biyobaskı prosedürü
- CAD'de iskele tasarımı için Ek Protokol 1'deki adımlara bakın. Tasarımın biyolojik baskısını almak için aşağıdaki adımları izleyin.
- Steril 3 cc'lik kartuşun ucunu uç kapağıyla (luer kilidi) kapatın ve pipetle çekerek biomürekkeple doldurun. Kartuşa bir piston takın. Kartuşu baş aşağı tutun ve uç kapağını çıkarın, kartuştaki tüm hava giderilene kadar pistonu biyomürekkebe doğru itin.
NOT: GelMA biyomürekkebi ile kartuşun kenarları arasındaki temastan kaçının, çünkü bu, biyomürekkebin jelleşmesi nedeniyle pistonun hareketini engelleyebilir. - Biyomürekkebin biyoyazıcının ısıtma mantosunda 23 °C'de (20-30 dk) soğumasını bekleyin. Kartuşun üstündeki basınç adaptörünü vidalayın. Biyomürekkebin sızmasını önlemek için giriş tüpü üzerindeki klipsi kapatın, kartuşa 22 G konik PE iğne takın. İğne boyutunu ve çapını iskele tasarımına ve küresel çap ve konsantrasyona uyarlayın.
NOT: Kirlenmeyi önlemek için ağız maskesi ve püskürtülmüş eldiven takın. - Biyoyazıcıya %70 etanol püskürtün ve emici kağıtla kurulayın. Kartuşu, ekstrüzyon bazlı yazıcı kafasındaki ısıtma mantosuna takın. Basınç girişini takın ve girişteki klipsi açın. Tasarımınızın G kodu dosyasını baskı yazılımına yükleyin.
- İğne uzunluğu ölçümüne başlayın. Steril bir Petri kabına biraz biyomürekkep dağıtarak baskı basıncını düzenleyin. 0.025-0.045 MPa'lık bir baskı basıncı, GelMA bazlı biyoinkler38'i yazdırmak için tipiktir.
- 6 delikli bir plaka takın, kuyu plakasını açın, davlumbazın kapağını kapatın ve yazdırmaya başlayın. Baskıdan sonra, iskelelerin 5 ° C'de 10 dakika boyunca fiziksel olarak çapraz bağlanmasına izin verin ve basılı iskeleleri UV LED lamba ile 60 s ışınlayın (üreticiye göre 365 nm; 500 mW).
NOT: UV çapraz bağlama süresi, UV ışığının özelliklerine, foto-başlatıcı tipine ve konsantrasyonuna, istenen iskele çapraz bağlama derecesine, şişmeye ve elastikiyet modülüne bağlıdır. - Hemen 100 U/mL penisilin ve 100 μg/mL streptomisin (P/S) içeren ilgili büyüme ortamını biyobaskılı ızgaralara sahip tüm kuyucuklara ekleyin (6 delikli hücre kültürü plakasının kuyuğu başına 2 mL).
- Mikroskopiye başlayana kadar 37 °C CO2 inkübatörde kültür. Biyobaskılı yapı mikroskobu için, basılı bir waffle ızgarasını mikroskopi kabına aktarın, görüntüleme ortamıyla örtün ve 3.2 ve 3.3 numaralı adımlarla devam edin.
NOT: Yüzer biyobaskılı yapılar söz konusu olduğunda, hücre canlılığı üzerinde bir etkisi olmadan, örneğin sitouyumlu yapıştırıcı ile mikroskopi kabına sabitlenmeleri gerekir. Ters mikroskop aktarımı için, biyoprint mikroskopi cam tabanlı bir kaba ve numunenin istenmeyen şekilde yüzmesini önlemek için bir görüntüleme ortamı (~ 200-500 μL, görüntüleme ortamı bileşimi için adım 3.1'e ilişkin Not'a bakın) ile örtün. Ek floresan problarla boyama, biyobaskılı yapıların mikroskopi kaplarına aktarılmasından önce hücre kültürü kabında yapılabilir (bkz. adım 3.1.6).
3. Biyofabrikasyon dokuda sferoid oksijenasyonun oranmetrik floresan canlı mikroskopisi
NOT:O2 probunun oranmetrik yoğunluk tepkisini (R) gerçek hipoksi seviyelerine dönüştürmek için, prob yanıtının24'te açıklanan prosedürler kullanılarak kalibre edilmesi gerekir. Bununla birlikte, oranmetrik kalibrasyon cihaza özgü olduğundan ve T/O2/CO2 kontrollü bir inkübatörün kurulmasını gerektirdiğinden (her zaman mevcut değildir), yarı kantitatif oran tespitinin kullanılması tercih edilen seçenektir.
- Canlı görüntüleme analizi için sferoidlerin hazırlanması
- Bu adımda sferoid ataşman için, steril mikroskopi kaplarını kollajen IV ve / veya poli-D-lizin ile önceden kaplayın veya ticari olarak temin edilebilenleri kullanın39. Mikroskopi bulaşıklarının çalışma mesafesi ve mikroskopunuzun amacının diğer özellikleri ile uyumluluğunu kontrol edin.
NOT: Çok parametreli görüntüleme durumunda, tüm ek boyama prosedürleri, hücreleri buharlaşmadan, ozmotik şoktan veya diğer streslerden koruyan yeterli miktarda ortam içeren kültür plakası tabaklarında yapılmalıdır. Kullanmadan önce görüntüleme ortamını hazırlayın ve ısıtın: DMEM, sodyum bikarbonat (1.2 g / L), HEPES-Na, pH 7.2 (10 mM), sodyum piruvat (1 mM), L-glutamin (2 mM) ve glikoz (5 mM) ile desteklenmiş, fenol kırmızısı olmadan. - 1 mL'lik bir pipet kullanarak, O2 probunda önceden boyanmış sferoidleri agaroz mikro kuyularından nazikçe yıkayın. Küreseller hala medyada yüzerken, onları 15 mL'lik bir konik alt tüpe aktarın.
- Tüm sferoidlerin mikro desenli bir kuyudan toplanmasını sağlamak için, kuyuyu ek 1 mL kültür ortamı ile 1 ila 3 kez durulayın ve tüm küresel süspansiyonları tek bir şişede birleştirin. Şişeyi 10 dakikaya kadar dikey bir konumda bırakın, böylece sferoidlerin görünür bir pelet oluşturarak şişenin dibine yerleşmesine izin verin.
- Medyayı tüpten dikkatlice çıkarın ve sferoidleri rahatsız etmeden bırakın. Bunları, mikroskopi numune kabı başına en az 20 sferoid için yeterli olacak taze kültür ortamı miktarında nazikçe askıya alın. Bu, kültür ortamının kullanımını en aza indirecek ve görüntüleme sırasında sferoidlerin yerini belirlemeyi kolaylaştıracaktır.
NOT: Kapak camına tutturulmuş μ odacıklı 12 delikli plakanın otoklavlanabilir silikon kısmını (bkz. Malzeme Tablosu) kuyu başına maksimum ortam hacmine sahip mikroskopi numune kabı (24 x 60 mm, kalınlık #1) olarak kullanın. Bu kültür odasının silikon kısmı, tabağa yapıştırıldığında sterilize edilebilir ve diğer plastik ve cam yüzeylerle tekrar kullanılabilir. - Hemen her mikroskopi kabına / kuyusuna eşit miktarda sferoid süspansiyon ekleyin. Sferoidleri, mikroskopi kabının yüzeyine tutturmak için bir CO2 inkübatöründe 37 ° C'de 1 saat bekletin. Oksijenasyon analizi için diğer boyaların kullanımı ile birleştiğinde adım 3.1.6 ile devam edin. Basit oksijenasyon analizi için adım 3.1.7 ile devam edin.
NOT: Yetersiz inkübasyon süresi (<1 saat), ortam değişimi sırasında ara sıra küresel sferoidin çıkarılmasına ve kaybolmasına neden olarak denemenizi iptal edebilir. Aynı zamanda, aşırı inkübasyon (>3 saat), hücrelerin sferoidlerden mikroskopi kabı yüzeyine göçü ve gerçek zamanlı oksijenasyonlarını etkilemesi nedeniyle 3D organizasyonlarının kısmen veya tamamen kaybına yol açabilir. - (isteğe bağlı) Ortamı, boyama konsantrasyonuna seyreltilmiş floresan prob (lar) içeren bir prob (lar) ile dikkatlice değiştirin ve optimum yoğunluğa ulaşmak için 1 saat daha inkübasyona devam edin. Medya değişimi sırasında sferoidlerin çıkarılmasını önlemek için, ortamı mikroskopi kaplarının kenarlarından 200 μL'lik bir pipetle dikkatlice aspire edin ve mikroskopi kabında yana doğru orta ilave uygulayın. Adım 3.1.7 ile devam edin.
NOT: Çok hücreli agregalarda zayıf difüzyona sahip problarla etkili boyama için, yükleme konsantrasyonunu ve/veya süresini uzatın. Kullanmadan önce, ön deneylerde isteğe bağlı prob yükleme parametrelerini belirleyin. - Ortamı mikroskopi kabından çıkarın ve görüntüleme ortamıyla bir kez durulayın. Numuneye tam görüntüleme ortamı miktarını ekleyin (örneğin, 12 delikli bir kültür plakasının μ odacığının mikrokuyusu başına 300 μL). Adım 3.2 ile devam edin.
- Bu adımda sferoid ataşman için, steril mikroskopi kaplarını kollajen IV ve / veya poli-D-lizin ile önceden kaplayın veya ticari olarak temin edilebilenleri kullanın39. Mikroskopi bulaşıklarının çalışma mesafesi ve mikroskopunuzun amacının diğer özellikleri ile uyumluluğunu kontrol edin.
- Görüntü alma
- Isınmak ve ölçüm koşullarına (sıcaklık, farklı O2 değerleri,% 5 CO2, gerekirse nem) dengelenmek için görüntülemeden 30 dakika önce mikroskopu ve bağlı cihazları (yani, uyarma ışık kaynağı, kamera, bilgisayar, inkübatör ve diğer çalışma elektronik blokları) açın. Tam mikroskop kurulumuyla birlikte verilen mikroskopi işletim yazılımını başlatın.
NOT: Açıklanan protokol CellSens Dimension yazılımı v.3 için uyarlanmıştır. - Seçilen floresan (veya fosforesan) problar için uygun uyarma (kaynak, güç) ve emisyon filtrelerini ve maruz kalma süresini seçin. Çok parametreli, 3D ve hızlandırılmış mikroskopi analizleri için, işletim mikroskobu yazılımında otomatik ölçüm sırası protokollerini yazın.
- Ön deneylerde her prob, deneysel model ve hücre hattı için en uygun görüntüleme ayarlarını ampirik olarak belirleyin. Ayarların referans (I ref) ve O2 algılama (Isens) kanallarında minimum fotobeyazlatma ve özellikle 3D ve hızlandırılmış ölçüm deneylerinde yoğunluk oranı (R = Iref / Isens) üzerinde minimum etkiye sahip olduğundan emin olun.
- Mikroskopi kabını mikroskopi aşamasında lekeli sferoidlerle ayarlayın. Düşük büyütme hedefini kullanarak, numuneyi iletim ışığında önizleyin, sferoidlere ön odaklanma yapın ve bunları görüntünün merkezine yerleştirin.
NOT: Standart 4x ila 10x büyütmeli hava hedefleri ön odaklama için yeterli olurken, gerçek ölçüm için, çanağa bağlı sferoidler için yeterli çalışma mesafesine sahip 0,6 veya daha yüksek sayısal diyafram açıklığına (NA) sahip (hava veya suya daldırma) hedeflerle 20x ila 40x öneririz. - Hedefi gerekli yüksek büyütme ile çalışma pozisyonuna getirin. Küreselin orta (ekvatoral) kesitindeki iletim ışık moduna odaklanın. 3B nesnelerde oksijenasyon doğrudan görüntüleme bölümünün derinliğine bağlıdır. Bunu sağlamak için, gruplar içindeki ve arasındaki benzer kesitleri, örneğin sferoidlerin orta ve üst/alt kesitlerini analiz edin.
NOT:O2 gradyanlarının ayrıntılı ve hassas analizi ve yeniden yapılandırılması için, konfokal, ışık tabakası veya iki fotonlu (en iyi seçenek) mikroskopları kullanarak Z-yığınlarını taramanızı ve üretmenizi öneririz. Tüm kesitlerden gelen sinyalin aynı anda toplanacağı geleneksel geniş alan mikroskobu için,O2 gradyanlarının kesin bir analizi yerine orta kesit ile ortalama bir tahmin yapılabilir. Bu durumda, orta kesit, sferoidlerin sınırlarına keskin bir odaklanma ile maksimum çapa sahip olduğu bir odak kesiti olarak tanımlanır. - Multiparametrik görüntüleme için uygulananO2 probunun ve diğer floresan problarının referans ve hassas spektral kanallarının floresan/fosforesans sinyallerinin toplanması için ayarları yapın.
- Kantitatif yoğunluğa dayalı karşılaştırma için, gruplar halinde ölçülen tüm nesneler için pozlama süresi, uyarma ışık kaynağı gücü, çözünürlük, tarama hızı ve iğne deliği boyutunun aynı seçilmiş görüntüleme ayarlarını uygulayın.
NOT: Satıcı tarafından sağlanan birçok mikroskopi yazılımı sürümü, yoğunluk oranının otomatik olarak hesaplanmasını sağlar. Burada kullanılan görüntüleme yazılımındaki deney yöneticisinde görüntüleme elde etme programını yazarken,O2 probunun referans ve hassas kanallarının yoğunluk ölçümlerine fonksiyon birleştirme uygulayın. - O2 probunun referans ve hassas spektral kanalları ve gerekirse ek floresan kanalları için aynı optik bölümden görüntüler toplayın. Bu protokol için, kırmızı referanslı (ör. = 580 nm, em. = 650 nm) ve yakın kızılötesiO2'ye duyarlı (ör. =635 nm, em. = 760 nm) spektrumlu MMIR1 probu kullanın.
- İstatistiksel çözümleme için yeterli sayıda veri noktası toplamak üzere 3.2.5-3.2.8 arasındaki adımları yineleyin. Farklı ilaçlar, mitokondriyal uncoupler veya elektron taşıma zinciri inhibitörleri ve diğer hızlı etkili bileşiklerle tedavi üzerine hızla gelişen hücresel yanıtların dinamik analizi için, hızlandırılmış ölçüm modunu kullanın (adım 3.2.10).
- Ölçümleri, numunenin periyodik olarak aydınlatılmasıyla 37 °C'de görüntüleme ortamında gerçekleştirin ve ilgilenilen floroforların sinyallerini toplayın (örneğin,O2 prob referans ve algılama kanalları), örneğin 2 dakikadan fazla bir süre boyunca her 10 sn'de.
- Görüntüleme sırasında odak kayması olmadığından emin olmak için periyodik ölçüm yapıldıktan sonra her küresel için bir odak kontrolü yapın. Gerekirse tekrarlayın. Veri analizi için adım 3.3 ile devam edin.
NOT: Hücre stimülasyonu ve ilaç ilavesi olmadan, referans boyaya kıyasla, örneğin floresein, kalsein yeşili veya tetrametilrodamin metil ester gibi fotostabiliteyi değerlendirmek için hızlandırılmış ölçüm yapılabilir.
- Isınmak ve ölçüm koşullarına (sıcaklık, farklı O2 değerleri,% 5 CO2, gerekirse nem) dengelenmek için görüntülemeden 30 dakika önce mikroskopu ve bağlı cihazları (yani, uyarma ışık kaynağı, kamera, bilgisayar, inkübatör ve diğer çalışma elektronik blokları) açın. Tam mikroskop kurulumuyla birlikte verilen mikroskopi işletim yazılımını başlatın.
- Görüntü sunumu
NOT: Burada O'nun otomatik olarak nasıl hesaplanacağını açıklıyoruz2 görüntüleme yazılımındaki oran analizi işlevini kullanarak sferoidlerde prob yoğunluk oranı (R) ve sferoid mikroskopi bölümünün yanlış renkli R dağılım görüntülerini oluşturmak için piksel piksel R hesaplaması uygulayın. R ayrıca, küresel görüntünün aynı ilgi bölgesinden (ROI) toplanan referans ve hassas spektral kanalların yoğunluk verilerinden, basit R = I formülü uygulanarak manuel olarak hesaplanabilir.Ref/Isens24,34. İlgili mikroskopi yazılımında ham görüntüden yoğunluk verilerini çıkarmak mümkün değilse, yoğunluk verileri ImageJ veya Fiji gibi programlar kullanılarak elde edilebilir (bkz.- Birleştirilmiş modda yapılan referans ve hassas spektral kanallardan O2 prob yoğunluk verilerini içeren .vsi dosyasını açın. Hesaplama menüsünden oran analizi işlev penceresini açın. Referans kanalının yoğunluğunu pay olarak ve hassas kanalın yoğunluğunu R hesaplaması için payda olarak seçin.
NOT: R'yi hesaplamak için referans ve hassas sinyallerin ters oranı da mümkündür, ancak bu durumda R,O2'deki artışla birlikte azalacaktır. - Arka planı birleştirilmiş yoğunluk görüntüsünden çıkarmak için her spektral kanala karşılık gelen yoğunluk eşiği ayarlarını uygulayın. Görüntü arka planı eşit şekilde siyah olana kadar eşik değerlerini artırmaya devam edin. Eşik parametresini, karşılaştırmalı analizde kullanılan veri kümesindeki tüm küresel görüntülere eşit olarak uygulayın.
NOT: Sferoidlerin önceden hesaplanan yanlış renkli R görüntüsünü gözlemleyerek eşik ayarlarını en iyi duruma getirmek için önizleme penceresini kullanın. Yoğunluğu eşik alanındaki geçerli değerden daha düşük olan tüm pikseller R analizinden kaldırılır ve siyah noktalar olarak sunulur. Eşik uygulamasından sonra sadece sferoid floresana karşılık gelen alan görselleştirilmelidir. Bağımsız spektral kanalların ortalama arka plan yoğunluğunun (sferoidsiz alanlar) ön tahmini, görüntüye uygun bir eşik seçimini basitleştirir. Ek olarak, karşılık gelen iletim ışığı küresel görüntüsünden birleştirilmiş floresan görüntüsüne tanımlanan küresel ROI sınırlarının uygulanması, arka plan dışı sinyal yoğunluklarının aşırı çıkarılmasını önlemek için eşik parametrelerinin doğru bir şekilde belirlenmesine yardımcı olur. - Arka plan eşik uygulamasıyla zaten çıkarıldığından, pay ve payda yoğunlukları için arka plan ayarlarını 0'da tutun.
- Önizleme görüntüsü R gradyanının istenen çözünürlüğünü sağlayana kadar ölçekleme faktörünü (Ölçek) oran görüntüsüne ayarlayın. Ölçekleme parametresini, karşılaştırmalı analizde kullanılan veri kümesindeki tüm küresel görüntülere eşit olarak uygulayın.
NOT: Ölçekleme parametresi, R görüntüsünün mümkün olduğunca fazla bilgi içerdiğinden ve R sayısal verileri için bir çözünürlük faktörü olarak görülebildiğinden emin olmak için yeterince büyük (en az 1.000) olmalıdır. - Ayarlanan parametreleri küresel görüntüye Uygula düğmesine basarak uygulayın. Araç pencereleri menüsünden ekranı ayarla penceresinde görüntünün parlaklığını ve karşıtlığını ayarlayın.
- Görüntüyü Ayarla penceresindeki sabit ölçeklendirme seçeneğini kullanarak bir oran dağılımı histogramının bağlama ve bağlantıyı kaldırma sınırlarını el ile belirleyin. Bu, R parametre sunumu için yanlış renk çubuğunun aralığını belirler.
NOT: Farklı gruplar arasında küresel görüntüleri karşılaştırmak için, tüm analitik numuneler için benzer bir renk çubuğu aralığı tutmak önemlidir. R parametresindeki değişikliklerin aralığı gruplar arasında farklılık gösterebileceğinden, seçilen yanlış renk çubuğu aralığı tüm analitik gruplardaki dağılım histogramları için evrensel olmalıdır. - Sferoidler genellikle ideal olarak küresel değildir, küresel çapın, sferoidin merkezinden (genellikle hipoksik bir çekirdek) çizilen en uzun çizgi olduğunu varsayalım. Ölçü menüsünden doğrusal cetvel fonksiyonunu kullanarak, küresel çapı belirleyin. Verileri elektronik tablo dosyası olarak dışa aktarın.
- Gerekli boyuttaki (mümkün olduğunca küçük) ve şeklin (örneğin, yuvarlak) yatırım getirisini seçin ve sferoidin çevresine ve hipoksik çekirdeğine uygulayın. Seçilen yatırım getirisinin içindeki ortalama R'yi (çevresel R-Rp ve çekirdek R-Rc) analiz etmek için yatırım getirisini ölçüm nesnesine dönüştürün. Verileri elektronik tablo uyumlu tablo biçiminde dışa aktarın.
NOT: Sferoidler grup arasında aynıO2 dağılımına sahip değildir ve hipoksik çekirdekler küresel merkezlerle mükemmel bir şekilde birlikte lokalize olmaz. Analizi basitleştirmek ve standartlaştırmak için, en hipoksik alanların sferoidin merkezindeki ideal çekirdeğe karşılık geldiğini varsayıyoruz. Bubölgelerde ölçülen R C,O2 gradyan aralığı (R p-R c) ve diklik (Rp-R c) / r hesaplamaları için uygulanır; burada r (ideal olarak, periferik ve hipoksik çekirdek ROI'leri arasındaki mesafe), çap ölçümlerinden hesaplanan μm cinsinden sferoidin yaklaşık bir yarıçapıdır. İsteğe bağlı olarak, küreselO2 gradyanları, küresel çap boyunca yapılan R parametre değişiminin (ölçü menüsündeki çizgi profili penceresi) doğrusal çizgi profilleri olarak sunulabilir. Bu veriler elektronik tablo dosyası olarak da dışa aktarılabilir. - Daha fazla hesaplama ve istatistiksel karşılaştırma yapmak için sferoid çapların, Rc ve Rp'nin veri setini elde etmek için sferoidlerin her mikroskopi bölümüne ölçümler uygulayın. Tüm verileri tek bir elektronik tablo dosyasında birleştirin.
- Fotobeyazlatmanın veya farklı uyaranlara verilen dinamik tepkilerin hızlandırılmış analizi için, seçilen YG'yi bir kümedeki her görüntüde aynı koordinatlara uygulayın. R parametrelerini karşılaştırmak için, bunları hızlandırılmış görüntü kümesindeki ilk döngünün R'sinden bir yüzde olarak sunun.
- Fotobeyazlatma analizi için, her hızlandırılmış döngü için ortalama R'yi yüzde olarak hesaplamak ve değişiklikleri izlemek için birkaç ROI'den R kullanın.
- 12 döngü sürekli aydınlatmadan sonra başlangıç yoğunluğunda% 5'ten daha az bir azalma varsa, fotobeyazlatma etkisinin kritik olmadığını varsayalım. Oranmetrik hızlandırılmış yanıtın önemini sağlamak için dinamik değişiklikleri her zaman bir kontrol olarak fotobeyazlatma eğrisiyle karşılaştırın (bkz. Şekil 2A,B).
- Elde edilen parametrelerden, bir veri kümesindeki bireysel sferoidler için r, (R p-R c) ve (R p-R c) / r hesaplayın. Kolmogorov-Smirnov veya ilgili testlerle veri dağılımının normalliğini analiz edin. Veri analizi için uygun istatistiksel yöntemi seçin ve veri sunum rakamlarıyla devam edin.
NOT: Burada sunulan veriler normal olarak dağıtılmıştır ve küresel gruplar arasında istatistiksel karşılaştırma için p = 0.05'te bağımsız bir t-testi uygulanmıştır.
- Birleştirilmiş modda yapılan referans ve hassas spektral kanallardan O2 prob yoğunluk verilerini içeren .vsi dosyasını açın. Hesaplama menüsünden oran analizi işlev penceresini açın. Referans kanalının yoğunluğunu pay olarak ve hassas kanalın yoğunluğunu R hesaplaması için payda olarak seçin.
Sonuçlar
Mikrodesenli agaroz yöntemi kullanılarakO2 probu önceden boyanmış sferoidlerin yüksek verimli üretimi, önceden boyanmış sferoidler olmadan ve onlarla birlikte agaroz mikrokuyularının örneklerini gösteren Şekil 1C'de şematik olarak gösterilmiştir. Küresel oluşumun agaroz kaplama üzerindeki etkinliği ve şekilleri/sferiklikleri hücreye özgü olabilir. Örneğin, insan kolon HCT116 hücreleri, lipit kaplı yüzey17'nin aksine, agaroz mikrowell yöntemini kullanarak hiçbir zaman ideal küresel yapılar oluşturmazken, tek başına ve HUVEC ile birlikte kültürlenmiş hDPSC'ler her zaman hücre kompozisyonu, ilk hücre sayısı ve sferoid oluşum / büyüme süresi ile orantılı olarak yüksek oranda tekrarlanabilir şekil ve büyüklükte sferoidler üretti. Test edilen tüm hücre tipleri, sferoid oluşum sırasındaO2 probu nanopartiküllerini verimli bir şekilde biriktirdi (Şekil 1B) ve bu lekelenmeyi en az 5 gün boyunca koruyarak, biyobaskı ve biyobaskılı doku oksijenasyonunun izlenmesi için kullanımlarına izin verdi (Şekil 1D).
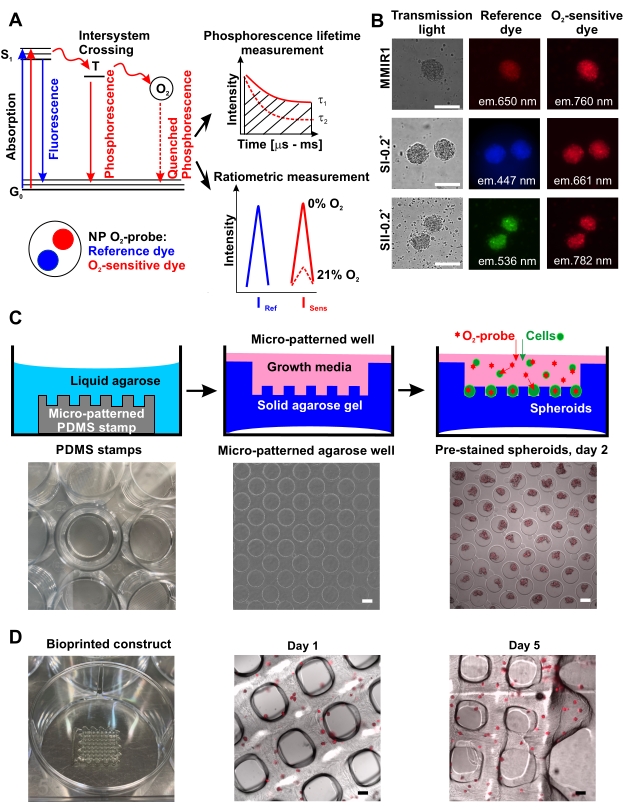
Şekil 1:O2 prob fonksiyonunun prensibi ve küresel boyama ve biyobaskı için uygulanması. (A) Fosforlu nanopartikül (NP) probları tarafındanO2-algılama prensibini açıklayan basitleştirilmiş bir Yablonski diyagramı. Yasak üçlü uyarılmış durum (T) sırasında enerjinin moleküler O2'ye aktarılması, fosforesans ömrü tau, τ (% 0O2'de τ 1'den %21 O2'de τ 2'ye değişir) ile ters orantılı fosforesans yoğunluğunun azalmasına yol açar, bu da singlet durumuna (S1) uyarılması ile zemin durumuna (G0)42 dönüşü arasındaki süredir. KantitatifO2 ölçümü, oranmetrik ölçüm veya τ (fosforesans ömrü ölçümleri) ölçümü ile yapılabilir. (B) İletim ışığı, referans ve O2'ye duyarlı boya floresan kanallarında gösterilen, farklı nanopartikülO2 probları ile boyanmış insan diş pulpası kök hücre (hDPSC) sferoidlerinin boyanmasına bir örnek. Ölçek çubuğu 100 μm'dir. (C) Mikrodesenli agaroz yöntemi kullanılarak yüksek verimliO2 probu önceden boyanmış küresel üretimin şemaları. Soldan sağa: Kültür plakasının bir kuyucuğuna yerleştirilen PDMS silikon damgası, agarozda bir mikrowell deseni örneği (4x büyütme) ve mikrodesenli agaroz (4x büyütme) üzerine tohumlamadan sonra 2. günde HCT116 insan kolon kanseri hücrelerinden üretilen MMIR1 önceden boyanmış sferoidlerin bir örneği. Ölçek çubuğu 100 μm'dir. (D) Soldan sağa: Biyobaskıdan sonraki 1. ve 5. günlerde MMIR1 önceden boyanmış küresel biyobaskılı yapının biyobaskılı waffle yapısı ve mikroskopi analizi. Floresan sinyali, MMIR1 nanopartiküllerindeO2'ye duyarlı fosforlu boyaya karşılık gelir (hariç = 635 nm / em. = 760 nm). Ölçek çubuğu 400 μm'dir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tarif edilen mikroskopi kurulumunda (ışık kaynağı olarak ışık yayan diyot (LED) ile donatılmış geleneksel geniş alan floresan mikroskobu) kırmızı/yakın kızılötesi MMIR1 probu, referans ve hassas boyalarının fotostabilitesi açısından en iyisi olarak bulundu ve başlangıç yoğunluk oranlarının parlaklığında% 5'ten daha az azalma oldu (R = Iref / Isens ) 12 döngü sürekli aydınlatmadan sonra. Bu, mitokondriyal uncoupler (FCCP) ve elektron taşıma zincirinin (rotenon) kompleks I inhibitörü ile tedavi üzerine hDPSC sferoidlerinde hızlı solunum yanıtının dinamik gerçek zamanlı çalışması için MMIR1 probunun kullanılmasına izin verdi (Şekil 2A, B). Kök hücre kaynaklı sferoidlerde, FCCP'nin, DPSC40'ın daha önce bildirilen metabolik özellikleriyle uyumlu olarak, bu ilacı ekledikten sonra ~ 80 s içinde hücre solunumunda hafif bir azalma ile sadece hafif bir ayrışma etkisi gösterdiğini bulduk. Öte yandan, rotenon, sferoidlerin reoksijenasyonuna (Rp - sferoid periferi oranının ve Rc - sferoid çekirdek oranının artması olarak yansır) ve stimülasyondan sonra periferi-çekirdekO2 gradyanlarının ~ 80 s içinde dağılmasına yol açan solunumu güçlü bir şekilde inhibe etti (Şekil 2A). MMIR1 prob oranının (R) yüksek (atmosferik) ve düşük (görüntüleme ortamlarında sodyum sülfit ve glikoz oksidaz varlığında)O2 seviyelerinin iki noktalı yarı kalibrasyonu, antimisin A / rotenon kokteyli tedavisi ile ön inhibe edilmiş solunum ile sferoidlerde oksijenasyonun azalmasına bağlı olarak R düşüşünü doğruladı (Şekil 2C ), MMIR1 probu R ölçümünün, 3D'de uzun süreli kararlı durum ve hızlı oksijenasyon yanıtlarının yarı kantitatif izlenmesi için nasıl uygulanabileceğini göstermektedir.

Şekil 2: Farklı uyaranlaraO2 probu yanıtının kinetik analizi. (A) İstirahatte ve FCCP ve rotenon tedavilerine yanıt olarak hDPSC sferoid oksijenasyon görüntülemesinin temsili sonucu. Ölçek çubuğu 100 μm'dir. (B) MMIR1 yoğunluk oranının FCCP ve rotenon tedavisine kinetik yanıtı, başlangıçtaki fotobeyazlatma yoğunluk oranı kinetiğine kıyasla (%). (C) Oksijenli (antimisin A + rotenon ilavesi) ve deoksijenli (glukoz oksidaz ilavesi) hallerde hDPSC sferoidlerindeki MMIR1 probunun yoğunluk oranı görüntülerindeki değişiklikler. Renk çubuğu, görüntü boyuncaO2 prob yoğunluk oranını (R = Iref / Isens) dağılımını temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Canlı metabolik görüntüleme için MMIR1 probu uygulamasını göstermek için, homosellülerhDPSC'deki O2 gradyanlarının heterosellüler hDPSC / HUVEC (1: 1) sferoidlerine karşı karşılaştırmalı analizi yapıldı. Hoechst 34580 (HXT) ve SYTOX Green (SYTOX) ile birlikte boyanan serbest mavi ve yeşil floresan spektral kanalların mevcudiyetinden yararlanarak, multiparametrik çalışmalar içinO2 probunun uygulanmasını göstermek için yapılmıştır (Şekil 3). Görüntüleme yazılımı tarafından sağlanan piksel piksel yoğunluk oranı hesaplamalarının otomatik protokolü kullanılarak, sferoidlerdeki R dağılımının yanlış renk oranı görüntüleri üretildi ve her türlü sferoidde gerçek zamanlı olarak tespit edilen periferiden çekirdeğeO2 gradyanlarını görselleştirdi: merkezdeki oksijenli çevre ve hipoksik nişler ile (Şekil 2 ve Şekil 3A). Bununla birlikte, Rp ve Rc değerlerinin yanı sıra orta kesitlerdekiO2 gradyanının dikliği farklı sferoid tipleri için farklılık göstermiştir: hDPSC'ye karşı hDPSC/HUVEC sferoidlerinde ve hDPSC'de biyobaskılı hDPSC sferoidlerine karşı orta kesitlerin çizgi profillerine bakınız (Şekil 3B,C). O2 gradyanlarını tanımlamanın yaygın olarak kabul görmüş bir yolu olmadığından, genel sferoid oksijenasyonun kolay karşılaştırılmasına ve ayrıntılı bir şekilde tanımlanmasına izin veren birkaç parametre sunduk: R p ve R c veO2 gradyanlarının oksijenli ve hipoksik bölgeler arasındaki fark gibi özellikleri (R p-R c) ve μm başına ortalama oksijenasyon değişiklikleri (R p-R c) / r, burada r, çevre ve hipoksik çekirdek arasındaki bir mesafedir ve orta kesitte küresel yarıçap ile ilişkilidir (Şekil 3D). Bu parametrelerin sferoidlerde SYTOX tarafından görselleştirilen nekrotik ölü hücrelerden elde edilen verilerle istatistiksel olarak karşılaştırılması, sferoid hücre tipine özgüO2 dağılım gradyanlarının kökeni hakkında ön sonuçlar çıkarmamıza yardımcı oldu.

Şekil 3: Sferoidlerde oksijenasyon gradyanlarının karşılaştırmalı analizi. (A) Baskı öncesi ve sonrası homosellüler hDPSC sferoidlerinde oksijenasyonun canlı mikroskopisinin (MMIR1'in oranmetrik floresan mikroskobu) ve canlı/ölü hücre boyamasının (Hoechst 34580, HXT, mavi ve SYTOX Green, SYTOX) temsili örnekleri ve heterosellüler hDPSC/HUVEC (1:1) sferoidleri. Tüm sferoid tiplerindeki hDPSC'ler aynı hücre kültüründendi. Sferoidler, oluşumları sırasında 2 gün boyunca 5 μg / mL MMIR1 probu ile önceden boyandı ve daha sonra görüntüleme veya biyobaskı için (sadece hDPSC sferoidleri) kullanıldı ve ardından biyobaskıdan sonraki 1. günde görüntüleme analizi yapıldı. MMIR1 boyalı sferoidlerin yoğunluk oranı (Iref / Isens) görüntülerinin yanlış renkli görüntüleri, çevre-çekirdekO2 gradyanlarına karşılık gelir. Ölçek çubuğu 100 μm'dir. Renk çubuğu, görüntü boyuncaO2 prob yoğunluk oranını (R = Iref/Isens) dağılımını temsil eder. Çap kesitlerinin 1 ve 2 numaraları, B ve C'de gösterilen yoğunluk profillerine karşılık gelir. (B,C) Homojen hDPSC ile heterojen hDPSC/HUVEC sferoidleri (B) ve biyobaskı öncesi ve sonrası homojen hDPSC sferoidleri arasındaki yoğunluk oranı profillerinin karşılaştırılması (C). Profiller, (A)'da gösterilen sferoidlerin kesitleri için ölçüldü. (D) Sferoidlerde periferiden çekirdeğe O2 gradyanlarının tanımlanması için kullanılan parametrelerin şematik gösterimi, burada r sferoidin yarıçapıdır ve Rp ve Rc, buna karşılık olarak sferoidin çevre ve çekirdek bölgesinin yoğunluk oranlarıdır. Renk çubuğu, ideal küresel sferoiddeO2 gradyanının yüksek (kırmızı) seviyelerden düşük (mavi) seviyelere dağılımını şematik olarak temsil eder. (E,F) Biyo-baskıdan (F) önce ve sonraki 1. günde hDPSC/HUVEC ve hDPSC sferoidlerinde (E) ve hDPSC sferoidlerinde periferi-çekirdeğ-O 2-gradyanlarının (Rp-R c) / r değerlerinin karşılaştırmalı analizi. Bir deney tekrarı için istatistiksel analiz yapıldı (n = 18-23). Kutular standart sapmalara karşılık gelir. Yıldız işaretleri gruplar arasındaki istatistiksel farkı gösterir (p = 0.05'te); ** = p 0,0005 <. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Homosellüler hDPSC sferoidlerine kıyasla, hDPSC/HUVEC sferoidleri anlamlı derecede daha dik gradyanlara sahipti: daha yüksek değerler (R p-R c) / r parametresi ve aralığı (Rp-R c; Şekil 3F). Aynı zamanda, çevre (Rp) ve çekirdeğin (Rc) daha yüksek oksijenlenmesini gösterdiler (Şekil 4A, Tablo 1). İlginç bir şekilde, istatistiksel olarak da daha büyüktüler (Şekil 4A, Tablo 1), oksijenasyondaki bu tür farklılıkların farklı hücresel biyoenerjetik profillerinden kaynaklandığını düşündürmektedir. Bu veriler, ATP ve NAD (P) H41'in ana biyoenerjetik kaynakları olarak glikoliz ve pentoz-fosfat yolaklarına güçlü bir şekilde bağlı olan hücrelerin genellikle daha düşük solunum aktivitesine sahip olan HUVEC hücrelerinin iyi bilinen metabolik özellikleri ile uyumludur. Aynı zamanda, heterojen sferoidlerde oluşan belirgin periferi-çekirdeğeO2 gradyanı muhtemelen hiperpolarize mitokondri ve aktif elektron taşıma zinciri40 ile karakterize edilen ve hDPSC sferoidlerinin oksijenasyonu ile ilgili sonuçlara göre, güçlü solunum aktivitesine sahip olan bileşimlerinde hDPSC tarafından üretilir (Şekil 3, Şekil 4A ve Tablo 1 ). Bu nedenle, genellikle SYTOX ile boyanan ölü hücrelerinin düşük yoğunluğu ile doğrulanan hDPSC / HUVEC sferoidlerinin daha yüksek canlılığı (Şekil 3A) potansiyel olarak daha yüksek oksijenasyon seviyelerine bağlıdır.
Biyofabrikasyonda sferoid oksijenasyonun canlı mikroskopi görüntülemesinin uygulanabilirliğini göstermek için, MMIR1 O 2-prob önceden boyanmış sferoidler, biyobaskıdan önce ve sonraki 1. günde hDPSC sferoidlerindekiO2 gradyanlarının aşağıdaki karşılaştırması ile GelMA biyomürekkebinde biyobaskı için kullanılmıştır (Şekil 3A, C, F, Şekil 4B ve Tablo 2). Biyobaskılı hDPSC sferoidleri, biyobaskıdan önce ölçülen sferoidlere kıyasla anlamlı oksijenli periferiye (daha yüksek Rp) sahipken, çekirdek oksijenasyonları benzer değerlere sahipti (Şekil 4B). Periferik oksijenasyonlarındaki değişiklikler, biyobaskıdan önce ölçülenhDPSC sferoidlerinden istatistiksel olarak farklı olan periferi-çekirdekO2 gradyanlarının aralığını (R p-Rc) ve diklik (artmış (Rp-R c) / r) 'yi etkiler (Şekil 3F ve Şekil 4B). Ölü hücrelerin boyanması genellikle biyobaskılı sferoidlerde daha parlaktı, bu da azalmış sferoid canlılığın sferoid oksijenasyonun değişmesinde rol oynadığını düşündürmektedir (Şekil 3A).

Şekil 4: MMIR1 boyalı sferoidlerin çap ve yoğunluk oranının karşılaştırmalı analizi . (A) Hetero-hDPSC/HUVEC ve homosellüler hDPSC sferoidleri arasındaki karşılaştırma. (B) Biyo-baskı öncesi ve sonrası homosellüler hDPSC sferoidlerinin karşılaştırılması. Rp ve Rc - periferideki yoğunluk oranı ve buna bağlı olarak sferoidlerin çekirdeği; (Rp-R c) - sferoidlerdekiO2 gradyanı aralığına karşılık gelen yoğunluk oranındaki fark. Bir deneysel replika için istatistiksel analiz yapıldı (n = 18-23). Kutular standart sapmalara karşılık gelir. Yıldız işaretleri, gruplar arasındaki istatistiksel farkı gösterir (p = 0.05'te), burada * = p 0.005 ve ** = p 0.0005'< <. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Seroid tipi (N) | Çap [μm] | Rp [a.u.] | Rc [a.u.] | Rp-R c [a.u.] | (Rp-R c)/r [a.u./μm] |
| hDPSC / HUVEC (18) | 113,2 ± 10,6 | 0.779 ± 0.034 | 0.398 ± 0.055 | 0.982 ± 0.051 | 0.00677 ± 0.00091 |
| hDPSC (18) | 88,1 ± 9,9 | 0.558 ± 0.025 | 0.331 ± 0.034 | 0.227 ± 0.032 | 0.00520 ± 0.00090 |
| p-değeri | 1,5 x 10-8 * | 1,5 x 10-21 * | 1,3 x 10-4 * | 1,4 x 10-12 * | 9,2 x 10-6 * |
Tablo 1. Küresel çap, sferoidlerin çekirdeğindeki (R c) ve periferisindeki (R p) yoğunluk oranı, heterojen hDPSC/HUVEC ve homojenhDPSC sferoidlerinde yoğunluk oranı (Rp-R c) ve (R p-R c)/r değerindeki fark. N sferoidler üzerindeki bir t-testinin p-değeri istatistiksel farklılık gösterir ve yıldız işareti ile de gösterilir.
| Seroid tipi (N) | Çap [μm] | Rp [a.u.] | Rc [a.u.] | Rp-R c [a.u.] | (Rp-R c)/r [a.u./μm] |
| hDPSC (18) | 88,1 ± 9,9 | 0.558 ± 0.025 | 0.331 ± 0.034 | 0.227 ± 0.032 | 0.00520 ± 0.00090 |
| Biyobaskı hDPSC (23) | 80,9 ± 12,5 | 0.584 ± 0.023 | 0.323 ± 0.038 | 0.261 ± 0.039 | 0.00658 ± 0.00144 |
| p-değeri | 0.054 | 0.0024 * | 0.46 | 9,9 x 10-4 * | 6,3 x 10-6 * |
Tablo 2. Biyobaskı öncesi ve sonrası homojen hDPSC sferoidlerde sferoid çapı, sferoidlerin çekirdeğindeki (Rc) ve periferindeki(R p) yoğunluk oranı farkı (R p-R c) ve (R p-R c)/r değeri. İstatistiksel analizin p-değeri (N sferoidler). İstatistiksel fark yıldız işareti ile gösterilir.
Tartışmalar
Mana. Doku oksijenasyon ölçümü, hücre ve dokuya özgü metabolizma, doku büyümesi ve gelişimi, canlılık, tümörigenez ve hücre göçü ve mikroplar ve diğer patojenlerle etkileşim hakkında bir fikir verir. Sunulan yöntem, çok hücreli sferoid kültürlerin fizyolojisinin daha iyi anlaşılması için yeni bir araç sunmaktadır: oranmetrik nanopartikülO2 probları ile oksijenasyonun analizi ve hipoksiyi değerlendirmek, belirli enerji üretim yollarına olan güveni görselleştirmek için araçlar sağlar ve modelleme çalışmalarını ve alternatif metabolik görüntüleme yaklaşımlarını tamamlar43,44 yaygın olarak bulunan düşük maliyetli floresan mikroskopta. Oranmetrik ölçümler, ideal olarak T veO2 inkübatör odaları ile donatılmış bir floresan geniş alan (darbeli LED uyarımı tercih edilir), lazer taramalı konfokal, ışık tabakası ve iki foton mikroskop üzerinde gerçekleştirilebilir. Daha da önemlisi, sunulanO2 mikroskopi ölçümü, çeşitli fizyolojik parametrelerin ve hücre izleyicilerinin (heterosellüler sferoid kültürler durumunda), canlılık (canlı / ölü boyama durumunda), lipit metabolizmasının (lipit algılayan floresan problar), pH dinamiklerinin (boyalar, nanopartiküller ve floresan proteinler) veya [Ca2+ ], mevcut floresan spektral kanallarında veya paralel olarak gerçekleştirilir ve sferoidlerde, biyobaskılı yapılarda ve potansiyel doku nakillerinde gerçek zamanlı hücre fonksiyonu hakkında genişletilmiş bir görünüm sağlar.
Küresel kültürler, kanser hücreleri, tümör ve kök hücre niş mikro çevresi, tümöroidler, ilaç verimliliği ve toksisite taraması çalışmalarında ve aslında doku biyofabrikasyonu ve kendi kendine montaj için doku yapı taşları olarak kullanım alanı bulmaktadır45. Birden fazla hücre tipinden çeşitli farklı yaklaşımlarla üretilebilirler46. Küresel modelin popülaritesi, yakın zamanda ilk küresel veritabanı8'in geliştirilmesiyle denenen araştırma bütünlüğü ve veri analizinin iyileştirilmesi açısından standardizasyonlarını gerektirmektedir.
Protokolümüzün canlı sferoid metabolizmasını daha iyi anlamaya, bu deneysel modeli standartlaştırmaya ve daha sonra biyobaskılı ve implante edilebilir materyaller içinde uzun vadeli stabilitelerini, tekrarlanabilirliklerini ve yaşayabilirliklerini iyileştirmelerine yardımcı olması beklenmektedir.
Değişiklikler. Bu protokol, oksijenasyon analizi içinO2 probu yüklü sferoidlerin yüksek verim üretimi için mikrodesenli agaroz düşük yapışkan yüzeyin (mikrokalıp bazlı oluşum29) kullanımını açıklar. Asılı damla, ultra düşük bağlantı plakalarının uygulanması, lipit kaplama veya serbest yüzer oluşum gibi alternatif küresel üretim yöntemleri de önerilenO2 prob yükleme protokolü ile uyumludur. Sunulan protokol, hDPSC sferoidleri ve hDPSC'nin HUVEC ile ortak kültür sferoidleri için optimize edilmiştir (1:1). Diğer hücre hatları kesinlikle uygulanabilir 15,17,47,48; Bununla birlikte, farklı hücre yapışma özellikleri, kültür koşulları, metabolik substrat gereksinimleri ve nanopartikül boyama ile hücre uyumluluğu nedeniyle bazı protokol optimizasyonları gerekebilir. Uygun bir oranmetrik nanopartikül bazlıO2-duyarlı probun seçimi, spesifik hücre modeline bağlı olarak ve kullanılan mikroskopi kurulumundaki prob fotobeyazlatma özelliklerine (ışık kaynağının yoğunluğu ve tipi, kameranın spektral hassasiyeti) ve ilgili referans ve probun O2'ye duyarlı spektral kanalları için uygun uyarma / emisyon filtrelerinin mevcudiyetine göre yapılmalıdır.
Bazı oranmetrikO2 probları ticari olarak temin edilebilir2. Alternatif olarak, referans veO2'ye duyarlı boyaların başka bir yerde24,25,49'da açıklandığı gibi bir polimerle birlikte çökeltilmesi ile şirket içinde hazırlanabilirler. Her bir model için, uygun prob ve optimal mikroskopi koşullarını belirlemek ve oranmetrik ölçümler sırasında prob fotobeyazlatma veya fotoindüklenmişO2 tüketiminin etkisini en aza indirmek için ön testler yapılmalıdır. O2 algılayıcı nanopartiküllerin önceki çalışmaları, düşük hücre toksisitelerini gösterdi ve çok çeşitli boyama konsantrasyonlarında (1-20 μg / mL) uygulamaya izin verdi. Bazı katyonik nanopartiküller depolama sırasında kendiliğinden agrega yapabildiğinden, küresel oluşum üzerindeki potansiyel etkilerini en aza indirmek için yükleme konsantrasyonlarını mümkün olduğunca düşük tutmanızı öneririz. İsteğe bağlı olarak, nanopartikül süspansiyonu filtrelenebilir (0,2 μm) veya tüm agregaları süspansiyondan çıkarmak için kullanılmadan önce santrifüjleme (10.000 x g, 5 dakika) ile temizlenebilir.
BioCAD ve HMI yazılımı sunulan biyoyazıcı için özel olmasına rağmen, bu protokol biyomürekkebin hazırlanması, montajı, standart bir kartuşun doldurulması ve gözenekli bir hidrojel iskelesinin tasarımı sağlandığından diğer biyoyazıcılar için geçerlidir. Ayrıca, baskı hızı ve sıcaklık gibi biyobaskı parametreleri, farklı ekstrüzyon tabanlı biyoyazıcılar için karşılaştırılabilir olmalıdır. Baskı basıncı ve dikme çapı, iğne tipine ve çapına, biyomürekkep bileşimine, sıcaklığa ve sonuçta ortaya çıkan viskoziteye bağlıdır, ancak bazı biyoyazıcılar biyomürekkep50'yi ekstrüzyon yapmak için hava basıncı yerine iğler kullansa da, GelMA tabanlı biyomürekkepleri farklı biyoyazıcılarla biyobaskı yapmak için baskı parametrelerini optimize etmek için bir başlangıç noktası olabilirler.
Kritik adımlar ve sorun giderme. Kritik adımlardan biri, aşağıdaki hususlara dayananO2 probunun seçimidir: ilk olarak, mevcut floresan mikroskop kurulumu (yani, uyumlu uyarma ışık kaynağı, uyarma ve emisyon filtreleri, kamera hassasiyeti ve spektral geçirgenlik ve hedefin sayısal açıklığı), fotostabilitelerine göre mevcut probların sayısını sınırlayabilir, parlaklık ve potansiyel fototoksisite. Bazı daldırma yağı türlerinin (yağ daldırma hedefleri durumunda) kırmızı ve kızılötesi floresan sinyallerine müdahale edebileceğini de belirtmek önemlidir. Fotostabilite testlerinin son derece önemli olduğunu ve ilk kurulum ve ön testler sırasında yapılması gerektiğini düşünüyoruz. Floresan kanallar ve farklı boyalar arasındaki potansiyel spektral çapraz konuşma dikkate alınmalıdır. Gerçekten de,O2 probunun ve diğer seçilmiş boyaların potansiyel karanlık ve fotoindüklenmiş toksisitesi, spesifik hücre modeline göre, protokol optimizasyonu51 sırasında değerlendirilmelidir. Nanopartiküller için spesifik sorun, çalışma konsantrasyonlarını, boyama ortamının bileşimini (örneğin, serum içeriği), nanopartiküllerin ortamla karıştırılmadan önce sonikasyonu veya sferoid oluşum ve sıkıştırma prosedürü sırasında prob yüklemesi yerine sferoid oluşum içinO2-prob önceden boyanmış ve yıkanmış hücrelerin kullanılmasıyla hafifletilebilen kendi kendine toplanmaları olabilir.
Tarif edilen sferoid modellerle ışık penetrasyon derinliği ile ilişkili problemler gözlemlemedik, ancak oranmetrik yoğunluk sinyallerini, küresel ve biyofabrikasyon yapıların boyutunu (doku greftleri) seçerken ve ilgili boyalarla hücre boyamasını optimize ederken bu dikkate alınmalıdır. Kırmızı ve yakın kızılötesi emisyon dalga boylarıyla yakından eşleşen MMIR1 probunun, diğer kırmızı / mavi veya yeşil yayan floresan biyosensör problarına kıyasla en düşük arka plan ve en iyi doku ışığı penetrasyonunu sağlaması beklenmektedir.
Oran görüntülerinin üretimi ve işlenmesi (ve potansiyel olarak spektral karıştırma veya dekonvolüsyon), satıcı tarafından sağlanan bir yazılımda veya ImageJ, Fiji52,53, napari (https://napari.org), MATLAB ve diğerleri gibi açık kaynaklı seçeneklerde yapılabilir. Kritik bir adım, arka planın çıkarılması ve doğrusal bir aralıktaki sinyal yoğunluğu değişikliklerinin ölçülmesi olacaktır.
O2 probunun kalibrasyonu: Rotenon ve antimisin A, mitokondriyal elektron taşıma zincirinin sırasıyla kompleks I ve III'ünün inhibitörleridir, hücre solunumunubloke eder 54,55,15 ve sferoidlerde O2-gradyanlarının dağılımını ve çevreselO2 ile dengelerini indükler. Bu nedenle, çevresel O2 konsantrasyonunun değiştirilmesi (yani,% 20,% 15,% 10,% 5,% 2,5,% 1,% 0O2), hücrelerdekiO2'ye duyarlı probun oranmetrik yoğunluğuna veya fosforesans ömrü kalibrasyonuna izin verecektir. Tipik olarak, O2 kontrollü inkübatörler mutlak% 0O2 elde edemez ve bazı durumlarda, probun deoksijenasyona hızlı bir şekilde yanıt testi gerekir. Bu gibi durumlarda, numuneye 25-100 μg/mL glikoz oksidaz veya Na 2 SO3/K2HPO4 karışımı (damıtılmış suda 10x çözeltisi için her bileşik için 50 mg/mL) eklenmelidir. Önemli olarak, hücre hattında önemli derecede mitokondriyal olmayanO2 tüketimi varsa, solunum ve kalibrasyon deneylerinin inhibisyonu yapılırken bunu göz önünde bulundurun.
Sınırlamalar ve gelecekteki araştırmalar. Önerilen yöntemin ve genel olarak oranmetrik tespitin ana sınırlaması, gözlemlenen oran seviyelerinin kalibrasyonu ve gerçekO2 seviyelerine dönüştürülmesidir; bu, donanım ve kullanıcı görüntüsü yakalama ayarlarındaki içsel farklılıklar nedeniyle, oran kalibrasyon cihazını ve hücreye özgü hale getirecektir. Daha da önemlisi, geniş alan floresan mikroskobu ve tarif edilen kurulum için, oran görüntüleri ideal optik bölümlerden ziyade birleşik projeksiyonları yansıtmaktadır veO2 kalibrasyonu mantıklı olmayacaktır. Öte yandan, yarı kantitatif oran ölçümlerinin, çeşitli kaynaklardan üretilen ve oksijenasyonda farklılıklara sahip olan sferoidlerin istatistiksel olarak anlamlı ve ölçülmesi kolay karşılaştırmalı fenotiplenmesini sağladığını gösteriyoruz.
SPIM, ışık tabakası, teta, iki foton ve lüminesans ömrü görüntüleme gibi canlı 3D nesneler için tasarlanmış daha erişilebilir ve uygun fiyatlı mikroskopi yaklaşımları yapma konusundaki gelecekteki araştırmalar, makine öğrenimi 56,57,58,59,19 ile birleştiğinde, multiparametrikO2 görüntülemenin daha da nicel uygulamalara getirilmesine yardımcı olacaktır.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma, Ghent Üniversitesi Özel Araştırma Fonu hibesi (BOF / STA / 202009 / 003) ve AB FP7 ITN Programı "Chebana", 264772 numaralı hibe sözleşmesi (AVK için) tarafından desteklenmiştir. Talep üzerine veriler temin edilebilir. Biyo-baskı için G kodu paylaşılabilir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | Gibco | 25300-054 | Also available from Sigma |
| 12 well cell-culture plates, sterile | Greiner bio-one | 665-180 | Similar products are also available from Sarstedt, Corning and other companies. |
| 12 Well Chamber slide, removable | Ibidi | 81201 | Also available from Grace Bio-Labs, ThermoFisher Scientific and others |
| 15 mL centrifuge tubes | Nerbe plus | 02-502-3001 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| 3cc Cartridge, UV secure, luer lock | RegenHU | C-033CC-UV | Also available from CelIink and others |
| 3D Discovery Bioprinter | RegenHU | N/A | Bioprinter equiped with an extrusion based printhead, heating mantle, UV-LED curing lamp, 3D Discovery HMI software (CAD/CAM software with direct machine control) and BioCAD software (version 1.1-12) |
| 6 well cell-culture plates, sterile | Greiner bio-one | 657160 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Antimycin A from Streptomyces sp. | Sigma-Aldrich | A8674-25MG | Used as inhibitor of complex III of the mitochondrial electron transport chain, blocking cell respiration |
| B-Braun Tip Cap, luer lock | RegenHU | TC-BB-B | Also available from Regemat, Cellink and others |
| Cell view cell culture dish, PS, 35/10mm, glass bottom, 1 compartment, sterile | Greiner bio-one | 627861 | For microscopy of bioprinted spheroids |
| Collagen from human placenta, type IV | Sigma | C5533 | For the preparation of 0.07mg/mL Collagen and 0.03mg/mL Poly-D-lysine coated microscopy dishes |
| D(+)-Glucose | Merck | 8342 | Prepare 1M stock solution, 1/100 for preparation of imaging medium (final concentration 10mM) |
| Dulbecco's modified Eagle's medium (DMEM), phenol red-, glucose-, pyruvate- and glutamine-free | Sigma-Aldrich | D5030-10X1L | For preparation of imaging medium |
| Endothelial Cell Growth Medium 2 | PromoCell | C-22011 | Also available from Lonza and others |
| Endothelial Growth SupplementMix | PromoCell | C-39216 | Also available from Lonza and others |
| FCCP, Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma-Aldrich | C2920-10MG | Used as mitochondrial uncoupler |
| Fetal Bovine Serum | Gibco | 10270-098 | Also available from Sigma |
| GelMA | N/A | N/A | GelMA was synthesized by the PBM group (Prof Dr Peter Dubruel and Sandra Van Vlierberghe, University of Gent) [https://www.sciencedirect.com/science/article/pii/S0142961213011782] but are also available from Xpect Inx |
| Glucose-oxidase from Aspergillus nige (10000 u) | Sigma-Aldrich | G7141 | Used to test the response of probe to deoxygenation |
| GlutaMAX 100x Supplement | Gibco | 35050-038 | Dilution 1/100 for preparation of imaging medium (final concentration 2mM) |
| HEPES (1M) | Gibco | 15630-080 | Dilution 1/100 for preparation of imaging medium (final concentration 10mM) |
| Hoechst 34580 | Invitrogen (Life Technologies) | H21486 | Also available from Sigma, BDBiosciences and others |
| Human dental pulp stem cells (hDPSC) | Lonza | PT-5025 | Also available from ATCC or other vendors |
| Human umbilical vein endothelial cells (HUVEC) | Lonza | CC-2517 | Also available from ATCC or other vendors |
| KH2PO4 (potassium dihydrogen phosphate) | Merck | 4873 | For preparation of sodium sulfite solution (5 mg / mL Na2SO3 and 5 mg / mL KH2PO4). Prepare fresh from 10x concentrated stock solution daily. |
| Li-TPO | N/A | N/A | Li-TPO-L was synthesized by the PBM group (Prof Dr Peter Dubruel and Sandra Van Vlierberghe, University of Gent) [https://link.springer.com/referenceworkentry/10.1007%2F97 8-3-319-45444-3_15) , https://asmedigitalcollection.asme.org/nanoengineeringmedical/article/6/2/021001/376814/Hybrid-Tissue-Engineering-Scaffolds-by-Combination] but comparable photo-initiators are available from Sigma |
| MEM Alpha Medium + Glutamax Minimum essential medium | Gibco | 32561-029 | Also available from Sigma and others |
| Micro-patterned 3D-printed PDMS stamps, wells with a diameter 400 µm, thickness, total well numbers 1585 | Self-fabricated | These stamps were self-fabricated by the Centre for Microsystems Technology (Professor Dr Jan Vanfleteren, University of Gent) but can also be obtained commercially from Merck (Z764094, Microtissues 3D Petri Dish micro-mold mixed spheroid kit) | |
| Na2SO3 (sodium sulfite) | Sigma-Aldrich | 239321-500G | For preparation of sodium sulfite solution (5 mg / mL Na2SO3 and 5 mg / mL KH2PO4). Prepare fresh from 10x concentrated stock solution daily. |
| O2 probes: MMIR1, SI-0.2+, SII-0.2+ | N/A | N/A | Can be prepared ‘in-house’ using commercially available dyes, polymers and precipitation method [https://pubs.acs.org/doi/abs/10.1021/nn200807g https://onlinelibrary.wiley.com/doi/abs/10.1002/adfm.201201387 ]. Some nanoparticles are available commercially as discussed in [https://link.springer.com/article/10.1007/s00018-018-2840-x ] |
| Pen Strep :Penicillin (10,000 U/mL) / streptomycin (10,000 μg/mL) 100x solution | Gibco | 15140-122 | Also available from Sigma . Apply in dilution 1:100 |
| Petri dishes, sterile | Greiner bio-one | 633181 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Piston for 3cc cartridge | RegenHU | P-03CC-UV | Also available from Cellink, Regemat and others |
| Poly-D-lysine | Sigma | P6407-5mg | For the preparation of 0.07mg/mL Collagen and 0.03mg/mL Poly-D-lysine coated microscopy dishes |
| PVDF syringe filter 0.22 µm | Novolab | A35149 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Rotenone | Sigma-Aldrich | R8875-1G | Used as inhibitor of complex I of the mitochondrial electron transport chain, blocking cell respiration |
| Sodium pyruvate (100 mM) | Gibco | 11360-070 | Dilution 1/100 for preparation of imaging medium (final concentration 1mM) |
| SYTOX Green | Invitrogen (Life Technologies) | S7559 | Also available from Sigma, Promega and others |
| Taper tip 22 gauge (conical PE needle | Amada Myachi Europe | 22K62222 | Similar products are also available from RegenHU, Cellink, Regemat and others |
| Tissue culture flask (75 cm2) | VWR | 734-2313 | Similar products are also available from Sarstedt, Corning, VWR and other companies |
| Ultrapure Agarose | Invitrogen (Life Technologies) | 16500-500 | Other types of Agarose such as Agarose low melting point (A-9414, Sigma), Agarose for routine use (A-9539, Sigma) |
| Widefield fluorescence inverted microscope | Olympus | N/A | Inverted fluorescence microscope IX81, with motorised Z-axis control, CoolLED pE4000 (16 channels, 365-770 nm), ORCA-Flash4.0LT (Hamamatsu) cMOS camera, glass warming plate Okolab, CellSens Dimension v.3 software and air objectives 4x/0.13 UPlanFLN and 40x/0.6 LUCPlanFLN. (Optional, for high-resolution imaging) 60x/1.0 LUMPLFLN water |
Referanslar
- Papkovsky, D. B., Dmitriev, R. I. Biological detection by optical oxygen sensing. Chemical Society Reviews. 42 (22), 8700-8732 (2013).
- Papkovsky, D. B., Dmitriev, R. I. Imaging of oxygen and hypoxia in cell and tissue samples. Cellular and Molecular Life Sciences. 75 (16), 2963-2980 (2018).
- Cordeiro, I. R., Tanaka, M. Environmental oxygen is a key modulator of development and evolution: From molecules to ecology: Oxygen-sensitive pathways pattern the developing organism, linking genetic and environmental components during the evolution of new traits. BioEssays. 42 (9), 2000025 (2020).
- Wenger, R. H., Kurtcuoglu, V., Scholz, C. C., Marti, H. H., Hoogewijs, D. Frequently asked questions in hypoxia research. Hypoxia. 3, 35 (2015).
- Erecińska, M., Silver, I. A. Tissue oxygen tension and brain sensitivity to hypoxia. Respiration Physiology. 128 (3), 263-276 (2001).
- Gholipourmalekabadi, M., Zhao, S., Harrison, B. S., Mozafari, M., Seifalian, A. M. Oxygen-generating biomaterials: a new, viable paradigm for tissue engineering. Trends in Biotechnology. 34 (12), 1010-1021 (2016).
- Zheng, L., Kelly, C. J., Colgan, S. P. Physiologic hypoxia and oxygen homeostasis in the healthy intestine. A review in the theme: cellular responses to hypoxia. American Journal of Physiology-Cell Physiology. 309 (6), 350-360 (2015).
- Peirsman, A., et al. MISpheroID: a knowledgebase and transparency tool for minimum information in spheroid identity. Nature Methods. 18 (11), 1294-1303 (2021).
- Suvarnapathaki, S., Wu, X., Lantigua, D., Nguyen, M. A., Camci-Unal, G. Breathing life into engineered tissues using oxygen-releasing biomaterials. NPG Asia Materials. 11 (1), 1-18 (2019).
- Salazar-Noratto, G. E., et al. Understanding and leveraging cell metabolism to enhance mesenchymal stem cell transplantation survival in tissue engineering and regenerative medicine applications. Stem Cells. 38 (1), 22-33 (2020).
- Leedale, J. A., et al. Mathematical modelling of oxygen gradients in stem cell-derived liver tissue. Plos One. 16 (2), 0244070 (2021).
- Sutherland, R., et al. Oxygenation and differentiation in multicellular spheroids of human colon carcinoma. Cancer Research. 46 (10), 5320-5329 (1986).
- Walenta, S., Dötsch, J., Bourrat-Flöck, B., Mueller-Klieser, W. Size-dependent oxygenation and energy status in multicellular tumor spheroids. Oxygen Transport to Tissue XII. , (1990).
- Hompland, T., Fjeldbo, C. S., Lyng, H. Tumor hypoxia as a barrier in cancer therapy: Why levels matter. Cancers. 13 (3), 499 (2021).
- Dmitriev, R. I., Zhdanov, A. V., Nolan, Y. M., Papkovsky, D. B. Imaging of neurosphere oxygenation with phosphorescent probes. Biomaterials. 34 (37), 9307-9317 (2013).
- Dmitriev, R. I., Borisov, S. M., Jenkins, J., Papkovsky, D. B. Multi-parametric imaging of tumor spheroids with ultra-bright and tunable nanoparticle O2 probes. Imaging, manipulation, and analysis of biomolecules, cells, and tissues XIII. , (2015).
- Dmitriev, R. I., et al. Versatile conjugated polymer nanoparticles for high-resolution O2 imaging in cells and 3D tissue models. ACS Nano. 9 (5), 5275-5288 (2015).
- Okkelman, I. A., Puschhof, J., Papkovsky, D. B., Dmitriev, R. I. Visualization of Stem Cell Niche by Fluorescence Lifetime Imaging Microscopy. Intestinal Stem Cells. , 65-97 (2020).
- Dmitriev, R. I., Intes, X., Barroso, M. M. Luminescence lifetime imaging of three-dimensional biological objects. Journal of Cell Science. 134 (9), 1-17 (2021).
- Yasukagawa, M., Yamada, K., Tobita, S., Yoshihara, T. Ratiometric oxygen probes with a cell-penetrating peptide for imaging oxygen levels in living cells. Journal of Photochemistry and Photobiology A: Chemistry. 383, 111983 (2019).
- Xie, B. -. R., et al. A near infrared ratiometric platform based π-extended porphyrin metal-organic framework for O2 imaging and cancer therapy. Biomaterials. 272, 120782 (2021).
- Düssmann, H., Perez-Alvarez, S., Anilkumar, U., Papkovsky, D. B., Prehn, J. H. Single-cell time-lapse imaging of intracellular O 2 in response to metabolic inhibition and mitochondrial cytochrome-c release. Cell Death & Disease. 8 (6), 2853 (2017).
- Roussakis, E., et al. Theranostic biocomposite scaffold membrane. Biomaterials. 212, 17-27 (2019).
- Kondrashina, A. V., et al. A phosphorescent nanoparticle-based probe for sensing and imaging of (intra) cellular oxygen in multiple detection modalities. Advanced Functional Materials. 22 (23), 4931-4939 (2012).
- Borisov, S. M., et al. Precipitation as a simple and versatile method for preparation of optical nanochemosensors. Talanta. 79 (5), 1322-1330 (2009).
- Borisov, S., Nuss, G., Klimant, I. Red light-excitable oxygen sensing materials based on platinum (II) and palladium (II) benzoporphyrins. Analytical Chemistry. 80 (24), 9435-9442 (2008).
- Strobl, M., Rappitsch, T., Borisov, S. M., Mayr, T., Klimant, I. NIR-emitting aza-BODIPY dyes-new building blocks for broad-range optical pH sensors. Analyst. 140 (21), 7150-7153 (2015).
- Tsytsarev, V., et al. In vivo imaging of brain metabolism activity using a phosphorescent oxygen-sensitive probe. Journal of Neuroscience Methods. 216 (2), 146-151 (2013).
- Fukuda, J., et al. Micromolding of photocrosslinkable chitosan hydrogel for spheroid microarray and co-cultures. Biomaterials. 27 (30), 5259-5267 (2006).
- Thomsen, A. R., et al. A deep conical agarose microwell array for adhesion independent three-dimensional cell culture and dynamic volume measurement. Lab on a Chip. 18 (1), 179-189 (2018).
- Gevaert, E., et al. High throughput micro-well generation of hepatocyte micro-aggregates for tissue engineering. PloS One. 9 (8), 105171 (2014).
- De Moor, L., et al. High-throughput fabrication of vascularized spheroids for bioprinting. Biofabrication. 10 (3), 035009 (2018).
- Rivron, N. C., et al. Tissue deformation spatially modulates VEGF signaling and angiogenesis. Proceedings of the National Academy of Sciences of the United States of America. 109 (18), 6886-6891 (2012).
- Nunes, P., Guido, D., Demaurex, N. Measuring phagosome pH by ratiometric fluorescence microscopy. Journal of Visualized Experiments:JoVE. (106), e53402 (2015).
- Billiet, T., Gevaert, E., De Schryver, T., Cornelissen, M., Dubruel, P. The 3D printing of gelatin methacrylamide cell-laden tissue-engineered constructs with high cell viability. Biomaterials. 35 (1), 49-62 (2014).
- Tytgat, L., Ovsianikov, A., Yoo, J., Mironov, V., et al. Photopolymerizable materials for cell encapsulation. 3D Printing and Biofabrication. , 353-396 (2018).
- Markovic, M., et al. Hybrid tissue engineering scaffolds by combination of three-dimensional printing and cell photoencapsulation. Journal of Nanotechnology in Engineering and Medicine. 6 (2), 0210011 (2015).
- De Moor, L., et al. Hybrid bioprinting of chondrogenically induced human mesenchymal stem cell spheroids. Frontiers in Bioengineering and Biotechnology. 8, 484 (2020).
- Zhdanov, A. V., Dmitriev, R. I., Hynes, J., Papkovsky, D. B. Kinetic analysis of local oxygenation and respiratory responses of mammalian cells using intracellular oxygen-sensitive probes and time-resolved fluorometry. Methods in Enzymology. 542, 183-207 (2014).
- Uribe-Etxebarria, V., Agliano, A., Unda, F., Ibarretxe, G. Wnt signaling reprograms metabolism in dental pulp stem cells. Journal of Cellular Physiology. 234 (8), 13068-13082 (2019).
- Vizán, P., et al. Characterization of the metabolic changes underlying growth factor angiogenic activation: identification of new potential therapeutic targets. Carcinogenesis. 30 (6), 946-952 (2009).
- Dmitriev, R. I., Papkovsky, D. B. Quenched-phosphorescence detection of molecular oxygen: applications in life sciences. Royal Society of Chemistry. , (2018).
- Perottoni, S., et al. Intracellular label-free detection of mesenchymal stem cell metabolism within a perivascular niche-on-a-chip. Lab on a Chip. 21 (7), 1395-1408 (2021).
- Okkelman, I. A., Neto, N., Papkovsky, D. B., Monaghan, M. G., Dmitriev, R. I. A deeper understanding of intestinal organoid metabolism revealed by combining fluorescence lifetime imaging microscopy (FLIM) and extracellular flux analyses. Redox Biology. 30, 101420 (2020).
- Mironov, V., et al. Organ printing: tissue spheroids as building blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Cui, X., Hartanto, Y., Zhang, H. Advances in multicellular spheroids formation. Journal of the Royal Society Interface. 14 (127), 20160877 (2017).
- Dmitriev, R. I., et al. Imaging oxygen in neural cell and tissue models by means of anionic cell-permeable phosphorescent nanoparticles. Cellular and Molecular Life Sciences. 72 (2), 367-381 (2015).
- Jenkins, J., Borisov, S. M., Papkovsky, D. B., Dmitriev, R. I. Sulforhodamine nanothermometer for multiparametric fluorescence lifetime imaging microscopy. Analytical Chemistry. 88 (21), 10566-10572 (2016).
- Fercher, A., Borisov, S. M., Zhdanov, A. V., Klimant, I., Papkovsky, D. B. Intracellular O2 sensing probe based on cell-penetrating phosphorescent nanoparticles. ACS Nano. 5 (7), 5499-5508 (2011).
- Wagner, M., Karner, A., Gattringer, P., Buchegger, B., Hochreiner, A. A super low-cost bioprinter based on DVD-drive components and a raspberry pi as controller. Bioprinting. 23, 00142 (2021).
- Golub, A. S., Pittman, R. N. Monitoring parameters of Oxygen transport to cells in the microcirculation. Quenched-Phosphorescence Detection of Molecular Oxygen. , 193-204 (2018).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Huang, C., Becker, M. F., Keto, J. W., Kovar, D. Annealing of nanostructured silver films produced by supersonic deposition of nanoparticles. Journal of Applied Physics. 102 (5), 054308 (2007).
- Foster, K. A., Galeffi, F., Gerich, F. J., Turner, D. A., Müller, M. Optical and pharmacological tools to investigate the role of mitochondria during oxidative stress and neurodegeneration. Progress in Neurobiology. 79 (3), 136-171 (2006).
- Schmidt, C. A., Fisher-Wellman, K. H., Neufer, P. D. From OCR and ECAR to energy: perspectives on the design and interpretation of bioenergetics studies. The Journal of Biological Chemistry. 297 (4), 101140 (2021).
- Stelzer, E. H., Lindek, S. Fundamental reduction of the observation volume in far-field light microscopy by detection orthogonal to the illumination axis: confocal theta microscopy. Optics Communications. 111 (5-6), 536-547 (1994).
- Pitrone, P. G., et al. OpenSPIM: an open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Legant, W. R., et al. High-density three-dimensional localization microscopy across large volumes. Nature Methods. 13 (4), 359-365 (2016).
- von Chamier, L., et al. Democratising deep learning for microscopy with ZeroCostDL4Mic. Nature Communications. 12 (1), 1-18 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır