Method Article
שיטה ללא להבה לעיקור C. elegans פיקים , מריתות ואזמלים
In This Article
Summary
מאמר זה מתאר שיטה לעיקור קטיף תולעים, מריתות ואזמלים באמצעות מיקרו משרפה במקום להבה פתוחה.
Abstract
Caenorhabtidis elegans (C. elegans) הוא אורגניזם מודל אופטימלי למחקר וחינוך במוסדות לתואר ראשון בעיקר. סטודנטים לתואר ראשון יכולים ללמוד במהירות את הטכניקה הסטרילית הנדרשת כדי לשמור על תרבויות C. elegans . עיקור של בחירות פלטינה המשמשות להעברת תולעים מצלחת אחת לאחרת נעשה באופן מסורתי על ידי החזקת הפיק בלהבה ממבער בונזן או פנס אתנול. עם זאת, מבערי בונזן דורשים מקור גז, ושני חלקי הציוד מהווים את הסיכון לשריפה מקרית הקשורה ללהבה פתוחה. כאן הודגמה טכניקה לעיקור קטיף תולעים, מריתות ואזמלים באמצעות מיקרו-משרפה בקטריולוגית אינפרה-אדומה. ציוד זה דורש רק שקע חשמל וממזער את סכנות האש הפוטנציאליות. על ידי הפחתת הסיכון ודרישות הגז, טכניקה זו מתאימה היטב למחקר ולהוראה במסגרת תואר ראשון.
Introduction
אורגניזם המודל C. elegans מתאים היטב הן למחקר והן לחינוך במוסדות לתואר ראשון בעיקר (PUIs) בשל העלות הנמוכה, קלות התחזוקה ומגוון היישומים 1,2,3,4. על מנת לטפל בתולעים - למשל, כדי להעביר תולעת מצלחת אחת לאחרת, נסיינים יכולים להשתמש בקטיף תולעים. ניתן לבצע או לרכוש מגוון בחירות לשימוש עם C. elegans. הבחירות מיוצרות בדרך כלל באמצעות קצה פלטינה או פלטינה/אירידיום, המורכב על ידית זכוכית, מתכת או עץ. ידיות זכוכית ניתן לייצר בתוך הבית על ידי המסת פיפטה פסטר סביב חוט פלטינה עד שהחוט מאובטח. מידע נוסף על גידול C. elegans, כולל כיצד לגדל ולתחזק תולעים ומקורות המזון שלהן, ניתן למצוא ב- WormBook5 ובמקורות אחרים 6,7,8.
כאשר עובדים עם C. elegans, טכניקות אספטיות משמשות בדרך כלל כדי למנוע זיהום עם חיידקים ופטריות. דוגמאות לטכניקות אספטיות כוללות עיקור של מכשירים, אוטוקלבים של ריאגנטים וביצוע עבודה בתחומים סטריליים. קטיף תולעים מעוקר בדרך כלל באמצעות להבה פתוחה9. בנוסף, עיקור של פיק התולעים משרף את התולעים, ובכך מונע ערבוב מקרי של זנים בעת עבודה עם זני תולעים מרובים. שיטות אופייניות לעיקור קטיף תולעים כוללות להבה פתוחה ממבער בונזן, פנס אתנול או מצית רגיל (טבלה 1). הייתה לנו מוטיבציה לחפש חלופות בטוחות יותר לשיטות הקיימות במעבדה כאשר סטודנט לתואר ראשון שפך אתנול ללא ידיעתו בזמן שמילא פנס אתנול והצית בטעות שריפה קטנה בעת הצתת הפנס. למרבה הצער, תאונות רבות דווחו באמצעות עששיות אתנול 10,11,12. למרבה המזל, שיטות עיקור חלופיות אומתו לשימוש במיקרוביולוגיה, ומטרת מאמר זה היא להדגים כיצד להשתמש בציוד זה כדי לעקר מכשירים לשימוש עם C. elegans.
במעבדות מיקרוביולוגיה, גם הטכניקה האספטית היא קריטית. לולאות וחוטים סרולוגיים העשויים מפלטינה מעוקרים באמצעות להבה פתוחה13 או מיקרו-משרפה 14,15,16. שמות אחרים למיקרו-משרפות כוללים מיקרו-מעקרים או בקט-משרפות. היתרונות של המיקרו-משרפה על פני שיטות הלהבה המסורתיות כוללים סכנת שריפה מופחתת, חיסול התזה של חומרים שנשרפו ויכולת לעבוד במכסה מנוע זרימה למינרי/ארון בטיחות ביולוגית 16,17,18. למעשה, הן האגודה האמריקאית למיקרוביולוגיה והן ארגון הבריאות העולמי ממליצים להשתמש במיקרו-משרפות על פני שימוש בלהבה פתוחה 17,19,20. בהשוואה למבערים של בונזן, מיקרו-משרפות גם אינן דורשות קו גז, שמעבדות מסוימות אולי לא היו צריכות, או שאולי לא היו ממוקמות בכל ספסל כדי שהסטודנטים יוכלו להשתמש בו. בהשראת יתרונות אלה, פותח פרוטוקול כדי להחליף את השימוש בלהבה במיקרו-משרפות לעיקור של מכשירים נפוצים כגון פיקים, מריתות ואזמלים במעבדת C. elegans. שיטה זו עשויה להתאים למדריכים ולחוקרים המבקשים לשפר את הבטיחות ו/או הגמישות בעת עבודה עם C. elegans.
Protocol
1. הכינו את המיקרו-משרפה
- חבר מדריך עזר למחזיק לולאה למיקרו-משרפה על-ידי חיתוךו אל הקנה החיצוני.
- חברו מיקרו-משרפה לשקע חשמל סטנדרטי של 120 וולט או 230 וולט לפי הצורך.
הערה: ניתן לעשות זאת על ספסל או במכסה זרימה למינרי. - סובבו את המיקרו-משרפה להגדרה הגבוהה ואפשרו לו להתחמם במשך 10-20 דקות בהתאם להוראות היצרן כדי להגיע לטמפרטורה אופטימלית של 800-825 מעלותצלזיוס.
הערה: אם שומרים על משרפה דולקת למשך יותר מ-3 שעות, ניתן להשתמש בהגדרת הטמפרטורה הנמוכה יותר (500 oC) כהגדרת המתנה. על פי מדריכי המשתמש של היצרנים, זה מאריך את החיים השימושיים של הציוד.
2. לעקר את הכיור, המרית או האזמל
- הכנס את המכשיר לאזור העיקור הגלילי מבלי לגעת בצדדים על ידי החלקה לאורך המדריך21.
הערה: אם מעקרים אזמל, חשוב להימנע מלגעת בקיר הקרמי עם הלהב. גירוד הדופן הקרמית עלול לפגוע בשלמות יחידת החימום. - החזק את המכשיר באזור העיקור במשך 5-7 שניות.
- הסר את הכלי מבלי לגעת בצדדים על ידי החלקה לאחור לאורך המדריך.
- עבור פיקים, אפשרו לכלי להתקרר במשך 3-5 שניות לפני שאתם נוגעים בתולעת כדי להימנע משריפתה.
הערה: אזמלים או מרית שאינם מורשים להתקרר ישירו את האגר. - לאחר קטיף התולעים, הכניסו מחדש את התולעים לתא במשך 5-7 שניות כדי לשרוף את כל התולעים על הברק.
3. שיטה השוואתית - עיקור מכשירים באמצעות מבער בונזן
- חברו את מבער בונזן לקו הגז באמצעות צינורות גומי. הקפידו לאבטח היטב את הצינורות ולמקם את המבער הרחק מחפצים עיליים.
- הפעל גז על ידי הפעלת הידית על קו הגז.
- הציתו את המבער באמצעות מכת או מצית.
- כוונו את הלהבה באמצעות ידית הגז וכניסת האוויר עד לעין חרוט כחול.
- החזיקו את הפיק, המרית או האזמל בלהבה עד שהיא זוהרת באדום.
- עבור פיקים, אפשרו לכלי להתקרר למשך 3-5 שניות לפני שאתם נוגעים בתולעת כדי להימנע משריפתה.
הערה: אזמלים או מרית שאינם מורשים להתקרר ישירו את האגר. - לאחר קטיף התולעים, הכנסו מחדש את הפיק בלהבה כדי לשרוף את כל התולעים על התולעים על הקטיף.
4. ניסוי
- תרבית חיידקי OP50 Escherichia coli (E. coli) במרק לוריא22 לילה על שייקר 37 oC.
- לאחר תרבית לילה, דיללו את התרבית במים סטריליים ביחס של 1:100.
הערה: גורם דילול זה נבחר כדי להבטיח הפרדת מושבות לאחר הציפוי. - טובלים את התולעת מעוקרת באמצעות מבער בונזן בתמיסת החיידקים, מעקרים מחדש עם מבער הבונזן ומסובבים אותו ב-100 מ"ל של מים סטריליים.
- צלחת 100 μL של מים על צלחת 10 ס"מ אגראגר 22,23 פטרי 10 ס"מ, מפזרים את המים באמצעות מפזר תאים סטרילי, ודגירה בטמפרטורת החדר במשך 24 שעות עם המכסה על.
- בצע שלבים 4.3-4.4 באמצעות קטיף תולעים מעוקר באמצעות מיקרו-משרפה.
- כבקרה חיובית, בצע שלבים 4.3-4.4 ללא עיקור מחדש.
- כבקרה שלילית, בצע שלבים 4.3-4.4 באמצעות מים סטריליים במקום תמיסת החיידקים.
- ספרו את המושבות באופן ידני לאחר תקופת הדגירה.
תוצאות
ניסוי פשוט (סעיף 4) הומצא כדי להדגים את שיעורי הזיהום היחסיים באמצעות מיקרו-משרפה לעומת להבה (איור 1, טבלה 2). בעוד שתוצאות אלה מייצגות שיעורי זיהום בין שיטות שונות, לא יהיה צורך לחזור על שיטה זו כדי להשתמש בטכניקת המיקרו-משרפה. הניסוי נערך במשולש. ההדברה השלילית הייתה מים סטריליים ללא חיידקים. הבקרה החיובית לא השתמשה בטכניקת העיקור: הפיק נטבל בתרבית OP50 המדוללת ואז הועבר ישירות למים הסטריליים. כל השכפולים והתנאים הופעלו במקביל באותו יום. בכל שלושת לוחות הבקרה השליליים נספרו אפס מושבות. ספירה ממוצעת של 4.7 מושבות (± 0.3 SEM) הושגה כאשר מבער בונזן שימש לעיקור פיקים. ספירה ממוצעת של 3.3 (±1.2 SEM) מושבות נצפתה במצב מיקרו-משרפה. עם זאת, ספירה ממוצעת של 298.3 (±17.9 SEM) הושגה במצב שליטה חיובי. בדיקת t בעלת 2 זנב בהנחה של שונות שווה המשווה בין מבער בונזן למיקרו-משרפה לא הניבה הבדל מובהק סטטיסטית, p = 0.35. לפיכך, המיקרו-משרפה השיגה תוצאות סטריליות יעילות באותה מידה למבער בונזן.
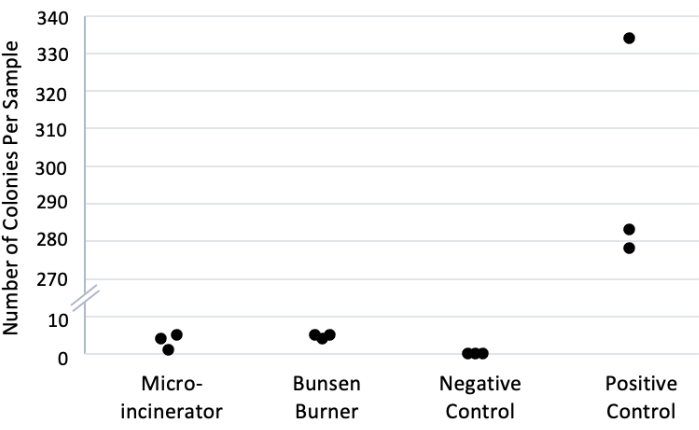
איור 1: ספירת חיידקים בשיטות עיקור שונות. הקוטים טבלו בתרבית OP50 של 1:100 במים סטריליים ולאחר מכן עוקרו באמצעות מבער בונזן או מיקרו-משרפה. לאחר מכן טבלו הקוטים במים סטריליים, צופו ב-LBagar 22,23, והודגמו במשך 24 שעות בטמפרטורת החדר, והמושבות נספרו ידנית. להדברה חיובית לא היה עיקור, ובקרה שלילית השתמשו במים סטריליים ללא חיידקים. n = 3 שכפולים לכל תנאי. הערה: ציר y שבור כדי לאפשר הפרדת נקודות נתונים בחלקים הרלוונטיים של הגרף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| שיטת העיקור | עלות | דרישות המעבדה | יתרונות | חסרונות | |||
| מיקרו-משרפה | $365–530 | שקע 120 V או 230 V | • נייד • ללא להבה פתוחה או גוף חימום חשוף • ניתן לשימוש במנדפי גלימה למינריים וארונות בטיחות ביולוגיים | • זמן חימום • עלות גבוהה יותר | |||
| בונזן ברנר | 24–169 דולר | קו גז | • הגדרה מהירה • עלות נמוכה | • להבה פתוחה • לא מומלץ לשימוש במכסה המנוע של זרימה למינרית או בארון בטיחות ביולוגי | |||
| מנורת אתנול | $11 | ללא | • הגדרה מהירה • עלות נמוכה • ניתן למילוי חוזר | • להבה פתוחה • סכנה בטיחותית בעת מילוי מחדש • לא מומלץ לשימוש במכסה המנוע של זרימה למינרית או בארון בטיחות ביולוגי • אסור במוסדות מסוימים | |||
| מצית | 5–8 דולר | ללא | • עלות נמוכה • נגיש • חד פעמי • ניתן למילוי חוזר | • להבה פתוחה • הפעלה ידנית • לא מומלץ לשימוש במכסה המנוע של זרימה למינרית או בארון בטיחות ביולוגי | |||
טבלה 1: השוואת שיטות לעיקור מכשירים. ארבע שיטות לעיקור מכשירים הושוו על בסיס יתרונות, חסרונות, עלויות ודרישות מעבדה.
| לשכפל | תנאי | |||
| מיקרו-משרפה | בונזן ברנר | שליטה שלילית | שליטה פוזיטיבית | |
| 1 | 1 | 5 | 0 | 278 |
| 2 | 4 | 4 | 0 | 334 |
| 3 | 5 | 5 | 0 | 283 |
| התכוון | 3.3 | 4.7 | 0.0 | 298.3 |
| SEM | 1.2 | 0.3 | 0.0 | 17.9 |
טבלה 2: נתונים גולמיים של ספירת חיידקים בשיטות עיקור שונות. הקוטים טבלו בתרבית OP50 של 1:100 במים סטריליים ולאחר מכן עוקרו באמצעות מבער בונזן או מיקרו-משרפה. לאחר מכן טבלו הקוטים במים סטריליים, צופו ב-LBagar 22,23, והודגמו במשך 24 שעות בטמפרטורת החדר, והמושבות נספרו ידנית. להדברה חיובית לא היה עיקור, ובקרה שלילית השתמשו במים סטריליים ללא חיידקים. n = 3 שכפולים לכל תנאי. ממוצע ו- SEM דיווחו מתחת לספירות בודדות.
Discussion
C. elegans הוא אורגניזם מודל המתאים היטב לתרגילים במעבדות הוראה לתואר ראשון. השימוש במיקרו-משרפות במקום להבות פתוחות מספק יתרונות הן במעבדות המחקר והן במעבדות הכיתה. למעשה, קורסי מעבדה לתואר ראשון עשויים להוות סיכון גבוה יותר לשריפות מקריות בהתחשב במספר המדענים החדשים שהוכשרו בחדר. בנוסף, הסיכון לאש עולה כאשר אתנול משמש לעיקור מכשירים ליד מקור הלהבה כמו אדי אתנול ניתנים להצתה. הניידות גם מקנה יתרון לכיתות שבהן קווי גז אינם מותקנים בכל ספסל. שיטה זו הופעלה במעבדות הוראה ומחקר במוסד שלנו, וכתוצאה מכך לא עלו בזיהום ואפס תאונות בטיחות במעבדה מאז הקמתה בשנת 2016.
כדי להבטיח תאימות למיקרו-משרפות, נבדקו מגוון של פיקים עם הרכבות שונות, הרכבי חוטים ומדדי חוטים שונים. הרכב החוטים כלל 100% פלטינה וכן 90% פלטינה/10% אירידיום בעובי חוט של 30-32 גרם, וללא קשר לעובי והרכב, שיטת החימום לא פגעה בשלמות החוט. ההרכבות כללו שני סוגים שונים של ידיות איסוף זמינות מסחרית ותושבות זכוכית תוצרת בית מבית של פיפטות פסטר. שימו לב שהבחירות אינן זוהרות באדום-חם כפי שהן זוהרות בלהבה. עם זאת, עיקור מספיק עדיין מושגת כל עוד העיקור הגיע לטמפרטורה הנכונה. לכן, זה קריטי לאפשר למיקרו-משרפה להתחמם במשך 10 או 20 דקות, כפי שצוין בהוראות היצרן. שמירה על המכשיר בתא במשך 5 שניות לפחות כדי להשיג עיקור היא גם קריטית. השארת הכלי בתא שאורכו עולה על 7 שניות לא תגרום נזק לכלי אלא היא מיותרת. אמנם זהו הליך פשוט יחסית עם צעדים מינימליים ולא סביר שיזדקק לפתרון בעיות, אך ייתכן שיידרש תרגול מסוים כדי ללמוד לייצב את המכשיר בחבית מבלי לגעת בצדדים.
על מנת להחליף להבה פתוחה, שיטת עיקור חייבת לכסות את כל היישומים המשמשים במעבדה. בנוסף למכשירי עיקור, מעבדות C. elegans עשויות גם להשתמש במבערי בונזן כדי ליצור שדה סטרילי לביצוע משימות אחרות כגון מזיגת צלחות או חיסון תרביות13. עם זאת, השאלה אם זה יוצר שדה סטרילי או שואב מזהמים שעדיין בני קיימא נותרה שנויה במחלוקת14. למרות שאינה אופציה בכל המוסדות, ארון בטיחות ביולוגית או מכסה מנוע זרימה למינרי יכול לשמש למטרות אלה, המאפשר למעבדה לתפקד ללא שימוש בלהבות פתוחות. חוברות הוראות לרוב המיקרו-משרפות ממליצות שלא להשתמש בעיקור להבי אזמל מכיוון ששריטת הקירות הפנימיים פוגעת במעקר. עם זאת, אם משתמשים בזהירות במדריך, ניתן לעקר להב אזמל או מרית מבלי לגעת בקירות הפנימיים. זה מרחיב את השימוש בטכניקה כדי לאפשר קיבוץ ללא שימוש בלהבה ומאפשר למעבדה של C. elegans לתפקד מבלי להחליף טכניקות בין עיקור עצמים שונים.
כפי שמתואר בטבלה 1, מיקרו-משרפות מציעות בטיחות מוגברת, תאימות מוגברת למכסי זרימה למינריים וניידות מוגברת על פני שיטות מבוססות להבה, אך יש להן מגבלות. הם יקרים יותר מהשיטות האחרות ודורשים זמן חימום לפני שטמפרטורות העיקור מושגות. לסיכום, שיטה זו, המשמשת באופן שגרתי במעבדות מיקרוביולוגיה רבות, עשויה להיות ישימה בכמה מעבדות מחקר והוראה של C. elegans המבקשות לשפר את בטיחות המעבדה מבלי להתפשר על העקרות.
Disclosures
לא נחשפו ניגודי עניינים.
Acknowledgements
המחברים רוצים להודות לסוזן הווארד וג'סטין פין. עבודה זו מומנה על ידי המחלקה למדעי המוח במכללת וולסלי. תולעי N2 סופקו על ידי CGC הממומן על ידי המשרד לתוכניות תשתית מחקר של NIH (P40 OD010440). דמי הפרסום עבור מאמר זה נתמכו על ידי קרן הגישה הפתוחה של הספרייה ושירותי הטכנולוגיה של מכללת וולסלי.
Materials
| Name | Company | Catalog Number | Comments |
| 90% platinum 10% iridium wire | Tritech | PT-9010 | Other sources and wire compositions may be used. |
| Agarose | Sigma Aldrich | A6013 | LB agar ingredient |
| Bunsen burner | Fisher Scientific | 50-110-1225 | Other Bunsen burners may be used |
| Ethanol Lamp | Carolina | 706604 | Included here as a reference to Table 1 |
| Lighter | Carolina | 706636 | Included here as a reference to Table 1 |
| Loop holder accessory | Fisher | 22-630-002 | Referred to in the manuscript as "guide" |
| Micro-incinerator | Thomas Scientific | 1154J15 | There are many companies that sell similar equipment. Similar models also sold by Benchmark Scientific (B1001), Fisher Scientific (22-630-001), Carolina (703400), and BT Lab Systems (BT1702). |
| N2 worms | CGC | N2 | |
| NaCl | Sigma Aldrich | S5886 | LB ingredient |
| OP50 E. coli | CGC | OP50 | |
| Petri dish | Fisher | 08-772B | |
| Pick handle | Tritech | TWPH1 | |
| Scalpel blade | Fisher | 12-000-161 | |
| Scalpel handle | Fisher | 12-000-164 | |
| Spatula | Fisher | 14-374 | Other spatulas will work |
| Sterile cell spreaders | VWR | 76206-438 | Other cell spreaders may be used as long as they are sterile |
| Tryptone | Sigma Aldrich | T7293 | LB ingredient |
| Yeast Extract | Sigma Aldrich | Y1625 | LB ingredient |
References
- Attix, H., et al. Wild caught nematode identification and early embryo development: An accessible undergraduate research experience. microPublication Biology. 2021, (2021).
- Rose, J. K. Demonstrating connections between neuron signaling and behavior using C. elegans learning assays and optogenetics in a laboratory class. Journal of Undergraduate Neuroscience Education. 16 (3), 223-231 (2018).
- Lemons, M. L. An inquiry-based approach to study the synapse: Student-driven experiments using C. elegans. Journal of Undergraduate Neuroscience Education: JUNE: A Publication of FUN, Faculty for Undergraduate Neuroscience. 15 (1), 44-55 (2016).
- Raley-Susman, K. M., Gray, J. M. Exploration of gerontogenes in the nervous system: a multi-level neurogenomics laboratory module for an intermediate neuroscience and behavior course. Journal of Undergraduate Neuroscience Education. 8 (2), 108-115 (2010).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. Elegans Biology. , 1-11 (2006).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Cerón, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments: JoVE. (64), e4019 (2012).
- JoVE. Biology I: yeast, Drosophilia, and C. Elegant. C. Elegans Maintenace. JoVE Science Education Database. , (2022).
- Hope, I. A. . C. elegans: A Practical Approach. , (1999).
- Meneely, P. M., Dahlberg, C. L., Rose, J. K. Working with Worms: Caenorhabditis elegans as a Model Organism. Current Protocols Essential Laboratory Techniques. 19 (1), 35 (2019).
- Waechter-Brulla, D. Improving safety in the microbiology laboratory through active learning and investigation. American Society for Microbiology. , (2000).
- Young, J. A. It says in the books that ethanol burns with a cool flame. Journal of Chemical Education. 77 (11), 1488 (2000).
- Mojtabai, F., Kaufman, J. A. . Learning by accident. V. 2. , (2005).
- JoVE. General Laboratory Techniques. Introduction to the Bunsen Burner. JoVE Science Education Database. , (2022).
- Bykowski, T., Stevenson, B. Aseptic Technique. Current Protocols in Microbiology. 56 (1), 98 (2020).
- Katz, D. S. The streak plate protocol. American Society for Microbiology Laboratory Protocols. , (2008).
- Public Health Agency of Canada. Agency of Canada Canadian Biosafety Handbook. Government of Canada. , (2016).
- Emmert, E. A. B. ASM Task Committee on Laboratory Biosafety Biosafety guidelines for handling microorganisms in the teaching laboratory: development and rationale. Journal of Microbiology & Biology Education. 14 (1), 78-83 (2013).
- Collins, C. H., Pal, S. B. Health Hazards in Microbiology. Handbook of Laboratory Health and Safety Measures. , (1990).
- Laboratory Biosafety Manual. World Health Organization Available from: https://www.who.int/publications/I/item/9789240011311 (2020)
- Fleming, D. O. Laboratory Safety Principles and Practices. American Society for Microbiology. , (1995).
- Gordon, R. C., Davenport, C. V. Simple modification to improve usefulness of the Bacti-Cinerator. Applied Microbiology. 26 (3), 423 (1973).
- Cold Spring Harbor. LB (Luria-Bertani) liquid medium. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Cold Spring Harbor. Media containing agar or agarose. Cold Spring Harbor Protocols. 2006 (1), (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved