Method Article
זיהוי פשוט ומהיר של הגברה מבוססת מעגל של פעילות טופואיזומראז 1 בדגימות ביולוגיות גולמיות
In This Article
Summary
מתואר פרוטוקול לזיהוי רגיש וכמותי של פעילות טופואיזומרז 1 באמצעות בדיקת זיהוי פעילות אנזים משופרת במעגל מתגלגל. השיטה מאפשרת זיהוי של פעילות טופואיזומראז 1 מרכיבים מטוהרים או תמציות תאים/רקמות. לפרוטוקול זה יש יישומים נרחבים בכל תחום הכרוך בזיהוי פעילות אנזימטית.
Abstract
טכניקות מבוססות הגברה איזותרמית כגון הגברת מעגל מתגלגל שימשו בהצלחה לזיהוי חומצות גרעין, כמויות חלבון או מולקולות רלוונטיות אחרות. שיטות אלה הוכחו כחלופות משמעותיות ל-PCR או ל-ELISA עבור יישומים קליניים ומחקריים. יתר על כן, זיהוי כמות החלבון (על ידי כתם מערבי או אימונוהיסטוכימיה) אינו מספיק לעתים קרובות כדי לספק מידע לאבחון סרטן, בעוד שמדידת פעילות האנזים מייצגת סמן ביולוגי בעל ערך. מדידת פעילות האנזים מאפשרת גם אבחון וטיפול פוטנציאלי במחלות המועברות על ידי פתוגנים. בכל האאוקריוטים, טופואיזומראזות הן האנזימים הקושרים DNA המרכזיים המעורבים בשליטה על המצב הטופולוגי של הדנ"א במהלך תהליכים תאיים חשובים, והם בין הסמנים הביולוגיים החשובים לפרוגנוזה ולטיפול בסרטן.
במהלך השנים, טופואיזומראזות נחקרו באופן משמעותי כיעד פוטנציאלי לתרופות אנטי-פרזיטיות ואנטי-סרטניות עם ספריות של תרכובות טבעיות וסינתטיות של מולקולות קטנות הנחקרות מדי שנה. כאן מוצגת שיטת ההגברה של המעגל המתגלגל, המכונה בדיקת זיהוי פעילות אנזים משופרת של מעגל מתגלגל (REEAD) המאפשרת מדידה כמותית של פעילות טופואיזומראז 1 (TOP1) באופן פשוט, מהיר ונטול ג'ל. על ידי ביקוע וקשירת מצע דנ"א שתוכנן במיוחד, TOP1 ממיר אוליגונוקלאוטיד DNA למעגל סגור, שהופך לתבנית להגברת מעגל מתגלגל, ומניב ~10 3 תוצרי מעגל מתגלגל חוזר. בהתאם לשילוב הנוקלאוטידים במהלך ההגברה, קיימת אפשרות לשיטות קריאה שונות, החל מפלואורסצנציה ועד כימילומינסנציה ועד קולורימטרי. מכיוון שכל קשירת מחשוף בתיווך TOP1 יוצרת מעגל דנ"א סגור אחד, הבדיקה רגישה מאוד וכמותית באופן ישיר.
Introduction
טופואיזומראזות שייכות לקבוצת האנזימים המשנים את הדנ"א, ורבים מהם הוכחו כיעילים כסמנים ביולוגיים למחלות אנושיות 1,2,3,4,5,6. TOP1 מעורב בפתרון העקה הטופולוגית הקשורה לתהליכים תאיים כגון שכפול DNA, שעתוק גנים, רקומבינציה והפרדה כרומוזומלית7. TOP1 יכול לפתור גם סופר-קוילים שליליים וגם חיוביים על ידי מנגנון הכולל היווצרות של שבר חד-גדילי חולף בדנ"א 8,9. לאחר קשירת הדנ"א, TOP1 ממקם את האתר הפעיל טירוזין (Tyr723) כדי לבצע התקפה נוקלאופילית על עמוד השדרה של הפוספודיסטר. לאחר מכן נוצר קומפלקס ביקוע TOP1-DNA כאשר האנזים מחובר באופן קוולנטי לקצה 3'-קצה של גדיל הדנ"א השבור. פעולה זו משחררת לחץ פיתול בכך שהיא מאפשרת לקצה ה-5' של הגדיל הבקע להסתובב סביב הגדיל השלם. לבסוף, קבוצת ההידרוקסיל של קצה 5 מבצעת התקפה נוקלאופילית על הקשר 3'-phosphotyrosyl. כתוצאה מכך, TOP1 משתחרר, ואת עמוד השדרה DNA משוחזר8.
מספר מבחנים פותחו כדי לחקור את השלבים של המחזור הקטליטי TOP1, כולל מבחן ההרפיה 10, מבחן ההסטה של הניידות האלקטרופורטית (EMSA)11,12, מבחני הבקיעה-קשירת ההתאבדות של DNA13,14, וקומפלקס in vivo של אנזימים (ICE)מבחן 15 . עם זאת, למבחנים אלה יש מספר מגבלות מכיוון שהם תלויים באלקטרופורזה בג'ל, הדורשת סוכני אינטרקלציה של DNA, או שהם דורשים הכשרה וציוד מיוחדים ביותר. יתר על כן, הבדיקות דורשות כמויות גדולות של אנזים TOP1 מטוהר (החל מ-1 עד 5 ננוגרם לבדיקת ההרפיה ו-50 עד 200 ננוגרם ל-EMSA ולבדיקת קשירת הבקיעה) או תמציות מלפחות 106 תאים כדי לתפקד בצורה מיטבית. לכן, פותחה שיטה רגישה ביותר המאפשרת זיהוי ספציפי של פעילות TOP1 בדגימות ביולוגיות גולמיות וברמת האירוע הקטליטי היחיד, הנקראת בדיקת REEAD,16.
כאן מוצג פרוטוקול לזיהוי פעילות TOP1 באמצעות מבחן REEAD16 . ייצוג סכמטי של הבדיקה מתואר באיור 1. רשת סיליקון שעוצבה בהתאמה אישית מחוברת לשקופית פונקציונלית כדי ליצור מערך רב-שקופיות זכוכית, הנקרא wellmaker להלן (איור 1A). לאחר מכן מתבצע צימוד של פריימר שונה של 5'-אמינו לקבוצות ה-NHS הפונקציונליות בבארות של השקופית (איור 1B). תגובת ביקוע וקשירת בתיווך TOP1 ממירה מצע דנ"א מסוים למעגל סגור. המצע הספציפי ל-TOP1 (איור 1C) מתקפל באופן ספונטני לצורת משקולת המכילה גבעול דו-גדילי ושתי לולאות חד-גדיליות. אחת הלולאות משלימה את הפריימר המעוגן על פני השטח. אזור הגבעול מכיל אתר ביקוע TOP1 מועדף שלושה בסיסים במעלה הזרם מהקצה 3'-ושלוחה 5'-הידרוקסיל. ניתן להשיג סירקולריזציה של המצע באמצעות תמצית תאים/רקמות (איור 1C) או באמצעות TOP1 רקומביננטי ומטוהר (איור 1D).
כאשר הסובסטרט נבקע על ידי TOP1, האנזים הופך להיות קשור באופן חולף לקצה 3'-והמקטע בעל שלושת הבסיסים מתפזר, מה שמאפשר ל-5'-overhang להתמסר לסובסטרט ומקל על קשירת TOP1 בתיווך. הקשירה גורמת למעגליות של המצע ולאחר מכן לדיסוציאציה של TOP1. המעגל הסגור הוא הכלאה לפריימר המעוגן על פני השטח (איור 1E) ומשמש כתבנית להגברת מעגל מתגלגל איזותרמי (RCA) בתיווך הפולימראז phi29, שיכול לבצע RCA עם תזוזת גדיל, ולהניב 10 3 מוצריםחוזרים טנדם . במהלך שלב ה-RCA, ניתן לשלב נוקלאוטידים המסומנים באופן פלואורסצנטי (איור 1F) או נוקלאוטידים מצומדים לביוטין (איור 1G)17. שילוב של נוקלאוטידים המסומנים באופן פלואורסצנטי מאפשר זיהוי של ה-RCPs באמצעות מיקרוסקופ פלואורסצנטי או סורק פלואורסצנטי. לחלופין, נוגדן אנטי-ביוטין מצומד לחזרת פרוקסידאז (HRP) (איור 1H) יכול לקשור את הנוקלאוטידים הביוטינילטים, ובכך לאפשר זיהוי של תוצרי המעגל המגולגל (RCPs) באמצעות כימילומינסנציה משופרת (ECL) או על ידי המרה של 3,3',5,5'-טטרה-מתיל-בנזידין (TMB) לצבע הניתן לזיהוי. ה-RCA עוקב אחר תגובה קינטית ליניארית, מה שהופך את מבחן REEAD לכמותי באופן ישיר, שכן RCP אחד מייצג תגובת קשירת ביקוע יחידה בתיווך TOP1. כאן מוצג כי בדיקה זו יכולה לשמש לזיהוי פעילות TOP1 כאנזים רקומביננטי מטוהר או מופק מדגימות גולמיות וככלי סינון תרופות נגד TOP1.
Protocol
הערה: מצא רשימה של הרכבי חיץ, ציוד וחומרים אחרים הנדרשים בטבלת החומרים.
1. תרבית תאים
- תרבית התאים המועדפים במדיום מתאים וגידולם על פי ההוראות. לדוגמה, לגדל Caco2, תאים שמקורם באדנוקרצינומה של המעי הגס, במדיום חיוני מינימלי (MEM) בתוספת 20% סרום בקר עוברי (FBS), 1% חומצות אמינו לא חיוניות (NEAA), 100 יחידות / מ"ל פניצילין, ו 100 מ"ג / מ"ל סטרפטומיצין. לשמור על תרביות התאים באינקובטור לח (5% CO2/95% אווירת אוויר ב 37 מעלות צלזיוס). צלחת את התאים לתוך צלוחיות תרבית רקמה ולהתפצל כל 3 ימים כדי לשמור על התאים ב 70% מפגש.
- יש לקצור את התאים מבקבוק מפגש של 70% על ידי טיפול בטריפסין (0.25% טריפסין, תמיסת EDTA של 0.02%) ולשטוף עם מלח עם מאגר פוספט (PBS).
- השהה את כדור התא ב- PBS כדי להתאים את ריכוז התא ל- 0.5 × 106 תאים / צינור. סובבו ב-200 × גרם למשך 5 דקות ושאפו בזהירות את הסופר-נטנט.
הערה: יש להשתמש בתאים המשמשים ל-REEAD טריים ולשמור אותם על קרח. התוצאות המתקבלות עם תאי Caco2 פורסמו לאחרונה17. הבדיקה נבדקה עם מגוון קווי תאים, כולל תאים שמקורם במעי הגס, השד, הריאה וצוואר הרחם 18,19,20,21,22,23, אך ניתן להשתמש בה עם כל הדגימות הביולוגיות הגולמיות המכילות TOP1, כגון רקמות, דם ורוק.
2. הכנת שקופיות פונקציונליות
- חברו את רשת מבודד הסיליקון המעוצבת בהתאמה אישית לשקופית הפונקציונלית, ובכך יצרו את הבאר. לחצו על הסיליקון כדי למנוע היווצרות של בועות אוויר (ראו איור 1A).
- הכן תערובת של פריימר 5 μM 5'-אמינו במאגר הדפסה 1x. מוסיפים 4 μL של התערובת לכל באר ומכניסים את הוולמקר לתא הכלאה עם NaCl רווי בטמפרטורות שבין 15 מעלות צלזיוס ל -25 מעלות צלזיוס, מוגן מפני אור.
הערה: ניתן ליצור בקלות תא הכלאה באמצעות קופסת קצה פיפטה מלאה ב- NaCl רווי. ההכלאה אורכת מינימום של 16 שעות ומקסימום של 72 שעות. ראו את הרצף של פריימר 5'-אמינו באיור 1B. השקופיות מתפקדות עם קבוצות NHS כדי לאפשר קשירה של אוליגונוקלאוטידים שעברו שינוי אמינו.
3. יצירת מצעים מעגליים סגורים
- הכנת מצעים מעגליים סגורים עם TOP1 רקומביננטי או תמצית תאים.
- Lyse כדור תא של 0.5 × 10 6 תאים ב 500 μL של Lysis Buffer להגיע לצפיפות תאים של 1,000תאים / μL. דגירה במשך 10 דקות על קרח.
- הכינו תערובת מעגלית של 2 μL של 5 μM TOP1 מצע ספציפי (רצף המצע הוא כדלקמן: 5'-AGA AAA ATT TTT AAA AAA ACT GTG AAG ATC GCT TAT TTT TTT AAA AAT AAA TCT AAG TCT TTT TTT TCC CTC AAT GCA CAT GTT TGG CTC CGA TCT AAA AGA CTT AGA-3') ו-2 μL של אנזים TOP1 רקומביננטי או 2 μL של תמצית תאים (ראה שלב 3.1.1) ב-16 μL של 1x TOP1 מאגר תגובה.
הערה: ריכוז ה-TOP1 הרקומביננטי שבו נעשה שימוש תלוי בשיטת הקריאה שנבחרה (ראו איור 2, איור 3, איור 4 ואיור 5). ראו את הרצף של המצע הספציפי ל-TOP1 באיור 1C. - דגירה במשך 30 דקות ב-37 מעלות צלזיוס (ראו איור 1C,D).
- עצור את התגובה על ידי הוספת 2 μL של 1% SDS.
- הכנת מצעים מעגליים סגורים בנוכחות תרופות
- הכינו תערובת מעגלית של 2 μL של 5 μM TOP1 מצע ספציפי ו-1 μL של 100% DMSO או 1 μL של 1.6 mM קמפטוטצין (CPT) ב-14 μL של מאגר תגובה 1x TOP1. יש להוסיף 2 מיקרוגרם של אנזים TOP1 רקומביננטי 5 ננוגרם/מיקרון.
הערה: ניתן להשתמש בתרכובות או בתרופות אחרות של מולקולות קטנות. במקרה כזה, יש לבצע טיטרציה של המתחם. אם התרכובת מומסת בממס שאינו DMSO, יש להשתמש בה כבקרה במקום DMSO. - דגירה במשך דקה אחת ב 37 מעלות צלזיוס.
- עצור את התגובה על ידי הוספת 2 μL של 1% SDS.
- הכינו תערובת מעגלית של 2 μL של 5 μM TOP1 מצע ספציפי ו-1 μL של 100% DMSO או 1 μL של 1.6 mM קמפטוטצין (CPT) ב-14 μL של מאגר תגובה 1x TOP1. יש להוסיף 2 מיקרוגרם של אנזים TOP1 רקומביננטי 5 ננוגרם/מיקרון.
הערה: ניתן להתחיל את שלב 3 במקביל לשלב 2, וניתן לאחסן את המעגלים בטמפרטורה של 4 מעלות צלזיוס למשך הלילה. לחלופין, ניתן להכין את מעגלי הדנ"א במקביל לשלב 4 ולהשתמש בהם באופן מיידי. ראו את הרצף של המצע הספציפי ל-TOP1 באיור 1C. המצע מתקפל לצורת משקולת עם אזור גבעול כפול המכיל אתר מחשוף TOP1 מועדף ושתי לולאות חד-גדיליות. מצע המשקולת הפתוחה מומר למצע מעגלי סגור על ידי מחשוף וקשירה בתיווך TOP1 והוא מכונה להלן מעגל. מכיוון שיש עודף של פריימר 5'-אמינו, לא תהיה תחרות בין מצעים פתוחים וסגורים ספציפיים ל- TOP1.
4. חסימת הבאר
- טבלו את הבאר במגש בגודל 5 ס"מ על 5 ס"מ מלא ב-Buffer 1 שחומם מראש ל-50 מעלות צלזיוס. על ידי שימוש בפיפטה, דחפו את הנוזל לתוך הבארות כדי לוודא שאין בועות אוויר. דגירה במשך 30 דקות ב 50 מעלות צלזיוס.
- יש להסיר את חיץ 1 ולשטוף 2 x 1 דקות עם dH2O. יש ללחוץ במרץ ביד.
- הוסף את Buffer 2 שחומם מראש ל-50°C. וודאו שאין בועות אוויר בבארות. דגירה במשך 30 דקות ב 50 מעלות צלזיוס.
- יש לשטוף 2 x 1 דקות עם dH2O. יש ללחוץ במרץ ביד.
- יש לשטוף עם 70% EtOH למשך דקה אחת. ללחוץ במרץ ביד.
- תנו ליצרן הבאר להתייבש באוויר.
הערה: השתמש באוויר דחוס כדי לייבש את הבארות. לחלופין, ניתן לנשוף אוויר באמצעות פיפטה פסטר. ודא שהבארות יבשות לפני שתמשיך.
5. הכלאה של המעגלים לבאר
- הוסף 4 μL של העיגולים (שנעשו בשלב 3) לכל באר מתאימה.
- מניחים את הבאר בתא לחות למשך שעה אחת עם dH2O ב-37 מעלות צלזיוס.
הערה: ניתן ליצור תא לחות על ידי שימוש בקופסה לקצוות פיפטה מלאים ב- dH2O. לחלופין, ניתן לבצע את ההכלאה למשך הלילה בטמפרטורה של 25 מעלות צלזיוס בתא הלחות.
6. כביסה
- שטפו את הבאר עם חיץ 3.
- הסר את מאגר 3 והחלף במאגר 4.
- יש להסיר את Buffer 4 ולשטוף עם 70% EtOH.
- הסר את ה- EtOH ותן ליצרן הבאר להתייבש.
הערה: כל שלבי הכביסה מבוצעים למשך דקה אחת במגש בגודל 5 ס"מ על 5 ס"מ על ידי טבילה מלאה של המגלשה. וודאו תמיד שאין בועות אוויר בתוך הבארות.
7. הגברה מעגלית מתגלגלת
- הכינו תערובת RCA של 1x Phi29 Reaction Buffer בתוספת 0.2 מיקרוגרם/μL BSA, יחידה אחת של Phi29 פולימראז, ו-0.25 mM dNTP ו-0.0125 mM ATTO-488-dUTP לקריאה פלואורסצנטית, או 0.1 mM dATP, 0.1 mM DTTP, 0.1 mM dGTP, 0.09 mM dCTP ו-0.01 mM Biotin-dCTP לקריאת צבע/כימילומינסנציה. יש להוסיף 4 מיקרון לכל באר. ראו איור 1E.
הערה: הכנת תערובת RCA חייבת להיעשות על קרח. בעת שילוב נוקלאוטידים פלואורסצנטיים ב-RCA, יש להימנע מאור ישיר משלב זה כדי להגן על הפלואורופורים. - דגירה במשך 2 שעות ב 37 מעלות צלזיוס בתא הלחות. במקרה של שימוש בנוקלאוטידים פלואורסצנטיים, הגדר את תא הלחות בחושך. ראה איור 1F,G.
8. כביסה
- עבור פרוטוקולי הקריאה הכימילומינסנציה או הצבע, יש לשטוף את הבאר כמו בשלב 6, ולאחר מכן להמשיך לשלב 11.
- עבור פרוטוקול הקריאה הפלואורסצנטית, הסר את רשת הסיליקון באמצעות פינצטה לפני השטיפה כמו בשלבים הבאים.
- שטפו את המגלשה במשך 10 דקות במאגר 3.
- הסר את מאגר 3 והחלף במאגר 4. יש לשטוף במשך 5 דקות.
- יש להסיר את חיץ 4 ולשטוף במשך דקה אחת ב-70% EtOH.
- הסר את ה- EtOH ותן ליצרן הבאר להתייבש.
9. הדמיה של תוצרי מעגל גלגול פלואורסצנטי באמצעות סורק פלואורסצנטי
- סרוק את השקופית בסורק פלואורסצנטי באמצעות המסננים המתאימים לפלואורופור שבו נעשה שימוש. השתמש במולטיפלייר המקסימלי האפשרי שאינו נותן רוויה.
הערה: סורק הפלואורסצנט המשמש לרכישת תמונה בפרוטוקול זה מצויד בלייזר של 473 ננומטר ובעירור מסנן FAM בגודל 490 ננומטר, פליטה של 520 ננומטר. - ייבוא התמונה ל- ImageJ ושינוי סוג התמונה ל - 8 סיביות (תמונה | סוג | 8 סיביות). למדידת הפסים בנפרד, הגבל את השטח שנמדד באמצעות כלי ציור המלבן מסרגל הכלים. ציירו את האזור הרצוי ומדדו את העוצמה (ניתוח | למדוד). לאחר מכן, הזיזו את האזור שצויר במקור לרצועה הבאה ומדדו.
- התווה את הנתונים בתוכנה הרצויה. תמונות מייצגות הכוללות כימות שחולץ מ-ImageJ מתוארות באיור 2.
10. הדמיה של תוצרי מעגל מתגלגל פלואורסצנטי באמצעות מיקרוסקופ פלואורסצנטי
- בעזרת עט עמיד ל-EtOH, ציירו את מיקום הבארות לפני הסרת רשת הסיליקון ושטפו את המגלשה כמו בשלב 8.2. לאחר שלבי הכביסה, הרכב את המגלשה עם 1 μL של מדיום הרכבה ללא 4',6-diamidino-2-פנילינדול (DAPI) והוסף כיסוי. כדי לאפשר הדמיה במצלמה, הדבק את השקופית על שקופית מיקרוסקופ בגודל 76 מ"מ x 26 מ"מ.
- נתח באמצעות מיקרוסקופ פלואורסצנטי המצויד במטרה לטבול בשמן פי 60 ומצלמה. צלם 12-15 תמונות של כל דגימה/באר.
- ייבוא התמונות ל- ImageJ וערימה של התמונות (תמונה | ערימות | תמונה לערימה). שינוי סוג התמונה ל - 8 סיביות (תמונה | סוג | 8 סיביות).
- הגדר את הסף (תמונה | התאמה | סף).
- הגדר את הסף באופן הבא: הגדר את הסרגל התחתון והתאם את הסרגל העליון כך שרק האותות הנכונים יהיו אדומים והרקע יהיה שחור. ודא שהסף נמוך ככל האפשר לפני שהאותות האמיתיים יתחילו להיעלם.
- טאטאו את התמונות הבודדות וודאו שהן תואמות לתמונות לפני קביעת הסף. שים לב שהסף עשוי להשתנות מניסוי לניסוי.
- ספירת האותות (ניתוח | לנתח חלקיקים). ודא שהשדה המסוכם בהגדרות ImageJ מסומן.
- ייצא את התוצאות לגיליון אלקטרוני או לתוכנה אחרת לעיבוד נתונים נוסף. תמונות מייצגות הכוללות כימות שחולץ מ-ImageJ מתוארות באיור 3.
11. צימוד של נוגדן אנטי-ביוטין מצומד HRP למוצרי מעגל מתגלגל המסומנים בביוטין
- הוסיפו 4 מיקרון ליטר של נוגדן אנטי-ביוטין מצומד HRP מדולל 1:300 ב-Buffer 5 בתוספת 5% חלב דל שומן ללא שומן ו-5% BSA לכל באר.
- דגירה במשך 50 דקות בטמפרטורה של 15-25 מעלות צלזיוס בתא הלחות (ראו איור 1H).
- לשטוף 3 x 3 דקות עם מאגר 5.
- ייבשו את הבאר.
12. הדמיה של מוצרי מעגל מתגלגל עם תווית ביוטין
- הדמיה עם ECL
- יש לערבב 40 μL של ECL Luminol ו-40 μL של H 2O2 מיד לפני השימוש. יש להוסיף 2 מיקרון לכל באר.
- הצג את השקופית באופן חזותי באמצעות מצלמת CCD או בסרטי רנטגן.
- תצוגה חזותית עם TMB
- לאחר שלב 11.4, הסר את רשת הסיליקון. לאחר מכן, הוסף 400 μL של TMB על גבי השקופית כולה והנח את המגלשה בתא לחות. המתן ~ 5-10 דקות לפיתוח צבע. לאחר פיתוח הצבע, לשטוף את השקופית עם 70% EtOH.
- דמיינו את התפתחות הצבע בעין בלתי. צלם תמונה של השקופית באמצעות מצלמת תמונות או טלפון נייד.
- ייבוא התמונה ל- ImageJ ושינוי סוג התמונה ל - 8 סיביות (תמונה | סוג | 8 סיביות). למדידת הפסים בנפרד, הגבל את השטח שנמדד באמצעות כלי ציור המלבן מסרגל הכלים. ציירו את האזור הרצוי ומדדו את העוצמה (ניתוח | למדוד). לאחר מכן, הזיזו את האזור שצויר במקור לרצועה הבאה ומדדו.
- התווה את הנתונים בתוכנה הרצויה. תמונות מייצגות הכוללות כימות שחולץ מ-ImageJ מתוארות באיור 4, איור 5 ואיור 6.
תוצאות
כאן, פרוטוקול לזיהוי פעילות TOP1 באמצעות מבחן REEAD מוצג16. הפרוטוקול שימש לזיהוי פעילות TOP1 רקומביננטית באמצעות ארבע שיטות קריאה שונות: סורק פלואורסצנטי, מיקרוסקופ פלואורסצנטי, כימילומינסנציה וצבע. הפרוטוקול שימש גם לזיהוי הפעילות של TOP1 המופק מתאי Caco2, כדוגמה לתמצית גולמית, עם כימילומינסנציה או קריאת TMB. יתר על כן, הפרוטוקול שימש ככלי לסינון תרופות, כדי לזהות את העיכוב של פעילות TOP1 רקומביננטית על ידי CPT, כדוגמה למעכב ספציפי ל- TOP1, באמצעות שיטת הקריאה chemiluminescence.
התוצאות המתקבלות כאשר מנתחים את פעילות TOP1 באמצעות הקריאה הפלואורסצנטית מתוארות באיור 2 ובאיור 3. סריקה מייצגת של השקופית הפלואורסצנטית והכימות המתקבל מוצגים באיור 2. כפי שניתן לראות מהכימות, לקריאה זו יש מגבלת זיהוי של 12.5 ננוגרם של TOP1. תמונות מייצגות והכימות המתקבל מתקבל בעת שימוש במיקרוסקופ פלואורסצנטי מוצגים באיור 3. באמצעות שיטת קריאה זו, מגבלת הזיהוי היא רק 0.1 ננוגרם של TOP1. התוצאות המתקבלות כאשר מנתחים את פעילות TOP1 באמצעות קריאת הכימילומינסנציה מתוארות באיור 4, והתוצאות מהקריאה הצבעונית מתוארות באיור 5. גבול הזיהוי של שיטות קריאה אלה הוא 6 ננוגרם של TOP1 או כ-TOP1 המופק מ-312 תאי Caco2. איור 6 מציג את המדידות של פעילות TOP1 בנוכחות 80 μM CPT או DMSO כדוגמה ליישום בדיקת תרופות. התמונה המייצגת והכימות שנוצר כתוצאה מכך של שלושה ניסויים בלתי תלויים מראים כי CPT מעכב מעגליות בתיווך TOP1 של המצע כצפוי24,25.
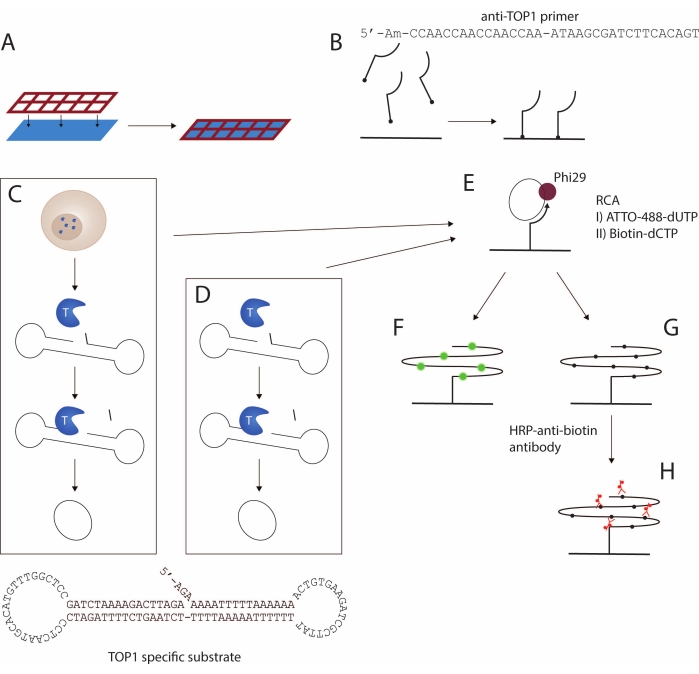
איור 1: ייצוג סכמטי של פרוטוקול REEAD. (A,B) הכנת השקופיות הפונקציונליות. רשת הסיליקון מחוברת לשקופית הפונקציונלית. לאחר מכן, פריימר 5'-אמינו מוצמד לשקופית, ובכך מאפשר הגברה של המצע הספציפי ל-TOP1. (ג,ד) יצירת מצעים מעגליים סגורים. המצע הספציפי ל-TOP1 מתקפל לצורת משקולת עם אתר ביקוע TOP1 מועדף בגבעול הדו-גדילי ורצף קשירת פריימר באחת משתי הלולאות החד-גדיליות. (C) TOP1 משתחרר עם ליזיס של התאים. במחשוף וקשירה בתיווך TOP1, המצע מומר למעגל סגור; (D) נעשה שימוש ב-TOP1 מטוהר ורקומביננטי. (E) הגברה מעגלית מתגלגלת. המצעים המעגליים הסגורים עוברים הכלאה לפריימר המעוגן על פני השטח ומוגברים על ידי RCA באמצעות Phi29 פולימראז. ניתן להשיג את ה-RCA על ידי שילוב של נוקלאוטידים פלואורסצנטיים כמו ב-F או נוקלאוטידים ביוטינילטים כמו ב-G. תוצרי המעגל המתגלגל הפלואורסצנטי מוצגים באופן חזותי באמצעות מיקרוסקופ פלואורסצנטי או סורק פלואורסצנטי. (H) צימוד של נוגדן אנטי-ביוטין מצומד HRP. תוצרי העיגול המתגלגל הביוטיניליים מודגרים עם נוגדן אנטי-ביוטין מצומד HRP. פיתוח האותות מתווך על ידי אנזים HRP, והאותות מוצגים באופן חזותי על ידי ECL ומזוהים באמצעות מצלמת CCD או באמצעות TMB היוצר הדמיה colorimetric. קיצורים: REEAD = מעגל מתגלגל משופר זיהוי פעילות אנזים; RCA = הגברה מעגלית מתגלגלת; TOP1 = טופואיזומראז 1; HRP = פרוקסידאז חזרת; ECL = כימילומינסנציה משופרת; TMB = 3,3',5,5'-טטרה-מתיל-בנזידין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
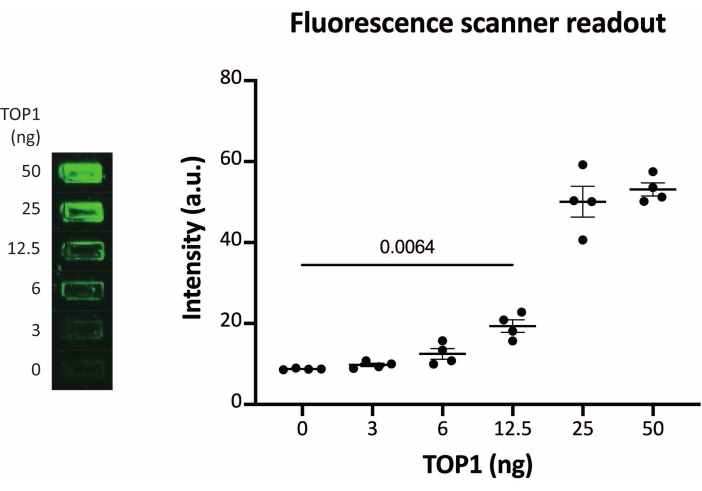
איור 2: מדידות של פעילות TOP1 באמצעות סורק פלואורסצנטי. הלוח השמאלי מציג תמונה מייצגת של השקופית בעת ניתוח הפעילות של 3-50 ננוגרם של TOP1 באמצעות פרוטוקול הקריאה של סורק פלואורסצנטי. הלוח הימני מציג את הכימות המתקבל. t-test עם התיקון של וולש, p = 0.0064, n = 4. קיצור: TOP1 = טופואיזומראז 1. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
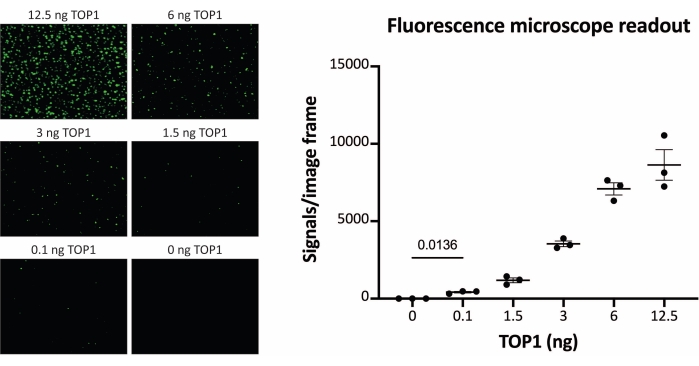
איור 3: מדידות של פעילות TOP1 באמצעות מיקרוסקופ פלואורסצנטי. הלוח השמאלי מציג תמונות מייצגות של השקופית בעת ניתוח הפעילות של 0.1-12.5 ננוגרם של TOP1 באמצעות פרוטוקול הקריאה של מיקרוסקופ פלואורסצנטי. שים לב שהתמונות הן גרסאות חתוכות כדי להציג כראוי את הנקודות. מסיבה זו, הם אינם דומים למספר האותות בכימות המוצג בלוח הימני. t-test עם התיקון של וולש, p = 0.0136, n = 3. קיצור: TOP1 = טופואיזומראז 1. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
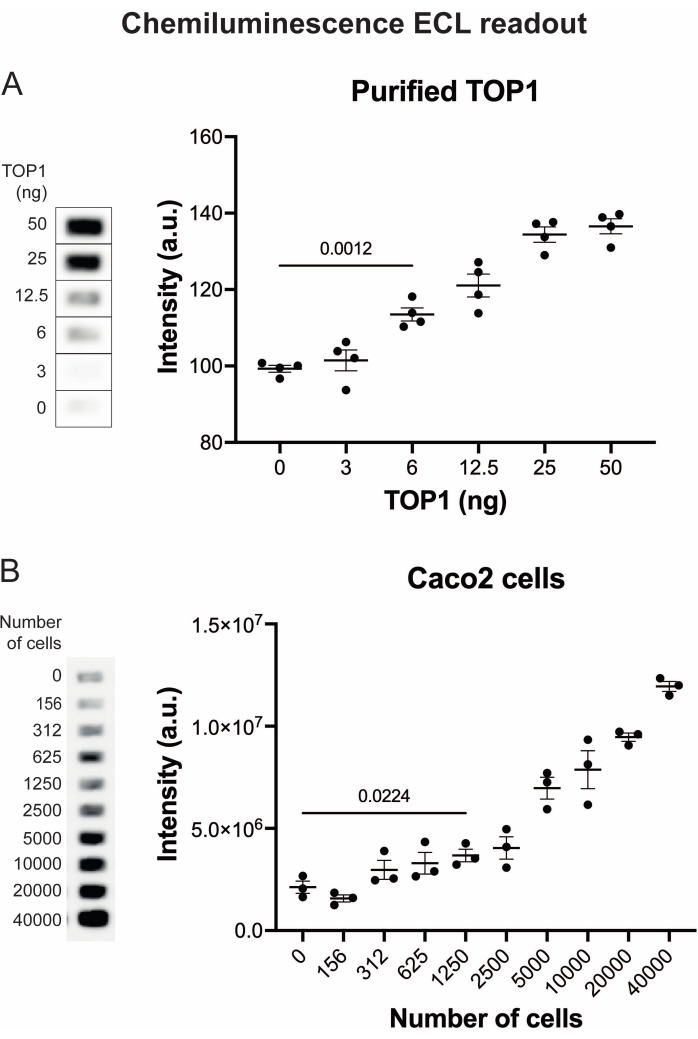
איור 4: מדידות של פעילות TOP1 באמצעות קריאת הכימילומינסנציה. (A) החלונית השמאלית מציגה תמונה מייצגת של השקופית בעת ניתוח הפעילות של 3-50 ננוגרם של TOP1 באמצעות פרוטוקול הקריאה chemiluminescence. הלוח הימני מציג את הכימות המתקבל. t-test עם התיקון של וולש, p < 0.0001, n = 4. (B) הפאנל השמאלי מציג תמונה מייצגת של השקופית בעת ניתוח הפעילות של TOP1 שחולץ מ-156-40,000 תאי Caco2 באמצעות פרוטוקול הקריאה chemiluminescence. הלוח הימני מציג את הכימות המתקבל. t-test עם התיקון של וולש, p = 0.0224, n = 3. קיצורים: TOP1 = טופואיזומראז 1. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
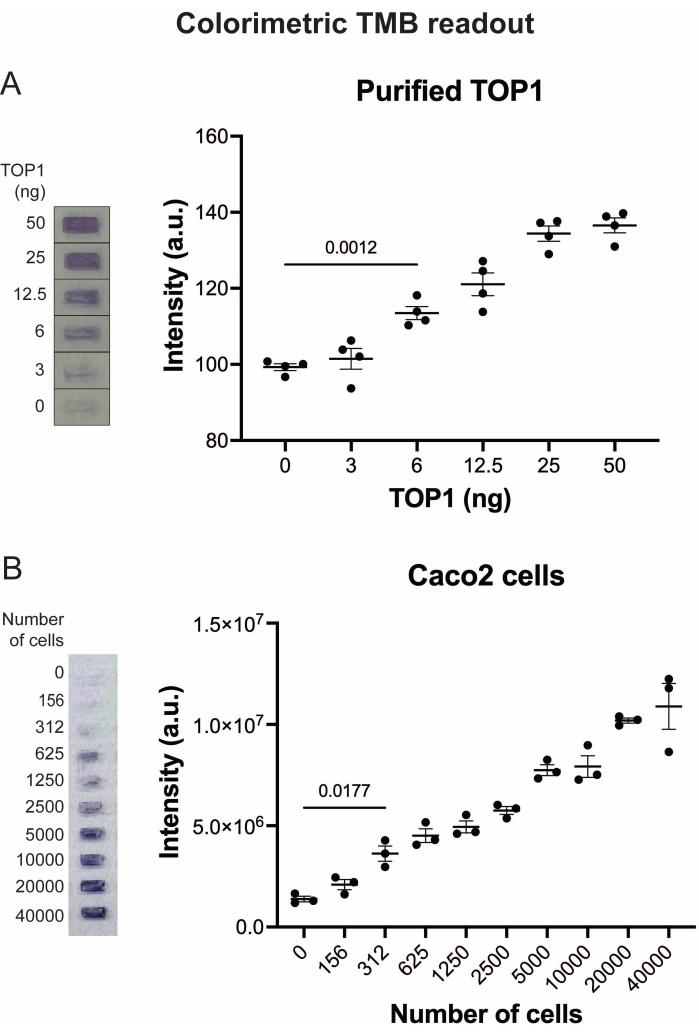
איור 5: מדידות של פעילות TOP1 באמצעות הקריאה הצבעונית. (A) הלוח השמאלי מציג תמונה מייצגת של השקופית בעת ניתוח 3-50 ננוגרם של TOP1 באמצעות פרוטוקול הקריאה הצבעונית. הלוח הימני מציג את הכימות המתקבל. t-test עם התיקון של וולש, p = 0.0012, n = 4. (B) החלונית השמאלית מציגה תמונה מייצגת של השקופית בעת ניתוח הפעילות של TOP1 שחולץ מ-156-40,000 תאי Caco2 באמצעות פרוטוקול הקריאה הצבעונית. הלוח הימני מציג את הכימות המתקבל. t-test עם התיקון של וולש, p = 0.0117, n = 3. קיצורים: TOP1 = טופואיזומראז 1; TMB = 3,3',5,5'-טטרה-מתיל-בנזידין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
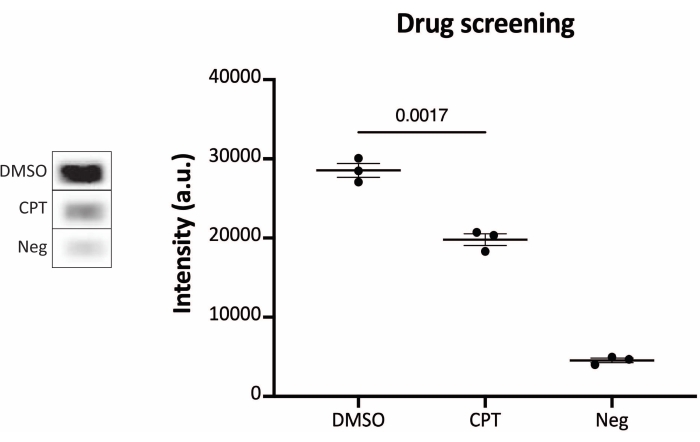
איור 6: מדידות של פעילות TOP1 לאחר טיפול תרופתי באמצעות פרוטוקולי הקריאה של כימילומינסנציה. הלוח השמאלי מציג תמונה מייצגת של השקופית בעת ניתוח 10 ננוגרם של TOP1 בנוכחות 5% DMSO או 80 μM CPT למשך דקה אחת. הלוח הימני מציג את הכימות המתקבל. t-test עם התיקון של וולש, p = 0.0017, n = 3. קיצורים: TOP1 = טופואיזומראז 1; CPT = קמפטוטצין; DMSO = דימתילסולפוקסיד; נג = שליטה שלילית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
Topoisomerases מייצגים קבוצה של אנזימים משנים DNA שמושכים מחקר גבוה ועניין קליני, להיות המטרה של תרכובות מולקולות קטנות עם השפעה פוטנציאלית בטיפול נגד סרטן או במאבק של מחלות זיהומיות. יתר על כן, הפעילות של TOP1 האנושי הוכחה כסמן ביולוגי יעיל של פרוגנוזה וטיפול בסרטן18,19,23. למרות שפעילות TOP1 היא המשפיעה על היעילות של מעכב כימותרפי26, לעתים קרובות מדובר בכמות ה- DNA-RNA או בכמות ה- TOP1 המוערכת במסגרות קליניות. זאת בשל היעדר כלים מהירים, קלים ומבוססי ג'ל שיכולים לספק כימות מדויק ומדויק של פעילות הטופואיזומראז בכל סביבת מעבדה.
כאן מתואר פרוטוקול לבדיקת REEAD המאפשר מדידה של פעילות TOP1 באופן נטול ג'ל. בפרוטוקול זה, TOP1 מטוהר או תמצית גולמית מתאים מודגר עם מצע בצורת משקולת DNA שתוכנן במיוחד, אשר בבקיעה/קשירה בתיווך TOP1 מומר למולקולה סגורה ועגולה. לאחר מכן העיגולים עוברים הכלאה על משטח זכוכית ומוגברים על ידי RCA. כדי לאפשר קלות שימוש בביצוע תגובות המתרחשות על המגלשה, רשת סיליקון מחוברת לזכוכית, ויוצרת בארות בודדות שבהן מתרחשות התגובות. בדרך זו, הפרוטוקול מנצל את מערכת multiwell - רשת סיליקון הנקראת wellmaker.
הפרוטוקול שימש לזיהוי הפעילות של TOP1 ו-TOP1 רקומביננטיים המופקים מתאי אדנוקרצינומה במעי הגס Caco2, המשמשים כדוגמה. יתר על כן, כדוגמה ל-REEAD שישמש ככלי לסינון תרופות, הפרוטוקול שימש לזיהוי עיכוב פעילות TOP1 על ידי מעכב TOP1 הידוע CPT24,25. הבדיקה שולבה עם שיטות קריאה שונות - מיקרוסקופיה פלואורסצנטית, המעניקה רגישות גבוהה, וסורק פלואורסצנטי, כימילומינסנציה, או colorimetric, הדורשים פחות ציוד והכשרה מיוחדים. לקריאת המיקרוסקופ הפלואורסצנטי הרגיש ביותר יש את המגבלות של הצורך בהגדרת מיקרוסקופ פלואורסצנטי באיכות טובה, כוח אדם מיומן ורכישה וניתוח תמונה הגוזלים זמן רב.
מסיבות אלה, קריאת הסורק הפלואורסצנטי המאפשרת רכישה וניתוח מהירים יותר גם אם על חשבון הרגישות מוצגת. במקרה של היעדר סורק פלואורסצנטי, ניתן לשקול שתי חלופות מצוינות, chemiluminescence ושיטות קריאה colorimetric. שתי השיטות מהירות ופשוטות, ואינן דורשות ציוד יקר או הכשרה מיוחדת. בכל פורמטי הקריאה, ל- REEAD יש יתרונות רבים בהשוואה למבחנים החדישים ביותר, שהם גוזלים זמן רב יותר, מבוססי ג'ל (עם הדרישות של סוכני אינטרקלציה), ופחות כמותיים ישירות. עם זאת, ישנם כמה שלבים קריטיים בפרוטוקול המוצג. בעת הטיפול בבדיקת התרופה, יש למטב את נקודות הזמן, ריכוז התרופה והיחס בין כמות TOP1 / מצע DNA בהשוואה להגדרות המתוארות המותאמות ל- CPT. ניתן לחקור את התרופה בביצוע קדם-אינקובציה עם מצע הדנ"א או קדם-אינקובציה עם האנזים TOP1. זה יכול לתת מידע רב ערך על היכולת של המולקולה לעכב TOP1 ולהציע תובנה של מנגנון הפעולה של התרופה.
יתר על כן, אם חווים אותות נמוכים או נעדרים, סביר להניח שזה נובע מתזה לא יעילה של הדגימה הגולמית או השפלה של TOP1 בתמצית עקב שימוש לא נכון במעכבי פרוטאז. בנוסף, זה יכול להיות גם בגלל אחסון לקוי של רכיבי הבדיקה החשובים, כגון רקומביננטי TOP1, phi29 פולימראז, נוקלאוטידים, מצע, פריימר. לבסוף, יש להימנע ממחזורי הפשרה חוזרים ונשנים של האוליגונוקלאוטידים, שכן הדבר משפיע באופן דרמטי על ביצועי הבדיקה. כאשר משתמשים בתמצית גולמית, יש למטב את יעילות המיצוי של הדגימה הביולוגית הספציפית והכמות והפעילות של TOP1 עשויות להיות שונות מהדוגמה המדווחת כאן. מסיבה זו, כל תמצית גולמית שתיבדק תדרוש טיטרציה לזיהוי מגבלת זיהוי הבדיקה וטווח הרגישות בעת שימוש בדגימה המסוימת הזו. הפרוטוקול עבר אופטימיזציה לזיהוי TOP1 אנושי. ניתן למדוד את הפעילות של TOP1s אאוקריוטים אחרים, אך ייתכן שיהיה צורך למטב את ריכוז ה-NaCl ואת זמן הדגירה בהתאם לשיטת טיהור האנזימים ולפעילות האנזים האופטימלית. מצעים מעגליים יותר ינבעו מדגרה ממושכת, בעוד שפחות מצעים מעגליים ינבעו מדגרה מקוצרת.
בנוסף ליישומים המוצגים, REEAD מאפשר למדוד את פעילות TOP1 בתמציות גולמיות מביופסיות קטנות מחולי סרטן18, חיזוי ההשפעה האנטי-סרטנית הציטוטוקסית של CPT בקווי תאים סרטניים 20,21,22, ואפילו זיהוי פעילות האנזים בתאים בודדים20,21 . יתר על כן, הגדרת REEAD המוצגת באמצעות הבאר מאפשרת סינון תרופות מבוסס רב של ספריות של תרכובות סינתטיות או טבעיות. בנוסף לכך, פותחה גרסה שונה של מבחן REEAD, הנקראת REEAD C/L. מערך זה מאפשר חקירות נפרדות של שלבי הבקיעה והקשירה של תגובת TOP127. עם REEAD C/L, ניתן לקבוע את מנגנון הפעולה של מעכבי מולקולות קטנות ולאפיין אותם כמעכבים קטליטיים TOP1 עם השפעות אנטי-פרזיטיות פוטנציאליות28 או כרעלים TOP1 שישמשו לטיפול נגד סרטן24,25. לבסוף, עם עיצוב מחדש ספציפי של מצעי הדנ"א כך שיתאימו לדרישות השונות (לקשירת DNA או קשירת מחשוף) של אנזימי TOP1 אחרים, REEAD שימש גם לזיהוי מחלות זיהומיות (כגון במקרה של פלסמודיום פלציפרום, הגורם למלריה29), או לישמניה דונובאני ונגיף אבעבועות הקופים (הנתונים לא מוצגים). לחלופין, ניתן להשתמש בו כדי לזהות תרכובות מולקולות קטנות עם השפעות אנטיפתוגניות. הפרוטוקול המוצג מספק למדענים בתחום TOP1 שיטה קלה לזיהוי פעילות אנזימים עם אופטימיזציה מועטה או ללא אופטימיזציה ועם אפשרות להתאמה ליישומים רחבים עוד יותר בעתיד.
Disclosures
המחברים C.T. ו- K.M. הם עובדים של VPCIR biosciences ApS. C.T., B.R.K., ומ.ש. הם בעלי מניות ו/או בעלי אופציות למניות. C.T., B.R.K., ו- M.S. מצהירים כי הם נקראים ממציאים של הפטנט EP2022/057172 שהוגש על שם VPCIR biosciences ApS. המחברים האחרים מצהירים כי אין להם אינטרסים מתחרים.
Acknowledgements
המחברים רוצים להודות לטכנאי המעבדה נוריקו י. הנסן, המחלקה לביולוגיה מולקולרית וגנטיקה, אוניברסיטת ארהוס, על הסיוע הטכני ביחס לטיהור האנזימים Phi29 ו- TOP1.
Materials
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Camera for fluorescence image analysis | |||
| CCD camera | For chemiluninescence image analysis | ||
| Fluorescence microscope | Olympus | Equipped with 60x oil immersion objective and a GFP filter ( https://www.edmundoptics.com/p/gfp-filter-cube-set-olympus/21527/) | |
| Fluorescence scanner | Typhoon | FLA 9500 | Equipped with 473 laser and FAM filter |
| Humidity chamber with dH2O | |||
| Hybridization chamber with saturated NaCl | |||
| ImageJ software | Fiji | Download at: https://imagej.net/software/fiji/downloads | |
| Materials | |||
| Cell culture | |||
| Cell growth medium appropiate for the chosen cell line | |||
| Trypsin | Sigma | #T4174 | |
| Pen strep | Sigma | #P4300 | |
| Tissue culture flasks | ThermoFisher | #178983 | |
| FBS | Gibco | #10270106 | |
| NEEA | Sigma | #M7145 | |
| PBS | ThermoFisher | #10010023 | |
| Functionalized slides | |||
| 5'-amine anti-TOP1 primer | Sigma | 5’-/5AmMC6/CCA ACC AAC CAA CCA AAT AAG-3’ | |
| Activated Codelink HD slides | SurModics | #DHD1-0023 | |
| Silicon grid | Grace-biolabs | Custom made | |
| Pertex glue | Histolabs | #00801 | |
| Microscope slide 76 x 26 mm | Hounisen | #2510 1201BL | Other microscope slide of same dimension can be used |
| DNA circles and rolling circle amplification | |||
| TOP1 specific substrate | Sigma | 5’-AGA AAA ATT TTT AAA AAA ACT GTG AAG ATC GCT TAT TTT TTT AAA AAT AAA TCT AAG TCT TTT AGA TCC CTC AAT GCA CAT GTT TGG CTC CGA TCT AAA AGA CTT AGA-3’ | |
| ATTO-488-dUTP | Jena Biosciences | #95387 | |
| Biotin-dCTP | Jena Biosciences | #NU-809-BIO16L | |
| dNTP | ThermoFisher | #R0181 | |
| Phi29 polymerase | VPCIR Biosciences | #10010041 | |
| Recombinant TOP1 | VPCIR Biosciences | #10010001 | |
| Detection of rolling circle products | |||
| BioFX TMB | SurModics | #ESPM-0100-01 | |
| Cover glass | |||
| ECL mixture | Cytiva | #RPN2236 | |
| HRP conjugated anti-biotin antibody | Merck | #A4541 | |
| Mounting medium (vectachield) | Vector laboratories | #H-1000 | |
| Buffer list | |||
| 1x PE Buffer | 1 mM EDTA, 8.12 mM Na2HPO4·2H2O, 1.88 mM NaH2PO4·H2O | ||
| 6x Print Buffer | 300 mM Na3PO4, pH 8.5 | ||
| Blocking solution | Buffer 5 supplemented with 5% non-fat milk and 5% BSA pH 9 | ||
| Lysis Buffer | 10 mM Tris-HCl pH 7.5, 1 mM EDTA + protease inhibitors | ||
| 10x TOP1 Reaction Buffer | 50 mM CaCl2, 50 mM MgCl2, 100 mM Tris-HCl pH 7.5 | ||
| 10x Phi29 Reaction Buffer | 330 mM Tris-acetate pH 7.5, 100 mM Mg-acetate, 660 mM K-acetate, 1% Tween20, 200 mM DTT | ||
| Buffer 1 | 50 mM Tris, 50 mM Tris-HCl, 32 mM ethanolamine. NB: stored at 50 °C. | ||
| Buffer 2 | 4x SSC, 0.1% SDS. NB: stored at 50 °C. | ||
| Buffer 3 | 100 mM Tris-HCl pH 7.5, 150 mM NaCl, 0.3% SDS | ||
| Buffer 4 | 100 mM Tris-HCl pH 7.5, 150 mM NaCl, 0.05% Tween20 | ||
| Buffer 5 | 20 mM Tris-HCl pH 7.5, 150 mM NaCl, 0.05% Tween20 | ||
| Chemicals for buffers | |||
| Tris | Sigma | #T1506 | |
| HCl | Sigma | #1.00317.2011 | |
| EDTA | Sigma | #1.08418.1000 | |
| PMSF | Sigma | #05056489001 | |
| SDS | Applichem | #436143 | |
| Na2HPO4 | Sigma | #1.06580.1000 | |
| NaH2PO4 | Sigma | #1.06346.1000 | |
| Ethanolamine | Sigma | #411000 | |
| SSC | Invitrogen | #15557-036 | |
| Tris-acetate | Sigma | #T1258 | |
| Mg-acetate | Sigma | #M0631 | |
| K-acetate | Sigma | #1.04820.1000 | |
| Tween20 | Sigma | #8.22184.0500 | |
| DTT | Sigma | #D0632 | |
| CaCl2 | Sigma | #1.02382.1000 | |
| MgCl2 | Sigma | #M2670 | |
| NaCl | Sigma | #1.06404.5000 | |
| Skimmed milk powder | Sigma | #70166 | |
| BSA | Sigma | #A4503 |
References
- Baldwin, E. L., Osheroff, N. Etoposide, topoisomerase II and cancer. Current Medicinal Chemistry-Anti-Cancer Agents. 5 (4), 363-372 (2005).
- Gilbert, D. C., Chalmers, A. J., El-Khamisy, S. F. Topoisomerase I inhibition in colorectal cancer: Biomarkers and therapeutic targets. British Journal of Cancer. 106 (1), 18-24 (2012).
- Ikeguchi, M., et al. TopoisomeraseI expression in tumors as a biological marker for CPT-11 chemosensitivity in patients with colorectal cancer. Surgery Today. 41 (9), 1196-1199 (2011).
- Meisenberg, C., et al. Clinical and cellular roles for TDP1 and TOP1 in modulating colorectal cancer response to irinotecan. Molecular Cancer Therapeutics. 14 (2), 575-585 (2015).
- Palshof, J. A., et al. Topoisomerase I copy number alterations as biomarker for irinotecan efficacy in metastatic colorectal cancer. BMC Cancer. 17 (1), 1-10 (2017).
- Proszek, J., et al. Topoisomerase I as a biomarker: Detection of activity at the single molecule level. Sensors. 14 (1), 1195-1207 (2014).
- Leppard, J. B., Champoux, J. J. Human DNA topoisomerase I: Relaxation, roles, and damage control. Chromosoma. 114 (2), 75-85 (2005).
- Champoux, J. J. DNA topoisomerases: structure, function, and mechanism. Annual Review of Biochemistry. 70 (1), 369-413 (2001).
- Redinbo, M. R., et al. Crystal structures of human topoisomerase I in covalent and noncovalent complexes with DNA. Science. 279 (5356), 1504-1513 (1998).
- Nitiss, J. L., Soans, E., Rogojina, A., Seth, A., Mishina, M. Topoisomerase assays. Current Protocols in Pharmacology. 57 (1), 3(2012).
- Tesauro, C., et al. Erybraedin C, a natural compound from the plant Bituminaria bituminosa, inhibits both the cleavage and religation activities of human topoisomerase I. Biochemical Journal. 425 (3), 531-539 (2010).
- Keller, J. G., et al. Topoisomerase 1 inhibits MYC promoter activity by inducing G-quadruplex formation. Nucleic Acids Research. 50 (11), 6332-6342 (2022).
- Christiansen, K., Westergaard, O. Characterization of intra- and intermolecular DNA ligation mediated by eukaryotic topoisomerase I. Role of bipartite DNA interaction in the ligation process. Journal of Biological Chemistry. 269 (1), 721-729 (1994).
- Svejstrup, J. Q., Christiansen, K., Andersen, A. H., Lund, K., Westergaard, O. Minimal DNA duplex requirements for topoisomerase I-mediated cleavage in vitro. Journal of Biological Chemistry. 265 (1), 12529-12535 (1990).
- Anand, J., Sun, Y., Zhao, Y., Nitiss, K. C., Nitiss, J. L. Detection of topoisomerase covalent complexes in eukaryotic cells. Methods in Molecular Biology. , Clifton, NJ. 283-299 (2018).
- Stougaard, M., et al. Single-molecule detection of human topoisomerase I cleavage-ligation activity. ACS Nano. 3 (1), 223-233 (2009).
- Keller, J. G., Petersen, K. V., Knudsen, B. R., Tesauro, C. Simple and fast DNA-based tool to investigate topoisomerase 1 activity, a biomarker for drug susceptibility in colorectal cancer. Recent Underst. Colorectal Cancer Treatment. , (2022).
- Jakobsen, A. K., et al. Correlation between topoisomerase I and tyrosyl-DNA phosphodiesterase 1 activities in non-small cell lung cancer tissue. Experimental and Molecular Pathology. 99 (1), 56-64 (2015).
- Jakobsen, A. K., et al. TDP1 and TOP1 as targets in anticancer treatment of NSCLC: Activity and protein level in normal and tumor tissue from 150 NSCLC patients correlated to clinical data. Lung Cancer. 164, 23-32 (2022).
- Keller, J. G., et al. On-slide detection of enzymatic activities in selected single cells. Nanoscale. 9 (36), 13546-13553 (2017).
- Keller, J. G., Stougaard, M., Knudsen, B. R. Enzymatic activity in single cells. Trends in Biotechnology. 29 (5), 222-230 (2019).
- Tesauro, C., et al. Different camptothecin sensitivities in subpopulations of colon cancer cells correlate with expression of different phospho-isoforms of topoisomerase i with different activities. Cancers. 12 (5), 1240(2020).
- Tesauro, C., et al. Topoisomerase i activity and sensitivity to camptothecin in breast cancer-derived cells: A comparative study. BMC Cancer. 19 (1), 1-15 (2019).
- Pommier, Y. DNA topoisomerase I Inhibitors: Chemistry, biology, and interfacial inhibition. Chemical Reviews. 109 (7), 2894-2902 (2009).
- Pommier, Y. Drugging topoisomerases: lessons and challenges. ACS Chemical Biology. 8 (1), 82-95 (2013).
- Bailly, C. Irinotecan: 25 years of cancer treatment. Pharmacological Research. 148, 104398(2019).
- Petersen, K. V., et al. Simple and fast dna based sensor system for screening of small-molecule compounds targeting eukaryotic topoisomerase 1. Pharmaceutics. 13 (8), 1255(2021).
- García-Estrada, C., Prada, C. F., Fernández-Rubio, C., Rojo-Vázquez, F., Balaña-Fouce, R. DNA topoisomerases in apicomplexan parasites: promising targets for drug discovery. Proceedings of the Royal Society B: Biological Sciences. 277 (1689), 1777-1787 (2010).
- Hede, M. S., et al. Detection of the malaria causing Plasmodium parasite in saliva from infected patients using topoisomerase I activity as a biomarker. Scientific Reports. 8 (1), 1-12 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved