Method Article
Detecção Simples e Rápida de Amplificação por Círculo de Rolamento da Atividade da Topoisomerase 1 em Amostras Biológicas Brutas
Neste Artigo
Resumo
Um protocolo para a detecção sensível e quantitativa da atividade da topoisomerase 1 usando o ensaio de detecção de atividade enzimática aprimorada do círculo rolante é descrito. O método permite a detecção da atividade da topoisomerase 1 a partir de componentes purificados ou extratos celulares/teciduais. Este protocolo tem amplas aplicações em qualquer campo que envolva a detecção de atividade enzimática.
Resumo
Técnicas baseadas em amplificação isotérmica, como a amplificação por círculo rolante, têm sido empregadas com sucesso para a detecção de ácidos nucleicos, quantidades de proteínas ou outras moléculas relevantes. Esses métodos têm se mostrado alternativas substanciais à PCR ou ELISA para aplicações clínicas e de pesquisa. Além disso, a detecção da quantidade de proteína (por Western blot ou imuno-histoquímica) é muitas vezes insuficiente para fornecer informações para o diagnóstico de câncer, enquanto a medição da atividade enzimática representa um biomarcador valioso. A medição da atividade enzimática também permite o diagnóstico e o tratamento potencial de doenças transmitidas por patógenos. Em todos os eucariotos, as topoisomerases são as principais enzimas de ligação ao DNA envolvidas no controle do estado topológico do DNA durante processos celulares importantes e estão entre os biomarcadores importantes para o prognóstico e tratamento do câncer.
Ao longo dos anos, as topoisomerases têm sido substancialmente investigadas como um alvo potencial de drogas antiparasitárias e anticancerígenas com bibliotecas de compostos naturais e sintéticos de moléculas pequenas que são investigadas a cada ano. Aqui, o método de amplificação de círculo rolante, denominado ensaio de detecção de atividade enzimática aprimorada por círculo de rolamento (REEAD) que permite a medição quantitativa da atividade da topoisomerase 1 (TOP1) de maneira simples, rápida e livre de gel. Ao clivar e ligar um substrato de DNA especialmente projetado, o TOP1 converte um oligonucleotídeo de DNA em um círculo fechado, que se torna o modelo para amplificação do círculo rolante, produzindo ~ 103 produtos de círculo rolante de repetição em tandem. Dependendo da incorporação de nucleotídeos durante a amplificação, existe a possibilidade de diferentes métodos de leitura, da fluorescência à quimioluminescência e à colorimetria. Como cada ligadura de clivagem mediada por TOP1 gera um círculo fechado de DNA, o ensaio é altamente sensível e diretamente quantitativo.
Introdução
As topoisomeras pertencem à classe das enzimas modificadoras de DNA e muitas delas têm se mostrado úteis como biomarcadores para doenças humanas 1,2,3,4,5,6. O TOP1 está envolvido na resolução do estresse topológico associado a processos celulares como replicação de DNA, transcrição gênica, recombinação e segregação cromossômica7. O TOP1 pode resolver superbobinas negativas e positivas por um mecanismo que envolve a formação de uma ruptura transitória de fita simples no DNA 8,9. Após a ligação ao DNA, o TOP1 posiciona a tirosina do sítio ativo (Tyr723) para realizar um ataque nucleofílico na espinha dorsal do fosfodiéster. Um complexo de clivagem de DNA TOP1 é então gerado com a enzima covalentemente ligada à extremidade 3'-da fita de DNA quebrada. Isso libera o estresse de torção, permitindo que a extremidade 5 'do fio clivado gire em torno do fio intacto. Finalmente, o grupo hidroxila da extremidade 5'-realiza um ataque nucleofílico na ligação 3'-fosfotirosil. Como resultado, o TOP1 é liberado e a espinha dorsal do DNA é restaurada8.
Vários ensaios foram desenvolvidos para investigar as etapas do ciclo catalítico TOP1, incluindo o ensaio de relaxamento 10, o ensaio de deslocamento de mobilidade eletroforética (EMSA)11,12, os ensaios de ligadura de clivagem suicida de DNA 13,14 e o ensaio in vivo de complexo de enzimas (ICE) 15 . No entanto, esses ensaios têm várias limitações, pois dependem da eletroforese em gel, que requer agentes intercalantes de DNA, ou exigem treinamento e equipamentos altamente especializados. Além disso, os ensaios requerem grandes quantidades de enzima TOP1 purificada (variando de 1 a 5 ng para o ensaio de relaxamento e 50 a 200 ng para o EMSA e o ensaio de ligadura de clivagem) ou extratos de pelo menos 106 células para um desempenho ideal. Portanto, um método altamente sensível que permite a detecção específica da atividade TOP1 em amostras biológicas brutas e no nível de evento catalítico único, denominado ensaio REEAD, foi desenvolvido16.
Aqui, um protocolo para a detecção da atividade TOP1 usando o ensaio REEAD16 é apresentado. Uma representação esquemática do ensaio é representada na Figura 1. Uma grade de silicone personalizada é anexada a uma lâmina funcionalizada para criar uma configuração de multipoço de lâmina de vidro, chamada de wellmaker a seguir (Figura 1A). Segue-se o acoplamento de um primer modificado de 5'amino aos grupos funcionais do NHS nos poços da lâmina (Figura 1B). A reação de clivagem e ligadura mediada por TOP1 converte um substrato específico de DNA em um círculo fechado. O substrato específico do TOP1 (Figura 1C) dobra-se espontaneamente em forma de haltere contendo uma haste de fita dupla e duas alças de fita simples. Um dos laços é complementar ao primer ancorado na superfície. A região do caule contém um local de clivagem TOP1 favorecido três bases a montante da extremidade 3'-end e uma saliência 5'-hidroxila. A circularização do substrato pode ser obtida usando extrato de célula/tecido (Figura 1C) ou TOP1 recombinante e purificado (Figura 1D).
Quando o substrato é clivado pelo TOP1, a enzima torna-se transitoriamente ligada à extremidade 3' e o fragmento de três bases se difunde, permitindo que a saliência de 5' recoza ao substrato e facilitando a ligadura mediada pelo TOP1. A ligadura resulta na circularização do substrato e, posteriormente, na dissociação do TOP1. O círculo fechado é hibridizado ao primer de superfície ancorado (Figura 1E) e é utilizado como molde para amplificação isotérmica de círculo rolante (RCA) mediada pela polimerase phi29, que pode realizar RCA com deslocamento de fita, produzindo 103 produtos de repetição tandem. Durante a etapa de RCA, nucleotídeos marcados fluorescentemente (Figura 1F) ou acoplados à biotina (Figura 1G) podem ser incorporados17. A incorporação de nucleotídeos marcados fluorescentemente permite a detecção dos RCPs usando um microscópio de fluorescência ou um scanner de fluorescência. Alternativamente, um anticorpo anti-biotina acoplado à peroxidase de rábano (HRP) (Figura 1H) pode ligar os nucleotídeos biotinilados, permitindo assim a detecção dos produtos do círculo laminado (RCPs) usando quimioluminescência aprimorada (ECL) ou pela conversão de 3,3',5,5'-tetrametilbenzidina (TMB) em uma cor detectável. O RCA segue uma cinética de reação linear, tornando o ensaio REEAD diretamente quantitativo, pois um RCP representa uma única reação de ligadura de clivagem mediada por TOP1. Aqui é mostrado que este ensaio pode ser usado para detectar a atividade TOP1 como uma enzima recombinante purificada ou extraída de amostras brutas e como uma ferramenta de triagem de drogas anti-TOP1.
Protocolo
NOTA: Encontre uma lista de composições de buffer, equipamentos e outros materiais necessários na Tabela de Materiais.
1. Cultura celular
- Cultive as células preferidas em meio adequado e cultive-as de acordo com as instruções. Como exemplo, cultivar Caco2, células derivadas de adenocarcinoma colorretal, em meio essencial mínimo (MEM) suplementado com 20% de soro fetal bovino (FBS), 1% de aminoácidos não essenciais (NEAA), 100 unidades/mL de penicilina e 100 mg/mL de estreptomicina. Manter as culturas celulares em incubadora umidificado (5% de CO2/95% de atmosfera de ar a 37 °C). Chapear as células em frascos de cultura de tecidos e dividir a cada 3 dias para manter as células em 70% de confluência.
- Colher as células de um balão de 70% de confluentes por tratamento com tripsina (tripsina a 0,25%, solução de EDTA a 0,02%) e lavar com solução salina tamponada com fosfato (PBS).
- Ressuscite o pellet celular no PBS para ajustar a concentração celular para 0,5 × 106 células/tubo. Gire a 200 × g por 5 min e aspirar cuidadosamente o sobrenadante.
NOTA: As células utilizadas para REEAD devem ser utilizadas frescas e mantidas sobre gelo. Os resultados obtidos com células Caco2 foram publicados recentemente17. O ensaio foi testado com uma variedade de linhagens celulares, incluindo células derivadas de câncer de cólon, mama, pulmão e colo do útero18,19,20,21,22,23, mas pode ser usado com todas as amostras biológicas brutas contendo TOP1, como tecidos, sangue e saliva.
2. Preparação de lâminas funcionalizadas
- Anexe a grade do isolador de silicone personalizada à lâmina funcionalizada, tornando assim o bem-feitor. Pressione o silicone para evitar a formação de bolhas de ar (ver Figura 1A).
- Prepare uma mistura de 5 μM de 5'-amino primer em 1x buffer de impressão. Adicionar 4 μL da mistura a cada poço e colocar o wellamker numa câmara de hibridização com NaCl saturado a temperaturas entre 15 °C e 25 °C, protegido da luz.
NOTA: Uma câmara de hibridização pode ser facilmente feita usando uma caixa de ponta de pipeta cheia de NaCl saturado. A hibridização leva um mínimo de 16 h e um máximo de 72 h. Veja a sequência do primer de 5'-amino na Figura 1B. As lâminas são funcionalizadas com grupos NHS para permitir a ligação de oligonucleotídeos modificados por aminoácidos.
3. Geração de substratos circulares fechados
- Preparação de substratos circulares fechados com TOP1 recombinante ou extrato celular.
- Lise um pellet celular de 0,5 × 106 células em 500 μL de tampão de lise para atingir uma densidade celular de 1.000 células/μL. Incubar por 10 min no gelo.
- Preparar uma mistura circular de 2 μL de 5 μM de substrato específico TOP1 (a sequência do substrato é a seguinte: 5'-AGA AAA ATT TTT AAA AAA ACT GTG AAG ATC GCT TAT TTT TTT AAA AAT AAA TCT AAG TCT TTT AGA TCC CTC AAT GCA CAT GTT TGG CTC CGA TCT AAA AGA CTT AGA-3') e 2 μL de enzima TOP1 recombinante ou 2 μL de extracto celular (ver passo 3.1.1) em 16 μL de 1x buffer de reação TOP1.
NOTA: A concentração de TOP1 recombinante usada depende do método de leitura escolhido (consulte a Figura 2, a Figura 3, a Figura 4 e a Figura 5). Veja a sequência do substrato específico do TOP1 na Figura 1C. - Incubar durante 30 minutos a 37 °C (ver figura 1C,D).
- Pare a reação adicionando 2 μL de 1% de SDS.
- Preparação de substratos circulares fechados na presença de drogas
- Preparar uma mistura circular de 2 μL de substrato específico TOP1 de 5 μM e 1 μL de DMSO a 100% ou 1 μL de camptotecina (CPT) de 1,6 mM em 14 μL de 1x tampão de reação TOP1. Adicionar 2 μL de 5 ng/μL da enzima recombinante TOP1.
NOTA: Outros compostos de moléculas pequenas ou drogas podem ser usados. Nesse caso, uma titulação do composto deve ser feita. Se o composto for dissolvido em um solvente diferente do DMSO, este deve ser usado como um controle em vez de DMSO. - Incubar durante 1 min a 37 °C.
- Pare a reação adicionando 2 μL de 1% de SDS.
- Preparar uma mistura circular de 2 μL de substrato específico TOP1 de 5 μM e 1 μL de DMSO a 100% ou 1 μL de camptotecina (CPT) de 1,6 mM em 14 μL de 1x tampão de reação TOP1. Adicionar 2 μL de 5 ng/μL da enzima recombinante TOP1.
NOTA: A etapa 3 pode ser iniciada em paralelo com a etapa 2 e os círculos podem ser armazenados a 4 °C durante a noite. Alternativamente, os círculos de DNA podem ser preparados ao mesmo tempo que a etapa 4 e usados imediatamente. Veja a sequência do substrato específico do TOP1 na Figura 1C. O substrato se dobra em forma de haltere com uma região de haste dupla contendo um local de clivagem TOP1 preferido e dois laços de fita simples. O substrato de haltere aberto é convertido em um substrato circular fechado por clivagem e ligadura mediadas por TOP1 e é doravante referido como um círculo. Como há um excesso do primer de 5'-amino, não haverá competição entre substratos abertos e fechados específicos do TOP1.
4. Bloqueio do bem-estar
- Mergulhe o wellmaker em uma bandeja de 5 cm x 5 cm cheia de Buffer 1 que foi pré-aquecida a 50 °C. Usando uma pipeta, empurre o líquido dentro dos poços para se certificar de que não há bolhas de ar. Incubar durante 30 min a 50 °C.
- Retire o tampão 1 e lave 2 x 1 min com dH2O. Agite vigorosamente à mão.
- Adicione o buffer 2 que foi pré-aquecido a 50 °C. Certifique-se de que não há bolhas de ar nos poços. Incubar durante 30 min a 50 °C.
- Lave 2 x 1 min com dH2O. Agite vigorosamente à mão.
- Lave com EtOH a 70% por 1 min. Agite vigorosamente com a mão.
- Deixe a configuração do wellmaker secar ao ar.
NOTA: Use ar comprimido para secar os poços. Alternativamente, é possível soprar ar usando uma pipeta Pasteur. Certifique-se de que os poços estão secos antes de prosseguir.
5. Hibridização dos círculos ao bem-educador
- Adicione 4 μL dos círculos (feitos no passo 3) a cada poço correspondente.
- Colocar o alvéolo numa câmara de humidade durante 1 h com dH2O a 37 °C.
NOTA: Uma câmara de umidade pode ser feita usando uma caixa para pontas de pipeta preenchidas com dH2O. Alternativamente, a hibridização pode ser feita durante a noite a 25 °C na câmara de umidade.
6. Lavagem
- Lave o wellmaker com Buffer 3.
- Remova o Buffer 3 e substitua pelo Buffer 4.
- Retire o tampão 4 e lave com 70% de EtOH.
- Retire o EtOH e deixe o wellmaker secar.
NOTA: Todas as etapas de lavagem são realizadas por 1 min em uma bandeja de 5 cm x 5 cm, submergindo totalmente a lâmina. Certifique-se sempre de que não há bolhas de ar dentro dos poços.
7. Amplificação do círculo rolante
- Prepare uma mistura RCA de 1x Buffer de Reação Phi29 suplementada com 0,2 μg/μL BSA, 1 unidade de Polimerase Phi29 e 0,25 mM dNTP e 0,0125 mM ATTO-488-dUTP para leitura de fluorescência, ou 0,1 mM dATP, 0,1 mM DTTP, 0,1 mM dGTP, 0,09 mM dCTP e 0,01 mM Biotin-dCTP para leitura colorimétrica/quimioluminescência. Adicione 4 μL a cada poço. Consulte a Figura 1E.
NOTA: A preparação da mistura RCA deve ser feita em gelo. Ao incorporar nucleotídeos fluorescentes no RCA, evite a luz direta desta etapa para proteger os fluoróforos. - Incubar durante 2 h a 37 °C na câmara de humidade. No caso de nucleotídeos fluorescentes usados, defina a câmara de umidade no escuro. Consulte a Figura 1F,G.
8. Lavagem
- Para os protocolos de quimioluminescência ou leitura colorimétrica, lave o bem-estar como na etapa 6 e, em seguida, prossiga para a etapa 11.
- Para o protocolo de leitura de fluorescência, remova a grade de silicone usando uma pinça antes de lavar, como nas etapas a seguir.
- Lave a lâmina por 10 min no Buffer 3.
- Remova o Buffer 3 e substitua pelo Buffer 4. Lave por 5 min.
- Retire o tampão 4 e lave por 1 min em EtOH a 70%.
- Retire o EtOH e deixe o wellmaker secar.
9. Visualização de produtos fluorescentes de círculo rolante usando um scanner de fluorescência
- Digitalize a lâmina em um scanner de fluorescência usando os filtros correspondentes ao fluoróforo usado. Use o fotomultiplicador máximo possível que não dê saturação.
NOTA: O scanner fluorescente usado para aquisição de imagem neste protocolo é equipado com um laser de 473 nm e um filtro de excitação FAM de 490 nm, emissão de 520 nm. - Importe a imagem para o ImageJ e altere o tipo de imagem para 8 bits (Imagem | Tipo | 8 bits). Para medir as bandas separadamente, limite a área medida usando a ferramenta de desenho de retângulo da barra de ferramentas. Desenhe a área desejada e meça a intensidade (Analisar | Medida). Em seguida, mova a área originalmente desenhada para a próxima faixa e meça.
- Plote os dados no software desejado. As imagens representativas, incluindo a quantificação extraída do ImageJ, estão representadas na Figura 2.
10. Visualização de produtos fluorescentes de círculo rolante usando um microscópio de fluorescência
- Com uma caneta resistente a EtOH, desenhe a posição dos poços antes de remover a grelha de silicone e lave a lâmina como no passo 8.2. Após as etapas de lavagem, monte a lâmina com 1 μL de meio de montagem sem 4',6-diamidino-2-fenilindol (DAPI) e adicione um vidro de cobertura. Para permitir a visualização na câmera, cole a lâmina em uma lâmina de microscópio de 76 mm x 26 mm.
- Analise usando um microscópio de fluorescência equipado com uma objetiva de imersão em óleo 60x e uma câmera. Tire de 12 a 15 imagens de cada amostra/poço.
- Importe as imagens para o ImageJ e empilhe as imagens (Imagem | Pilhas | Imagem a empilhar). Alterar o tipo de imagem para 8 bits (Imagem | Tipo | 8 bits).
- Definir o limite (Imagem | Ajustar | Limiar).
- Defina o limite da seguinte forma: defina a barra inferior e ajuste a barra superior para que apenas os sinais corretos sejam vermelhos e o fundo seja preto. Certifique-se de que o limite seja o mais baixo possível antes que os sinais reais comecem a desaparecer.
- Varra as imagens individuais e certifique-se de que elas correspondem às imagens antes de definir o limite. Observe que o limite pode mudar de experimento para experimento.
- Contar os sinais (Analisar | Analisar partículas). Verifique se o campo resumido nas configurações do ImageJ está marcado.
- Exporte os resultados para uma planilha ou outro software para processamento de dados adicionais. As imagens representativas, incluindo a quantificação extraída do ImageJ, estão representadas na Figura 3.
11. Acoplamento do anticorpo antibiotina conjugado com HRP aos produtos do círculo rolante rotulados com biotina
- Adicione 4 μL de anticorpo antibiotina conjugado com HRP diluído 1:300 em Buffer 5 suplementado com 5% de leite desnatado sem gordura e 5% de BSA a cada poço.
- Incubar durante 50 min a 15-25 °C na câmara de humidade (ver figura 1H).
- Lave 3 x 3 min com o Buffer 5.
- Seque o bem-estar.
12. Visualização dos produtos de círculo rolante rotulados com biotina
- Visualização com ECL
- Misturar 40 μL de Luminol ECL e 40 μL de H 2 O2imediatamente antes da utilização. Adicione 2 μL a cada poço.
- Visualize o slide usando uma câmera CCD ou em filmes de raios-X.
- Visualização com TMB
- Após a etapa 11.4, remova a grade de silicone. Em seguida, adicione 400 μL de TMB em cima de toda a lâmina e coloque a lâmina em uma câmara de umidade. Aguarde ~5-10 min para o desenvolvimento de cores. Após o desenvolvimento da cor, lave a lâmina com 70% de EtOH.
- Visualize o desenvolvimento da cor a olho nu. Tire uma fotografia do slide com uma câmera fotográfica ou telefone celular.
- Importe a imagem para o ImageJ e altere o tipo de imagem para 8 bits (Imagem | Tipo | 8 bits). Para medir as bandas separadamente, limite a área medida usando a ferramenta de desenho de retângulo da barra de ferramentas. Desenhe a área desejada e meça a intensidade (Analisar | Medida). Em seguida, mova a área originalmente desenhada para a próxima faixa e meça.
- Plote os dados no software desejado. Imagens representativas, incluindo quantificação extraída do ImageJ, estão representadas na Figura 4, Figura 5 e Figura 6.
Resultados
Aqui, apresenta-se um protocolo para a detecção da atividade TOP1 utilizando o ensaio REEAD16. O protocolo foi utilizado para detectar a atividade recombinante do TOP1 utilizando quatro métodos de leitura diferentes: scanner de fluorescência, microscópio de fluorescência, quimioluminescência e colorimétrico. O protocolo também foi utilizado para detectar a atividade do TOP1 extraído de células Caco2, como exemplo de extrato bruto, com quimioluminescência ou leitura de TMB. Além disso, o protocolo foi utilizado como uma ferramenta de triagem de drogas, para detectar a inibição da atividade recombinante do TOP1 pela CPT, como um exemplo de um inibidor específico do TOP1, usando o método de leitura da quimioluminescência.
Os resultados obtidos ao analisar a atividade do TOP1 utilizando a leitura de fluorescência estão representados na Figura 2 e na Figura 3. Uma varredura representativa da lâmina fluorescente e a quantificação resultante são mostradas na Figura 2. Como evidenciado a partir da quantificação, esta leitura tem um limite de detecção de 12,5 ng de TOP1. As imagens representativas e a quantificação resultante obtida quando se utilizou a leitura do microscópio fluorescente são mostradas na Figura 3. Usando esse método de leitura, o limite de detecção é tão pequeno quanto 0,1 ng de TOP1. Os resultados obtidos ao analisar a atividade TOP1 utilizando a leitura por quimioluminescência estão representados na Figura 4, e os resultados da leitura colorimétrica estão representados na Figura 5. O limite de detecção desses métodos de leitura é de 6 ng de TOP1 ou como TOP1 extraído de 312 células Caco2. A Figura 6 mostra as medidas da atividade TOP1 na presença de 80 μM de CPT ou DMSO como exemplo de aplicação de triagem de medicamentos. A imagem representativa e a quantificação resultante de três experimentos independentes mostram que a CPT inibe a circularização mediada pelo TOP1 do substrato como esperado24,25.
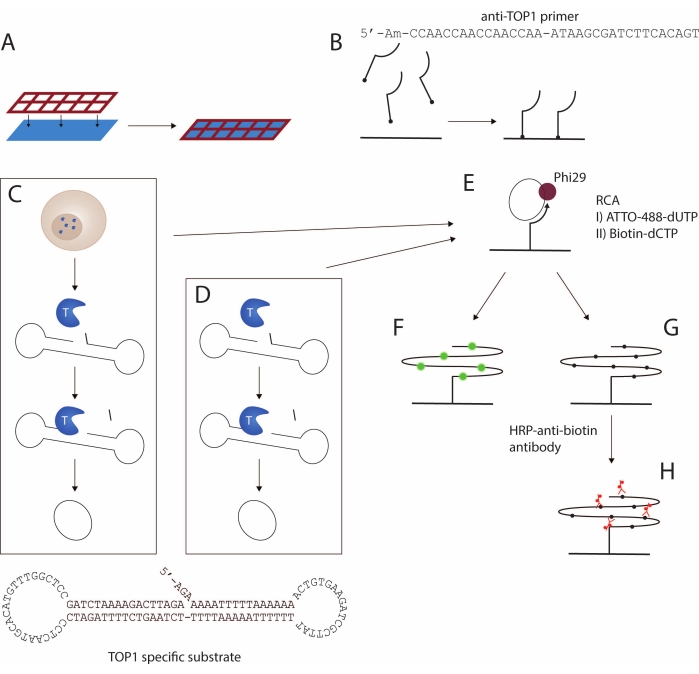
Figura 1: Representação esquemática do protocolo REEAD. (A,B) Preparação dos slides funcionalizados. A grade de silicone é anexada à lâmina funcionalizada. Em seguida, o primer de 5'-amino é acoplado à lâmina, permitindo assim a amplificação do substrato específico do TOP1. (C,D) Geração de substratos circulares fechados. O substrato específico do TOP1 se dobra em uma forma de haltere com um local de clivagem TOP1 preferido no caule de fita dupla e uma sequência de ligação ao primer em um dos dois laços de fita simples. (C) TOP1 é liberado após a lise das células. Após a clivagem e ligadura mediadas por TOP1, o substrato é convertido em um círculo fechado; (D) Utiliza-se TOP1 purificado e recombinante. (E) Amplificação do círculo rolante. Os substratos circulares fechados são hibridizados ao primer de superfície ancorados e amplificados por RCA usando Phi29 polimerase. O ACR pode ser alcançado tanto pela incorporação de nucleotídeos fluorescentes como em F ou nucleotídeos biotinilados como em G. Os produtos fluorescentes do círculo rolante são visualizados usando um microscópio de fluorescência ou um scanner de fluorescência. (H) Acoplamento do anticorpo antibiotina conjugado com HRP. Os produtos do círculo rolante biotinilado são incubados com o anticorpo antibiotina conjugado com HRP. O desenvolvimento do sinal é mediado pela enzima HRP, e os sinais são visualizados por ECL e detectados usando uma câmera CCD ou usando TMB gerando uma visualização colorimétrica. Abreviaturas: REEAD = detecção de atividade enzimática aumentada por círculo rolante; ACR = amplificação do círculo rolante; TOP1 = topoisomerase 1; HRP = peroxidase de rábano; ECL = quimioluminescência aumentada; TMB = 3,3',5,5'-tetrametilbenzidina. Por favor, clique aqui para ver uma versão maior desta figura.
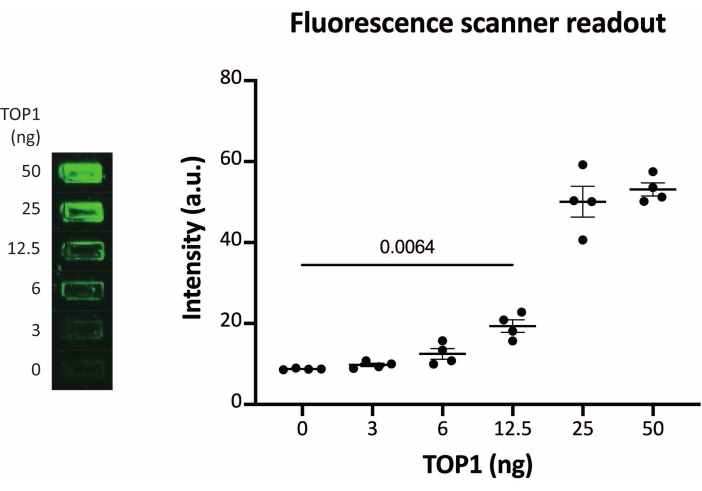
Figura 2: Medições da atividade TOP1 usando o scanner de fluorescência. O painel esquerdo mostra uma imagem representativa do slide ao analisar a atividade de 3-50 ng do TOP1 usando o protocolo de leitura do scanner de fluorescência. O painel direito mostra a quantificação resultante. teste t com correção de Welch, p = 0,0064, n = 4. Abreviatura: TOP1 = topoisomerase 1. Por favor, clique aqui para ver uma versão maior desta figura.
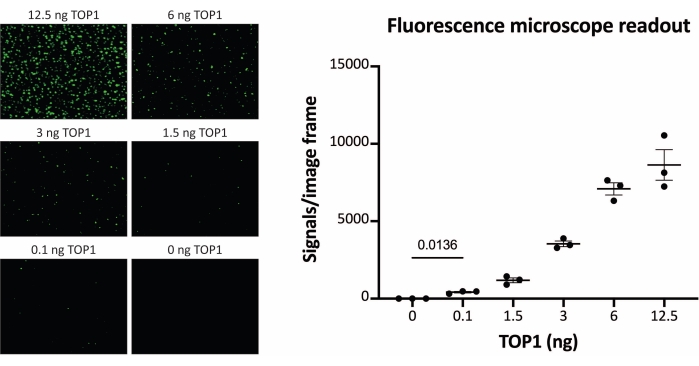
Figura 3: Medidas da atividade TOP1 usando o microscópio de fluorescência. O painel esquerdo mostra imagens representativas da lâmina ao analisar a atividade de 0,1-12,5 ng de TOP1 usando o protocolo de leitura do microscópio de fluorescência. Observe que as imagens são versões cortadas para mostrar corretamente os pontos. Por esta razão, eles não se assemelham ao número de sinais na quantificação mostrada no painel direito. teste t com correção de Welch, p = 0,0136, n = 3. Abreviatura: TOP1 = topoisomerase 1. Por favor, clique aqui para ver uma versão maior desta figura.
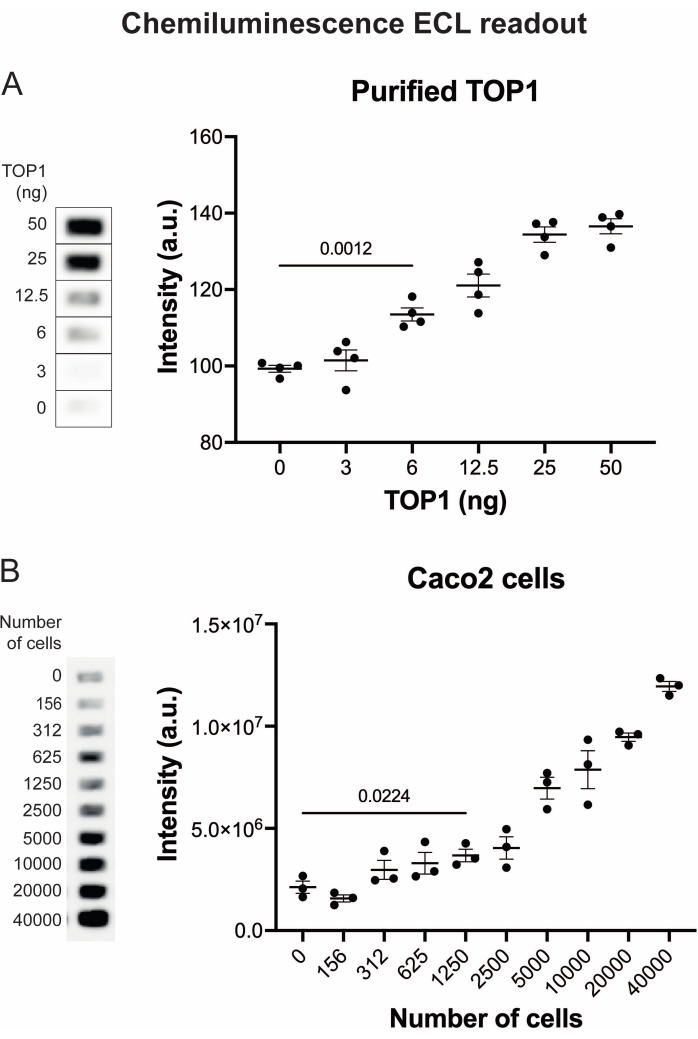
Figura 4: Medições da atividade TOP1 usando a leitura de quimioluminescência. (A) O painel esquerdo mostra uma imagem representativa do slide ao analisar a atividade de 3-50 ng de TOP1 usando o protocolo de leitura de quimioluminescência. O painel direito mostra a quantificação resultante. teste t com correção de Welch, p < 0,0001, n = 4. (B) O painel esquerdo mostra uma imagem representativa do slide ao analisar a atividade do TOP1 extraído de 156-40.000 células Caco2 usando o protocolo de leitura de quimioluminescência. O painel direito mostra a quantificação resultante. teste t com correção de Welch, p = 0,0224, n = 3. Abreviaturas: TOP1 = topoisomerase 1. Por favor, clique aqui para ver uma versão maior desta figura.
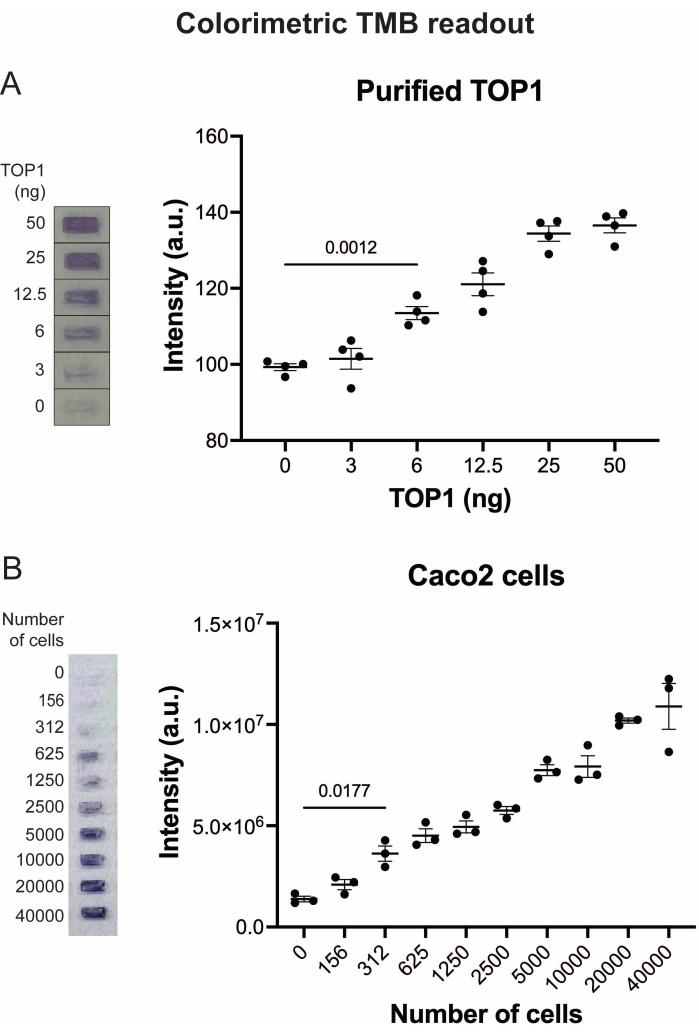
Figura 5: Medidas da atividade TOP1 usando a leitura colorimétrica. (A) O painel esquerdo mostra uma imagem representativa do slide ao analisar 3-50 ng de TOP1 usando o protocolo de leitura colorimétrica. O painel direito mostra a quantificação resultante. teste t com correção de Welch, p = 0,0012, n = 4. (B) O painel esquerdo mostra uma imagem representativa do slide ao analisar a atividade do TOP1 extraído de 156-40.000 células Caco2 usando o protocolo de leitura colorimétrica. O painel direito mostra a quantificação resultante. teste t com correção de Welch, p = 0,0117, n = 3. Abreviaturas: TOP1 = topoisomerase 1; TMB = 3,3',5,5'-tetrametilbenzidina. Por favor, clique aqui para ver uma versão maior desta figura.
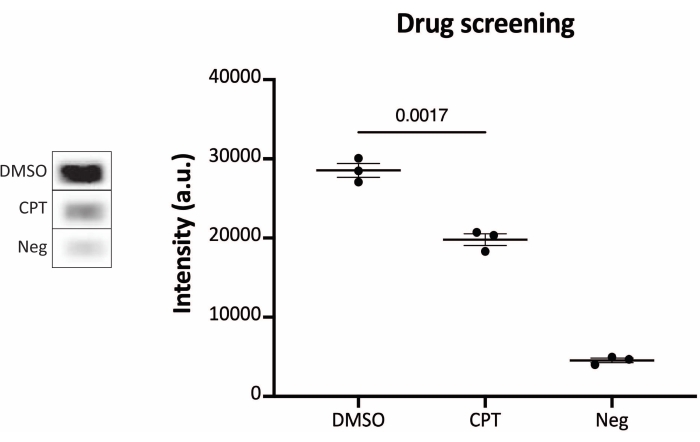
Figura 6: Medidas da atividade do TOP1 após tratamento medicamentoso utilizando os protocolos de leitura de quimioluminescência. O painel esquerdo mostra uma imagem representativa do slide ao analisar 10 ng de TOP1 na presença de 5% de DMSO ou 80 μM de CPT por 1 min. O painel direito mostra a quantificação resultante. teste t com correção de Welch, p = 0,0017, n = 3. Abreviaturas: TOP1 = topoisomerase 1; CPT = camptotecina; DMSO = dimetilsulfóxido; Neg = controle negativo. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
As topoisomeras representam uma classe de enzimas modificadoras de DNA que atraem alto interesse clínico e de pesquisa, sendo alvo de compostos de moléculas pequenas com potencial efeito no tratamento anticancerígeno ou no combate a doenças infecciosas. Além disso, a atividade do TOP1 humano tem se mostrado um biomarcador eficaz do prognóstico e tratamento do câncer18,19,23. Embora seja a atividade do TOP1 que influencia a eficácia de um inibidor quimioterápico26, é frequentemente a quantidade de DNA-RNA ou a quantidade de TOP1 que é avaliada em ambientes clínicos. Isso se deve à falta de ferramentas rápidas, fáceis e gratuitas à base de gel que possam fornecer quantificação precisa e precisa da atividade da topoisomerase em todos os ambientes de laboratório.
Aqui, um protocolo para o ensaio REEAD que permite a medição da atividade do TOP1 de maneira livre de gel é descrito. Neste protocolo, o TOP1 purificado ou extrato bruto de células é incubado com um substrato em forma de haltere de DNA especialmente projetado que, após a clivagem/ligadura mediada por TOP1, é convertido em uma molécula circular fechada. Os círculos são então hibridizados em uma superfície de vidro e amplificados pelo RCA. Para permitir a facilidade de uso na realização de reações que acontecem na lâmina, uma grade de silicone é anexada ao vidro, fazendo poços individuais onde as reações ocorrem. Desta forma, o protocolo tira proveito de um sistema multipoço - uma grade de silicone - chamada wellmaker.
O protocolo foi utilizado para detectar a atividade dos recombinantes TOP1 e TOP1 extraídos de células de adenocarcinoma colorretal Caco2, utilizados como exemplo. Além disso, como exemplo de REEAD para ser utilizado como ferramenta de triagem de medicamentos, o protocolo foi utilizado para detectar a inibição da atividade do TOP1 pelo conhecido inibidor do TOP1 CPT24,25. O ensaio foi acoplado a diferentes métodos de leitura - microscopia de fluorescência, que dá uma alta sensibilidade, e um scanner de fluorescência, quimioluminescência ou colorimétrica, que exigem equipamentos e treinamento menos especializados. A leitura do microscópio de fluorescência altamente sensível tem as limitações da necessidade de uma configuração de microscópio de fluorescência de boa qualidade, pessoal qualificado e aquisição e análise de imagens demoradas.
Por estas razões, apresenta-se a leitura do scanner de fluorescência que permite uma aquisição e análise mais rápidas, mesmo que à custa da sensibilidade. Em caso de falta de um scanner de fluorescência, duas excelentes alternativas, quimioluminescência e métodos de leitura colorimétrica, podem ser consideradas. Ambos os métodos são rápidos e simples, não exigindo equipamentos caros ou treinamento especializado. Em todos os formatos de leitura, o REEAD tem muitas vantagens em comparação com os ensaios de última geração, que são mais demorados, baseados em gel (com os requisitos de agentes intercalantes) e menos diretamente quantitativos. No entanto, existem algumas etapas críticas no protocolo apresentado. Ao manusear a triagem do medicamento, os pontos de tempo, a concentração do medicamento e a proporção de quantidade de TOP1/substrato de DNA devem ser otimizados em comparação com as configurações descritas otimizadas para CPT. O medicamento pode ser investigado realizando uma pré-incubação com o substrato de DNA ou uma pré-incubação com a enzima TOP1. Isso pode fornecer informações valiosas sobre a capacidade da molécula de inibir o TOP1 e oferecer informações sobre o mecanismo de ação da droga.
Além disso, se houver sinais baixos ou ausentes, isso provavelmente se deve a uma lise ineficiente da amostra bruta ou a uma degradação do TOP1 no extrato devido ao uso inadequado de inibidores de protease. Além disso, isso também pode ser devido ao armazenamento inadequado dos componentes importantes do ensaio, como TOP1 recombinante, polimerase phi29, nucleotídeos, substrato e primer. Finalmente, ciclos repetidos de congelamento-descongelamento dos oligonucleotídeos devem ser evitados, pois isso afeta drasticamente o desempenho do ensaio. Quando o extrato bruto é usado, a eficiência de extração da amostra biológica específica precisa ser otimizada e a quantidade e a atividade do TOP1 podem variar do exemplo relatado aqui. Por esta razão, cada extracto bruto a ensaiar exigirá uma titulação para a identificação do limite de detecção do ensaio e da gama de sensibilidade ao utilizar essa amostra específica. O protocolo foi otimizado para a detecção de TOP1 humano. A atividade de outros TOP1s eucarióticos pode ser medida, mas a concentração de NaCl e o tempo de incubação podem precisar ser otimizados de acordo com o método de purificação enzimática e a atividade enzimática ideal. Substratos mais circularizados resultarão de incubação prolongada, enquanto menos substratos circularizados resultarão de incubação encurtada.
Além das aplicações apresentadas, o REEAD permite a mensuração da atividade TOP1 em extratos brutos de pequenas biópsias de pacientes com câncer18, a predição do efeito anticancerígeno citotóxico da CPT em linhagens celulares cancerígenas 20,21,22 e até mesmo a detecção da atividade enzimática em células isoladas 20,21 . Além disso, a configuração REEAD apresentada usando o bem-maker permite a triagem de drogas baseadas em multi-poços de bibliotecas de compostos sintéticos ou naturais. Além disso, uma versão modificada do ensaio REEAD, chamada REEAD C/L, foi desenvolvida. Essa configuração permite investigações separadas das etapas de clivagem e ligadura da reação TOP127. Com o REEAD C/L, é possível determinar o mecanismo de ação de inibidores de pequenas moléculas e caracterizá-los como inibidores catalíticos TOP1 com potenciais efeitos antiparasitários28 ou como venenos TOP1 a serem utilizados para o tratamento anticancerígeno24,25. Finalmente, com um redesenho específico dos substratos de DNA para atender aos diferentes requisitos (para ligação ao DNA ou ligadura por clivagem) de outras enzimas TOP1, o REEAD também tem sido usado para a detecção de doenças infecciosas (como no caso do Plasmodium falciparum, causador da malária29), ou Leishmania donovani e vírus da varíola de macaco (dados não mostrados). Ou, pode ser usado para identificar compostos de moléculas pequenas com efeitos antipatogênicos. O protocolo apresentado fornece aos cientistas do campo TOP1 um método fácil para detectar a atividade enzimática com pouca ou nenhuma otimização e com a possibilidade de ser adaptado a aplicações ainda mais amplas no futuro.
Divulgações
Os autores C.T. e K.M. são funcionários da VPCIR biosciences ApS. C.T., B.R.K. e M.S. são acionistas e/ou detentores de opções de ações. C.T., B.R.K. e M.S. declaram que são nomeados inventores da patente EP2022/057172 depositada em nome da VPCIR biosciences ApS. Os demais autores declaram que não têm interesses conflitantes.
Agradecimentos
Os autores gostariam de agradecer à técnica de laboratório Noriko Y. Hansen, Departamento de Biologia Molecular e Genética da Universidade de Aarhus, pela assistência técnica em relação às purificações enzimáticas Phi29 e TOP1.
Materiais
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Camera for fluorescence image analysis | |||
| CCD camera | For chemiluninescence image analysis | ||
| Fluorescence microscope | Olympus | Equipped with 60x oil immersion objective and a GFP filter ( https://www.edmundoptics.com/p/gfp-filter-cube-set-olympus/21527/) | |
| Fluorescence scanner | Typhoon | FLA 9500 | Equipped with 473 laser and FAM filter |
| Humidity chamber with dH2O | |||
| Hybridization chamber with saturated NaCl | |||
| ImageJ software | Fiji | Download at: https://imagej.net/software/fiji/downloads | |
| Materials | |||
| Cell culture | |||
| Cell growth medium appropiate for the chosen cell line | |||
| Trypsin | Sigma | #T4174 | |
| Pen strep | Sigma | #P4300 | |
| Tissue culture flasks | ThermoFisher | #178983 | |
| FBS | Gibco | #10270106 | |
| NEEA | Sigma | #M7145 | |
| PBS | ThermoFisher | #10010023 | |
| Functionalized slides | |||
| 5'-amine anti-TOP1 primer | Sigma | 5’-/5AmMC6/CCA ACC AAC CAA CCA AAT AAG-3’ | |
| Activated Codelink HD slides | SurModics | #DHD1-0023 | |
| Silicon grid | Grace-biolabs | Custom made | |
| Pertex glue | Histolabs | #00801 | |
| Microscope slide 76 x 26 mm | Hounisen | #2510 1201BL | Other microscope slide of same dimension can be used |
| DNA circles and rolling circle amplification | |||
| TOP1 specific substrate | Sigma | 5’-AGA AAA ATT TTT AAA AAA ACT GTG AAG ATC GCT TAT TTT TTT AAA AAT AAA TCT AAG TCT TTT AGA TCC CTC AAT GCA CAT GTT TGG CTC CGA TCT AAA AGA CTT AGA-3’ | |
| ATTO-488-dUTP | Jena Biosciences | #95387 | |
| Biotin-dCTP | Jena Biosciences | #NU-809-BIO16L | |
| dNTP | ThermoFisher | #R0181 | |
| Phi29 polymerase | VPCIR Biosciences | #10010041 | |
| Recombinant TOP1 | VPCIR Biosciences | #10010001 | |
| Detection of rolling circle products | |||
| BioFX TMB | SurModics | #ESPM-0100-01 | |
| Cover glass | |||
| ECL mixture | Cytiva | #RPN2236 | |
| HRP conjugated anti-biotin antibody | Merck | #A4541 | |
| Mounting medium (vectachield) | Vector laboratories | #H-1000 | |
| Buffer list | |||
| 1x PE Buffer | 1 mM EDTA, 8.12 mM Na2HPO4·2H2O, 1.88 mM NaH2PO4·H2O | ||
| 6x Print Buffer | 300 mM Na3PO4, pH 8.5 | ||
| Blocking solution | Buffer 5 supplemented with 5% non-fat milk and 5% BSA pH 9 | ||
| Lysis Buffer | 10 mM Tris-HCl pH 7.5, 1 mM EDTA + protease inhibitors | ||
| 10x TOP1 Reaction Buffer | 50 mM CaCl2, 50 mM MgCl2, 100 mM Tris-HCl pH 7.5 | ||
| 10x Phi29 Reaction Buffer | 330 mM Tris-acetate pH 7.5, 100 mM Mg-acetate, 660 mM K-acetate, 1% Tween20, 200 mM DTT | ||
| Buffer 1 | 50 mM Tris, 50 mM Tris-HCl, 32 mM ethanolamine. NB: stored at 50 °C. | ||
| Buffer 2 | 4x SSC, 0.1% SDS. NB: stored at 50 °C. | ||
| Buffer 3 | 100 mM Tris-HCl pH 7.5, 150 mM NaCl, 0.3% SDS | ||
| Buffer 4 | 100 mM Tris-HCl pH 7.5, 150 mM NaCl, 0.05% Tween20 | ||
| Buffer 5 | 20 mM Tris-HCl pH 7.5, 150 mM NaCl, 0.05% Tween20 | ||
| Chemicals for buffers | |||
| Tris | Sigma | #T1506 | |
| HCl | Sigma | #1.00317.2011 | |
| EDTA | Sigma | #1.08418.1000 | |
| PMSF | Sigma | #05056489001 | |
| SDS | Applichem | #436143 | |
| Na2HPO4 | Sigma | #1.06580.1000 | |
| NaH2PO4 | Sigma | #1.06346.1000 | |
| Ethanolamine | Sigma | #411000 | |
| SSC | Invitrogen | #15557-036 | |
| Tris-acetate | Sigma | #T1258 | |
| Mg-acetate | Sigma | #M0631 | |
| K-acetate | Sigma | #1.04820.1000 | |
| Tween20 | Sigma | #8.22184.0500 | |
| DTT | Sigma | #D0632 | |
| CaCl2 | Sigma | #1.02382.1000 | |
| MgCl2 | Sigma | #M2670 | |
| NaCl | Sigma | #1.06404.5000 | |
| Skimmed milk powder | Sigma | #70166 | |
| BSA | Sigma | #A4503 |
Referências
- Baldwin, E. L., Osheroff, N. Etoposide, topoisomerase II and cancer. Current Medicinal Chemistry-Anti-Cancer Agents. 5 (4), 363-372 (2005).
- Gilbert, D. C., Chalmers, A. J., El-Khamisy, S. F. Topoisomerase I inhibition in colorectal cancer: Biomarkers and therapeutic targets. British Journal of Cancer. 106 (1), 18-24 (2012).
- Ikeguchi, M., et al. TopoisomeraseI expression in tumors as a biological marker for CPT-11 chemosensitivity in patients with colorectal cancer. Surgery Today. 41 (9), 1196-1199 (2011).
- Meisenberg, C., et al. Clinical and cellular roles for TDP1 and TOP1 in modulating colorectal cancer response to irinotecan. Molecular Cancer Therapeutics. 14 (2), 575-585 (2015).
- Palshof, J. A., et al. Topoisomerase I copy number alterations as biomarker for irinotecan efficacy in metastatic colorectal cancer. BMC Cancer. 17 (1), 1-10 (2017).
- Proszek, J., et al. Topoisomerase I as a biomarker: Detection of activity at the single molecule level. Sensors. 14 (1), 1195-1207 (2014).
- Leppard, J. B., Champoux, J. J. Human DNA topoisomerase I: Relaxation, roles, and damage control. Chromosoma. 114 (2), 75-85 (2005).
- Champoux, J. J. DNA topoisomerases: structure, function, and mechanism. Annual Review of Biochemistry. 70 (1), 369-413 (2001).
- Redinbo, M. R., et al. Crystal structures of human topoisomerase I in covalent and noncovalent complexes with DNA. Science. 279 (5356), 1504-1513 (1998).
- Nitiss, J. L., Soans, E., Rogojina, A., Seth, A., Mishina, M. Topoisomerase assays. Current Protocols in Pharmacology. 57 (1), 3(2012).
- Tesauro, C., et al. Erybraedin C, a natural compound from the plant Bituminaria bituminosa, inhibits both the cleavage and religation activities of human topoisomerase I. Biochemical Journal. 425 (3), 531-539 (2010).
- Keller, J. G., et al. Topoisomerase 1 inhibits MYC promoter activity by inducing G-quadruplex formation. Nucleic Acids Research. 50 (11), 6332-6342 (2022).
- Christiansen, K., Westergaard, O. Characterization of intra- and intermolecular DNA ligation mediated by eukaryotic topoisomerase I. Role of bipartite DNA interaction in the ligation process. Journal of Biological Chemistry. 269 (1), 721-729 (1994).
- Svejstrup, J. Q., Christiansen, K., Andersen, A. H., Lund, K., Westergaard, O. Minimal DNA duplex requirements for topoisomerase I-mediated cleavage in vitro. Journal of Biological Chemistry. 265 (1), 12529-12535 (1990).
- Anand, J., Sun, Y., Zhao, Y., Nitiss, K. C., Nitiss, J. L. Detection of topoisomerase covalent complexes in eukaryotic cells. Methods in Molecular Biology. , Clifton, NJ. 283-299 (2018).
- Stougaard, M., et al. Single-molecule detection of human topoisomerase I cleavage-ligation activity. ACS Nano. 3 (1), 223-233 (2009).
- Keller, J. G., Petersen, K. V., Knudsen, B. R., Tesauro, C. Simple and fast DNA-based tool to investigate topoisomerase 1 activity, a biomarker for drug susceptibility in colorectal cancer. Recent Underst. Colorectal Cancer Treatment. , (2022).
- Jakobsen, A. K., et al. Correlation between topoisomerase I and tyrosyl-DNA phosphodiesterase 1 activities in non-small cell lung cancer tissue. Experimental and Molecular Pathology. 99 (1), 56-64 (2015).
- Jakobsen, A. K., et al. TDP1 and TOP1 as targets in anticancer treatment of NSCLC: Activity and protein level in normal and tumor tissue from 150 NSCLC patients correlated to clinical data. Lung Cancer. 164, 23-32 (2022).
- Keller, J. G., et al. On-slide detection of enzymatic activities in selected single cells. Nanoscale. 9 (36), 13546-13553 (2017).
- Keller, J. G., Stougaard, M., Knudsen, B. R. Enzymatic activity in single cells. Trends in Biotechnology. 29 (5), 222-230 (2019).
- Tesauro, C., et al. Different camptothecin sensitivities in subpopulations of colon cancer cells correlate with expression of different phospho-isoforms of topoisomerase i with different activities. Cancers. 12 (5), 1240(2020).
- Tesauro, C., et al. Topoisomerase i activity and sensitivity to camptothecin in breast cancer-derived cells: A comparative study. BMC Cancer. 19 (1), 1-15 (2019).
- Pommier, Y. DNA topoisomerase I Inhibitors: Chemistry, biology, and interfacial inhibition. Chemical Reviews. 109 (7), 2894-2902 (2009).
- Pommier, Y. Drugging topoisomerases: lessons and challenges. ACS Chemical Biology. 8 (1), 82-95 (2013).
- Bailly, C. Irinotecan: 25 years of cancer treatment. Pharmacological Research. 148, 104398(2019).
- Petersen, K. V., et al. Simple and fast dna based sensor system for screening of small-molecule compounds targeting eukaryotic topoisomerase 1. Pharmaceutics. 13 (8), 1255(2021).
- García-Estrada, C., Prada, C. F., Fernández-Rubio, C., Rojo-Vázquez, F., Balaña-Fouce, R. DNA topoisomerases in apicomplexan parasites: promising targets for drug discovery. Proceedings of the Royal Society B: Biological Sciences. 277 (1689), 1777-1787 (2010).
- Hede, M. S., et al. Detection of the malaria causing Plasmodium parasite in saliva from infected patients using topoisomerase I activity as a biomarker. Scientific Reports. 8 (1), 1-12 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados