Method Article
Einfache und schnelle Rolling Circle Amplification-basierte Detektion der Topoisomerase 1-Aktivität in rohen biologischen Proben
In diesem Artikel
Zusammenfassung
Ein Protokoll für den sensitiven und quantitativen Nachweis der Topoisomerase 1-Aktivität unter Verwendung des Rolling-Circle-Enhanced Enzymaktivitätsnachweis-Assays wird beschrieben. Die Methode ermöglicht den Nachweis der Topoisomerase 1-Aktivität aus gereinigten Komponenten oder Zell-/Gewebeextrakten. Dieses Protokoll hat weitreichende Anwendungen in allen Bereichen, in denen enzymatische Aktivität nachgewiesen wird.
Zusammenfassung
Isotherme Amplifikationstechniken wie die Rollkreisamplifikation wurden erfolgreich zum Nachweis von Nukleinsäuren, Proteinmengen oder anderen relevanten Molekülen eingesetzt. Diese Methoden haben sich als wesentliche Alternativen zu PCR oder ELISA für klinische und Forschungsanwendungen erwiesen. Darüber hinaus reicht der Nachweis der Proteinmenge (durch Western Blot oder Immunhistochemie) oft nicht aus, um Informationen für die Krebsdiagnose zu liefern, während die Messung der Enzymaktivität einen wertvollen Biomarker darstellt. Die Messung der Enzymaktivität ermöglicht auch die Diagnose und mögliche Behandlung von durch Krankheitserreger übertragenen Krankheiten. In allen Eukaryoten sind Topoisomerasen die wichtigsten DNA-bindenden Enzyme, die an der Kontrolle des topologischen Zustands der DNA während wichtiger zellulärer Prozesse beteiligt sind und zu den wichtigen Biomarkern für die Krebsprognose und -behandlung gehören.
Im Laufe der Jahre wurden Topoisomerasen als potenzielles Ziel von Antiparasitika und Krebsmedikamenten mit Bibliotheken natürlicher und synthetischer niedermolekularer Verbindungen, die jedes Jahr untersucht werden, wesentlich untersucht. Hier wird die Rolling-Circle-Amplifikationsmethode vorgestellt, die als REEAD-Assay (Rolling Circle Enhanced Enzyme Activity Detection) bezeichnet wird und die quantitative Messung der Topoisomerase 1 (TOP1)-Aktivität auf einfache, schnelle und gelfreie Weise ermöglicht. Durch Spaltung und Ligierung eines speziell entworfenen DNA-Substrats wandelt TOP1 ein DNA-Oligonukleotid in einen geschlossenen Kreis um, der zur Vorlage für die Rollkreisamplifikation wird und ~103 Tandem-Wiederholungsrollkreisprodukte ergibt. Je nach Nukleotideinbau während der Amplifikation besteht die Möglichkeit verschiedener Auslesemethoden, von Fluoreszenz über Chemilumineszenz bis hin zu kolorimetrisch. Da jede TOP1-vermittelte Spaltungsligatur einen geschlossenen DNA-Kreis erzeugt, ist der Assay hochsensitiv und direkt quantitativ.
Einleitung
Topoisomerasen gehören zur Klasse der DNA-modifizierenden Enzyme und viele von ihnen haben sich als Biomarker für menschliche Krankheiten 1,2,3,4,5,6 bewährt. TOP1 ist an der Auflösung des topologischen Stresses beteiligt, der mit zellulären Prozessen wie DNA-Replikation, Gentranskription, Rekombination und chromosomaler Segregation verbundenist 7. TOP1 kann sowohl negative als auch positive Superspulen durch einen Mechanismus auflösen, der die Bildung eines vorübergehenden einzelsträngigen Bruchs in der DNA 8,9 beinhaltet. Nach der Bindung an DNA positioniert TOP1 das aktive Tyrosin (Tyr723), um einen nukleophilen Angriff auf das Phosphodiester-Rückgrat durchzuführen. Ein TOP1-DNA-Spaltungskomplex wird dann erzeugt, wobei das Enzym kovalent an das 3'-Ende des gebrochenen DNA-Strangs gebunden ist. Dadurch wird Torsionsspannung freigesetzt, indem sich das 5'-Ende des gespaltenen Strangs um den intakten Strang drehen kann. Schließlich führt die Hydroxylgruppe des 5'-Endes einen nukleophilen Angriff auf die 3'-Phosphotyrosylbindung durch. Als Ergebnis wird TOP1 freigesetzt und das DNA-Rückgrat wird wiederhergestellt8.
Mehrere Assays wurden entwickelt, um die Schritte des katalytischen TOP1-Zyklus zu untersuchen, darunter der Relaxationsassay10, der elektrophoretische Mobilitätsverschiebungsassay (EMSA)11,12, der DNA-Selbstmord-Spaltungs-Ligations-Assays 13,14 und der In-vivo-Enzymkomplex (ICE)-Assay15 . Diese Assays haben jedoch einige Einschränkungen, da sie von der Gelelektrophorese abhängig sind, die DNA-Interkalationsmittel erfordert, oder sie erfordern eine hochspezialisierte Ausbildung und Ausrüstung. Darüber hinaus erfordern die Assays große Mengen an gereinigtem TOP1-Enzym (im Bereich von 1 bis 5 ng für den Relaxationstest und 50 bis 200 ng für den EMSA und den Spaltungs-Ligations-Assay) oder Extrakte aus mindestens 10bis 6 Zellen, um optimal zu funktionieren. Daher wurde eine hochempfindliche Methode entwickelt, die den spezifischen Nachweis der TOP1-Aktivität in rohen biologischen Proben und auf der Ebene einzelner katalytischer Ereignisse ermöglicht, der sogenannte REEAD-Assay,16.
Hier wird ein Protokoll zum Nachweis der TOP1-Aktivität mit dem REEAD-Assay16 vorgestellt. Eine schematische Darstellung des Assays ist in Abbildung 1 dargestellt. Ein speziell entwickeltes Silikongitter wird an einem funktionalisierten Objektträger befestigt, um ein Glasobjektträger-Multiwell-Setup zu erstellen, das im Folgenden als Wellmaker bezeichnet wird (Abbildung 1A). Es folgt die Kopplung eines 5'-aminomodifizierten Primers an die funktionellen NHS-Gruppen in den Vertiefungen des Objektträgers (Abbildung 1B). Die TOP1-vermittelte Spaltungs- und Ligationsreaktion wandelt ein spezifisches DNA-Substrat in einen geschlossenen Kreis um. Das TOP1-spezifische Substrat (Abbildung 1C) faltet sich spontan zu einer Hantelform, die einen doppelsträngigen Stiel und zwei einzelsträngige Schlaufen enthält. Eine der Schlaufen ist komplementär zur oberflächenverankerten Grundierung. Die Stammregion enthält eine bevorzugte TOP1-Spaltstelle drei Basen stromaufwärts vom 3'-Ende und einen 5'-Hydroxylüberhang. Die Zirkular des Substrats kann entweder mit Zell-/Gewebeextrakt (Abbildung 1C) oder rekombinantem, gereinigtem TOP1 (Abbildung 1D) erreicht werden.
Wenn das Substrat durch TOP1 gespalten wird, wird das Enzym vorübergehend an das 3'-Ende gebunden und das Dreibasenfragment diffundiert, wodurch der 5'-Überhang zum Substrat geglüht werden kann und die TOP1-vermittelte Ligatur erleichtert wird. Die Ligatur führt zu einer Zirkularisierung des Substrats und anschließend zur Dissoziation von TOP1. Der geschlossene Kreis wird mit dem oberflächenverankerten Primer hybridisiert (Abbildung 1E) und als Vorlage für die isotherme Rollkreisamplifikation (RCA) verwendet, die durch die phi29-Polymerase vermittelt wird, die RCA mit Strangverschiebung durchführen kann, was 103 Tandem-Wiederholungsprodukte ergibt. Während des RCA-Schritts können fluoreszenzmarkierte (Abbildung 1F) oder Biotin-gekoppelte (Abbildung 1G) Nukleotide eingebaut werden17. Der Einbau von fluoreszenzmarkierten Nukleotiden ermöglicht die Detektion der RCPs entweder mit einem Fluoreszenzmikroskop oder einem Fluoreszenzscanner. Alternativ kann ein Meerrettichperoxidase (HRP)-gekoppelter Antibiotin-Antikörper (Abbildung 1H) die biotinylierten Nukleotide binden und so den Nachweis der Rolled Circle Products (RCPs) ermöglichen, entweder durch verstärkte Chemilumineszenz (ECL) oder durch Umwandlung von 3,3',5,5'-Tetramethylbenzidin (TMB) in eine nachweisbare Farbe. Die RCA folgt einer linearen Reaktionskinetik, wodurch der REEAD-Assay direkt quantitativ wird, da ein RCP eine einzelne TOP1-vermittelte Spaltungs-Ligationsreaktion darstellt. Hier wird gezeigt, dass dieser Assay verwendet werden kann, um die TOP1-Aktivität als gereinigtes rekombinantes Enzym oder aus Rohproben und als Anti-TOP1-Drogen-Screening-Tool nachzuweisen.
Protokoll
HINWEIS: Eine Liste der Pufferzusammensetzungen, Geräte und anderen erforderlichen Materialien finden Sie in der Materialtabelle.
1. Zellkultur
- Kulturieren Sie die bevorzugten Zellen in geeignetem Medium und züchten Sie sie nach Anweisungen. Zum Beispiel wachsen Caco2, kolorektale Adenokarzinom-abgeleitete Zellen, in Minimal Essential Medium (MEM), ergänzt mit 20% fetalem Rinderserum (FBS), 1% nicht-essentiellen Aminosäuren (NEAA), 100 Einheiten / ml Penicillin und 100 mg / ml Streptomycin. Die Zellkulturen werden in einem befeuchteten Inkubator aufbewahrt (5% CO2/95% Luftatmosphäre bei 37 °C). Die Zellen in Gewebekulturkolben geben und alle 3 Tage teilen, um die Zellen bei 70% Konfluenz zu halten.
- Ernten Sie die Zellen aus einem 70% konfluenten Kolben durch Trypsinbehandlung (0,25% Trypsin, 0,02% EDTA-Lösung) und waschen Sie mit phosphatgepufferter Kochsalzlösung (PBS).
- Resuspendieren Sie das Zellpellet in PBS, um die Zellkonzentration auf 0,5 × 106 Zellen / Röhrchen einzustellen. Bei 200 × g 5 min drehen und den Überstand vorsichtig absaugen.
HINWEIS: Zellen, die für REEAD verwendet werden, müssen frisch verwendet und auf Eis aufbewahrt werden. Die mit Caco2-Zellen erzielten Ergebnisse wurden kürzlich veröffentlicht17. Der Assay wurde mit einer Vielzahl von Zelllinien getestet, einschließlich Dickdarm-, Brust-, Lungen- und Gebärmutterhalskrebszellen 18,19,20,21,22,23, aber er kann mit allen rohen biologischen Proben verwendet werden, die TOP1 enthalten, wie Gewebe, Blut und Speichel.
2. Erstellung funktionalisierter Objektträger
- Befestigen Sie das speziell entwickelte Silikonisolatorgitter am funktionalisierten Objektträger und machen Sie so den Wellmaker. Drücken Sie auf das Silikon, um die Bildung von Luftblasen zu vermeiden (siehe Abbildung 1A).
- Bereiten Sie eine Mischung aus 5 μM 5'-Amino-Primer in 1x Druckpuffer vor. 4 μL der Mischung in jede Vertiefung geben und den Wellamker in eine Hybridisierungskammer mit gesättigtem NaCl bei Temperaturen zwischen 15 °C und 25 °C geben, geschützt vor Licht.
HINWEIS: Eine Hybridisierungskammer kann leicht mit einer mit gesättigtem NaCl gefüllten Pipettenspitzenbox hergestellt werden. Die Hybridisierung dauert mindestens 16 h und maximal 72 h. Siehe die Sequenz des 5'-Amino-Primers in Abbildung 1B. Die Objektträger werden mit NHS-Gruppen funktionalisiert, um die Bindung von aminomodifizierten Oligonukleotiden zu ermöglichen.
3. Erzeugung geschlossener kreisförmiger Substrate
- Herstellung geschlossener kreisförmiger Substrate mit rekombinantem TOP1 oder Zellextrakt.
- Lysieren Sie ein Zellpellet von 0,5 × 106 Zellen in 500 μL Lysepuffer, um eine Zelldichte von 1.000 Zellen / μL zu erreichen. Inkubieren Sie für 10 min auf Eis.
- Es wird eine Kreismischung aus 2 μL 5 μM TOP1-spezifischem Substrat hergestellt (die Reihenfolge des Substrats ist wie folgt: 5'-AGA AAA ATT TTT AAA AAA ACT GTG AAG ATC GCT TAT TTT TTT AAA AAT AAA TCT AAG TCT TTT AGA TCC CTC AAT GCA CAT GTT TGG CTC CGA TCT AAA AGA CTT AGA-3') und 2 μL rekombinantes TOP1-Enzym oder 2 μL Zellextrakt (siehe Schritt 3.1.1) in 16 μL von 1x TOP1 Reaktionspuffer.
HINWEIS: Die Konzentration des verwendeten rekombinanten TOP1 hängt von der gewählten Auslesemethode ab (siehe Abbildung 2, Abbildung 3, Abbildung 4 und Abbildung 5). Siehe die Reihenfolge des TOP1-spezifischen Substrats in Abbildung 1C. - 30 min bei 37 °C inkubieren (siehe Abbildung 1C,D).
- Stoppen Sie die Reaktion durch Zugabe von 2 μL 1% SDS.
- Herstellung von geschlossenen kreisförmigen Substraten in Gegenwart von Arzneimitteln
- Bereiten Sie eine Kreismischung aus 2 μL 5 μM TOP1-spezifischem Substrat und 1 μL 100% DMSO oder 1 μL 1,6 mM Camptothecin (CPT) in 14 μL 1x TOP1-Reaktionspuffer vor. Fügen Sie 2 μL 5 ng/μL rekombinantes TOP1-Enzym hinzu.
HINWEIS: Andere niedermolekulare Verbindungen oder Medikamente können verwendet werden. In diesem Fall sollte eine Titration der Verbindung vorgenommen werden. Wenn die Verbindung in einem anderen Lösungsmittel als DMSO gelöst ist, sollte dieses anstelle von DMSO als Kontrolle verwendet werden. - 1 min bei 37 °C inkubieren.
- Stoppen Sie die Reaktion durch Zugabe von 2 μL 1% SDS.
- Bereiten Sie eine Kreismischung aus 2 μL 5 μM TOP1-spezifischem Substrat und 1 μL 100% DMSO oder 1 μL 1,6 mM Camptothecin (CPT) in 14 μL 1x TOP1-Reaktionspuffer vor. Fügen Sie 2 μL 5 ng/μL rekombinantes TOP1-Enzym hinzu.
HINWEIS: Schritt 3 kann parallel zu Schritt 2 gestartet werden, und die Kreise können über Nacht bei 4 °C gelagert werden. Alternativ können die DNA-Kreise gleichzeitig mit Schritt 4 präpariert und sofort verwendet werden. Siehe die Reihenfolge des TOP1-spezifischen Substrats in Abbildung 1C. Das Substrat faltet sich zu einer Hantelform mit einer doppelten Stammregion, die eine bevorzugte TOP1-Spaltstelle und zwei einzelsträngige Schleifen enthält. Das offene Hantelsubstrat wird durch TOP1-vermittelte Spaltung und Ligatur in ein geschlossenes kreisförmiges Substrat umgewandelt und im Folgenden als Kreis bezeichnet. Da es einen Überschuss des 5'-Amino-Primers gibt, wird es keine Konkurrenz zwischen offenen und geschlossenen TOP1-spezifischen Substraten geben.
4. Blockieren des Bohrlochs
- Tauchen Sie den Wellmaker in ein 5 cm x 5 cm großes Tablett, gefüllt mit Buffer 1, das auf 50 °C vorgeheizt wurde. Drücken Sie die Flüssigkeit mit einer Pipette in die Vertiefungen, um sicherzustellen, dass keine Luftblasen vorhanden sind. 30 min bei 50 °C inkubieren.
- Puffer 1 entfernen und 2 x 1 min mitdH2O waschen.
- Fügen Sie den auf 50 °C vorgeheizten Puffer 2 hinzu. Stellen Sie sicher, dass sich keine Luftblasen in den Brunnen befinden. 30 min bei 50 °C inkubieren.
- 2 x 1 min mit dH2O waschen.
- Mit 70% EtOH 1 min waschen. Mit der Hand kräftig schütteln.
- Lassen Sie den Brunnenmacher an der Luft trocknen.
HINWEIS: Verwenden Sie Druckluft, um die Brunnen zu trocknen. Alternativ ist es möglich, Luft mit einer Pasteur-Pipette zu blasen. Stellen Sie sicher, dass die Brunnen trocken sind, bevor Sie fortfahren.
5. Hybridisierung der Kreise zum Wellmaker
- Fügen Sie 4 μL der Kreise (in Schritt 3 gemacht) zu jeder entsprechenden Vertiefung hinzu.
- Stellen Sie den Wellmaker für 1 h mitdH2O bei 37 °C in eine Feuchtigkeitskammer.
HINWEIS: Eine Feuchtekammer kann unter Verwendung einer mitdH2O gefüllten Box für Pipettenspitzen hergestellt werden. Alternativ kann die Hybridisierung über Nacht bei 25 °C in der Feuchtigkeitskammer erfolgen.
6. Waschen
- Waschen Sie den Wellmaker mit Puffer 3.
- Entfernen Sie Puffer 3 und ersetzen Sie ihn durch Puffer 4.
- Puffer 4 entfernen und mit 70% EtOH waschen.
- Entfernen Sie das EtOH und lassen Sie den Bohrlocher trocknen.
HINWEIS: Alle Waschschritte werden für 1 min in einer 5 cm x 5 cm großen Schale durchgeführt, indem der Objektträger vollständig eingetaucht wird. Stellen Sie immer sicher, dass sich keine Luftblasen in den Brunnen befinden.
7. Rollkreisverstärkung
- Bereiten Sie eine RCA-Mischung aus 1x Phi29-Reaktionspuffer vor, ergänzt mit 0,2 μg/μL BSA, 1 Einheit Phi29-Polymerase und entweder 0,25 mM dNTP und 0,0125 mM ATTO-488-dUTP für die Fluoreszenzauslesung oder 0,1 mM dATP, 0,1 mM DTTP, 0,1 mM dGTP, 0,09 mM dCTP und 0,01 mM Biotin-dCTP für kolorimetrische/Chemilumineszenzauslesung. Fügen Sie 4 μL in jede Vertiefung hinzu. Siehe Abbildung 1E.
HINWEIS: Die Zubereitung der RCA-Mischung muss auf Eis erfolgen. Wenn Sie fluoreszierende Nukleotide in die RCA einarbeiten, vermeiden Sie direktes Licht aus diesem Schritt, um die Fluorophore zu schützen. - 2 h bei 37 °C in der Feuchtekammer inkubieren. Bei Verwendung von fluoreszierenden Nukleotiden die Feuchtigkeitskammer im Dunkeln stellen. Siehe Abbildung 1F,G.
8. Waschen
- Für die Chemilumineszenz- oder kolorimetrischen Ausleseprotokolle waschen Sie den Wellmaker wie in Schritt 6 und fahren Sie dann mit Schritt 11 fort.
- Für das Fluoreszenz-Ausleseprotokoll entfernen Sie das Silikongitter vor dem Waschen wie in den folgenden Schritten.
- Waschen Sie den Objektträger 10 Minuten in Puffer 3.
- Entfernen Sie Puffer 3 und ersetzen Sie ihn durch Puffer 4. 5 min waschen.
- Puffer 4 entfernen und 1 min in 70% EtOH waschen.
- Entfernen Sie das EtOH und lassen Sie den Bohrlocher trocknen.
9. Visualisierung von fluoreszierenden Rollkreisprodukten mit einem Fluoreszenzscanner
- Scannen Sie den Objektträger in einem Fluoreszenzscanner mit den Filtern, die dem verwendeten Fluorophor entsprechen. Verwenden Sie den maximal möglichen Photomultiplier, der keine Sättigung ergibt.
HINWEIS: Der in diesem Protokoll für die Bildaufnahme verwendete Fluoreszenzscanner ist mit einem 473-nm-Laser und einem FAM-Filter-Anregungssensor 490 nm, Emission 520 nm ausgestattet. - Importieren Sie das Bild in ImageJ und ändern Sie den Bildtyp in 8-Bit (Bild | Typ | 8-Bit). Um die Bänder separat zu messen, begrenzen Sie den gemessenen Bereich mithilfe des Rechteckzeichnungswerkzeugs aus der Symbolleiste. Zeichnen Sie den gewünschten Bereich und messen Sie die Intensität (Analysieren | Messen). Verschieben Sie dann den ursprünglich gezeichneten Bereich zum nächsten Band und messen Sie.
- Zeichnen Sie die Daten in der gewünschten Software. Repräsentative Bilder einschließlich der aus ImageJ extrahierten Quantifizierung sind in Abbildung 2 dargestellt.
10. Visualisierung fluoreszierender Rollkreisprodukte mit einem Fluoreszenzmikroskop
- Zeichnen Sie mit einem EtOH-resistenten Stift die Position der Vertiefungen, bevor Sie das Silikongitter entfernen, und waschen Sie den Objektträger wie in Schritt 8.2. Nach den Waschschritten montieren Sie den Objektträger mit 1 μL Montagemedium ohne 4',6-Diamidino-2-phenylindol (DAPI) und fügen Sie ein Deckglas hinzu. Um die Visualisierung in der Kamera zu ermöglichen, kleben Sie den Objektträger auf einen 76 mm x 26 mm großen Objektträger.
- Analysieren Sie mit einem Fluoreszenzmikroskop, das mit einem 60-fachen Ölimmersionsobjektiv und einer Kamera ausgestattet ist. Nehmen Sie 12-15 Bilder von jeder Probe/Vertiefung auf.
- Importieren Sie die Bilder in ImageJ und stapeln Sie die Bilder (Bild | Stapel | Bild zum Stapeln). Ändern Sie den Bildtyp in 8-Bit (Bild | Typ | 8-Bit).
- Festlegen des Schwellenwerts (Bild | Anpassen | Schwellenwert).
- Stellen Sie den Schwellenwert wie folgt ein: Stellen Sie den unteren Balken ein und stellen Sie den oberen Balken so ein, dass nur die richtigen Signale rot und der Hintergrund schwarz ist. Stellen Sie sicher, dass der Schwellenwert so niedrig wie möglich ist, bevor die realen Signale verschwinden.
- Streichen Sie durch die einzelnen Bilder und stellen Sie sicher, dass sie den Bildern entsprechen, bevor Sie den Schwellenwert festlegen. Beachten Sie, dass sich der Schwellenwert von Experiment zu Experiment ändern kann.
- Zählen Sie die Signale (Analysieren | Partikel analysieren). Stellen Sie sicher, dass das zusammengefasste Feld in den ImageJ-Einstellungen aktiviert ist.
- Exportieren Sie die Ergebnisse zur weiteren Datenverarbeitung in eine Tabelle oder eine andere Software. Repräsentative Bilder einschließlich der aus ImageJ extrahierten Quantifizierung sind in Abbildung 3 dargestellt.
11. Kopplung von HRP-konjugierten Antibiotin-Antikörpern an die Biotin-markierten Rollkreisprodukte
- Fügen Sie 4 μL HRP-konjugierten Antibiotin-Antikörper verdünnt 1:300 in Puffer 5 hinzu, ergänzt mit 5% fettfreier Magermilch und 5% BSA.
- 50 min bei 15-25 °C in der Feuchtekammer inkubieren (siehe Abbildung 1H).
- 3 x 3 min mit Buffer 5 waschen.
- Trocknen Sie den Brunnenmacher.
12. Visualisierung der Biotin-markierten Rollkreisprodukte
- Visualisierung mit ECL
- Mischen Sie 40 μL ECL Luminol und 40 μLH2O2unmittelbar vor Gebrauch. Fügen Sie 2 μL zu jeder Vertiefung hinzu.
- Visualisieren Sie das Dia mit einer CCD-Kamera oder auf Röntgenfilmen.
- Visualisierung mit TMB
- Entfernen Sie nach Schritt 11.4 das Silikongitter. Fügen Sie dann 400 μL TMB auf den gesamten Objektträger und legen Sie den Objektträger in eine Feuchtigkeitskammer. Warten Sie ~5-10 Minuten für die Farbentwicklung. Nach der Farbentwicklung den Objektträger mit 70% EtOH waschen.
- Visualisieren Sie die Farbentwicklung mit bloßem Auge. Machen Sie ein Foto des Dias mit einer Fotokamera oder einem Mobiltelefon.
- Importieren Sie das Bild in ImageJ und ändern Sie den Bildtyp in 8-Bit (Bild | Typ | 8-Bit). Um die Bänder separat zu messen, begrenzen Sie den gemessenen Bereich mithilfe des Rechteckzeichnungswerkzeugs aus der Symbolleiste. Zeichnen Sie den gewünschten Bereich und messen Sie die Intensität (Analysieren | Messen). Verschieben Sie dann den ursprünglich gezeichneten Bereich zum nächsten Band und messen Sie.
- Zeichnen Sie die Daten in der gewünschten Software. Repräsentative Bilder einschließlich der aus ImageJ extrahierten Quantifizierung sind in Abbildung 4, Abbildung 5 und Abbildung 6 dargestellt.
Ergebnisse
Hier wird ein Protokoll zum Nachweis der TOP1-Aktivität unter Verwendung des REEAD-Assays vorgestellt16. Das Protokoll wurde verwendet, um rekombinante TOP1-Aktivität mit vier verschiedenen Auslesemethoden zu erkennen: Fluoreszenzscanner, Fluoreszenzmikroskop, Chemilumineszenz und Kolorimetrie. Das Protokoll wurde auch verwendet, um die Aktivität von TOP1 aus Caco2-Zellen als Beispiel für Rohextrakt mit Chemilumineszenz oder TMB-Auslesung nachzuweisen. Darüber hinaus wurde das Protokoll als Wirkstoff-Screening-Tool verwendet, um die Hemmung der rekombinanten TOP1-Aktivität durch CPT nachzuweisen, als Beispiel für einen TOP1-spezifischen Inhibitor unter Verwendung der Chemilumineszenz-Auslesemethode.
Die Ergebnisse der Analyse der TOP1-Aktivität mit Hilfe der Fluoreszenzanzeige sind in Abbildung 2 und Abbildung 3 dargestellt. Ein repräsentativer Scan des fluoreszierenden Objektträgers und die daraus resultierende Quantifizierung sind in Abbildung 2 dargestellt. Wie aus der Quantifizierung hervorgeht, hat diese Anzeige eine Nachweisgrenze von 12,5 ng TOP1. Repräsentative Bilder und die resultierende Quantifizierung, die bei Verwendung der fluoreszierenden Mikroskopauslesung erhalten wurde, sind in Abbildung 3 dargestellt. Bei dieser Auslesemethode liegt die Nachweisgrenze bei nur 0,1 ng TOP1. Die Ergebnisse der Analyse der TOP1-Aktivität mit der Chemilumineszenzanzeige sind in Abbildung 4 dargestellt, und die Ergebnisse der kolorimetrischen Anzeige sind in Abbildung 5 dargestellt. Die Nachweisgrenze dieser Auslesemethoden liegt bei 6 ng TOP1 oder als TOP1, extrahiert aus 312 Caco2-Zellen. Abbildung 6 zeigt die Messungen der TOP1-Aktivität in Gegenwart von 80 μM CPT oder DMSO als Beispiel für eine Drogenscreening-Anwendung. Das repräsentative Bild und die daraus resultierende Quantifizierung von drei unabhängigen Experimenten zeigen, dass CPT die TOP1-vermittelte Zirkularisierung des Substrats wie erwartet hemmt24,25.
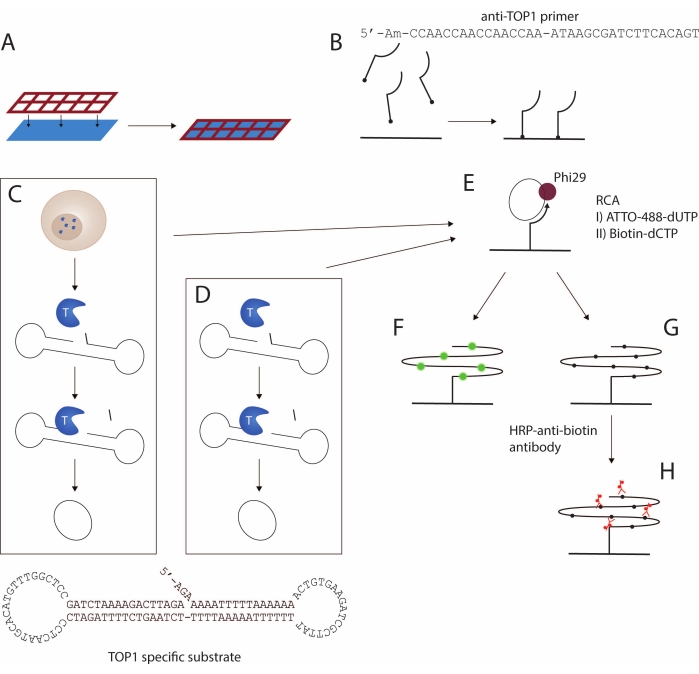
Abbildung 1: Schematische Darstellung des REEAD-Protokolls. (A,B) Vorbereitung der funktionalisierten Objektträger. Das Silikongitter wird am funktionalisierten Objektträger befestigt. Anschließend wird der 5'-Amino-Primer an den Objektträger gekoppelt und ermöglicht so eine Verstärkung des TOP1-spezifischen Substrats. (C,D) Erzeugung geschlossener kreisförmiger Substrate. Das TOP1-spezifische Substrat faltet sich in eine Hantelform mit einer bevorzugten TOP1-Spaltstelle im doppelsträngigen Stamm und einer Primer-Bindungssequenz in einer der beiden einzelsträngigen Schleifen. (C) TOP1 wird bei der Lyse der Zellen freigesetzt. Bei TOP1-vermittelter Spaltung und Ligatur wird das Substrat in einen geschlossenen Kreis umgewandelt; (D) gereinigtes, rekombinantes TOP1 verwendet wird. (E) Rollkreisverstärkung. Die geschlossenen kreisförmigen Substrate werden mit dem oberflächenverankerten Primer hybridisiert und mittels RCA mittels Phi29-Polymerase amplifiziert. Die RCA kann entweder durch Einbau von fluoreszierenden Nukleotiden wie in F oder biotinylierten Nukleotiden wie in G erreicht werden. Die fluoreszierenden Rollkreisprodukte werden entweder mit einem Fluoreszenzmikroskop oder einem Fluoreszenzscanner visualisiert. (H) Kopplung des HRP-konjugierten Antibiotin-Antikörpers. Die biotinylierten Rollkreisprodukte werden mit dem HRP-konjugierten Antibiotin-Antikörper inkubiert. Die Signalentwicklung wird durch das HRP-Enzym vermittelt, und die Signale werden entweder durch ECL visualisiert und mit einer CCD-Kamera oder mit TMB detektiert, um eine kolorimetrische Visualisierung zu erzeugen. Abkürzungen: REEAD = rolling circle enhanced enzyme activity detection; RCA = Rollkreisverstärkung; TOP1 = Topoisomerase 1; HRP = Meerrettichperoxidase; ECL = erhöhte Chemilumineszenz; TMB = 3,3',5,5'-Tetramethylbenzidin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
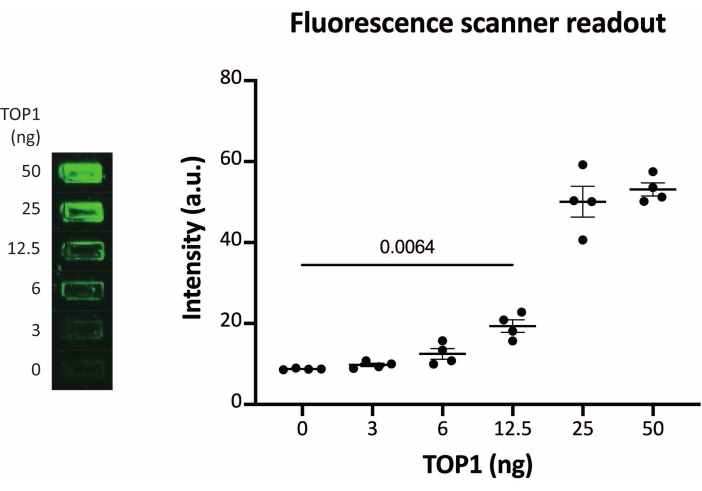
Abbildung 2: Messung der TOP1-Aktivität mit dem Fluoreszenzscanner. Das linke Feld zeigt ein repräsentatives Bild des Objektträgers bei der Analyse der Aktivität von 3-50 ng TOP1 unter Verwendung des Fluoreszenzscanner-Ausleseprotokolls. Das rechte Feld zeigt die resultierende Quantifizierung. t-Test mit Welch-Korrektur, p = 0,0064, n = 4. Abkürzung: TOP1 = Topoisomerase 1. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
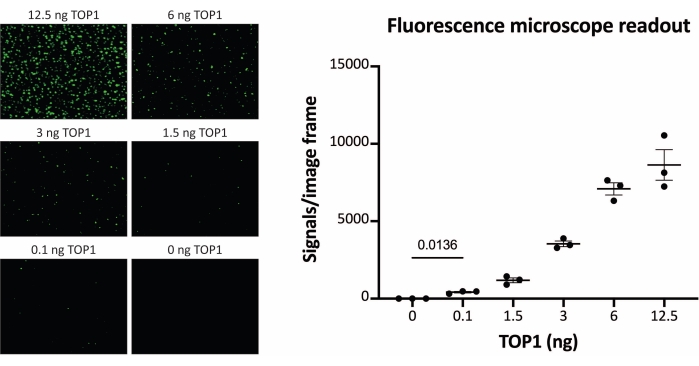
Abbildung 3: Messung der TOP1-Aktivität mit dem Fluoreszenzmikroskop. Das linke Feld zeigt repräsentative Bilder des Objektträgers bei der Analyse der Aktivität von 0,1-12,5 ng TOP1 unter Verwendung des Fluoreszenzmikroskop-Ausleseprotokolls. Beachten Sie, dass es sich bei den Bildern um zugeschnittene Versionen handelt, um die Punkte richtig darzustellen. Aus diesem Grund ähneln sie nicht der Anzahl der Signale in der Quantifizierung im rechten Feld. t-Test mit Welch-Korrektur, p = 0,0136, n = 3. Abkürzung: TOP1 = Topoisomerase 1. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
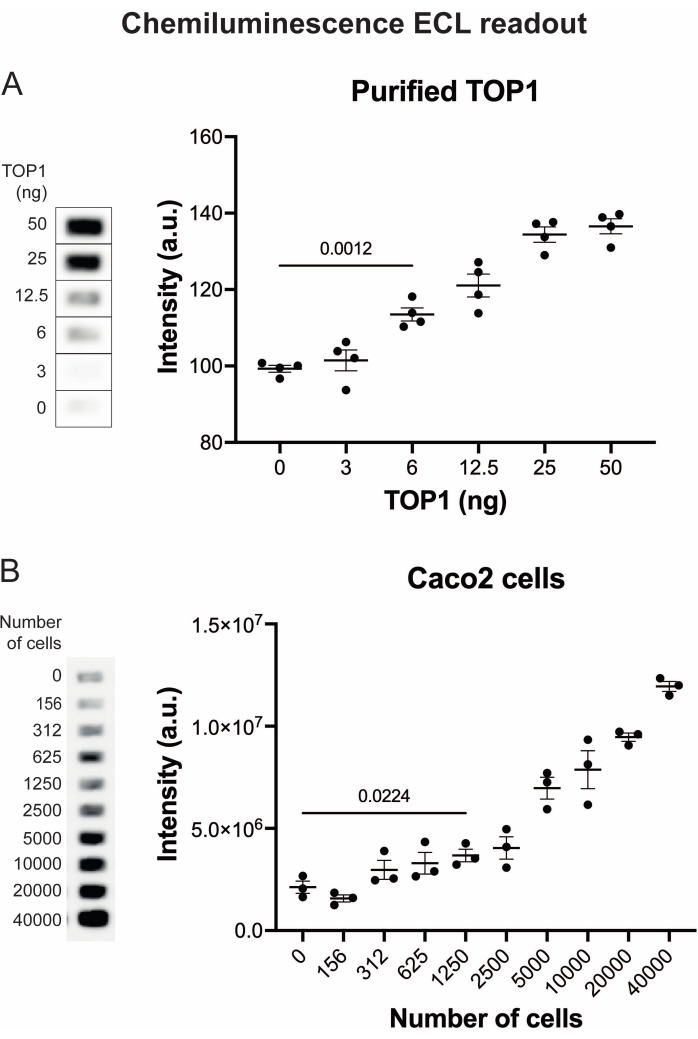
Abbildung 4: Messung der TOP1-Aktivität mit der Chemilumineszenzanzeige. (A) Das linke Feld zeigt ein repräsentatives Bild des Objektträgers bei der Analyse der Aktivität von 3-50 ng TOP1 unter Verwendung des Chemilumineszenz-Ausleseprotokolls. Das rechte Feld zeigt die resultierende Quantifizierung. t-Test mit Welchscher Korrektur, p < 0,0001, n = 4. (B) Das linke Feld zeigt ein repräsentatives Bild des Objektträgers bei der Analyse der Aktivität von TOP1, das aus 156-40.000 Caco2-Zellen extrahiert wurde, unter Verwendung des Chemilumineszenz-Ausleseprotokolls. Das rechte Feld zeigt die resultierende Quantifizierung. t-Test mit Welch-Korrektur, p = 0,0224, n = 3. Abkürzungen: TOP1 = Topoisomerase 1. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
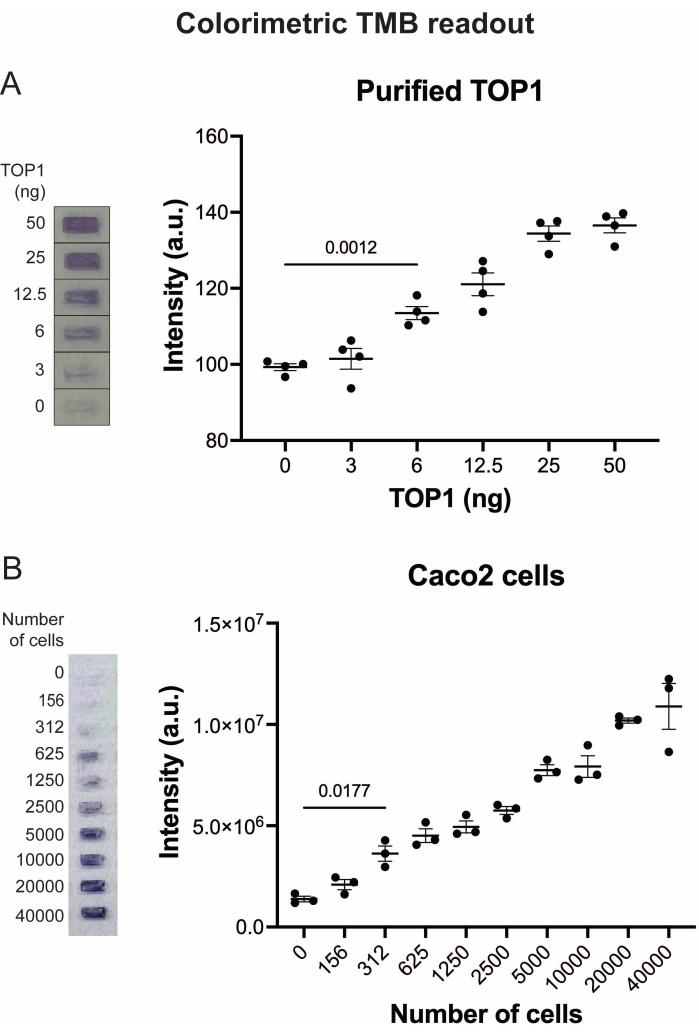
Abbildung 5: Messung der TOP1-Aktivität mit der kolorimetrischen Anzeige. (A) Das linke Feld zeigt ein repräsentatives Bild des Objektträgers bei der Analyse von 3-50 ng TOP1 mit dem kolorimetrischen Ausleseprotokoll. Das rechte Feld zeigt die resultierende Quantifizierung. t-Test mit Welch-Korrektur, p = 0,0012, n = 4. (B) Das linke Feld zeigt ein repräsentatives Bild des Objektträgers bei der Analyse der Aktivität von TOP1, das aus 156-40.000 Caco2-Zellen unter Verwendung des kolorimetrischen Ausleseprotokolls extrahiert wurde. Das rechte Feld zeigt die resultierende Quantifizierung. t-Test mit Welch-Korrektur, p = 0,0117, n = 3. Abkürzungen: TOP1 = Topoisomerase 1; TMB = 3,3',5,5'-Tetramethylbenzidin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
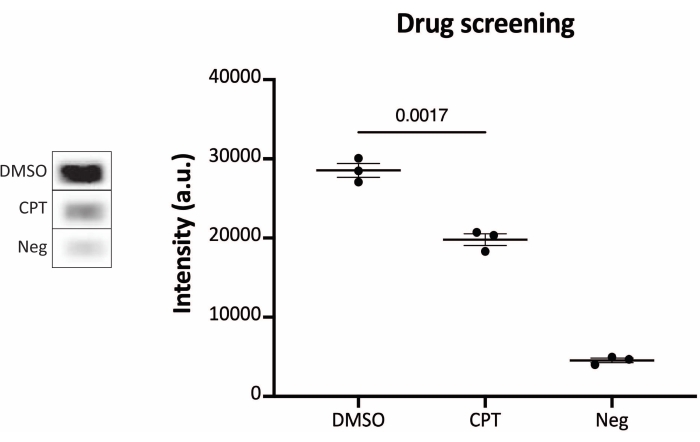
Abbildung 6: Messungen der TOP1-Aktivität nach medikamentöser Behandlung unter Verwendung der Chemilumineszenz-Ausleseprotokolle. Das linke Feld zeigt ein repräsentatives Bild des Objektträgers bei der Analyse von 10 ng TOP1 in Gegenwart von 5% DMSO oder 80 μM CPT für 1 Minute. Das rechte Feld zeigt die resultierende Quantifizierung. t-Test mit Welch-Korrektur, p = 0,0017, n = 3. Abkürzungen: TOP1 = Topoisomerase 1; CPT = Camptothecin; DMSO = Dimethylsulfoxid; Neg = Negativkontrolle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Topoisomerasen stellen eine Klasse von DNA-modifizierenden Enzymen dar, die hohes Forschungs- und klinisches Interesse wecken und das Ziel niedermolekularer Verbindungen mit potenzieller Wirkung bei der Krebsbehandlung oder bei der Bekämpfung von Infektionskrankheiten sind. Darüber hinaus hat sich die Aktivität von humanem TOP1 als wirksamer Biomarker für die Krebsprognose und -behandlung erwiesen18,19,23. Obwohl es die TOP1-Aktivität ist, die die Wirksamkeit eines chemotherapeutischen Inhibitors26 beeinflusst, ist es häufig die Menge der DNA-RNA oder die Menge an TOP1, die im klinischen Umfeld bewertet wird. Dies ist auf den Mangel an schnellen, einfachen und gelbasierten kostenlosen Tools zurückzuführen, die eine genaue und präzise Quantifizierung der Topoisomerase-Aktivität in jeder Laborumgebung ermöglichen können.
Hier wird ein Protokoll für den REEAD-Assay beschrieben, das die gelfreie Messung der TOP1-Aktivität ermöglicht. In diesem Protokoll wird gereinigtes TOP1 oder Rohextrakt aus Zellen mit einem speziell entwickelten DNA-Hantelsubstrat inkubiert, das bei Spaltung / Ligatur, die durch TOP1 vermittelt wird, in ein geschlossenes, kreisförmiges Molekül umgewandelt wird. Die Kreise werden dann auf einer Glasoberfläche hybridisiert und durch RCA verstärkt. Um die Durchführung von Reaktionen auf dem Objektträger zu erleichtern, ist ein Silikongitter am Glas befestigt, wodurch einzelne Vertiefungen entstehen, in denen die Reaktionen stattfinden. Auf diese Weise nutzt das Protokoll ein Multiwell-System - ein Silikongitter - namens Wellmaker.
Das Protokoll wurde verwendet, um die Aktivität von rekombinantem TOP1 und TOP1 nachzuweisen, die aus kolorektalen Adenokarzinomzellen Caco2 extrahiert wurden, als Beispiel verwendet. Darüber hinaus wurde das Protokoll als Beispiel für REEAD, das als Drogenscreening-Tool verwendet werden soll, verwendet, um die Hemmung der TOP1-Aktivität durch den bekannten TOP1-Inhibitor CPT24,25 nachzuweisen. Der Assay wurde mit verschiedenen Auslesemethoden gekoppelt - Fluoreszenzmikroskopie, die eine hohe Empfindlichkeit ergibt, und einem Fluoreszenzscanner, Chemilumineszenz oder kolorimetrisch, die weniger spezielle Ausrüstung und Training erfordern. Das hochempfindliche Auslesen des Fluoreszenzmikroskops hat die Grenzen der Notwendigkeit einer qualitativ hochwertigen Fluoreszenzmikroskopeinstellung, qualifiziertem Personal und zeitaufwändiger Bildaufnahme und -analyse.
Aus diesen Gründen wird der Fluoreszenzscanner angezeigt, der eine schnellere Erfassung und Analyse ermöglicht, auch wenn dies auf Kosten der Empfindlichkeit geht. Im Falle des Fehlens eines Fluoreszenzscanners können zwei ausgezeichnete Alternativen, Chemilumineszenz und kolorimetrische Auslesemethoden, in Betracht gezogen werden. Beide Methoden sind schnell und einfach und erfordern keine teure Ausrüstung oder spezielle Schulung. In allen Ausleseformaten hat REEAD viele Vorteile gegenüber den State-of-the-Art-Assays, die zeitaufwendiger, gelbasiert (mit den Anforderungen von Interkalationsmitteln) und weniger direkt quantitativ sind. Es gibt jedoch einige kritische Schritte in dem vorgestellten Protokoll. Bei der Durchführung des Wirkstoffscreenings sollten die Zeitpunkte, die Wirkstoffkonzentration und das Verhältnis von TOP1-Menge/DNA-Substrat im Vergleich zu den beschriebenen Einstellungen optimiert werden, die für CPT optimiert sind. Das Medikament kann untersucht werden, indem eine Präinkubation mit dem DNA-Substrat oder eine Vorinkubation mit dem TOP1-Enzym durchgeführt wird. Dies kann wertvolle Informationen über die Fähigkeit des Moleküls geben, TOP1 zu hemmen und Einblicke in den Wirkmechanismus des Arzneimittels zu geben.
Darüber hinaus ist dies bei niedrigen oder fehlenden Signalen höchstwahrscheinlich auf eine ineffiziente Lyse der Rohprobe oder einen Abbau von TOP1 im Extrakt aufgrund unsachgemäßer Verwendung von Proteaseinhibitoren zurückzuführen. Darüber hinaus kann dies auch auf eine unzureichende Lagerung der wichtigen Assay-Komponenten wie rekombinantes TOP1, phi29-Polymerase, Nukleotide, Substrat und Primer zurückzuführen sein. Schließlich sollten wiederholte Gefrier-Tau-Zyklen der Oligonukleotide vermieden werden, da dies die Assay-Leistung dramatisch beeinträchtigt. Wenn Rohextrakt verwendet wird, muss die Extraktionseffizienz der spezifischen biologischen Probe optimiert werden, und die Menge und Aktivität von TOP1 kann von dem hier berichteten Beispiel abweichen. Aus diesem Grund erfordert jeder zu testende Rohextrakt eine Titration zur Identifizierung der Assay-Nachweisgrenze und des Empfindlichkeitsbereichs bei Verwendung dieser bestimmten Probe. Das Protokoll wurde für den Nachweis von humanem TOP1 optimiert. Die Aktivität anderer eukaryotischer TOP1 kann gemessen werden, aber die NaCl-Konzentration und Inkubationszeit muss möglicherweise entsprechend der Enzymreinigungsmethode und der optimalen Enzymaktivität optimiert werden. Mehr zirkularisierte Substrate resultieren aus längerer Inkubation, während weniger zirkularisierte Substrate aus verkürzter Inkubation resultieren.
Zusätzlich zu den vorgestellten Anwendungen ermöglicht REEAD die Messung der TOP1-Aktivität in Rohextrakten aus kleinen Biopsien von Krebspatienten18, die Vorhersage der zytotoxischen Antikrebswirkung von CPT in Krebszelllinien 20,21,22 und sogar den Nachweis der Enzymaktivität in einzelnen Zellen 20,21 . Darüber hinaus ermöglicht die vorgestellte REEAD-Einstellung mit dem Wellmaker ein Multiwell-basiertes Wirkstoffscreening von Bibliotheken synthetischer oder natürlicher Verbindungen. Darüber hinaus wurde eine modifizierte Version des REEAD-Assays namens REEAD C/L entwickelt. Dieser Aufbau ermöglicht getrennte Untersuchungen der Spaltungs- und Ligationsschritte der TOP1-Reaktion27. Mit dem REEAD C/L ist es möglich, den Wirkmechanismus von niedermolekularen Inhibitoren zu bestimmen und sie als TOP1-katalytische Inhibitoren mit potentieller antiparasitärer Wirkung28 oder als TOP1-Gifte zur Krebsbehandlung 24,25 zu charakterisieren. Schließlich wurde REEAD mit einer spezifischen Neugestaltung der DNA-Substrate, um den unterschiedlichen Anforderungen (für DNA-Bindung oder Spaltungsligatur) anderer TOP1-Enzyme gerecht zu werden, auch für den Nachweis von Infektionskrankheiten (wie im Fall von Plasmodium falciparum, das Malaria verursacht29) oder Leishmania donovani und Monkeypox virus (Daten nicht gezeigt) verwendet. Oder es kann verwendet werden, um niedermolekulare Verbindungen mit antipathogener Wirkung zu identifizieren. Das vorgestellte Protokoll bietet Wissenschaftlern im TOP1-Bereich eine einfache Methode, um Enzymaktivität mit wenig bis gar keiner Optimierung zu erkennen und mit der Möglichkeit, in Zukunft an noch breitere Anwendungen angepasst zu werden.
Offenlegungen
Die Autoren C.T. und K.M. sind Mitarbeiter von VPCIR biosciences ApS. C.T., B.R.K. und M.S. sind Aktionäre und/oder Inhaber von Aktienoptionen. C.T., B.R.K. und M.S. erklären, dass sie Erfinder des Patents EP2022/057172 sind, das im Namen von VPCIR biosciences ApS eingereicht wurde. Die anderen Autoren erklären, dass sie keine Interessenkonflikte im Zusammenhang mit diesem Artikel haben.
Danksagungen
Die Autoren danken der Labortechnikerin Noriko Y. Hansen, Department of Molecular Biology and Genetics, Aarhus University, für die technische Unterstützung in Bezug auf Phi29- und TOP1-Enzymreinigungen.
Materialien
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Camera for fluorescence image analysis | |||
| CCD camera | For chemiluninescence image analysis | ||
| Fluorescence microscope | Olympus | Equipped with 60x oil immersion objective and a GFP filter ( https://www.edmundoptics.com/p/gfp-filter-cube-set-olympus/21527/) | |
| Fluorescence scanner | Typhoon | FLA 9500 | Equipped with 473 laser and FAM filter |
| Humidity chamber with dH2O | |||
| Hybridization chamber with saturated NaCl | |||
| ImageJ software | Fiji | Download at: https://imagej.net/software/fiji/downloads | |
| Materials | |||
| Cell culture | |||
| Cell growth medium appropiate for the chosen cell line | |||
| Trypsin | Sigma | #T4174 | |
| Pen strep | Sigma | #P4300 | |
| Tissue culture flasks | ThermoFisher | #178983 | |
| FBS | Gibco | #10270106 | |
| NEEA | Sigma | #M7145 | |
| PBS | ThermoFisher | #10010023 | |
| Functionalized slides | |||
| 5'-amine anti-TOP1 primer | Sigma | 5’-/5AmMC6/CCA ACC AAC CAA CCA AAT AAG-3’ | |
| Activated Codelink HD slides | SurModics | #DHD1-0023 | |
| Silicon grid | Grace-biolabs | Custom made | |
| Pertex glue | Histolabs | #00801 | |
| Microscope slide 76 x 26 mm | Hounisen | #2510 1201BL | Other microscope slide of same dimension can be used |
| DNA circles and rolling circle amplification | |||
| TOP1 specific substrate | Sigma | 5’-AGA AAA ATT TTT AAA AAA ACT GTG AAG ATC GCT TAT TTT TTT AAA AAT AAA TCT AAG TCT TTT AGA TCC CTC AAT GCA CAT GTT TGG CTC CGA TCT AAA AGA CTT AGA-3’ | |
| ATTO-488-dUTP | Jena Biosciences | #95387 | |
| Biotin-dCTP | Jena Biosciences | #NU-809-BIO16L | |
| dNTP | ThermoFisher | #R0181 | |
| Phi29 polymerase | VPCIR Biosciences | #10010041 | |
| Recombinant TOP1 | VPCIR Biosciences | #10010001 | |
| Detection of rolling circle products | |||
| BioFX TMB | SurModics | #ESPM-0100-01 | |
| Cover glass | |||
| ECL mixture | Cytiva | #RPN2236 | |
| HRP conjugated anti-biotin antibody | Merck | #A4541 | |
| Mounting medium (vectachield) | Vector laboratories | #H-1000 | |
| Buffer list | |||
| 1x PE Buffer | 1 mM EDTA, 8.12 mM Na2HPO4·2H2O, 1.88 mM NaH2PO4·H2O | ||
| 6x Print Buffer | 300 mM Na3PO4, pH 8.5 | ||
| Blocking solution | Buffer 5 supplemented with 5% non-fat milk and 5% BSA pH 9 | ||
| Lysis Buffer | 10 mM Tris-HCl pH 7.5, 1 mM EDTA + protease inhibitors | ||
| 10x TOP1 Reaction Buffer | 50 mM CaCl2, 50 mM MgCl2, 100 mM Tris-HCl pH 7.5 | ||
| 10x Phi29 Reaction Buffer | 330 mM Tris-acetate pH 7.5, 100 mM Mg-acetate, 660 mM K-acetate, 1% Tween20, 200 mM DTT | ||
| Buffer 1 | 50 mM Tris, 50 mM Tris-HCl, 32 mM ethanolamine. NB: stored at 50 °C. | ||
| Buffer 2 | 4x SSC, 0.1% SDS. NB: stored at 50 °C. | ||
| Buffer 3 | 100 mM Tris-HCl pH 7.5, 150 mM NaCl, 0.3% SDS | ||
| Buffer 4 | 100 mM Tris-HCl pH 7.5, 150 mM NaCl, 0.05% Tween20 | ||
| Buffer 5 | 20 mM Tris-HCl pH 7.5, 150 mM NaCl, 0.05% Tween20 | ||
| Chemicals for buffers | |||
| Tris | Sigma | #T1506 | |
| HCl | Sigma | #1.00317.2011 | |
| EDTA | Sigma | #1.08418.1000 | |
| PMSF | Sigma | #05056489001 | |
| SDS | Applichem | #436143 | |
| Na2HPO4 | Sigma | #1.06580.1000 | |
| NaH2PO4 | Sigma | #1.06346.1000 | |
| Ethanolamine | Sigma | #411000 | |
| SSC | Invitrogen | #15557-036 | |
| Tris-acetate | Sigma | #T1258 | |
| Mg-acetate | Sigma | #M0631 | |
| K-acetate | Sigma | #1.04820.1000 | |
| Tween20 | Sigma | #8.22184.0500 | |
| DTT | Sigma | #D0632 | |
| CaCl2 | Sigma | #1.02382.1000 | |
| MgCl2 | Sigma | #M2670 | |
| NaCl | Sigma | #1.06404.5000 | |
| Skimmed milk powder | Sigma | #70166 | |
| BSA | Sigma | #A4503 |
Referenzen
- Baldwin, E. L., Osheroff, N. Etoposide, topoisomerase II and cancer. Current Medicinal Chemistry-Anti-Cancer Agents. 5 (4), 363-372 (2005).
- Gilbert, D. C., Chalmers, A. J., El-Khamisy, S. F. Topoisomerase I inhibition in colorectal cancer: Biomarkers and therapeutic targets. British Journal of Cancer. 106 (1), 18-24 (2012).
- Ikeguchi, M., et al. TopoisomeraseI expression in tumors as a biological marker for CPT-11 chemosensitivity in patients with colorectal cancer. Surgery Today. 41 (9), 1196-1199 (2011).
- Meisenberg, C., et al. Clinical and cellular roles for TDP1 and TOP1 in modulating colorectal cancer response to irinotecan. Molecular Cancer Therapeutics. 14 (2), 575-585 (2015).
- Palshof, J. A., et al. Topoisomerase I copy number alterations as biomarker for irinotecan efficacy in metastatic colorectal cancer. BMC Cancer. 17 (1), 1-10 (2017).
- Proszek, J., et al. Topoisomerase I as a biomarker: Detection of activity at the single molecule level. Sensors. 14 (1), 1195-1207 (2014).
- Leppard, J. B., Champoux, J. J. Human DNA topoisomerase I: Relaxation, roles, and damage control. Chromosoma. 114 (2), 75-85 (2005).
- Champoux, J. J. DNA topoisomerases: structure, function, and mechanism. Annual Review of Biochemistry. 70 (1), 369-413 (2001).
- Redinbo, M. R., et al. Crystal structures of human topoisomerase I in covalent and noncovalent complexes with DNA. Science. 279 (5356), 1504-1513 (1998).
- Nitiss, J. L., Soans, E., Rogojina, A., Seth, A., Mishina, M. Topoisomerase assays. Current Protocols in Pharmacology. 57 (1), 3(2012).
- Tesauro, C., et al. Erybraedin C, a natural compound from the plant Bituminaria bituminosa, inhibits both the cleavage and religation activities of human topoisomerase I. Biochemical Journal. 425 (3), 531-539 (2010).
- Keller, J. G., et al. Topoisomerase 1 inhibits MYC promoter activity by inducing G-quadruplex formation. Nucleic Acids Research. 50 (11), 6332-6342 (2022).
- Christiansen, K., Westergaard, O. Characterization of intra- and intermolecular DNA ligation mediated by eukaryotic topoisomerase I. Role of bipartite DNA interaction in the ligation process. Journal of Biological Chemistry. 269 (1), 721-729 (1994).
- Svejstrup, J. Q., Christiansen, K., Andersen, A. H., Lund, K., Westergaard, O. Minimal DNA duplex requirements for topoisomerase I-mediated cleavage in vitro. Journal of Biological Chemistry. 265 (1), 12529-12535 (1990).
- Anand, J., Sun, Y., Zhao, Y., Nitiss, K. C., Nitiss, J. L. Detection of topoisomerase covalent complexes in eukaryotic cells. Methods in Molecular Biology. , Clifton, NJ. 283-299 (2018).
- Stougaard, M., et al. Single-molecule detection of human topoisomerase I cleavage-ligation activity. ACS Nano. 3 (1), 223-233 (2009).
- Keller, J. G., Petersen, K. V., Knudsen, B. R., Tesauro, C. Simple and fast DNA-based tool to investigate topoisomerase 1 activity, a biomarker for drug susceptibility in colorectal cancer. Recent Underst. Colorectal Cancer Treatment. , (2022).
- Jakobsen, A. K., et al. Correlation between topoisomerase I and tyrosyl-DNA phosphodiesterase 1 activities in non-small cell lung cancer tissue. Experimental and Molecular Pathology. 99 (1), 56-64 (2015).
- Jakobsen, A. K., et al. TDP1 and TOP1 as targets in anticancer treatment of NSCLC: Activity and protein level in normal and tumor tissue from 150 NSCLC patients correlated to clinical data. Lung Cancer. 164, 23-32 (2022).
- Keller, J. G., et al. On-slide detection of enzymatic activities in selected single cells. Nanoscale. 9 (36), 13546-13553 (2017).
- Keller, J. G., Stougaard, M., Knudsen, B. R. Enzymatic activity in single cells. Trends in Biotechnology. 29 (5), 222-230 (2019).
- Tesauro, C., et al. Different camptothecin sensitivities in subpopulations of colon cancer cells correlate with expression of different phospho-isoforms of topoisomerase i with different activities. Cancers. 12 (5), 1240(2020).
- Tesauro, C., et al. Topoisomerase i activity and sensitivity to camptothecin in breast cancer-derived cells: A comparative study. BMC Cancer. 19 (1), 1-15 (2019).
- Pommier, Y. DNA topoisomerase I Inhibitors: Chemistry, biology, and interfacial inhibition. Chemical Reviews. 109 (7), 2894-2902 (2009).
- Pommier, Y. Drugging topoisomerases: lessons and challenges. ACS Chemical Biology. 8 (1), 82-95 (2013).
- Bailly, C. Irinotecan: 25 years of cancer treatment. Pharmacological Research. 148, 104398(2019).
- Petersen, K. V., et al. Simple and fast dna based sensor system for screening of small-molecule compounds targeting eukaryotic topoisomerase 1. Pharmaceutics. 13 (8), 1255(2021).
- García-Estrada, C., Prada, C. F., Fernández-Rubio, C., Rojo-Vázquez, F., Balaña-Fouce, R. DNA topoisomerases in apicomplexan parasites: promising targets for drug discovery. Proceedings of the Royal Society B: Biological Sciences. 277 (1689), 1777-1787 (2010).
- Hede, M. S., et al. Detection of the malaria causing Plasmodium parasite in saliva from infected patients using topoisomerase I activity as a biomarker. Scientific Reports. 8 (1), 1-12 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten