9.13 : Energie di legame e lunghezze di legame
Esistono molecole stabili perché i legami covalenti tengono insieme gli atomi. La forza di un legame covalente è misurata dall'energia necessaria per romperlo, cioè l'energia necessaria per separare gli atomi legati. Separare ogni coppia di atomi legati richiede energia: più forte è un legame, maggiore è l'energia necessaria per romperlo.
L'energia necessaria per rompere uno specifico legame covalente in una talpa di molecole gassose è chiamata energia di legame o energia di dissociazione del legame. L'energia di legame per una molecola biatomica, DX-Y, è definita come il cambiamento di entalpia standard per la reazione endotermica:
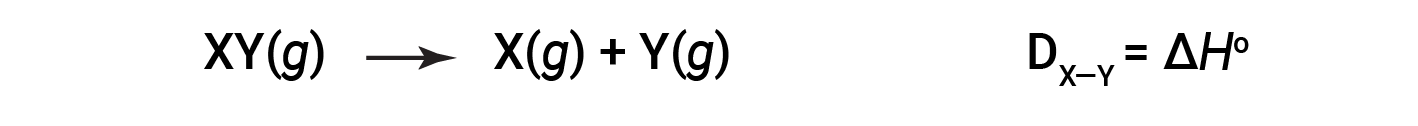
Ad esempio, l'energia di legame del legame puro covalente H-H, DH-H, è di 436 kJ/mol di legami H-H spezzati:

Le molecole con tre o più atomi hanno due o più legami. La somma di tutte le energie di legame in una tale molecola è uguale al cambiamento di entalpia standard per la reazione endotermica che rompe tutti i legami nella molecola. Per esempio, la somma delle quattro energie di legame C-H in CH4, 1660 kJ, è uguale al cambiamento di entalpia standard della reazione:
L'energia media del legame C-H, DC-H, è 1660/4 = 415 kJ/mol perché ci sono quattro talpe di legami C-H rotte per talpa della reazione. Sebbene i quattro legami C-H siano equivalenti nella molecola originale, non richiedono ciascuno la stessa energia per rompersi; una volta rotto il primo legame (che richiede 439 kJ/mol), i legami rimanenti sono più facili da rompere. Il valore di 415 kJ/mol è la media, non il valore esatto richiesto per rompere un'obbligazione.
La forza di un legame tra due atomi aumenta con l'aumentare del numero di coppie di elettroni nel legame. Generalmente, con l'aumentare della forza del legame, la lunghezza del legame diminuisce. Quindi, i legami tripli sono più forti e più corti dei doppi legami tra gli stessi due atomi; allo stesso modo, i doppi legami sono più forti e più corti dei singoli legami tra gli stessi due atomi. Quando un atomo si lega a vari atomi in un gruppo, la forza del legame in genere diminuisce man mano che ci spostiamo verso il basso nel gruppo. Ad esempio, C–F è 439 kJ/mol, C-Cl è 330 kJ/mol, e C–Br è 275 kJ/mol.
Le energie di legame possono essere usate per calcolare i cambiamenti approssimativi di entalpia per le reazioni, chiamate anche entalpie di Bond, dove gli entalpie di formazione non sono disponibili. Calcoli di questo tipo diranno anche se una reazione è esotermica o endotermica. Una reazione esotermica (ΔH negativo, calore prodotto) si verifica quando i legami nei prodotti sono più forti dei legami nei reagenti. Una reazione endotermica (ΔH positiva, calore assorbito) si verifica quando i legami nei prodotti sono più deboli di quelli dei reagenti.
Il cambiamento di entalpia, ΔH, per una reazione chimica è approssimativamente uguale alla somma dell'energia necessaria per rompere tutti i legami nei reagenti (energia "in", segno positivo) più l'energia rilasciata quando tutti i legami si formano nei prodotti (energia "out", segno negativo). Questo può essere espresso matematicamente nel seguente modo:

In questa espressione, il simbolo Æ© significa "la somma di" e D rappresenta l'energia di legame in kJ/mol, che è sempre un numero positivo. L'energia di legame dipenderà dal fatto che il particolare legame sia un legame singolo, doppio o triplo. Pertanto, nel calcolare gli entalpie in questo modo, è importante considerare l'incollaggio in tutti i reagenti e prodotti. Poiché i valori D sono tipicamente medie per un tipo di legame in molte molecole diverse, questo calcolo fornisce una stima approssimativa, non un valore esatto, per l'entalpia di reazione.
Si consideri la seguente reazione:
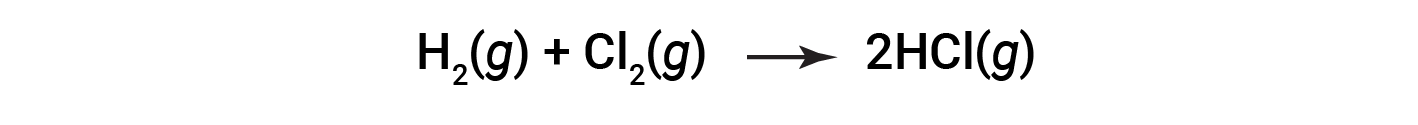
O
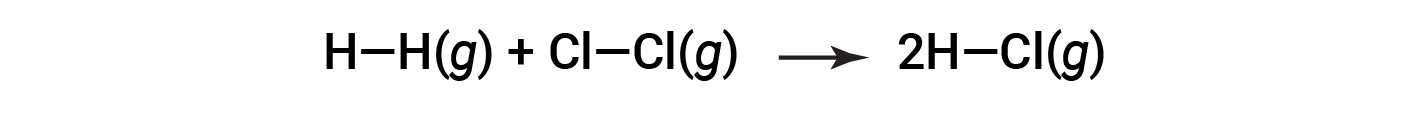
Per formare due talpe di HCl, una talpa di legami H-H e una talpa di legami cl-cl devono essere rotte. L'energia necessaria per rompere questi legami è la somma dell'energia di legame del legame H-H (436 kJ/mol) e del legame Cl-Cl (243 kJ/mol). Durante la reazione, si formano due talpe di legami H-Cl (energia di legame = 432 kJ/mol), rilasciando 2 × 432 kJ; o 864 kJ. Poiché i legami nei prodotti sono più forti di quelli dei reagenti, la reazione rilascia più energia di quella che consuma:

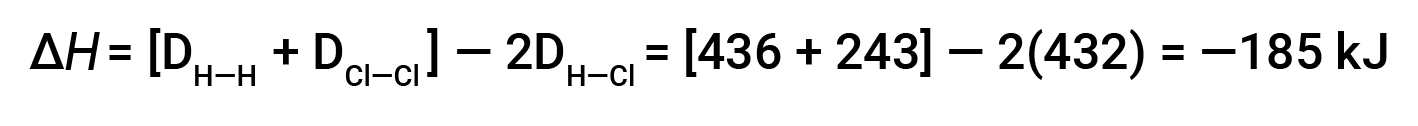
Questa energia in eccesso viene rilasciata come calore, quindi la reazione è esotermica.
Questo testo è adattato da Openstax, Chemistry 2e, Section 7.5: Bond Strength: Covalent Bonds.
Tags
Dal capitolo 9:

Now Playing
9.13 : Energie di legame e lunghezze di legame
Legame chimico: concetti di base
24.9K Visualizzazioni

9.1 : Tipi di legami chimici
Legame chimico: concetti di base
75.3K Visualizzazioni

9.2 : Simboli di Lewis e regola dell'ottetto
Legame chimico: concetti di base
62.6K Visualizzazioni

9.3 : Legame ionico e trasferimento di elettroni
Legame chimico: concetti di base
41.2K Visualizzazioni

9.4 : Il ciclo Born-Haber
Legame chimico: concetti di base
21.6K Visualizzazioni

9.5 : Tendenze nell'energia dei reticoli: dimensione e carica degli ioni
Legame chimico: concetti di base
23.7K Visualizzazioni

9.6 : Legame covalente e strutture di Lewis
Legame chimico: concetti di base
48.7K Visualizzazioni

9.7 : Elettronegatività
Legame chimico: concetti di base
67.0K Visualizzazioni

9.8 : Polarità di legame, momento di dipolo e carattere ionico percentuale
Legame chimico: concetti di base
28.5K Visualizzazioni

9.9 : Strutture di Lewis di composti molecolari e ioni poliatomici
Legame chimico: concetti di base
34.4K Visualizzazioni

9.10 : Risonanza
Legame chimico: concetti di base
53.1K Visualizzazioni

9.11 : Cariche formali
Legame chimico: concetti di base
32.2K Visualizzazioni

9.12 : Eccezioni alla regola dell'ottetto
Legame chimico: concetti di base
27.5K Visualizzazioni

9.14 : Legami nei metalli
Legame chimico: concetti di base
46.8K Visualizzazioni