12.6 : Proprietà fisiche che influenzano la solubilità
Soluzioni di gas nei liquidi
Come per qualsiasi soluzione, la solubilità di un gas in un liquido è influenzata dalle forze intermolecolari attraenti tra le specie di soluto e solvente. A differenza dei soluti solidi e liquidi, tuttavia, non vi è alcuna attrazione intermolecolare soluto-soluto da superare quando un soluto gassoso si dissolve in un solvente liquido poiché gli atomi o le molecole che compongono un gas sono molto separati e sperimentano interazioni trascurabili. Di conseguenza, le interazioni soluto-solvente sono l'unico fattore energetico che influisce sulla solubilità. Ad esempio, la solubilità in acqua dell'ossigeno è circa tre volte superiore a quella dell'elio (ci sono maggiori forze di dispersione tra l'acqua e le molecole di ossigeno più grandi) ma 100 volte inferiore alla solubilità del clorometano, CHCl3 (le molecole di clorometano polare sperimentano l'attrazione del dipolo-dipolo per le molecole di acqua polare). Allo stesso modo, si noti che la solubilità dell'ossigeno nell'esano, C6H14, è circa 20 volte maggiore di quanto non sia in acqua perché esistono maggiori forze di dispersione tra l'ossigeno e le molecole di esano più grandi.
La temperatura è un altro fattore che influisce sulla solubilità, con la solubilità del gas che in genere diminuisce con l'aumentare della temperatura. Questa relazione inversa tra temperatura e concentrazione di gas disciolto è responsabile di uno dei principali impatti dell'inquinamento termico nelle acque naturali.
La solubilità di un soluto gassoso è influenzata anche dalla pressione parziale del soluto nel gas a cui è esposta la soluzione. La solubilità del gas aumenta con l'aumentare della pressione del gas.
Per molti soluti gassosi, la relazione tra solubilità,gas Se pressione parziale,gas P, è proporzionale:
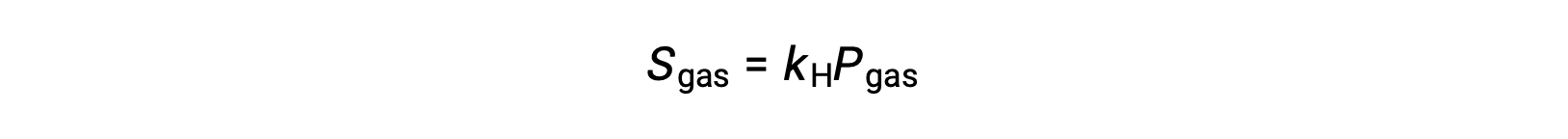
dove kH è una costante di proporzionalità che dipende dalle identità del soluto gassoso e del solvente e dalla temperatura della soluzione. Questa è una dichiarazione matematica della legge di Henry: La quantità di un gas ideale che si dissolve in un volume definito di liquido è direttamente proporzionale alla pressione del gas.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 11.3: Solubilità.
Dal capitolo 12:

Now Playing
12.6 : Proprietà fisiche che influenzano la solubilità
Soluzioni e colloidi
22.4K Visualizzazioni

12.1 : Formazione della soluzione
Soluzioni e colloidi
31.2K Visualizzazioni

12.2 : Forze intermolecolari nelle soluzioni
Soluzioni e colloidi
32.9K Visualizzazioni

12.3 : Entalpia della soluzione
Soluzioni e colloidi
24.6K Visualizzazioni

12.4 : Soluzioni acquose e calore di idratazione
Soluzioni e colloidi
14.3K Visualizzazioni

12.5 : Soluzione equilibrio e saturazione
Soluzioni e colloidi
18.4K Visualizzazioni

12.7 : Esprimere la concentrazione della soluzione
Soluzioni e colloidi
58.2K Visualizzazioni

12.8 : Abbassamento della pressione del vapore
Soluzioni e colloidi
25.9K Visualizzazioni

12.9 : Soluzioni ideali
Soluzioni e colloidi
19.0K Visualizzazioni

12.10 : Depressione del punto di congelamento e elevazione del punto di ebollizione
Soluzioni e colloidi
34.1K Visualizzazioni

12.11 : Osmosi e pressione osmotica delle soluzioni
Soluzioni e colloidi
38.9K Visualizzazioni

12.12 : Elettroliti: fattore di van't Hoff
Soluzioni e colloidi
32.7K Visualizzazioni

12.13 : Colloidi
Soluzioni e colloidi
17.3K Visualizzazioni