19.1 : Radioattività ed equazioni nucleari
La chimica nucleare è lo studio delle reazioni che comportano cambiamenti nella struttura nucleare. Il nucleo di un atomo è composto da protoni e, ad eccezione dell'idrogeno, neutroni. Il numero di protoni nel nucleo è chiamato numero atomico (Z) dell'elemento, e la somma del numero di protoni e del numero di neutroni è il numero di massa (A). Gli atomi con lo stesso numero atomico ma numeri di massa diversi sono isotopi dello stesso elemento.
Un nuclide di un elemento ha un numero specifico di protoni e neutroni ed è in uno specifico stato di energia nucleare. La notazione per un nuclide è 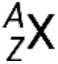 , dove X è il simbolo dell'elemento, A è il numero di massa, e Z è il numero atomico. Ci sono anche diverse notazioni stenografiche per i nuclidi, molte delle quali omettono il numero atomico. Ad esempio,
, dove X è il simbolo dell'elemento, A è il numero di massa, e Z è il numero atomico. Ci sono anche diverse notazioni stenografiche per i nuclidi, molte delle quali omettono il numero atomico. Ad esempio, 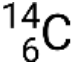 può essere scritto carbonio-14, C-14 o 14C.
può essere scritto carbonio-14, C-14 o 14C.
Se il nuclide si trova in uno stato eccitato temporaneo, questo è in genere indicato con un asterisco. Se si trova in uno stato eccitato più longevo, chiamato stato metastabile, questo è indicato aggiungendo 'm' al numero di massa. Ad esempio, l'isotopo tecnezio-99 esiste come stato-suolo 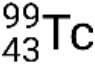 e metastabile
e metastabile 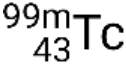 . Se c'è più di uno stato metastabile per un dato isotopo, sono numerati in ordine energetico crescente. Ad esempio, l'isotopo tantalio-180 ha cinque nuclidi: stati del suolo
. Se c'è più di uno stato metastabile per un dato isotopo, sono numerati in ordine energetico crescente. Ad esempio, l'isotopo tantalio-180 ha cinque nuclidi: stati del suolo 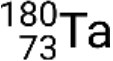 e stati metastabili
e stati metastabili  , , e
, , e 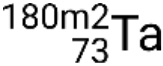
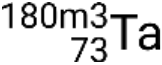
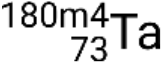 .
.
Le reazioni nucleari sono le trasformazioni di uno o più nuclidi in un altro, che avvengono attraverso cambiamenti nei numeri atomici, nei numeri di massa o negli stati di energia nucleare dei nuclei. Per descrivere una reazione nucleare, usiamo un'equazione che identifica i nuclidi e le particelle coinvolte nella reazione. Come per le reazioni chimiche, le reazioni nucleari obbediscono alla conservazione della massa: la somma dei numeri di massa dei reagenti è uguale alla somma dei numeri di massa dei prodotti.
Molte particelle o fotoni diversi possono essere coinvolti nelle reazioni nucleari. Le più comuni sono le particelle alfa (α o ), che sono nuclei di 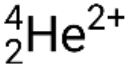 elio-4 ad alta energia; particelle beta (β), che includono elettroni (e− o β−) e positroni (e+ o β+); raggi gamma (γ); neutroni (
elio-4 ad alta energia; particelle beta (β), che includono elettroni (e− o β−) e positroni (e+ o β+); raggi gamma (γ); neutroni ( 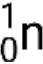 ); e protoni (p+ o
); e protoni (p+ o 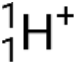 ).
).
Alcuni nuclidi rimangono intatti indefinitamente, o sono stabili, mentre altri si trasformano spontaneamente in altri nuclidi, o sono instabili. Il cambiamento spontaneo di un nuclide instabile in un altro è il decadimento radioattivo. Il nuclide instabile è chiamato nuclide genitore, e il nuclide che deriva dal decadimento è noto come nuclide figlia. Il nuclide figlia può essere stabile, o può decadere da solo.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 21.1: Struttura nucleare e Stabilità e Openstax, Chimica 2e, Sezione 21.2: Equazioni nucleari.
Fonti aggiuntive
Iupac. Compendium of Chemical Terminology, 2a ed. (il "Libro d'oro"). Compilato da A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versione online (2019-) creata da S. J. Chalk. https://doi.org/10.1351/goldbook. Accesso 2021-01-10
Agenzia internazionale per l'energia atomica, sezione dati nucleari. Grafico in diretta dei Nuclidi. https://www-nds.iaea.org/relnsd/vcharthtml/VChartHTML.html. Accesso 2021-01-10
