È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Generazione di influenza da virus ricombinante del DNA plasmidi
In questo articolo
Riepilogo
Salvataggio di virus dell'influenza A dal DNA plasmide è una tecnica di base ed essenziale sperimentale che consente ai ricercatori di generare virus influenzali ricombinanti per studiare i molteplici aspetti della biologia del virus dell'influenza, e da utilizzare come potenziali vettori o vaccini.
Abstract
Gli sforzi da una serie di gruppi di ricerca sono stati influenzali fondamentale per lo sviluppo e il miglioramento della genetica del virus dell'influenza A inversa. Originariamente fondata nel 1999
Protocollo
1. Virus influenzale trasfezione di soccorso
Influenza A virus appartiene alla famiglia delle Orthomyxoviridae negativo-stranded RNA virus avvolto. Il genoma del virus influenzale A si compone di otto geni diversi RNA di polarità negativa che codificano, almeno, 11 proteine virali (Figura 1) 4. Ci concentreremo, in questa relazione, il salvataggio di uno dei ceppo di laboratorio più comuni, l'influenza A/PR/8/34, 5 usando plasmidi ambisense (PDZ) contenente l'influenza 8 A/PR/8/34 segmenti virali ( Figura 2).
Per il salvataggio dei virus influenzali ricombinante da DNA plasmidico, si consiglia 3 trasfezioni indipendenti per ogni virus ricombinante. Se più di un salvataggio virus ricombinante è tentato, scala le seguenti operazioni accordantly al numero di virus di essere salvati. La transfezione seguente e protocollo infezione è stabilita per 6-ben-piastre. Una rappresentazione schematica del protocollo è illustrato in Figura 3.
- OptiMEM-Lipofectamine 2000 (LPF2000) miscela: Preparare 250 microlitri di media OptiMEM e 6-8 ml di LPF2000 per trasfezione. Incubare per 5-10 minuti a temperatura ambiente (RT). Nel frattempo, preparare la miscela plasmide trasfezione.
- Miscela di trasfezione plasmide: Preparare il cocktail di plasmide transfezione in 50 ml di mezzi OptiMEM. Usiamo solitamente 1 mg di ogni influenza del DNA plasmidico al salvataggio. Aggiungere 1 ml di i plasmidi PDZ (a 1 mg / mL) PB2, PB1, PA, HA, NP, NA, M, e NS in una provetta contenente 50 ml di mezzi OptiMEM.
- OptiMEM-LPF2000-DNA miscela plasmide: Aggiungere 250 microlitri dal passo 1,1 nella miscela di trasfezione di DNA influenza plasmide (punto 1.2). Incubare la miscela per 20-30 minuti a temperatura ambiente. Nel frattempo, preparare sospensioni di cellule 293T e MDCK per la trasfezione.
- Preparazione di 293T/MDCK co-coltura: Prima di iniziare, portare l'1X PBS, DMEM 10% FBS 1% PS media e EDTA-tripsina miscela a 37 ° C. La densità delle cellule dovrebbe essere di 80-90% di confluenza del giorno di trasfezione. Di solito, una confluenti piatto 100 mm di 293T e un piatto confluenti 100 mm di cellule MDCK può essere utilizzato per 10-12 salvataggi. Abbiamo intenzione di utilizzare 250 microlitri di cellule per pozzetto. Entrambe le linee cellulari saranno risospese in un totale di 3 ml di DMEM 10% FBS 1% PS.
- Con attenzione risospendere ogni linea cellulare in 10 ml di DMEM 10% FBS 1% PS in una provetta da centrifuga da 15 ml. Avrete un tubo per le cellule 293T e un tubo per le cellule MDCK.
- Risospendere le cellule 293T in 3 ml di DMEM 10% FBS 1% PS e quando risospeso, fornire i 3 ml per le cellule MDCK per sospendere di nuovo le cellule. Questo vi darà la miscela di cellule 293T e MDCK da utilizzare per il vostro co-coltura.
- Aggiungere 250 microlitri di cellule 293T/MDCK per pozzetto (10-12 a 6 e pozzi).
- Dopo l'incubazione 20-30 minuti RT (passo 1.3), aggiungere 1 ml di DMEM 10% FBS 1% PS al OptiMEM-LPF2000-influenzali miscela DNA plasmidico.
- Aggiungere il 1,3 ml (passo 1,5) nei pozzetti con il 250 microlitri di cellule 293T/MDCK (passo 1,4).
- Agitare delicatamente il 6-ben piatto e lasciare che la trasfezione incubare overnight (ON) in incubatrice a 37 ° C e 5% di CO 2.
- Il giorno dopo, a circa 16-24 ore dopo la trasfezione, cambiare il supporto di trasfezione e incubare le cellule transfettate in BA DMEM 0,3% 1% PS contenente 1 mg / ml di TPCK-tripsina per 48 ore.
- Dopo 48 ore di cambiare i media, trasferire il surnatante dalle cellule transfettate in una provetta.
- Centrifugare il surnatante coltura di tessuti in una microcentrifuga per 1-2 minuti, 13.000 giri al minuto.
- Infettare nuove cellule MDCK in 6 pozzetti (placcato il giorno prima) o 10 giorni di età uova embrionate di pollo con 200 ml di surnatanti centrifugati coltura dei tessuti dal punto 1.10. Incubare le cellule e / o uova a 37 ° C per 2-3 giorni.
- L'infezione di uova embrionate di 10 giorni di età pollo: Tutte le procedure per infettare le uova embrionate di pollo vengono eseguite in condizioni sterili.
- Candela di 10 giorni di età le uova con un light-box speratura per vedere l'interfaccia tra il sacco d'aria e la cavità allantoidea. Fare un segno di matita sul bordo interfaccia.
- Con un ago da siringa da 5 ml di fare un buco nel guscio d'uovo.
- Con una siringa da 1 ml, infettare ogni uovo con 200 ml di sovranatanti del tessuto dal punto 1.10.
- Coprire il buco nel guscio d'uovo con la cera fusa usando un tampone di cotone.
- Incubare le uova infette al 37οC per 2-3 giorni.
- L'infezione di nuove cellule MDCK: Il giorno prima il passaggio della coltura tissutale surnatante dal 293T/MDCK co-culture, prepare ben 6 piatti piatto con le cellule MDCK raggiungere 80-90% confluenza giorno successivo. Di solito, un tessuto confluenti 100 mm Piastra cultura può essere suddivisa in 6-8 pozzi. Lavare le cellule due volte con PBS 1X, trypsinize e preparare il 6-pozzetti. Agitare delicatamente a mano i piatti in modo da avere una distribuzione uniforme delle celle. Coltivare le cellule, ON, nel 37 ° C incubatore, 5% di CO 2. Prima dell'infezione, controllare le cellule al microscopio per confermare un monostrato, quindi, procedere con l'infezione:
- Lavare le cellule due volte, con 1 ml di PBS 1X.
- Infettare con il 200 microlitri di surnatanti centrifugati coltura dei tessuti per 1 ora a temperatura ambiente. Non lasciare le pile a secco. Rock the 6-ben-piastra ogni 10 minuti.
- Dopo 1 ora di assorbimento virale, rimuovere il supporto infezione dalle cellule MDCK e aggiungere 2 ml di DMEM BA 0,3% 1% PS contenente 1 mg / ml di TPCK-tripsina.
- A 48-72 ore dopo il passaggio, a seconda dell'efficacia trasfezione e la carica virale, un effetto citopatico (CPE) saranno osservati nelle cellule infette MDCK. CPE suggerisce un salvataggio di successo. Tuttavia, un test HA (sezione 2) devono ancora essere eseguiti per confermare la presenza del virus in sovranatanti tessuto.
- L'infezione di uova embrionate di 10 giorni di età pollo: Tutte le procedure per infettare le uova embrionate di pollo vengono eseguite in condizioni sterili.
- Fluido raccolta allantoideo da uova embrionate di pollo infetto: Tutte le procedure per raccogliere il liquido allantoico da uova infette vengono eseguite in condizioni sterili. Circa il 8-12 ml di liquido allantoico può essere raccolto da ogni 10 giorni di età con infezione da uovo. Prima della raccolta del liquido allantoico, incubare le uova di gallina per 2 ore (o ON) a 4 ° C per uccidere l'embrione di pollo e coagulare il sangue.
- Lavare i gusci d'uovo con il 70% di etanolo per stabilire condizioni di sterilità.
- Aprire l'uovo, con attenzione, oltre la cavità d'aria toccando con un cucchiaio. Togliere il guscio d'uovo rotto con l'aiuto di pinze.
- Con un ago 1 ml, togliere la membrana allantoide senza rompere il tuorlo dell'uovo.
- Stabilizzare l'embrione di pollo con una spatola come si guida a 10 ml, pipetta nel liquido allantoico. Raccogliere il maggior liquido allantoico possibile in una provetta da centrifuga da 15 ml sul ghiaccio in un secchio di ghiaccio, senza rompere o raccogliere qualsiasi tuorlo dell'uovo. Utilizzare una provetta da centrifuga da 15 ml per ogni uovo.
- Centrifugare per 5 minuti a 4 ° C e trasferire il liquido allantoico (senza prendere in pellet globuli rossi) ad un nuovo 15 ml provette centrifuga.
- Conservare le provette contenenti il liquido centrifugato allantoideo a 4 ° C fino a quando non vengono controllati per la presenza del virus in salvo con un saggio di emoagglutinazione (HA).
2. HA test per confermare il salvataggio dei virus influenzali ricombinanti
Saggio emoagglutinazione (HA) viene normalmente utilizzato per rilevare la presenza del virus in salvo a surnatanti MDCK colture di tessuti e / o il liquido allantoico di uova raccolte. In alternativa, test di immunofluorescenza (IFA) può essere anche eseguita. Una volta che un test individua la presenza del virus in salvo, il virus dovrebbe essere purificata placca e la composizione genetica del virus sarà confermata mediante RT-PCR e sequenziamento.
La presenza del virus nei surnatanti MDCK coltura di tessuti e / o nel liquido allantoico da uova infette può essere determinata macroscopicamente con HA di pollo (o altra fonte) globuli rossi (RBC). La presenza del virus induce emoagglutinazione di RBC, mentre l'assenza di virus permette la formazione di una pallina rossa sul fondo del pozzo (Figura 4). Nel caso del virus influenzale, si ritiene che circa il 10 3 -10 4 unità placca formando (PFU) sono tenuti a dare un segnale positivo nel test HA, quindi, un IFA può essere eseguita in parallelo con il test per confermare HA un risultato vero negativo. IFA con primarie anticorpi anti-influenzale è più sensibile il test HA perché meno di 103-104 virus può essere rilevato con questa tecnica. E 'possibile che surnatanti o fluidi allantoide che sono HA-negativi sono positivi da IFA. In questo caso, il virus dovrebbe essere amplificato da passaging, ancora una volta, in cellule MDCK o nelle uova. Liquido allantoico e / o surnatanti di coltura dal secondo passaggio dovrebbe essere chiaramente positivo nel saggio HA.
Saggi di HA sono svolte in V-parte inferiore piastre a 96 pozzetti. Negativo (per esempio, PBS 1X) e positivo (surnatanti colture di tessuti e / o liquido allantoico da una infezione da virus influenzale), campioni di controllo devono essere sempre inclusi in qualsiasi test HA per convalidarlo.
- Dispensare 50 ml di PBS 1X in ciascun pozzetto della V-parte inferiore a 96 pozzetti.
- Aggiungere 50 ml diil MDCK surnatanti coltura di tessuti e / o liquido allantoico dalle uova infette al pozzo prima e, fanno diluizioni seriali di 2 volte per i pozzi di seguito. Scartare la extra di 50 microlitri dal pozzo scorso.
- Aggiungere 50 ml di 0,5% -1,0% globuli rossi di pollo (preparato in PBS 1X) in ciascun pozzetto.
- Incubare il V-basso 96-pozzetti per 30-45 minuti (fino a un punto rosso è visibile nella parte inferiore di un campione di controllo negativo PBS) su ghiaccio. Leggere e interpretare i risultati come indicato in Figura 4.
3. Passaggio di surnatanti coltura dei tessuti
Un risultato negativo nel test HA può essere il risultato di bassa efficienza di trasfezione con bassi livelli di virus presente di essere in sovranatanti il tessuto e / o liquido allantoico. Passaggio di questi campioni in MDCK uova fresche e / o embrionate permetterà l'amplificazione del virus (come indicato nella figura 3) Le infezioni sono eseguiti come precedentemente descritto nel paragrafo 1.11.2.
4. Rappresentante Risultati
Successo di soccorso virus influenzale sarà confermata dalla presenza di un test positivo HA (Figura 4). Inoltre, l'esistenza di CPE nelle cellule infette con sovranatanti il tessuto o con il liquido allantoico da uova proporrà un salvataggio positivo virale.
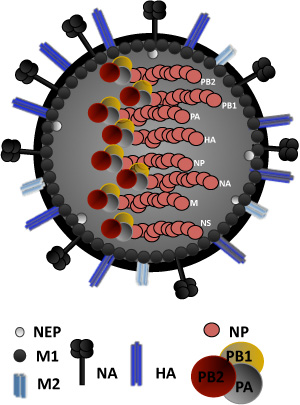
Figura 1. Struttura virus dell'influenza: Il virus dell'influenza è circondato da un doppio strato lipidico contenente i due glicoproteine virali (HA, NA) e, inoltre, la proteina del canale ionico, M2. HA è la proteina virale attaccamento, responsabile per il legame di acido sialico contenenti recettori. NA è responsabile del rilascio dei virus da cellule ospiti. Sotto il doppio strato lipidico, è uno strato proteico costituito da proteine della matrice interna busta superficie 1, M1, che svolge un ruolo nel virione assemblaggio e in erba e la proteina nucleare esportatore (NEP), richiesti per l'esportazione nucleare di ribonucleocapsids virale. Il nucleo del virus è costituito da un complesso ribonucleoproteina (RNP), composta da 8 geni negativi a singolo filamento di RNA virale encapsidated dal nucleoproteina virale, NP. Associata con il complesso RNP sono i virale RNA-dipendente di RNA polimerasi subunità PA, PB1, e PB2. Le proteine non strutturali NS1 e PB1-F2, codificate dai segmenti di RNA NS e PB1, rispettivamente, non fanno parte della struttura del virione.
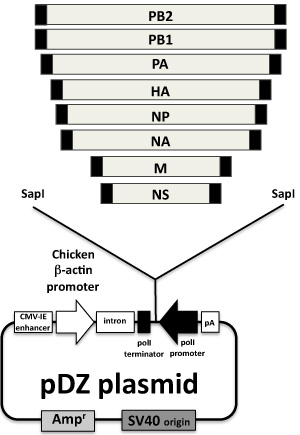
Figura 2. Influenza plasmidi salvataggio virus: Gli otto geni del virus influenzale clonato nel PDZ ambisense plasmide sono indicati. plasmide PDZ 6, derivato dalla espressione della proteina plasmide pCAGGs 7, è un vettore bidirezionale plasmide con un umano RNA polimerasi I promoter del mouse e una sequenza di terminazione che codifica l'RNA genomico senso negativo, con orientamento opposto al polimerasi mi unisco, una polimerasi II cassetta di trascrizione (pollo β-actina promotore e polyA) codifica le proteine virali da lo stesso gene virale. cDNA da ogni segmento virali sono generati mediante RT-PCR con primer avanti e indietro che contiene il sito di restrizione Sapi endonucleasi e le regioni non codificanti di ogni segmento (scatole nere, alla fine dei geni virali). Il prodotto PCR è clonato nel PDZ digerito con Sap-I.
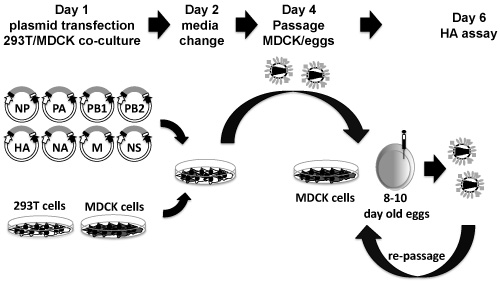
Figura 3. Otto plasmide basato salvataggio del sistema influenza: PDZ plasmidi contenenti i geni 8 influenza virale sono co-trasfettate, in sospensione, in-293T MDCK cellule co-culture (giorno 1). Ventiquattro ore dopo la trasfezione, i media senza FBS ma contenente TPCK / tripsina viene sostituito (giorno 2). Quarantotto ore dopo la sostituzione del supporto, supernatante di coltura di tessuto viene raccolta e utilizzata per infettare MDCK o 10 giorni di età uova embrionate di pollo (giorno 4). 48-72 ore post-amplificazione, sovranatante di coltura tissutale da MDCK cellule infette o liquido allantoico da uova vengono raccolti e analizzati per la presenza del virus da HA (giorno 6). Se nessun virus è rilevato, il sovranatante stesso e / o liquidi allantoideo può essere ri-diversi passaggi in fresco le cellule MDCK e / o uova embrionate.
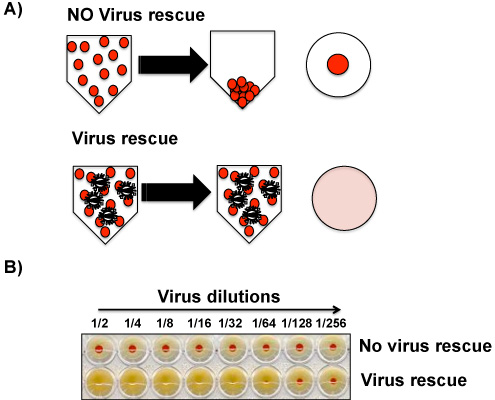
Figura 4. Emoagglutinina saggio (HA): emoagglutinazione di RBC da particella del virus è visibile macroscopicamente ed è la base per rilevare particelle virali nei supernatanti colture di tessuti e / o fluidi allantoideo. Anche se il test HA non discrimina tra particelle virali infettive e che sono particelle che sono degradati e non più in grado di infettare le cellule, il saggio è un buon indicatore della presenza del virus nei campioni. A) L'assenza (in alto) di presenza (in basso) del virus nei campioni biologici è determinato dalla presenza di RBC sul fondo del piatto o la loro assenza, respectively. B) Un risultato rappresentante di un test HA senza livelli rilevabili di virus (in alto) o presenza (in basso) del virus è mostrato.
Discussione
Salvataggio dei virus influenzali ricombinante da DNA plasmidico è un processo semplice e lineare una volta che il protocollo è eseguita di routine in laboratorio, ma in principio, più cose possono andare storte. E 'indispensabile avere una buona preparazione plasmide per generare il virus. La corretta manutenzione delle linee cellulari (293T e MDCK) è fondamentale per un salvataggio di successo virale. Tradizionalmente, un tag genetico viene inserito in una influenza gene codifica plasmide, da mutagenesi silenz...
Divulgazioni
Riconoscimenti
Gli autori desiderano ringraziare i membri passati e presenti nel Adolfo García-Sastre e Peter Palese laboratori per lo sviluppo di tecniche di reverse influenza genetica e plasmidi. La ricerca in laboratori di AG-S è parzialmente finanziato dalla CRIP, un NIAID-finanziato Centro di Eccellenza per la Ricerca e la sorveglianza dell'influenza (HHSN266200700010C) e da sovvenzioni NIAD R01AI046954, U01AI070469 e P01AI058113. La ricerca in laboratorio LM-S è parzialmente finanziato dal NIAID concedere RO1AI077719.
Materiali
Linee cellulari
293T (numero di catalogo CRL-11268) e MDCK (numero di catalogo CCL-34) linee di cellule sono mantenute in un incubatore a 37 ° C con 5% di CO 2 in DMEM 10% FBS, 1% PS. Le cellule vengono modulo disponibile l'American Type Culture Collection (ATCC, 10801 Università Boulevard, Manassas, in Virginia. 20110-2209 USA).
Uova embrionate di pollo
Embrionate di 10 giorni di età uova di pollo può essere ottenuto da Charles River Laboratories, organismi patogeni specifici di alimentazione aviaria Fee (SPAFAS) aviaria Prodotti e Servizi. Franklin Commons, 106 Route 32, North Franklin, CT 06254 USA. Le uova vengono incubate a 37 ° C precedente e dopo l'infezione virale. Prima e dopo l'infezione virale, le uova sono candled a determinare la vitalità degli embrioni. E 'molto importante per cercare le uova morti prima e dopo l'infezione virale. Prima dell'infezione un uovo morto può essere facilmente individuato per l'assenza di vasi sanguigni così come l'assenza di mobilità dell'embrione. Quando esaminate, embrioni vivi movimento. Dopo l'infezione virale un uovo morto (probabilmente correlati all'infezione da virus influenzale) sarà facilmente individuato dalla comparsa cattiva dell'uovo come si vede dal volume più piccolo e sanguinario di liquido allantoico. Infetti-uova vengono scartati in due sacchetti autoclavabili e sterilizzati in autoclave seguendo le procedure standard.
Pollo globuli rossi (RBC)
Pollo RBC possono essere acquistati presso Fattorie Truslow, 201 Valley Road, Chestertown, MD 21620. Conservare a 4 ° C. Per i saggi di HA, lavare 5 ml di globuli rossi di pollo con 45 ml di PBS 1X in un tubo da centrifuga da 50 ml. Centrifugare per 5 minuti a 1000 rpm, RT. Scartare con attenzione il sopranatante e utilizzare una diluizione 1:1000 del RBC pellet in PBS 1X (concentrazione finale del 0.5-1.0% RBC).
Tessuti e fluidi sovranatanti allantoideo
Entrambi, surnatanti colture di tessuti e fluidi allantoideo può essere conservato a 4 ° C per un breve periodo di tempo. Dopo aver confermato di soccorso virus, virus da surnatanti di cellule o liquido allantoico sono conservati a -80 ° C.
Plasmidi
Tutti i plasmidi sono preparati con le raccomandazioni di un plasmide produttore di kit maxi successivo. Tutti i plasmidi sono aliquota a concentrazioni di 1 mg / ml in DDH 2 O e conservati a -20 ° C. Per la conservazione a breve termine, il plasmide si può mantenere a 4 ° C. La concentrazione del DNA plasmidico purificato è determinata dalla spettrofotometria a 260 nm, con purezza di essere stimato utilizzando il rapporto 260:280 nm. Preparazioni a 1,8-2,0 260:280 rapporti nm sono considerati appropriati per operazioni di ripristino del virus. Inoltre, la concentrazione e la purezza plasmide deve essere confermata con gel cromatografia. Ambisense PDZ plasmidi (6) contenente l'influenza otto A/PR/8/34 geni virali (7) sono illustrati nella Figura 2.
Virus
Il protocollo descritto per il salvataggio influenza A/PR/8/34 può essere effettuata sotto il livello di biosicurezza (BSL) 2 condizioni. Materiali contaminati, comprese sovranatanti tessuti e uova embrionate, devono essere sterilizzati prima dello smaltimento. Salvataggio del virus dell'influenza altri possono esigere condizioni BSL superiore e, di conseguenza, le condizioni speciali / misure di sicurezza dovranno essere seguite.
Terreni di coltura dei tessuti e soluzioni
DMEM 10% FBS 1% PS: 445 ml di Dulbecco modificato Eagle medium (DMEM), 50 ml di siero fetale bovino (FBS), e 5 ml di 100X penicillina / streptomicina (PS). Conservare a 4 ° C. Questo supporto sarà utilizzato per mantenere le cellule 293T e MDCK così come per la transfezione. DMEM BA 0,3% 1% PS: 495,7 ml di DMEM, 4,3 ml di 35% di albumina bovina (BA). Conservare a 4 ° C. Appena prima dell'uso, aggiungere tripsina TPCK trattati per una concentrazione finale di 1 mg / ml. Mezzi di comunicazione infettivi.
Fosfato 10X soluzione salina tamponata (PBS): 80 g di NaCl, 2 g di KCl, 11,5 g di Na 2 HPO 4 0,7 H 2 O, 2 g di KH 2 PO 4. Aggiungi DDH 2 O fino a 1 litro. Regolare il pH a 7,3. Sterilizzare in autoclave. Conservare a temperatura ambiente.
PBS 1X: Diluire 10X PBS 1:10 con DDH 2 O. Sterilizzare in autoclave e conservare a temperatura ambiente.
Riferimenti
- Neumann, G., Watanabe, T., Ito, H., Watanabe, S., Goto, H., Gao, P., Hughes, M., Perez, D. R., Donis, R., Hoffmann, E., Hobom, G., Kawaoka, Y. Generation of influenza A viruses entirely from cloned cDNAs. Proc Natl Acad Sci U S A. 96, 9345-9350 (1999).
- Fodor, E., Devenish, L., Engelhardt, O. G., Palese, P., Brownlee, G. G., Garcia-Sastre, A. Rescue of influenza A virus from recombinant DNA. J Virol. 73, 9679-9682 (1999).
- Martinez-Sobrido, L., Garcia-Sastre, A. Recombinant influenza virus vectors. Future Virology. 2, 401-416 (2007).
- Palese, P., Shaw, M. L., Knipe, D. M., Howley, P. H. Orthomyxoviridae. The viruses and their replication. Fields Virology. , 1647-1689 (2006).
- Schickli, J. H., Flandorfer, A., Nakaya, T., Martinez-Sobrido, L., Garcia-Sastre, A., Palese, P. Plasmid-only rescue of influenza A virus vaccine candidates. Philos Trans R Soc Lond B Biol Sci. 356, 1965-1973 (2001).
- Quinlivan, M., Zamarin, D., Garcia-Sastre, A., Cullinane, A., Chambers, T., Palese, P. Attenuation of equine influenza viruses through truncations of the NS1 protein. J Virol. 79, 8431-8439 (2005).
- Niwa, H., Yamamura, K., Miyazaki, J. Efficient selection for high-expression transfectants with a novel eukaryotic vector. Gene. 108, 193-199 (1991).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon