È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Di campo elettrico controllato migrazione diretta di cellule progenitrici neurali in ambienti 2D e 3D
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo vengono utilizzati dei metodi utilizzati per stabilire gli ambienti 2D e 3D in custom-designed camere electrotactic, che permette di monitorare le celle In vivo / ex vivo Con time-lapse a livello di singola cellula, al fine di indagare galvanotaxis / electrotaxis e le altre risposte cellulari a corrente continua (DC) campi elettrici (EFS).
Abstract
Endogeni campi elettrici (EFS) si trovano naturalmente nel vivo e giocare un ruolo critico durante tessuto / organo di sviluppo e rigenerazione, compresa quella del 1,2 del sistema nervoso centrale. Questi EF endogeni sono generati da regolazione cellulare di trasporto ionico combinata con la resistenza elettrica di cellule e tessuti. È stato riportato che applicata EF trattamento può promuovere la riparazione funzionale di lesioni del midollo spinale negli animali e nell'uomo 3,4. In particolare, EF-diretta migrazione delle cellule è stata dimostrata in un'ampia varietà di tipi cellulari 5,6, incluse le cellule progenitrici neurali (NPC) 7,8. Applicazione di corrente continua (DC) EFS non è una tecnica comunemente disponibili nella maggior parte dei laboratori. Abbiamo descritto i protocolli modalità di applicazione di EFS DC per colture cellulari e tissutali in precedenza 5,11. Qui vi presentiamo un video dimostrativo dei metodi standard basato su una intensità di campo calcolato per istituire uno 2Dd ambienti 3D per i PNG, e per indagare le risposte cellulari alla stimolazione EF in entrambe le singole condizioni di crescita delle cellule in 2D, e la fetta organotipica midollo spinale in 3D. Il cordslice spinale è un tessuto destinatario ideale per studiare i comportamenti degli NPC ex vivo, post-trapianto, perché l'organizzazione del tessuto citoarchitettonica è ben conservato all'interno di queste culture 9,10. Inoltre, questo modello ex vivo permette inoltre procedure che non sono tecnicamente realizzabile per monitorare le cellule in vivo usando time-lapse a livello di singola cellula. È essenziale valutare criticamente comportamenti delle cellule non solo in un ambiente 2D, ma anche in una condizione 3D organotipica che imita l'ambiente in vivo. Questo sistema consentirà di imaging ad alta risoluzione con copertura in vetro a base di pesce in tessuto o cultura organistica con tracking 3D della migrazione singola cellula in vitro ed ex vivo e può essere una tappa intermedia prima di passare in vivo paradigmi.
Protocollo
1. Neural isolamento delle cellule progenitrici
- Dissect cervelli interi da E14-16 topi e posto a freddo DMEM/F12 medio basale. Rimuovere tutte le meningi con un microscopio anatomico e cervelli di trasferimento in una capsula Petri 35 millimetri.
- Utilizzare pinze sottili a dissociarsi meccanicamente cervello in frammenti di tessuto e trasferirli in una provetta da 15 ml, quindi centrifugare i campioni a 800 rpm per 3 min per rimuovere i detriti.
- Aggiungi DMEM/F12 contenenti bFGF e di EGF e triturare con una pipetta 1 ml.
- Far passare la sospensione cellulare attraverso un filtro cella per ottenere una sospensione di cellule singole.
- Cellule Plate in palloni a 2-5 x 10 4 cellule / ml, quindi eseguire un mezzo completo cambio ogni 3 giorni e il passaggio delle cellule ogni 6 giorni.
- Dopo almeno 5 passaggi, digest neurosfere di singole cellule con tripsina e EDTA e crescere sulle camere electrotactic poly-D-lysine/laminin-coated (preparato come descritto di seguito in 2). Utilizzare il terreno di coltura contenente N2-supplemento,bFGF EGF e in ogni momento di mantenere le proprietà di NPC.
2. Preparazione della camera electrotactic
- Preparare 22 x 11 mm strisce di vetro dividendo in autoclave 22 x 22 mm spessore coprioggetto n.1 in mezzo utilizzando una penna di diamante.
- Creare un free-standing in vetro e di dimensioni interne 22 x 10 mm incollando insieme quattro in verticale in piedi 22 x 11 mm con strisce di alto vuoto grasso al silicone. Lasciare asciugare i pozzetti completamente e indurire durante la notte.
- Il giorno seguente, collegare due strisce 22 x 11 mm di vetro, parallele fra loro lasciando uno spazio di 10 mm, alla base di un piatto di coltura da 100 mm con grasso siliconico. Sigillare la regione tra queste strisce inserendo un x 22 22 mm copertura antiscivolo a ciascuna estremità, fissato al fondo del recipiente con il grasso su tre lati, ma non quella più vicina al centro.
- Posizionare il vetro ben preparata nella fase 2,2 sul coperchio scivola in modo che le pareti interne creare uno spazio confinato per la seminale cellule sul fondo della piastra. Acqua a prova di tutti i giunti con grasso al silicone. Coat questa regione limitata sequenzialmente con poli-D-lisina quindi laminina: aggiungere 1 ml di poli-D-lisina nella camera e lasciare per 5 minuti per consentire il poli-D-lisina di legarsi al fondo della piastra, il lavaggio della camera con PBS sterile due volte, quindi diluire laminina in PBS sterile per dare 20 pg / ml e utilizzare per coprire il fondo della piastra. Lasciare a temperatura ambiente per tutta la notte.
- Il giorno seguente, le cellule raccolto e preparare 1 ml di sospensione contenente 1 x 104 cellule. Rimuovere laminina dal vetro bene, permettendo di asciugare completamente e sostituirlo con 1 ml di sospensione cellulare. Porre la capsula in incubatore a 37 ° C per un minimo di 4 ore per consentire fissaggio.
- Una volta che le cellule confluenti sono sufficientemente rimuovere tutto mezzo dalla camera. Rimuovere con cautela il vetro bene. Formare un tetto sopra le celle con attenzione collegando, con grasso al silicone, uno sterilizzato 22 x 22 mm vetro coprioggettoponte tra le due strisce di 22 x 11 mm. Coprire le cellule con qualche goccia di medium per evitare l'essiccamento fuori.
- Forma un serbatoio isolato mezzo a ciascuna estremità della camera creando due barriere stagne grasso al silicone che corrono da un bordo del piatto all'altro, oltre il tetto della camera. Riempire la camera con mezzo fresco, garantendo un flusso continuo da un serbatoio mezzo all'altro. Ritorna il piatto per l'incubatore per 12 ore per consentire il recupero delle cellule.
3. Applicazione di un campo elettrico alla camera electrotactic
- Preparare un coperchio per coprire il piatto forando due fori, uno posizionato su ciascun serbatoio della camera di migrazione.
- Sostituire tutto medium nella camera con terreno di coltura contenente 25 mM di tampone HEPES e trasferire il piatto alla temperatura controllata sistema di imaging. Impostare i parametri sperimentali per il time-lapse e multi-posizione di registrazione. Allineare camera in modo che il catodo e l'anodo sonosulla sinistra e destra rispettivamente, per assicurare che il vettore EF corre orizzontalmente come visto al microscopio e registrata nel sistema di imaging.
- Riempire due bicchieri con la soluzione di Steinberg (58 mM NaCl, 0,67 mM KCl, 0,44 mM Ca (NO 3) 2 .4 H 2 0, 1,3 mM MgSO 4 .7 H 2 0 e 4,6 mM Trizma base, pH 7,4). Collegare un becher separato per ciascun serbatoio medio usando pre-preparati ponti di vetro (tubi di vetro ~ 13 cm di lunghezza e ~ 3 mm di diametro, e piegato a U da riscaldamento in una fiamma Bunsen), riempite con 2% (w / v) Steinberg's-agar soluzione, passando attraverso i fori del coperchio. Completare il circuito elettrico inserendo Ag / AgCl elettrodi collegati ad un alimentatore DC in ogni bicchiere di soluzione di Steinberg.
- Impostare il selettore di tensione di alimentazione a 0 e accendere. Misurare la tensione attraverso la camera electrotactic mentre ruotando la manopola di tensione, usando un misuratore di tensione, e regolare a seconda delle esigenze sperimentali.
- Start time-lapse. Eseguire una variazione media e regolare la tensione, come richiesto, ogni ora. Mezzo fresco, farmaci, agenti chimici o possono essere aggiunti ai serbatoi come richiesto. Quando esegue cambiamento mezzo, due opzioni può essere considerato come di seguito:
- Opzione n.1 - Per mettere in pausa il time-lapse temporaneamente, rimuovere con cautela ponti di vetro dalla camera per evitare perturbante coperchio coperchio, utilizzare un sterilizzato pipetta Pasteur gentilmente sostituire tutte di medie dimensioni con terreno fresco e mettere i ponti di vetro schiena, poi riprendere la registrazione.
- Opzione No.2 - In alternativa, misura coperchio coperchio 4 con due fori (posizionato su ciascun serbatoio della camera di migrazione) può anche essere utilizzato per la variazione media. Due collegamento vetro ponti, gli altri due per cambiare mezzo. L'opzione 2 consente di registrare in continuo, senza interferenze durante il cambio medio.
4. Preparazione della fetta organotipica midollo spinale
- Dissect Lumbcorde ar spinale di due settimane vecchio C57 BL / 6 topi.
- Tagliate midollo spinale in 500 sezioni micron di spessore con un elicottero del tessuto McIlwain.
- Fette separati sotto un microscopio anatomico e selezionare fette con intatta sagittale / assiale struttura del midollo spinale.
- Fette piastra in una capsula Petri 35 millimetri Matrigel contenente 30 microlitri e posizionare il più vicino al centro possibile e mantenuti in 5% CO 2 incubatore a 37 ° C per almeno 30 min fino proteine Matrigel auto-assemblano per produrre un film sottile che copre la superficie della fetta midollo spinale. È molto importante assicurarsi che Matrigel è stato completamente assemblato, incubare la piastra di Petri a 37 ° C per altri 30 minuti, se necessario.
- Aggiungere 4-6 ml DMEM/F-12 mezzo contenente 25 mM di tampone HEPES e 15-20% siero di vitello fetale delicatamente in modo da evitare flusso medio direttamente sulla fetta. Assicurarsi che la sezione non è completamente sommerso nel mezzo, lasciando la superficie di espianti ben espostol'aria. Modificare media due volte a settimana.
5. L'iniezione di Hoechst 33342 NPC etichettati nella fetta organotipica midollo spinale
- Preparare la sospensione NPC a 1 × 10 6 cellule / microlitro.
- Pre-incubare la sospensione cellulare in terreno con 5 pM Hoechst 33342 per 30 min.
- Utilizzare tubo capillare di vetro a microinject 2 microlitri di sospensione nella sezione midollo spinale lentamente sotto un microscopio. Assicurarsi capillare di vetro passa attraverso il matrigel (parte rosa sotto microscopio) e raggiungere all'interno della fetta midollo spinale (tessuto grigio sotto microscopio), rimangono all'interno della fetta midollo spinale per almeno 30 secondi per evitare la sospensione cellulare investito. Mettere la piastra di Petri contenente fetta del midollo spinale in incubatore (37 ° C 5% CO 2) e lasciare tutta la notte.
- Il giorno seguente, applicare un EF di 500 mV / mm alla fetta midollo spinale contenente Hoechst 33342-marcati NPC nella camera electrotactic (utilizzando i metodi descritti nella3).
6. Risultati rappresentativi
Quando NPC sono stati esposti ad una serie di EF fisiologiche, hanno mostrato la migrazione cellulare altamente orientata verso il catodo (Figura 1). La stessa osservazione è stata fatta a livello di singola cellula sulla organotipica spinale modello fetta cavo ex vivo, uno mimando ambiente 3D in condizioni in vivo (Figura 2).
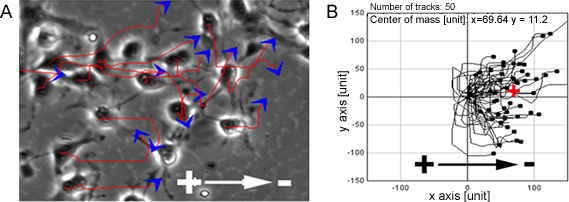
Figura 1. NPCs mostrano la migrazione diretta in EF. PC ha mostrato grande migrazione diretta verso il catodo, quando esposti ad EF, linee rosse e frecce blu rappresentano le traiettorie e la direzione di movimento delle cellule (A). B mostra i percorsi di migrazione degli NPC. Bar: 50 micron.
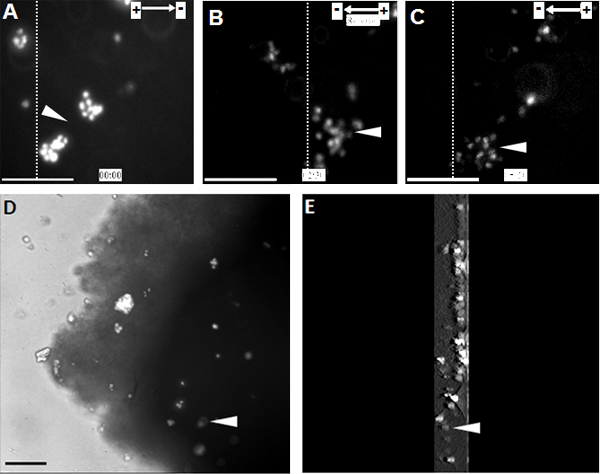
Figura 2. NPC trapiantati mostrano la migrazione diretta verso il catodo nella fetta organotipica midollo spinale . (A) NPC marcati con Hoechst 33342 sono stati trapiantati in sezione organotipica midollo spinale al punto di partenza del trattamento EF. NPC migrazione direzionale verso il catodo per 2,5 ore, a questo punto la polarità EF è stata invertita (B). Alterare la polarità EF ha innescato una brusca inversione di electrotaxis nuovo verso il catodo (C). (D) Immagine di NPC trapiantate all'interno della fetta di midollo spinale, alla fine del time-lapse. (E) Una ricostruzione 3D di NPC trapiantate all'interno della fetta di midollo spinale. 3D sezioni scansione erano di 300 pm di spessore, a partire dalla metà e termina nella parte inferiore della fetta. Le linee tratteggiate indicano le posizioni relative della stessa popolazione di cellule trapiantate all'inizio, inversione, e punti finali del trattamento EF (A - C, rispettivamente). Punte di freccia indicano la stessa popolazione di Hoechst 33342 NPC etichettati. Bar: 50 micron.
Discussione
I protocolli che usiamo sono basati su studi precedenti 5,11. L'utilizzo di questi metodi, cultura stabile ed elettrico condizioni attuali può essere mantenuta, mentre l'applicazione di un EF via ponti agar, soluzione Steinberg, e Ag / AgCl elettrodi, alle cellule o fette coltivate in camere electrotactic custom-progettati di dimensioni standardizzate e precise. La profondità delle camere può essere regolata per accogliere campione per diversi spessori 11, e nel caso di cellule, la dimen...
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Royal Society URF concessione UF051616, Regno Unito e il Consiglio europeo della ricerca StG concessione 243.261 a BS. Il lavoro in MZ laboratorio è anche supportato da una California Institute of Regenerative Medicine concessione RB1-01.417.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| FGF-base ricombinante umano | Invitrogen | PHG0026 | 20 ng / mL |
| EGF umano ricombinante | Invitrogen | PHG0311 | 20 ng / mL |
| N2-Supplement (100X) di liquido | Invitrogen | 02048 | |
| DMEM/F12 medio (glucosio) | Invitrogen | 31330-095 | |
| Poly-D-lisina | Millipore | A-003-E | |
| Naturale del mouse laminina | Invitrogen | 23017-015 | |
| Fattore di crescita ridotta Basement Membrane Matrix (Matrigel) | BD Biosciences | 354230 | |
| Tampone HEPES | Gibco | 15630 | |
| McIlwain tessuto chopper | Il Laboratorio Mickle Engineering Co Ltd | TC752-PD | |
| Dow Corning alto vuoto grasso al silicone | Sigma-Aldrich | Z273554 |
Riferimenti
- Huttenlocher, A., Horwitz, A. R. Wound healing with electric potential. N. Engl. J. Med. 356, 303-303 (2007).
- McCaig, C. D., Rajnicek, A. M., Song, B. Controlling cell behavior electrically: current views and future potential. Physiol. Rev. 85, 943-943 (2005).
- Borgens, R. B., Jaffe, L. F., Cohen, M. J. Large and persistent electrical currents enter the transected lamprey spinal cord. PNAS. 77, 1209-1209 (1980).
- Shapiro, S., Borgens, R., Pascuzzi, R. Oscillating field stimulation for complete spinal cord injury in humans: a phase 1 trial. J. Neurosurg. Spine. 2, 3-3 (2005).
- Zhao, M., Song, B., Pu, J. Electrical signals control wound healing through phosphatidylinositol-3-OH kinase-gamma and PTEN. Nature. 442, 457-457 (2006).
- Yao, L., Shanley, L., McCaig, C. Small applied electric fields guide migration of hippocampal neurons. J. Cell. Physiol. 216, 527-527 (2008).
- Li, L., El-Hayek, Y. H., Liu, B. Direct-current electrical field guides neuronal stem/progenitor cell migration. Stem Cells. 26, 2193-2193 (2008).
- Meng, X., Arocena, M., Penninger, J. PI3K mediated electrotaxis of embryonic and adult neural progenitor cells in the presence of growth factors. Exp. Neurol. 227, 210-210 (2011).
- Bonnici, B., Kapfhammer, J. P. Bone marrow stromal cells promote neurite extension in organotypic spinal cord slice: significance for cell transplantation therapy. Neurorehabil. Neural Repair. 22, 447-447 (2008).
- Shichinohe, H., Kuroda, S., Tsuji, S. Bone marrow stromal cells promote neurite extension in organotypic spinal cord slice: significance for cell transplantation therapy. Neurorehabil. Neural Repair. 22, 447-447 (2008).
- Song, B., Gu, Y., Pu, j. Application of direct current electric fields to cells and tissues in vitro and modulation of wound electric field in vivo. Nature Protocol. 2, 1479-1479 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon