Method Article
Femorale cateterismo arterioso e venoso per il campionamento del sangue, Drug Administration e pressione sanguigna consapevole e misure di frequenza cardiaca
In questo articolo
Riepilogo
Cateterismo cronico dei vasi sanguigni nel ratto è spesso necessaria per la somministrazione di sostanze, ottenere campione di sangue per un periodo di tempo o per le misure dirette consapevole della pressione arteriosa. Cateterismo arterioso femorale di ratto e le corrispondenti misure della pressione arteriosa nell'animale cosciente sarà dimostrato.
Abstract
In molteplici campi di studio, l'accesso al sistema circolatorio in studi di laboratorio è necessario. Studi farmacologici nei ratti utilizzando cateteri impiantati cronicamente consentire un ricercatore di amministrare in modo efficace e umanamente sostanze, eseguire il prelievo di sangue ripetute e consapevole aiuta a misurazioni dirette della pressione arteriosa e frequenza cardiaca. Una volta che il catetere viene impiantato lungo periodo di campionamento è possibile. La vita e la pervietà del catetere dipende da molteplici fattori tra cui la soluzione di blocco utilizzato, il regime di lavaggio e materiale del catetere. Questo video dimostra la metodologia di arteria femorale e cateterismo venoso del ratto. Inoltre il video sarà dimostrare l'uso della venoso femorale e cateteri arteriosi per il prelievo di sangue, somministrazione di farmaci e l'uso del catetere arterioso nel prendere le misurazioni della pressione arteriosa e la frequenza cardiaca in un consapevole ratto liberamente in movimento. Un cordino e imbracatura collegata ad un sistema girevole permette all'animale di essere houtilizzati e sono campioni prelevati dal ricercatore con il minimo disturbo per l'animale. Per mantenere la pervietà del catetere, attenta manutenzione quotidiana del catetere è necessario utilizzare una soluzione di blocco (100 U / ml soluzione salina eparinata), macchina-terra smussato aghi di siringa punta e l'uso di filtri siringa per minimizzare la contaminazione potenziale. Con attenzione tecniche asettiche chirurgiche, materiali catetere corretta ed attenta tecniche di manutenzione del catetere, è possibile sostenere cateteri brevetti e animali in buona salute per lunghi periodi di tempo (alcune settimane).
Protocollo
1. Prima di partire Procedura chirurgica
Nota: Prima di iniziare qualsiasi sperimentazione animale assicurarsi di avere ottenuto le autorizzazioni del caso, tramite il vostro istituto / organizzazione. Come per tutte le operazioni chirurgiche la sopravvivenza, assicurarsi che l'intervento chirurgico viene eseguito in condizioni di sterilità e la antidolorifici e antibiotici appropriati necessari vengono utilizzati per un esito positivo.
- Prima di iniziare la procedura di cateterismo valutare i cateteri da lavaggio con soluzione salina sterile per assicurarsi che siano brevetto.
- Anestetizzare il topo.
- Preparare il topo per la procedura chirurgica.
- Accorciare il pelo dalle regioni chirurgici, che comprendono la parte posteriore del collo (tra le scapole) e la regione interna delle gambe.
- Utilizzando Betadine e una macchia etanolo al 70% rispettivamente, macchia le regioni rasata chirurgico a partire dal centro verso l'esterno e facendo una scansione circolare. Ripeterequesto 3 volte per ogni regione, terminando con una pulizia finale con etanolo al 70%.
- Posizionare l'animale su una superficie e telini sterili luogo sterile su aree chirurgiche. (L'utilizzo di Press-n-Seal è un drappeggio ideale chirurgica che consente al ricercatore di monitorare l'animale durante tutta la procedura.)
- Garantire tutti gli strumenti chirurgici per la procedura chirurgica sono stati sterilizzati.
2. Preparazione delle aree chirurgiche per il posizionamento del catetere
- Con il topo che prona (sulla pancia), fanno circa un pollice e mezzo (12 mm) incisione orizzontale sulla parte posteriore del collo a livello delle scapole con le forbici o un bisturi, poi smussato dissezionare un sottocutaneo "tasca" in la parte posteriore delle dimensioni di un quarto. Questo verrà utilizzato come area di inserire una piccola quantità di tubi che compensare la crescita degli animali e / o movimento, cioè in modo che il catetere non viene tirato su, e quindi rimosso dal arteria è stato postod pollici (In alternativa questa fase può essere eseguita immediatamente prima tunnel del catetere.)
- Posizionare il topo sul dorso (posizione supina) e fare un'incisione nella zona inguinale [circa ½ pollice (12 mm) incisione lungo l'angolo naturale della gamba posteriore.
- Blunt sezionare per separare il tessuto connettivo (Figura 1) (può usare forbici a punta smussata, hemostats, bastoncini di cotone, ecc) (in genere tenendo le forbici a punta e / o tamponi di cotone con un angolo di 45 gradi questo garantisce la localizzazione più facile della regione di interesse) fino a quando l'arteria femorale e la vena sono esposti.
- La vena è rosso di colore scuro e l'arteria è più chiara e più luminosa la vena. Il nervo che corre lungo l'arteria è biancastra di tono.
- Blunt sezionare nella regione gamba per fare una piccola regione aperta sotto la pelle (Pocket IE, circa le dimensioni di un quarto) lungo la parte interna della gamba per il posizionamento di una piccola sezione del catheter (di nuovo per tener conto del movimento degli animali e la crescita dell'animale se posizionamento cronica).
- Posizionare il divaricatori nella zona incisione in modo che si può pienamente vista l'arteria e vena.
- Utilizzando punta fine pinze separare delicatamente il nervo (colore biancastro) che è lungo l'arteria femorale di distanza dalla arteria e vena. (Figura 2) Fare attenzione a non tagliare o danneggiare il nervo.
- Separare l'arteria e la vena come una singola unità, cercando di esporre un sezione di lunghezza circa ¼ di pollice (5-7 mm) di arteria / vena.
- Ripetere il processo di separazione della vena dall'arteria. Mantenete il vostro strumenti chirurgici (pinze punta cioè bene) perpendicolare ai vasi e separare i vasi in parallelo. Questo aiuta a evitare strappi, pizzicore o danneggiare i vasi. Inserendo il forcipe punta fine delicatamente tra l'arteria e la vena da sotto e lentamente aprendo la pinza e ripetere questo, si lentamente separare le navi. Nota: se si fa strappare o osservare alcunesanguinamento utilizzare un tampone sterile di cotone e / o 2 x 2 garze e pressione posto sulla zona fino a quando l'emorragia si è fermata, quindi continuare con l'intervento chirurgico.
3. Tunneling il catetere
- Soluzione salina sterile imbevuta posto 2 x 2 garza sopra l'incisione e trasformare l'animale al suo stomaco.
- Posizionare il Rochester Pean pinze (pinze lungo rettilineo) nella incisione sul retro che è stato fatto in precedenza e guida il forcipe per via sottocutanea lungo la schiena al livello dei fianchi [garantire le punte delle hemostats sono rivolta verso l'alto, non (verso la colonna vertebrale ) per evitare lesioni al midollo spinale]. Approssimativamente alla regione dell'anca hemostat girare la punta verso l'incisione che è stato fatto nella regione delle gambe e spingere la punta del hemostats fuori l'incisione gamba preparato.
- Afferrare con delicatezza la fine dei cateteri (non la fine che verrà inserito in arteria / vena) con la pinza e tirare delicatamente il catetere attraverso la cavità che è stato fattoe, infine, fuori l'incisione del collo.
- Posizionare la punta smussata appropriata siringa riempita con 20 U / ml Eparina / salino alla fine del rispettivo cateteri e riempire i cateteri (assicurarsi che non vi siano bolle d'aria) con il eparinizzata / salina. Ancora una volta controllare che i cateteri sono brevetti e nessun danno è giunta alla cateteri. Lasciare le siringhe attaccate alla fine delle linee catetere per garantire che non l'aria è in grado di entrare in linee catetere e ruotare il topo sul dorso, ancora una volta.
4. Inserimento del catetere nella vena femorale e delle arterie (Figura 3)
- Posizionare un pezzo piegato di 4,0 sterili seta / filo sotto la vena femorale e poi tagliare la seta alla fine piegato. Ci saranno ora due pezzi di seta sotto la vena. Oppure, in alternativa, posto 2 pezzi di 4,0 seta sotto la vena singolarmente.
- Separare la seta che vi posto sotto la vena, un pezzo verso la gamba (distale) e l'altro verso il corpo. Tcioè una legatura allentata sul lato più vicino al corpo, quindi utilizzando hemostats piccolo, afferrare e tirare la seta ha insegnato, ma non stringere il nodo. Tirare l'altro pezzo di seta, per quanto possibile verso la gamba (distale) e legare questo in un nodo triplo, afferrare la seta con hemostats piccole e tirare insegnato. Questo metodo permetterà la vena di riempirsi di sangue, rendendo più semplice per rendere il l'incisione che è richiesta per l'inserimento del catetere (punto 4).
- Luogo 1-2 gocce di lidocaina sulla vena.
- Utilizzando il micro-dissezione forbici Vanna, fare una piccola incisione nella vena circa ¼ attraverso e con un angolo di 45 gradi.
- Luogo punta fine pinze (45 pinze) nella incisione e l'utilizzo di un altro paio di pinze, fare avanzare il catetere nella vena. Aprire delicatamente il forcipe che vengono inseriti nella vena, in modo da permettere al ricercatore di inserire delicatamente il catetere venoso sotto la pinza e nella vena.
- Quando il catetere è completamente inserito (approx. 6-7 cm) (quando si effettua il catetere è un marchio posto sul catetere per aiutare il chirurgo a identificare quando il catetere è completamente inserito) (questo pone il catetere venoso nella vena cava addominale), stringere la legatura anteriore intorno alla vena e catetere, un nodo triplo (in modo che non si occlude la vena). Utilizzare la sutura di seta vicino alla gamba (legatura posteriore) per fissare di nuovo il catetere (nodo tripla) e assicurare il posizionamento. Lentamente tira indietro la siringa fino a quando c'è un po 'di sangue visibile nel catetere, che aiuta a garantire che i nodi di sutura non siano troppo strette e che il catetere è funzionale. Dopo il controllo, spingere il pistone fino a quando il sangue non è più visibile nel catetere.
Nota: è possibile inserire 2 cateteri nella vena femorale, se necessario. - Ripetere i passaggi 9-13 per posizionare un catetere dell'arteria femorale con le seguenti eccezioni:
- Cravatta di seta più vicino alla gamba (posteriore) con un nodo triplo e tirare taught prima di legare la legatura allentata vicino al corpo (anteriore) prima di effettuare l'incisione per il posizionamento del catetere. Questo permetterà l'arteria di riempirsi di sangue rendendo più facile da tagliare. Garantire la sutura prossimale viene tirato insegnato ad occludere l'arteria prima del taglio l'arteria. Ciò eviterà la perdita di sangue quando il taglio è fatto.
- Inserire il catetere arterioso di circa 5 cm dal arteria femorale (questo pone il catetere in aorta addominale).
- Il fissaggio del catetere con la sutura, assicurarsi che la sutura non è troppo stretto e occlusione del catetere.
5. Chirurgico Wrap-up
- Fai un centesimo al quarto ciclo di dimensioni di cateteri e posto sulla parte interna della gamba (il ciclo dovrebbe andare bene nella zona che è stato smussato sezionato in precedenza). Dopo aver posizionato due cateteri, li sicuro con 1-2 punti su 5,0 sutura chirurgica nello strato muscolare.
- Chiudere l'incisione con 4.0 Ethilon con i continui sutures.
- Girare il ratto sulla sua pancia e fare un altro ciclo nella cateteri circa le dimensioni di un quarto e mettere in tasca sezionato nella parte posteriore. Chiudere l'incisione con la sutura.
- Utilizzando una goccia di vetbond, fissare il catetere nella schiena.
- Bloccare il cateteri vicino l'incisione posteriore con hemostats imbottito e rimuovere le siringhe dalle estremità.
- Montare il topo con una pastoia di tipo giacca, il cappello cateteri (per mantenere il blocco eparina), e rimuovere il hemostats imbottita.
- Per il mantenimento a lungo termine sostituzione del catetere soluzione fisiologica con 20 U / ml di eparina / salina.
6. Manutenzione di catetere (guanti sterili devono essere indossati durante la procedura)
- Bloccare il catetere con una pinza imbottiti.
- Togliere il tappo del catetere.
- Inserire una siringa con soluzione di punta smussata agganciare il catetere.
- Sbloccare le pinze.
- Riempire il catetere con la soluzione di bloccaggio (volume è pre-deterioramentormined, in genere 0,3 ml).
- Bloccare il catetere mentre lavaggio per evitare il riflusso di sangue nella punta del catetere e togliere la siringa.
- Sostituire il tappo del catetere.
- Sbloccare la pinza e spingere delicatamente la spina in un po 'per garantire che non è sangue nella punta del catetere.
7. Sangue di campionamento (guanti sterili devono essere indossati durante la procedura)
Bloccare il catetere con una pinza imbottiti.
- Togliere il tappo del catetere.
- Estrarre lentamente la soluzione di blocco usando una siringa con punta smussata e scartare.
- Attaccare siringa di campionamento al catetere e ritirare lentamente il campione.
- Bloccare il catetere con una pinza imbottito e posto una siringa con soluzione di agganciare il catetere e ri-riempire il catetere con la soluzione di bloccaggio.
- Bloccare il catetere, mentre ri-riempire il catetere con la soluzione.
- Re-inserire la spina del catetere.
- Rimuovere la pinza imbottito e spingere delicatamente t si collega un po 'più.
8. Infusione di droga
- Bloccare il catetere con una pinza imbottiti.
- Togliere il tappo del catetere.
- Estrarre lentamente la soluzione di blocco usando una siringa con punta smussata e scartare.
- Attaccare siringa riempita di droga al catetere e infondere la sostanza in animali.
- si può usare un rubinetto a 3 vie e un intermedio se iniezioni multiple sono necessari, richiedendo così l'infusione di liquidi in meno l'animale.
- si può anche allegare una costante pompa a siringa per infusione con un filtro sterile per infusioni continue.
- Fascetta con una pinza imbottito e posto una siringa con soluzione di agganciare il catetere e ri-riempire il catetere con la soluzione di bloccaggio.
- Bloccare il catetere, mentre ri-riempire il catetere con la soluzione.
- Re-inserire la spina del catetere.
- Rimuovere la pinza imbottito e spingere delicatamente la spina in un po 'più.
- Bloccare il catetere arterioso imbottito con una pinza e togliere il tappo del catetere.
- Fissare la linea arteriosa al trasduttore di pressione.
- Seguire le istruzioni del produttore per l'utilizzo del software per la raccolta della pressione sanguigna.
- Al termine del periodo di monitoraggio della pressione arteriosa, utilizzando pinze imbottito bloccare il catetere e staccare dal trasduttore.
- Lavare il catetere con la soluzione di blocco e sostituire il tappo del catetere come descritto sopra.
10. Rappresentante Risultati
Un rappresentante di misurare la pressione arteriosa è stata presa da un animale cosciente muoversi liberamente ed è presentato in figura 4. Fenilefrina (3 ug / kg, iv), un alfa 1 agonista del recettore adrenergico, è stato somministrato nella linea vena femorale per aumentare la pressione sanguigna, e contemporaneamente la misurazione della pressione arteriosa dalla linea arteriosa femorale. Fentolamina (4 mg / kg, iv),uno non selettivi alfa-adrenergici antagonista, è stato poi somministrato per abbassare la pressione sanguigna.

Figura 1. Blunt dissezione dei tessuti. Con il topo sulla schiena, avrete fatto circa un pollice e mezzo (12 mm), incisione su l'angolo della gamba posteriori e utilizzando forbici o hemostats si smussato sezionare il tessuto connettivo per esporre l'arteria e la vena femorale.
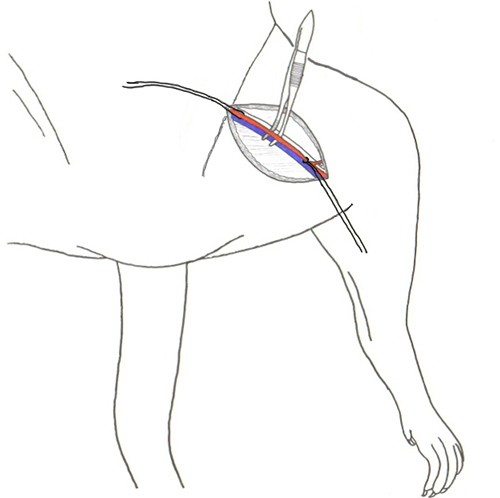
Figura 2. Separazione di arteria femorale e la vena da tessuto connettivo.
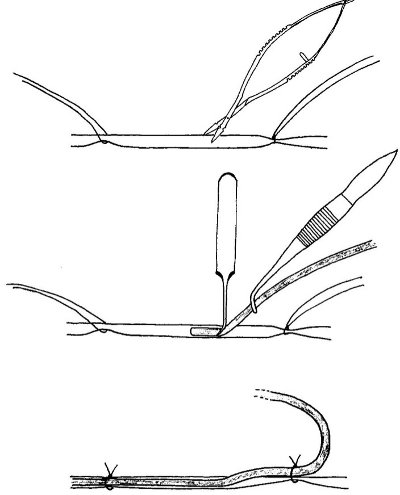
Figura 3. Posizionamento del catetere. Vanna utilizzando micro-dissezione forbici posto una piccola incisione di circa ¼ della strada attraverso l'imbarcazione ad una angolo di 45 gradi (sopra) e posto a punta fine pinze in °e incisione e l'utilizzo di un altro paio di pinze alimentare il catetere nel vaso (al centro). Infine, al termine del posizionamento del catetere sutura del catetere al posto (in basso).
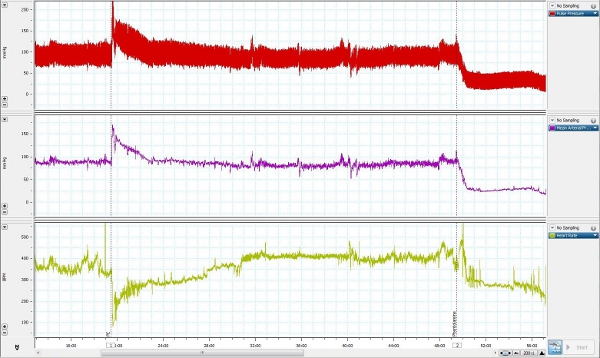
Figura 4. Rappresentante misurare la pressione prelevato da un animale cosciente liberamente in movimento.
Discussione
Cateterismo arterioso e venoso sono stati storicamente utilizzati per entrambi acuta e cronica monitorare la pressione sanguigna, i campioni di sangue e fornire le sostanze presenti nel modello sperimentale animale di ratto 1-4. Uno dei principali vantaggi di queste strumentazioni chirurgiche è che permette di procedure di monitoraggio, tra cui, il campionamento somministrazione del farmaco nel sangue, e di monitoraggio della pressione sanguigna, da condurre con disturbi minimi e / o stress per l'animale 1. Numerosi ricercatori hanno scritto i protocolli e le metodologie specifiche sono da cui il loro laboratorio esegue la procedura chirurgica 5-8. Il video e le illustrazioni di dimostrare quello che il nostro laboratorio ha scoperto di avere successo per quanto riguarda la femorale arterioso e la procedura di cateterismo venoso.
I ratti sono comunemente utilizzati in laboratorio per una moltitudine di studi scientifici a causa delle loro piccole dimensioni e praticità nella gestione. Sono molti i luoghi in cui una malattia cronicacatetere può essere inserito all'interno di un animale, tra cui la vena giugulare, l'aorta addominale, arteria carotide e dell'arteria femorale, per citarne alcuni. La posizione ratto femorale per risultati cateterizzazione cronica in aumento della durata della pervietà del catetere ed era il più veloce recupero di pre-chirurgica peso dell'animale rispetto ad altri luoghi catetere 9.
Numerosi ricercatori hanno usato cateteri per prelievo di sangue acuta e cronica 1-5,11-13. In molti studi sangue più attira sono tenuti di un animale e cannulazione esterno / cateterizzazione è una metodologia che è vantaggioso per la sua natura non traumatica, inoltre può essere fatto mentre l'animale è cosciente, quindi non è limitata dagli effetti di anestetici e anche l'animale può essere liberamente muoversi 1,10. Il miglior metodo per ottenere campioni di sangue e di misurare gli ormoni dello stress nei roditori è stata a lungo dibattuta 6,13. Per quanto riguarda farmacocinetiche Studies, cateterismo dell'animale ricerca permette il prelievo di sangue ripetute con moderazione minima quando si utilizza un sistema cronicamente catetere impiantato. Inoltre, alcuni studi hanno dimostrato ridotto le concentrazioni basali di adrenalina, noradrenalina e dopamina nel plasma dei ratti muoversi liberamente (catetere giugulare) rispetto agli animali che sono stati trattati (30 secondi) e o trattenuto (5 minuti) 14. Un ulteriore metodo con il quale discernere un aumento dello stress è quello di misurare i livelli plasmatici di corticosterone. In precedenza è stato suggerito che anche dopo tre o quattro giorni di tempi di recupero chirurgico che i livelli plasmatici di corticosterone sono state elevate nel ratto cronica cannulata 15. Tuttavia, i recenti miglioramenti nella metodologia hanno stabilito che non ci sono differenze nei livelli plasmatici basali di corticosterone nei ratti vena giugulare cannulata rispetto ai ratti uncannulated 16. Inoltre, la metodologia per l'analisi HPLC corticosterone ha anche rivelato che corticosteruno livelli sono elevati da stress moderazione, tuttavia, stabile dopo cateterizzazione giugulare 16.
L'uso addizionale della cateterizzazione cronica è la misurazione della pressione arteriosa e la frequenza cardiaca nei roditori. Ci sono diverse metodologie che vengono utilizzate per misurare la pressione arteriosa e frequenza cardiaca nel ratto, tra cui i non-invasiva metodologie bracciale coda, le procedure radiotelemetry e diretto cateteri. Ogni metodo ha i suoi vantaggi e svantaggi, che sono descritte in dettaglio in altre pubblicazioni. Insito pieno di liquido cateteri possono essere impiantati nelle arterie più all'interno del ratto. L'arteria femorale non è che una delle arterie che possono essere utilizzati per questa misura. Per la pressione del sangue / misure di frequenza cardiaca, l'estremità distale del catetere è collegato ad un trasduttore di pressione calibrata. Il catetere può essere ospitato in una primavera di protezione che è collegato ad un girevole per consentire la libera circolazione degli animali, o collegato ad un pulsante personalizzate e sicureautomaticamente impiantato per l'animale. Cateteri permanenti hanno il vantaggio di ridurre a lungo termine dello stress sull'animale 17,18. Inoltre i materiali sono economici, la calibrazione è facile per misure di pressione e continue misure a lungo termine possono essere ottenuti in condizioni di stress relativamente basso per diverse settimane 19. Saremmo negligenti se non ricordare che ci sono svantaggi a questa tecnica, tra cui, è una tecnica chirurgica invasiva, la manutenzione del catetere è necessario per mantenere la pervietà, danni alle arterie a causa l'impianto del catetere e la potenziale di infezione per citarne alcuni.
Per le misure cronica delle registrazioni della pressione sanguigna diretta da cronicamente impiantati cateteri arteriosi sono tecnicamente più impegnativo, ma sono più precisi e può essere fatta in continuo senza disturbare l'animale. Coda-bracciale misure sono meno accurati, ma non richiedono l'intervento chirurgico e può anche essere ripetutaed. Coda-bracciale metodologie richiedono manipolazione, nonché riscaldamento dell'animale per dilatare i vasi coda per facilitare l'individuazione del polso 20. Manipolazione e lo stress possono influenzare calore aggiunto misurazioni della pressione del sangue, non fornendo misure veramente accurata. Inoltre, la mancata diretta coda-bracciale metodo non permette un facile campionamento simultaneo di sangue o somministrazione del farmaco.
Un ulteriore metodo con cui misura diretta può essere ottenuto sia utilizzando una metodologia telemetrica. Telemetria permette registrazioni di alta qualità della pressione arteriosa (e altre misure) ininterrottamente per lunghi periodi di tempo in consapevole animali liberi di muoversi senza restrizioni o anestetici 18. Tuttavia, i dispositivi di telemetria, mentre l'ideale sono molto costosi. Rispetto al telemetria, i benefici cateterizzazione sono: diminuzione "setup" e costi operativi, la capacità di amministrare facilmente droga e facilmente prendere campioni di sangue in consapevole animali liberi di muoversi. L'amministratoioni di farmaci e sostanze, e campioni di sangue per ottenere dall'animale ricerca può essere fatta mentre minimamente disturbare l'animale, riducendo al minimo lo stress per l'animale e consentendo una misura più accurata.
Divulgazioni
Produzione e il libero accesso di questo video-articolo è sponsorizzato da ADInstruments.
Riconoscimenti
Gli autori desiderano ringraziare il Dr. Andrew King, PhD e Katrina re per il contributo delle illustrazioni. NIH sovvenzione: R00HL087927.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome | Tipo | Azienda | Numero di catalogo |
| Catetere arterioso | Di consumo | SAI infusione | RFA-01 |
| Catetere venoso | Di consumo | Commodities Scientific, Inc. | BB518-20 & BB31785-V / 2 |
| 27g 1 / 2 "Needle Blunt | Attrezzatura | Erogazione integrata Solutions, Inc. | 9991113 |
| 23g 1 / 2 "Needle Blunt | Attrezzatura | Erogazione integrata Solutions, Inc. | 9991109 |
| PowerLab/8SP | Attrezzatura | ADInstruments | w.adinstruments.com/products/hardware/research/product/PL3508 "target =" / _blank "> ML765 |
| Quad Ponte | Attrezzatura | ADInstruments | ML118 |
| LabChart 7,2 | Software | ADInstruments | |
| Trasduttore BP con rubinetto e cavo | Attrezzatura | ADInstruments | MLT844 |
| Canale girevole singolo | Attrezzatura | Instech | 375/22PS |
| Singolo asse-Counter Balance pivotante | Attrezzatura | Instech | CM375BP |
| Covance infusione Harness | Attrezzatura | Instech | CIH105 |
| Tabella Unità di Anestesia Top isoflurano | Attrezzatura | Protech International, Inc. | 61020 |
| Roditore Anestesia Maschera | Attrezzatura | Protech International, Inc. | RAM-02 |
| Roditore induzione Camera | Attrezzatura | Protech International, Inc. | RIC-01 |
| Anestesia Canister Filtro Gas | Attrezzatura | Protech internazionaleal, Inc. | 80120 |
| Tavolo cappa a flusso laminare | Attrezzatura | Sentry Air Systems, Inc. | SS-200-WSL |
| Oster Golden A5 | Attrezzatura | Oster Prodotti professionali | 78005-140 |
| Illuminazione a fibre ottiche con guida a doppio collo di cigno | Attrezzatura | LW Scientific, Inc. | ILL-1502-DGG1 |
| DeltaPhase Pad isotermica | Attrezzatura | Braintree Scientific | 39DP |
| Punte di cotone | Di consumo | Solone Manufacturing Company | 36200 |
| Garza Spugne 2 "x2" | Di consumo | Kendall rezza | 2146 |
| 5-0 Nylon Sutura | Di consumo | Ethicon | 661G |
| Seta sutura 4-0 | Di consumo | DekNATEL | 8-S, 136075-0208 |
| Tessuto adesivo | Di consumo | 3M | 1469SB |
| Splinter & Fissazione Pinze | Attrezzatura | George Tiemann & Company | 160-55 |
| Studente tessuto Pinza | Attrezzatura | Belle Scienza Strumenti, Inc. | 91121-12 |
| Micro Pinza / Bracken Pinze | Attrezzatura | George Tiemann & Company | 10-1942 |
| Extra Pinza Graefe Belle | Attrezzatura | Belle Scienza Strumenti, Inc. | 11152-10 |
| Olsen-Hegar Porta aghi | Attrezzatura | Belle Scienza Strumenti, Inc. | 12002-12 |
| Studente Halsted-Mosquito emostatica | Attrezzatura | Belle Scienza Strumenti, Inc. | 91308-12 |
| Rochester Pean Forzap | Attrezzatura | Biomedical Research Instruments, Inc. | 31-1640 |
| Forbici chirurgiche studente | Attrezzatura | Belle Scienza Strumenti, Inc. | 91402-12 |
| Dumont Pinza | Attrezzatura | Belle Scienza Strumenti, Inc. | 11251-35 |
| Micro Forbici dissezione | Attrezzatura | George Tiemann & Company | 160-210 |
| Strabismo Forbici | Attrezzatura | Belle Scienza Strumenti, Inc. | 14075-11 |
| Hartman emostatica | Attrezzatura | Belle Scienza Strumenti, Inc. | 13003-10 |
| Tessuto Forbici | Attrezzatura | George Tiemann & Company | 160-150 |
| Retractor | Attrezzatura | Custom Made |
Riferimenti
- Tabata, Y., Chang, T. M. Intermittent vascular access for extracorporeal circulation in conscious rats: a new technique. Artif. Organs. 6, 213-215 (1982).
- Chester, J. F., Weitzman, S. A., Malt, R. A. Implantable device for drug delivery and blood sampling in the rat. J. Appl. Physiol. 59, 1665-1666 (1985).
- Koeslag, D., Humphreys, A. S., Russell, J. C. A technique for long-term venous cannulation in rats. J. Appl. Physiol. 57, 1594-1596 (1984).
- Hall, R. I., Ross, L. H., Bozovic, M., Grant, J. P. A simple method of obtaining repeated venous blood samples from the conscious rat. J. Surg. Res. 36, 92-95 (1984).
- Burt, M. E., Arbeit, J., Brennan, M. F. Chronic arterial and venous access in the unrestrained rat. Am. J. Physiol. 238, H599-H603 (1980).
- Cocchetto, D. M., Bjornsson, T. D. Methods for vascular access and collection of body fluids from the laboratory rat. J. Pharm. Sci. 72, 465-492 (1983).
- Rigalli, A., E, D. L. V. . Experimental surgical models in the laboratory rat. , (2009).
- Waynforth, H. B. . F.P.A. Experimental and surgical tehcnique in the rat. , (2007).
- Yoburn, B. C., Morales, R., Inturrisi, C. E. Chronic vascular catheterization in the rat: comparison of three techniques. Physiol. Behav. 33, 89-94 (1984).
- Staub, J. F., Coutris, G. A technique for multiple, high-rate blood samplings via an external cannula in rats. J. Appl. Physiol. 46, 197-199 (1979).
- Steffens, A. B. A method for frequent sampling of blood and continuous infusion of fluids in the rat without disturbing the animal. Physiol. Behav. 4, 833-836 (1969).
- Thrivikraman, K. V., Huot, R. L., Plotsky, P. M. Jugular vein catheterization for repeated blood sampling in the unrestrained conscious rat. Brain. Res. Brain. Res. Protoc. 10, 84-94 (2002).
- Vahl, T. P. Comparative analysis of ACTH and corticosterone sampling methods in rats. Am. J. Physiol. Endocrinol. Metab. 289, E823-E828 (2005).
- Buhler, H. U., da Prada, M., Haefely, W., Picotti, G. B. Plasma adrenaline, noradrenaline and dopamine in man and different animal species. J. Physiol. 276, 311-320 (1978).
- Fagin, K. D., Shinsako, J., Dallman, M. F. Effects of housing and chronic cannulation on plasma ACTH and corticosterone in the rat. Am. J. Physiol. 245, E515-E520 (1983).
- Ling, S., Jamali, F. Effect of cannulation surgery and restraint stress on the plasma corticosterone concentration in the rat: application of an improved corticosterone HPLC assay. J. Pharm. Pharm. Sci. 6, 246-251 (2003).
- Fink, G. D., Bryan, W. J., Mann, M., Osborn, J., Werber, A. Continuous blood pressure measurement in rats with aortic baroreceptor deafferentation. Am. J. Physiol. 241, H268-H272 (1981).
- Van Vliet, B. N., Chafe, L. L., Antic, V., Schnyder-Candrian, S., Montani, J. P. Direct and indirect methods used to study arterial blood pressure. J. Pharmacol. Toxicol Methods. 44, 361-373 (2000).
- Wang, J., Tempini, A., Schnyder, B., Montani, J. P. Regulation of blood pressure during long-term ouabain infusion in Long-Evans rats. Am. J. Hypertens. 12, 423-426 (1999).
- Bunag, R. D. Facts and fallacies about measuring blood pressure in rats. Clin. Exp. Hypertens. A. 5, 1659-1681 (1983).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon