Method Article
Un test Parasite salvataggio e di trasformazione per screening Antileishmanial contro intracellulare
In questo articolo
Riepilogo
Un saggio parassita-salvataggio e di trasformazione con THP1 cellule infettate In vitro Con Leishmania donovani È stato ottimizzato per l'anti-leishmanial screening di farmaci. Il test prevede la differenziazione delle cellule THP1, infezione da promastigoti, il trattamento con farmaci di prova, lisi controllata dei macrofagi infetti, di salvataggio di amastigoti, la trasformazione in promastigoti promastigote e monitoraggio della crescita e la proliferazione con un saggio fluorimetrico.
Abstract
La leishmaniosi è una delle malattie più trascurate del mondo, in gran parte colpisce i più poveri tra i poveri, soprattutto nei paesi in via di sviluppo. Oltre 350 milioni di persone sono considerate a rischio di contrarre la leishmaniosi, e circa 2 milioni di nuovi casi si verificano ogni anno 1. Leishmania donovani è l'agente eziologico per la leishmaniosi viscerale (VL), la forma più mortale della malattia. La scelta dei farmaci disponibili per trattare la leishmaniosi è limitato 2; trattamenti attuali prevedono limitata efficacia e molti sono tossici a dosi terapeutiche. Inoltre, la maggior parte dei primi farmaci di trattamento linea hanno già perso la loro utilità a causa della crescente resistenza ai farmaci multipla 3. La pipeline corrente della protezione anti-leishmanial droga è anche gravemente impoverito. Occorre un impegno costante per arricchire di un nuovo anti-leishmanial gasdotto scoperta di nuovi farmaci, e questo sforzo si basa sulla disponibilità di adeguati modelli di screening in vitro.
In promastigoti vitro 4 e axeniche saggi amastigoti 5 sono utilizzati principalmente per l'anti-leishmanial screening di farmaci tuttavia, può non essere adeguato a causa di significative cellulari, differenze fisiologiche, biochimiche e molecolari rispetto a amastigoti intracellulari. Saggi con macrofagi amastigoti modelli sono considerati più vicini alle condizioni fisiopatologiche della leishmaniosi, e sono quindi i più appropriati per screening in vitro. Differenziati, non dividono cellule leucemia acuta monocitica (THP1) (fare un attraente) alternativa a macrofagi isolati primari e può essere utilizzato per saggiare l'attività anti-leishmanial di diversi composti contro amastigoti intracellulari.
Qui, vi presentiamo un saggio parassita-salvataggio e di trasformazione con differenziate THP1 cellule infettate in vitro con Leishmania donovani per lo screening di composti puri e naturali prodottiestratti di dotti e determinare l'efficacia contro gli amastigoti intracellulari Leishmania. Il test prevede le seguenti fasi: (1) la differenziazione di cellule THP1 alle società non dividono macrofagi, (2) l'infezione dei macrofagi con L. donovani metaciclici promastigoti, (3) il trattamento di cellule infettate con farmaci di prova, (4) lisi controllata di macrofagi infetti, (5) il rilascio / salvataggio di amastigoti e (6) la trasformazione di amastigoti vivi ai promastigoti. Il saggio è stato ottimizzato mediante trattamento detergente per lisi controllata di Leishmania infettate cellule THP1 raggiungere salvataggio quasi completa vitali amastigoti intracellulari con un effetto minimo sulla loro capacità di trasformare a promastigoti. Macrofagi diverse: rapporti promastigoti sono stati testati per ottenere la massima infezione. Quantificazione l'infezione è stata effettuata attraverso la trasformazione di vivo, salvato amastigoti di Leishmania promastigoti e valutazione della loro crescita da un alamarBlue saggio fluorimetrico a 96 pozzetti. Questo dosaggio è paragonabile alla correntemente utilizzato microscopico, gene reporter transgenico e immagini digitali saggi di analisi. Questo test è robusto e misura solo i vivi amastigoti intracellulari rispetto al gene reporter e saggi di analisi delle immagini, che non possono distinguere tra amastigoti vivi e morti. Inoltre, il test è stato validato con un pannello corrente della protezione anti-leishmanial farmaci ed è stato applicato con successo su vasta scala di composti puri e di una libreria di prodotti naturali frazioni (Tekwani et al. Pubblicato).
Protocollo
1. Mantenere e Subculture THP1 Colture Cellulari
- Mantenere THP1 cellule in mezzo RPMI-1640 (con 10% FBS e pH 7,4) a 37 ° C in 5% CO 2 incubatore.
- Subculture cellule due volte a settimana per evitare numero di celle di superare 1x10 6 cellule / ml. Questo è importante per mantenere la loro capacità di trasformazione.
2. Mantenere e Subculture Leishmania donovani promastigoti Cultura
- Mantenere la L. donovani promastigoti (S1, ceppo sudan) in mezzo RPMI-1640 (senza bicarbonato di sodio e sodio piruvato) con 10% FBS a 26 ° C.
- Subculture L. donovani promastigoti due volte a settimana, con alta concentrazione celle nell'intervallo di 20-25x10 6 / promastigoti ml.Caution: Tutti i mezzi e le soluzioni devono essere portati a temperatura ambiente prima dell'uso.
3. Semina e differenziazione delle cellule THP1 in un 96 pozzetti di micropiastre e 16-camera di scorrimento Cultura vetro.
- Preparare un diluito THP1 cultura con conta delle cellule di 2.5x10 5 cellule / ml da una quattro giorni di età coltura cellulare (numero di celle non deve superare i 10 6 cellule / ml) in RPMI-1640 con 10% di siero FBS. Preparati 20 ml di coltura per ciascuna piastra da 96 pozzetti e 4 ml di coltura per ogni 16 pozzetti vetrino camera.
- Aggiungere forbolo 12-miristato 13-acetato (PMA) (per la differenziazione dei THP1) per sospensione diluita coltura cellulare (10 ml μl/20 cultura dallo stock di 50 pg / ml in DMSO) (concentrazione finale PMA diluito in coltura cellule dovrebbe essere 25 ng / ml).
- Per confrontare il Digital-Image-Analysis-Direct-conteggio-test e parassita-Rescue-trasformazione-test, impostare i saggi contemporaneamente in chiaro, a fondo piatto, piastra a 96 pozzetti e 16-camera, vetro, diapositive cultura microscopico.
- Pipettare 200 ml di cellule THP1-PMA-trattati in ciascun pozzetto o camera.
- Incubare a 96 pozzetti plates e 16 pozzetti scivoli camera a 37 ° C, 5% CO 2 incubatore notte per consentire differenziazione quasi completa delle cellule.
Nota: le THP1 cellule, che normalmente crescono in sospensione, si differenziano in macrofagi aderenti.
4. L'infezione delle cellule trasformate THP1 con Leishmania promastigoti donovani
- Per infezione di differenziata THP1 coltura cellulare con Leishmania donovani promastigoti, la maggior parte dei parassiti sia nella fase metaciclici infettiva (lunghe forme cilindriche, ~ 5-6 giorni vecchia cultura).
- A 1:10 THP1 cella al rapporto parassita è ottimale per l'infezione sia nel Digital-Image-Analysis-Direct-conteggio-analisi e l'promastigote-Rescue-trasformazione-test.
- Preparare una coltura diluita di L. donovani promastigoti con un conteggio parassita di 2.5x10 6 parassita / ml (per THP1 cellule: rapporto parassiti = 01:10) a partire daa 5-6 giorni di età cultura in mezzo RPMI-1640 con 2% FBS.
- Dalla fase 3.5 (dopo la differenziazione durante la notte di THP1 coltura cellulare) estrarre le piastre e le diapositive da camera, rimuovere il terreno e lavare le colture cellulari una volta con RPMI senza siero-1640.
- Dopo accurato lavaggio di PMA-trattati con cellule THP1 privo di siero, caldo RPMI-1640 (~ 37 ° C) medie, sostituire il terreno privo di siero con 200 microlitri della coltura diluita di L. promastigoti donovani (2.5x10 6 parassiti / ml) a partire dal punto 4.3. Impostare i pozzetti di controllo del THP1 cellule senza il parassita ei parassiti senza THP1 cellule in ogni piatto e 16 diapositive e da camera.
- Dopo aver aggiunto parassita alla cultura THP1 cella, la piastra e incubare vetrini a 37 ° C, 5% di CO 2 per 24 ore per permettere ai parassiti di infettare le cellule differenziate THP1.
5. Trattamento di macrofagi infettati con farmaci di prova / Compounds
- TestAmfotericina B, pentamidina e Miltefosine come standard anti-leishmanial farmaci per lo screening. Preparare soluzioni dei farmaci / composti di prova in acqua o DMSO come indicato nella tabella dei reagenti. Verificare ogni composto di droga a 6 concentrazioni.
- Diluire serialmente (1:5) i farmaci standard e composti di prova in una piastra a 96 pozzetti fresco o 2 ml provette (per diapositive camera) con mezzo RPMI-1640 con 2% FBS. I farmaci / concentrazioni composto di prova in questo piatto sono 2X delle concentrazioni finali.
- Lavare le piastre di coltura e le diapositive da camera con infezione da L. promastigoti donovani (dal punto 4.5) almeno 5 volte con privo di siero, RPMI-1640. Aggiungere 100 microlitri coltura (RPMI-1640 con 2% FBS) in ogni pozzetto / camera. I lavaggi sono necessarie per assicurare la completa rimozione di non internalizzati promastigoti.
- Aggiungere 100 microlitri di serie-diluiti standard anti-leishmanial farmaci o composti in esame in ciascun pozzetto o camera. Impostare l'infezioneted cellule THP1 controlla senza farmaci contemporaneamente in ciascun piatto / camera di scorrimento.
- Incubare le piastre e vetrini camera a 37 ° C, 5% CO2 per 48 ore.
6. Presentazione Camera di colorazione, Imaging microscopio a fluorescenza e Image Analysis per la quantificazione di infezione ed Effetto del trattamento farmacologico
- Dopo una incubazione di 48 ore, lavare il vetrino camera 3 volte con siero privo di mezzo RPMI-1640. Staccare le camere di plastica dai vetrini e fissare le cellule immergendo i vetrini in metanolo per 30 sec. Lasciare i vetrini in bio-cappa sotto flusso d'aria per l'asciugatura.
- Preparare una SYBR Green I soluzione colorante (5X) diluendo (1:2.000) lo stock (10.000 X) con acqua.
- Colorare i vetrini in condizioni di oscurità con SYBR Green I macchia soluzione diluita per 15 min a temperatura ambiente, lavate una volta con acqua e lasciare i vetrini sotto il flusso di aria di asciugatura.
- Posizionare un vetrino completo di vetro sopra la STAIdiapositiva ned con l'aiuto di mezzo di montaggio.
- Catturare le immagini digitali di cellule THP1: senza infezione (bianco), con infezione (controllo), cellule infettate trattate con differenti farmaci standard o composti di prova a varie diluizioni (Figura 3, 5 e 6)) usando un microscopio a fluorescenza Nikon Eclipse 90i accompagnata da elemento di software NIS AR 3.2.
- Contare i nuclei dei macrofagi (grande) ed i nuclei parassita (piccola cinetoplasto) utilizzando ImageJ (Figura 7), che è un-pubblicamente disponibili, basato su Java programma di elaborazione delle immagini sviluppato presso il National Institutes of Health ( http://rsb. info.nih.gov / IJ / download.html ). Esprimono i dati come il numero di amastigoti per 100 THP1 cellule trasformate.
7. The Parasite-Rescue-trasformazione-test: lisi controllata di L. donovani amastigoti macrofagi infettati
- Lavare la micropiastra a 96 pozzetti da 5,5 passo tre volte con RPMI privo di siero-1640 terreno di coltura.
- Tra detergenti diversi testati a diverse concentrazioni, 0,05% SDS trattamento per 30 sec è ottimale per lisi controllata (lisi cellulare massimo con minima perdita di vitalità parassiti salvato ").
- Rimuovere il terreno privo di siero da ogni pozzetto dopo l'ultimo lavaggio e aggiungere 20 ml di RPMI-1640 (con 0,05% SDS) a ciascun pozzetto. Agitare la piastra per 30 sec e aggiungere 180 microlitri completo RPMI-1640 (con 10% di FBS) in ciascun pozzetto.
- Incubare le piastre a 26 ° C per 48 ore per la trasformazione di amastigoti salvati a promastigoti.
8. Analisi quantitativa di promastigote Transformed (alamarBlue saggio)
- Dopo una incubazione di 48 ore a 26 ° C, tutte le amastigoti salvati vivi sono trasformati in promastigoti (Figura 1D). Aggiungere 10 ml di alamarBlue in ogni pozzetto della 96 p-welllates.
- Incubare le piastre a 26 ° C per una notte.
- Dopo incubazione per una notte, leggere le piastre per fluorescenza standard su un Galaxy Fluostar fluorimetro (BMG Technologies Lab) in 544 nm di eccitazione, emissione 590nm.
- Preparare le curve dose-risposta (crescita per cento contro la concentrazione del composto di farmaco o di prova) con ExcelFit (figure 7-9) e calcolare IC 50 / IC 90 valori da queste curve (Tabella 1).
9. Standardizzazione dei THP1 cellule Rapporto parassiti
- Standardizzare le cellule THP1 rapporto parassiti per determinare la sensibilità del test. Nota: infezione bassa / alta numeri parassiti / possono compromettere con sensibilità e selettività della proiezione.
- Standardizzare le THP1 cellule a rapporto parassiti seguendo il protocollo descritto in precedenza per THP1 semina cellule e Leishmania infezione promastigote (Sezione 3 e 4), tranne l'uso diffrapporti di erenti THP1 cellule ai parassiti come 1:1,25, 1:2.5, 1:5 e 1:10.
- Impostare l'esperimento sia a 16-camera di scorrimento (per analisi di immagini) e piastra a 96 pozzetti (per parassita-salvataggio saggio) formati da confrontare il salvataggio parassita e saggi di analisi di immagine.
10. Standardizzazione di detersivi diversi per lisi cellulare controllata
- L'obiettivo principale di questo esperimento è quello di ottimizzare il protocollo di lisi controllata delle cellule THP1 per ottenere la massima / completa THP1 lisi cellule senza alterare in modo significativo la vitalità dei parassiti amastigote salvati.
- Testare detergenti diversi come Tween 20, Tween 80, Triton X-100, NP-40 e SDS a diverse concentrazioni e durate differenti di trattamento (Figura 2).
- THP1 cellule a parassiti rapporto è di 1:10 e le altre condizioni sono simili come sezioni di cui sopra 1-8.
- Prova il trattamento 0,05% SDS ulteriore tempo di trattamento diversos per ottimizzare ulteriormente la lisi cellulare controllata.
Risultati
L'analisi quantitativa è stata effettuata sia per Digital-Image-Analysis-Direct-conteggio-test e parassita-Rescue-trasformazione-test per 24, 48, 72 e 96 ore di post-trattamento farmacologico
Nel metodo di conteggio diretto, infezione di L. donovani macrofagi infettati (THP1 cellule) è stato calcolato con la seguente equazione:
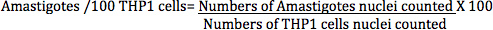
Le amastigoti (determinata contando nuclei amastigoti) / 100 (cellule trasformate THP1 determinata contando contati THP1 nuclei cellulari) (Figura 7) è una misura più accurata per analizzare l'effetto di standard diversi o composti di prova rispetto alla percentuale di cellule infettate THP1 , come riportato in alcuni documenti precedenti, perché questo numero è direttamente correlata effetto complessivo di composti, sia attraverso una diminuzionein parassiti nei macrofagi o rimozione totale del parassita dal cells.Infection macrofagi è stata calcolata dalle immagini digitali di THP1 infettate cellule trattate con differenti farmaci standard a diluizioni differenti per diversi intervalli di tempo (Figura 10 e Tabella 1). La lettura per il Digital-Image-Analysis-Direct-conteggio-test è stato amastigoti infection/100 trasformato THP1 cellule, mentre il read-out per il parassita-Rescue-trasformazione-test era relativi unità di fluorescenza (RFU), che è direttamente proporzionale al numero di live amastigoti Leishmania salvati dai macrofagi infetti e si trasformano in promastigoti. Il saggio alamarBlue è solitamente usata per Leishmania promastigoti anti-leishmanial screening di farmaci.
Il saggio è stato inizialmente standardizzata e ottimizzata per lisi controllata di Leishmania THP1 cellule infettate. L'obiettivo è stato quello di ottimizzare le condizioni per il detersivo treatment, che danno lisi quasi completa di THP1 cellule con un effetto minimo sulla vitalità delle amastigoti salvati. figura 1 mostra una vista microscopico del protocollo di dosaggio completo. Intatte THP1 cellule infettate con amastigoti Leishmania può essere visto in Figura 1A. Figura 1B mostra la lisi delle cellule dopo trattamento THP1 detergente. Figura 1C illustra salvato Leishmania amastigoti, che sono stati parzialmente trasformati in promastigoti e Figura 1D mostra trasformazione quasi completa in amastigoti promastigoti e la loro proliferazione successiva. La crescita di queste promastigoti trasformate possono essere quantitativamente monitorato con aggiunta di alamarBlue e misura di fluorescenza su un lettore di micropiastre. Il trattamento con NP-40 (Figura 2A) e Triton X-100 (Figura 2B) lisate le cellule infette THP1, tuttavia anche influenzato la redditività etrasformazione dei amastigoti salvati. Trattamento con Tween 20 (figura 2C) e Tween 80 (Figura 2D) non ha causato lisi THP1 ottimale delle cellule risultanti in un salvataggio incompleto di amastigoti come indicato da un numero ridotto di promastigoti trasformate. Il trattamento con 0,05% SDS per 30 sec (Figura 2E) prodotto lisi quasi completa di Leishmania infettate THP1 cellule e non influenzare la vitalità e la trasformazione di amastigoti salvato. Ulteriore ottimizzazione mostrato che il trattamento delle cellule con il 0,05% SDS per 20-30 sec dato più alto recupero di vitali amastigoti di Leishmania (Figura 2F). In esperimenti successivi, il trattamento con 0,05% SDS per 30 secondi è stato utilizzato. Procedimento per il trattamento SDS è la stessa per lastre singole o multiple. In più lastre, il trattamento con SDS è stato attuato colonna per colonna con una pipetta multicanale. Terreno privo di siero è stato rimosso da ogni 8 pozzetti di una colonna e della piastra 20 e mu; L di 0,05% SDS è stato aggiunto in 8 pozzetti della stessa colonna e diluito dopo 30 secondi con RPMI-1640 con 10% FBS. Durante standardizzazione iniziale del dosaggio, le piastre sono state controllate al microscopio per non interiorizzate promastigoti. Un minimo di cinque lavaggi sono stati necessari per la rimozione dei parassiti prima del punto 5 del trattamento di cellule macrofagiche infettate con composti standard e tre lavaggi sono stati necessari prima del punto 7 del trattamento SDS. Così, le cellule sono state lavate 8 volte e non visibili non internalizzati promastigoti rimasto prima lisi controllo THP1 cellule infette.
Image Analysis digitale e conteggio diretto
Le immagini digitali di Leishmania infettate THP1 cellule sono state catturate al microscopio Nikon Eclipse 90i fluorescenza dopo colorazione con SYBR Green I. Sia nuclei macrofagi e nuclei Leishmania intracellulare con il DNA cinetoplasto caratteristica sono stati osservati sotto i filtri fluorescenti (Figura 3). Inoltre, le immagini di cellule infette THP1 sono stati catturati sotto DIC. Quando entrambe le immagini sono state fuse, le linee di cellule THP1 con amastigoti intracellulari sono meglio visibile (Figura 4). Il software ImageJ è stato utilizzato per analizzare le immagini. ImageJ è un dominio pubblico, basato su Java, di elaborazione delle immagini programma sviluppato presso il National Institutes of Health ( http://rsb.info.nih.gov/ij/download.html ). ImageJ è stato progettato con un'architettura aperta che fornisce estensibilità tramite plugin Java e macro registrabili. Plugin acquisizione personalizzata, analisi ed elaborazione possono essere sviluppate utilizzando ImageJ è built-in editor e un compilatore Java. Per il conteggio differenziale dei nuclei THP1 cellule e nuclei dei parassiti ImageJ, l'immagine è stata aperta in ImageJ. Contatore di cellule è stato trovato in opzione Analizza nel plugin del Software. L'immagine è stata inizializzata e tipo cellulare contatore 1 è stato selezionato per THP1 cnuclei ell e contatore di tipo cella 2 è stato selezionato per nuclei parassita (Figura 3). Conteggio differenziale è stato fatto per almeno 200 THP1 nuclei delle cellule e gli amastigoti intracellulari presenti in questi nuclei delle cellule THP1. Un confronto di parassita-salvataggio dosaggio e il metodo di analisi immagine è stata fatta per valutare l'infettività di cellule THP1 macrofagi con differenti:. Rapporti promastigoti (Figura 4) La figura 5 rappresenta l'infettività differenziale in cellule THP1 a macrofagi diversa: rapporti promastigote. Entrambi i metodi hanno mostrato risultati comparabili e macrofagi: rapporto promastigote 1:10 infettività prodotto ottimale e riproducibile.
Una volta che le condizioni per il dosaggio parasite-rescue/transformation e l'analisi di immagini digitali sono state ottimizzate, l'utilità di questi test è stata valutata per anti-leishmanial screening di farmaci. Le Leishmania infettate THP1 cellule sono state trattate con differenti concentrazioni di norma unnti-leishmanial farmaci ovvero amfotericina B, pentamidina e Miltefosine per diversi intervalli di tempo compresa da 24 a 96 ore. L'esperimento di parassita salvato / trasformazione test è stato fatto in triplice copia e l'esperimento per le celle diretti metodo di conteggio è stato fatto in duplicato. Figura 6 mostra le immagini microscopiche del controllo non infetto, il controllo infetti non trattati e con infezione da Leishmania, trattati THP1 cellule. Le curve dose-risposta sono state preparate da saggio parassita-salvataggio e trasformazione (concentrazione del farmaco contro parassiti trasformate) e il saggio di analisi dell'immagine (numero di cellule THP1 amastigotes/100) (Figure 7-9). La IC 50 dei farmaci sono state calcolate ExcelFit e sono presentati nella Tabella 1. Digital-Image-Analysis-Direct-conteggio-test e parassita-Rescue-trasformazione-test ha mostrato risultati comparabili. Digital-Image-Analysis-Direct-conteggio-test era meno ottimale durante i momenti iniziali di 24 e 48 ore di droga treatments, mentre il parassita-Rescue-trasformazione-test ha mostrato risultati più coerenti con i valori riportati in tutti gli intervalli di tempo durante il 24-96 hr dopo trattamenti farmacologici. Questa differenza nei risultati con Digital-Image-Analysis-Direct-conteggio-test e parassita-Rescue-trasformazione-test può essere dovuto alla presenza di non vitali amastigoti durante i periodi iniziali del trattamento farmacologico in Digital-Image-Analysis-Direct-Conteggio -test.

Figura 1. Una vista microscopico del donovani Leishmania amastigoti di soccorso e di trasformazione per promastigoti. A - aderenti THP1 cellule infettate con Leishmania amastigoti; B - aderenti, le cellule infettate THP1 dopo lisi C controllata - Trasformata Leishmania promastigoti donovani dalle amastigoti salvati da macrofagi infetti THP1 cellule D - la crescita e la proliferazione delle transformed Leishmania donovani promastigoti.
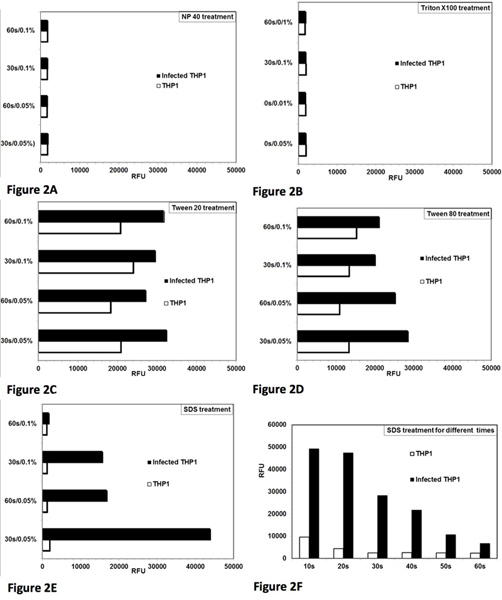
Figura 2. Ottimizzazione della lisi controllata di cellule infette THP1 per ottenere soccorso massimo di vivi Leishmania amastigoti donovani e la loro trasformazione a promastigoti. Analisi della lisi delle cellule e THP1 salvataggio di amastigoti dalle Leishmania infettate THP1 cellule con detergenti diversi. Due concentrazioni (0,05% e 0,1%) di detersivo e due periodi di tempo (30 sec e 60 sec) per il trattamento sono stati testati. RFU = unità relative di fluorescenza. Ogni barra rappresenta la media delle osservazioni duplicate. [A] NP-40 trattamento l'ha lisi delle cellule e THP1 colpito anche la vitalità dei parassiti amastigote salvati. [B] Triton X-100 Curent causato lisi delle cellule e THP1 colpito anche la vitalità dei parassiti amastigote salvati [C] Tween 80 causato lisi parziale THP1 cellule per salvare i amastigoti. [D] Tween 80 causato lisi parziale THP1 cellule per salvare i amastigoti. [E ] trattamento SDS causato lisi quasi completa di THP1 cellule e non ha influenzato la redditività delle amastigoti soccorse in 0,05% / 30 sec. [F] Il trattamento con 0,05% SDS per 20-30 sec causato lisi quasi completa di THP1 cellule e salvato parassita vitale amastigoti per trasformare in promastigoti. Clicca qui per ingrandire la figura .

Figura 3. Fluorescente un'immagine digitale di una cellula differenziata THP1 infettate in vitro con Leishmaniun donovani amastigoti. Il kDNA caratteristica può anche essere visto con ogni nucleo parassita. Il nucleo macrofagi (mN) (1) e la nuclei parassita (pN) (2) possono essere marcati in modo differenziale e differenzialmente contato dal software di analisi per la valutazione quantitativa ImageJ dell'infezione. La quantificazione è stata eseguita come numero di cellule THP1 amastigotes/100.
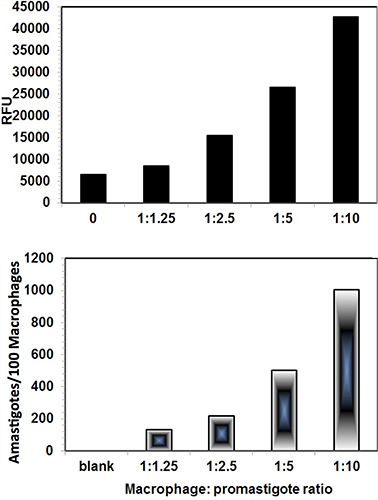
Figura 4. Confronto tra Digital-Image-Analysis-Direct-conteggio-Assay (pannello inferiore) e Parasite-Rescue-trasformazione-Assay (pannello superiore). Il macrofago: rapporto di 1:10 promastigote prodotto infezione ottimale. Entrambi hanno mostrato risultati comparabili. Il parassita-salvataggio test ha mostrato alcuni valori di fondo. Ogni mostra barra media dei valori duplicati.

Figura 5 THP1 cellule infettate con promastigoti leishmania da diversi THP1:. Rapporto promastigote. I risultati quantitativi come numero di amastigotes/100 THP1 cellule sono presentati nella figura 4.

Figura 6. Immagini digitali (fluorescente + DIC) di THP1 cellule infettate con Leishmania donovani amastigoti dopo il trattamento con standard anti-leishmanial farmaci per periodi di tempo diversi. Risultati sono stati quantificati come numero di cellule THP1 amastigotes/100 e utilizzati per calcolare la percentuale di crescita rispetto ai controlli non trattati e di determinare i valori di IC 50.

Figura 7. Confronto di Digital-Image-Analysis-Direct-conteggio-test e parassita-Rescue-trasformazione-test per l'anti-leishmanial screening di farmaci (Amophotericin B). I macrofagi infetti sono state trattate con diverse concentrazioni di standard anti-leishmanial farmaco per periodi diversi. IC 50 (mg / ml) i valori sono stati calcolati dalla curva dose-risposta per Excelfit. Clicca qui per ingrandire la figura .
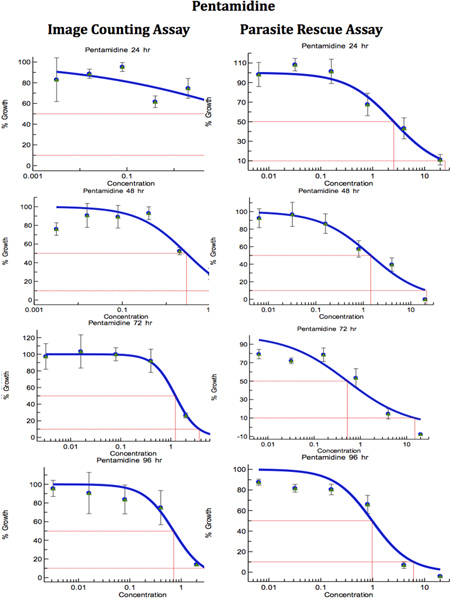
Figura 8. Confronto di Digital-Image-Analysis-Direct-conteggio-test e parassita-Rescue-trasformazione-test per unnti-leishmanial screening di farmaci (pentamidina). I macrofagi infetti sono state trattate con diverse concentrazioni di standard anti-leishmanial farmaco per periodi diversi. IC 50 (mg / ml) i valori sono stati calcolati dalle curve di risposta della dose da Excelfit. Clicca qui per ingrandire la figura .
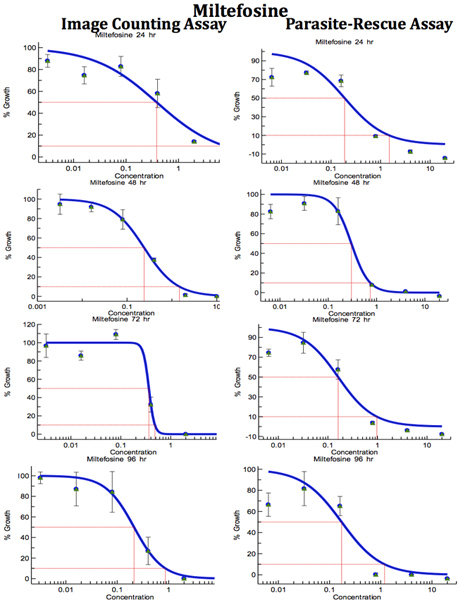
Figura 9. Confronto di Digital-Image-Analysis-Direct-conteggio-test e parassita-Rescue-trasformazione-test per l'anti-leishmanial screening di farmaci (Mitefosine). I macrofagi infetti sono state trattate con diverse concentrazioni di standard anti-leishmanial farmaco per periodi di tempo diversi. IC 50 (mg / ml) i valori sono stati calcolati dalle curve di risposta della dose da Excelfit.Clicca qui per ingrandire la figura .
| Drug Test | 24 ore di | 48 ore di | 72 ore a | 96 ore di | ||||
| IACA b | PRTA c | IACA b | PRTA c | IACA b | PRTA c | IACA b | PRTA c | |
| Amfotericina B | 0,24 ± 0,03 | 0,17 ± 0,01 * | 0,12 ± 0,04 | 0,20 ± 0,07 | 0,06 ± 0,01 | 0,06 ± 0,01 | 0,11 ± 0,03 | 0,10 ± 0,03 |
| Pentamidina | > 10 | 2,55 ± 1,16 * | 2,88 & plusmn; 0,58 | 1,43 ± 0,91 | 1,24 ± 0,35 | 1,52 ± 0,16 | 0,71 ± 0,63 | 0,98 ± 0,33 |
| Miltefosine | 0,38 ± 0,02 | 0,19 ± 0,08 * | 0,24 ± 0,06 | 0,30 ± 0,08 | 0,36 ± 0,02 | 0,16 ± 0,06 | 0,21 ± 0,15 | 0,17 ± 0,10 |
Tabella 1. Confronto di Digital-Image-Analysis-Direct-conteggio-test e parassita-Rescue-trasformazione-test per l'anti-leishmanial screening di farmaci. I macrofagi infetti sono state trattate con diverse concentrazioni di standard anti-leishmanial farmaco per periodi diversi. IC 50 (mg / ml) i valori sono stati calcolati dalle curve di risposta della dose da Excelfit (figure 7-9) un post Ore trattamento farmacologico,. B Conteggio IACA = Image Analysis e DirectTenore c PRTA = Parasite di soccorso e test di trasformazione. Valori indicati sono IC 50 (concentrazione del farmaco che provoca il 50% di inibizione della crescita parassita) come pg / ml e sono la media ± SD di almeno tre esperimenti. * Statisticamente differente (<0.05) rispetto ai valori di IC 50 con IACA.
Discussione
Ci sono diversi metodi disponibili per l'anti-leishmanial screening di farmaci sulla base di macrofagi amastigote modelli. Saggi può essere fatto con i macrofagi raccolti da cellule animali ospiti essudato cioè peritoneali (PEC), cellule monociti del sangue periferico (PBMC) 6 o midollo osseo macrofagi (BMM) o in linee cellulari monocitiche come mouse (J774 e RAW264.7 ) 7 e umano (THP1, U937, HL-60) 8 cellule monocitiche. I saggi, che utilizzano la divisione delle cellule ospiti, devono garantire che gli effetti confondenti di attività farmaco sia sul parassita e ospite numero di cellule sono considerate. I macrofagi differenziati primari raccolti da varie fonti, come i topi e ratti non sono dividendo in natura, ma queste preparazioni di cellule non possono avere popolazioni di cellule omogenee. Linee cellulari monocitiche cellule di derivazione sono omogenei in natura e sono un modello migliore per il macrofago-amastigote-screening. Su diverse linee cellulari monocitiche, differentiated THP1 cellule (umane acuta monocitica linea cellulare di leucemia) possono formare una non-divisione monostrato e di offrire una valida alternativa alle materie prime macrofagi isolati.
Il macrofago-amastigote di screening può essere fatto in diversi modi. Classica valutazione microscopica basata su cellule direttamente e parassita conteggio 9 è alta intensità di manodopera. L'assenza di automazione limita l'utilità di questo test. Conta delle cellule in termini di tempo e può dare determinazione imprecisa della valori di IC 50 poiché la determinazione della redditività parassita attraverso una procedura di colorazione è difficile. Molti coloranti fluorescenti e anticorpi monoclonali possono essere impiegati per i saggi di citometria di flusso 10, 11, ma questi saggi sono limitati a causa della minore sensibilità e limitazione di intervallo di tempo di trattamento terapeutico di un solo giorno. Ci sono diversi saggi reporter gene disponibili per quantificare la crescita di amastigoti intracellulari 12,13,14. Un automatlo screening ed può essere possibile utilizzando geni reporter, ma questi test hanno anche alcuni inconvenienti. Primo, la maggioranza di questi saggi richiedono la selezione dei farmaci per mantenere l'espressione episomale dei geni reporter, che non può essere ideale per un esperimento di screening di farmaci. Il modo con cui viene introdotto il gene reporter può anche influenzare le proprietà fisiologiche del parassita e hanno un impatto sul screening. Se il gene reporter è la parte di un plasmide episomale, la relativa uscita di reporter può dipendere dal numero di copie del plasmide trasfettato (che varia da cellula a cellula) piuttosto che l'attività del farmaco 14. Alcuni parassiti del reporter che sono trasformati parassiti non è necessario per mantenere la pressione selettiva del gene reporter, tuttavia, ci potrebbero essere conseguenze biologiche o interrompendo l'architettura genomico o solo dalla presenza delle proteine reporter straniero 15. Nei saggi basati qualche reporter gene, esistonoquestioni di attività sensibilità e sfondo 16. Ancora più importante, molti dei saggi di espressione genica giornalista, appositamente quello con GFP giornalista gene15, non possono distinguere tra i vivi e morti amastigoti intracellulari. Le prove basate sul gene reporter della luciferasi può discernere tra vivi e morti amastigoti intracellulari, ma substrato e tampone di lisi cellulare per questi test sono costosi per lo screening su larga scala 17. Per superare questi demeriti e le limitazioni di test di screening precedenti macrofagi amastigote-based, abbiamo sviluppato e ottimizzato da questo test parassita-salvataggio e trasformazione. Questo saggio è basato sulla THP1 cellule che hanno una buona omogeneità e sono non-dividendo in natura, come cellule ospiti.
Il Parasite-Rescue-Transformation Assay-saggio descritto qui è paragonabile al saggio basato sulla Digital-Image-Analysis-conteggio diretto delle amastigoti intracellulari. Microscopia a fluorescenza e DIC, digital imagingE di analisi differenziale ImageJ per il conteggio dei nuclei macrofagi ed i nuclei parassita hanno ulteriormente perfezionato il test microscopico conteggio. Catturare le immagini in luce filtra a fluorescenza e contrasto di interferenza differenziale (DIC) filtri hanno migliorato la qualità dell'immagine digitale per il conteggio più accurato dei parassiti intracellulari. Sia le immagini fluorescenti e DIC possono essere unite per ottenere le immagini digitali con contorni netti delle cellule macrofagiche e fluorescente nuclei intracellulare. I nuclei dei macrofagi e dei nuclei parassita può essere differenziato riconosciuto con ImageJ. Pertanto, sia Digital-Image-Analysis-Direct-conteggio-test e parassita-Rescue-trasformazione-test hanno il potenziale per l'automazione e l'applicazione su larga scala di screening. Le fasi critiche nel parassita-Rescue-trasformazione-Assay sono: (a) lavaggi ripetuti THP1 colture cellulari dopo esposizione a promastigoti Leishmania, per assicurare la rimozione quasi completa della non-internpromastigoti alized e (b), lisi controllata delle cellule infette THP1 con attacco SDS. Entrambe le fasi possono anche essere controllato con automazione e non dovrebbero compromettere con throughput del dosaggio. La seconda fase di lavaggio, dopo esposizione delle cellule infettate Leishmania THP1 ai farmaci di prova / composti rimuove i rimanenti non interiorizzate parassiti, se presente. The Parasite-Rescue-trasformazione-saggio offre vantaggi significativi rispetto esistenti microscopico, gene reporter e saggi di analisi di immagine. Il test è semplice, robusta, e riproducibile, può essere automatizzato per lo screening su larga scala e quindi dovrebbero avere importante applicazione nello screening di grandi librerie di composti per il nuovo anti-leishmanial scoperta di nuovi farmaci. Inoltre, il dosaggio può essere applicato anche per la valutazione clinica di infettività, nonché, isolati di laboratorio di Leishmania in vitro.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Il NCNPR-USDA-ARS scientifico accordo No. 58-6408-2-0009; CDMRP Award concessione # W81XWH-09-2-0093 dalla ricerca medica e US Army Materiel Command.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
| Forbolo 12-Myristate 13-acetato (PMA) | Sigma-Aldrich USA | P1585 | Necessario per la differenziazione delle cellule THP1. |
| Mezzo RPMI-1640 | Invitrogen | 23400021 | |
| Lab-Tek Sezione Sistema di scorrimento (16 Sezione) | Thermo Scientific Nunc | 178599 | |
| Chiari, a fondo piatto, a 96 pozzetti | BD Falcon | 353075 | Piastre per eseguire 96 pozzetti test piastra |
| Amfotericina B | Sigma-Aldrich USA | A4888 | Standard anti-leishmanial farmaco sciogliere in DMSO (2 mg / ml) |
| Pentamidina Isothionate Salt | Sigma-Aldrich USA | P 0547 | Standard anti-leishmanial farmaco sciogliere in DMSO (2 mg / ml) |
| Miltefosine | EMD Biosciences USA | 475841 | Standard anti-leishmanial farmaco dissolvono nel siero privo di mezzo RPMI-1640 (preparare fresco) (2 mg / ml) |
| Sodio stibogluconato | EMD Biosciences USA | 567565 | Standard anti-leishmanial farmaco preparare in RPMI-1640 con 4% FBS. (1 mg / ml) |
| Sodio dodecil solfato | Sigma-Aldrich USA | L 5750 | |
| Microscopio a fluorescenza | NIKON | ECLIPSE 90i | |
| Fluorescenza lettore di micropiastre | BMG | Polar Star Galaxy | |
| Mezzo di montaggio | Sigma-Aldrich USA | M 1289 | |
| unlamarBlue | ABD Serotec | BUF012 B | |
| SYBR Green I | Sigma-Aldrich USA | S 9430 | |
| Bicarbonato di Sodio | Sci Fisher. | 523500 | |
| Sodio piruvato | Sigma-Aldrich USA | P2256 | |
| 2-Mercaptoethanol | Sigma-Aldrich USA | M6250 | |
| Siero fetale bovino | Atlanta Biologicals | S11050H | |
| Tween 20 | Sigma-Aldrich USA | P9416 | |
| Tween 80 | Sigma-Aldrich USA | P6474 | |
| Triton X-100 | Sigma-Aldrich USA | T8787 | |
| NP-40 | Calbiochem | 492016 |
Riferimenti
- WHO. . Control of the leishmaniasis: report of a meeting of the WHO Expert Committee on the Control of Leishmaniasis. Xii, 22-26 (2010).
- Croft, S. L., Seifert, K., Yardley, V. Current scenario of drug development for leishmaniasis. Indian J. Med. Res. 123 (3), 399-410 (2006).
- Croft, S. L., Sundar, S., Fairlamb, A. H. Drug Resistance in Leishmaniasis. Clinical Microbiology reviews. 19 (1), 111-126 (2006).
- Mikus, J., Steverding, D. A simple colorimetric method to screen drug cytotoxicity against Leishmania using the dye AlamarBlue. Parasitology International. 48 (3), 265-269 (2000).
- Callahan, H. L., Portal, A. C., Devereaux, R., Grogl, M. An Axenic Amastigote System for Drug Screening. Antimicrob. Agents Chemother. 41 (4), 818-822 (1997).
- Seifert, K., Escobar, P., Croft, S. L. In vitro activity of anti-leishmanial drugs against Leishmania donovani is host cell dependent. J. Antimicrob. Chemother. 65 (3), 508-511 (2010).
- Kolodziej, H., Kiderlen, A. F. Antileishmanial activity and immune modulatory effects of tannins and related compounds on Leishmania parasitized RAW 264.7 cells. Phytochemistry. 66 (17), 2056-2071 (2005).
- Maia, C., et al. Infectivity of five different types of macrophages by Leishmania infantum. Acta Tropica. 103 (2), 150-155 (2007).
- Neal, R. A., Croft, S. L. An in vitro system for determining the activity of compounds against the intracellular amastigote form of Leishmania donovani. J. Antimicrob. Chemother. 14, 463-475 (1984).
- Abdullah, S. M., Flath, B., Presber, H. W. Comparison of different staining procedures for the flow cytometric analysis of U-937 cells infected with different Leishmania-species. J. Microbiol Methods. 37 (2), 123-138 (1999).
- Giorgio, C. D., et al. Flow Cytometric Detection of Leishmania Parasites in Human Monocyte-Derived Macrophages: Application to Antileishmanial-Drug Testing. Antimicrob Agents Chemother. 44 (11), 3074-3078 (2000).
- Mandal, S., et al. High throughput screening of Leishmania donovani clinical isolates against drug using a colorimetric β Lactamase assay. Indian J. Exp. Biol. 47 (6), 475-479 (2009).
- Chan, M. M. Y., Bulinski, J. C., Chang, K. P., Fong, D. A. Microplate assay for Leishmania amazonensis promastigotes expressing multimeric green fluorescent protein. Parasitol. Res. 89 (4), 266-271 (2003).
- Buckner, F. S., Wilson, A. J. Colorimetric assay for screening compounds against Leishmania Amastigote Grown in macrophages. Am. J. Trop. Med. 72 (5), 600-605 (2005).
- Sereno, D., et al. Advances and perspectives in Leishmania cell based drug-screening procedures. Parasitol. Int. 56 (1), 3-7 (2007).
- Gupta, S., Nishi, Visceral leishmaniasis: experimental models for drug discovery. Indian J. Med. Res. 133, 27-39 (2011).
- Roy, G., et al. Episomal and stable expression of the luciferase reporter gene for quantifying Leishmania spp. Infections in macrophages and in animal models. Mol. Biochem. Parasitol. 110 (2), 195-206 (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon