Method Article
Automatizzati high-throughput analisi comportamentali nelle larve Zebrafish
In questo articolo
Riepilogo
Il nostro laboratorio ha sviluppato un sistema di imaging automatizzato romanzo ad alta produttività che è utile per il rilevamento di diversi comportamenti differenti in 7 giorni di età zebrafish larve. Il sistema può essere usato per rilevare sottili cambiamenti nel comportamento dopo le larve sono stati esposti agli agenti tossici ambientali o farmaceutici.
Abstract
Abbiamo creato un sistema di imaging ad alta produttività romanzo per l'analisi del comportamento in 7 giorni di età larve di zebrafish in piastre a più corsie. Questo sistema misura i comportamenti spontanei e la risposta a uno stimolo avversivo, riportato alle larve attraverso una presentazione di PowerPoint. Le immagini registrate vengono analizzati con una macro ImageJ, che suddivide automaticamente i canali di colore, sottrae il fondo, e si applica una soglia di identificare il posizionamento individuale larve nelle corsie. Possiamo quindi importare le coordinate in un foglio di Excel per quantificare la velocità di nuotata, la preferenza per il bordo o lato della corsia, il comportamento riposo, thigmotaxis, distanza tra le larve, e il comportamento di evitamento. Sottili cambiamenti nel comportamento sono facilmente rilevabili con il nostro sistema, rendendolo utile per analisi comportamentali dopo l'esposizione alle sostanze tossiche o prodotti farmaceutici ambientali.
Introduzione
Zebrafish stanno diventando un modello popolare per le scienze genetiche, sviluppo e comportamentali 1-4. Si schiudono dalle loro chorions da 2-3 giorni dopo la fecondazione (DPF), sviluppare pienamente organi funzionanti ad 4-5 dpf, e presentano un gran numero di comportamenti di 7 dpf 5,6. Zebrafish larve sono ideali per le analisi high-throughput a causa delle loro piccole dimensioni 7,8. Il software è disponibile in commercio per le analisi automatizzate di comportamento larvale e adulto zebrafish 9-14. Tuttavia, questo software può essere costoso e ha opzioni limitate per la misurazione di comportamenti complessi di larve di zebrafish in piastre multi-pozzetto.
Abbiamo creato un sistema di imaging di alto-rendimento romanzo che è poco costoso da installare e in grado di quantificare una serie di comportamenti diversi in 7 dpf zebrafish larve 15,16. Il sistema consente di testare rapidamente ed efficientemente sottili anomalie del comportamento dopo l'esposizione embrionale ad un numero difarmaci e sostanze tossiche ambientali 16-18.
Il sistema è stato costruito utilizzando armadi in legno, che ospitano una fotocamera digitale nella parte superiore del mobile. La fotocamera rivolta verso il basso sul fondo del mobile in cui un computer portatile è collocato con lo schermo rivolto verso l'alto 15. Tempo lapse imaging viene utilizzato per catturare il posizionamento delle larve nelle corsie. Le larve può essere ospitato in un massimo di quattro piastre multi-pozzetto o più corsie che sono posizionati sulla parte superiore dello schermo del computer portatile. Usiamo una presentazione di PowerPoint come stimolo negativo a cui le larve risponde allontanandosi (evitamento) e nuotando verso il bordo (thigmotaxis) 15,17. Le immagini vengono importate in ImageJ in cui una macro automatico è usato per separare i canali di colore, sottrarre lo sfondo, e applicare una soglia per identificare larve individuale. Le coordinate sono elencate per ogni larva in ogni immagine e possono essere inseriti in un file Excel che usiamo per quantificare l'evasione e thigmotacomportamento xis, pesce a distanza di pesce, la velocità e la quantità di riposo 16 nuotare.
Protocollo
1. Raccolta di embrioni di zebrafish e Raising Larve
- Vetro pyrex piatti a base di erba "fake" (realizzato in lana verde) (Figura 1) devono essere inseriti i serbatoi all'alba e lasciati in per due ore al fine di raccogliere embrioni di zebrafish. I piatti di vetro contenenti gli embrioni devono essere gettati su un colino palmare e risciacquati con acqua deionizzata. Gli embrioni devono poi essere coltivate in acqua uovo. L'acqua uovo contiene 60 mg / L di Instant Ocean in acqua deionizzata e 0,25 mg / L di blu di metilene, che è utilizzato come un inibitore stampo.
- A seconda della ipotesi dell'esperimento individuale, gli embrioni possono essere trattati immediatamente o durante specifici stadi di sviluppo utilizzando sostanze tossiche o prodotti farmaceutici. Le sostanze tossiche e farmaceutici sono solitamente disciolti in DMSO (concentrazione 1.000 X) e dovrebbero essere ulteriormente diluiti direttamente nel mezzo acqua uovo.
- Durante il trattamento embrionale e larvale con farmaci o sostanze tossiches, le larve e gli embrioni possono essere alloggiati in piatti profondi Petri con una densità di circa 50-60 larve per 50 ml fino a quando le analisi comportamentali alle 7 dpf (soluzione di acqua uovo deve essere cambiata almeno ogni due giorni per evitare la crescita di funghi / batteri da embrioni morti).
2. Preparazione Stampi per analisi comportamentali
- Appositamente sviluppato stampi di plastica, che misurano 11,7 centimetri x 7,6 cm x 5 mm sono stati realizzati su misura in-house. Gli stampi sono necessari per creare corsie utilizzando agarosio che viene versato in piatti di plastica e singoli da Thermo Scientific. L'unico provvedimento ben piastre 12,4 centimetri x 8,1 centimetri x 1,2 cm.
- Gli stampi contengono cinque corsie in cui i lati sono inclinati a 60 °. Le corsie in stampi sono 3,5 mm di altezza con una base di 18 mm nella parte superiore, che è la più ampia, mentre la larghezza inferiore è 14 mm. C'è un divario 4 mm tra le corsie nello stampo (Figura 2).
- Per preparare le corsie versare 50 ml di fuso agarosio (0,8% di agarosio in deionizzared acqua con 60 mg / L Instant Ocean) in un unico piatto bene. Lo stampo deve essere messo poi molto lentamente sopra il liquido agarosio per eliminare qualsiasi formazione di bolle e può essere rimosso quando l'agarosio si è raffreddato (che richiede circa 45 min).
- Le corsie agarosio dovrebbero essere non prima di un giorno prima dell'esperimento comportamentale è da eseguire (per evitare l'agarosio essiccazione) Le corsie possono essere conservati a temperatura ambiente con i coperchi sulle stoviglie fino a circa 36 ore. Le corsie agarosio deve essere utilizzato solo per un esperimento e devono quindi essere eliminati.
3. Acquisizione Immagine
- Fino a 20 larve può essere collocato in ogni corsia delle piastre. Tipicamente 5 larve per corsia sono utilizzati per facilitare il monitoraggio più accurato della velocità nuotata e di ridurre il numero di larve che sono necessari per esperimento. Le corsie possono essere riempiti con acqua uovo con o senza farmaci o sostanze tossiche a seconda dell'esperimento. Tuttavia, corsie non dovrebbero essere filled su tutto il senso fino a quando essi sono posti in armadi di imaging, questo impedirà di overflow. Per coerenza, le larve dovrebbe avere un periodo di acclimatazione di dieci minuti dopo essi sono posti in stampi agarosio e posizionati sulla parte superiore dello schermo del computer portatile. In modo efficiente lo spostamento delle larve dalla piastra di Petri per l'agarosio corsia contribuirà a ridurre lo stress larve. Questo è più facile quando le larve sono alloggiati in vasche poco profonde o piatti di Petri.
- Gli armadi di imaging includono una fotocamera digitale Canon usato per fotografia time-lapse e un computer portatile. La telecamera deve essere posizionato nella parte superiore del mobile, in direzione del fondo del mobile in cui un computer portatile 15,6 pollici schermo deve essere posizionato con schermo rivolto verso l'alto (Figura 3). Quattro piastre devono essere posizionate a mano direttamente sulla parte superiore dello schermo del computer portatile. In questo momento le corsie vengano coronata con acqua uovo o trattamento chimico in modo che sia a livello con la parte superiore della corsia (per eliminare le ombre sui bordi della lAnes nelle immagini).
- Una presentazione PowerPoint è usato come stimolo negativo per le larve. In passato si spostano palle rosse hanno mostrato di larve di zebrafish in 6 o 12 piastre multi-pozzetto 15,17,18. La corrente PowerPoint inizia con uno sfondo bianco bianco per 15 min, seguiti da 15 minuti di una barra rossa movimento sulla metà superiore della piastra (Figura 4). Al fine di eliminare il surriscaldamento delle larve, è meglio per l'acquisto di un computer portatile con una temperatura di schermo che non va oltre i 28 ° C. Per evitare l'evaporazione del liquido all'interno delle corsie di agarosio, il tempo di imaging massimo deve essere mantenuta al di sotto di un'ora.
- La fotocamera digitale deve essere programmata per fotografia time-lapse, scattare foto ogni 6 secondi per un totale di 300 immagini per esperimento. Tuttavia, la frequenza e la lunghezza può essere regolata a seconda della sperimentazione e quantificazione comportamentale. In tempi di imaging prolungati passati sono stati impiegati con intervalli più lunghi tra ogni immagine. La cameruna può essere impostato ad una risoluzione più bassa per l'imaging a velocità il video (30 fotogrammi al secondo). Mentre la risoluzione inferiore limita le registrazioni per un unico piatto multiwell, le registrazioni video sono appropriate per l'imaging rapido gare di nuoto 15.
4. Image Analysis
- Le immagini devono essere aperti con ImageJ ed utilizzati con una macro che è stato scritto specificamente in-house. La macro divide automaticamente i canali di colore in modo che il colore rosso può essere rimosso, sottrae il fondo, applica una soglia, e identifica l'larve mediante analisi delle particelle. La macro più attuale per cinque analisi corsia larvale è Zebrafish_macro25k. Utilizzare le istruzioni nella macro per impostare il numero di immagini, di colore da sottrarre, soglia di immagine, ecc
- Dopo che tutte le immagini è gestita attraverso la macro ImageJ, verrà visualizzato un file di risultati e conterrà le coordinate x, y del larve individuale per ogni immagine con il numero dell'immagine e il numero di corsia.
- Il file dei risultati deve essere salvato in formato Excel e ordinati in base alla sfondo bianco vs mobile bar sfondo e poi il numero di bene. Un modello di Excel deve essere utilizzato, che ha equazioni costruite in che determina automaticamente il posizionamento di larve nei pozzi, la distanza tra le larve, velocità di movimento, e la quantità di riposo. Il modello di Excel più recente è 25ib creato nel Creton laboratorio, che è disponibile su richiesta. Grafici che mostrano i vari gruppi di trattamento dovrebbero essere integrati nel foglio Excel con t-test per il confronto tra i gruppi di trattamento e di controllo. Ulteriore analisi statistica può essere eseguita utilizzando SPSS.
Risultati
Nei nostri saggi precedenti, utilizzando la sfera di rimbalzo aversive stimolo, tipo selvatico larve che vengono trattati rispondere alla palla in movimento nuotando giù nel bene (comportamento di evitamento) e verso i bordi del pozzo (comportamento thigmotaxis) 15. Abbiamo poi confermato che il comportamento thigmotaxis in questo saggio è una misura del comportamento di ansia legati in zebrafish larve 17. Vi erano differenze significative nel movimento larve lontano dalla palla e la preferenza per il bordo rispetto allo sfondo bianco vuoto. Questi comportamenti sono stati confermati nel nostro nuovo test utilizzando la barra rossa in movimento e sono ancora più robusto 16. Inoltre, si può campionare un numero maggiore di comportamenti in un singolo saggio inclusi velocità nuotata, riposo, preferenza per l'estremità o lato del bene, e la distanza tra pesce (Figura 5). Larve controllo coltivato in acqua uovo mostrano un maggiore preferenza da giù nel piatto e sul bordo della corsia unopo sono presentati con uno stimolo negativo (spostamento barra rossa). Risultati simili si ottengono quando le larve sono coltivate in acqua uovo contenente 1 mg / ml di DMSO, un solvente che viene comunemente utilizzato per sciogliere i vari farmaci e sostanze tossiche come 1.000 x soluzioni stock.
Risultati rappresentativi sono mostrati in figura 5 in larve trattate con acqua uovo e DMSO (come controlli) e concentrazioni variabili di un pesticida organofosfati trovano negli alimenti non biologici. I risultati mostrati sono un campionamento da un esperimento. Tuttavia, se ripetuta, i risultati indicano che la velocità di nuotata e il comportamento thigmotaxis è alterato da basse concentrazioni di pesticidi organofosfati, che imitano i livelli del consumo alimentare umano 18.

Figura 1. Vasche di raccolta. Vetro pyrex piatti vengono utilizzati per raccogliere embryos dalle vasche dei pesci adulti. Coperchi dei piatti Pyrex sono state tagliate e inserite con griglie di plastica e filo verde è stato cucito sopra le griglie in plastica. Questo crea un ambiente fertile per la zebrafish adulto imitando l'ambiente naturale.

Figura 2. Muffa di plastica e agarosio corsie. A) Lo stampo viene mostrato a sinistra. 0,8% agarosio viene versata in un piatto uno-bene, lo stampo viene inserito lentamente e poi rimosso quando l'agarosio è raffreddato B) La piastra a destra mostra le corsie creati in agarosio dalla muffa di plastica..

Figura 3. Imaging Armadi armadi. Imaging erano specially costruito nel nostro laboratorio e utilizzata per analisi comportamentali high-throughput. Un megapixel fotocamera digitale 15 è stato collegato alla parte superiore del mobile rivolta verso il basso al fine di raccogliere le immagini lasso di tempo delle larve in lastre incanalatori sovrapposti dello schermo di un computer portatile. Tra le piastre e lo schermo vi è un diffusore di plastica che viene utilizzato per prevenire moiré nelle immagini raccolte.

Figura 4. Priorità bassa in bianco e PowerPoint aversive stimolo. Questa è la corrente di PowerPoint utilizzato per evocare cambiamenti comportamentali in larve di zebrafish. Esso fornisce robuste differenze comportamentali tra A) lo sfondo bianco e B) la barra rossa in movimento.
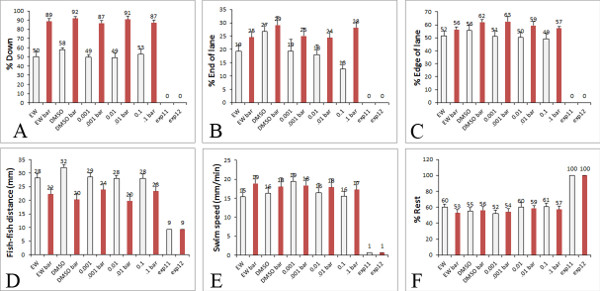
Figura 5. Comportamenti quantificati nel saggio ad alta prestazione. Esempio di comportamenti che sono quantificate dalla nostra analisi comportamentale all'interno del foglio Excel che usiamo per coordinate x, y del larve. Le barre bianche indicano i dati da larve esposte a uno sfondo bianco e le barre rosse indicano i dati del larve esposte al bar in movimento rosso in PowerPoint. I grafici si riferiscono alle misurazioni che possono essere ottenuti da analisi comportamentale A) percentuale di larve giù nella corsia, B) Percentuale di larve sull'estremità della corsia, C) Percentuale di larve sul bordo della corsia, D) Distanza tra pesce (mm), E) la velocità delle larve (mm / min), F) Percentuale resto del larve nuotare. Nei grafici riportati, dati va da treatmento delle larve con controllo DMSO e diverse concentrazioni di pesticida compresa tra 0,001 e 0,1 micron (livelli che si trovano comunemente nella dieta umana). Clicca qui per ingrandire la figura .
Discussione
Mentre stiamo migliorando continuamente il nostro nuovo metodo di analisi del comportamento, è sempre stato utile per la ricerca di evasione e di comportamento thigmotaxis in zebrafish larve 15. Molte prove sono state eseguite per ottimizzare i risultati del dosaggio, come il colore di stimolo utilizzato, il numero ideale di larve per corsia, e la lunghezza di dosaggio comportamentale. In precedenza, abbiamo usato piastre multi-pozzetto (con 6 o 12 pozzetti) 15,17,18. Tuttavia, di recente abbiamo creato lo stampo corsia romanzo di creare uno spazio più grande per il nuoto larve che ci permette di raccogliere un maggior numero di misure comportamentali in un singolo test 16 (Figura 5). Altre modifiche includono variazioni della PowerPoint indicato (movimento alterato o la lunghezza del test) e la dimensione delle corsie utilizzate (abbiamo anche stampi per vicoli più stretti).
Attualmente, questo sistema automatizzato ad alta velocità è unico nella sua capacità di misurare una vasta gamma di comportamenti in zebrafish larve, allo stesso tempo, come la velocità, l'evasione, la vicinanza alle altre larve, e thigmotaxis in piastre a più corsie. Risultati possono essere ottenuti rapidamente e un gran numero di larve possono essere analizzati al momento imaging. Il sistema è sia poco costoso da costruire e facile e veloce da installare. Un limite di questo sistema è che i movimenti 3-D non possono essere valutati in larve di zebrafish. I sistemi automatizzati che traccia zebrafish adulto hanno la capacità 3-D e in grado di identificare una gamma più ampia di comportamenti come il movimento verso l'alto o verso il basso all'interno della colonna d'acqua 10,19. Un'altra limitazione è che il nostro sistema di imaging non è attualmente ottimizzato per le analisi high-throughput a velocità video. L'imaging velocità Video è possibile quando si imposta la fotocamera a una risoluzione più bassa 15, ma questo limita l'analisi a un unico piatto.
Nell'uso del metodo appena creato "corsia", più parti del saggio dovevano essere eseguite in maniera precisa. Quando si posizionano le larve in tegli corsie, è fondamentale per assicurarsi che il livello del liquido è molto bassa fino a quando le piastre sono posizionate sulla parte superiore dello schermo del computer portatile. Se le corsie sono troppo pieno di liquido, le larve fuga nella periferia della piastra. Inoltre, quando si inserisce lo stampo in agarosio, bisogna fare attenzione ad abbassare lo stampo molto lentamente. Se lo stampo viene inserito troppo in fretta, le bolle si formano in agarosio e saranno identificati dalla J macro immagine come ulteriore larve. Si consiglia che, se le corsie di agarosio sono anche un paio di bolle, è meglio farne di nuovi.
In futuro, vorremmo ottimizzare la nostra analisi comportamentale per analizzare altri comportamenti complessi come l'apprendimento in larve di zebrafish e di esaminare come l'apprendimento possa essere influenzata dall'esposizione a sostanze tossiche e farmaci in sviluppo precoce. Attualmente stiamo lavorando su saggi che possono essere utili per analizzare il comportamento di apprendimento in cui i risultati comportamentali possono facilitare determinare quali aree del cervello sonocolpiti da certe sostanze tossiche o farmaci durante lo sviluppo. Test automatici sono stati sviluppati per misurare i comportamenti in zebrafish larve di 20 e di questi test di apprendimento può essere modificabile per high-throughput screening utilizzando la risposta di evitamento robusta in piastre a più corsie.
Proponiamo che questo test comportamentale potrebbe essere utilizzato in studi futuri per testare gli effetti sullo sviluppo di un gran numero di farmaci e sostanze tossiche. Tali studi potrebbero fornire una serie di informazioni sui fattori di rischio specifici e di contribuire alla definizione di orientamenti per la salute e la sicurezza migliori per le donne incinte e bambini.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari in competizione.
Riconoscimenti
Ringraziamo Sean Pelkowski per l'assistenza nella ottimizzazione del test comportamentali. Questo lavoro è stato sostenuto dal National Institute of Child Health e lo Sviluppo Umano, R01 HD060647 e il National Institute of Environmental Health Sciences, F32 ES021342 e R03 ES017755.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Instant Ocean | That Pet Place | 198262 | |
| Agarose | Fisher | BP1356-100 | |
| Methylene Blue | That Pet Place | 214325 | |
| Equipment | |||
| One well plates | Fisher | 12-565-493 | |
| Digital camera | Canon | EOS Rebel T1i | |
| Imaging Cabinets | WoodCraft Towers | ||
| Laptops | Acer Aspire | Any is good as long as it has a 15.6 in. LCD screen with 1366 x 768 pixel resolution and a brightness of 220 cd/m2. | |
| Camera Lens | Canon | EF-S 55 - 250 mm f/4.0 - 5.6 IS zoom lens | |
| Plastic diffuser | Pendaflex | 52345 | |
| Software | |||
| PowerPoint 2010 | Microsoft | ||
| ImageJ | NIH | http://rsb.info.nih.gov/ij/ | |
| Excel 2010 | Microsoft | ||
| Statistical software | SPSS 20 | ||
Riferimenti
- Gerlai, R., Lahav, M., Guo, S., Rosenthal, A. Drinks like a fish: zebra fish (Danio rerio) as a behavior genetic model to study alcohol effects. Pharmacol. Biochem. Behav. 67, 773-782 (2000).
- Selderslaghs, I. W. T., Hooyberghs, J., De Coen, W., Witters, H. E. Locomotor activity in zebrafish embryos: A new method to assess developmental neurotoxicity. Neurotoxicol. Teratol. 32, 460-471 (2010).
- Norton, W., Bally-Cuif, L. Adult zebrafish as a model organism for behavioural genetics. BMC Neuroscience. 11, 90 (2010).
- Levin, E. D., Cerutti, D., Buccafusco, J. J. Ch. 15. Methods of behavioral analysis in neuroscience. , (2009).
- Kimmel, C., Ballard, W., Kimmel, S., Ullmann, B., Schilling, T. Stages of embryonic development of the zebrafish. Dev. Dyn. , 203-253 (1995).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Kokel, D., Bryan, J., et al. Rapid behavior-based identification of neuroactive small molecules in the zebrafish. Nat. Chem. Biol. 6, 231-237 (2010).
- Rihel, J., Prober, D. A., et al. Zebrafish Behavioral Profiling Links Drugs to Biological Targets and Rest/Wake Regulation. Science. 327, 348-351 (2010).
- Cachat, J., Stewart, A., et al. Measuring behavioral and endocrine responses to novelty stress in adult zebrafish. Nat. Protoc. 5, 1786-1799 (2010).
- Cachat, J., Stewart, A., et al. Three-Dimensional Neurophenotyping of Adult Zebrafish Behavior. PLoS ONE. 6, e17597 (2011).
- Sledge, D., Yen, J. Critical duration of exposure for developmental chlorpyrifos-induced neurobehavioral toxicity. Neurotoxicol. Teratol. 33, 742-751 (2011).
- Stewart, A., Wu, N. Pharmacological modulation of anxiety-like phenotypes in adult zebrafish behavioral models. Prog. Neuropsychopharmacol. Biol. Psychiatry. 35, 1421-1431 (2011).
- Eddins, D., Cerutti, D., Williams, P., Linney, E., Levin, E. D. Zebrafish provide a sensitive model of persisting neurobehavioral effects of developmental chlorpyrifos exposure: comparison with nicotine and pilocarpine effects and relationship to dopamine deficits. Neurotoxicol. Teratol. 32, 99-108 (2010).
- Emran, F., Rihel, J., Dowling, J. A behavioral assay to measure responsiveness of zebrafish to changes in light intensities. J. Vis. Exp. (20), e923 (2008).
- Pelkowski, S., Kapoor, M., et al. A novel high-throughput imaging system for automated analyses of avoidance behavior in zebrafish larvae. Behav. Brain Res. 223, 135-144 (2011).
- Richendrfer, H., Pelkowski, S., et al. Assessment of developmental toxicity by automated analyses of behavior in zebrafish larvae. Unpublished observations. , (2012).
- Richendrfer, H., Pelkowski, S., Colwill, R. M., Creton, R. On the edge: pharmacological evidence for anxiety-related behavior in zebrafish larvae. Behav. Brain Res. 228, 99-106 (2012).
- Richendrfer, H. A., Pelkowski, S., Colwill, R., Creton, R. Developmental sub-chronic exposure to chlorpyrifos reduces anxiety-related behavior in zebrafish larvae. Neurotoxicol. Teratol. , (2012).
- Egan, R. J., Bergner, C. L., et al. Understanding behavioral and physiological phenotypes of stress and anxiety in zebrafish. Behav. Brain Res. 205, 38-44 (2009).
- Colwill, R., Creton, R., Kalluef, A., Stewart, A. . Zebrafish protocols for neurobehavioral research. 66, (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon