È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Quantificare singolo microvasi Permeabilità in Isolata Blood-perfusione Rat Lung Preparazione
In questo articolo
Riepilogo
La preparazione isolato polmone sangue perfuso rende possibile visualizzare le reti microvasali sulla superficie polmonare. Qui si descrive un metodo per quantificare permeabilità delle singole microvasi nei polmoni isolati utilizzando l'imaging di fluorescenza in tempo reale.
Abstract
La preparazione isolato polmone sangue perfuso è ampiamente usato per visualizzare e definire segnalazione in singoli microvasi. Accoppiando questa preparazione con la rappresentazione in tempo reale, diventa fattibile per determinare le variazioni di permeabilità delle singole microvasi polmonari. Qui descriviamo passi per isolare i polmoni di ratto e profumato con sangue autologo. Poi, abbiamo delineare misure per infondere fluorofori o agenti attraverso un microcatetere in una piccola regione del polmone. Utilizzando queste procedure descritte, abbiamo determinato un aumento della permeabilità nel ratto microvasi polmonari in risposta alle infusioni di lipopolisaccaride batterico. I dati hanno rivelato che lipopolisaccaride aumentata perdita di liquido in entrambi i segmenti venulare e capillare dei microvasi. Così, questo metodo permette di confrontare le risposte permeabilità tra segmenti vascolari e quindi, definisce alcun eterogeneità nella risposta. Mentre i metodi comunemente usati per definire la permeabilità polmonare richiedono post-elaborazione di campioni di tessuto polmonare, iluso di imaging in tempo reale evita questo requisito come evidente dal presente metodo. Così, la preparazione polmone isolato combinato con l'imaging in tempo reale offre diversi vantaggi rispetto ai metodi tradizionali per determinare la permeabilità microvascolare polmonare, ma è un metodo semplice per sviluppare e implementare.
Introduzione
Aumento della permeabilità microvascolare nei polmoni porta allo sviluppo di edema alveolare e gli scambi gassosi compromessa ed è un importante caratteristica del danno polmonare acuto (ALI) 1-3. Pertanto, le stime di permeabilità vascolare sono importanti nel definire l'entità del danno polmonare e l'efficacia degli interventi terapeutici proposti. Analisi gravimetrica come rapporto polmone gratuito sangue wet-to-dry e coefficiente di filtrazione microvascolare sono ampiamente utilizzati metodi per stimare la permeabilità 4,5. Altri metodi includono quantificare la ritenzione di sonde radioattive o fluorescenti nel tessuto polmonare 6-8. Tuttavia, i metodi di cui sopra richiedono un'elaborazione postexperiment di campioni di tessuto polmonare verso chiarire i dati di permeabilità. Inoltre, poiché un animale può essere utilizzato solo per un protocollo singolo trattamento, possono essere necessari grandi numeri di animali per uno studio completo. Una caratteristica comune dei metodi sopra descritti è che essi determinano la permeabilità vascolare medio pertutti i vasi sanguigni all'interno del campione di tessuto. Tuttavia, è noto che polmonari micro-e macro-vasi sono fenotipicamente diversi 9. Quindi, risposte permeabilità possono essere eterogenei tra i vari segmenti di flotta e 9,10. Così, quantificando la permeabilità media di tutti i vasi polmonari in un campione di tessuto può non riflettere adeguatamente tale eterogeneità.
Nella preparazione isolato polmone sangue perfuso, vasi sanguigni sulla superficie polmonare possono essere visualizzati tramite un microscopio verticale 4,11,12. In questo modo le risposte che caratterizzano in singoli vasi e, quindi, affrontare qualsiasi eterogeneità nelle risposte 13. Inoltre, utilizzando imaging di fluorescenza di microvasi, saggi di fluorescenza base possono essere incorporati. Inoltre, un microcatetere atriale sinistro può essere utilizzato per fornire agenti e sonde di fluorescenza nei vasi sanguigni 11,14. Microcatetere limita la consegna di una piccola regione polmonare, così exche propone solo i vasi sanguigni all'interno della regione agli agenti infusi e fluorofori. Questo consente a più piccole regioni dello stesso polmone da utilizzare per esperimenti separati, portando ad una riduzione complessiva animali necessari per uno studio.
L'imaging in tempo reale consente l'acquisizione dei cambiamenti dinamici nella vascolare e fluorescenza extravascolare singoli microvasi della preparazione polmone isolato. Così, per ogni microvasi all'interno di un campo immagine, cambiamenti nella fluorescenza durante l'infusione di fluorofori e washoff possono essere registrati, e quantificati in linea 14. Utilizzando i valori di fluorescenza massima e residua vascolare, un indice di permeabilità per ogni microvasi nel campo dell'imaging può essere determinato. Per determinare le variazioni di permeabilità in risposta ad agenti infiammatori o pregiudizievoli, l'agente desiderato può essere somministrato prima e poi l'indice di permeabilità determinato. Inoltre, il campo dell'immagine può essere regolato dovunque nella regione polmonare infusa dallomicrocatetere, consentendo così un elevato grado di flessibilità nella scelta della rete vascolare desiderato. Così, l'isolato di sangue perfuso preparazione del polmone in tandem con le immagini in tempo reale fornisce un modello sperimentale interessante per quantificare permeabilità dei microvasi polmonari singoli.
Protocollo
Tutti gli esperimenti condotti su animali erano come approvato dal Comitato Istituzionale cura degli animali e uso della University of Tennessee Health Science Center.
1. Tubing preparati perfusione Rat Lung
- Preparare un sistema di tubi con tubi Tygon (# 18) per la perfusione di sangue come mostrato in Figura 1. Collegare trasduttori di pressione (P23XL) e posizionare il tubo sul palco microscopio.
- Regolare la temperatura del bagno d'acqua a 37 ° C.
- Collegare l'ingresso del polmone e di uscita temporanea con tubo Tygon.
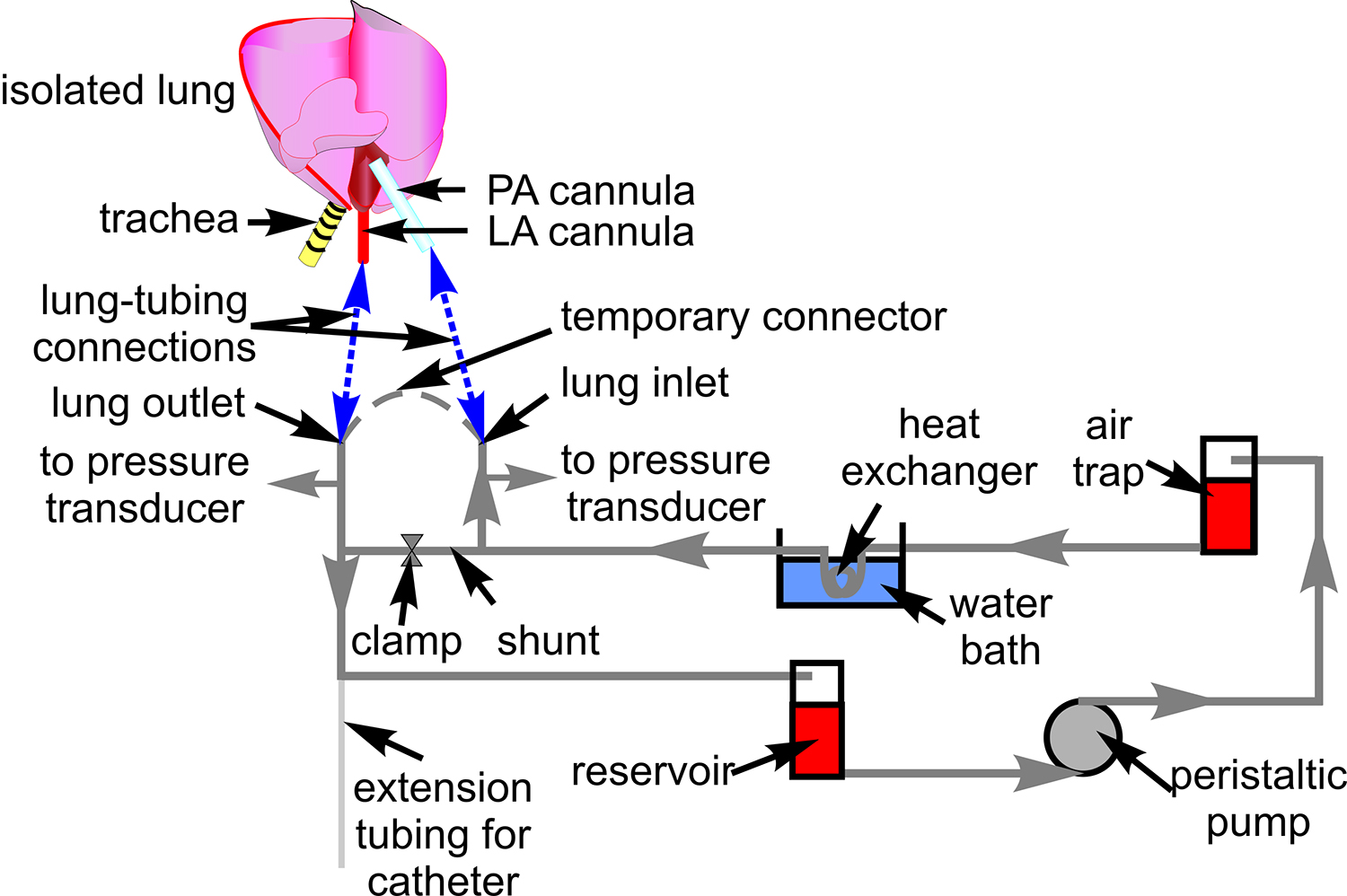
Figura 1. Tubo per perfusione di sangue. Lo schema mostra la configurazione tubo utilizzato per far circolare il sangue attraverso la preparazione polmone isolato. Inoltre, sono indicati i componenti associati attraverso il quale l'i tubis instradato. Uno schema di cuore e polmone è incluso per mostrare siti di collegamento tra il tubo e l'arteria polmonare (PA), e atriale (LA) cannula (linee blu tratteggiate) sinistra.
2. Preparazione dei polmoni Rat isolati
- Anestetizzare ratti (ratti maschi Sprague-Dawley, 250-300 g) con ketamina (80-100 mg / kg) e con xilazina (5-10 mg / kg). Dopo garantendo un piano chirurgico di anestesia, posizionare l'animale in posizione supina.
- Eseguire tracheostomia, inserire una cannula tracheale (PE-90) e fissare con sutura chirurgica.
- Infondere eparina (100-200 U) nel cuore mediante puntura cardiaca (21 G ago a farfalla), attendere 60 secondi e il sangue exsanguinate (~ 12-15 ml di sangue).
- Preparare due cannule (tubi Tygon, 3 mm di diametro, lunghi 4 centimetri; svasati a una estremità) e riempire con soluzione fisiologica.
- Eseguire una toracotomia. Fare un'incisione (3 mm) sul ventricolo destro e far scorrere l'estremità svasata di una cannula nell'incisione verso la polmonarearteria. Fissare cannula dell'arteria polmonare con suture chirurgiche.
- Incidere (3 mm) all'apice del ventricolo sinistro e far scorrere l'estremità svasata della seconda cannula nell'incisione. Guida la cannula in atrio sinistro. Fissare cannula al ventricolo sinistro con un nastro ombelicale (2 mm di larghezza).
- Sezionare qualsiasi tessuto connettivo, e rimuovere il polmone e cuore insieme alle cannule allegate. Posizionare polmone e cuore su un piatto di Petri. Riposizionare il polmone modo che la superficie diaframmatica è in cima. I tre cannule devono affrontare la stessa direzione.
- Posizionare la preparazione polmone in una fase che può essere manipolata nelle direzioni XY. Ogni fase che viene con un microscopio può essere modificato per tenere il tubo o una fase fatta su misura, se necessario.
3. Perfusione sanguigna dei polmoni Rat isolati
- Mescolare il sangue dissanguato con albumina uguale volume (5%) soluzione e aggiungere al serbatoio. Avviare la pompa peristaltica e impostare il flusso rmangiato a 14 ml / min. Lasciare che il sangue per riempire il tubo.
- Con lo shunt aperto, rimuovere il connettore di ingresso-uscita del polmone temporaneo. Attaccare l'arteria polmonare e sinistra cannula atriale all'ingresso polmone e di uscita, rispettivamente. Assicurarsi che non ci siano bolle d'aria nel tubo.
- Collegare la cannula tracheale di un terzo trasduttore di pressione (P23XL). Gonfiare polmoni con il 30% di ossigeno attraverso la cannula tracheale e mantenere la pressione alle 5 cm H 2 O.
- Chiudere lo shunt con un morsetto per iniziare perfusione polmonare. Mantenere arteria polmonare e di sinistra pressioni atriali a ~ 10 e il 3 cm H 2 O, rispettivamente.
4. Preparazione del polmone per microvascolare Infusione
- Sollevare la parte posteriore del tubo di estensione per il catetere di sopra del livello del polmone e sicuro.
- Preparare un catetere di infusione con l'inserimento di circa 30 cm di 40 cm di lunghezza tubo PE10 in un tubo PE90 ~ 30 cm di lunghezza. Collegare l'estremità esposta del tubo PE10 di un ago (30 G) atached ad una siringa (1 cc).
- Inserire la combinazione catetere nella parte posteriore sollevata del tubo di estensione. Guida la combinazione catetere attraverso l'atrio sinistro e nei polmoni finché non incontra resistenza. Quindi, spingere il catetere PE10 solo ulteriormente nei polmoni finché non incontra resistenza. Si noti che l'applicazione di una forza eccessiva durante l'inserimento del catetere ferire il polmone.
- Riempire la siringa da 1 cc con soluzione di Ringer e legarsi a una pompa a siringa. Impostare la velocità di infusione a 10 ml / min.
- Al sito di infusione diventerà chiaro rispetto al resto del polmone.
- Inumidire il polmone con soluzione salina e coprire il polmone con involucro di plastica con un foro abbastanza grande per lasciare il sito di infusione scoperto.
- Tampone del grasso rubinetto sul fondo di un O-ring (misura) e posizionare un vetrino di vetro (# 1.5, 22 mm di diametro) sul fondo della O-ring. Posizionare delicatamente l'O-ring con il vetrino sul sito di infusione. Fissare l'O-ring con una Hol provetta normader. La combinazione coprioggetto / O-ring non distorce le strutture alveolari sotto di esso, come recentemente riportato 15.
- Posizionare un obiettivo (20X) di un microscopio a fluorescenza sopra l'O-ring e concentrarsi sulla superficie polmonare.
5. Imaging fluorescente Dextran transito attraverso microvasi
- Preparare il microscopio per l'imaging FITC fioritura.
- Selezionare una regione per essere ripreso e acquisire immagini alla velocità di 1/minuto utilizzando software di acquisizione immagini.
- Iniziare infusione di FITC-destrano 20 kD (0,5 mg / ml) utilizzando la pompa a siringa. Fluorescenza nei vasi sanguigni aumenterà gradualmente e raggiungere un massimo. Continuare infusione per 60 min.
- Quindi, passare a infusione di Ringer per lavare via la fluorescenza luminale. Mantenere infusione per oltre 10 min. Continua l'acquisizione di immagini a 1/min durante il lavaggio-off.
6. Image Analysis
- Aprire il file di acquisizione delle immagini.
- Regioni postodi interessi per microvasi all'interno della cornice dell'immagine.
- Riprodurre il file immagine del fotogramma per fotogramma e registrare l'intensità di fluorescenza a ciascuna regione di interesse per tutti i fotogrammi.
- Tracciare la variazione di intensità di fluorescenza per ogni regione di interesse in funzione del tempo.
- Quantificare la massima intensità di fluorescenza e l'intensità di fluorescenza residua dopo 10 min di washoff.
- Calcolare il rapporto di massima intensità di fluorescenza residua in ogni regione di interesse per ottenere l'indice di permeabilità per microvasi quella regione di interesse.
Risultati
Un isolato preparazione polmone sangue perfuso collegato al tubo per perfusione e relative apparecchiature è mostrato in Figura 2. A scopo dimostrativo, abbiamo usato un ratto Sprague Dawley, se le procedure qui descritte possono essere utilizzati con qualsiasi specie di ratto. Infusioni attraverso un microcatetere atriale sinistra raggiungono solo una piccola regione del polmone. La regione infuso può essere identificato dal scolorimento infusione indotta (Figura 3). La preparazione ...
Discussione
La preparazione isolato polmone sangue perfuso accoppiato con immagini in tempo reale fornisce un semplice strumento per la determinazione delle variazioni di permeabilità in microvasi polmonari singoli. Abbiamo applicato questo metodo per definire cambiamenti di permeabilità in risposta alle infusioni di LPS. I nostri dati indicano chiaramente che LPS infusione provocato un aumento della permeabilità microvascolare. Inoltre, i dati indicano anche che i cambiamenti di permeabilità indotte da LPS erano simili in entr...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli studi sono stati supportati da NIH HL75503 a KP.
Materiali
| Name | Company | Catalog Number | Comments |
| Tygon Tubing | Fisher Scientific | #18 | |
| Pressure Transducer | Data Sciences International | P23XL | Need quantity 3 |
| Butterfly Needle | Greiner Bio-One | 450081 | 21 G |
| Peristaltic pump | Cole Parmer | Masterflex L/S | |
| PE-90 tubing | Becton Dickinson | 427421 | 30 cm needed |
| PE-10 tubing | Becton Dickinson | 427401 | 40 cm needed |
| Syringe Pump | Braintree Scientific | BS8000 | |
| O-ring | Custom made with a 20 mm diamter hole and a handle to secure O-ring to holder | ||
| Upright fluorescence microscope | Olympus America | BX61WI | |
| Image Acquisition Software | Molecular Devices | Metamorph | |
| FITC Dextran 20KD | Sigma Aldrich | 0.5 mg/ml (A dextran of different molecular size can be selected, if trial experiments indicate its suitability based on the calculated permeability index values) | |
| Lipopolysaccharide | Sigma Aldrich | Serotype 0111:B4 |
Riferimenti
- Ware, L. B., Matthay, M. A. The acute respiratory distress syndrome. N Engl J Med. 342, 1334-1349 (2000).
- Matthay, M. A., et al. The acute respiratory distress syndrome. J Clin Invest. 122, 2731-2740 (2012).
- Bhattacharya, J., Matthay, M. A. Regulation and repair of the alveolar-capillary barrier in acute lung injury. Annu Rev Physiol. 75, 593-615 (2013).
- Parthasarathi, K., et al. Connexin 43 mediates spread of Ca2+-dependent proinflammatory responses in lung capillaries. J Clin Invest. 116, 2193-2200 (2006).
- Parthasarathi, K., Bhattacharya, J. Localized Acid instillation by a wedged-catheter method reveals a role for vascular gap junctions in spatial expansion of Acid injury. Anat Rec (Hoboken). 294, 1585-1591 (2011).
- Gorin, A. B., Stewart, P. A. Differential permeability of endothelial and epithelial barriers to albumin flux. J Appl Physiol Respir Environ Exerc Physiol. 47, 1315-1324 (1979).
- Boutoille, D., et al. FITC-albumin as a marker for assessment of endothelial permeability in mice: comparison with 125I-albumin. Exp Lung Res. 35, 263-271 (2009).
- Thorball, N. FITC-dextran tracers in microcirculatory and permeability studies using combined fluorescence stereo microscopy, fluorescence light microscopy and electron microscopy. Histochemistry. 71, 209-233 (1981).
- Stevens, T. Functional and molecular heterogeneity of pulmonary endothelial cells. Proc Am Thorac Soc. 8, 453-457 (2011).
- Ofori-Acquah, S. F., et al. Heterogeneity of barrier function in the lung reflects diversity in endothelial cell junctions. Microvasc Res. 75, 391-402 (2008).
- Kandasamy, K., et al. Real-time imaging reveals endothelium-mediated leukocyte retention in LPS-treated lung microvessels. Microvasc Res. 83, 323-331 (2012).
- Kandasamy, K., et al. Lipopolysaccharide induces endoplasmic store Ca2+-dependent inflammatory responses in lung microvessels. PloS One. 8, (2013).
- Qiao, R. L., Bhattacharya, J. Segmental barrier properties of the pulmonary microvascular bed. J Appl Physiol. 71, 2152-2159 (1991).
- Parthasarathi, K. Endothelial connexin43 mediates acid-induced increases in pulmonary microvascular permeability. Am J Physiol Lung Cell Mol Physiol. 303, (2012).
- Wu, Y., Perlman, C. E. In situ methods for assessing alveolar mechanics. J Appl Physiol 1985. 112, 519-526 (2012).
- Kuebler, W. M., et al. A novel signaling mechanism between gas and blood compartments of the lung. Journal Clin Invest. 105, 905-913 (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon