JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
고립 된 혈액 관류 쥐 폐 준비에 단일 미세 혈관 투과성의 양을
요약
고립 된 혈액 관류 폐 준비는 폐 표면에 미세 혈관의 네트워크를 시각화하는 것이 가능합니다. 여기에서 우리는 실시간 형광 이미징을 사용하여 격리 된 폐의 단일 미세 혈관의 투과성을 정량화하는 방법을 설명합니다.
초록
고립 된 혈액 관류 폐 준비 널리 시각화하고 하나의 미세 혈관에 신호를 정의하는 데 사용됩니다. 실시간 이미징이 혼합물을 결합함으로써, 각각의 폐의 미세 혈관 투과성의 변화를 결정하기 위하여 가능해진다. 여기에서 우리는 쥐의 폐를 분리하고자가 혈액을 perfuse하는 단계를 설명합니다. 다음, 우리는 작은 폐 영역으로 microcatheter를 통해 형광 또는 대리인을 주입하는 단계를 설명합니다. 설명이 절차를 사용하여, 우리는 박테리아 리포 폴리 사카 라이드의 주입에 대한 응답으로 쥐의 폐의 미세 혈관의 투과성이 증가 결정. 데이터는 리포 폴리 사카 라이드가 모두 세정맥과 모세 혈관의 미세 혈관의 세그먼트에 걸쳐 유체 누출을 증가 것으로 나타났습니다. 따라서,이 방법은 가능한 혈관 세그먼트 구비 투과성 응답과 비교함으로써, 어떤 응답 이질성을 정의 할 수있다. 폐 투과성을 정의하기 위해 일반적으로 사용되는 방법으로는 폐 조직 샘플의 후 처리를 필요로하지만실시간 이미징의 사용은 본 방법에서 명백한 바와 같이 이러한 요구를 미연에 방지한다. 따라서, 실시간으로 영상과 함께 격리 된 폐 준비는 폐의 미세 혈관의 투과성을 결정하는 기존의 방법에 비해 여러 가지 장점을 제공합니다, 아직 개발하고 구현하는 간단한 방법입니다.
서문
폐에 증가 된 미세 혈관의 투과성은 폐포 부종과 손상 가스 교환의 개발에 이르게 및 급성 폐 손상 (ALI) 1-3의 주요 특징입니다. 따라서, 혈관 투과성의 평가는 폐 손상과 제안 된 치료 적 개입의 효과의 범위를 정의하는 데 중요합니다. 혈액 무료 폐 습윤 건조 비율과 미세 혈관의 여과 계수와 같은 중량 분석 널리 투자율 4.5을 추정하는 방법을 사용합니다. 다른 방법은 폐 조직 6-8 방사성 형광 프로브의 유지를 정량화 있습니다. 그러나, 상기 방법은 투자율 데이터 해명 향해 폐 조직 샘플 postexperiment 가공을 필요로한다. 동물은 단일 치료 프로토콜에 대해서만 이용 될 수 있기 때문에 더욱, 큰 동물 번호는 완전한 연구를 위해 필요할 수도있다. 상기 방법의 일반적인 특징은 그들이 뜻 혈관 투과성을 결정한다는 것이다조직 샘플 내의 모든 혈관. 그러나, 잘 폐 마이크로 및 매크로 혈관 9 표현형 달라 확립된다. 따라서, 투과성 반응뿐만 아니라 9,10 다양한 용기 세그먼트 사이에서 이기종 수 있습니다. 따라서, 조직 샘플에있는 모든 폐 혈관의 평균 투자율을 정량화하는 것은 적절이 이질성을 반영하지 않을 수 있습니다.
절연 혈액 관류 폐 제제에서, 폐 표면에 혈관 직립 현미경 4,11,12 의해 시각화 될 수있다. 이 응답 (13)에서 임의의 이질성을 어드레싱, 따라서 단일 혈관의 특징 인 응답을 가능하게하고. 또, 미세 혈관의 형광 이미징을 이용하여 형광 분석법을 기반으로 통합 될 수있다. 또한, 좌심방 microcatheter 혈관 11,14으로 에이전트 및 형광 프로브를 전달하기 위해 사용될 수있다. microcatheter 작은 폐 영역에 배달 제한, 따라서 전주입 에이전트 및 형광에 지역 내에서만 혈관을 포즈. 이것은 동일한 폐 내의 체류 소 영역이 연구에 필요한 동물에서 전체적인 감소로 이어지는 별도의 실험에 사용되는 것을 허용한다.
실시간 영상은 혈관과 분리 된 폐 준비의 하나의 미세 혈관의 혈관 외 형광의 역동적 인 변화를 캡처 할 수 있습니다. 따라서, 이미지 필드 내의 각각의 미세 혈관에 대해, 형광체 및 washoff의 주입 동안 형광의 변화를 기록하고, 오프라인 (14)을 정량 할 수있다. 최대 및 잔류 혈관 형광의 값을 사용하여, 촬상 필드 내의 각 미세 혈관 투과성에 대한 인덱스가 결정될 수있다. 염증성 또는 유해한 제제에 응답 투자율 변화를 결정하기 위하여, 원하는 에이전트 제 투여 될 수 후 투자율 인덱스가 결정. 또, 이미지 필드는 주입에 의해 폐 영역 내의 아무 설정할 수microcatheter, 따라서 원하는 혈관 네트워크를 선택에서 높은 수준의 유연성을 가능하게한다. 따라서, 실시간으로 영상과 연계하여 고립 된 혈액 관류 폐 준비는 단일 폐의 미세 혈관의 투과성을 정량화 할 수있는 매력적인 실험 모델을 제공합니다.
프로토콜
테네시 건강 과학 센터의 대학의 기관 애니멀 케어 및 사용위원회에 의해 승인 된 동물에서 수행 모든 실험이었다.
관류 쥐 폐 준비를위한 1. 관
- 그림 1에서와 같이 압력 변환기 (P23XL)를 연결합니다. 혈액 관류에 대한 타이곤 튜브 (# 18)와 튜브 시스템을 준비하고 현미경 단계에 튜브를 배치합니다.
- 37 ° C의 물을 욕조의 온도를 설정
- 폐의 입구를 연결하고 타이곤 튜브와 함께 일시적으로 출구.
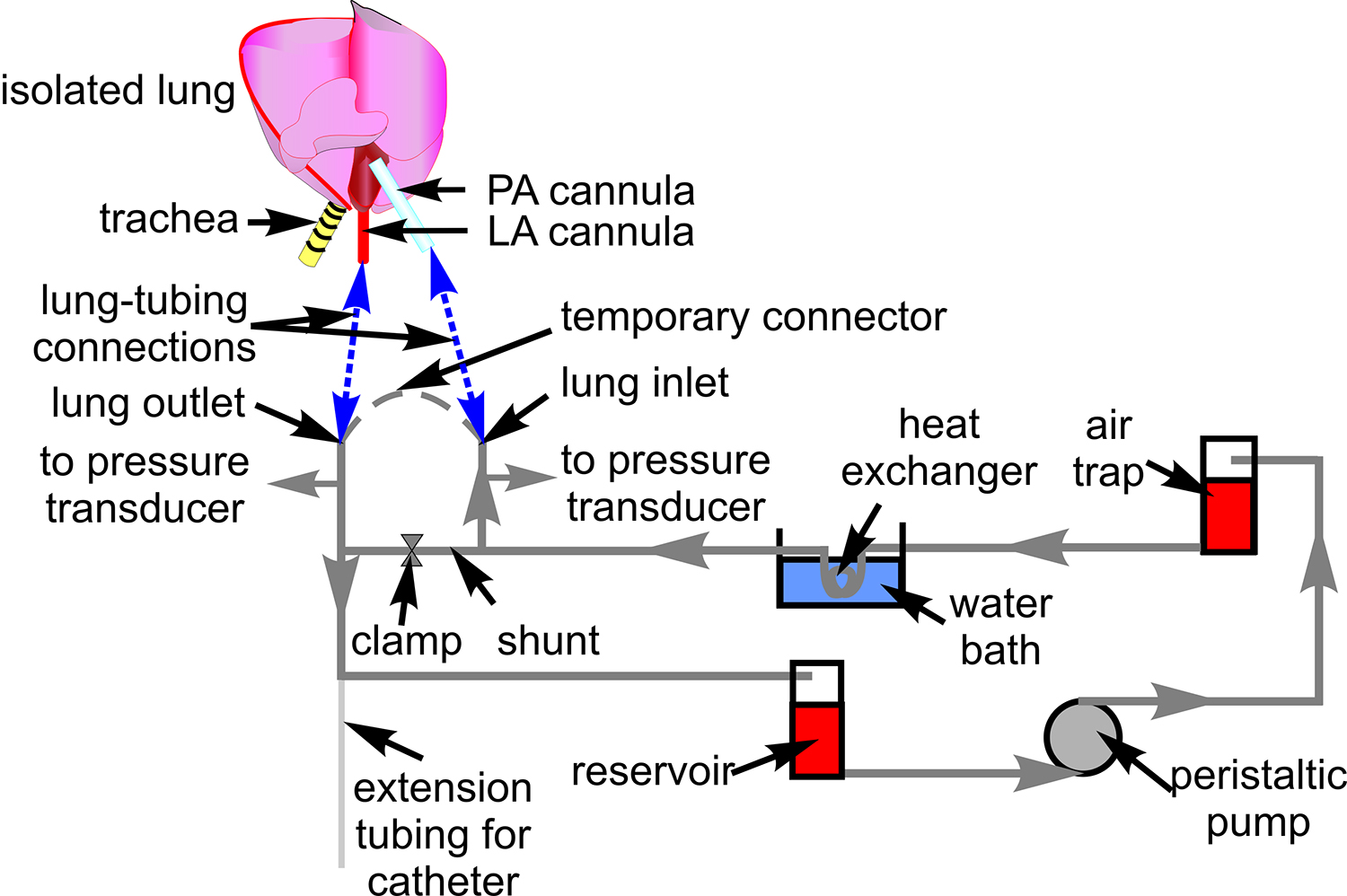
그림 1. 혈액 관류 관. 회로도는 격리 된 폐 준비를 통해 혈액 순환에 사용되는 배관 설치를 보여줍니다. 또한 관련된 구성 요소가 있습니다 표시되는 통해 튜브 나의 라우팅. 심장과 폐의 회로도는 튜브 및 폐동맥 (PA)의 접속 위치를 표시하기 위해 포함, 심방 (LA) 정맥 (파란색 점선)에 남아 있습니다.
고립 된 쥐의 폐의 2. 준비
- 케타민 (80 ~ 100 ㎎ / ㎏)과과 자일 라진 (5 ~ 10 ㎎ / ㎏)와, 쥐 (250-300그램 남성 흰쥐)를 마취. 마취의 수술 비행기를 확인한 후, 앙와위에서 동물을 배치합니다.
- 기관 절개를 수행, 기관 캐 뉼러 (PE-90)를 삽입하고 수술 봉합사로 고정.
- 심장 천자 (21 G 나비 바늘)에 의해 심장에 헤파린 (100 ~ 200 U)를 주입, 60 초 및에게서 피를 뽑다 혈액 (~ 12 ~ 15 ㎖의 혈액)을 기다립니다.
- 두 캐 뉼러 (, 4 cm 길이, 타이곤 튜브 3 mm 직경의 한쪽 끝에 플레어)를 준비하고 식염수로 채우십시오.
- 개흉술을 수행합니다. 우심실에 절개 (3 mm)를 확인하고 폐쪽으로 절개로 정맥의 플레어 끝을 밀어동맥. 봉합 수술과 폐 동맥에 정맥을 고정합니다.
- 좌심실의 정점 (3 mm)를 절개하고 절개로 두 번째 정맥의 플레어 끝을 밀어 넣습니다. 좌심방으로 정맥을 안내합니다. 제대 테이프 (2 mm 폭)과 좌심실에 캐 뉼러를 고정합니다.
- 모든 결합 조직을 해부하고, 첨부 된 캐 뉼러와 함께 폐와 심장을 제거합니다. 배양 접시에 폐와 심장을 놓습니다. 횡격막 표면 위에 있도록 폐의 위치를 조정합니다. 세 캐 뉼러는 동일한 방향에 직면한다.
- XY 방향으로 조작 할 수있는 단계에 폐 준비를 놓습니다. 현미경으로 오는 모든 단계는 튜브 또는 필요한 경우, 내장 맞춤 제작 단계를 유지하기 위해 수정 될 수있다.
고립 된 쥐의 폐의 3. 혈액 관류
- 같은 부피의 알부민 용액 (5 %)로 exsanguinated 혈액을 혼합하고 저장을 추가 할 수 있습니다. 연동 펌프를 시작하고 흐름의 R 설정14 ㎖ / 분으로 먹었다. 혈액 튜브를 채울 수 있습니다.
- 션트을 열어 둔 임시 폐 입구 출구 커넥터를 제거합니다. 각각 폐의 입구와 출구에 폐동맥과 왼쪽 심방 정맥을 연결합니다. 튜브에 기포가 없는지 확인합니다.
- 제 3 압력 변환기 (P23XL)에 기관의 정맥을 연결합니다. 기관 캐뉼라를 통해 30 %의 산소와 폐를 팽창시키고 5cm의 H 2 O에 압력을 유지
- 폐 관류를 시작하는 클램프 션트을 닫습니다. 폐동맥 각각 10과 3 개 cm H 2 O ~에서 좌심방의 압력을 유지한다.
4. 미세 혈관 주입을위한 폐 준비
- 폐 및 보안의 수준 위의 카테터의 확장 튜브의 후단을 올립니다.
- ~ 길이 30cm PE90 튜브에 40 cm 길이 PE10 튜브의 약 30 센티미터 삽입하여 주입 카테터를 준비합니다. 바늘 (30 G)에서에 PE10 튜브의 노출 끝을 연결합니다주사기 (1 CC)에 블.
- 확장 튜브의 제기 후 단부에 카테터 조합을 삽입합니다. 이 저항을 만날 때까지 좌심방을 통해 폐에 카테터 조합을 안내합니다. 이 저항을 충족 할 때까지, 폐에 더 혼자 PE10 카테터를 밀어 넣습니다. 카테터를 삽입 할 때 과도한 힘을 적용하면 폐를 손상되므로주의.
- 링거액과 함께 1 CC의 주사기를 입력하고 주사기 펌프에 연결합니다. 10 μL / min으로 주입 속도를 설정합니다.
- 주입 사이트는 폐의 나머지 부분에 비해 창백 될 것입니다.
- 식염수로 폐를 적셔 발견 주입 사이트를 떠날 정도로 큰 구멍을 가진 플라스틱 포장으로 폐를 포함한다.
- O-링 (맞춤 제작)의 바닥에 약간의 꼭지 그리스를 면봉 O-링의 바닥에 유리 커버 슬립 (# 1.5, 22mm 직경)를 배치합니다. 부드럽게 주입 사이트의 커버 슬립과 O-링을 배치합니다. 표준 테스트 튜브 홀리와 O-링을 고정데르. 최근 15를보고 커버 슬립 / O-링의 조합은, 그 아래 폐포 구조를 왜곡하지 않습니다.
- O-링 위의 형광 현미경의 목적 (20X)를 놓고 폐 표면에 초점을 맞 춥니 다.
미세 혈관을 통해 5. 이미징 형광 덱스 트란 교통
- 영상 FITC 개화에 대한 현미경을 준비합니다.
- 이미지에 표시 할 영역을 선택하고, 이미지 수집 소프트웨어를 사용하여 1/minute의 속도로 이미지를 수집.
- 주사기 펌프를 사용하여 FITC-덱스 트란 20 kD의 (0.5 ㎎ / ㎖)의 주입을 시작합니다. 혈관에 형광이 점차 증가하고 최대에 도달 할 것입니다. 60 분 동안 주입을 계속합니다.
- 그런 내강 형광을 씻어 링거 주입으로 전환합니다. 10여 분 동안 주입을 유지한다. 워시 오프 동안 분당 1에서 이미지 수집을 계속합니다.
6. 이미지 분석
- 이미지 수집 파일을 엽니 다.
- 장소 지역이미지 프레임 내의 미세 혈관에 관심.
- 이미지 파일을 프레임을 재생하고 모든 프레임에 대한 관심의 각 영역에서의 형광 강도를 기록한다.
- 시간의 함수로서 각각의 관심 영역에 대한 형광 강도의 변화를 그린다.
- 최대 형광 강도 및 washoff 10 분 후의 잔류 형광 강도를 계량화한다.
- 관심의 지역과 관련된 미세 혈관의 투과성 인덱스를 얻기 위해 각 관심 영역에서 잔류 형광 강도에 최대의 비율을 계산합니다.
결과
관류 배관 및 관련 장비에 연결된 절연 혈액 관류 폐 제조는도 2에 도시된다. 본 명세서에 기재된 방법은 랫트 종으로 이용 될 수 있지만 설명을 위해, 우리는 스프 라그 돌리 래트를 사용 하였다. 좌심방 microcatheter 통해 주입은 폐의 작은 영역에 도달한다. 주입 영역 주입 유도 탈색 (도 3)에 의해 식별 될 수있다. 실시간 이미징 위치로 폐 제제는도 4에 도?...
토론
실시간 영상과 함께 고립 된 혈액 관류 폐 준비는 단일 폐의 미세 혈관의 투과성 변화의 측정을위한 간단한 도구를 제공합니다. 우리는 LPS의 주입에 대한 응답으로 투자율 변화를 정의하려면이 방법을 적용했다. 우리의 데이터는 명확하게 LPS 주입은 미세 혈관 투과성의 증가를 야기하는 것이 좋습니다. 또한, 데이터는 LPS에 의해 유도 투자율 변화 세정맥과 모세 혈관에서 모두 유사 하였다 것을 ?...
공개
저자가 공개하는 게 없다.
감사의 말
연구 KP에 NIH HL75503에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Tygon Tubing | Fisher Scientific | #18 | |
| Pressure Transducer | Data Sciences International | P23XL | Need quantity 3 |
| Butterfly Needle | Greiner Bio-One | 450081 | 21 G |
| Peristaltic pump | Cole Parmer | Masterflex L/S | |
| PE-90 tubing | Becton Dickinson | 427421 | 30 cm needed |
| PE-10 tubing | Becton Dickinson | 427401 | 40 cm needed |
| Syringe Pump | Braintree Scientific | BS8000 | |
| O-ring | Custom made with a 20 mm diamter hole and a handle to secure O-ring to holder | ||
| Upright fluorescence microscope | Olympus America | BX61WI | |
| Image Acquisition Software | Molecular Devices | Metamorph | |
| FITC Dextran 20KD | Sigma Aldrich | 0.5 mg/ml (A dextran of different molecular size can be selected, if trial experiments indicate its suitability based on the calculated permeability index values) | |
| Lipopolysaccharide | Sigma Aldrich | Serotype 0111:B4 |
참고문헌
- Ware, L. B., Matthay, M. A. The acute respiratory distress syndrome. N Engl J Med. 342, 1334-1349 (2000).
- Matthay, M. A., et al. The acute respiratory distress syndrome. J Clin Invest. 122, 2731-2740 (2012).
- Bhattacharya, J., Matthay, M. A. Regulation and repair of the alveolar-capillary barrier in acute lung injury. Annu Rev Physiol. 75, 593-615 (2013).
- Parthasarathi, K., et al. Connexin 43 mediates spread of Ca2+-dependent proinflammatory responses in lung capillaries. J Clin Invest. 116, 2193-2200 (2006).
- Parthasarathi, K., Bhattacharya, J. Localized Acid instillation by a wedged-catheter method reveals a role for vascular gap junctions in spatial expansion of Acid injury. Anat Rec (Hoboken). 294, 1585-1591 (2011).
- Gorin, A. B., Stewart, P. A. Differential permeability of endothelial and epithelial barriers to albumin flux. J Appl Physiol Respir Environ Exerc Physiol. 47, 1315-1324 (1979).
- Boutoille, D., et al. FITC-albumin as a marker for assessment of endothelial permeability in mice: comparison with 125I-albumin. Exp Lung Res. 35, 263-271 (2009).
- Thorball, N. FITC-dextran tracers in microcirculatory and permeability studies using combined fluorescence stereo microscopy, fluorescence light microscopy and electron microscopy. Histochemistry. 71, 209-233 (1981).
- Stevens, T. Functional and molecular heterogeneity of pulmonary endothelial cells. Proc Am Thorac Soc. 8, 453-457 (2011).
- Ofori-Acquah, S. F., et al. Heterogeneity of barrier function in the lung reflects diversity in endothelial cell junctions. Microvasc Res. 75, 391-402 (2008).
- Kandasamy, K., et al. Real-time imaging reveals endothelium-mediated leukocyte retention in LPS-treated lung microvessels. Microvasc Res. 83, 323-331 (2012).
- Kandasamy, K., et al. Lipopolysaccharide induces endoplasmic store Ca2+-dependent inflammatory responses in lung microvessels. PloS One. 8, (2013).
- Qiao, R. L., Bhattacharya, J. Segmental barrier properties of the pulmonary microvascular bed. J Appl Physiol. 71, 2152-2159 (1991).
- Parthasarathi, K. Endothelial connexin43 mediates acid-induced increases in pulmonary microvascular permeability. Am J Physiol Lung Cell Mol Physiol. 303, (2012).
- Wu, Y., Perlman, C. E. In situ methods for assessing alveolar mechanics. J Appl Physiol 1985. 112, 519-526 (2012).
- Kuebler, W. M., et al. A novel signaling mechanism between gas and blood compartments of the lung. Journal Clin Invest. 105, 905-913 (2000).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유