Method Article
Maggiore analisi genetica di singole bioparticelle umani recuperati da semplificato Micromanipolazione da Forensic Evidence 'tocco DNA'
In questo articolo
Riepilogo
Qui si descrive una strategia di rimozione ottimizzato ed efficiente per la raccolta di bio-particelle presenti nel 'toccare DNA' campioni, con un protocollo di amplificazione potenziata coinvolge un solo passaggio 5 microlitri micro-volume di lisi / STR amplificazione, per consentire il recupero di repeat short tandem (STR) profili del donatore bio-particelle (s).
Abstract
Profili DNA possono essere ottenuti da prove 'touch DNA', che comprende le tracce microscopiche di materiale biologico umano. Gli attuali metodi per il recupero di tracce di DNA tamponi impiego di cotone o nastro adesivo di assaggiare una zona di interesse. Tuttavia, un tale approccio 'blind-swabbing' co-campione di materiale cellulare da diverse persone, anche se le cellule degli individui si trovano in luoghi geograficamente distinti sulla voce. Pertanto, alcune delle miscele di DNA riscontrate nei campioni di DNA tattili creati artificialmente dal tampone stesso. In alcuni casi, il DNA della vittima può essere trovato in notevole eccesso mascherando così DNA qualsiasi potenziale aggressore.
Al fine di eludere le sfide con metodi di recupero e di analisi standard, abbiamo sviluppato un costo inferiore, il metodo 'analisi intelligente' che si traduce in analisi genetica avanzata di prove tocco DNA. Descriviamo un un ottimizzatod strategia di recupero micromanipolazione efficiente per la raccolta di bio-particelle presenti nei campioni di DNA contatto, nonché una strategia di amplificazione potenziata coinvolge un solo passaggio 5 microlitri microvolumi lisi / STR amplificazione per consentire il recupero dei profili STR dal donatore bio-particelle (s). L'uso di singoli o pochi (cioè "grumi") bioparticelle risultati nella capacità di ottenere profili sorgente singoli. Tali procedure rappresentano tecniche avanzate alternative per l'isolamento e l'analisi delle singole bioparticelle da forense prove tocco DNA. Anche se non necessaria in ogni indagine forense, il metodo potrebbe essere estremamente utile per il recupero di un profilo DNA fonte autore unico in casi coinvolgono aggressione fisica (ad esempio, strangolamento) che potrebbe non essere possibile utilizzando tecniche di analisi standard. Inoltre, le strategie sviluppate qui offrono la possibilità di ottenere informazioni genetiche a livello di singola cellula da una varietà di other traccia non-forense materiale biologico.
Introduzione
Toccare DNA è una forma di traccia prove biologiche che è il trasferimento diretto di materiale cellulare (ad es, gettare le cellule della pelle) da un individuo ad un oggetto o di un altro individuo durante il contatto fisico 1. La possibilità di ottenere profili DNA da una varietà di oggetti toccati (documenti, biancheria, scarpe, armi da fuoco, contenitori bere, penne, valigetta gestisce) è stato riportato in letteratura 2-9.
Un fattore critico nella analisi delle prove tocco DNA è assicurare il recupero della traccia materiale biologico presente. Al tatto prova del DNA è tipicamente raccolte tamponando la zona sospetta con un tampone di cotone sterile (denominato "blind-swabbing"). Usando questo approccio, la natura del materiale biologico raccolto non è nota e viene eseguita campionamento di una zona generalizzata. La presenza di scanalature superficiali o fessure può ostacolare il completamento del ripristino del spesso già piccola quantità di bimateriale ological presente. Inoltre, un approccio 'blind-swabbing' sarà materiale cellulare necessariamente co-campione dai diversi individui le cui cellule sono presenti sulla voce, anche se le cellule degli individui si trovano in posizioni spazialmente distinte sulla voce. Il recupero dei profili DNA mescolate, che sono spesso difficili da risolvere in particolare con campioni di DNA a basso template, è frequente 8,10,11 e in molti casi sarà un artefatto conseguente processo swabbing stesso. Se solo una piccola quantità di materiale era presente da uno dei donatori, tecniche di estrazione e analisi standard possono non riescono a recuperare un profilo dal contributo minore. Inoltre, il tipo di tampone o se è stato utilizzato asciutto o bagnato (pre-inumidito con acqua sterile) possono influenzare la quantità di materiale biologico che vengono raccolte a causa di differenze di assorbimento e adsorptivity e l'efficienza di rilascio del materiale biologico 12. Smetodi di estrazione tandard possono causare la perdita del campione supplementare a causa di richieste manipolazione fisica dei passaggi di esempio o di trasferimento del campione.
Come descritto sopra, semplici tecniche di tampone per il recupero di materiale biologico può comportare la perdita di tracce di campione biologico nonché una maggiore frequenza di profili mescolate causa di un guasto per separare i singoli componenti biologici. Pertanto, abbiamo cercato di sviluppare strategie di recupero più selettivi ed efficienti per la raccolta di microparticelle cellulari presenti sugli oggetti toccati. La strategia sviluppata per l'analisi di materiale biologico da prove tocco DNA (indicato qui come "bioparticelle" a causa del fatto che un nucleo non è sempre visibile poiché la maggior parte delle cellule presenti nello strato epidermico esterno della pelle sono morti o morenti cheratinociti 13) prevede quanto segue: 1) raccolta di materiale biologico (cioè bioparticelle) tramite gel film from toccato oggetti e superfici, articoli di abbigliamento indossati o pelle umana diretta, 2) esame microscopico del materiale biologico recuperato per garantire la riscossione dei potenziale materiale biologico umano, e 3) di micromanipolazione di bio-particelle singole o poche utilizzando un adesivo solubile in acqua, e 4) autosomica DNA-STR profiling dei bio-particelle raccolte utilizzando una microvolumi (5 ml) di uno stadio lisi / reazione di amplificazione.
Questa procedura offre numerosi vantaggi rispetto ai metodi di analisi utilizzati tradizionalmente. Recupero bioparticelle utilizzando gel pellicola permette un esame microscopico del materiale biologico presente nel campione prima dell'analisi. Mentre la maggioranza dei bioparticelle recuperati da prove tocco DNA non sia cellule nucleate rendendo più difficile determinare quale o quanti dovrebbero essere selezionati bio-particelle, l'esame microscopico di questi campioni prima dell'analisi fornisce alla possibilità di cercare cellule nucleate quindi maximizzione la probabilità di recupero del profilo DNA. La collezione di bioparticelle utilizzando solubile in acqua micromanipolazione adesivo assistita consente il trasferimento diretto di bioparticelle mirati nelle provette di reazione. Questa procedura viene visualizzato al microscopio per garantire un efficace trasferimento del materiale biologico. La reazione ridotto o microvolumi aumenta la sensibilità riducendo il costo di analisi per campione. Questo permette l'analisi di aumento del numero di campioni da un singolo pezzo di prova. Grazie alla gamma dello stato genetico di bio-particelle in contatto la prova del DNA, si raccomanda più campionamenti da singoli elementi.
Qui, dimostriamo il successo nell'uso dei protocolli sviluppati per ottenere profili genetici altamente probatorio dei donatori di materiale biologico a prova del DNA tocco. La collezione bioparticle sviluppato e DNA metodi di profiling forniscono una vasta 'intelligente' (cioè, specifici, misurabili, Attainable, realistici e tempestivi) molecolare approccio alla caratterizzazione, analisi e interpretazione della traccia di materiale biologico. Mentre originariamente sviluppato per l'applicazione di analisi forense delle prove tocco DNA, le strategie sviluppate qui possono essere applicati ad altre fonti di materiale biologico e offrono la possibilità di ottenere informazioni di identificazione individuale a livello di singola cellula.
Protocollo
NOTA: i fluidi del corpo sono stati raccolti da volontari utilizzando procedure approvate dalla University of Institutional Review Board della Florida centrale. Consenso informato è stato ottenuto da ciascun donatore.
1. Raccolta di bioparticelle da oggetti e superfici Toccato
- Tagliare il gel film alle dimensioni desiderate. Assicurarsi che è la dimensione appropriata per il vetrino per microscopio utilizzato come supporto solido. Ad esempio, per una "x 1" slitta 3 vetro, utilizzare una dimensione gel film 2 "x 0,75".
NOTA: La lunghezza e la larghezza del materiale può essere ridotto, se desiderato, ma non dovrebbe superare queste dimensioni. - Rimuovere il rivestimento bianco dal gel a film e collegare il gel-film al vetrino (Figura 1A). Premere con decisione per garantire un collegamento completo.
NOTA: C'è un livello superiore di protezione trasparente che non deve essere rimosso per consentire la pressione da applicare lungo il pezzo di gel-film senza contaminare la superficie del gel a film. Vetrini preparati gel a film (con strato protettivo in allegato) possono essere conservati a temperatura ambiente fino a quando necessario. - Rimuovere la pellicola protettiva superiore libero dal gel a film con pinzette sterili quando è pronto da usare (Figura 1B) il campione di gel-film. Posizionare la superficie del gel pellicola in contatto diretto con l'oggetto desiderato toccato o superficie (Figura 2). Applicare una piccola quantità di pressione al fine di garantire un efficace trasferimento di bio-particelle al gel-film.
NOTA: Se si applica una pressione eccessiva, il vetrino potrebbe rompersi.
NOTA: Più campionamenti dello stesso oggetto o superficie può essere raccolti sullo stesso pezzo di gel-film. - Confermare il trasferimento di bio-particelle sul gel-film (Figura 3) ponendo il vetrino su uno stereomicroscopio (trasmissione o epi-illuminazione possono essere usati). L'uso di ingrandimento di 20X ~ per i migliori visualizzazione più grandi aree del gel-film, e l'ingrandimento di ~ 200X per meglio viEwing singoli bio-particelle.
- Conservare il campione di scorrimento gel pellicola a temperatura ambiente in un contenitore coperto diapositiva o usare immediatamente per la colorazione e / o raccolta bio-particelle.
2. colorazione facoltativa di bioparticelle per aiutare nella visualizzazione
- Posizionare il vetrino campione di gel-pellicola preparata al punto 1 su una griglia scorrevole colorazione sopra un lavandino.
- Usando una pipetta monouso, coprire l'intera superficie del gel-pellicola con trypan colorazione blu (Figura 4A). Incubare a temperatura ambiente per 1-2 min.
- Rimuovere eccesso di colorante inclinando il vetrino per consentire la macchia di defluire nel lavandino (Figura 4B).
NOTA: La slitta può essere sciacquato delicatamente inondazioni con acqua sterile utilizzando una pipetta usa e getta, se necessario (Figura 4C). - Lasciare il vetrino asciugare prima di procedere all'isolamento di bio-particelle. Visualizza la diapositiva utilizzando uno stereomicroscopio (~ 20X per la visualizzazione complessiva e ~ 200-300X di vbioparticelle singoli IEW) per garantire la corretta colorazione (Figura 4D-E).
NOTA: La slitta può essere conservato a temperatura ambiente in una scatola diapositiva coperto.
3. Isolamento di bioparticelle di interesse per l'analisi
- Collocare il numero appropriato di 0,2 ml provette PCR in un rack ed etichettare i tubi in modo appropriato.
- Preparare la miscela di amplificazione STR (vedi Materiali List) in una cappa di amplificazione PCR designato o cabinet biosicurezza. Vortex il master mix bene e centrifugare brevemente in una mini-centrifuga.
- Il volume di mix di amplificazione necessaria per campione è di 3,5 ml; preparare un volume adeguato di master mix per il numero desiderato di campioni.
- Dispensare 3,5 ml di miscela di amplificazione in ogni provetta 0,2 ml. Tappare ogni provetta liberamente.
- Posizionare un pezzo di nastro biadesivo su un panno pulito per microscopio diapositiva o direttamente su un blocco di vetro.
NOTA: Questo sarà utilizzato per contenere laTubo 0,2 ml in atto durante la raccolta del campione. - Posizionare un pezzo di nastro biadesivo su un panno pulito per microscopio diapositiva. Posizionare un pezzo di nastro onda saldatura idrosolubile sopra il nastro biadesivo.
NOTA: Questa diapositiva può essere conservato in un essiccatore per uso futuro. - Posizionare il primo tubo di 0,2 ml sulla doppia slitta nastro bastone o blocco preparato al punto 3.4. Impostare questo tubo da parte fino a quando viene raccolto il campione.
- Posizionare l'onda saldatura nastro scorrevole solubile in acqua al microscopio (basso ingrandimento). Con la punta di un ago di tungsteno, raschiare delicatamente la superficie del nastro per raccogliere una piccola quantità (o "pallone") di adesivo all'estremità dell'ago (Figura 5A).
NOTA: La dimensione della sfera può essere piccolo o grande a seconda del numero di bioparticelle che verranno raccolti. - Rimuovere accuratamente l'ago di tungsteno con adesivo da sotto il microscopio senza disturbare la punta dell'ago. L'ago puòessere posto in un rack, se lo si desidera durante il posizionamento del campione.
- Mettere il campione preparato gel-film (da Piazza di 1 e 2) sul palco microscopio. Regolare la messa a fuoco e l'ingrandimento fino a quando i bioparticelle possono essere facilmente visualizzati. Identificare i bio-particelle che verranno raccolti.
NOTA: Un blocco di vetro può essere utilizzato per sostenere la diapositiva, se necessario. - Recuperare l'ago di tungsteno con la palla adesivo e posizionare l'ago sulla superficie del gel-film in cui si trovano i bio-particelle di interesse. Premere la punta dell'ago (con adesivo) verso il basso in modo che sia a contatto con il bio-particelle (Figura 5B). Sollevare l'ago per garantire che la bio-particelle sono state raccolte. Ripetere questo processo fino a quando è stato raccolto il numero desiderato di bio-particelle.
- Mettere il preparato 0,2 ml provetta PCR sul palco microscopio. Regolare l'ingrandimento in modo che il fondo della provetta contenente la miscela di amplificazione è a fuoco.
- Inserire con attenzione il needl tungstenoe in 0,2 ml PCR tubo finché la punta dell'ago sia nella miscela di amplificazione.
NOTA: Questo è meglio eseguita durante la visualizzazione al microscopio. - Tenere l'ago nella miscela di amplificazione finché le dissolve adesive e le bioparticelle vengono rilasciati in soluzione (Figura 5C). Rimuovere l'ago, posizionare i 0,2 ml in posizione verticale e tappare liberamente il tubo.
- Ripetere la procedura di raccolta per i campioni supplementari. Pulire l'ago di tungsteno con alcool pre-inumidito (isopropanolo) salviette in tra i campioni.
4. Combinato Microvolume Nucleic Acid Isolation (diretto Lisi) e autosomica Short Tandem Repeat (STR) Profiling
- Preparare il tampone di lisi (vedi Materiali) in una cappa di amplificazione PCR designato o cabinet biosicurezza. Aggiungere 1,5 ml di tampone di lisi a ciascuna provetta per un volume totale di reazione 5 microlitri. Chiudi coperchi tubo ben.
NOTA: Le provette da 0,2 ml già contengono 3,5 ml dimix di amplificazione e la raccolta bio-particelle dal punto 3. - I campioni del termociclatore e amplificare i campioni con le seguenti formule di ciclismo: 75 ° C per 15 minuti; 95 ° C per 11 min; 34 cicli di 94 ° C per 20 sec e 59 ° C per 3 min; 60 ° C per 10 min; e 4 ° C in attesa.
- Conservare i prodotti di amplificazione a 4 ° C per la conservazione a breve termine.
5. Detection prodotto - elettroforesi capillare (CE)
- In un piatto ben 96, aggiungere 10 ml di mix corsa CE (9,7 microlitri formammide deionizzata e dimensioni standard 0,3 ml, vedi Materiali). Aggiungere 1 ml di prodotto amplificato o ladder allelico di ogni bene.
ATTENZIONE: Formamide è un potenziale mutageno e dovrebbe essere fatta in una cappa chimica indossando dispositivi di protezione individuale idonei. - Utilizzare condizioni elettroforetici specificate dal produttore nel manuale del kit di amplificazione o internally condizioni convalidato.
- Analizzare i dati grezzi con il software di analisi STR.
Risultati
Immagini rappresentative della bioparticelle individuali e ragruppato che sono stati recuperati da un colletto della camicia (100% poliestere) indossato da un donatore maschio sono mostrati in figura 6 (individuali bioparticelle) e la figura 7 (bioparticelle ragruppato). I bioparticelle sono stati recuperati dal colletto della camicia utilizzando il protocollo descritto qui: trasferimento di bioparticelle dal colletto della camicia di gel-pellicola attraverso il contatto diretto, la colorazione delle bioparticelle recuperati con trypan blu, raccolta di campioni bioparticle utilizzando un ago di tungsteno e adesivo solubile in acqua e analisi STR utilizzando l'amplificazione 5 microlitri micro-volumi lisi / STR. Figure 6 e 7 rappresentano un campionamento tipica di bioparticelle che sarebbero analizzati da un elemento tocco DNA individuale (20 bioparticelle singoli / singole e 20 bioparticelle aggregata). Il bioparticle (s) raccolti in ogni immagine sono etichettati con lunghezza e larghezza misure (in micron). La percentage di alleli STR recuperati da ciascuno dei bioparticle (s) raccolti viene fornito su ogni singola immagine per dimostrare i gradi variabili di successo che ci si può aspettare di ottenere dal bioparticelle con questo tipo di prove. I bioparticelle recuperati da campioni di DNA tocco sono ampiamente morti o morenti cheratinociti e quindi un profilo STR probatorio non è ottenuta da ciascuna bioparticle raccolto, come visibile nelle figure 6 e 7. Per questo esempio colletto della camicia, profili STR sono stati ottenuti da 14/20 (70%) dei singoli bioparticelle e 15/20 (75%) hanno ragruppato bioparticelle. Tuttavia, ognuno dei profili recuperati gamme di valore probatorio: 3-97% di recupero allele per singoli profili bioparticelle e 3-100% di recupero allele per i profili bioparticle ragruppato. A causa della variabilità dei tassi di successo, si raccomanda la raccolta di numerosi bioparticelle da ogni elemento del DNA tocco. Ciò garantisce una migliore possibilità di ottenere una elevata probative profilo STR.
Il profilo STR ottenuti da uno dei singoli campioni bioparticle dal colletto della camicia è mostrata in Figura 8 (il bioparticle da cui il profilo origine viene mostrato a sinistra). Quasi un profilo STR completo (28 su 30 alleli, un locus abbandonano, la precisione del profilo ottenuto verificata rispetto ad un profilo di riferimento) è stato ottenuto da questo individuo bioparticle. Il profilo ottenuto è di alta qualità con ragionevolmente equilibrate picco altezze inter-locus e non allelica abbandono. Allelic drop out e sbilanciati manufatti altezza di picco sono entrambi spesso osservata con campioni di DNA bassa del modello. Il profilo STR ottenuti da uno dei campioni bioparticle ragruppato dal colletto della camicia è mostrato nella Figura 9. Un profilo completo STR (30/30 alleli, la precisione del profilo ottenuto verificata rispetto ad un profilo di riferimento) è stato ottenuto. Come accennato in precedenza, un profilo STR non viene recuperato da semprey bioparticle raccolto. Un esempio di insuccesso profili DNA di un singolo bioparticle (3% di recupero allele, 1/30 alleli) è mostrato in Figura 10 (bioparticle individuale). Mentre questo individuo bioparticle non ha avuto successo, molto probanti profili STR del donatore delle bioparticelle in questo campione sono stati ottenuti da altri bioparticelle recuperati dallo stesso campione. Ciò dimostra la necessità di eseguire più campionamenti singola cella / ciuffo dallo stesso oggetto.
I metodi sviluppati "intelligenti" di analisi descritte qui per toccare la prova del DNA sono stati utilizzati con successo per recuperare i profili singola fonte probatori da sola e bioparticelle "ragruppato" provenienti da vari toccato oggetti e capi d'abbigliamento (ad esempio, sedie braccioli, ruote sterzanti auto, telefoni cellulari, tazze di caffè, sigarette, penne, magliette, pantaloncini e maglie). Tuttavia, soprattutto, questo approccio è stato utilizzato anche per la rilevazione e profilatura di maschio dOnor DNA (un'unica fonte) in campioni di miscela contatto / aggressione fisica simulati (ad esempio, autore afferrando il polso, il collo della vittima o di abbigliamento, o contatto con biancheria da letto della vittima, come in aggressioni sessuali).
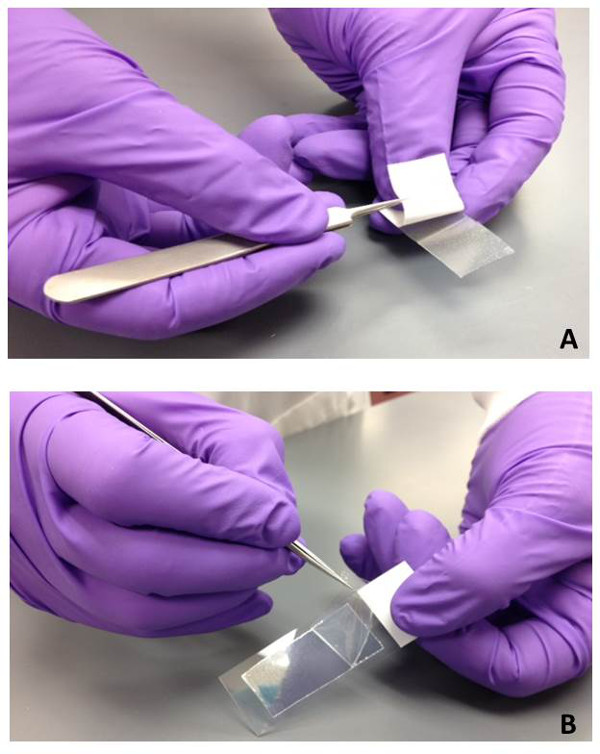
Figura 1: Preparazione di vetrini gel a film per la raccolta bioparticle. (A) Il coperchio di protezione posteriore bianco viene rimossa con pinzette sterili dal pezzo di gel-pellicola per esporre la parte adesiva. Il gel-pellicola viene quindi rispettato un vetrino da microscopio in vetro con una forte pressione. (B) Quando il campione di gel-film è pronto per essere utilizzato per la raccolta bioparticle, il top pellicola protettiva trasparente viene rimossa con pinzette sterili.

Figura 2: raccolta Bioparticle utilizzando gelpellicola stretch da vari substrati. Le slitte gel a film può essere utilizzato per raccogliere bioparticelle da una varietà di superfici. Il gel-film è posto a diretto contatto con l'oggetto o la superficie di interesse. Leggera pressione viene applicata per trasferire bioparticelle sulla superficie del gel a film. Raccolta di bioparticelle da (A) articoli indossati abbigliamento (collare cappotto), (B) ha toccato oggetti (viaggi tazza di caffè), e (C) pelle umana diretta (polso maschile) sono mostrati.

Figura 3:. Bioparticelle su un capo d'abbigliamento usurato (all'interno pantalone) bioparticelle vengono trasferiti al gel pellicola attraverso il contatto diretto con la superficie dell'oggetto. Bioparticelle si trovano come "grumi" o individuali bioparticelle singoli / (indicati dalle frecce rosse).
alt = "Figura 4" src = "/ files / ftp_upload / 52612 / 52612fig4.jpg" />
Figura 4:. Colorazione facoltativa del bioparticelle sui vetrini gel a film Per una migliore visualizzazione dei bioparticelle, campioni di gel a film possono essere colorati con trypan colorazione blu. L'intera superficie di gel-film è coperto da trypan blu (A). Dopo 1-2 min di colorazione, la slitta è inclinato leggermente per consentire eccesso di colorante di tirare la slitta (B). Gentle allagamento con acqua sterile (C) può essere utilizzata per rimuovere l'eccesso di colorante. Dopo la slitta viene essiccato, la slitta può essere osservato al microscopio per garantire la corretta colorazione (D, E). Nota:. Non tutti bioparticelle appariranno macchiato (cioè, di colore blu) Cliccate qui per vedere una versione più grande di questa figura.
OAD / 52612 / 52612fig5.jpg "/>
Figura 5: raccolta e analisi Bioparticle. (A) Una piccola quantità (o "pallone") di nastro onda saldatura idrosolubile ("collante") viene raccolto sulla punta di un ago di tungsteno delicatamente raschiatura. (B) L'adesivo viene toccata al gel- superficie della pellicola per raccogliere le bioparticelle di interesse. Bioparticelle singole o multiple possono essere raccolti con una singola sfera adesivo. (C) Una volta che i bioparticelle desiderati sono stati raccolti, la punta dell'ago viene inserita nella miscela di amplificazione in una provetta 0,2 ml PCR. L'ago viene tenuto nel liquido fino a completa dissoluzione e il rilascio di bioparticelle in soluzione viene osservata. Tutte le fasi del processo di raccolta vengono eseguiti e visualizzati sotto il microscopio per assicurare la raccolta bioparticle di successo e il trasferimento. Clicca qui per visualizzare un larversione ger di questa figura.

Figura 6:. Bioparticelle individuali in un campione colletto bioparticelle stati recuperati usando gel pellicola dall'interno di un collare camicia indossata da un donatore maschile. I bioparticelle erano macchiati con trypan blu e le immagini di venti diversi bioparticelle singoli individuati nel campione sono mostrati. In ogni immagine, il bioparticle che è stato raccolto è cerchiata (cerchi rossi indicano bioparticelle in cui è stato recuperato un profilo, cerchi neri indicano bioparticelle in cui un profilo non è stato recuperato). La percentuale di recupero allele (numero di alleli osservati su un massimo di 30), viene visualizzato sopra l'immagine di bioparticle da cui profilo è stato recuperato. Clicca qui per vedere una versione più grande di questa figura.
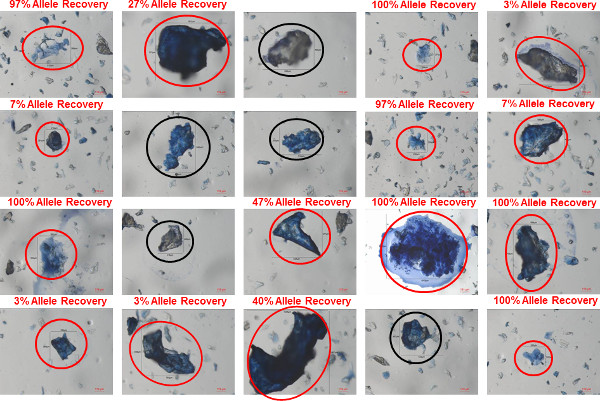
Figura 7: clumped bioparticelle in un campione colletto bioparticelle stati recuperati usando gel pellicola dall'interno di un collare camicia indossata da un donatore maschile.. I bioparticelle erano macchiati con trypan blu e le immagini di venti diversi bioparticelle aggregata individuati nel campione sono mostrati. In ogni immagine, il bioparticle che è stato raccolto è cerchiata (cerchi rossi indicano bioparticelle in cui è stato recuperato un profilo, cerchi neri indicano bioparticelle in cui un profilo non è stato recuperato la percentuale di recupero allele (numero di alleli osservati su un massimo di 30). è indicato per ogni bioparticle da cui profilo è stato recuperato. Cliccate qui per vedere una versione più grande di questa figura.

Figura 8: profilo autosomica STR ottenuto da un singolo bioparticle da un colletto della camicia maschile Un profilo autosomica STR è stato ottenuto da un unico bioparticle (mostrato a sinistra) con i 5 ml di lisi diretta / reazione di amplificazione.. La precisione di questo profilo è stato determinato rispetto ad un campione di riferimento donatore. Quindici autosomica STR loci e amelogenina (determinazione del sesso) sono co-amplificati in una singola reazione e separati mediante elettroforesi capillare. I risultati vengono visualizzati qui come elettroferogramma. Numeri alleliche sono designazione sotto ogni picco ad ogni locus. L'asse x rappresenta la dimensione del frammento (paia di basi, bp) e Y rappresenta intensità del segnale (RFU unità relativa a fluorescenza, a condizione in ogni numero corrispondente allele). Clicca qui per vedere una versione più grande questa figura.
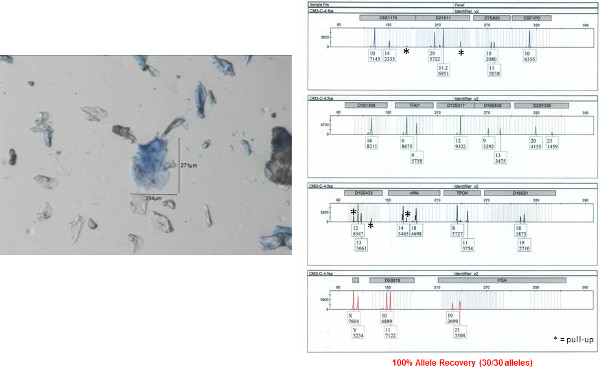
Figura 9: profilo autosomica STR ottenuto da un bioparticle clumped da un colletto della camicia maschile Un profilo autosomica STR è stato ottenuto da un bioparticle clumped (mostrato a sinistra) con i 5 ml di lisi diretta / reazione di amplificazione.. La precisione di questo profilo è stato determinato rispetto ad un campione di riferimento donatore. Quindici autosomica STR loci e amelogenina (determinazione del sesso) sono co-amplificati in una singola reazione e separati mediante elettroforesi capillare. I risultati vengono visualizzati qui come elettroferogramma. Numeri alleliche sono designazione sotto ogni picco ad ogni locus. L'asse x rappresenta la dimensione del frammento (paia di basi, bp) e Y rappresenta l'intensità del segnale (RFU unità relativa a fluorescenza, a condizione in ogni numero corrispondente allele).pg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
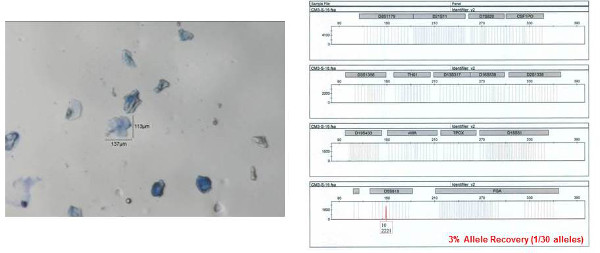
Figura 10:. Esempio di un fallimento per ottenere un profilo autosomica STR ottenuto da un bioparticle raccolti Il bioparticle individuale mostrato a sinistra è stato raccolto da un campione di gel-pellicola colletto della camicia. Come si può vedere dal profilo STR risultante (mostrato a destra), è stato ottenuto un solo allele (su 30 possibili). Numeri alleliche sono designazione sotto ogni picco ad ogni locus. L'asse x rappresenta la dimensione del frammento (paia di basi, bp) e Y rappresenta l'intensità del segnale (RFU unità relativa a fluorescenza, a condizione in ogni numero corrispondente allele). Clicca qui per vedere una versione più grande di questa figura.
Discussione
Qui abbiamo descritto metodi per la raccolta e l'analisi genetica avanzata di bioparticelle recuperati dalla prova del DNA tocco. L'approccio sviluppato prevede quanto segue: 1) raccolta di materiale biologico (cioè bioparticelle) tramite gel a film da oggetti toccati e superfici, articoli di abbigliamento indossati o pelle umana diretta, 2) l'esame microscopico del materiale biologico recuperato per garantire la raccolta di potenziale materiale umano biologici, e 3) di micromanipolazione bioparticelle singole o poche usando un adesivo solubile in acqua, e 4) autosomica DNA-STR profilatura dei bioparticelle raccolti utilizzando un microvolumi (5 ml) a fase di lisi / reazione di amplificazione. L'uso di una reazione tubo chiuso one-step riduce la possibilità di contaminazione del campione e perdite da manipolazioni campioni supplementari o trasferimento ad altre provette di reazione. La migliorata microvolumi one-step (5 microlitri) lisi / reazioni di amplificazione STR permette il recupero di tutto o probative STR profili del donatore di bioparticelle singole o poche. Questo approccio è stato sviluppato per ottenere profili fonte STR singole da single e multi-source tocco prova del DNA (ad esempio, articoli indossati abbigliamento ed altri articoli per la casa, toccato / oggetti manipolati e superfici, miscele pelle / pelle). È stato usato con successo per la rilevazione del donatore maschio in campioni miscela attacco fisici simulati.
Questo approccio potrebbe essere ulteriormente valutato in ulteriori scenari miscela corpo fluido / tessuto, come una vittima che graffia la sua / il suo assalitore, in cui solo pochi bioparticelle dal aggressore sarebbe presente tra una straordinaria quantità di materiale biologico da parte della vittima. Inoltre, dal momento che questo approccio sviluppato in questo studio consente analisi a livello bioparticle singolo, potrebbe essere utilizzata per ottenere una migliore comprensione della natura e l'entità di trasferimento secondario 14-19, in cui un intermediario trasferisce un profilo DNA su un surface, oggetto o persona ad un altro oggetto di superficie o di una persona 20. Un approccio cieco swabbing all'analisi di trasferimento secondario può riuscire ad identificare tracce di materiale dal donatore secondario. L'approccio qui sviluppato permette l'analisi di bioparticelle singole o poche e quindi i risultati non sono confuso dalla presenza di una quantità enorme di materiale biologico dal donatore primario. Le metodologie sviluppate in questo lavoro può anche avere implicazioni per l'analisi delle tracce di materiale biologico nei casi di violenza sessuale, come quelli che coinvolgono la penetrazione digitale della vagina dove identificazione di tracce di cellule della pelle dal colpevole potrebbe essere cruciale per stabilire il contatto sessuale si è verificato.
Mentre la raccolta di bioparticelle dal campione di gel a film non comporta manipolazioni difficili e complesse, vi sono passaggi critici in questo procedimento che devono essere effettuate con grande cura per assicurare la SUtrasferimento ccessful di bioparticelle nel recipiente di reazione a valle. La raccolta di bioparticelle con l'adesivo solubile in acqua deve essere considerata microscopicamente (cioè, stereomicroscopio ad alto ingrandimento (~ 200-300X) per garantire che solo le bioparticelle di interesse sono raccolti. A seconda delle dimensioni del collante "pallone" usato, ci è la possibilità di raccogliere materiale circostante aggiuntivo che può comprendere sia materiale biologico e non biologico (ad esempio, le fibre, altri detriti). La raccolta di impreviste bioparticelle supplementari può comportare il recupero dei profili di DNA mescolate. La raccolta di materiale non biologico può introdurre inibitori nella lisi micro-volume / reazioni STR. Se più bioparticelle sono raccolti con lo stesso adesivo "pallone", vi è un potenziale di bioparticelle precedentemente raccolti per diventare distaccato dal collante. Questo non è frequente, ma può verificarsi quando un numero maggiore di bioparticles vengono raccolti (ad esempio, più di 50) con un unico "pallone" adesivo. Se un numero elevato di bioparticelle sono mirati, si raccomanda che più insiemi di numero inferiore bioparticelle sono fatti ma tutti trasferiti nella stessa provetta 0,2 ml. Una volta bioparticelle sono stati raccolti, è necessario prestare attenzione durante la rimozione della slitta gel pellicola dal microscopio e il posizionamento del tubo 0,2 ml modo che la punta dell'ago non è disturbato. Durante il posizionamento della punta dell'ago nella miscela di amplificazione sul fondo della provetta 0,2 ml, la punta dell'ago non deve entrare in contatto con i lati del tubo al fine di evitare perdite di materiale sui lati del tubo. Mentre la solubilizzazione dell'adesivo è tipicamente rapida (~ 30 sec o meno a seconda delle dimensioni del collante "pallone") e può monitorata durante l'esame al microscopio, la punta dell'ago deve essere lentamente rimosso dalla miscela di amplificazione per garantire che completa solubilizzazionedell'adesivo è stato raggiunto. Se l'adesivo non ha completamente dissolto, l'ago può essere restituito al liquido per permettere la completa dissoluzione.
I protocolli qui descritti sono stati ottimizzati per l'uso con bioparticelle e cellule umane di prove biologiche forensi. Il tampone di lisi selezionato è compatibile con il kit di amplificazione del DNA-STR selezionato. Mentre ci possono essere adeguati buffer di lisi alternative, la loro efficienza in termini di lisi cellulare e la compatibilità con l'analisi a valle deve essere verificata da parte dell'utente. Inoltre, il numero di kit di STR amplificazione e ciclo di amplificazione descritto in questo protocollo sono stati ottimizzati per l'uso con bioparticelle singoli o pochi. Un kit STR amplificazione di nuova generazione con riportato un aumento robustezza e la sensibilità è stato selezionato ed è stato dimostrato di provocare il recupero dei profili STR alta qualità da bioparticelle singole o poche. Mentre molti altri kit STR, con diversi amplificatore consigliatonumero di cicli cazione, sono disponibili, essi potrebbero non avere la sensibilità adatta e quindi avrebbe bisogno di essere adeguatamente valutati prima dell'uso in questi protocolli.
Nonostante l'uso efficace dei metodi descritti per i profili STR recupero da bioparticelle singoli o pochi, il tasso di successo di recupero profilo non sarà al 100%. Pertanto, per alcuni campioni possono essere osservati un profilo DNA parziale, limitato o nessun profilo. Ciò non può essere evitata a causa della incapacità di identificare visivamente conclusivamente maggior bioparticelle come materiale cellulare, il potenziale stato di degrado del materiale nucleare nei bioparticelle o perdita di materiale del collante raccolti prima del trasferimento nel recipiente di reazione. Pertanto, non è raccomandato l'analisi di un singolo campione bioparticle per ogni articolo DNA tocco. Abbiamo spesso raccogliere 20 set di campioni provenienti da un campione di gel-singolo film e raccoglieremo set di campioni supplementari, se necessario, se non si ottiene un profilo STR adeguato. Tegli limitazione solo per collezioni è la quantità di materiale biologico presente sul campione gel film (e probabilmente il costo di analisi, anche se le reazioni microvolumi offrono la possibilità di raccogliere campioni supplementari per un costo simile o inferiore come un unico volume di reazione standard ( ad esempio, 25 ml).
I metodi del DNA profiling sviluppati descrivono qui forniscono un approccio basato molecolare alla caratterizzazione, analisi e interpretazione della traccia di materiale biologico recuperato da campioni di DNA a sfioramento. Tuttavia, vi sono informazioni genetiche aggiuntiva che può essere ottenuto dalle bioparticelle recuperati in aggiunta alla determinazione del donatore (cioè, profilo STR) del donatore del materiale biologico. Il tessuto o organo sorgente del fluido di origine (ad esempio, la pelle contro saliva) può fornire informazioni contestuali fondamentale per un'indagine penale. Senza una tale determinazione, l'ambiguità della fonte tessuto di origine può essere Explotata come circostanze alternative di reato (ad esempio, come il fluido corpo potrebbe essere stato depositato) potrebbe essere suggerito. I protocolli di raccolta bioparticle e isolamento qui descritti potrebbero essere utilizzati per raccogliere bioparticelle o altre cellule (ad esempio, buccale, vaginale) da utilizzare in un identificativo fonte tissutale (mRNA profilatura 21-30) strategia che coinvolge micro-volume di trascrizione inversa (RT) e reazioni di amplificazione. Con ulteriore ottimizzazione può anche essere possibile sviluppare un DNA / RNA strategia co-isolamento per consentire l'individuazione tipo cellulare (RNA) e STR profiling dallo stesso campione, compresi bioparticelle da prove tocco DNA.
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
The authors would also like to thank all participants who donated samples for this work. This work was funded by the Office of Justice Program, National Institute of Justice, Department of Justice under award number 2010-DN-BX-K139. The funding agencies had no involvement in the study design, in collection, analysis and interpretation of data, or in the writing of the report. Points of view in this document are those of the authors and do not necessarily represent the official positions of the U.S. Department of Justice.
Materiali
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| SealRite 1.5 mL natural microcentrifuge tubes, sterile | USA Scientific | 1615-5510 | numerous altnerative suppliers are available, but tubes should be sterile |
| 0.2 mL PCR tubes with flat cap, natural | Phenix Research | MPX-200F | or equivalent |
| Kimwipes | Fisher Scientific | 06-666 and/or 06-666-11C | |
| Alcohol prep pads | Fisher Scientific | 06-669-62 | alternative is 06-665-24 (Fisher Sci); canister of larger alcohol wipes rather than individual pads |
| Sterile water | 18.2 mega-ohm, autoclaved | ||
| Glass microscope slides, frosted, 3" x 1": 1mm | Fisher Scientific | 12-544-3 | alternative brands or sizes are acceptable |
| Disposable transfer pipet | Fisher Scientific | 13-711-9D | alternatives are acceptable |
| Trypan blue solution | Sigma | T8154 | |
| Pipets: 0.2-2, 2-20, 10-100, 100-1,1000 mL | various | ||
| Sterile, aerosol-resistant pipet tips | various | ||
| Mini-centrifuge | various | ||
| Stereomicroscope | Leica | M205C | others are suitable, but must be capable of magifications up to 350X |
| GeneAmp PCR system 9700 thermal cycle (silver or gold block) | Life Technologies | N8050200 or 4314878 | other models and manufacturers can be used, but performance with the STR amplification kit must be verified |
| 3130 Genetic Analyzer | Life Technologies | 3130-01 | Alternatives: 310 or 3500 Genetic Aanlyzers (Life Technologies) |
| GeneMapper software | Life Technologies | various | Various versions of the software are available and can be used |
| WF Gel-Film , x8 retention level | Gel-Pak | WF-40-x8-A | 4" x 4" wafer film; can be ordered in other size specifications |
| Double sided tape | various | ||
| Glass block, 3" x 1.5" x 3/8" | McCrone Microscopes and Accessories | 370-2 | or equivalent |
| Tungsten needle with holder | McCrone Microscopes and Accessories | 106 | |
| 3M water soluble wave solder tape, 5414 transparent | Allied Electronics | 70113977 | |
| Lysis buffer (forensicGEM Saliva, Zygem) | VWR | 95043-992 | Lysis buffer is prepared in 10 ml portions (prepare additional master mix portions as needed to accommodate the desired number of samples). 1.5 ml is used for each sample. To prepare 10 ml of lysis buffer (sufficient for ~6 samples): 6.9 mL sterile water, 2.1 mL 10x buffer - blue, 1 mL forensicGEM. |
| STR Amplification kit, AmpFlSTR Identifiler Plus PCR amplification kit | Life Technologies | 4427368 | Alternative STR amplification kits can be used, but performance would have to be verified by user. The amplification mix is prepared as follows (volumes per sample): 2.2 ml PCR reaction mix, 1.1 ml Primer set, 0.2 ml (1U) AmpliTaq Gold DNA polymerase. A master mix sufficient for the desired number of samples should be prepared. 3.5 ml of the prepared mix is added to the 0.2 mL tube for bio-particle collection. |
| AmpliTaq Gold DNA polymerase | Life Technologies | N808-0245 | |
| HiDi formamide | Life Technologies | 4311320 | |
| GeneScan 500 LIZ size standard | Life Technologies | 4322682 | |
| 96 well optical reaction plates | Life Technologies | N8010560 | |
| Plate septa, 96 well | Life Technologies | 4315933 | |
| Performance-optimized polymer, POP-7 | Life Technologies | 4363785 | Alternatives such as POP-4 are acceptable |
Riferimenti
- Hanson, E. K., Ballantyne, J. Getting blood from a stone': ultrasensitive forensic DNA profiling of microscopic bio-particles recovered from 'touch DNA' evidence. Methods Mol.Biol. 1039, 3-17 (2013).
- Balogh, M. K., Burger, J., Bender, K., Schneider, P. M., Alt, K. W. STR genotyping and mtDNA sequencing of latent fingerprint on paper. Forensic Sci Int. 137 (2-3), 188-195 (2003).
- Barbaro, A., Cormaci, P., Teatino, A., La, M. A., Barbaro, A. Anonymous letters? DNA and fingerprints technologies combined to solve a case. Forensic Sci Int. 146, S133-S134 (2004).
- Bright, J. A., Petricevic, S. F. Recovery of trace DNA and its application to DNA profiling of shoe insoles. Forensic Sci.Int. 145 (1), 7-12 (2004).
- Castello, A., Alvarez, M., Verdu, F. DNA from a Computer Keyboard. Forensic Science Communications. 6 (3), (2004).
- Horsman-Hall, K. M., et al. Development of STR profiles from firearms and fired cartridge cases. Forensic Sci Int. Genet. 3 (4), 242-250 (2009).
- Petricevic, S. F., Bright, J. A., Cockerton, S. L. DNA profiling of trace DNA recovered from bedding. Forensic Sci. Int. 159 (1), 21-26 (2006).
- Oorschot, R. A., Jones, M. K. DNA fingerprints from fingerprints. Nature. 387 (6635), 767 (1997).
- Sewell, J., et al. Recovery of DNA and fingerprints from touched documents. Forensic Sci Int.Genet. 2 (4), 281-285 (2008).
- Raymond, J. J., van Oorschot, R. A., Gunn, P. R., Walsh, S. J., Roux, C. Trace evidence characteristics of DNA: A preliminary investigation of the persistence of DNA at crime scenes. Forensic Sci Int Genet. 4 (1), 26-33 (2009).
- Wickenheiser, R. A. Trace DNA: a review, discussion of theory, and application of the transfer of trace quantities of DNA through skin contact. J.Forensic Sci. 47 (3), 442-450 (2002).
- Sweet, D., Lorente, M., Lorente, J. A., Valenzuela, A., Villanueva, E. An improved method to recover saliva from human skin: the double swab technique. J. Forensic Sci. 42 (2), 320-322 (1997).
- Darmon, M. M., Blumenberg, M. M. . Molecular Biology of the Skin - the Keratinocyte. , (1993).
- Daly, D. J., Murphy, C., McDermott, S. D. The transfer of touch DNA from hands to glass, fabric and wood. Forensic Sci Int Genet. 6 (1), 41-46 (2012).
- Goray, M., Eken, E., Mitchell, R. J., van Oorschot, R. A. Secondary DNA transfer of biological substances under varying test conditions. Forensic Sci Int Genet. 4 (2), 62-67 (2010).
- Goray, M., Mitchell, R. J., van Oorschot, R. A. Investigation of secondary DNA transfer of skin cells under controlled test conditions. Leg.Med.(Tokyo). 12 (3), 117-120 (2010).
- Lowe, A., Murray, C., Whitaker, J., Tully, G., Gill, P. The propensity of individuals to deposit DNA and secondary transfer of low level DNA from individuals to inert surfaces. Forensic Sci Int. 129 (1), 25-34 (2002).
- Phipps, M., Petricevic, S. The tendency of individuals to transfer DNA to handled items. Forensic Sci Int. (2-3), 168-162 (2007).
- Zoppis, S., et al. DNA fingerprinting secondary transfer from different skin areas: Morphological and genetic studies. Forensic Sci Int Genet. 11, 137-143 (2014).
- Gill, P. . Misleading DNA Evidence: Reasons for Miscarriages of Justice. , (2014).
- Haas, C., Hanson, E., Ballantyne, J. Capillary electrophoresis of a multiplex reverse transcription-polymerase chain reaction to target messenger RNA markers for body fluid identification. Methods Mol. Biol. 830, 169-183 (2012).
- Hanson, E., Ballantyne, J. RNA Profiling for the Identification of the Tissue Origin of Dried Stains in Forenic Biology. Forensic Sci Rev. , 22145-22157 (2010).
- Hanson, E., Haas, C., Jucker, R., Ballantyne, J. Specific and sensitive mRNA biomarkers for the identification of skin in 'touch DNA' evidence. Forensic Sci Int Genet. 6, 548-558 (2012).
- Hanson, E. K., Ballantyne, J. Highly specific mRNA biomarkers for the identification of vaginal secretions in sexual assault investigations. Sci Justice. 53 (1), 14-22 (2013).
- Juusola, J., Ballantyne, J. Messenger RNA profiling: a prototype method to supplant conventional methods for body fluid identification. Forensic Sci Int. 135 (2), 85-96 (2003).
- Juusola, J., Ballantyne, J. Multiplex mRNA profiling for the identification of body fluids. Forensic Sci Int. 152 (1), 1-12 (2005).
- Fleming, R. I., Harbison, S. The development of a mRNA multiplex RT-PCR assay for the definitive identification of body fluids. Forensic Sci Int Genet. 4 (4), 244-256 (2010).
- Haas, C., Klesser, B., Maake, C., Bar, W., Kratzer, A. mRNA profiling for body fluid identification by reverse transcription endpoint PCR and realtime PCR. Forensic Sci Int Genet. 3 (2), 80-88 (2009).
- Lindenbergh, A., et al. A multiplex (m)RNA-profiling system for the forensic identification of body fluids and contact traces. Forensic Sci Int Genet. 6 (2), 565-577 (2012).
- Richard, M. L., et al. Evaluation of mRNA marker specificity for the identification of five human body fluids by capillary electrophoresis. Forensic Sci Int Genet. 6 (4), 452-460 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon