È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
L'esposizione del Maiale CNS per l'analisi istologica: Un manuale per la decapitazione, Teschio di apertura, e Cervello di rimozione
In questo articolo
Riepilogo
L'obiettivo di questo documento e video didattico è quello di descrivere come esporre e rimuovere il post-mortem del cervello di maiale e ghiandola pituitaria in uno stato integro, adatto per la successiva analisi macroscopica e istologica.
Abstract
Suini sono diventate sempre più popolari in larga animale ricerca traslazionale neuroscienze come sostituto economicamente ed eticamente fattibile primati non umani. La dimensione del cervello di grandi dimensioni del maiale permette l'utilizzo di convenzionali imager cervello clinica e l'uso diretto e la sperimentazione di procedure e attrezzature neurochirurgiche dalla clinica umana. Ulteriori analisi macroscopica e istologica, tuttavia, richiede l'esposizione post mortem del maiale sistema nervoso centrale (SNC) e successiva rimozione del cervello. Questo non è un compito facile, come il maiale CNS è incapsulato da una fitta, il cranio ossuto e della colonna vertebrale. L'obiettivo di questo documento e video didattico è quello di descrivere come esporre e rimuovere il cervello post-mortem di suini e la ghiandola pituitaria in uno stato integro, adatto per la successiva analisi macroscopica e istologica.
Introduzione
studi neuroscienze traslazionale nei suini sono diventati sempre più popolari nel corso degli ultimi due decenni. Le grandi dimensioni del cervello di maiale consente l'utilizzo di convenzionali imager cerebrali clinica e l'uso diretto e sperimentazione di procedure neurochirurgiche ed attrezzature dalla clinica umana 1, 2, 3, 4, 5, 6, 7, 8. Negli ultimi 20 anni, maiali, specialmente maialino (ad esempio, Göttingen cavia), sono stati utilizzati per esaminare modalità di trattamento neuromodulatori, come il trapianto di cellule staminali; Vettore virale trasfezione; e la stimolazione cerebrale profonda diretta verso il morbo di Parkinson, l'obesità, la depressione, e la malattia di Alzheimer 2, 6,= "xref"> 9, 10, 11, 12, 13, 14, 15, 16, 17. Questo è stato seguito dallo sviluppo di approcci stereotassica e chirurgici per manipolare cavia CNS 3, 18, 19, 20, 21. I cambiamenti del SNC istituiti sono state valutate in animali vivi mediante imaging cerebrale (PET 10, 13, 22, 24 e MR 23), cistometria 11, 12, 25, analisi del passo17, la valutazione neurologica 9, 17, e l'esame autoptico basato su istologia e analisi stereologica 14, 15, 17, 26, 27, 31. Tuttavia, l'analisi post-mortem richiede l'esposizione e la rimozione del cervello di maiale, che non è un compito facile, come una spessa cranio osseo e durale fibroso che copre circondano il cervello di maiale.
L'obiettivo di questo documento e video didattico è quello di descrivere come il cervello post-mortem di suini e dell'ipofisi possono essere esposti e rimossi in uno stato integro in 15-20 minuti utilizzando strumenti chirurgici non motorizzati. Il video didattico e illustrazioni fotografiche mostrano cavie di sesso maschile (età: 6 mesi, a corpo libero: 20-25 kg) utilizzato per uno studio anatomico sulla ghiandola pituitaria cavia.
Protocollo
anestesia degli animali e euthanesia è stata eseguita in conformità con i "Principi di laboratorio cura degli animali" (NIH pubblicazione n ° 86-23, rivisto 1985) e approvato dal Consiglio danese per la ricerca etica animale.
1. Strumenti
- Raccogliere gli strumenti presentati nel video ed elencati nella tabella dei materiali.
2. Decapitazione
NOTA: L'anestesia è stata indotta mediante iniezione intramuscolare di 5 mL di midazolam (5 mg / ml) e 5 ml di ketamina (25 mg / mL). 5-10 minuti più tardi, quando l'animale era profondamente sedato, una vena dell'orecchio è stata incannulata e overdose letale (100 mg / kg di peso corporeo) di pentobarbital sodio (200 mg / ml) è stato somministrato per via endovenosa. Per garantire che l'animale è stato completamente eutanasia, il dolore riflesso interdigitale è stato testato come mostrato da Ettrup et al. (2011) 20. euthanization completo è stato assicurato come descritto inl'istruzione etica sopra e seguita da una perfusione transcardial con 5 L di soluzione salina isotonica, come dimostrato da Ettrup et al. (2011) 20. Tutte le procedure vengono eseguite dimostrate postmortem, precludendo la necessità per le precauzioni necessarie per l'anestesia benessere a lungo termine e la sopravvivenza postprocedurale.
- Decapitare il maiale da un alto un'incisione circolare cervicale, utilizzando un bisturi chirurgico, appena sotto l'angolo mandibolare (Figura 1A).
- Ancora con il bisturi chirurgico, continuare l'incisione anteriormente attraverso il tessuto molle del collo, compresa la laringe e dell'esofago, finché la colonna vertebrale ossea viene raggiunto, approssimativamente al livello della giunzione cranio cervicale.
- Avanzare il taglio con un bisturi chirurgico dal lato anteriore della giunzione craniocervicale, sopra l'arco anteriore dell'atlante, e attraverso la membrana atlanto anteriore, esponendo così il canale vertebrale e il midollo spinale (Figura 1B). Allo stesso tempo chiedere un assistente di tirare il corpo del maiale lontano dalla testa di maiale per facilitare l'accesso tra la base del cranio e la prima vertebra cervicale.
- Continuare l'incisione chirurgica attraverso il sacco durale e il midollo spinale (Figura 1B). Prestare particolare attenzione per garantire che una sezione trasversale completa del midollo spinale è raggiunto.
NOTA: La mancata esecuzione del passaggio precedente può portare a trazione indesiderati sul midollo spinale e del cervello durante le seguenti fasi del processo di decapitazione. - Forza estendere la giunzione cranocervical a livello di sezione (Figura 1C). Al tempo stesso, utilizzare il bisturi chirurgico alla sezione restanti legamenti atlanto per rilasciare l'articolazione tra i condili occipitali e il processo articoli superiore dell'atlante. Separare la testa di maiale dal corpo.

Figura 1: minipig decapitazione. (A) del collo incisione (freccia, angolo mandibolare). (B) incisione attraverso i legamenti atlanto e il midollo spinale dura circondato (SC) alla giunzione craniocervicale (C1, arco anteriore dell'atlante, OC, condilo occipitale). (C) La parte posteriore dell'articolazione atlanto viene rilasciato da un'estensione forte (frecce) a livello di sezione. Si prega di cliccare qui per vedere una versione più grande di questa figura.
3. Teschio di apertura
- Posizionare la testa di maiale su un tavolo.
- Effettuare un'incisione longitudinale dorsale con un bisturi chirurgico attraverso la pelle e il tessuto molle sottostante dal retro del muso, sul vertice della testa, e giù attraverso la parte posterioreregione occipitale.
- Esporre la parte dorsale e posteriore del cranio rimuovendo il tessuto molle situata lateralmente alla incisione iniziale con un bisturi chirurgico.
- Rilasciare il muscolo temporale bilateralmente dal cranio (Figura 2A) con un bisturi chirurgico. Assicurarsi che l'osso occipitale posteriore è pulita dei tessuti molli.
- Utilizzare l'entrata posteriore del foro occipitale per rimuovere l'osso occipitale con Kerrison osso punzone e Bone Rongeurs ed esporre il cervelletto dura coperto (Figura 2B).
- Ritorno al lato anteriore esposta del cranio e selezionare un punto di ingresso nel dell'osso frontale, proprio di fronte agli occhi. A questo punto, utilizzare uno scalpello osso con un martello per penetrare il cranio e immettere il seno frontale (Figura 2C).
- Utilizzare l'entità del seno frontale per favorire la rimozione della lamina dorsoposterior cranio esterno con una rongeur ossea o punzone ed esporre l'interno, sottilecranio lamina ossea che copre il cervello (Figura 2D).
- Aprire delicatamente la lamina interna cranio osseo anteriormente con un martello e scalpello osso per esporre cervello dura coperto (Figura 2E).
- Continuare la rimozione di osso lateralmente usando uno scalpello osseo e una rongeur osso attraverso l'osso temporale e parietale al fine di rilasciare la parte dorsoposterior finale del cranio, situato tra le parti già esposte del cervello e nel cervelletto dura coperto (Figura 2F).
NOTA: E 'spesso possibile, durante la fase finale di questa procedura, per usare lo scalpello per rompere il restante posteriore ossa del cranio da una parte all'altra, proprio come uno apre una porta.
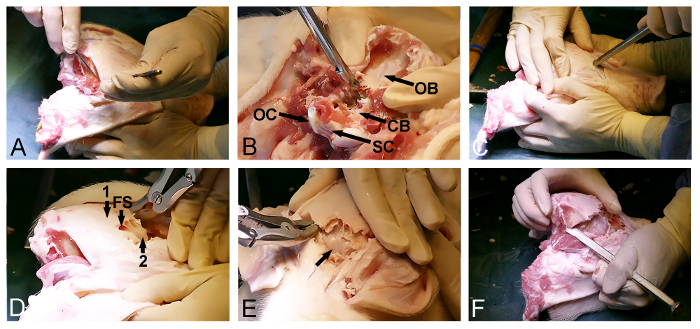
Figura 2: apertura cranio cavia. (A) esposizione della dorsoposteriosuperficie del cranio R, tra cui la rimozione del occipitale e muscoli temporali. (B) La rimozione dell'osso occipitale (CB, dura coperta di cervelletto, OB, osso occipitale, OC, condilo occipitale, e SC, midollo spinale). (C) un martello e uno scalpello osso sono usati per penetrare il cranio anteriormente e per entrare nel seno frontale a livello degli occhi. (D) La portata del seno frontale (FS) viene utilizzato per rimuovere il cranio esterna dell'osso spessore (1), esponendo una sottile lamina ossea interna (2) che copre il cervello. (E) La rimozione del sottile lamina ossea, esponendo il cervello dura coperto (freccia). (F) Infine, un martello e uno scalpello osso vengono utilizzati per il collegamento laterale anteriore e le aperture posteriori cranio. Si prega di cliccare qui per vedere una versione più grande di questa figura.
4. Cervello Removal
- Utilizzare pinze chirurgiche per sollevare la dura e creare un dolce un'incisione vicino alla venoso seno longitudinale superiore utilizzando un bisturi chirurgico fine (Figura 3A).
- Utilizzare micro-forbice o un coltello dura per aprire ulteriormente la dura madre che copre la superficie dorsale del cervello.
NOTA: Particolare cura deve essere presa quando si rimuove la dura corrispondente al tentorio cerebellare (figura 3B), come conservazione di questo foglio durale impedirà successiva rimozione cervello. - Posizionare la testa di maiale verticalmente (Figura 3C).
- Utilizzare lo scalpello osso o un dissettore per rilasciare cervello ventroanterior per via smussa del bulbo olfattivo dal pavimento dura coperto della cavità cranica (Figura 3D).
- Utilizzare un bisturi chirurgico fino al punto chiasma ottico esposta (Figura 3E). Esporre e la sezione del peduncolo ipofisario ei nervi oculomotori.
- Rilasciare il tronco cerebrale ventrale sezionando LOwer nervi cranici (Figura 3F) con una multa bisturi chirurgico. Garantire che tentorio cerebellare durale stato completamente inciso (figura 3B), in quanto questa foglia durale sarà altrimenti tagliare il tronco cerebrale durante il processo di rilascio.
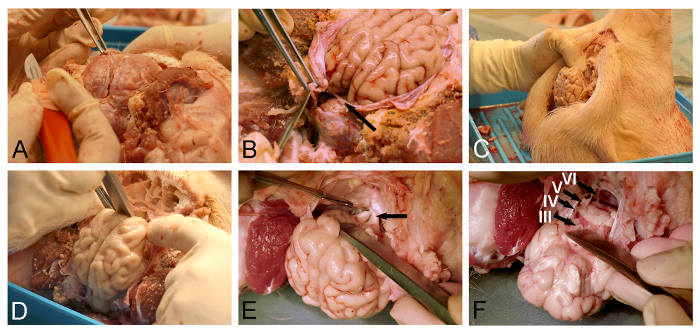
Figura 3: rimozione cervello cavia. Apertura (A) durale con pinze chirurgiche e un coltello dura. (B) Bisogna fare attenzione a incidere completamente la foglia durale (freccia), che si trova tra il cervello e il cervelletto. (C) La testa di maiale è in posizione verticale per una migliore visualizzazione delle strutture di base del cranio e al fine di gravità per aiutare lo spostamento previsto del cervello. (D) Un dissettore o uno scalpello osso viene usato per alleviare il bulbo olfattivo dalla sezione smussata dalla dura madre-coverebase del cranio d. (E) La dissezione viene continuata in direzione posteriore lungo la base del cranio per l'esposizione e sezionamento del chiasma ottico (freccia), gambo infundibolare e nervi oculomotori. (F) Il rilascio cervello è completato con la sezione dei nervi cranici inferiori come si allontanano dalla superficie ventrale del tronco cerebrale (III, oculomotore, IV, nervo trocleare, V, nervo trigemino e VI, abducente nervi). Si prega di cliccare qui per vedere una versione più grande di questa figura.
5. Rimozione pituitaria
- Identificare il peduncolo ipofisario ei suoi dintorni foglia durale (la sellae diapragma) nel pavimento cranio (Figura 4A).
- Incidere la foglia laterali durale al peduncolo ipofisario utilizzando una multa bisturi chirurgico (Figura 4B).
- Utilizzare un dissettore per rilasciare la fossauitary ed estrarlo dell'ipofisi fossa (Figura 4C).

Figura 4: rimozione pituitaria cavia. (A) La fossa pituitaria (*) è identificato nel piano cranio (1, bulbo olfattivo, 2, chiasma ottico e PF, fossa cranica posteriore). (B) La copertura durale (diagphragm Sellar, (freccia)) viene incisa lateralmente. (C) L'ipofisi (freccia) viene rilasciato con un dissettore e tirato fuori dalla fossa pituitaria. barra di scala (AC) = 10 mm. Si prega di cliccare qui per vedere una versione più grande di questa figura.
Risultati
Per evitare che il materiale del tessuto si secchi, si consiglia di conservare il cervello rimosso e pituitaria in un vaso riempito di fissativo o soluzione salina isotonica immediatamente dopo l'analisi macroscopica è stata eseguita. Il materiale tessuto può essere immagazzinato nel fissativo per anni, mentre stoccaggio in soluzione salina isotonica, anche in frigorifero, porterà a decadimento dei tessuti con il tempo.
...
Discussione
La maggior parte degli studi di neuroscienze sperimentali vengono eseguiti in piccole specie animali, come topi e ratti, in cui l'accesso al sistema nervoso centrale è facilitato da un sottile skull- e durale spessore. Tuttavia, in animali da esperimento più grandi come maiali 1, 4, 8, pecore 32, e primati non umani, l'elevato spessore di queste strutture richiede l'uso di strumenti robusti...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori riconoscono con gratitudine l'aiuto sapiente della signora Trine W. Mikkelsen, la signora M. Lise montaggio, e il personale a Påskehøjgaard. The Danish Medical Research Council, la Fondazione Lundbeck, e la Novo Nordisk Foundation sostenuti finanziariamente lo studio.
Materiali
| Name | Company | Catalog Number | Comments |
| Heavy Scalpel Handle #4 | FST (Fine Science Tools) | 10008-13 | Good for skin incision and soft tissue removal |
| Non-Sterile Scalpel Blades #23 | FST | 10023-00 | |
| Scalpel Handle #7 | FST | 10007-12 | Optimal for dural incision and precision work |
| Non-Sterile Scalpel Blades #11 | FST | 10011-00 | |
| Surgical Forceps | FST | 11024-18 | The tip of the surgical forceps ensure a firm grip |
| Kerrison Bone Punch | Aesculap Neurosurgery | FF713R | Must be robust, bite size 3-5 mm |
| Bone Rongeur | Aesculap Neurosurgery | MD615 | Must be robust, bite size 15 x 5 mm |
| Bone Rongeur | Aesculap Neurosurgery | FO551R | Must be robust, bite size 25 x 15 mm |
| Bone Chisel | Lawton | 67-0335 | The size of the chisel head should not exceed 20 mm |
| Mallet (Hammer) | Millarco | 5624108 | Weigth 300 g, length 30 cm, head hit area size 2 x 2 cm |
| Micro-Scissor | FST | 14002-14 | |
| Dissector | Aesculap Neurosurgery | OL165R | |
| Göttingen minipigs | Ellegaard Göttingen Minipigs A/S, Denmark | ||
| Euthanimal | pentobarbital | ||
| Ketamine | Pfizer | ||
| Midazolam | Hameln Pharmaceuticals |
Riferimenti
- Lind, M. N., Moustgaard, A., Jelsing, J., Vajta, G., Cumming, P., Hansen, A. K. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31, 728-751 (2007).
- Bjarkam, C. R., et al. Neuromodulation in a minipig model of Parkinson disease. British J Neurosurg. 22 (Suppl. 1), S9-S12 (2008).
- Bjarkam, C. R., Cancian, G., Glud, A. N., Ettrup, K. S., Østergaard, L., Sørensen, J. C. MRI-guided stereotaxic targeting in pigs based on a stereotaxic localizer box fitted with an isocentric frame and use of SurgiPlan computer-planning software. J Neurosci Methods. 183 (2), 119-126 (2009).
- Sauleau, P., Lapouble, E., Val-Laillet, D., Malbert, C. H. The pig model in brain imaging and neurosurgery. Animal. 3 (8), 1138-1151 (2009).
- Bjarkam, C. R., et al. Safety and function of a new clinical intracerebral microinjection instrument for stem cells and therapeutics examined in the Göttingen minipig. Stereotact Funct Neurosurg. 88 (1), 56-63 (2010).
- Fjord-Larsen, L., et al. Long-term delivery of nerve growth factor by encapsulated cell biodelivery in the minipig basal forebrain. Mol Therapy. 18 (12), 2164-2172 (2010).
- Sørensen, J. C., et al. Development of neuromodulation treatments in a large animal model - Do neurosurgeons dream of electric pigs?. Prog Brain Res. 194, 97-103 (2011).
- Dolezalova, D., et al. Pig models of neurodegenerative disorders: utilization in cell replacement-based preclinical safety and efficacy studies. J Comp Neurol. 522 (12), 2784-2801 (2014).
- Mikkelsen, M., Moller, A., Jensen, L. H., Pedersen, A., Harajehi, J. B., Pakkenberg, H. MPTP-induced Parkinsonism in minipigs: A behavioral, biochemical, and histological study. Neurotoxicol Teratol. 21, 169-175 (1999).
- Danielsen, E. H., et al. The DaNEX study of embryonic mesencephalic, dopaminergic tissue grafted to a minipig model of Parkinson's disease: Preliminary findings of effect of MPTP poisoning on striatal dopaminergic markers. Cell Transplant. 9 (2), 247-259 (2000).
- Dalmose, A., Bjarkam, C. R., Sørensen, J. C., Jørgensen, T. M., Djurhuus, J. C. Effects of high frequency deep brain stimulation on urine storage and voiding function in conscious minipigs. Neurourol Urodyn. 23 (3), 265-272 (2004).
- Dalmose, A., Bjarkam, C. R., Djurhuus, J. C. Stereotactic electrical stimulation of the pontine micturition center in the pig. Br J Urol. 95, 886-889 (2005).
- Andersen, F., Watanabe, H., Bjarkam, C. R., Danielsen, E. H., Cumming, P. Pig brain stereotaxic standard space: Mapping of cerebral blood flow normative values and effect of MPTP-lesioning. Brain Res Bull. 66 (1), 17-29 (2005).
- Glud, A. N., et al. Direct gene transfer in the minipig CNS using stereotaxic lentiviral microinjections. Acta Neurobiol Exp. 70 (3), 1-8 (2010).
- Glud, A. N., et al. Direct MRI-guided stereotaxic viral mediated gene transfer of alpha-synuclein in the minipig CNS. Acta Neurobiol Exp. 71 (4), 508-518 (2011).
- Ettrup, K. S., Sørensen, J. C., Rodell, A., Alstrup, A. K. O., Bjarkam, C. R. Hypothalamic deep brain stimulation influences autonomic and limbic circuitry involved in the regulation of aggression and cardiocerebrovascular control in the minipig. Stereotact Funct Neurosurg. 90 (5), 281-291 (2012).
- Nielsen, M. S., et al. Continuous MPTP intoxication in the minipig results in chronic parkinsonian deficits. Acta Neurobiol Exp. 76, 198-210 (2016).
- Bjarkam, C. R., et al. A MRI-compatible stereotaxic localizer box enables high-precision stereotaxic procedures in pigs. J Neurosci Methods. 139 (2), 293-298 (2004).
- Bjarkam, C. R., Jorgensen, R. L., Jensen, K. N., Sunde, N. A. A., Sørensen, J. C. H. Deep brain stimulation electrode anchoring using BioGlue®, a protective electrode covering, and a titanium microplate. J Neurosci Methods. 168, 151-155 (2008).
- Ettrup, K. S., et al. Basic Surgical Techniques in the Minipig: Intubation, Transurethral Bladder Catheterization, Femoral Vessel Catheterization, and Transcardial Perfusion. J Vis Exp. (52), e2652 (2011).
- Ettrup, K. S., Tornøe, J., Sørensen, J. C., Bjarkam, C. R. A surgical device for minimally invasive implantation of experimental deep brain stimulation leads in large research animals. J Neurosci Methods. 200 (1), 41-46 (2011).
- Danielsen, E. H., et al. Positron emission tomography of living brain in minipigs and domestic pigs. Scand J Lab Anim Sci Suppl. 25 (1), 127-135 (1998).
- Røhl, L., et al. Time evolution of cerebral perfusion and ADC measured by MRI in a porcine stroke model. J Magn Reson Imaging. 15 (2), 123-129 (2002).
- Cumming, P., Gillings, N. M., Jensen, S. B., Bjarkam, C. R., Gjedde, A. Kinetics of the uptake and distribution of the dopamine D2/3 agonist (R)-N-[1-11C]n-propylnorapomorphine in brain of healthy and MPTP-poisoned Gottingen miniature pigs. Nucl Med Biol. 30 (5), 547-553 (2003).
- Jensen, K. N., Deding, D., Sørensen, J. C., Bjarkam, C. R. Long-term implantation of deep brain stimulation electrodes in the pontine micturition centre of the minipig. Acta Neurochir. 151 (7), 785-794 (2009).
- Rosendal, F., et al. Does chronic low dose treatment with ciclosporin influence the brain? A histopathological study in pigs. Transplantation Proc. 37 (8), 3305-3308 (2005).
- Nielsen, M. S., Sørensen, J. C., Bjarkam, C. R. The substantia nigra pars compacta of the minipig: An anatomical and stereological study. Brain Struct Funct. (4-5), 481-488 (2009).
- Sørensen, J. C., Bjarkam, C. R., Simonsen, C. Z., Danielsen, E., Geneser, F. A. Oriented sectioning of irregular tissue blocks in relation to computerized scanning modalities. Results from the domestic pig brain. J Neurosci Methods. 104, 93-98 (2000).
- Bjarkam, C. R., Pedersen, M., Sørensen, J. C. New strategies for embedding, orientation and sectioning of small brain specimens enable direct correlation to MR-images, brain atlases, or use of unbiased stereology. J Neurosci Methods. 108, 153-159 (2001).
- Bjarkam, C. R., Sørensen, J. C., Geneser, F. A. Distribution and morphology of serotonin-immunoreactive axons in the hippocampal region of the New Zealand white rabbit. I. Area dentata and hippocampus proper. Hippocampus. 13 (1), 21-37 (2003).
- Bjarkam, C. R., Glud, A. N., Orlowski, D., Sørensen, J. C., Palomero-Gallagher, N. The telencephalon of the minipig, cytoarchitecture and cortical surface anatomy. Brain Struct Funct. , (2016).
- Boltze, J., Nitzsche, B., Geiger, K. D., Schoon, H. A. Histopathological investigation of different MCAO modalities and impact of autologous bone marrow mononuclear cell administration in an ovine stroke model. Transl Stroke Res. 2, 279-293 (2011).
- Jortner, B. S. The return of the dark neuron. A histological artifact complicating contemporary neurotoxicologic evaluation. Neurotoxicology. 27, 628-634 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon