È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Tramite un Chip olfattiva di microfluidica adattato per l'Imaging dell'attività neuronale in risposta ai feromoni in neuroni di testa maschio C. Elegans
In questo articolo
Riepilogo
L'uso di un "chip olfattivo" adattato per l'imaging del calcio efficiente dei maschi di c. elegans è descritto qui. Sono indicati anche gli studi di esposizione maschio a glicerolo e ad un feromone.
Abstract
L'uso di indicatori di calcio ha notevolmente migliorato la nostra comprensione delle dinamiche neurali e regolamento. Il nematode Caenorhabditis elegans, con il suo sistema nervoso completamente mappato e trasparente anatomia, presenta un modello ideale per comprendere dinamiche neurali in tempo reale utilizzando indicatori di calcio. In combinazione con tecnologie di microfluidica e disegni sperimentali, calcio-formazione immagine studia usando questi indicatori vengono eseguite in animali liberi di muoversi e intrappolati. Tuttavia, la maggior parte degli studi precedente che utilizzano dispositivi di cattura, come il chip olfattivo descritto in Chronis et al., hanno dispositivi progettati per l'uso nell'ermafrodita più comune, come l'uomo meno comuni si sia morfologicamente e strutturalmente dissimili. Un chip olfattivo adattato è stato progettato e fabbricato per una maggiore efficienza nella formazione immagine di un neurone maschile con l'utilizzo di animali adulti, giovani. Una svolta fu incorporata il worm carico porta a ruotare gli animali e per consentire la separazione dei singoli neuroni all'interno di una coppia bilaterale in imaging 2D. Vermi sono esposti ad un flusso controllato di odorizzante all'interno del dispositivo di microfluidica, come descritto in precedenti studi ermafroditi. Transitori di calcio vengono poi analizzati utilizzando il software open-source ImageJ. La procedura descritta nel presente documento dovrebbe consentire una maggiore quantità di uomo-base di c. elegans calcio formazione immagine studia, approfondire la nostra comprensione dei meccanismi di segnalazione di un neurone di sesso-specifici.
Introduzione
Dispositivi microfluidici consentono un maggiore accesso alle precisamente ambienti controllati, in cui animali, come il nematode c. elegans, può essere manipolato sperimentalmente1. Questi studi comprendono le analisi comportamentali, studi di formazione immagine del calcio o proiezioni anche per specifici fenotipi, conseguente misure più esatte di risultati sperimentali1,2,3,4, 5,6. Microfluidica fornisce condizioni liquide su scala ridotta attraverso il quale è possono eseguire esperimenti dettagliati mentre utilizzando quantità minime di reagenti. C'è una produzione costante di nuovi modelli di dispositivi microfluidici, e sull'utilizzo di ognuno varia, dalle arene che consentono il movimento sinusoidale naturale di c. elegans in analisi comportamentale e studi di imaging neurali intercettare i dispositivi utilizzati nell'imaging neurale e studi olfattivi, ai dispositivi che consentono per analisi fenotipica di alto-rendimento in genetica schermi4,5,6,7. In seguito la realizzazione di uno stampo master, sono poco costosi costruire dispositivi microfluidici — dato la riusabilità del Maestro — e facile da usare, che permette per la generazione di dati rapida tramite studi di alto-rendimento. La fabbricazione di dispositivi utilizzando polimeri come il polidimetilsilossano (PDMS) consente la creazione di nuovi dispositivi entro ore.
Studi di formazione immagine del calcio utilizzano indicatori di calcio codificato geneticamente (GECIs) espressi in cellule bersaglio per misurare la dinamica neurale di quelle cellule in tempo reale8,9,10,11. La natura trasparente di c. elegans consente la registrazione dei livelli fluorescente di queste proteine animali vivi. Tradizionalmente, GECIs affidano la proteina fluorescente verde (GFP)-basato su sensore GFP-calmodulina-M13 Peptide (GCaMP), anche se gli studi più recenti hanno adattato questi sensori per consentire migliore rapporto segnale-rumore e profili di eccitazione rosso-spostato. In seguito allo sviluppo di GCaMP3, proteine con queste specifiche hanno variato, compresi sensori quali GCaMP6s e GCaMP6f (lento e veloce fluorescenza off-tariffe, rispettivamente), così come RFP-calmodulina-M13 Peptide (RCaMP), che ha spostato un rosso Profilo di attivazione. La combinazione di questi GECIs con sequenze di c. elegans cellula-specifico gene promotore può mirare le cellule di interesse, i neuroni sensoriali in particolare12,13,14,15 , 16.
Mentre la facilità d'uso di c. elegans negli studi di microfluidica è evidente, quasi tutti gli studi si sono concentrati su ermafroditi. Nonostante i maschi solo contabilità per 0,01-0,02% della popolazione wild-type, inestimabili risultati possono derivare da loro caratterizzazione. Mentre il connettoma fisico del sistema nervoso Ermafrodito è stato completamente mappato per decenni17, il connettoma maschio rimane incompleto, soprattutto nella regione della testa dell' animale18. L'uso di formazione immagine del calcio nei maschi contribuirà a generare una comprensione del sistema nervoso maschile e le differenze che emergono tra i due sessi. Le dimensioni più piccole dei maschi adulti di c. elegans previene intrappolamento efficace e affidabile nelle porte di caricamento dei tradizionali dispositivi olfattivi progettati per grandi ermafroditi. Per risolvere questo problema, una versione modificata del Chip olfattivo Chronis19 è stata sviluppata con un orificio di caricamento più stretto, una minore altezza del canale e si trasforma nel verme orificio di caricamento (che ruotare l'animale), consentendo la visualizzazione dei bilaterale sinistra/destra coppie di un neurone. Questo design consente: (1) l'efficace intrappolamento di giovani maschi adulti, (2) un orientamento più affidabile dell'animale per la visualizzazione di entrambi i membri dei neuroni accoppiati bilaterali e (3) l'immagine precisa dell'attività neurale in neuroni maschili.
Sempre più, gli studi mostrano che i maschi di c. elegans rispondano diversamente che ermafroditi a una varietà di ascarosides (ascr), o nematode feromoni20,21,22,23 ,24. Pertanto, lo sviluppo di una comprensione delle dinamiche neurali e rappresentazioni all'interno il connettoma maschio è diventata ancora più pertinente. Maschio di c. elegans contengono 87 sesso-specifici neuroni non presenti nel ermafroditi25,26, alterando il connettoma in come-modi ancora indeterminati. Essendo in grado di queste dinamiche neurali uniche di immagine ci permetterà di comprendere meglio le risposte sesso-specifici e rappresentazioni neurali.
Questo protocollo descrive l'uso di un chip olfattivo uomo-adattato per l'imaging neurale del maschio c. elegans chemosensation. Il neurone nocicettivo che Ash risponde in modo affidabile a glicerolo 1 M nei maschi, coerenti con le precedenti Ermafrodito studia27. L'esposizione a ascarosides può suscitare le risposte che sono variabili da un animale a altro, che richiedono un numero maggiore di animali da sottoporre. La risposta dei neuroni CEM maschio-specific precedentemente è stata indicata, attraverso sia di elettrofisiologia e di calcio formazione immagine studia, per rispondere in modo variabile a ascaroside #323.
Protocollo
1. fabbricazione di dispositivi
Nota: Vedi riferimento 1.
Nota: stampi in silicone master furono fabbricati usando tecniche fotolitografiche standard per patterning photoresist SU-8 su un silicio Maestro 1 , 7. Maschere fotografiche per la modellatura del wafer sono stati stampati a 25.000 dpi. Le caratteristiche del dispositivo uomo-adattato un Chip olfattivo Chronis progettare 19 con un cambiamento nel verme orificio di caricamento, adattando un disegno ottenuto da M. Zimmer (corrispondenza personale, 2016). Una svolta è inclusa per controllare la rotazione degli animali. La larghezza del worm caricamento porto canale si restringe a 50 μm. Tutti i canali sono 32 μm alto. Una volta che una muffa del silicone master è disponibile per l'utente, l'utente può seguire il successivo protocollo, come descritto in precedenza 1.
- Agente di base e polimerizzazione di PDMS Mix con un rapporto di 10:1 in peso.
- Mescolare accuratamente con pipette di trasferimento.
- Degas la miscela in un essiccatore sotto vuoto per 1 h, finché non vengono rimosse tutte le bolle visibili.
- Versare il composto su un maestro di stampo di silicone in un piatto di diametro 150 mm fino a 5 mm di spessore (100 g). Utilizzare una pipetta Pasteur per rimuovere eventuali bolle o polvere che sono stati introdotti alla miscela.
- Cuocere in forno a 65 ° C per almeno 3 h, o durante la notte.
- Tagliare il PDMS lontano lo stampo usando un bisturi e tagliate i dispositivi separati usando una lama di rasoio.
- Punch fori di entrata e di uscita con un punch cutaneo di 1 mm.
- a filo i fori con dH 2 O, etanolo e di nuovo con dH 2 O per rimuovere le particelle dai pugni. Asciugare il dispositivo in un impulso di flusso aria.
- Pulire entrambi i lati di canale e il lato superiore del dispositivo con nastro adesivo, rimuovendo eventuale polvere o detriti rimanenti sul dispositivo per consentire riuscito legame.
- Plasma-bond il dispositivo, canale-lato verso il basso per un vetro di copertura di n. 1.
Vetro di copertura
- esporre e dispositivo (canale-lato alto) al plasma ad aria utilizzando le condizioni che consentono il corretto incollaggio, ad esempio 100 W per 30 s o 24 W per 60 s.
Nota: Le impostazioni possono essere regolate per migliorare l'efficienza di legame. Le condizioni di incollaggio al plasma non sono critiche come una corretta pulizia durante il tentativo di migliorare l'efficienza di legame. Un dispositivo non sufficientemente pulito non legherà, anche in condizioni di plasma ideale. - Inverti il vetro di copertura sul lato canale del dispositivo e premere verso il basso con il pollice per 5 s.
- esporre e dispositivo (canale-lato alto) al plasma ad aria utilizzando le condizioni che consentono il corretto incollaggio, ad esempio 100 W per 30 s o 24 W per 60 s.
2. Preparazione del buffer
- diluire 1 x S basali (100 mM NaCl e 0,05 M KPO 4, pH 6.0) da uno stock di sterile 10 x.
- Diluire 1 M Tetramisolo stock ad una concentrazione finale di 1 mM a 1 x S basali per tutte le soluzioni tampone.
- Aggiungere della fluorescina per entrambi il " controllo di flusso " e " buffer " serbatoi.
- Creare uno stock di 100 mg/mL di fluorescina in 1x basali di S.
- Diluire il brodo a concentrazioni finali di 1 µ g/mL nel controllo di flusso e 0,1 µ g/mL nel buffer.
- Creare stimoli.
- Glicerolo diluito ad una concentrazione finale di 1 M in 1 X basali di S.
- Diluito ascaroside #3 (ascr n. 3) ad una concentrazione finale di 1 µM in 1 X basali di S.
3. Configurazione del dispositivo
Nota: vedere 1.

Figura 1. Installazione di dispositivi microfluidici. (A) serbatoi e tubi. Un 30 mL siringa senza uno stantuffo serve come la " reservoir. " questo è collegato ad una valvola Luer con tre opzioni di flusso. Una presa è collegata ad una siringa da 3 mL con uno stantuffo, mentre l'altro è collegato ad un ago (arancione) che viene inserito nel tubo che si connette al dispositivo microfluidico. (B) il totale installazione di microfluidica esperimento di imaging. Il dispositivo è posizionato su un palco di un microscopio a epifluorescenza invertito, sopra le lenti dell'obiettivo. Il " controllo di flusso " buffer viaggia attraverso una valvola a 3 vie che è controllata da un'unità sulla mensola sopra il programma di installazione. Linee che contengono buffer vengono quindi inseriti nelle porte dispositivo appropriato. (C) le porte del dispositivo microfluidico. Il " controllo di flusso " porte fiancheggiano le altre porte di ingresso: il " stimolo " e " buffer " porte. La " presa " porta è la porta più a destra. A causa della posizione dell'arena caricamento verme, il " vite senza fine caricamento " porta è la porta centrale-la maggior parte sul dispositivo. Clicca qui per visualizzare una versione più grande di questa figura.
- Preparare tre serbatoi fluido collegando una siringa di 30 o 60 mL per valvola a 3 vie Luer, con una siringa da 3 mL e un ago attaccato alla valvola Luer pure (come in Figura 1A). Collegare l'ago al tubo che si estende al dispositivo microfluidico (come in Figura 1A -B).
- Rimuovere le bolle d'aria dal serbatoio e tubi.
- Riempire la siringa da 3 mL con annesso tubo con 1 x S basali e inserirlo nella presa di corrente porta.
- Applicare una leggera pressione sulla siringa fino a quando il buffer viene visualizzato in cima i fori di entrata.
- Collegare il controllo di flusso, buffer e tubazione di stimolo ai fori di ingresso appropriata (come in Figura 1B -C), garantendo che le gocce liquide sono presenti su entrambi l'orificio di caricamento foro e la tubatura di buffer da allegare.
- Ancora una volta, applicare una leggera pressione sulla siringa che è collegato alla porta presa fino a quando le goccioline appaiono nel verme ingresso porta di caricamento.
- Inserire una spina di bloccaggio solida nel verme caricamento porta.
- Rimuovere la siringa dal bocchettone e collegare la linea di uscita collegata all'aspirapolvere di casa (-670 Torr).
- Ispezionare il dispositivo per qualsiasi bolle nel flusso di canali, visivamente e attraverso la conferma a video tramite un software compatibile con la fotocamera utilizzata, come il software open-source Micro-Manger. Vedere il passaggio 6 per suggerimenti sull'utilizzo di Micro-Manager.
- Se le bolle sono presenti, aspettare per farli sloggiare o essere assorbite il PDMS parete prima di caricare qualsiasi animali; la presenza di bolle disturberà il corretto flusso di fluidi attraverso il dispositivo.
- Utilizzando un filtro GFP, confermare la dinamica del flusso corretto all'interno del dispositivo prima del verme caricamento aprendo la valvola a 3 vie e osservando la commutazione di buffer.
- Determinare la dinamica di flusso adeguato: osservare la fluoresceina presente nelle soluzioni di controllo e buffer di flusso ( Figura 2D -2E), quando viene modificato il valore del controllo di flusso premendo il controllo pulsante corrispondente per la valvola a 3 vie sul link valvola ( Figura 1B).
- Dopo l'apertura di Micro-Manager, fare clic su " Live " di osservare un'immagine in diretta del dispositivo. Accendere la sorgente luminosa fluorescente per osservare il flusso di buffer nel dispositivo ( Figura 2D -2E).
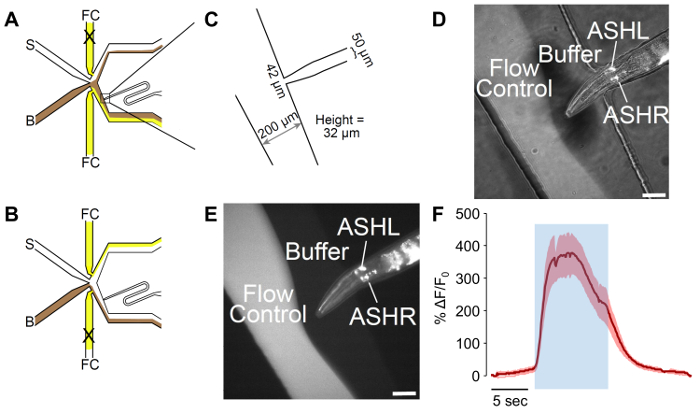
Figura 2: Un chip olfattiva di microfluidica uomo-adattato. (A) il flusso di modelli del dispositivo quando il worm è esposto al buffer. Tampone (B) è indicato in marrone, e controllo di flusso (FC) viene visualizzato in giallo, con stimolo (S) in bianco. Il worm orificio di caricamento è stato adattato per includere una curva, che permette per un migliore controllo dell'orientamento del verme. (B), il flusso di modelli del dispositivo quando il worm è esposto allo stimolo. Tampone (B) è indicato in marrone, e controllo di flusso (FC) viene visualizzato in giallo, con stimolo (S) in bianco. (C) misure del dispositivo adattato come fabbricato. Il worm orificio di caricamento finisce in un 42 µm di apertura, con un 50 µm canale progettato per la larghezza del maschio. L'altezza misurata dei canali è 32 µm, nonostante un obiettivo di 25 µm nella progettazione. (D-E) Intrappolati A maschio esprimenti p sra-6:: GCaMP3. Il promotore di sra-6 non è specifico di ASH, e alcune espressioni possono essere osservati nel neurone ASI, anche se non transitori di calcio sono stati osservati in ASI. L'immagine è (D), una combinazione di illuminazione campo chiaro e fluorescente, mentre (E) è fluorescente solo. Le barre di scala denotano 42 µm. (F) l'ASH neurone risponde alla stimolazione di glicerolo di 1m con robusta attività neurale. La zona blu indica il tempo dello stimolo di glicerolo di 1m. L'area ombreggiata indica l'errore standard, con n = 20 impulsi da sette vermi. Le tracce rosse denotano depolarizzazione risposte. La y mostrano ΔF/F 0. La barra della scala indica 5 s. Clicca qui per visualizzare una versione più grande di questa figura.
4. preparazione animale
Nota: Vedi riferimento 23.
- Risposte imaging ASH a glicerolo 1 M.
- Posto circa 20 c. elegans maschi che sono positivi per p sra-6:: espressione di matrice GCaMP3 su una piastra di agar (NGM) media crescita del nematode seminato con un prato di OP50 Escherichia coli. Utilizzare l'espressione di GECI fluorescenti e/o un indicatore di co-iniezione per l'identificazione degli animali di matrice positiva.
Nota: Animali positivi matrice darà fluorescenza secondo GECI utilizzato (cioè, animali che esprimono GCaMP darà fluorescenza verde sotto stimolazione di luce blu, mentre gli animali RCaMP darà fluorescenza rosso sotto stimolazione luce verde). Marcatori di co-iniezione possono variare da altre proteine fluorescenti, come GFP e RFP, a marcatori fenotipici, come rol-6, o possono salvare un fenotipo dominante, come il pha-1 mutazione 28.- Se raccogliendo immediatamente prima del saggio, pick giovani maschi adulti. Se selezionando il giorno prima del dosaggio, prendere maschi larvali L4.
- Posto circa 20 c. elegans maschi che sono positivi per p sra-6:: espressione di matrice GCaMP3 su una piastra di agar (NGM) media crescita del nematode seminato con un prato di OP50 Escherichia coli. Utilizzare l'espressione di GECI fluorescenti e/o un indicatore di co-iniezione per l'identificazione degli animali di matrice positiva.
- Imaging le risposte CEM a 1 µM ascr n. 3.
- Pick circa 20 L4 c. elegans maschi (fkEx98 [::GCaMP::SL2::dsRED pkd-2 p + pBX-1]; PHA-1 (e2123ts); lui-5 (e1490); Lite-1 (ce314)) che sono positivi per l'espressione di marcatori di co-iniezione dsRed.
Nota: dsRed espressione all'interno dei neuroni di ray del racconto maschile è più facile da osservare e confermare che l'espressione di GCaMP all'interno dei quattro neuroni CEM. - Isolare questi maschi da ermafroditi su una piastra di agar NGM seminato con un prato di OP50 Escherichia coli per 5-14 h prima di eseguire l'esperimento imaging.
Nota: I maschi non isolati per un minimo di 5 h comportamentale non rispondono alla ascr n. 3 e pertanto possono esibire ancor meno transitori di calcio per la ascaroside rispetto a quanto osservato qui.
- Pick circa 20 L4 c. elegans maschi (fkEx98 [::GCaMP::SL2::dsRED pkd-2 p + pBX-1]; PHA-1 (e2123ts); lui-5 (e1490); Lite-1 (ce314)) che sono positivi per l'espressione di marcatori di co-iniezione dsRed.
5. Caricamento degli animali
Nota: vedere refefence 1.
- Prendere un verme su una piastra di agar NGM non teste di serie utilizzando tecniche di manutenzione standard worm.
- Pick vermi di fiammeggiante un pick (fatto di filo di platino appiattito), raccogliendo i batteri sul pick, e " tamponando " un verme per raccoglierlo. Posizionare delicatamente il worm sulla nuova piastra, permettendogli di strisciare fuori da sè.
- Aggiungere circa 5 mL di 1x S basali alla piastra non teste di serie, tale che la piastra è invaso.
- Disegnare la vite senza fine in una siringa di carico (cioè, siringa da 3 mL con annesso tubo) che è stato pre-riempita con 1 x basali di S.
- Essere sicuri di succhiare il worm solo nel tubo, non tutto nella siringa.
Nota: Se il worm si sposta nella siringa, è quasi impossibile ottenerlo indietro nel tubo.
- Essere sicuri di succhiare il worm solo nel tubo, non tutto nella siringa.
- Spegnere il vuoto per fermare il flusso girando la valvola di uscita Luer.
- Rimuovere il perno solido blocco lombrico caricamento porta.
- Girare la valvola Luer collegata alla porta presa ( Figura 1B) in modo che esso è ventilazione.
Nota: Utilizzare un video live feed durante il caricamento il worm per confermare la posizione e l'orientamento dell'animale (passaggi 5.8-5.13). - Inserire la vite senza fine tubo nel verme porta di carico di carico
- Applicare una leggera pressione sulla siringa fino a che il worm appare il canale caricamento.
- Se il worm inizia a entrare nel canale coda-primo, tirare lo stantuffo della siringa per impedire che il worm entrando il canale.
- Interruttore tra l'applicazione e inversione di pressione fino a quando la testa entra nel canale primo.
- Apri il vuoto ruotando la valvola a 3 vie Luer collegato alla porta uscita per aprirlo a vuoto invece di atmosfera.
- Applicare manualmente la pressione premendo lo stantuffo della siringa per orientare e posizionare la testa del verme tale che è esposto per il canale di flusso di buffer, ma non così lontano che la testa può muoversi liberamente ( Figura 2 D-2E).
6. Stimolo e acquisizione
- utilizza un software open source microscopia, come Micro-Manager, registrare mediante l'acquisizione di immagini come una pila TIFF a 10 fotogrammi/s con luce blu eccitazione (470 nm) per 30 s.
- Impostare l'esposizione su menu principale per 100 ms.
- Open " multi-D Acq. " dal menu principale del software. Impostare il " numero " a " 300, " e il " intervallo " a " 0. " scegliere " Acquire! " per acquisire il video.
- Applica un impulso di 10 s di stimolo 5 s dopo l'inizio della acquisizione. Regolare la durata di applicazione di stimolo come desiderato.
- Dopo l'acquisizione di 5 s di video, cambiare la valvola a 3 vie il buffer di controllo di flusso per applicare lo stimolo per l'animale in fase di test di controllo. Fare clic sul pulsante più a sinistra sul link valvola ( Figura 1B).
- Dopo 10 s di esposizione di stimolo (questo tempo può essere regolato a piacere dall'utente), modificare il flusso di buffer premendo nuovamente il pulsante più a sinistra sul link valvola.
- Record sotto buffer solo fino al termine per consentire la fluorescenza GECI tornare alla linea di base della finestra di 30-s.
- Ripetere come desiderato. Aspettare 30 s tra la fine dell'acquisizione e l'inizio della prossima prova.
7. Analisi dell'immagine
- aprire lo stack TIFF con il software open-source, ImageJ, trascinando il file nella finestra di ImageJ.
- Fare clic con il cursore e trascinare per impostare la regione di interesse (ROI) il neurone di interesse. Impostare l'area di includere il soma del neurone di interesse (come in Figura 3A).
- Plot z-stack dell'intensità di fluorescenza del ROI attraverso pile facendo clic su Apri-> immagine - > pile - > tracciare il profilo dell'asse z.
- Clic " elenco " nella finestra che si apre. Fare clic su modifica - > copia per copiare i valori. Incollare i valori in un foglio di calcolo.
- Analizzare la fluorescenza di fondo per ogni impulso trascinando il ROI di una regione del worm che non contengono espressioni GCaMP.
- Eseguire la sottrazione di sfondo per ogni impulso sottraendo il valore di fluorescenza di fondo dal valore di intensità di fluorescenza del neurone.
- ΔF/F 0 per ogni fotogramma di ogni impulso di calcolare.
- Calcolare F 0 come valore di intensità media del ROI per primo 1 s di acquisizione (ad es., 1-10 di fotogrammi).
- ΔF/F 0 viene calcolato dividendo il valore sottratto a sfondo per il frame di interesse per il valore calcolato di 0 F.
- Ripetere per ogni neurone imaged ed ogni impulso di stimolo.
- Per i neuroni con profili di risposta coerente, come ASH, media tutti gli impulsi per ogni neurone e calcolare il SEM (come in Figura 2F).
- Tracciare il medio ΔF/F 0 con SEM nel tempo per ogni neurone.
Nota: In questo caso, è pratica comune per includere heatmaps delle risposte neuronali individuali di ogni prova pure. In neuroni che non manifestano in transitori di calcio sopra l'esposizione agli stimoli attraverso stimolazioni ripetute modifiche coerenti, o in diversi individui 23, può essere più applicabile per mostrare tracce di impulso specifico (come in Figura 4). Vedere la discussione per ulteriori informazioni su come determinare come visualizzare i dati.
Risultati
Un esempio dell'impostazione generale del dispositivo può essere visto in Figura 1A-B. Figura 1A raffigura il serbatoio corretta costruzione e installazione. Figura 1B Mostra le connessioni dei serbatoi al dispositivo microfluidico. Figura 1 raffigura un dispositivo microfluidico con singole porte etichettate per chiarezza.
Discussione
Il chip olfattivo uomo-adattato incorpora una girata in un orificio di caricamento più stretto, che permette per un maggiore controllo dell'orientamento e per il trapping efficiente del maschio c. elegans. Ciò consente la visualizzazione di entrambi i membri sinistro e destro di un neurone coppie bilaterale, senza la necessità per l'impilamento di z. Questa curva conduce ad un orientamento da verticale 100% del tempo a worms dove soltanto un accoppiamento bilaterale si rivolge con un marcatore fluorescente, c...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Vorremmo ringraziare Manuel Zimmer per averci fornito il file di progetto iniziale che è stato adattato per l'uso con i maschi; Frank Schroeder per la sintesi e la fornitura di ascr n. 3; Ross Lagoy per l'intuizione e l'assistenza con imaging e l'analisi; e Laura Aurilio per la realizzazione di master e che, insieme a Christopher Chute, ha contribuito alla revisione del manoscritto. Finanziamento di quest'opera fu fornito sotto il National Institutes of Health grant 1R01DC016058-01 (J.S.), il National Science Foundation grant CBET 1605679 (D.R.A.) e il premio alla carriera Burroughs Wellcome all'interfaccia scientifica (D.R.A.).
Materiali
| Name | Company | Catalog Number | Comments |
| Silicon Wafer | University Wafer | 452 | |
| SU-8 2035 | MicroChem | Y111070-0500L1GL | |
| Developer | MicroChem | Y020100-4000L1PE | |
| Wafer Mask | Cad/Art Services | - | Custom order. Printed at 25,000 dpi. |
| Sylgard-184 | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | |
| 1.0 mm Dermal Punches | Acuderm Inc. | P150 | |
| Soft Tubing | Cole-Palmer | EW-06419-01 | |
| Hard Tubing | IDEX Health & Science | 1622 | |
| Pins | New England Small Tube | NE-1027-12 | |
| Blocking Pins | New England Small Tube | 0.415/0.425" OD x .500 Long | Batch PB07027 |
| 3 mL syringes | BD | 309657 | |
| 30 mL syringes | Vitality Medical | 302832 | Used as buffer reservoirs. |
| Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer | Component Supply Company | NE-231PL-50 | |
| Stopcocks with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile | Cole-Palmer | EW-30600-07 | |
| Fisherfinest Premium Cover Glass | Fisher Scientific | 12-548-5M | |
| Mercator Control System LF-5 Plasma System | Mercator | LF-5 | |
| Scotch Tape | Scotch | BSN43575 | |
| Series 20 Chamber | Warner Instruments | P-2 | |
| Vacuum Desicator | Bel-Art Scienceware | 420250000 | 24 cm inner diameter. |
| Weigh Boats | Cole-Palmer | EW-01017-27 | |
| Classic Plus Balance | Mettler Toledo | PB1501-S/FACT | |
| Glass Pasteur Pipettes | Cole-Palmer | EW-25554-06 | |
| Transfer pipettes | Genesee Scientific | 30-202 | |
| Oven | Sheldon Manufacturing Inc | 9120993 | Model Number: 1500E. |
| 60 mm, non-vented, sharp edge Petri dishes | TriTech Research | T3308 | |
| Zeiss Axio Observer.A1 | Zeiss | - | |
| Hammamatsu Orca Flash 4.0 Digital CMOS | Hammamatsu | C11440-22CU | |
| Blue Fluorescent Light | Lumencor | SOLA SM6-LCR-SA | 24-30V/7.9A DC. |
| Illumination Adaptor | Zeiss | 423302-0000 | |
| Series 1 and 2 Miniature Inert PTFE Isolation Valve | Parker | 001-0017-900 | 3-way valve for controlling flow. |
| ValveLink8.2® | AutoMate Scientific | 01-18 | Flow Switch Controller |
| Micro Manager | Micro-Manager | - | Free software, can be downloaded at: https://www.micro-manager.org/wiki/Download_Micro-Manager_Latest_Release |
| ImageJ | ImageJ | - | Free software, can be downloaded at: https://imagej.nih.gov/ij/download.html |
| Agar, Bacteriological Grade | Apex | 9012-36-6 | |
| Peptone | Apex | 20-260 | |
| CaCl2 | VWR | BDH0224-1KG | |
| MgSO4 | Sigma-Aldrich | 230391-1kg | |
| Cholesterol | Alfa Aesar | A11470 | |
| Ethanol | Sigma-Aldrich | 270741-4L | |
| Tetramisole | Sigma-Aldrich | L9756-10(G) | Store at 4 °C. |
| Fluorescein | Sigma-Aldrich | FD2000S-250mg | Light Sensitive. Store in photoprotective vials. |
| Glycerol | Sigma-Aldrich | G6279-1L | |
| Ascaroside #3 | - | - | Synthesized in the Schroeder Lab (Cornell University). |
| NaCl | Genesee Scientific | 18-215 | |
| KH2PO4 | BDH | BDH9268.25 | |
| K2HPO4 | J.T. Baker | 3252-025 | |
| ASH GCaMP3 line | - | - | CX10979 (KyEx2865 [psra-6::GCAMP3 @ 100 ng/uL]). Developed in Bargmann lab. Provided from Albrecht Lab library. |
| CEM GCaMP6 line | - | - | JSR49 (FkEx98[ppkd-2::GCaMP::SL2::dsRED + pBX-1]; pha-1(e2123ts); him-5(e1490); lite-1(ce314)). Developed by Robyn Lints. Provided from Srinivasan Lab library. |
| E. coli (OP50) | Caenorhabditis Genetics Center | OP50 | |
| "Reservoir" | - | - | To create a Reservoir: A "30 mL syringe", is connected to a "Stopcock with Luer connections; 3-way; male lock; 5 flow pattern; non-sterile", which is connected to a "3 mL syringe" and a "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer". The "Stainless Steel Blunt Needle 23 Gauge, Polyprolylene Luer" is then inserted into "Soft Tubing" approximately 1/3 of the way down the needle. |
Riferimenti
- Lagoy, R. C., Albrecht, D. R. Microfluidic Devices for Behavioral Analysis, Microscopy, and Neuronal Imaging in Caenorhabditis elegans. Methods Mol Biol. 1327, 159-179 (2015).
- Ben-Yakar, A., Chronis, N., Lu, H. Microfluidics for the analysis of behavior, nerve regeneration, and neural cell biology in C. elegans. Curr Opin Neurobiol. 19 (5), 561-567 (2009).
- Chronis, N. Worm chips: Microtools for C. elegans biology. Lab on a Chip. 10 (4), 432-437 (2010).
- Lee, H., Crane, M. M., Zhang, Y., Lu, H. Quantitative screening of genes regulating tryptophan hydroxylase transcription in Caenorhabditis elegans using microfluidics and an adaptive algorithm. Integr Biol (Camb). 5 (2), 372-380 (2013).
- Lockery, S. R., et al. A microfluidic device for whole-animal drug screening using electrophysiological measures in the nematode C. elegans. Lab Chip. 12 (12), 2211-2220 (2012).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nat Commun. 7, 13023 (2016).
- Larsch, J., Ventimiglia, D., Bargmann, C. I., Albrecht, D. R. High-throughput imaging of neuronal activity in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 110 (45), E4266-E4273 (2013).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Front Mol Neuro. 6, 2 (2013).
- Badura, A., Sun, X. R., Giovannucci, A., Lynch, L. A., Wang, S. S. H. Fast calcium sensor proteins for monitoring neural activity. Neurophotonics. 1 (2), 025008 (2014).
- Tatro, E. T. Brain-wide imaging of neurons in action. Front Neural Circuits. 8, 31 (2014).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat Methods. 6 (12), 875-881 (2009).
- Greene, J. S., et al. Balancing selection shapes density-dependent foraging behaviour. Nature. 539 (7628), 254-258 (2016).
- Greene, J. S., Dobosiewicz, M., Butcher, R. A., McGrath, P. T., Bargmann, C. I. Regulatory changes in two chemoreceptor genes contribute to a Caenorhabditis elegans QTL for foraging behavior. Elife. 5, (2016).
- Kim, K., et al. Two Chemoreceptors Mediate Developmental Effects of Dauer Pheromone in C. elegans. Science. 326 (5955), 994-998 (2009).
- McGrath, P. T., et al. Parallel evolution of domesticated Caenorhabditis species targets pheromone receptor genes. Nature. 477 (7364), 321-325 (2011).
- Schmitt, C., Schultheis, C., Husson, S. J., Liewald, J. F., Gottschalk, A. Specific Expression of Channelrhodopsin-2 in Single Neurons of Caenorhabditis elegans. PLoS ONE. 7 (8), e43164 (2012).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The Structure of the Nervous System of the Nematode Caenorhabditis elegans. Phil Trans of the Royal Soc of Lon. 314 (1165), 1 (1986).
- White, J. Q., et al. The sensory circuitry for sexual attraction in C. elegans males. Curr Biol. 17 (21), 1847-1857 (2007).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat Meth. 4 (9), 727-731 (2007).
- Chute, C. D., Srinivasan, J. Chemical mating cues in C. elegans. Semin Cell Dev Biol. 33, 18-24 (2014).
- Izrayelit, Y., et al. Targeted metabolomics reveals a male pheromone and sex-specific ascaroside biosynthesis in Caenorhabditis elegans. ACS Chem Biol. 7 (8), 1321-1325 (2012).
- Ludewig, A. H., Schroeder, F. C. Ascaroside signaling in C. elegans. WormBook. , 1-22 (2013).
- Narayan, A., et al. Contrasting responses within a single neuron class enable sex-specific attraction in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 113 (10), E1392-E1401 (2016).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Sammut, M., et al. Glia-derived neurons are required for sex-specific learning in C. elegans. Nature. 526 (7573), 385-390 (2015).
- Sulston, J. E., Albertson, D. G., Thomson, J. N. The Caenorhabditis elegans male: postembryonic development of nongonadal structures. Dev Biol. 78 (2), 542-576 (1980).
- Hilliard, M. A., et al. In vivo imaging of C. elegans ASH neurons: cellular response and adaptation to chemical repellents. The EMBO Journal. 24 (1), 63-72 (2005).
- Evans, T. C. Transformation and microinjection. WormBook. , (2006).
- Cáceres, I. d. C., Valmas, N., Hilliard, M. A., Lu, H. Laterally Orienting C. elegans Using Geometry at Microscale for High-Throughput Visual Screens in Neurodegeneration and Neuronal Development Studies. PLoS ONE. 7 (4), e35037 (2012).
- Schrodel, T., Prevedel, R., Aumayr, K., Zimmer, M., Vaziri, A. Brain-wide 3D imaging of neuronal activity in Caenorhabditis elegans with sculpted light. Nat Methods. 10 (10), 1013-1020 (2013).
- García, L. R., Portman, D. S. Neural circuits for sexually dimorphic and sexually divergent behaviors in Caenorhabditis elegans. Curr Opin Neurobiol. 38, 46-52 (2016).
- Clokey, G. V., Jacobson, L. A. The autofluorescent "lipofuscin granules" in the intestinal cells of Caenorhabditis elegans are secondary lysosomes. Mech Ageing Dev. 35 (1), 79-94 (1986).
- Coburn, C., et al. Anthranilate Fluorescence Marks a Calcium-Propagated Necrotic Wave That Promotes Organismal Death in C. elegans. PLoS Biology. 11 (7), e1001613 (2013).
- Macosko, E. Z., et al. A hub-and-spoke circuit drives pheromone attraction and social behaviour in C. elegans. Nature. 458 (7242), 1171-1175 (2009).
- Park, D., et al. Interaction of structure-specific and promiscuous G-protein-coupled receptors mediates small-molecule signaling in Caenorhabditis elegans. Proc Natl Acad Sci U S A. 109 (25), 9917-9922 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon