Method Article
Un saggio di Burrowing/Tunneling per rilevazione di ipossia nelle larve di Drosophila melanogaster
In questo articolo
Riepilogo
Il protocollo descrive un'analisi semplice per identificare le larve di Drosophila melanogaster che stanno vivendo ipossia sotto i livelli normali di ossigeno atmosferico. Questo protocollo permette hypoxic larve deve essere distinto da altri mutanti che mostrano fenotipi sovrapposti ad esempio lentezza o crescita lenta.
Abstract
Privazione dell'ossigeno negli animali può derivare dall'esposizione a livelli bassi di ossigeno atmosferico o da danni ai tessuti interni che interferisce con la distribuzione di ossigeno. È anche possibile che il comportamento aberrante dei neuroni di rilevamento dell'ossigeno potrebbe indurre ipossia-come comportamento in presenza di livelli normali di ossigeno. In d. melanogaster, sviluppo a bassi livelli di ossigeno provoca l'inibizione della crescita e pigro comportamento durante le fasi larvali. Tuttavia, queste manifestazioni consolidate del deficit di ossigeno si sovrappongono notevolmente con i fenotipi di molte mutazioni che regolano la crescita, le risposte di sforzo o locomozione. Come risultato, non c'è attualmente nessun test disponibili per identificare i) cellulare ipossia indotta da una mutazione o ii) ipossia-come comportamento quando indotta dal comportamento di un neurone anormale.
Recentemente abbiamo identificato due comportamenti distintivi nelle larve di d. melanogaster che si verificano a livelli di ossigeno normale in risposta alla rilevazione interna di ipossia. In primo luogo, in tutte le fasi, tali larve evitare scavando cunicoli cibo, spesso randagi lontano dalla fonte di cibo. In secondo luogo, tunneling in un substrato morbido, che si verifica normalmente durante la terza tappa di instar errante è completamente abolita se le larve sono ipossiche. Il test qui descritto è stato progettato per rilevare e quantificare questi comportamenti e quindi per fornire un modo per rilevare ipossia indotta da danno interno piuttosto che esterno basso ossigeno. Piastre di dosaggio con un substrato di agar e una spina centrale della pasta di lievito sono utilizzate per sostenere gli animali attraverso la vita larvale. La posizione e lo stato delle larve vengono rilevate ogni giorno appena si procede dalla prima alla terza instar. Nella misura di tunneling in substrato agar durante fase errante è quantificata dopo impupamento usando ImageJ NIH. Il dosaggio sarà di valore per determinare quando l'ipossia è un componente di un fenotipo mutante e così fornire informazioni su possibili siti di azione del gene in questione.
Introduzione
La sofisticata gamma di strumenti genetici molecolari disponibili in d. melanogaster ne fanno un organismo prezioso per lo studio dei processi biologici evolutivamente conservati. Chiave risposte molecolari alla disponibilità di ossigeno hanno dimostrato di essere conservati attraverso l'evoluzione e studi precedenti in d. melanogaster hanno generato intuizioni i componenti universali di queste vie 1,2, di segnalazione 3,4,5,6.
Nell'ambito di uno studio volto a dissezione funzione del neurone sensoriale nelle larve di d. melanogaster , abbiamo identificato due risposte comportamentali che ha dimostrato di essere attivato da ipossia del tessuto normale dell'ossigeno livelli 7. Uno di questi, il mancato scavano nel cibo, è altamente relativo alla risposta a bassi livelli di ossigeno segnalato da Wingrove e o ' Farrell 8. Il secondo comportamento, guasto al tunnel in un substrato morbido durante il tardo terzo instar vagando fase, non era stati precedentemente identificato come relazione con l'ipossia. Abbiamo determinato che esponendo larve errante di tipo selvaggio a bassi livelli di ossigeno inoltre inibisce il substrato tunneling 7, stabilendo così che entrambi questi comportamenti hanno origine da ipossia - sia indotta da danno di tessuto o di livelli di assunzione di ossigeno basso. Qui descriviamo un'analisi che abbiamo sviluppato per quantificare questi due comportamenti indotti da ipossia, che inizia con osservazioni immediatamente dopo la schiusa larvale.
Risposte ipossiche nelle prime fasi larvali non sono state esaminate in precedenza e quindi eseguire un'analisi per tutta la vita larvale è una componente importante della nostra analisi. La maggior parte delle manifestazioni evidenti di ipossia – lento sviluppo, scarsa crescita e lentezza dell'apparato locomotore – si sovrappongono con i fenotipi larvali prodotti da molte mutazioni. Ma abbiamo trovato che solo terzo instar larve con ipossia mostrano un completo fallimento per 7un tunnel. Così, abbiamo determinato che larve anche più compromessi in termini di crescita e locomozione rispetto nostro larve hypoxic, ancora effettuato alcuni tunneling, considerando che larve ipossiche con tunnel mai 7. Un altro prezioso elemento di questo test è così che fornisce un modo per stabilire quando l'ipossia è la fonte di un particolare insieme di fenotipi pleiotropici, al contrario di alcuni altri stress o disfunzione metabolica. Come una dimostrazione del dosaggio, qui descriviamo il suo uso nel caratterizzare le risposte delle larve con ridotta espressione tracheale di uninflatable, un gene che funziona nel larvale airways 9.
Prevediamo che questo test sarà di valore per i ricercatori impegnati nella caratterizzazione dei fenotipi larvali che includono scarsa crescita e comportamento pigro. Di conseguenza, nuovi geni che influenzano la distribuzione, l'utilizzo o risposte, potrebbe essere identificato ossigeno in tutto il corpo. Inoltre, incorporare questo test un mutante protocollo di screening fornirebbe un percorso diretto ad identificare le mutazioni che producono ipossia. Questo test sarà anche prezioso nell'analizzare i circuiti che suscita i comportamenti innati indotta da ipossia descritti qui. Analisi di rete neurale di questo tipo sono un fuoco di molta ricerca corrente e il sistema nervoso semplice della larva d. melanogaster è un sistema prezioso per la dissezione fuori comportamenti automatizzati. Neuroni sensoriali coinvolte nella percezione del larvale ossigeno già individuati, fornendo un primo passo verso la definizione la circuiteria completa per risposte indotta da ipossia 10,11. Usando la nostra analisi in combinazione con atterramento selettiva neurale tramite il sistema GAL4-UAS12 è un percorso chiaro per la delineazione ulteriori componenti della rete neurale.
Protocollo
1. preparazione delle larve
- Due o più giorni prima di iniziare il dosaggio, impostare croci del desiderato sperimentale e controllare combinazioni (minime 20 femmine e 10 maschi ogni) in piatti di uovo-pone come descritto da Wieschaus e Nüsslein-Volhard 13 ma utilizzando il polipropilene 50 mL bicchieri e 6,0 cm di Petri monouso contenenti uva agar e spalmato con pasta di lievito appena prima dell'uso. Tenere le mosche nel Deposita uovo piatti al buio a temperatura ambiente fino a quando necessario.
- Ricetta agar uva – combinare 100ml congelato 100% uva succo concentrato, 350 mL di acqua di deioinized, 5ml glaciale acido acetico e 13 g d. melanogaster agar in un becher di vetro 1L. Forno a microonde a raffica di 1-2 min, mescolando tra burst, fino a quando agar è tutto sciolto. Raffreddare la soluzione per qualche minuto poi aggiungere 10 mL di 10% (p/v) di Nipagen (metil-p-idrossibenzoato) in etanolo al 95%. Mix, quindi pipetta 7 mL per piastra in capsule di Petri monouso 6,0 cm, permetterà di gel e asciugare a temperatura ambiente per 3-4 h. Store a 4 0C in sacchetti di plastica.
- Lievito pasta ricetta – 7 g secchi lievito, 10 mL di acqua deionizzata, mescolare con una spatola fino a consistenza uniforme.
- Collezioni di uovo temporizzato per generare sperimentale e controllare le larve. Usando le nuove, piastre imbrattato di lievito, uva, raccogliere le uova a temperatura ambiente per 4 ore nel buio durante le ore del mattino. Queste piastre di raccolta di 4 h di rimuovere e sostituire con piatti freschi. Incubare le piastre di raccolta di 4 h pernottamento presso 25 0C fino al pomeriggio del giorno successivo, quando la maggior parte delle larve si sono schiuse. Raccogliere queste prime larve instar e li usa per impostare l'esperimento.
2. creazione di piastre di dosaggio
- Preparazione delle piastre di dosaggio. Per un singolo ciclo del dosaggio, preparare cinque piastre dosaggio di 10 larve sperimentali e cinque piastre delle larve di controllo 10. Utilizzare un trivellatore di sughero di 1,5 cm per rimuovere un nucleo centrale di agar da ogni piatto creando un buco per il cibo. Porre della pasta di lievito (0,8 - 0,9 g) nel foro e picchiettare delicatamente con una spatola per rendere un tumulo il foro di riempimento.
- Preparazione di piastra di agar – combinare 700 mL di acqua deionizzata con 16 g di d. melanogaster agar in un becher di vetro 2L e forno a microonde per 5 min, togliere dal microonde e mescolare con una bacchetta di vetro per portare agar non disciolto nella soluzione. Aggiungere 17,5 mL di 10% (p/v) Nipagen in etanolo al 95%, mix, quindi continuare il riscaldamento per microonde in 30 s burst seguita da mescolando, fino a quando tutti i agar è dissolto completamente. Raffreddare per un minuto o due, quindi dispensare aliquote da 15 mL in plastica cm 10 capsule di Petri. Consentire l'agar gel, coprire le piastre con coperchi e lasciarli asciugare a temperatura ambiente per alcune ore o durante la notte. Conservare le piastre in sacchetti di plastica sigillati a 18 ° C.
Nota 1: Per evitare la formazione di cristalli di Nipagen sulla superficie delle piastre a causa di dessiccation in eccesso, è possibile utilizzare piastre entro pochi giorni dalla preparazione. Se necessario, cristalli possono essere ri-sciolto facendo cadere pochi microlitri di alcol al 95% su di loro.
Nota 2: lotti di agar possono avere diverse proprietà gelificanti. Le piastre di gel secco dovrebbero essere sodo al tatto e sufficientemente resiliente che un cerchio pulito, intatto dell'agar può essere rimosso quando si utilizza il dispositivo di prelievo del sughero per creare il foro di cibo (Vedi sopra). - Configurazione di larve nelle piastre di analisi. Utilizzare pressione meccanica per curva la punta di un microspatula di plastica e immergere la punta in pasta di lievito per fornire "adesivo" per raccogliere le larve. Pick up primo instar larve individualmente e metterli sulla piastra di agar vicino il tumulo di cibo. Preparare almeno cinque piastre replicare dei genotipi di controllo e 10 larve per entrambi sperimentali. Una volta completato, tappo ed etichettare ogni piatto e impostare le piastre (lato coperchio alto) in uno spazio buio a temperatura ambiente (nel nostro laboratorio questo è 22 ° C).
3. monitoraggio analisi piastre
- Esaminare le piastre al giorno sotto un microscopio per dissezione e registrare il numero di larve sulla sommità del cibo o sulla superficie dell'agar. Nota qualsiasi visibile delle larve morte o morenti. Nota Quando e se, tunneling in substrato agar è visto come larve spostare nel terzo instar. Nota le date su cui pupe cominciano a formare e notare eventuali anomalie pupale. Continuare osservazioni quotidiane fino a quando tutte le larve sono morti o popolate.
- Rimuovere attentamente pupe dalla piastra con un piegato in giro ago e un piatto di uva. Se si desidera continuare il monitoraggio pupe per determinare quanti eclose come adulti.
4. preparazione saggio piastre per l'imaging
- Rimuovere con cautela e scartare tutto il cibo lievito dal pozzo centrale di ogni piatto.
- Delicatamente alluvione ogni piatto con l'acqua del rubinetto e utilizzare il pennello di un artista morbido per strofinare accuratamente detriti che ha stati tracciati sulla superficie dell'agar. Sostituire l'acqua più volte e continuare una spazzolatura delicata fino a che ogni piatto è completamente pulito. Dare i piatti un risciacquo finale con acqua deionizzata, cap loro e lasciare a temperatura ambiente durante la notte a secco.
Nota: Tunneling dentro l'agar è più intenso intorno il tumulo di cibo (Vedi figura 2). Di conseguenza, il bordo del foro cibo solitamente è esteso di là del diametro iniziale di 1,5 cm. Inoltre, la fragilità dell'agar ha lavorato in questa regione può causare piccoli pezzi di agar con tunnel andranno persi dalla circonferenza del foro durante la pulizia. L'aumento della concentrazione di agar gel potrebbe aiutare con questi problemi, ma le correzioni sono possibili durante i passaggi di quantificazione di immagine J (Vedi sotto).
5. quantificazione del tunneling
- Le piastre di immagine. Preparare un'immagine di ogni piatto preso su uno sfondo nero in modo da mostrare i tunnel nell'agar come linee bianche luminose.
Nota: Usiamo un sistema comunemente utilizzato per DNA gel per questo passaggio di immagine (Vedi tabella materiali e reagenti). Alternativa in grado di generare file tiff, come fotocamere digitali o telecamere telefono cellulare sistemi di imaging potrebbe essere adattato per produrre immagini adatte. - Utilizzare il programma di pubblico dominio NIH Image J per quantificare larvale di tunneling. Scarica il programma da http://rsb.info.nih.gov/ij/download.html. Per ulteriori informazioni sul programma di andare a http://imagej.nih.gov/ij/docs/intro.html.
Nota: Altri sistemi di imaging possono essere utilizzati per quantificare il tunneling. Le seguenti istruzioni si applicano a NIH Image J. - Dopo l'apertura di un'immagine di file tiff di una piastra di tunneling, utilizzare lo strumento ovale per definire un'area per quantificazione che rappresenta la superficie dell'agar intero ma Ritaglia il bordo in plastica della piastra.
- Applicare la soglia automatica per produrre un'immagine invertita del piatto, con le gallerie mostrando come linee nere. Utilizzare il selettore colore e pennello strumenti al bianco fuori qualsiasi aree nere che rappresentano danni l'agar anziché il tunnel.
- In menu pull-down Analyze , selezionare Scala Set | Fare clic per rimuovere il calcare e quindi sulla finestra impostare misure (anche sotto Analyze), controllare la zona e limite di soglia.
- Premere il tasto CTRL + tasto M per richiamare l'area nera (tunnel) in pixel.
- Copia e incolla il valore in pixel per ogni piastra è in un programma di foglio di calcolo (come Excel) che permetterà l'analisi quantitativa.
- Il foro centrale è solitamente espanso a causa di intenso tunneling in questa regione. Per quantificare il tunneling mancante, deseleziona "Limitare a soglia" e utilizzare la bacchetta per definire il foro centrale. Premere il tasto CTRL + tasto M per ottenere il valore in pixel di questa zona. Sottrarre da questo valore il valore in pixel di un buco di 1,5 cm e aggiungere la differenza per il tunneling valore ottenuto al punto 5.6.
- Per alcuni piatti, il foro centrale potrebbe mancare un pezzo di agar con tunnel che include un'area di untunneled agar adiacente al foro. Quando il foro centrale per questi uso di piastre di quantificazione il selettore colore e pennello strumenti per aggiungere una barra nera in tutta la regione manca per definire la regione con tunnel ed escludere l'area con tunnel non da quantificazione.
Nota 1: Se le larve sperimentale il tunneling di qualsiasi, questa quantificazione permette il calcolo della media di tunneling valori per i set di piastre e comparazione statistica di controllo e i valori sperimentali.
Risultati
Come una dimostrazione del valore di questo test abbiamo utilizzato per indagare la potenziale ipossia nelle larve con la funzione alterata del gene uninflatable (uif) nelle trachee. UIF codifica per una proteina transmembrana grande che è fortemente espresso sulla superficie apicale delle cellule tracheale larvale. Mutanti di uif sono stati notati in precedenza presentano comportamento aberrante che poteva indicare ipossia tissutale a causa di malfunzionamento tracheale 9. In particolare abbiamo soppresso uif espressione nella trachea larvale utilizzando il sistema Gal4-UAS. Gal4 due linee sono state usate: i) senza fiato (btl)-Gal4, che è fortemente espresso in trachee dall'inizio del loro sviluppo embrionale e ii) tagliato(ue)-Gal4, che inizia l'espressione in una piccola regione posteriore del le trachee tronco dorsale principale all'estremità dell'embriogenesi e continua forte espressione in questa regione in tutto vita larvale 7. UAS -uif linea RNAi è stata ottenuta dal centro di ricerca della drosofila Vienna (VDRC ID n. 1050).
Come descritto nel protocollo di cui sopra, cinque replicare piastre di appena schiusi primo instar larve sono stata istituite per ciascuno dei quattro croci come segue.
Esperimento 1
1) controllo 1 - tagliare(ue)-Gal4 x Cantone-S (+)
2) sperimentale 1 - tagliare(ue)-Gal4 x UAS-uif RNAi
Esperimento 2
3) controllo 2 - btl-Gal4 x Cantone-S (+)
4) sperimentale 2 - btl-Gal4 x UAS-uif RNAi
Il comportamento del taglio(ue)-Gal4 > UAS -uif RNAi larve di esperimento 1 era paragonabile a quello del controllo taglio(ue)-Gal4 > + animali in termini di scavatori, tunneling e sopravvivenza all'impupamento, (Figura 1 e Figura 2). Al contrario, giù-regolando uif espressione attraverso l'intero sistema trachea da presto nello sviluppo (esperimento 2) prodotto marcatamente diverse risposte. Il btl-Gal4 > UAS -uif RNAi larve visualizzate entrambe le manifestazioni comportamentali di ipossia del tessuto – ridotto cibo scavando e una totale assenza di substrato tunneling più tardi nella vita larvale (Figura 1 e figura 2 ). Le larve sperimentali erano anche notevolmente più piccola, più sottile e più lento rispetto ai controlli (Figura 3) e ha mostrato un alto tasso di mortalità nel corso del test. Come discusso sopra, crescita ridotta, la lentezza e la morte organismal sono noti sintomi di ipossia larvale. Inoltre, la maggior parte delle larve sperimentale non è riuscito a tentare impupamento e rimase come terza instar larve lunghe dopo controllo larve erano popolate. Alcune larve è sopravvissuto più di 15 giorni prima di morire alla fine senza pupating (Figura 1A). Alcuni delle larve sperimentale provato a pupate ma in tutti i casi anormali pupe sono stati formati che non hanno generato gli adulti praticabili.
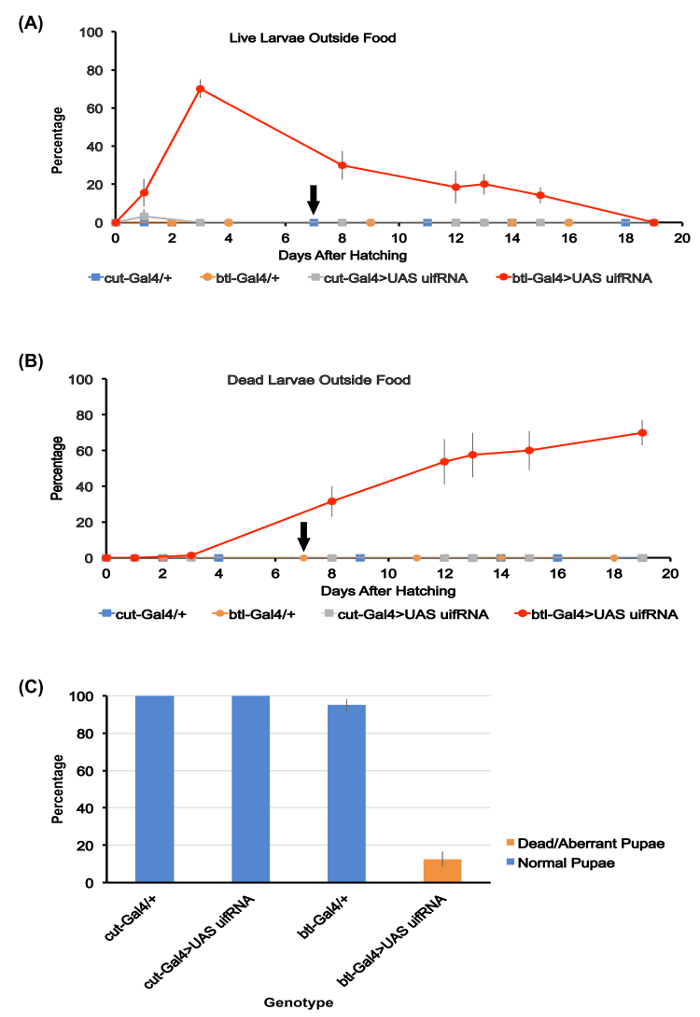
Figura 1. Quantificazione di sviluppo larvale e scavatori di cibo.
(A) percentuale di larve vive fuori i tumuli di cibo per i quattro genotipi studiati qui. Medie per le piastre di cinque test utilizzate per ciascun genotipo sono mostrate. Dal giorno 3 dopo la schiusa, circa il 70% di btl-Gal4 > UAS uif RNAi larve erano fuori il cibo, mentre nessun larve sono state rilevate all'esterno il cibo o sulla superficie dell'agar per altri tre genotipi. Il btl-Gal4 > le larve UAS uif RNAi morire lentamente tra i giorni 4-20, con ~ 15% di loro ancora vivo 15 giorni dopo la schiusa. La freccia nera lungo l'asse x qui e (b) indica il giorno con il quale avevano popolate tutte le larve dei tre altri genotipi.
(B) percentuale di morte larve visibile all'esterno il cibo per i quattro genotipi. Medie per le piastre di cinque dosaggio per ciascun genotipo sono mostrate. Morto btl-Gal4 > le larve UAS uif RNAi si accumulano nel tempo con la maggior parte muoiono fuori il cibo. Gli altri genotipi tutti sopravvivono all'impupamento
(C) percentuale di sopravvivenza all'impupamento per i quattro genotipi studiati. Medie per le piastre di cinque dosaggio per ciascun genotipo sono mostrate. Nessun normale pupe di btl-Gal4 > genotipo di RNAi uif UAS sono state prodotte. Barre di errore in tutta figura rappresentano SEMs. Clicca qui per visualizzare una versione più grande di questa figura.
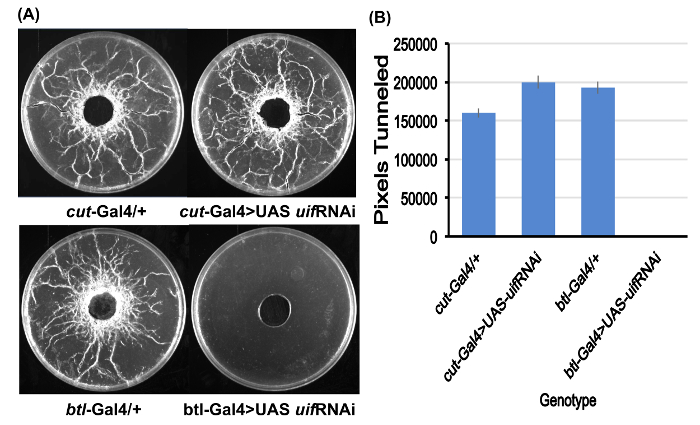
Nella figura 2. Quantificazione di tunneling larvale.
(A) esempi delle piastre di dosaggio per tutti i quattro genotipi studiati dopo la preparazione per il tunneling di quantificazione. Si noti la completa assenza di tunneling per il btl-Gal4 > le larve UAS uif RNAi. Piastre di dosaggio sono piastre di Petri di 10 cm.
(B) quantificazione di tunneling per i quattro genotipi derivata dall'immagine J. Valori dei pixel medio per le piastre di cinque dosaggio per ciascun genotipo. Nessun tipo di tunneling è stata osservata per il btl-Gal4 > le larve UAS uif RNAi. Barre di errore = SEMs. Clicca qui per visualizzare una versione più grande di questa figura.

Nella figura 3. Confronto di btl-Gal4 > UAS uif RNAi e btl-Gal4 > + larve
Larve di simile età (giorno 6 dopo la schiusa) per il btl-Gal4 > UAS uif RNAi (A) e btl-Gal4 > + (B) genotipi. Frecce rosse scegliere le trachee tronco dorsale. Entrambe le larve imaged allo stesso ingrandimento. Barra della scala = 0,5 mm. per favore clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Qui abbiamo presentato un'analisi semplice, progettata per rilevare l'ipossia tissutale nelle larve di d. melanogaster . La diagnosi si basa sulla diminuzione scavando cunicoli tumuli di cibo nei primi anni di vita larvale e l'assenza di substrato tunneling tardi nella vita larvale. Affollamento larvale può causare precoce migrazione lontano da una fonte di cibo e quindi un aspetto critico del test è che un piccolo numero di larve è dosato in presenza di un grande eccesso di cibo. L'inclusione del benzoato di idrossile di fungicida metil-p (Nipagen) nelle piastre agar è anche essenziale per impedire la crescita di muffe durante il dosaggio.
Troviamo che le piastre di agar possono essere una fonte di variabilità nell'analisi. In genere, le larve dello stesso genotipo, da differenti gruppi di genitori, o da diverse collezioni di larve, mostrano variazioni relativamente limitato nel loro comportamento nell'analisi. Al contrario, piastre di agar fatto in giorni diversi o con diversi lotti di agar possono produrre differenze di tunneling. Una condizione è pertanto tale controllo e larve sperimentali devono tutti essere verificate utilizzando piastre di agar dalla stessa preparazione batch. Agar di produttori diversi o anche le spedizioni dalla stessa fabbricazione possono variare nel loro potere gelatinizzante, e quindi può essere necessario regolare la concentrazione di agar verso l'alto dal 2,2% usato qui per ottenere un gel ottimo. Abbiamo trovato che le larve di tipo selvaggio possono prontamente tana attraverso gel 3% agar.
Al fine di dimostrare il valore di questo test, abbiamo utilizzato per indagare la potenziale ipossia tissutale nelle larve con soppressa funzione di uninflatable in trachee. I nostri risultati forniscono l'appoggio importante per l'ipotesi che la perdita di tracheale espressione di questo gene può produrre ipossia: btl-Gal4 > UAS -uif RNAi larve ha mostrato il guasto alla tana in cibo e completa assenza di substrato tunneling durante il terzo instar. Nei nostri studi precedenti di altri genotipi, abbiamo osservato che la perdita indotta da ipossia di cibo scavando non è completo come perdita di substrato tunneling e btl-Gal4 > UAS -uif RNAi larve studiato qui si sono comportati allo stesso modo. Il componente di tunneling non riuscito di questo test fornisce pertanto l'indicazione più forte di ipossia.
Anche se il btl-Gal4 > uif RNAi larve ha mostrato tratti comportamentali diagnostica di ipossia, il taglio(ue)-Gal4 > UAS -uif RNAi non ha esibito queste anomalie. Il btl e tagliare(ue), Gal4 driver sono espressi in diverse fasi e in diversi modelli, all'interno le trachee larvale. Il btl-Gal4 driver è espresso in tutto il sistema trachea a partire dal suo sviluppo nell'embriogenesi e continuando attraverso la vita larvale. Al contrario, espressione Gal4 dal taglio(ue)-Gal4 driver solo inizia alla fine della vita embrionale, dopo morfogenesi delle trachee ed è limitato alle sezioni posteriore estreme dei tronchi dorsale, i principali vasi longitudinali di il sistema trachea. atterramento di UIF con questa linea di Gal4 non può pertanto ridurre la uif espressione abbastanza presto o largamente sufficiente a produrre qualche livello di soglia di ipossia da innescare i comportamenti misurato in questo test.
Uno studio precedente trovato che terza larve instar esposte a bassi livelli di ossigeno (10%) mostrano crescita è diminuito e ha ritardato l'inizio di pupariation 14. Il btl-Gal4 > UAS -uif RNAi larve studiate qui ha diventato il terzo instar, ma gli effetti sui loro tassi di crescita e impupamento erano più pronunciati: erano considerevolmente più piccoli rispetto ai controlli con molto poco tessuto adiposo sotto la epidermide (Figura 3) e solo una piccola frazione (~ 10%) ha tentato di pupariation. Queste differenze suggeriscono il btl-Gal4 > UAS -uif RNAi larve ha avvertito un maggior grado di ipossia, uif atterramento nelle trachee era presente durante tutta la loro vita larvale, o perché ha prodotto un più privazione dell'ossigeno severa nel terzo instar. A questo punto è chiaro come perdita di funzione di uif nelle trachee potrebbe impedire il trasporto dell'ossigeno. Le trachee di btl-Gal4 > UAS -uif RNAi larve sono state prontamente visibile attraverso la cuticola (Figura 3), un'indicazione che conteneva aria e non sono stati danneggiati al punto che fluido voce funzione compromessa. È formalmente possibile quindi che il danno trachea creato da perdita di funzione di uif non suscitare ipossia ma piuttosto qualche altro difetto che inibisce il tunneling. Per i genotipi studiati in precedenza, abbiamo determinato che il mancato traforo è associato con i livelli elevati di LDH mRNA7, l'indicatore canonico di glicolisi e di ipossia in ritardo terzo instar larve 15. Così, la conferma definitiva di ipossia per il btl-Gal4 > UAS -uif RNAi larve (e nelle larve esaminate in futuro utilizzo di questo test) comporterebbe RT-PCR per valutare i livelli di mRNA LDH o l'uso di un indicatore disponibile in commercio per misurare livelli di ossigeno intracellulare (ad esempio vedere 16).
Divulgazioni
Gli autori dichiarano che non hanno nessun concorrenti interessi finanziari.
Riconoscimenti
Karen M. Qiang è stato il destinatario di 2016 di George J. Schroepfer Research Award alla Rice University. Fanli Zhou è il destinatario di una borsa di studio di insegnamento presso la Rice University. I servizi del centro Stock Drosophila Bloomington, l'impianto di Harvard TRiP, il centro di risorse di Drosophila Vienna sono ringraziano.
Materiali
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Dehydrated yeast | |||
| Frozen grape juice concentrate | Welch's | Available at most large supermarkets | |
| Glacial acetic acid | Sigma-Aldrich | 320099 | |
| Drosophila agar | Apex Bioresearch Products | 66-103 | |
| Methyl-para-hydroxybenzoate | Apex Bioresearch Products | 20-658 | |
| EQUIPMENT | |||
| 50 ml polypropylene beakers | |||
| 6.0 cm disposable Petri dishes | Falcon | 08757100B | |
| 10 cm disposable plastic Petri dishes | E+K Scientific | EK-24104 | |
| Plastic microspatulas | Corning Incorporated | 3012 | |
| Bent teasing needle | Nasco | S08848MH | |
| Dissecting microscope | Any microscope with 10-30X magnification |
Riferimenti
- O'Farrell, P. H. Conserved responses to oxygen deprivation. J. Clin. Invest. 107 (6), 671-673 (2001).
- Lavista-Llanos, S., et al. Control of the hypoxic response in D. melanogaster by the basic helix-loop-helix pas protein Similar. Mol. Cell. Biol. 22 (19), 6842-6853 (2002).
- Reiling, J. H., Hafen, E. The hypoxia-induced paralogs Scylla and Charybdis inhibit growth by down-regulating S6K activity upstream of Tsc in D. melanogaster. Genes Dev. 18 (23), 2879-2892 (2004).
- Gorr, T. A., Gassmann, M., Wappner, P. Sensing and responding to hypoxia via Hif in model invertebrates. J. Insect Physiol. 52 (4), 349-364 (2006).
- Romero, N. M., Dekanty, A., Wappner, P. Cellular and developmental adaptations to hypoxia: A D. melanogaster perspective. Meth. Enzymol. 435, 123-144 (2007).
- Dijkers, P. F., O'Farrell, P. H. Dissection of a hypoxia-induced, nitric oxide-mediated signaling cascade. Mol. Biol.Cell. 20 (18), 4083-4090 (2009).
- Zhou, F., Qiang, K. M., Beckingham, K. M. Failure to burrow and tunnel reveals roles for jim lovell in the growth and endoreplication of the D. melanogaster larval tracheae. PLOS ONE. 11, e0160233 (2016).
- Wingrove, J. A., O'Farrell, P. H. Nitric oxide contributes to behavioral, cellular, and developmental responses to low oxygen in D. melanogaster. Cell. 98 (1), 105-114 (1999).
- Zhang, L., Ward, R. E. Uninflatable encodes a novel ectodermal apical surface protein required for tracheal inflation in D. melanogaster. Dev. Biol. 336 (2), 201-212 (2009).
- Langlais, K. K., Stewart, J. A., Morton, D. B. Preliminary characterization of two atypical soluble guanylyl cyclases in the central and peripheral nervous system of D. melanogaster melanogaster. J. Expt. Biol. 207 (13), 2323-2338 (2004).
- Morton, D. B. Behavioral responses to hypoxia and hyperoxia in D. melanogaster larvae. Fly. 5 (2), 119-125 (2011).
- Brand, A., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Wieschaus, E., Nusslein-Volhard, C., Roberts, D. B. Looking at embryos. Drosophila: a practical approach. , 199-227 (1986).
- Callier, V., Shingleton, A. W., Brent, C. S., Ghosh, S. M., Kim, J., Harrison, J. F. The role of reduced oxygen in the developmental physiology of growth and metamorphosis initiation in D. melanogaster. J. Expt. Biol. 216 (23), 4334-4340 (2013).
- Li, Y., et al. Hif- and non-Hif-regulated hypoxic responses require the estrogen-related receptor in D. melanogaster. PLoS genetics. 9 (1), e1003230 (2013).
- Grifoni, D., Sallazzo, M., Fontana, E., Froldi, F., Pession, A. Multiple strategies of oxygen supply in Drosophila malignancies identify tracheogenesis as a novel cancer hallmark. Scient. Rep. 5 (9061), (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon