Method Article
Um ensaio de buraqueira/Tunneling para deteção de hipóxia em larvas de Drosophila melanogaster
Neste Artigo
Resumo
O protocolo descreve um ensaio simples para identificar larvas de Drosophila melanogaster que estão enfrentando a hipóxia sob os níveis de oxigénio atmosférico normal. Este protocolo permite hipóxicos larvas ser distinguido de outros mutantes que mostram fenótipos sobrepostos como lentidão ou crescimento lento.
Resumo
Privação de oxigênio em animais pode resultar da exposição a níveis baixos de oxigênio atmosférico ou de danos nos tecidos internos que interfere com a distribuição de oxigénio. Também é possível que comportamento aberrante de neurônios de sensor de oxigênio poderia induzir o comportamento de hipoxia na presença de níveis de oxigênio normal. No d. melanogaster, desenvolvimento em baixos níveis de oxigênio resulta em inibição de crescimento e comportamento lento durante as fases larvais. No entanto, essas manifestações estabelecidas de déficit de oxigênio se sobrepõem consideravelmente com os fenótipos de muitas mutações que regulam o crescimento, respostas de stress ou de locomoção. Como resultado, não há atualmente nenhum ensaio disponível para identificar hipóxia i) celular induzida por uma mutação ou ii) hipóxia comportamento quando induzida pelo comportamento neuronal anormal.
Recentemente, nós identificamos dois comportamentos distintos em larvas de d. melanogaster que ocorrem em níveis normais de oxigênio em resposta à detecção interna de hipóxia. Em primeiro lugar, em todas as fases, tais larvas evitar burrowing comida, muitas vezes se afastar muito longe de uma fonte de alimento. Em segundo lugar, encapsulamento em um substrato macio, que normalmente ocorre durante a terceira fase de ínstar errante é completamente abolido se as larvas são hipóxicos. O ensaio descrito aqui é projetado para detectar e quantificar esses comportamentos e, portanto, fornecer uma maneira para detectar hipoxia induzida por danos internos ao invés de baixo oxigênio externo. Placas de ensaio com um substrato de ágar e um plug central de massa de levedura são utilizadas para apoiar os animais através de vida larval. As posições e estado das larvas são controlados diariamente como proceder do primeiro ao terceiro ínstar. A extensão do túnel para o substrato de ágar durante fase errante é quantificada após a pupação usando NIH ImageJ. O ensaio será de valor na determinação de quando a hipóxia é um componente de um fenótipo mutante e, portanto, fornecer informações sobre possíveis locais de ação do gene em questão.
Introdução
A sofisticada matriz de ferramentas de genéticas moleculares disponíveis no d. melanogaster torná-lo um organismo valioso para o estudo de processos biológicos evolutivamente conservados. Chaves moleculares respostas a disponibilidade de oxigênio provaram ser conservadas através de evolução e estudos prévios no d. melanogaster geraram insights sobre os componentes universais destas vias 1,2, a sinalização 3,4,5,6.
Como parte de um estudo visto dissecando a função do neurônio sensorial em larvas de d. melanogaster , identificamos duas respostas comportamentais que provou ser ativado por hipóxia do tecido em níveis de oxigênio normal 7. Uma destas, incapacidade de burrow na comida, é altamente relacionada com a resposta a baixos níveis de oxigênio relatado por Wingrove e O'Farrell 8. O segundo comportamento, falha para cavar um túnel em um substrato macio durante a tarde ínstar terceiro vagando fase, tinha não foi anteriormente identificado como hipóxia-relacionados. Determinamos que expondo tipo selvagem errante larvas para baixos níveis de oxigênio também inibe a substratos de encapsulamento 7, estabelecendo assim que ambos esses comportamentos se originam de hipóxia - ou induzida por dano tecidual ou níveis de consumo de oxigênio baixa. Aqui descrevemos um ensaio que desenvolvemos para dosar estes dois comportamentos induzida por hipóxia, que se inicia com observações imediatamente após a eclosão de larvas.
Hipóxicos respostas nos estágios larvais iniciais não foram examinadas anteriormente e, portanto, realizar uma análise ao longo da vida larval é um componente valioso de nosso ensaio. A maioria das manifestações óbvias da hipóxia – desenvolvimento lento crescimento pobre e lentidão do aparelho locomotor – se sobrepõem com fenótipos larvas produzidos por muitas mutações. Mas achamos que só terceiro ínstar larvas com hipoxia mostram um completo fracasso para cavar um túnel 7. Assim, determinamos que larvas ainda mais comprometida em termos de crescimento e de locomoção do que nossas larvas hipóxicos, ainda realizado um encapsulamento, Considerando que larvas hipóxicos nunca fez um túnel 7. Outro elemento valioso neste ensaio é, assim, que fornece uma maneira de estabelecer quando hipóxia é a fonte de um determinado conjunto de fenótipos pleiotrópicos, ao contrário de alguns outros stress ou mau funcionamento metabólico. Como uma demonstração do ensaio, aqui descrevemos seu uso em caracterizar as respostas de larvas com reduzida expressão traqueal de uninflatable, um gene que funciona na vias aéreas larval 9.
Prevemos que este ensaio será de valor para os pesquisadores envolvidos em caracterizando larvas fenótipos que incluem comportamento lento e crescimento pobre. Como resultado, novos genes que influenciam a distribuição, uso ou respostas, oxigênio por todo o corpo pode ser identificado. Além disso, incorporando este ensaio em um protocolo de triagem de mutante forneceria uma rota direta para identificar as mutações que produzem hipóxia. Este ensaio também será valioso na análise dos circuitos que provoca os comportamentos inatos induzida por hipóxia, descritos aqui. Análise de rede neural deste tipo é um foco de muita pesquisa atual e o sistema nervoso simples da larva d. melanogaster é um sistema valioso para comportamentos automatizados de dissecação. Neurônios sensoriais envolvidos na percepção de oxigênio larval já foram identificados, proporcionando um primeiro passo para definir o circuito completo para respostas induzida por hipóxia 10,11. Usando nosso ensaio em combinação com nocaute neural seletiva através do sistema de GAL4-UAS12 é uma rota clara para delinear ainda mais componentes da rede neural.
Protocolo
1. preparação de larvas
- Dois ou mais dias antes do início do ensaio, configurar cruzes do desejado experimental e controlar as combinações (mínimas 20 fêmeas e 10 machos cada) em pratos do ovo a postura como descrito por Wieschaus e Nusslein-Volhard 13 mas usando polipropileno 50ml copos e pratos de Petri descartáveis 6,0 cm contendo ágar uva e manchado com fermento Cole imediatamente antes da utilização. Espantar moscas em pratos do ovo a postura na escuridão, à temperatura ambiente até que seja necessário.
- Receita de agar uva – combinar 100ml congelado 100% uva suco concentrado, 350 mL de água de deioinized, 5ml glacial acético e 13 g d. melanogaster ágar num copo de vidro de 1 L. Microondas em rajadas de 1-2 min, mexendo entre rajadas, até agar tudo é dissolvido. Esfriar a solução por alguns minutos, em seguida, adicionar 10 mL de 10% (p/v) de Nipagen (metil-p-hidroxibenzoato) em etanol a 95%. Mistura e, em seguida, pipeta 7 mL por placa em placas de Petri descartáveis 6,0 cm, permite ao gel e secar em temperatura ambiente por 3-4 h. loja a 4 0C em sacos plásticos.
- Colar de fermento receita – 7 g secas fermento, 10 mL de água desionizada, misture com uma espátula até consistência uniforme.
- Coleções de ovo cronometrado para gerar experimental e controlar as larvas. Usando novas, placas fermento-manchada, uvas, recolha os ovos à temperatura ambiente durante 4 h na escuridão durante horas da manhã. Remover estas placas de coleção de 4h e substituir com pratos frescos. Incubar as placas de coleção de 4h a noite no 25 0C, até a tarde do dia seguinte, quando a maioria das larvas será eclodiram. Coletar essas larvas de primeiro ínstar e usá-los para configurar o experimento.
2. criação de placas de ensaio
- Preparação de placas de ensaio. Para uma única execução do ensaio, prepare cinco placas ensaio cada de 10 larvas experimentais e cinco placas de 10 larvas de controle. Use uma broca de cortiça de 1,5 cm para remover um núcleo central de ágar de cada placa, criando um buraco para a comida. Coloque a pasta de fermento (0,8 - 0,9 g) no buraco e pat delicadamente com uma espátula para fazer um monte de encher o buraco.
- Preparação de placa de ágar – combinar 700 mL de água desionizada com ágar de d. melanogaster 16G num copo de vidro de 2 L e microondas por 5 min. Retire do microondas e agitar com uma vareta de vidro para trazer o ágar não dissolvido na solução. Adicione 17,5 mL de 10% (p/v) Nipagen em etanol a 95%, mistura, em seguida, continuar o aquecimento de microondas em 30 s rajadas seguido de agitação, até que todos os ágar é completamente dissolvido. Legal por um minuto ou dois, depois Pipete alíquotas de 15 mL para pratos de Petri plástico 10 cm. Permitir que agar para gel, cobrir as placas com as tampas e deixe-os secar à temperatura ambiente por algumas horas ou durante a noite. Placas de loja em sacos plásticos fechados a 18 ° C.
Nota 1: Para evitar a formação de cristais de Nipagen na superfície das placas devido a dessiccation em excesso, use placas dentro de alguns dias de preparação. Se necessário, cristais podem ser re-dissolvidos pela queda de alguns microlitros de 95% de álcool para eles.
Nota 2: lotes de ágar-ágar podem ter diferentes propriedades de coagulação. As placas de gel seco devem ser suficientemente resistente que um círculo limpo e intacto de ágar-ágar pode ser removido quando a broca de cortiça para criar o buraco de comida (veja acima) e firme ao toque. - Criação de larvas em placas de ensaio. Use pressão mecânica para curvar a ponta de um microspatula de plástico e mergulhe a ponta no colar de levedura para fornecer "adesivo" para pegar as larvas. Pegar o primeiro ínstar larvas individualmente e colocá-los na placa de ágar-ágar, perto do monte de comida. Prepare pelo menos cinco placas replicar de 10 larvas para ambos experimental e genótipos de controle. Depois de concluído, cap e rotular cada placa e definir as placas (tampa para cima) em um espaço escuro e à temperatura ambiente (em nosso laboratório é de 22 ° C).
3. monitoramento de placas de ensaio
- Examinar placas diariamente sob um microscópio de dissecação e registrar o número de larvas sobre o alimento ou na superfície do agar. Observe qualquer visíveis larvas mortas ou moribundos. Observação quando e se, de encapsulamento para o substrato de ágar-ágar é visto como larvas mover em terceiro instar. Datas de observação no qual pupas começam a se formar e observe qualquer anormalidade pupal. Continue as observações diárias até que todas as larvas morreram ou puparam.
- Remova pupas cuidadosamente a placa com um dobrados provocando a agulha e transferir para um prato de uvas. Se desejar, continue a acompanhar pupas para determinar quantos eclose como adultos.
4. preparação do ensaio as placas para a imagem latente
- Retire cuidadosamente e descartar todos os alimentos de levedura no poço central de cada placa.
- Delicadamente, inundar cada placa com água da torneira e usar escova de pintura do artista macio cuidadosamente pulverize os restos que seguiu para a superfície do ágar. Substitua a água várias vezes e continuar uma escovadela suave, até que cada placa é completamente limpeza. Dar as placas um enxágue final com água desionizada, cap-los e deixar à temperatura ambiente durante a noite para secar.
Nota: Encapsulamento sobre o agar é mais intenso em torno do monte de alimentos (ver Figura 2). Como resultado, a borda do furo comida geralmente é expandida para além da inicial 1,5 cm de diâmetro. Além disso, a fragilidade do ágar trabalhou nesta região pode causar pequenos pedaços de agar em túnel para ser perdidos desde a circunferência do buraco durante a limpeza. Aumentando a concentração de ágar gel poderia ajudar com esses problemas, mas as correções são possíveis durante as etapas de quantificação de imagem J (veja abaixo).
5. quantificação de tunelamento
- As placas da imagem. Prepare uma imagem de cada placa tomada contra um fundo preto, a fim de mostrar os túneis em agar como linhas brancas brilhantes.
Nota: Nós usamos um sistema comumente usado para géis de DNA para esta etapa de imagem (consulte a tabela de materiais e reagentes). Alternativa sistemas capazes de gerar arquivos tiff, como câmeras digitais ou câmeras de telefone celular de imagens poderia ser ajustada para produzir imagens adequadas. - Use o programa de domínio público NIH Image J para dosar larval de encapsulamento. Baixe o programa do http://rsb.info.nih.gov/ij/download.html. Para obter mais informações sobre o programa acesse http://imagej.nih.gov/ij/docs/intro.html.
Nota: Outros sistemas de imagem poderiam ser usados para dosar o encapsulamento. As seguintes instruções se aplicam a NIH Image J. - Depois de abrir um arquivo de imagem tiff de uma placa de encapsulamento, use a ferramenta Oval para definir uma área para quantificação que representa a superfície do agar inteira mas culturas fora a borda plástica da placa.
- Aplica o limiar automático para produzir uma imagem reversa da placa, com os túneis mostrando como linhas pretas. Use o seletor de cores e ferramentas de pincel para branco qualquer áreas pretas que representam danos para o ágar-ágar, ao invés de túneis.
- Sob o menu pull-down Analyze , selecione escala de conjunto | Clique para remover o tártaro e em seguida na janela definir medidas (também em Analyze), verifique a área e limite ao limiar.
- Pressione a tecla CTRL + tecla M para mostrar a área preta (túneis) em pixels.
- Copie e cole o valor de pixel para cada placa é em um programa de planilha (como o Excel) que permitirá a análise quantitativa.
- O furo central geralmente é ampliado devido ao tunelamento intensa nesta região. Para dosar o tunelamento faltando, desmarque a opção "Limitar ao limiar" e usar a ferramenta varinha para definir o furo central. Pressione a tecla CTRL + tecla M para obter o valor de pixel desta área. Subtrair esse valor, o valor de pixel de um buraco de 1,5 cm e adicione a diferença para o encapsulamento valor obtido na etapa 5.6.
- Para algumas placas, o furo central pode estar faltando um pedaço de ágar encapsulado que inclui uma região de ágar untunneled adjacente para o buraco. Quando dosar o furo central para o uso dessas placas o seletor de cores e pintura escovam ferramentas para adicionar uma barra preta em toda a região falta definir região encapsulada e excluir a área de não-tunelizado de quantificação.
Nota 1: Se as larvas experimentais realizar qualquer encapsulamento, esta quantificação permite o cálculo da média de valores para conjuntos de placas e comparação estatística de controle e experimental de encapsulamento.
Resultados
Como uma demonstração do valor deste teste que utilizámos para investigar potencial hipóxia em larvas com compromisso da função do gene uninflatable (uif) nos tracheae. UIF codifica uma proteína transmembrana grande que fortemente se expressa na superfície apical das células traqueais larvas. Mutantes de uif anteriormente foram anotados para expor o comportamento aberrante que possa indicar hipóxia do tecido devido a mau funcionamento traqueal 9. Nós especificamente suprimida expressão uif na traqueia larval usando o sistema de Gal4-UAS. Gal4 duas linhas foram utilizadas: i) sem fôlego (btl)-Gal4, que se expressa fortemente nos tracheae desde o início do seu desenvolvimento embrionário e ii) corte(ue)-Gal4, que começa a expressão em uma pequena região posterior de os tracheae tronco dorsal principal no final da embriogênese e continua forte expressão nesta região ao longo da vida larval 7. Um UAS -uif RNAi linha foi obtido a partir do centro de pesquisas de drosófila de Viena (VDRC ID #1050).
Conforme descrito no protocolo acima, cinco replicar placas de recém-eclodidos primeiro ínstar larvas foram criadas para cada um dos quatro cruzes como segue.
Experimento 1
1) controle 1 - corte(ue)-Gal4 x Cantão-S (+)
2) Experimental 1 - corte(ue)-Gal4 x UAS-uif RNAi
Experimento 2
3) controle 2 - btl-Gal4 x Cantão-S (+)
4) Experimental 2 - btl-x UAS-Gal4uif RNAi
O comportamento de corte(ue)-Gal4 > UAS -uif RNAi larvas do experimento 1 foi comparável de controle corte(ue)-Gal4 > + animais em termos de burrowing, encapsulamento e sobrevivência de pupa, (Figura 1 e Figura 2). Em contraste, para baixo-regulação uif expressão em todo o sistema traqueal no início do desenvolvimento (experimento 2) produziu respostas marcadamente diferentes. A btl-Gal4 > UAS -uif RNAi larvas exibidos ambas as manifestações comportamentais de hipóxia do tecido – reduzida comida burrowing e uma total ausência de substratos de encapsulamento mais tarde na vida larval (Figura 1 e Figura 2 de ). As larvas experimentais foram também visivelmente menor, mais fino e mais lento do que controles (Figura 3) e mostraram uma alta taxa de mortalidade no decorrer do ensaio. Como discutido acima, redução do crescimento, a lentidão e a morte são conhecidos sintomas de hipóxia larval. Além disso, a maioria das larvas experimentais falhou a tentativa de pupa e permaneceu como terceiro estádio larvas longas depois de larvas controle tinham puparam. Algumas larvas sobreviveram mais de 15 dias antes de eventualmente morrer sem pupating (figura 1A). Algumas das larvas experimentais tentaram empupar, mas em todos os casos anormais pupas foram formadas que não gerou adultos viáveis.
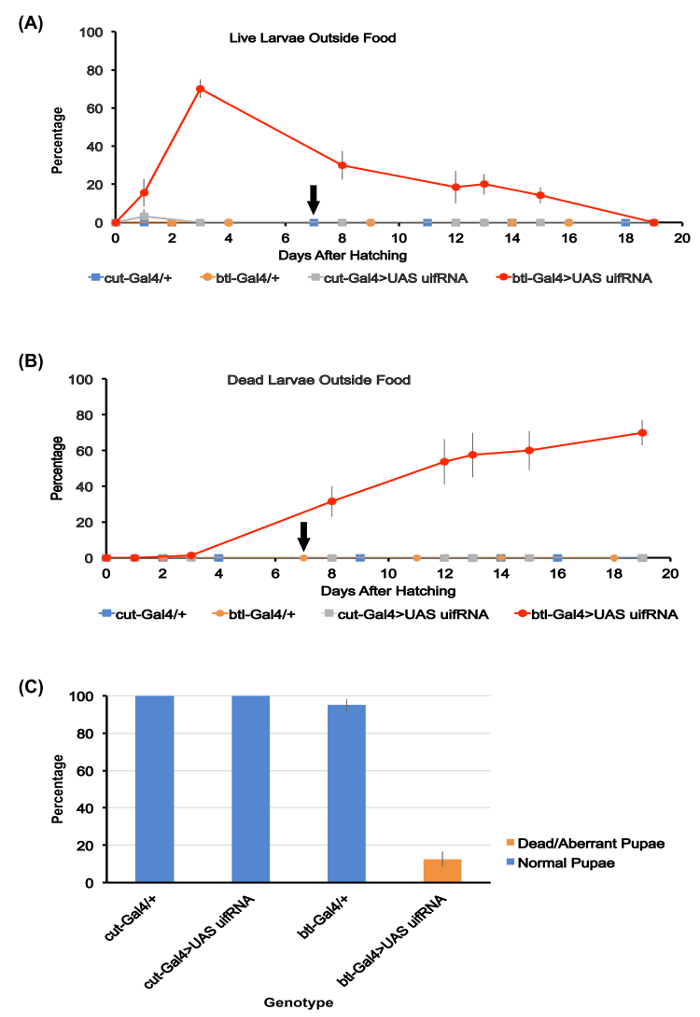
Figura 1. Quantificação de desenvolvimento larval e burrowing de comida.
(A) percentagem de larva viva fora dos montes de comida para os quatro genótipos estudados aqui. As médias para as placas de cinco ensaio utilizadas para cada genótipo são mostradas. De dia 3, após a eclosão, ~ 70% do btl-Gal4 > larvas de RNAi UAS uif estavam fora a comida, Considerando que não há larvas foram detectadas fora a comida ou à superfície do agar para os outros três genótipos. A btl-Gal4 > larvas de RNAi UAS uif morrem lentamente entre os dias 4-20, com ~ 15% deles ainda vivos 15 dias após a eclosão. A seta preta ao longo do eixo x aqui e em (B) indica o dia pelo qual todas as larvas de outros três genótipos tinham puparam.
(B) porcentagem de larvas mortas visíveis fora o alimento para os quatro genótipos. As médias para as placas de ensaio de cinco para cada genótipo são mostradas. Morto btl-Gal4 > larvas de RNAi UAS uif acumulam com o tempo, com a maioria morrendo lá fora a comida. Os outros genótipos que todos sobreviver a pupa
(C) porcentagem de sobrevivência de pupa para os quatro genótipos estudados. As médias para as placas de ensaio de cinco para cada genótipo são mostradas. Não normais pupas da btl-Gal4 > genótipo de RNAi UAS uif foram produzidos. Barras de erro em toda a figura representam SEMs. Clique aqui para ver uma versão maior desta figura.
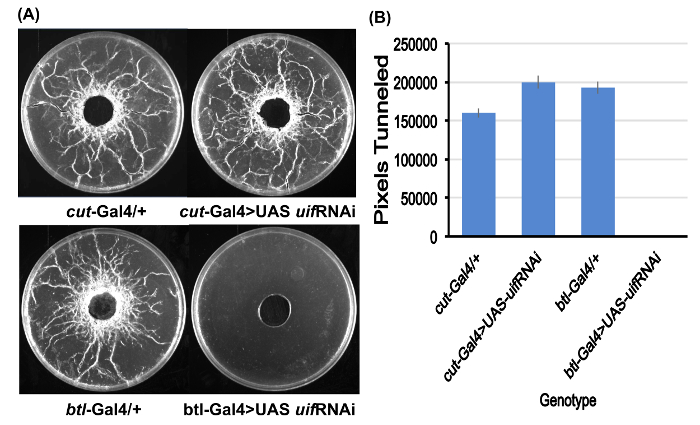
Figura 2. Quantificação de tunelamento larval.
(A) exemplos das placas de ensaio para todos os quatro genótipos estudaram após preparação para quantificação de encapsulamento. Observe a ausência completa de tunelamento para a btl-Gal4 > larvas de RNAi UAS uif . Placas de ensaio são as placas de Petri de 10 cm.
(B) a quantificação de encapsulamento derivado Image J para os quatro genótipos. Pixel valores médios para as placas de ensaio de cinco para cada genótipo. Sem encapsulamento foi observado para o btl-Gal4 > larvas de RNAi UAS uif . Barras de erro = SEMs. Clique aqui para ver uma versão maior desta figura.

Figura 3. Comparação de btl-Gal4 > UAS uif RNAi e btl-Gal4 > + larvas
Larvas de idade semelhante (6º dia após a eclosão) para o btl-Gal4 > UAS uif RNAi (A) e btl-Gal4 > + b genótipos. Setas vermelhas apontam para os tracheae dorsal do tronco. Ambas as larvas fotografadas na mesma ampliação. Barra de escala = 0,5 mm. clique aqui para ver uma versão maior desta figura.
Discussão
Apresentamos aqui um ensaio simples, desenvolvido para detectar hipoxia do tecido em larvas de d. melanogaster . Diagnóstico baseia-se na diminuição da burrowing montes de comida no início da vida larval e a ausência de substratos de encapsulamento mais tarde na vida larval. Apinhamento larval pode causar migração prematura longe de uma fonte de alimento e, portanto, um aspecto crítico do ensaio é que um pequeno número de larvas é doseado na presença de um grande excesso de comida. Inclusão de benzoato de hidroxila de metil-p o fungicida (Nipagen) para as placas de ágar também é essencial para evitar o crescimento de fungos durante o ensaio.
Achamos que as placas de ágar-ágar podem ser uma fonte de variabilidade no ensaio. Normalmente, as larvas do mesmo genótipo, de lotes diferentes dos pais, ou de diferentes coleções de larvas, mostram variação relativamente limitada em seu comportamento no ensaio. Em contraste, placas de ágar feitas em dias diferentes ou com diferentes lotes de ágar-ágar podem produzir diferenças no encapsulamento. Uma condição é, portanto, que o controle e larvas experimentais devem todos ser testadas usando placas de ágar da mesma preparação de lote. Agar de fabricantes diferentes ou mesmo transferências da mesma fabricação podem variar em sua força de gelificação, e então pode ser necessário o ajuste da concentração de ágar para cima dos 2.2% usada aqui para alcançar um gel ideal. Nós achamos que as larvas do tipo selvagem podem prontamente esburacam géis de ágar de 3%.
Para demonstrar o valor deste teste, nós usamos isso para investigar potenciais hipóxia do tecido em larvas com função suprimida de uninflatable nos tracheae. Nossas descobertas fornecem forte apoio para a hipótese de que a perda de expressão traqueal deste gene pode produzir hipóxia: btl-Gal4 > UAS -uif RNAi larvas mostraram falta de burrow na comida e ausência completa de substratos de encapsulamento durante o terceiro ínstar. Em nossos estudos anteriores de outros genótipos, observamos que perda induzida por hipóxia de escoar-se comida não é tão completa quanto a perda de substrato de encapsulamento e a btl-Gal4 > UAS -uif RNAi larvas estudaram aqui se comportou da mesma forma. O componente de encapsulamento falhado deste teste, portanto, fornece a mais forte indicação de hipóxia.
Embora o btl-Gal4 > uif RNAi larvas mostraram características comportamentais diagnóstico de hipóxia, a corte(ue)-Gal4 > UAS -uif RNAi não apresentam essas anormalidades. A btl e cortar(ue), Gal4 motoristas são expressos em diferentes fases e em padrões diferentes, dentro os tracheae larval. A btl-Gal4 motorista é expressa por todo o sistema traqueal, a partir de seu desenvolvimento na embriogênese e continuar com vida larval. Em contraste, Gal4 expressão das cortar(ue)-Gal4 driver só começa no final da vida embrionária, depois da morfogênese dos tracheae e limita-se às seções de extrema posteriores dos troncos dorsais, os principais vasos longitudinais de o sistema traqueal. UIF nocaute com esta linha de Gal4 não pode, portanto, reduzir a expressão uif suficientemente cedo ou amplamente suficiente para produzir algum nível de limiar de hipoxemia necessária para acionar os comportamentos medidos neste ensaio.
Um estudo prévio encontrado que terceiro ínstar larvas expostas a baixos níveis de oxigênio (10%) mostram diminuição do crescimento e atrasou o início da pupariation 14. A btl-Gal4 > UAS -uif RNAi larvas estudadas aqui apuraram-se para o terceiro instar, mas os efeitos sobre suas taxas de crescimento e pupa foram mais pronunciados: eram consideravelmente menores do que controles com muito pouco tecido adiposo, sob a a tentativa de epiderme (Figura 3) e apenas uma pequena fração (~ 10%) pupariation. Estas diferenças sugerem a btl-Gal4 > UAS -uif RNAi larvas experimentaram um maior grau de hipóxia, uif nocaute nos tracheae esteve presente ao longo de toda a sua vida larval, ou porque produzia mais grave falta de oxigenação no terceiro ínstar. Como perda da função uif nos tracheae pode impedir o transporte de oxigênio é clara neste ponto. Os tracheae da btl-Gal4 > UAS -uif RNAi larvas foram prontamente visíveis através da cutícula (Figura 3), uma indicação de que eles continham ar e não foram danificados ao ponto de que a entrada de fluido comprometido função. É formalmente possível, portanto, que o dano traqueal criado por perda da função uif não provocar hipóxia mas prefiro algum outro defeito que inibe o encapsulamento. Para os genótipos estudados anteriormente, determinamos que falha ao túnel está associada a níveis elevados de LDH mRNA7, o indicador canônico da glicólise e hipoxia em tarde terceiro ínstar larvas 15. Assim, a confirmação final de hipóxia para o btl-Gal4 > UAS -uif RNAi larvas (e em larvas examinadas no futuro usar deste teste) envolveria a RT-PCR para avaliar os níveis do mRNA LDH ou a utilização de um indicador disponível comercialmente para medir níveis de oxigênio intracelular (por exemplo ver 16).
Divulgações
Os autores declaram que têm sem interesses financeiros concorrentes.
Agradecimentos
Karen M. Qiang foi o destinatário de 2016 do George J. Schroepfer Research Award na Rice University. Fanli Zhou é o destinatário de uma bolsa de ensino da Universidade Rice. Os serviços do centro de estoque Drosophila Bloomington, instalação de viagem de Harvard, o centro de recursos de Drosophila Viena com gratidão são reconhecidos.
Materiais
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Dehydrated yeast | |||
| Frozen grape juice concentrate | Welch's | Available at most large supermarkets | |
| Glacial acetic acid | Sigma-Aldrich | 320099 | |
| Drosophila agar | Apex Bioresearch Products | 66-103 | |
| Methyl-para-hydroxybenzoate | Apex Bioresearch Products | 20-658 | |
| EQUIPMENT | |||
| 50 ml polypropylene beakers | |||
| 6.0 cm disposable Petri dishes | Falcon | 08757100B | |
| 10 cm disposable plastic Petri dishes | E+K Scientific | EK-24104 | |
| Plastic microspatulas | Corning Incorporated | 3012 | |
| Bent teasing needle | Nasco | S08848MH | |
| Dissecting microscope | Any microscope with 10-30X magnification |
Referências
- O'Farrell, P. H. Conserved responses to oxygen deprivation. J. Clin. Invest. 107 (6), 671-673 (2001).
- Lavista-Llanos, S., et al. Control of the hypoxic response in D. melanogaster by the basic helix-loop-helix pas protein Similar. Mol. Cell. Biol. 22 (19), 6842-6853 (2002).
- Reiling, J. H., Hafen, E. The hypoxia-induced paralogs Scylla and Charybdis inhibit growth by down-regulating S6K activity upstream of Tsc in D. melanogaster. Genes Dev. 18 (23), 2879-2892 (2004).
- Gorr, T. A., Gassmann, M., Wappner, P. Sensing and responding to hypoxia via Hif in model invertebrates. J. Insect Physiol. 52 (4), 349-364 (2006).
- Romero, N. M., Dekanty, A., Wappner, P. Cellular and developmental adaptations to hypoxia: A D. melanogaster perspective. Meth. Enzymol. 435, 123-144 (2007).
- Dijkers, P. F., O'Farrell, P. H. Dissection of a hypoxia-induced, nitric oxide-mediated signaling cascade. Mol. Biol.Cell. 20 (18), 4083-4090 (2009).
- Zhou, F., Qiang, K. M., Beckingham, K. M. Failure to burrow and tunnel reveals roles for jim lovell in the growth and endoreplication of the D. melanogaster larval tracheae. PLOS ONE. 11, e0160233 (2016).
- Wingrove, J. A., O'Farrell, P. H. Nitric oxide contributes to behavioral, cellular, and developmental responses to low oxygen in D. melanogaster. Cell. 98 (1), 105-114 (1999).
- Zhang, L., Ward, R. E. Uninflatable encodes a novel ectodermal apical surface protein required for tracheal inflation in D. melanogaster. Dev. Biol. 336 (2), 201-212 (2009).
- Langlais, K. K., Stewart, J. A., Morton, D. B. Preliminary characterization of two atypical soluble guanylyl cyclases in the central and peripheral nervous system of D. melanogaster melanogaster. J. Expt. Biol. 207 (13), 2323-2338 (2004).
- Morton, D. B. Behavioral responses to hypoxia and hyperoxia in D. melanogaster larvae. Fly. 5 (2), 119-125 (2011).
- Brand, A., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Wieschaus, E., Nusslein-Volhard, C., Roberts, D. B. Looking at embryos. Drosophila: a practical approach. , 199-227 (1986).
- Callier, V., Shingleton, A. W., Brent, C. S., Ghosh, S. M., Kim, J., Harrison, J. F. The role of reduced oxygen in the developmental physiology of growth and metamorphosis initiation in D. melanogaster. J. Expt. Biol. 216 (23), 4334-4340 (2013).
- Li, Y., et al. Hif- and non-Hif-regulated hypoxic responses require the estrogen-related receptor in D. melanogaster. PLoS genetics. 9 (1), e1003230 (2013).
- Grifoni, D., Sallazzo, M., Fontana, E., Froldi, F., Pession, A. Multiple strategies of oxygen supply in Drosophila malignancies identify tracheogenesis as a novel cancer hallmark. Scient. Rep. 5 (9061), (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados