Method Article
Alta sensibilità misura dell'affinità di legame di DNA di fattore di trascrizione per titolazione competitivo mediante microscopia a fluorescenza
In questo articolo
Riepilogo
Qui vi presentiamo un nuovo metodo per la determinazione dell'affinità di legame all'equilibrio e in soluzione con alta sensibilità su larga scala. Questo migliora l'analisi quantitativa di associazione del DNA di fattore di trascrizione. Il metodo si basa su misure di anisotropia di fluorescenza automatizzato in un sistema controllato di consegna.
Abstract
Quantificazione accurata del fattore di trascrizione (TF)-interazioni DNA è essenziale per la comprensione della regolazione dell'espressione genica. Poiché gli attuali approcci soffrono di limitazioni significative, abbiamo sviluppato un nuovo metodo per determinare l'affinità di legame di TF-DNA con alta sensibilità su larga scala. Il test si basa sul principio di anisotropia (FA) stabilito fluorescenza ma introduce importanti miglioramenti tecnici. In primo luogo, si misura una curva di titolazione competitivo FA completa in un singolo pozzo incorporando un riferimento fluorescente contrassegnato del DNA in una matrice di gel di agarosio poroso e TF. Senza etichetta oligomero di DNA viene caricato sulla cima di un concorrente e, attraverso diffusione, forma un gradiente spazio-temporali. La pendenza risultante FA viene poi letto utilizzando una configurazione di microscopio epifluorescenza su misura. Questa installazione migliorata notevolmente aumenta la sensibilità di rilevamento del segnale FA, consentendo l'associazione sia debole e forte, da quantificare in modo affidabile, anche per le molecole di simili pesi molecolari. In questo modo, possiamo misurare una curva di titolazione per pozzetto di una piastra multi-pozzetto e attraverso una procedura di montaggio, possiamo estrarre sia la costante di dissociazione assoluta (KD) e la concentrazione di proteina attiva. Testando tutte le varianti di mutazione di punto singolo di un dato consenso vincolante sequenza, noi possiamo indagine il paesaggio di specificità di intera associazione di un TF, in genere su un singolo piatto. Le matrici di peso posizione risultante (PWM) sovraperformare quelli derivati da altri metodi nella predizione in vivo occupazione TF. Qui, presentiamo una guida dettagliata per l'implementazione dell'anca-FA su un microscopio fluorescente automatizzato convenzionale e la pipeline di analisi di dati.
Introduzione
Dato il ruolo centrale di fattori di trascrizione (TFs) nella regolazione genica, determinare le preferenze di associazione in maniera quantitativa è di fondamentale importanza. Seminali studi di von Hippel ha introdotto il concetto che la regolamentazione TFs riconoscere rapidamente DNA, tale che la loro associazione è ben descritto dall'equilibrio termodinamico, mentre gli eventi a valle della RNA polimerasi al promotore di reclutamento sono controllati da più lenta cinetica1. Recenti studi di binding in vivo suggeriscono che questa immagine è probabilmente più complesso2,3; Tuttavia, questi presupposti generali servono come buone approssimazioni e hanno sostenuto molti approcci computazionali per trovare elementi cis-regolatori e predire espressione da sequenze4,5,6. Mentre l'associazione equilibrio così è stato impiegato con successo come un concetto, metodi attuali per determinare interazioni TF-DNA concentrano sull'associazione di specificità e in genere non direttamente misura affinità di legame all'equilibrio. La misurazione sistematica di TF-DNA binding rappresenta una notevole sfida tecnica e i metodi esistenti hanno diverse limitazioni diverse.
Immunoprecipitazione della cromatina seguita da deep sequencing (ChIP-seq)7, la tecnica più diffusa in vivo , non consente la misura dell'affinità di legame o la precisa localizzazione dei siti all'interno di frammenti genomic di legame. Sono in grado di misurare l'affinità di legame, diversi in vitro metodi, tra cui footprinting8DNasi, mobilità elettroforetica (EMSA) Maiusc9, surface plasmon resonance (SPR)10e Microscala submicronica11 ma essi sono relativamente bassa velocità effettiva. Viceversa, non sono in grado di misurare l'affinità di legame e in genere resa eccessivamente tecniche di throughput elevato compreso proteina associazione microarrays12, HT-SELEX13,14e batteriche monoibrido (B1H)15 specifiche sequenze, che è principalmente dovuto alla rigorosa selezione di associazione o fasi di lavaggio necessari. Gli sviluppi più recenti includono il sequenziamento profondo basato HiTS-FLIP16, SELEX-seq17e la base di microfluidica MITOMI18 o sorriso-Seq19, che permettono per l'estrazione di affinità di legame assoluto; Tuttavia, si basano sulla misurazione di intensità di fluorescenza di etichettati TF e DNA. Segnali di fluorescenza, di conseguenza, diventati limitando alle concentrazioni di proteina bassa e nella determinazione di bassi valori di KD (< ~ 10 nM). Inoltre, l'associazione di TF-DNA in questi metodi si svolge su superfici sottili, sollevare questioni con associazione aspecifici e/o auto-fluorescenza background, che lo rende difficile quantificare con precisione l'associazione debole.
Per risolvere queste limitazioni, abbiamo sviluppato un nuovo metodo per determinare i paesaggi di affinità TF-DNA all'equilibrio e in soluzione, che abbiamo chiamato ad alte prestazioni fluorescenza anisotropia (HiP-FA)20. La tecnica è basata sulla fluorescenza stabilito anisotropia (FA) dosaggio21 ma modificata per misurare le costanti obbligatorie con l'alta sensibilità e su larga scala utilizzando un microscopio automatizzato su misura e installazione di analysis.
Il saggio FA monitora l'interazione di specie fluorescente contrassegnati (come un oligomero di DNA) a un partner di associazione, in questo caso un TF, misurando la rotazione molecolare della molecola con etichetta. Legandosi a TF, sua velocità di rotazione diminuisce a causa della maggiore raggio idrodinamico e peso molecolare del complesso associato, che si traduce in FA maggiore. La misura esatta del legame molto forte (KD < ~ 1 nM) richiede l'utilizzo di basse concentrazioni di riferimento etichettato, DNA (c < ~ 1 nM). Questo è difficile da ottenere con uno strumento commerciale come un lettore di micropiastre standard. Inoltre, una differenza di grandi dimensioni (10-100 volte superiore) tra i complessi associati ed è di solito necessaria, che vieta di misurazione delle interazioni tra domini di legame di TF e brevi oligomeri del DNA, che sono in genere di più o meno simili pesi molecolari . Infine, una curva di titolazione completa normalmente richiede la preparazione e misurazione dei pozzi multipli contenenti una serie di concentrazione per le specie di titolazione.
Per risolvere questi problemi, usiamo un setup di microscopia widefield, modificato per ottenere alta sensibilità di rilevazione e consentono misurazioni FA alle z-posizioni diverse di un singolo pozzo. Questo permette di monitorare l'interazione di legame tra specie di simile peso molecolare e con alta affinità. Throughput più elevato si ottiene misurando FA in piastra Multi-ben formati e lo svolgimento di una serie di titolazione intero in un unico bene utilizzando un sistema di erogazione controllato (Figura 1a). Inoltre, impiegando un'analisi di legame competitivo, estraiamo non solo le costanti di associazione, ma anche la concentrazione di proteina attiva. Si tratta di una caratteristica importante del test, poiché solo una parte delle molecole espresse TF sono attivi a causa di degrado o di misfolding proteico. La messa a punto sperimentale si basa su un microscopio a epifluorescenza commerciale dotato di x-y - e Z-piezo stadi. Abbiamo aggiornato il sistema di eccitazione laser esterno, poi rilevato che i due emessi componenti di polarizzazione lineare sul chip di una telecamera EM-CCD con efficienza quantica alta per rilevamento della luce (Figura 1b e c 1). Il sistema utilizza un obiettivo di alta apertura numerica (NA) accoppiato ad un sensore ultra-sensibile e consente in tal modo misure FA altamente sensibili. Tramite la registrazione fluorescenza z-stack, associazione interazioni può essere misurata lungo l'asse ottico z quando si utilizza una matrice eterogenea per i reagenti. Tutte queste modifiche possono essere facilmente implementate su un sistema esistente e sono convenienti.
Ci avvaliamo di un saggio di legame competitivo in cui l'affinità di legame di un oligomero di DNA adenoida è misurato rispetto al DNA fluorescente contrassegnato, che funge da riferimento. TF e riferimento del DNA sono integrate alle concentrazioni fisse in una matrice di gel di agarosio poroso (poro dimensioni ~ 1 µm) che costituisce un ambiente non interagenti per l'associazione. Il riferimento DNA è etichettato con Cy5. Questo colorante ha dimostrato di essere particolarmente adatto per misurazioni FA a causa della sua durata di fluorescenza relativamente lungo (~ 1ns) e l'emissione di fluorescenza nella da' dello spettro visibile (priorità bassa bassa auto-fluorescenza). La concentrazione di TF è in eccesso molare sopra DNA Cy5-riferimento, assicurando che tutti i riferimento DNA è legato alle proteine. Una soluzione di adenoide concorrente del DNA viene quindi depositata sulla superficie del gel e si diffonde all'interno della matrice porosa, che istituisce un gradiente di concentrazione c (z, t) che cambia sopra il z-posizione del piano focale e tempo t (Figura 1una, Figura 2a-2 c). Il TF associato al DNA di Cy5-riferimento localmente è pertanto esposto a diverse concentrazioni del concorrente del DNA che compete per l'associazione, che conduce a una FA dinamicamente mutevole la Cy5-riferimento DNA FAREF(z, t) (Figura 2b e 2 c).
Per determinare il c(z,t) di concentrazione del concorrente, misuriamo in pozzetti separati (pozzi di calibrazione) la FA dinamicamente mutevole del segnale del Nilo blu (NB) FANB(z, t) (Figura 2una e 3). Questa tintura intercala nel DNA e quindi agisce come un sensore di DNA per il concorrente del DNA. Con questo sistema di erogazione controllato, decine o centinaia di differenti affinità di legame del DNA-proteina possono essere misurate all'interno di una piastra multi-pozzetto (formato piastra 96 o 384 pozzetti). Misurazione viene quindi eseguita in modo sequenziale fino a spostamento completo del riferimento con etichettato DNA da TF. Abbiamo determinato la specificità di legame per un dato fattore misurando le affinità di tutte le mutazioni del singolo-base di 3 N della sequenza consenso di lunghezza N. Anca-FA richiede basse quantità di proteina (~ pmols a curva di titolazione) e spettacoli bassa variabilità nella determinazione di KDs [coefficiente di variazione (CV) < 20%], consentendo misure su scala relativamente ampia. Il metodo può essere effettuato manualmente o completamente automatizzato usando un sistema robotizzato, con conseguente CVs ancora più basso (Figura 4, pannello superiore). Costanti di dissociazione sono misurate con alta precisione fino a 0,5 nM. Per affinità estremamente alta (KD < 500 pM), usiamo una titolazione standard competitiva (Figura 5) a causa di imprecisioni nella misurazione delle concentrazioni di DNA competitore a livelli bassi (< 100 nM).
Anca-FA può essere implementato su quasi qualsiasi standard, invertito, fluorescenti microscopio a epifluorescenza, fornito la disponibilità di un automatizzati XY-palcoscenico e una fase di z-axis di piezo. Componenti ottici sono stati costruiti intorno a un'installazione automatizzata widefield equipaggiata con un obiettivo a lunga distanza. In pratica, il dosaggio può essere adattato agli obiettivi con altre caratteristiche (in particolare lavoro, distanza e apertura numerica). Tuttavia, questo richiede l'ottimizzazione dei parametri (Distanze tra la z-fette, porosità e altezza del gel dell'agarosi, ecc.). È anche possibile l'uso di altri tipi di laser o macchina fotografica. Una descrizione dettagliata della intera procedura sperimentale e analisi dei dati è dato qui sotto nella sezione protocollo.
Protocollo
1. polarizzazione di microscopia
- Per l'illuminazione di laser di widefield, concentrarsi una linea 638 nm di un laser a diodi continuo (40 mW) sul diaframma di fibra ottica multimodale per la pulizia del fascio. Montare un polarizzatore lineare all'uscita della fibra per impostare la polarizzazione della luce laser.
- Bloccare il componente di eccitazione della luce emessa con uno specchio dicroico (cut-off 640 nm) e un filtro passa-banda (passa-banda 700/75).
- Lasciate che il segnale di fluorescenza passano attraverso un beam splitter polarizzante, che divide la luce emessa nei suoi componenti polarizzati perpendicolari e parallele. Allora, concentrare il fascio non riflessa (componente parallelo) e il fascio riflesso (componente perpendicolare) con una lente acromatica di lunghezza focale 200 mm sul chip di una fotocamera di EM-CCD retro-illuminato (Figura 1b e c 1). Usare uno specchio per regolare la direzione del fascio perpendicolare verso l'obiettivo.
2. progettazione e sperimentazione di riferimento etichettato fluorescente DNA oligomero
- Determinare la sequenza di nucleo del riferimento del DNA: il metodo si basa su un'analisi competitiva che misura la costante di dissociazione (KD2) tra un fattore di trascrizione e oligomero di DNA adenoide concorrente che compete per l'associazione con un DNA fluorescente contrassegnato cui affinità per il TF agisce come un riferimenti (KD1). La sequenza di consenso ottenuta da altre fonti come dell'impronta della dnasi o batterica 1-ibrido può servire come una partenza punto5,15.
Nota: come regola generale, un riferimento adeguato DNA ha un 3 a 7 volte diminuzione nell'affinità di legame per il TF rispetto alla sequenza di consenso. - Misurare da HiP-FA il K sD1di 2-3 provvisorie singole mutazioni della sequenza consenso derivato nel passaggio precedente. Tenta di mutare le posizioni in sequenza consenso che non sono troppo specifici per evitare la perdita completa dell'associazione.
Nota: È importante che la sequenza di riferimento è vincolata dal fattore di trascrizione di interesse (abbiamo usato in questo protocollo gigante Gt), ma non troppo fortemente, affinché i concorrenti più deboli si possono prevalere alle alte concentrazioni. - Il motivo di core (8-12 coppie di base generalmente) di estendere a una lunghezza di 16 coppie di basi o più aggiungendo simmetricamente fiancheggiando sequenza su entrambi i lati (aggiungere catene laterali per l'associazione corretta). Se necessario (per più biding domini, ad esempio), utilizzare sequenze più lunghe (fino a ~ 50 coppie di base di lunghezza sono state testate con il test di anca-FA).
Attenzione: Fare attenzione a non aggiungere basi che si prevede di creare siti di legame ectopico. Utilizzare strumenti computazionali che predicono i siti di legame da PWM disponibili per facilitare questo processo (ad es., PySite22). - Come riferimento con etichetta DNA, oligomeri di ordine fluorescente etichettati su Avanti o invertire il filo all'estremità 3' e 5'. Utilizzare, ad esempio Cy5, Bodipy-650 o qualunque altra tintura adatta ad una concentrazione di 10 µM (stock di 10 x 100 µM) in acqua e diluire graduale come descritto al punto 3.1.
- Preparare 500 mL di tampone di legame 1x aggiungendo tampone di fosfato di potassio 33 mM (pH = 7.0), 90 mM NaCl e il detergente non ionico 0,01% in acqua distillata. Anche preparare 3 x buffer di associazione, che contiene gli stessi componenti, tranne alle concentrazioni triplice. Se utilizza 3 x buffer obbligatorio come soluzione di riserva per il 1x buffer obbligatorio, preparare volumi > 500 mL; in caso contrario, preparare 250 mL.
Nota: Questa composizione è stata ottimizzata per la stabilità del fattore di trascrizione e per prevenire la dimerizzazione di glutatione S-transferasi (GST). - Misura con il programma di installazione di microscopia descritto nel passaggio 1 la FA di 200 µ l di tampone di associazione contenente 0,8 nM con etichettato riferimento DNA in presenza di quantità diverse di TF in una piastra a 96 pozzetti microscopia vetro inferiore (5-6 pozzetti con differenti concentrazioni di TF) determinare la concentrazione di TF da utilizzare. Eseguire una serie di titolazione con quantità crescenti di TF e scegliere per il dosaggio della concentrazione per il quale la curva raggiunge un plateau, che indica un legame completo dell'oligomero riferimento DNA.
Nota: La concentrazione ottimale di TF dipende dai valori delle costanti di dissociazione di TF-DNA. In genere, inferiore KDs richiedono concentrazioni più basse.
3. oligomero ricottura
- Per temprare gli oligomeri del DNA del riferimento con etichettato DNA (sequenza determinata nel passaggio precedente), mescolare 7 µ l di 10 mM tingere-contrassegnati avanti single-stranded DNA soluzione e 7 µ l di una concentrazione di 10 mM di suo complemento inverso senza etichetta in 186 µ l di acqua.
- Per le sequenze di DNA competitore, mescolare 20 µ l di soluzioni di 100 mM (in acqua, fornita dal costruttore) di DNA single-stranded avanti con 20 µ l di 100 mM del corrispondente inversa singolo filamento del DNA per ogni sequenza di concorrente individuale deve essere misurata.
- Eseguire la ricottura separatamente in un cycler PCR standard riscaldare le soluzioni a 70 ° C per 3 min e facendo diminuire la temperatura a RT a una velocità di 0,1 K/s. Se la macchina PCR utilizzata non supporta gradienti di temperatura a quel prezzo, semplicemente fare le incubazioni graduale con la diminuzione della temperatura (sono stati analizzati 99 cicli di 3 s con-0,40 K per ciclo).
4. preparazione del gel
Nota: La seguente sezione spiega la preparazione di due diversi tipi di gel: 1) i pozzi di titolazione contengono gel con proteine e vengono utilizzati per determinare la KDs per le sequenze di DNA del rispettivo concorrente, e 2) i pozzetti di calibrazione fanno uso di NB a determinare la concentrazione di DNA ad ogni altezza di punto e acquisizione di tempo dato. Il focus è sulla preparazione dell'esperimento in una piastra a 96 pozzetti, ma sono indicati anche i volumi corrispondenti per un formato di piastra 384 pozzetti.
- Sciogliere 0,5% w/v basso punto di fusione agarosio nel buffer di associazione facendo bollire in un forno a microonde di laboratorio. Dopo dissoluzione completa, regolare il volume nuovo con ddH2O per compensare possibili evaporazione.
Nota: Per comodità, preparare un brodo di 10-20 parti aliquote di 10 mL del gel e scioglieteli a 75° C quando sono necessari. Scorte di gel possono essere memorizzate a TA.
Attenzione: Fare attenzione per evitare il surriscaldamento della soluzione gel nel forno microonde. Breve tempo di riscaldamento intervalli con agitazione in mezzo sono preferibili. - Per preparare pozzi titolazione e calibrazione, prima di fondere due aliquote stock in gel 10ml a 75 ° C sotto agitazione.
- Utilizzare 240 µ l (incluso 20% sovraccarico) per ogni concorrente (n = numero di sequenze di concorrente).
- Utilizzare lo stesso volume di gel per il pozzo di taratura NB per garantire un'uguale temperatura e viscosità di entrambi gel.
- Quindi impostare la temperatura a 35 ° C e attendere che la temperatura equilibrare.
- Per i pozzi di titolazione, aggiungere 1,4 nM (concentrazione finale) ibridato riferimento DNA (ottenuta nel passaggio 3), proteina TF (concentrazione finale CTF = 20-60 nM, come determinata nel passaggio 2.6), DTT (0,2 mM) e l'associazione del buffer in un volume totale di n x 200 µ l o n x 13 µ l in un 96 - o 384 pozzetti piastra formato, rispettivamente (più alto). Mix accuratamente agitando invertendo / (Centrifugare).
- Lentamente aggiungere 200 µ l per pozzetto in formato piastra a 96 pozzetti (13 µ l/pozzetto per pozzi da 386) della soluzione gel il piatto ben preparato nel passaggio precedente nei pozzetti titolazione.
- Per i pozzi di calibrazione, innanzitutto aggiungere 5 nM NB per il gel fuso di fuori dei pozzetti (totali volume a seconda del formato di piastra ben utilizzato e il numero di taratura pozzi; di solito 5-6 per piastra bene è sufficiente).
- Dispensare 200 µ l (13 µ l per formato piastra 384 pozzetti) di NB contenenti gel lentamente all'interno dei pozzetti di titolazione della piastra ben e assicurarsi di evitare bolle d'aria.
Nota: L'utilizzo di pipette elettroniche o robotica aumenta significativamente la riproducibilità. - Lasciare che il gel solidificare per 10 min a RT e un altro 10 min a 4 ° C (rimuovere condensa dal vetro in seguito se necessario). Assicurarsi di eseguire tutti questi passaggi su una superficie perfettamente orizzontale per evitare superfici disomogenee gel.
Nota: I gel contenenti proteine sono solitamente stabili per almeno alcune ore a 4 ° C.
5. aggiunta della soluzione di DNA competitore
Nota: Le seguenti soluzioni dovrebbero essere preparate prima di iniziare la titolazione e vengono aggiunti in cima i pozzi di calibrazione e titolazione simultaneamente.
- Aggiungere che il ricotto etichettato riferimento DNA e proteine in 3 x buffer obbligatorio alle 3 volte più alte concentrazioni che le aliquote di riserva di gel.
- Ricotto, mix 20 µ l di soluzione ottenuta con 40 µ l di ogni soluzione di DNA concorrente ottenuta nel passaggio 3.
- Per ciascun pozzetto di calibrazione, mescolare 20 µ l di tampone di associazione contenente soluzione di 15mm NB con 40 µ l di ricotto concorrente del DNA (qualsiasi sequenza della stessa lunghezza è adatto): 3x.
Nota: Per le piastre da 384 pozzetti, utilizzare µ l 21 invece di 60 µ l in totale.
- Facoltativamente, verificare l'omogeneità dei livelli di altezza del gel in diversi pozzetti della piastra spettroscopicamente misurando l'assorbanza a 380 nm, utilizzando un lettore di piastre multi-pozzetto (i valori di assorbanza sono proporzionali alle altezze gel).
- Aggiungere 50 µ l (7 µ l per formato piastra 384 pozzetti) delle soluzioni di DNA misto concorrente (ricotto in passaggio 3) sopra il gel. Se si tenta di aggiungere tutte le soluzioni di concorrente contemporaneamente possibile utilizzando pipette multicanale elettroniche o una testa di pipettaggio di 96 canali, se disponibile. Dopo l'aggiunta delle soluzioni concorrenti, collocare la piastra sul tavolino del microscopio e iniziare le misurazioni immediatamente (passaggio 7).
6. acquisizione immagini
- Acquisire in modo sequenziale volte serie di z-pile (ad es., uso 12 aerei e 100-300 ms di tempo di illuminazione). Evitare immagini che troppo vicino alla superficie del bene (< ~1.4 µm con i piatti citati) per escludere eventuali bias di polarizzazione.
- Eseguire cicli di 10-25 delle misurazioni fino alla completa separazione del DNA con etichetta riferimento da TF. L'endpoint viene in genere raggiunto dopo 1-2 h, a seconda della cinetica di legame e la diffusività del concorrente del DNA.
7. estrazione di FA(z,t) dai dati grezzi
- Una volta un piatto ben è stato ripreso, calcolare dalle immagini raw fluorescenza i valori di pixel medi delle regioni di interesse per il parallelo (I=) e perpendicolarmente (I+) polarizzate intensità componenti (Figura 1c). Questo può essere fatto automaticamente utilizzando il software di anca-FA23.
Nota: Il software di anca-FA, un manuale di istruzioni e un set di dati di prova possono essere scaricati23. In alternativa, utilizzare qualsiasi altro software personalizzato per estrarre I= e I+ ed eseguire l'analisi a valle delle curve di titolazione, come descritto dettagliatamente di seguito. - Calcolare FA per ciascun pozzetto. Per ogni bene, lo script calcola FA(z,t) ogni posizione z e tempo punto t secondo:
Equazione 1: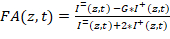
Dove G è lo strumento fattore-G che corregge per qualsiasi polarizzazione verso il canale perpendicolare. - Determinare il fattore di G del setup microscopia misurando la FA eventuali soluzioni contenente un colorante fluorescente dell'anisotropia noto. Estrarre i due componenti di polarizzazione del segnale e quindi utilizzare equazione 1 per ottenere G, sapendo la FA della soluzione (G = 1.15 in questa configurazione).
8. curva di taratura per la determinazione della concentrazione di DNA competitore da FANB
- Tempri 120 µ l di ogni oligomero di riferimento e inversa (concentrazione stock 100mm; qualsiasi sequenza casuale con la stessa lunghezza come il concorrente sequenza può essere utilizzato) e mescolare con 120 µ l di tampone di associazione contenente NB: 3x (15 nM).
- Preparare una serie di diluizioni con diluizioni 1:2 in 1 x buffer obbligatorio con 6 diluizioni in totale. Mix 50 µ l di queste diluizioni con 200 µ l di gel di agarosio (T > 35 ° C) punto di fusione basso di 0,5% in 1x tampone di associazione contenente 5 nM di NB in triplici copie.
- Aggiungere 200 µ l di ciascuna delle 6 soluzioni preparate nel passaggio precedente in una piastra a 96 pozzetti e memorizzare la piastra per 1 h a 4 ° C per garantire completa gelificazione, quindi 1h a RT. misura la FANB delle soluzioni utilizzando il programma di installazione di anca-FA.
- Estrarre FANB (z, t) in base al passaggio precedente e adattare i dati utilizzando un'equazione di Hill:
Equazione 2: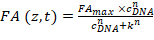
Dove CDNA è la concentrazione dell'oligomero del DNA; k la concentrazione degli oligomeri del DNA al quale metà delle sedi del legame sono occupati; FAmax è una costante di normalizzazione; e n è il coefficiente di Hill. durante la procedura di montaggio vengono impostati come parametri liberi k, FAmax e n . - Inserire i tre parametri ottenuti dalla procedura di montaggio nel software HiP-FA (nel riquadro inferiore sinistro).
- Ripetere la determinazione della curva di calibrazione ogni pochi mesi o dopo aver apportato modifiche nell'impostazione di microscopia.
9. determinazione delle concentrazioni di DNA competitore
- Utilizzare il software di anca-FA per estrarre c (z, t) dalle misurazioni FANB(z, t) (Figura 3). In primo luogo ottenere la curva di taratura come descritto nella sezione precedente e immettere i parametri di raccordo al software (Vedi manuale per i dettagli).
- Il programma consente di estrapolare automaticamente c(z,t) per l'utilizzo di c < 100 nM (Vedi manuale per i dettagli) equazione 3 (Figura 3b), che descrive la diffusione unidimensionale del concorrente del DNA nella matrice del gel dell'agarosi, assumendo diffusione gratuita.
Equazione 3: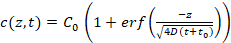
Dove C0 è la concentrazione iniziale del concorrente del DNA; ERF è la funzione di errore; z è la posizione; D è il coefficiente di diffusione del concorrente del DNA; e t0 è l'ora di inizio delle misurazioni. I parametri di connessione utilizzati sono C0 e z /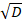 .
.
10. convenzionale titolazione competitivo con HIP-FA per il grippaggio del DNA molto forte
- Diluire in serie gli oligomeri di DNA diverso concorrente nelle righe di una piastra a 96 pozzetti (o piastra 384 pozzetti) alle concentrazioni di: 0, 1,25, 3.5, 9, 19, 45, 90, 190, 425, 900, 1900 e 4000 nM. Aggiungere il riferimento di Cy5-etichetta del DNA (1 nM) e TF (20-50 nM) ad una concentrazione costante, con un volume totale di 200 µ l per pozzetto nel buffer di associazione (Figura 5a). Aspettare 40 min fino a quando non viene raggiunto l'equilibrio termodinamico e acquisire (con il programma di installazione di anca-FA) z-stack per ogni pozzetto (l'acquisizione di diverse immagini per pozzetto riduce la variabilità calcolando i valori calcolati di FA).
- Costruire le curve di titolazione di associazione equilibrio e farli stare con equazione 4 (Figura 5b). I s KDdeterminato per titolazione competitivo convenzionali sono identici a quelli ottenuti da HIP-FA utilizzando una matrice di gel dell'agarosi20.
11. montaggio procedura delle curve di titolazione di FA
- Visualizzare nel software HiP-FA le curve di titolazione ricostruita per le sequenze di concorrente individuale FA(z,t) = f[c(z,t)] e controllare visivamente la qualità dei dati (Vedi manuale per i dettagli). Se necessario, ridefinire i parametri utilizzati per la determinazione delle concentrazioni di DNA competitore nel passaggio 10.
- Montare ogni curva di titolazione individuale automaticamente utilizzando equazione 4, che dà una soluzione analitica per titolazione competitivo analisi24.
Equazione 4: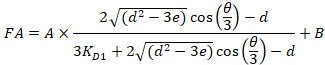
Con: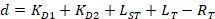
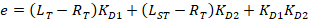
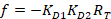
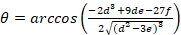
Dove RT è la concentrazione di proteina; LT è il senza etichetta e LST è la concentrazione di DNA con etichetta; KD2 è la costante di dissociazione da determinarsi; RT è la concentrazione di proteina attiva; e A e B sono parametri di normalizzazione.
In primo luogo determinare KD1, che serve come riferimento per la determinazione dei diversi valori KD2 . È KD1 può essere determinato facilmente con l'analisi scegliendo la sequenza del DNA di tintura-riferimento come la sequenza del DNA concorrente senza etichetta (Vedi manuale). - Immettere il valore ottenuto di KD1 nel software e calcolare i valori di KD2 per il concorrente del DNA sulla piastra.
Nota: I parametri liberi della procedura di montaggio sono KD2, RT, A e B. - Esportare la costante di dissociazione KD2 e la concentrazione di proteina attiva RT per tutti i pozzi di titolazione individuale della piastra facendo clic sul pulsante "Esporta" nel software.
12. PWM costruzione, specificità di interazione proteina-DNA e i conteggi di Pseudo
Creare i loghi di sequenza per il PWM differenti utilizzando il tool online WebLogo 3.0 (http://weblogo.threeplusone.com/create.cgi) come descritto in precedenza20.
Risultati
Abbiamo applicato HiP-FA a TFs della segmentazione gene rete25,26, che genera il modello anteriore-posteriore corpo di embrioni della drosofila, in gran parte attraverso la regolazione trascrizionale. Da questa rete, abbiamo scelto la bZIP dominio TF gigante (Gt) per un'analisi dettagliata (Figura 4). Poiché fattori di trascrizione full-length sono difficili da esprimere e produrre per lo più le stesse preferenze di associazione come loro DNA associazione domini (DBD)13, abbiamo usato il DBD fuso a GST ed espresso il costrutto in proteine di fusione di e. coli GST per fornire gli stessi risultati come DBDs solo20.
La sequenza di consenso di Gt (unTTACGTAAC) rappresenta la sequenza di associazione più forte che abbiamo determinato come descritto sopra. Poi abbiamo studiato l'influenza sull'energia di legame di tutte le possibili mutazioni di singolo punto all'interno della sequenza di consenso Gt 10-mer (un totale di 30), affiancata da altre basi alle estremità 5' e 3'. Abbiamo misurato due repliche cui campioni di gel sono stati prodotti utilizzando l'automazione e una replica aggiuntiva prodotte manualmente per il confronto. KDs variavano da 0,6 a > 2000 nM per sequenze singolarmente mutati, e inoltre abbiamo confermato la completa mancanza di associazione a una sequenza di "vincolanti" (dati non mostrati).
Specificità di legame di TF-DNA sono in genere modellate utilizzando una matrice di peso posizione (PWM), in cui viene assegnato un punteggio per ogni nucleotide possibili in ogni posizione nel motivo dell'associazione. Il PWM si presuppone che ogni posizione contribuisce alla forza di associazione in modo indipendente e in molti casi costituisce un modello sufficiente per TF vincolanti preferenze27. Abbiamo generato riveduta PWM basato sulle nostre misure di affinità segue stabilito procedure28,29 e li hanno confrontati a due PWM precedentemente segnalati nella letteratura. Il primo è basato su conteggi di frequenza del nucleotide da associazione siti individuati da DNA footprinting4,5, e il secondo PWM è stato ottenuto da batterica monoibrido (B1H) selezione. 15
L'alta somiglianza di PWM per le tre repliche (Figura 4, pannello superiore), anche per il campione preparato manualmente (replica 3), dimostra l'alta riproducibilità del metodo HiP-FA. Mentre il PWM ottenuti da HiP-FA sono nel complesso simile a PWM ottenuti con altri metodi (Figura 4, pannello inferiore), ci sono deviazioni significative: posizione 2 (freccia nera), l'inizio del motivo bZIP core, mutazioni T > (G, C, A) portare a perdita totale dell'associazione nel motivo ottenuto da HiP-FA, che è coerenza con il motivo B1H ma non con quella ottenuta con footprinting DNasi, in cui l'associazione rimane relativamente forte per le basi (G, A). Al contrario, in posizione 7 (freccia grigia), la mutazione di T > C conduce a molto associazione più forte rispetto a quello che si aspettava basato sul PWM misurato in precedenza.
Altre deviazioni sono più sottili ma non meno importante. Nel complesso, il PWM HiP-FA è meno specifico rispetto agli altri due, che riflette il fatto che molte mutazioni dal consenso ancora provocano moderatamente forte legame. Questo può essere quantificato utilizzando il contenuto di informazioni (IC). L'IC è 11,5 bit per la matrice di anca-FA (media dei tre replicati), rispetto alla IC = 13,4 bit e bit 16,8 per il footprinting DNasi e matrici B1H, rispettivamente. In generale (anche se non universalmente), il PWM ottenuti da HiP-FA sono meno specifici di quelli ottenuti da altri metodi, basati su 26 TFs studiato20.
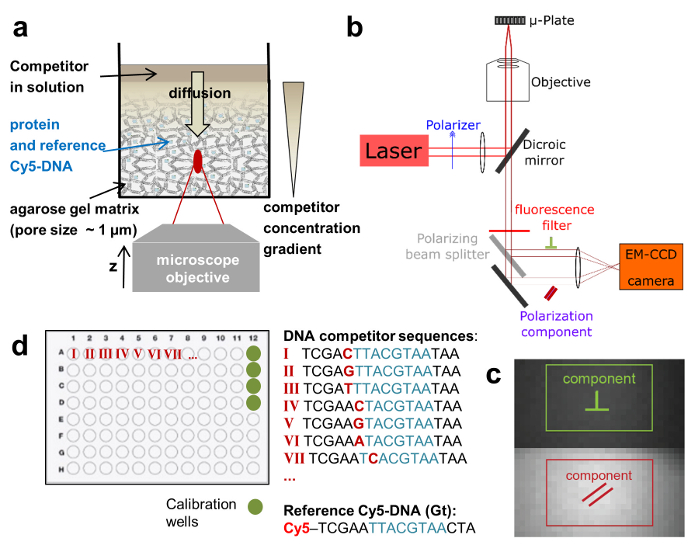
Figura 1:rappresentazioni schematiche del anca-FA analisi e messa a punto sperimentale. (a) sistema di consegna gel per titolazione concorrente del DNA a singolo wells. (b) installazione di microscopia HIP-FA. Su misura automatizzata widefield microscopio con luce rilevazione della fluorescenza polarizzata su una fotocamera di EM-CCD. (c) Raw immagine di fluorescenza con le due regioni d'interesse utilizzato per determinare il parallelo (rosso) e il perpendicolarmente (verde) polarizzati componenti. (d) layout tipico di una piastra a 96 pozzetti. Clicca qui per visualizzare una versione più grande di questa figura.
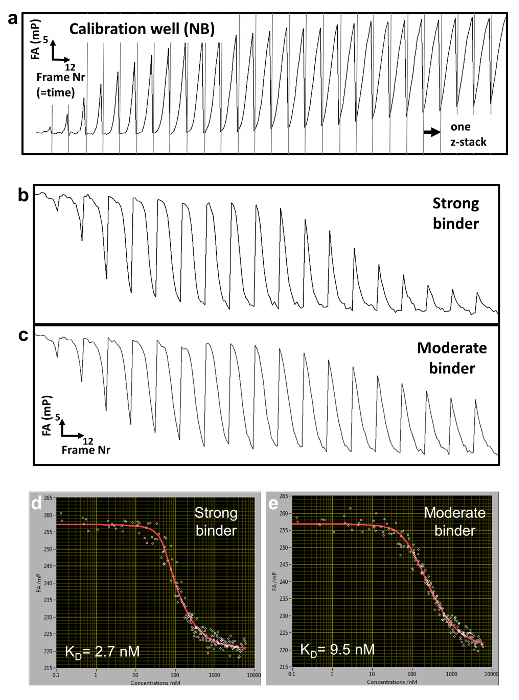
Figura 2 : FA raw dati e curve di titolazione ricostruita. (a) tipica FA(z,t) traiettoria per una calibrazione contenente ben NB (b, c) Traiettorie di tempo fa(z,t) per due pozzi di titolazione misura vincolante per una forte (b) e la più moderata (c) DNA associazione concorrente. (d, e) Corrispondente ricostruito misure titolazione FA e montato le curve per il forte (d) e moderata (e) associazione. Clicca qui per visualizzare una versione più grande di questa figura.
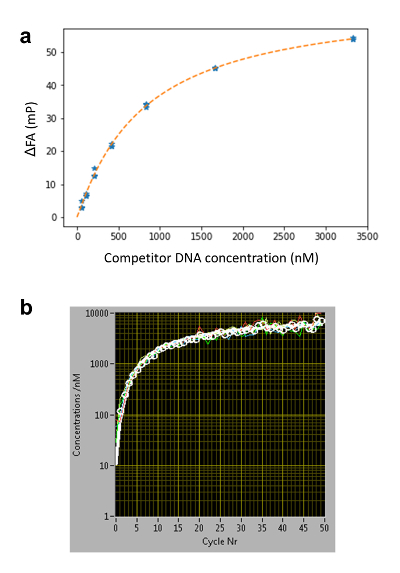
Figura 3 : Determinazione della concentrazione del DNA c concorrente (z, t) utilizzando il Nilo blu (NB). (a) curva di taratura FA-concentrazione per 16 oligomeri di coppie di basi del DNA. In una serie di titolazione convenzionale, NB è incorporato in gel di agarosio insieme a diverse concentrazioni di concorrente del DNA. L'affinità di NB al DNA è indipendente dalla sequenza20; di conseguenza, le stesse curve di calibrazione possono essere utilizzate per la determinazione di c (z, t) per diverse sequenze di DNA della stessa lunghezza. (b) profilo di diffusione del DNA tempo concorrente ad un'altezza di arbitrario z determinato utilizzando cinque pozzi di calibrazione. Per ogni ciclo di misura, la FAs medio di quattro pozzi contenenti NB vengono visualizzati come puntini bianchi. Le curve sono montate usando equazione 3 (linea bianca, singoli pozzetti in colore) e la c (z, t) a basse concentrazioni (C < ~ 100 nM) è determinata dalla curva estrapolata. Clicca qui per visualizzare una versione più grande di questa figura.
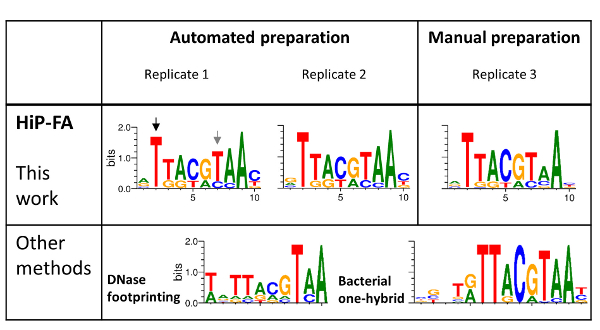
Figura 4 : Associazione delle specificità della famiglia dominio bZIP TF gigante (Gt). ANCA-FA PWM di tre repliche: due preparati utilizzando automazione e uno preparati manualmente (pannello superiore) vengono confrontati con PWM generato da dell'impronta della dnasi e dal metodo di selezione (B1H) monoibrido batterico (pannello inferiore). Nel complesso, i motivi che legano HIP-FA d'accordo con i dati precedenti ma anche mostrano differenze significative, come evidenziato con le frecce nere e grigie. Clicca qui per visualizzare una versione più grande di questa figura.
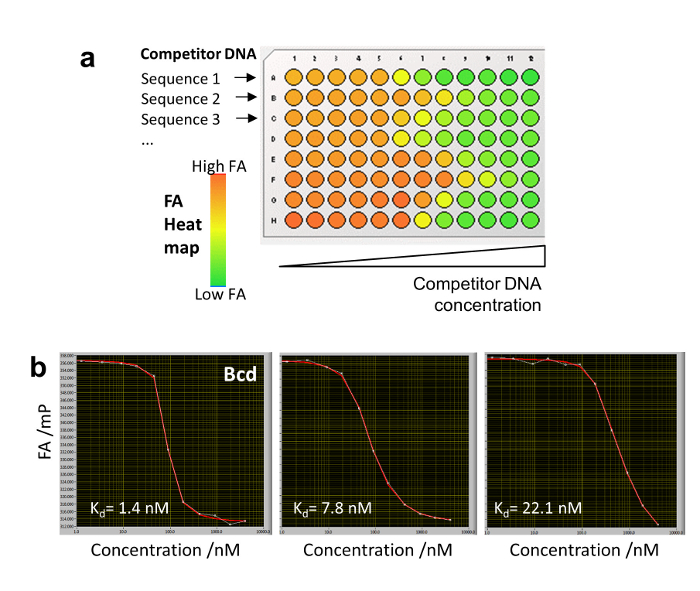
Figura 5 : Titolazione convenzionale competitivo con HIP-FA. (a) piastra design Mostra 8 DNA diverso concorrente in serie diluito in un tampone di associazione in una singola riga di una piastra a 96 pozzetti. Una mappa di calore FA è indicata per i punti di forza di associazione diversa arbitraria. (b) competitivo titolazione di tre concorrente DNAs vincolanti per il TF Bcd con diverse affinità. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Anca-FA è un completo nuovo metodo per determinare i paesaggi di preferenza di associazione delle interazioni TF-DNA. Misura affinità di legame di mutational varianti del DNA motivo direttamente, evitando qualsiasi ipotesi che preferenze di associazione vengono riflesse nella frequenza di occorrenza del nucleotide in un set di raccoglitori di sopra-soglia. Misura avviene nella soluzione senza immobilizzazione e interferenza meccanica o chimica con la reazione di associazione, ravvicinamento delle condizioni di equilibrio più fedelmente possibile. Il sistema di erogazione controllato consente la misurazione di una curva di titolazione completa all'interno di un singolo bene e aumenta l'affidabilità e velocità effettiva durante il salvataggio della proteina. Utilizzando un obiettivo con un'apertura numerica elevata ed EM-CCD fotocamera con un'efficienza alta collezione light permette per rivelazione di luce fluorescente altamente sensibile. Quindi, con questa configurazione, piccolo FA cambia in basso come 10-15 mP possono essere rilevate con precisione; in pratica, ciò significa che qualsiasi reazione di associazione per la quale è facilmente rilevato l'aumento di massa dopo l'associazione è minimo (basso quanto un rapporto massa 2). Questo non è solitamente il caso con sistemi commerciali come lettori di micropiastre. Dovuto la relativa alta sensibilità, anca-FA amplia la gamma di costanti di dissociazione può essere attendibilmente nella gamma picomolare. Energie di legame sono determinate con precisione su più ordini di grandezza.
Per valutare la qualità del PWM riveduta, abbiamo effettuato due tipi di analisi20. Abbiamo testato, per cinque fattori della rete genica segmentazione, come ben diversi PWM può prevedere sperimentale ChIP-seq profili nelle regioni genomiche di 21 geni di segmentazione. Come una seconda prova, abbiamo utilizzato un modello di espressione di sequenza4 che predice il pattern di espressione di esaltatori di segmentazione sulla base della concentrazione di preferenza e proteina di associazione di TFs partecipanti. In entrambi gli esercizi, abbiamo trovato che il PWM HiP-FA meno specifici eseguire significativamente migliore rispetto al più specifico dell'impronta e B1H PWM20.
A differenza dei metodi de novo , anca-FA richiede una certa conoscenza preventiva di preferenza di un determinato TF associazione. Tuttavia, sequenze consenso sono noti per molti TFs, e molti metodi esistenti è in grado di fornirli13,14,15. Se necessario, la sequenza di true associazione ottimale si trovano in modo iterativo.
Abbiamo usato gli oligomeri di riferimento DNA fluorescente etichettati con Cy5 e Bodipy-650. Questi coloranti hanno dimostrato di svolgere bene per misurazioni FA poiché l'anisotropia di DNA di riferimento etichettato associato ed erano il più grande tra i diversi coloranti testati. Questo assicura una massima gamma dinamica per i valori di FA. In generale, qualsiasi colorante fluorescente con fluorescenza durata ≥ 1 ns rischia di essere adatto ma ha bisogno di essere testati prima. Se possibile, si consiglia di utilizzare coloranti fluorescenti nella gamma vicino-IR per minimizzare la proteina autofluorescenza.
La fase più critica delle procedure sperimentali è il pipettaggio del gel nei piatti ben. Buona riproducibilità richiede i volumi di gel per essere il più uniforme possibile. Cambiamenti in altezza di gel sono tradotte in modifiche di diffusività per il competitivo oligomero di DNA e quindi in cambiamenti apparenti di affinità quando si valutano i dati. Questa è la fonte principale della varianza in una tecnica replica. L'uso di un tecniche di dispensare o automazione elettronica migliora la riproducibilità. Bolle d'aria all'interno del gel può essere evitata pipettando lento ed accurato. È anche importante aggiungere tutte le soluzioni di concorrente in cima i pozzetti di titolazione con come piccolo ritardo possibile. Per la migliore riproducibilità, l'intero processo può essere automatizzato utilizzando un robot pipettaggio con incubatori di calore. Una parte critica per il trasferimento il protocollo di automazione è necessario ottimizzare temperatura incubatrice e i tempi di incubazione. Assicurati di trovare un equilibrio ottimale tra la viscosità del gel (i. e., non troppo freddo) e la stabilità delle proteine (cioè, non troppo caldo). Questo dipende sia dalla velocità erogazione dei gel in pozzi e stabilità della proteina utilizzata.
Anca-FA fa uso di un sistema di erogazione controllato per gli oligomeri del DNA di concorrente. Per costruire le curve di titolazione, è necessario determinare la concentrazione del DNA a concorrente c(z,t) per ogni dato z-posizione nella matrice del gel e tempo punto t. Questo è un altro passo fondamentale, poiché la determinazione del KDs dipende direttamente da c(z,t). Pozzi di calibrazione contenente il colorante NB come un sensore per la concentrazione di DNA sono utilizzati per questo scopo (Figura 1d, Figura 2a). In genere, 3-5 pozzi di calibrazione contenente NB per ciascuna piastra sono sufficienti. Prima di valutare qualsiasi HiP-FA sperimentare, una curva di calibrazione NB deve essere costruita per il set-up eseguendo una serie di titolazione convenzionale di NB dissolto nel gel dell'agarosi con un concorrente del DNA di qualsiasi sequenza a diverse concentrazioni (Figura 3 un), come spiegato in dettaglio nel passaggio 8. In caso di associazione molto forte (KD < 500 pM), l'estrapolazione utilizzato per la determinazione delle concentrazioni basse di concorrente del DNA diventa limitando, dal momento che è meno accurata rispetto una misura diretta. Tuttavia, per TFs con tale basso KDs, l'installazione di anca-FA utilizzabile per eseguire una titolazione competitiva convenzionale nel buffer di associazione senza l'utilizzo di una matrice di gel di agarosio (Figura 5). Ad esempio, una titolazione completa con 12 differenti concentrazioni di DNA competitore può essere eseguita in una singola riga di una piastra a 96 pozzetti.
Il sistema di erogazione controllato richiede anche veloce cinetica di legame di TF-DNA e proteine stabili, poiché la diffusione anche se il gel dell'agarosi è dinamico (anche se lento). Entrambe le proprietà possono essere testate direttamente con il programma di installazione di anca-FA da seguito, nel corso del tempo, la FA di TFs di interesse quando è associato ai rispettivi fluorescente etichettati riferimento DNA. Abbiamo misurato KON e KOFF tariffe per i fattori indagati e li ho trovati ad essere dell'ordine di millisecondi a secondi20, secondo altri studi30. Questo è sufficientemente veloce per garantire che le misure avvengono all'equilibrio. Nel caso di altre reazioni di associazione con la cinetica più lenta, la diffusività del concorrente può essere sintonizzata abbassando la sua concentrazione o riducendo la dimensione dei pori gel. Nel caso il testata TFs, che tutti hanno veloce TOFF (~ secondi), un tempo di misura totale di circa 1-2 h è sufficiente a garantire l'equilibrio termodinamico a ogni misurazione.
Un altro potenziale problema correlato alla proteina è la formazione di aggregati proteici che possono alterare le misurazioni FA. L'uso di altre condizioni di buffer contenente diversi additivi (come tensioattivi) può impedire la formazione di aggregati, se necessario.
Abbiamo lavorato sotto l'ipotesi di linearità del PWM; Tuttavia, anca-FA può essere scalata per includere tutte le mutazioni possibili di nucleotide della sequenza consenso. Infine, anca-FA può essere adattato per misurare altri tipi di interazione di legame. Il presupposto è quello di avere disponibile una molecola di riferimento adeguati vincolato dalla proteina che può essere etichettata fluorescente. Con il sistema di erogazione controllato, un gradiente di concentrazione può essere generato per qualsiasi tipo di legante; di conseguenza, interazioni proteina-proteina e farmaco-proteina possono essere misurate Analogamente ad alta fedeltà e throughput.
Divulgazioni
Gli autori non dichiarano alcun conflitto di interessi.
Riconoscimenti
Ringraziamo J. Müller per cloni di cDNA e membri del laboratorio Gallia, in particolare S. Bergelt, per i preziosi consigli e discussione vivace. Questo lavoro è stato supportato da 646 SFB, reti di regolazione nell'espressione del genoma e manutenzione (C.J., P.B.), il centro per la scienza di proteina integrato (U.G.) e la scuola di specializzazione per quantitativi Biosciences Monaco di Baviera (M.S.). U.G. riconosce supporto dalla Deutsche Forschungsgemeinschaft (SFB 646, SFB 1064, CIPSM, QBM), il Bundesministerium für Bildung und Forschung (BMBF: ebio - Innovationswettbewerb Systembiologie) e la fondazione Humboldt (Alexander von Humboldt, Cattedra).
Materiali
| Name | Company | Catalog Number | Comments |
| Cy5-labled 16- / 18-bp DNA-oligomers | Eurofins | Custom synthesis | |
| 16- / 18-bp DNA-oligomers | Eurofins | Custom synthesis | |
| Nile Blue A | Sigma | N5632-25G | |
| Sensoplate plus microplate 96- or 384-well, PS | Greiner | 655891 | 175 µm thick glass bottom |
| 384 Well Sensoplate, black | Greiner | 788896 | |
| Agarose, low gelling temperature | Sigma | A9414-50G | |
| Sodium Chloride | Merck | 1.06404.1000 | |
| Tween-20 | Sigma | P1379-1L | |
| Di-Potassium hydrogen phosphate trihydrate | Merck | 1.05099.1000 | |
| Potassium dihydrogen phosphate | Merck | 1.04873.1000 | |
| Q-POD Element | Merck Millipore | ZMQSP0DE1 | |
| Millipak 40 Gamma Gold Filter | Merck Millipore | MPGL04GK2 | |
| Milli-Q Integral 3 Water Purification System | Merck Millipore | ZRXQ003WW | |
| Quantum TIX | Merck Millipore | QTUMOTIX1 | |
| DL-Dithiothreitol | Sigma | 43815-1G | |
| Mastercycler gradient | Eppendorf | Z316083 | |
| SafeSeal tube 1.5 mL | Sarstedt | 72.706.200 | |
| Tube 15 mL | Sarstedt | 62.554.502 | |
| Multiply-Pro cup 0.2 mL PP | Sarstedt | 72.737.002 | |
| MICROSCOPY SETUP: | |||
| Automated widefield microscope | LEICA | DMI6000 | |
| Long distance objective | LEICA | HCX PL FLUOAR L 60x/0.60 N.A. Dry | |
| 638 nm line continuous diode laser | Omicron | PHOxX 638-40, 40mW | |
| Back-illuminated EM-CCD Camera | Andor | iXon DV897 | |
| Dichroic mirror | AHF | 640nm cut-off | |
| Bandpass filter | AHF | ET bandpass 700/75 | |
| Linear polarizer | Thorlabs | LPVISC050-MP2 | |
| Polarizing beam splitter | Thorlabs | BS010 | |
| Achromatic lens | Thorlabs | 200 mm focal length | |
| Multimode optical fiber | Optronis | FVP600660710 | |
| ROBOTIC SYSTEM: | |||
| Our robotic system includes a Biomek NXP workstations with a 96-channel head and with Span-8 pipettors, connected with a servo-shuttle, are used for all liquid transfer steps. In addition, the system is equipped with orbital shakers and a microplate reader (Paradigm, Molecular device) served by the Span-8 gripper | Beckman Coulter | Biomek NXP | |
| SOFTWARE: | |||
| Programming language | National Instruments | Labview 9.0 | |
| Script for the HiP-FA software available at | https://github.com/GeneCenterMunich/HiP-FA |
Riferimenti
- Berg, O. G., von Hippel, P. H. Selection of DNA binding sites by regulatory proteins. Statistical-mechanical theory and application to operators and promoters. Journal of Molecular Biology. 193, 723-750 (1987).
- Hammar, P., et al. Direct measurement of transcription factor dissociation excludes a simple operator occupancy model for gene regulation. Nature Genetics. 46, 405-408 (2014).
- Chen, J., et al. Single-molecule dynamics of enhanceosome assembly in embryonic stem cells. Cell. 156, 1274-1285 (2014).
- Segal, E., Raveh-Sadka, T., Schroeder, M., Unnerstall, U., Gaul, U. Predicting expression patterns from regulatory sequence in Drosophila segmentation. Nature. 451, 535-540 (2008).
- Schroeder, M. D., et al. Transcriptional control in the segmentation gene network of Drosophila. PLoS Biology. 2, 271(2004).
- He, X., Samee, M. A., Blatti, C., Sinha, S. Thermodynamics-based models of transcriptional regulation by enhancers: the roles of synergistic activation, cooperative binding and short-range repression. PLoS Computionnal Biology. 6, (2010).
- Wilson, M. D., et al. Species-Specific Transcription in Mice Carrying Human Chromosome 21. Science. 322, 434-438 (2008).
- Galas, D. J., Schmitz, A. Dnaase footprinting - simple method for detection of protein-DNA binding specificity. Nucleic Acids Research. 5, 3157-3170 (1978).
- Hellman, L. M., Fried, M. G. Electrophoretic mobility shift assay (EMSA) for detecting protein-nucleic acid interactions. Nature Protocols. 2, 1849-1861 (2007).
- Liedberg, B., Nylander, C., Lundstrom, I. Surface-plasmon resonance for gas-detection and biosensing. Sensors and Actuators. 4, 299-304 (1983).
- Wienken, C. J., Baaske, P., Rothbauer, U., Braun, D., Duhr, S. Protein-binding assays in biological liquids using microscale thermophoresis. Nature Communications. 1, (2010).
- Berger, M. F., et al. Compact, universal DNA microarrays to comprehensively determine transcription-factor binding site specificities. Nature Biotechnology. 24, 1429-1435 (2006).
- Nitta, K. R., et al. Conservation of transcription factor binding specificities across 600 million years of bilateria evolution. eLife. 4, (2015).
- Jolma, A., et al. DNA-Binding Specificities of Human Transcription Factors. Cell. 152, 327-339 (2013).
- Noyes, M. B., et al. A systematic characterization of factors that regulate Drosophila segmentation via a bacterial one-hybrid system. Nucleic Acids Research. 36, 2547-2560 (2008).
- Nutiu, R., et al. Direct measurement of DNA affinity landscapes on a high-throughput sequencing instrument. Nature Biotechnology. 29, (2011).
- Riley, T. R., et al. SELEX.-seq: a method for characterizing the complete repertoire of binding site preferences for transcription factor complexes. Methods Molecular Biology. 1196, 255-278 (2014).
- Maerkl, S. J., Quake, S. R. A systems approach to measuring the binding energy landscapes of transcription factors. Science. 315, 233-237 (2007).
- Isakova, A., et al. SMiLE-seq identifies binding motifs of single and dimeric transcription factors. Nature Methods. 14, 316-322 (2017).
- Jung, C., et al. True equilibrium measurement of transcription factor-DNA binding affinities using automated polarization microscopy. Nature Communications. 9, 1605(2018).
- Weber, G. Polarization of the fluorescence of macromolecules: Fluorescent conjugates of ovalbumin and bovine serum albumin. Biochemical Journal. 51, 155-168 (1952).
- Github. , Available from: https://github.com/Reutern/PySite (2018).
- Github. , Available from: https://githum.com/GeneCenterMunich/HiP-FA (2018).
- Roehrl, M. H., Wang, J. Y., Wagner, G. A general framework for development and data analysis of competitive high-throughput screens for small-molecule inhibitors of protein-protein interactions by fluorescence polarization. Biochemistry. 43, 16056-16066 (2004).
- St Johnston, D., Nuesslein-Volhard, C. The origin of pattern and polarity in the Drosophila embryo. Cell. 68, 201-220 (1992).
- Pankratz, M., Jäckle, H. The Development of Drosophila melanogaster, Vol. 1. Bate, M., Martinez Arias, A. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor. 467-516 (1993).
- Zhao, Y., Ruan, S. X., Pandey, M., Stormo, G. D. Improved Models for Transcription Factor Binding Site Identification Using Nonindependent Interactions. Genetics. 191, (2012).
- Noureddine, M. A., et al. Probing the functional impact of sequence variation on p53-DNA interactions using a novel microsphere assay for protein-DNA binding with human cell extracts. PLoS Genetics. 5, 1000462(2009).
- Veprintsev, D. B., Fersht, A. R. Algorithm for prediction of tumour suppressor p53 affinity for binding sites in DNA. Nucleic Acids Research. 36, 1589-1598 (2008).
- Geertz, M., Shore, D., Maerkl, S. J. Massively parallel measurements of molecular interaction kinetics on a microfluidic platform. Proceedings of the National Academy of Sciences. 109, 16540-16545 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon