Method Article
경쟁 적정 형광 현미경 검사 법을 사용 하 여 녹음 방송 요인 DNA 바인딩 선호도의 높은 감도 측정
요약
여기 우리는 큰 규모에 높은 감도 가진 평형에서 및 솔루션에서 바인딩 선호도 결정 하기 위한 새로운 방법을 제시. 이 녹음 방송 요인 DNA 바인딩의 정량 분석을 향상 시킵니다. 메서드를 사용 하면 제어 전달 시스템에 자동화 된 형광 이방성 측정을 기반으로 합니다.
초록
녹음 방송 요인 (TF)의 정확한 정량화-DNA 상호 작용은 유전자 발현의 규칙을 이해 하기 위한 필수적입니다. 때문에 기존 접근 중요 한 한계에서 고통, 큰 규모에 높은 감도와 TF DNA 바인딩 선호도 결정 하기 위한 새로운 방법을 개발 했습니다. 분석 결과 기존된 형광 이방성 (FA) 원칙에 의존 하지만 소개 하는 중요 한 기술 개선. 첫째, 우리는 TF와 붙일 레이블된 참조 다공성 agarose 젤 매트릭스에 DNA 통합 하 여 단일 잘에서 전체 FA 경쟁 적정 곡선을 측정 합니다. 레이블이 없는 DNA 올리고 머 경쟁자로 상단에 로드 되 고, 확산을 통해 spatio 시간적 그라디언트를 형성 한다. 결과 FA 그라디언트는 다음 사용자 지정된 epifluorescence 현미경 설치를 사용 하 여 밖으로 읽기. 이 향상 된 설치는 매우 약하고 강한 바인딩을 비슷한 분자 무게의 분자에도 안정적으로 측정할 수 있도록 FA 신호 검출의 감도 증가 한다. 이 패션에서 우리 다 잘 플레이트의 당 한 적정 곡선을 측정할 수 있는 고 피팅 절차를 통해 우리는 절대 분리 상수 (KD) 및 활성 단백질 농도 추출할 수 있습니다. 바인딩 순서 주어진된 일치의 모든 단일-지점 돌연변이 이체를 테스트 하 여 일반적으로 단일 플레이트에 TF의 전체 바인딩 특이성 풍경 조사 수 우리. 결과 위치 무게 행렬 (Pwm) TF 인 비보에 예측에 다른 방법에서 파생 된 그 뛰어나다. 여기, 우리는 기존의 자동된 형광 현미경과 데이터 분석 파이프라인에 엉덩이-FA를 구현 하기 위한 상세한 가이드를 제시.
서문
유전자 규칙, 양적 방법으로 그들의 바인딩 기본은 파라마운트 중요성의 결정에서 녹음 방송 요인 (TFs)의 중심 역할을 주어. RNA 중 합 효소는 발기인을 모집의 다운스트림 이벤트에 의해 제어 됩니다 동안 그들의 바인딩 열역학 평형에 의해 잘 설명 된 폰 Hippel 정액 연구 규제 TFs 빠르게 DNA를 인식 하는 개념을 도입 느린 속도1. 최근 vivo에서 바인딩 연구 제안이 그림은 가능성이 더 복잡 한2,3; 그럼에도 불구 하 고, 이러한 일반적인 가정 좋은 근사 역할 하 고 cis 규정 요소를 찾아서 시퀀스4,,56식 예측 많은 전산 접근을 지원 했습니다. 평형 바인딩 따라서 성공적으로 개념으로 고용 되어, 현재 메서드를 TF DNA 상호 작용 특이성을 바인딩에 집중 하 고 일반적으로 하지 않습니다 직접 측정 평형에 바인딩 친 화력. TF-DNA 바인딩의 체계적인 측정 상당한 기술적 도전, 나타내고 기존의 방법 여러 가지 한계를가지고.
Chromatin immunoprecipitation 딥 시퀀싱 (칩 seq)7, 가장 널리 퍼진 vivo에서 기술, 다음 바인딩 선호도의 측정 또는 바인딩 게놈 조각 내 사이트의 정확한 지 방화를 허용 하지 않습니다. 여러 생체 외에서 포함 하 여 방법 DNase 프린팅8, 전기 이동 기동성 교대 (EMSA)9, 표면 플라스몬 공명 (SPR)10및 눈금 thermophoresis11 바인딩 선호도 측정할 수 있습니다. 하지만 그들은 상대적으로 낮은 처리량. 반대로, 높은 처리량 기술로 단백질 바인딩 microarrays12, HT SELEX13,14, 세균 한 하이브리드 (B1H)15 바인딩 선호도 측정 하 고 일반적으로 지나치게 얻을 수 없습니다. 특정 바인딩 시퀀스는 주로 엄격한 선택 하거나 필요한 단계를 세척 합니다. 최근 개발 포함 기반으로 딥 시퀀싱 안타-플립16, SELEX seq17그리고 마이크로 기반 MITOMI18 또는 미소-Seq19절대 바인딩 선호도;의 추출에 대 한 허용 그러나, 그들은 레이블 TF와 DNA의 형광 강도 측정에 의존. 형광 신호, 따라서 될 낮은 단백질 농도 및 낮은 KD 값 결정에 제한 (< ~ 10 nM). 또한, 이러한 방법에 TF DNA 바인딩이 일어난다 얇은 표면에 난다 바인딩 또는 자동 형광 배경, 약한 바인딩을 정확 하 게 계량 하기 어려운 문제를 제기.
이러한 한계를 해결 하기 위해 TF DNA 선호도 풍경, 솔루션, 우리 라는 고성능 형광 이방성 (엉덩이-FA)20평형에서 결정 하는 새로운 방법을 개발 했습니다. 기술은21 설립된 형광 이방성 (FA) 분석 결과 기반 하지만 높은 감도 대규모 사용 하 여 사용자 지정된 자동된 현미경 및 분석 설정에 바인딩 상수를 측정 하도록 수정.
FA 분석 결과 레이블이 분자의 분자 회전을 측정 하 여 바인딩 파트너, TF,이 경우에 게 붙일 레이블된 종 (같은 DNA 올리고 머)의 상호 작용을 모니터링 합니다. TF에 바인딩 시 회전 속도 높은 유체역학 반경 및 분자량 증가 FA에서 바인딩된 복합물의 감소. 매우 강한 바인딩의 정확한 측정 (KD < ~ 1 nM) 레이블된, 참조 DNA의 낮은 농도 사용 해야 합니다 (c < ~ 1 nM). 이것은 표준 microplate 리더 등 상업 악기와 함께 달성 하기 어렵습니다. 또한, 바운드 및 언바운드 단지 사이의 큰 크기 차이 (10-100 배)은 일반적으로 필요한, 측정 TF 바인딩 도메인 및 짧은 DNA 올리고, 대략 비슷한 분자 무게의 일반적으로 사이 상호 작용의 금지 . 마지막으로, 전체 적정 곡선은 일반적으로 준비 및 측정 넣는 종족에 대 한 집중 시리즈를 포함 하는 여러 우물의 필요 합니다.
이러한 문제를 해결 하려면 높은 검출 감도 달성 하는 단일의 다른 z 위치에 FA 측정 허용 수정 widefield 현미경 설치를 사용 합니다. 이 바인딩 높은 선호도 유사한 분자량의 종 사이 상호 작용을 모니터링 하는 데 수 있습니다. 더 높은 처리량 멀티 잘 플레이트 형식 고 잘 제어 전달 시스템 (그림 1a)를 사용 하 여 단일에서 전체 적정 시리즈에 FA를 측정 하 여 이루어집니다. 또한, 경쟁력 있는 바인딩 분석 결과 사용 하 여 우리를 바인딩 상수 뿐만 아니라 활성 단백질의 농도 추출. 이것은 분석 결과의 중요 한 특징만 표현된 TF 분자의 일부는 활성 단백질 misfolding 또는 저하 때문. 실험적인 체제 XY 및 Z 피 단계를 갖춘 상업 epifluorescence 현미경을 기반으로 합니다. 우리는 외부 레이저 여기, 시스템 업그레이드 후 두 빛 감지 (그림 1b 와 c 1)에 대 한 높은 양자 효율을 가진 EM-CCD 카메라의 칩에 선형 분극 부품 방출 감지. 시스템 매우 민감한 센서를 결합 하는 높은 수 가늠 구멍 (NA) 목표를 사용 하 고 따라서 매우 민감한 FA 측정을 준다. 형광 z 더미를 기록 하 여 상호 작용을 바인딩 측정할 수 있습니다 광학 z 축을 따라 반응 물에 대 한 이기종 매트릭스를 사용 하는 경우. 이러한 모든 수정 기존 시스템에 쉽게 구현할 수 있으며 비용 효율적인.
우리는 레이블 없는 DNA 올리고 머의 바인딩 선호도 참조로 붙일 레이블된 DNA에 비해 측정 경쟁 바인딩 분석 결과 사용 합니다. TF와 참조 DNA 다공성 agarose 젤 매트릭스 (기 공 크기 ~ 1 µ m)를 구성 하는 바인딩에 대 한 비-상호 작용 하는 환경에서에서 고정된 농도에 통합 됩니다. 참조가 DNA Cy5로 표시 됩니다. 이 염료는 상대적으로 긴 형광 일생 때문에 FA 측정 적합 입증 (~ 1ns)와의 가시 (낮은 자동 형광 배경)는 빨강에서 형광 방출. TF 농도 Cy5 참조 DNA, 모든 참조 DNA 단백질에 바인딩됩니다 보장에 어 금 니 과잉에 있다. 레이블이 없는 경쟁 DNA의 해결책 다음 젤 표면에 입금 됩니다 및 z에 따라 변화 하는 농도 기온 변화도 c (z, t)를 수립 다공성 매트릭스 내부 확산-초점 비행기 및 시간 t (그림의 위치 1는, 그림 2-2 c a). Cy5 참조 DNA에 바인딩된 TF 따라서 로컬 Cy5 참조 DNA FAREF(z, t) 의 동적 변화 FA로 이어지는 DNA 바인딩, 경쟁 하는 경쟁 업체의 다른 농도에 노출 된 (그림 2b 와 2 c).
확인 하려면 경쟁 농도 c(z,t), 우리는 별도 우물 (교정 웰) 동적으로 변화 FA 나 일 블루 (NB) FANB(z, t) 의 신호에 측정 (그림 2는 3와). 이 염료 DNA로 intercalates 그리고 그로 인하여 경쟁 DNA에 대 한 DNA 센서 역할. 이 제어 전달 시스템과 다른 DNA-단백질 바인딩 선호도의 수백 수만 하나 다 잘 플레이트 (96 또는 384 잘 플레이트 형식) 내에서 측정할 수 있습니다. 측정은 다음 TF에서 레이블이 참조 DNA의 전체 변위까지 순차적으로 수행 됩니다. 우리는 길이 N의 합의 시퀀스의 모든 3 N 단일 기반 돌연변이의 선호도 측정 하 여 지정 된 요소에 대 한 바인딩 특이성을 결정. 힙합-FA 단백질의 낮은 금액을 요구 한다 (~ 적정 곡선 당 pmols) 쇼 낮은 비교적 큰 규모에 측정을 하면서 KDs [편차 (CV) < 20%의 계수]의 결정에 변화. 메서드를 사용 하면 수동으로 또는 완전히 자동화 로봇 시스템, 더 낮은 CVs (그림 4, 상단 패널) 결과 사용 하 여 수행할 수 있습니다. 분리 상수 0.5까지 높은 정확도로 측정 된다 nM. 매우 높은 선호도 (KD < 500 분), 우리 (< 100 nM) 낮은 수준 경쟁 DNA 농도 측정에 있는 부정확 때문에 표준 경쟁 적정 (그림 5)를 사용 하 여.
엉덩이 빠는 거의 모든 표준에 구현, 반전, epifluorescence 형광 현미경, 자동된 XY 스테이지와 압 전 z 축 스테이지의 가용성을 제공 수 있습니다. 광학 부품 장거리 목표를 갖춘 자동된 widefield 설치의 주위에 건설 되었다. 실제로, 분석 결과 (특정 작업, 거리 및 조리개 수치)에서 다른 특성을 가진 목표에 적용할 수 있습니다. 그러나이 매개 변수 최적화를 필요로 하는, ( z사이의 거리-조각 다공성의, 및 높이 agarose 젤, 등.). 레이저 또는 카메라의 다른 종류의 사용도 가능 하다. 전체 실험 절차 및 자료 분석에 대 한 자세한 설명은 아래 프로토콜 섹션에서 제공 됩니다.
프로토콜
1. 편광 현미경 검사 법
- Widefield 레이저 조명, 초점을 지속적인 다이오드 레이저의 638 nm 선 (40 mW) 빔 정리에 대 한 다중 모드 광섬유의 조리개에. 레이저 빛의 편광을 설정 하는 섬유의 출력에서 선형 편광판을 탑재 합니다.
- 여기 구성 요소 dichroic 거울 (640 nm 컷오프)와 대역 통과 필터 (대역 700/75) 방출된 빛의 차단.
- 수직 및 병렬 편광 구성 방출된 빛을 분할 편광 빔 스플리터를 통과 하는 형광 신호를 하자. 그런 다음에 초점을 반영 비 빔 (병렬 구성 요소) 및 200 밀리미터 초점 거리의 achromatic 렌즈 반사 광선 (수직 성분) 백 조명 EM-CCD 카메라 (그림 1b 와 c 1)의 칩. 거울을 사용 하 여 렌즈를 향해 수직 광선의 방향을 조정 합니다.
2. 디자인 및 형광 표시 참조 DNA 올리고 머의 테스트
- 참조 DNA의 핵심 시퀀스를 확인: 메서드 기반 경쟁력 분석 결과 분리 상수 (Kd 2) 측정 녹음 방송 비율과 레이블이 없는 경쟁 DNA 올리고 머와 바인딩을 위해 경쟁 하는 사이 붙일 DNA의 선호도 TF 참조 (Kd 1) 역할 분류. 다른 소스에서 얻은 일치 시퀀스 DNase 프린팅 또는 세균 1-하이브리드 시작 지점5,15으로 사용할 수 있습니다.
참고:으로 있는 규칙의 thumb, DNA 바인딩 선호도 합의 시퀀스에 비해 TF 창사 감소 3는 적합 한 참조입니다. - 이전 단계에서 파생 된 합의 시퀀스의 2-3 미정 단일 돌연변이의 엉덩이-빠 Kd 1s로 측정 합니다. 바인딩의 완전 한 손실을 방지 하기 위해 특정 하지 않은 합의 순서로 위치를 변형 하려고 합니다.
참고:이 참조 시퀀스의 (우리는이 프로토콜을 거 대 한 Gt에 사용), 녹음 방송 요인에 의해 바인딩되어 중요 하지만 너무 강하게 하지 약한 경쟁 높은 농도에서 노르만족 수 있도록. - 핵심 주제 (8-12 쌍을 일반적으로 기본) 확장 길이 또는 더 대칭적으로 추가 하 여 16의 기본적인 쌍의 측면 (사이드 체인 적절 한 바인딩 추가) 양쪽에서 시퀀스. 필요한 경우 (더 이상 기다리고 도메인, 예를 들어), (~ 50까지 길이에서 기본 쌍 엉덩이-FA 분석 결과 함께 테스트) 더 긴 시퀀스를 사용 하 여.
주의: 수 소성 바인딩 사이트를 만들 것으로 예상 된다 베이스를 추가 하지 않도록 주의 하십시오. (예를 들어, PySite22)이이 과정을 촉진 하기 위하여 사용 가능한 Pwm에서 바인딩 사이트를 예측 하는 계산 도구를 사용 합니다. - 레이블이 참조 DNA로 붙일에 표시 된 순서 대로 올리고 앞으로 또는 가닥 3' 또는 5' 끝에 반전. 사용 하 여, Cy5, Bodipy-650 또는 10 µ m (100 µ M 10 배 재고), 물에 희석 농도에 다른 적합 한 염료로 stepwise 3.1 단계에서 설명 하는 예.
- 33 mM 칼륨 인산 염 버퍼를 추가 하 여 바인딩 버퍼 x 1의 500 mL를 준비 (pH = 7.0), 90 mM NaCl, 증류수에 0.01% 비 이온 세제. 또한 3 배 삼 배 농도에서 제외 하 고는 동일한 구성 요소를 포함 하는 바인딩 버퍼를 준비 합니다. 바인딩 버퍼 x 1에 대 한 재고 솔루션으로 바인딩 버퍼 x 3를 사용 하 여 경우 볼륨 > 500 mL; 준비 그렇지 않으면, 250 mL를 준비 합니다.
참고:이 구성 전사 요소 안정성과 티 S-전이 효소 (GST) 이합체 화를 방지 하기 위해 최적화 되었다. - 0.8을 포함 하는 바인딩 버퍼의 200 µ L의 FA 1 단계에 설명 된 측정 현미경 설치 nM를 참조 DNA 유리 하단 현미경 96 잘 접시 (다른 TF 농도와 웰 스 5-6)에서 다른 양의 TF의 존재를 표시 사용 하 여 TF 농도 결정 합니다. TF의 양의 증가 함께 적정 시리즈를 수행 하 고 있는 곡선 고원, DNA 참조 올리고 머의 완전 한 바인딩을 나타내는 도달 농도 분석 결과 대 한 선택.
참고: 최적의 TF 농도 TF DNA 분리 상수의 값에 따라 달라 집니다. 일반적으로, 낮은 KDs 낮은 농도 요구 한다.
3. 올리고 머 어 닐 링
- 레이블된 참조 DNA (이전 단계에서 확인 되는 순서)의 DNA 올리고 anneal, 7 µ L 염료 표시 10 m m의 앞으로 단일 가닥 DNA 솔루션 및 186 µ L의 물에는 레이블이 없는 역 보수의 10 mM 농도의 7 µ L을 혼합 한다.
- 경쟁 DNA 시퀀스에 대 한 혼합 (물, 제조업체에서 제공)에서 100 m m 솔루션의 20 µ L 20 µ L 해당 하는 역방향의 100 m m의와 함께 앞으로 단일 가닥 DNA의 단일 가닥 DNA 각 개별 경쟁자 시퀀스에 대 한 측정.
- 어 닐 링 별도로 표준 PCR cycler에 3 분 동안 70 ° C에 솔루션을가 열 하 고 0.1 K/s의 속도로 rt 온도 감소에 의해 수행 합니다. 사용 되는 PCR 기계 그 속도로 온도 그래디언트를 지원 하지 않는 경우 단순히 stepwise 외피 온도 감소와 함께 할 (테스트 했다 3의 99 주기 주기 당-0.4 k s).
4. 젤 준비
참고: 다음 섹션 설명 젤의 두 개의 서로 다른 종류의 준비: 1) 적정 우물 단백질 젤 포함 KDs 각각 경쟁 DNA 시퀀스를 결정 하는 데 사용 됩니다 그리고 2) 교정 웰에 NB의 사용 모든 주어진된 시간 포인트 및 수집 높이에서 DNA 농도 결정 합니다. 초점은 96 잘 접시에 실험의 준비 하지만 384-잘 플레이트 형식에 대 한 해당 볼륨도 표시 됩니다.
- 실험실 렌지에 끓는 바인딩 버퍼에서 0.5 %w / v 낮은 융 점 agarose를 녹. 완전 한 해체 후 ddH2O 가능한 증발에 대 한 보상으로 다시 볼륨을 조정 합니다.
참고: 편의 위해 10-20 10 mL aliquots는 젤의 재고를 준비 하 고 필요할 때 그들을 75 ° C에서 녹여. 젤 주식 실시간에 저장 될 수 있다
주의: 전자 레인지에 젤 솔루션의 superheating을 피하기 위해 주의 해야 합니다. 짧은 시간 간격으로 흔들어 사이 낫는 열. - 적정 및 교정 웰 스를 준비 하려면 먼저 두 10 mL 젤 재고 aliquots 떨고 아래 75 ° C에서 녹여.
- 각 경쟁 업체에 대 한 240 µ L (오버 헤드 20% 포함)를 사용 하 여 (n = 경쟁자 시퀀스의 수).
- NB 교정 잘 젤의 동일한 볼륨을 사용 하 여 동등한 온도 두 젤의 점도 확인.
- 다음 35 ° C로 온도 설정 하 고 equilibrate를 온도 기다립니다.
- 1.4 nM (최종 농도) 때 교배 참조 DNA (3에서 얻은 단계), TF 단백질 적정 웰 스에 대 한 추가 (최종 농도 CTF = 20-60 nM, 단계 2.6에서에서 확인), DTT (0.2 m m), 및 바인딩 n x 200 µ L 나는 96 µ L n x 13의 전체 볼륨에 버퍼 -384-잘 플레이트 형식, 각각 (플러스 오버 헤드) 또는. 반전/떨고에 의해 철저 하 게 혼합 (소용돌이 하지 않습니다).
- 천천히 잘 플레이트 적정 우물에 이전 단계에서 준비 된 젤 솔루션의 96 잘 접시 형식 (13 µ L/386 우물 우물)에 잘 당 200 µ L를 추가 합니다.
- 교정 웰에 대 한 추가 먼저 5 nM NB (총 볼륨 및 교정의 수에 사용 되는 잘 플레이트 형식 따라 우물, 일반적으로 5-6 잘 플레이트 당 충분 하다) 우물 밖에 서 녹은 젤.
- 200 µ L (384-잘 플레이트 형식에 대 한 13 µ L) 잘 플레이트의 적정 우물 안에서 천천히 젤을 포함 하는 NB의 pipette 고 공기 방울을 피하기 위해 있는지 확인.
참고: 전자 pipets 또는 로봇의 사용은 크게 재현성을 증가합니다. - RT, 10 분 및 4 ° C에서 또 다른 10 분 응고 하는 젤을 하자 (결로 제거 유리에서 나중에 필요한 경우). 휘도가 젤 표면을 피하기 위해 완벽 하 게 수평 표면에 이러한 모든 단계를 수행 해야 합니다.
참고: 단백질 포함 하 젤은 일반적으로 안정적인 4 ° c.에서 적어도 몇 시간에 대 한
5. 경쟁 DNA 솔루션 추가
참고: 다음 솔루션 적정을 시작 하기 전에 준비 해야 하 고 동시에 교정 및 적정 우물 위에 추가 됩니다.
- 단련 레이블이 참조 DNA와 단백질 바인딩 버퍼 x 3에 3 번에서 젤 재고 aliquots 보다 높은 농도 추가 합니다.
- 각 40 µ L로 획득된 솔루션의 믹스 20 µ L 경쟁 DNA 솔루션 단계 3에서에서 얻은 단련.
- 각 교정 잘 단련 된 경쟁 (동일한 길이의 어떤 순서는 적당 한) DNA의 40 µ L 15 mM NB 솔루션을 포함 하는 바인딩 버퍼 x 3의 20 µ L를 혼합.
참고: 384-잘 접시 총에서 60 µ L 대신 21 µ L을 사용 합니다.
- 필요에 따라 시선 380에서 흡 광도 측정 하 여 접시의 다른 우물에서 젤 높이 레벨의 동질성을 확인 nm, 다 잘 플레이트 리더 (흡 광도 값은 젤 높이에 비례)를 사용 하 여.
- 50 µ L (384-잘 플레이트 형식에 대 한 7 µ L)는 젤 위에 (3 단계에서 단련) 혼합된 경쟁 DNA 솔루션을 추가 합니다. 사용 가능한 경우 전자 멀티 채널 pipets 또는 96 채널 pipetting 머리를 사용 하 여 모든 경쟁 업체 솔루션을 가능한 동시에 추가 하십시오. 경쟁 솔루션의 추가, 후 접시 현미경 스테이지에 놓고 즉시 측정 (7 단계)을 시작 합니다.
6. 이미지 수집
- 순차적으로 z의 시리즈 시간 확보-스택 (예를 들어, 사용 12 비행기와 조명 시간의 100-300 ms). 잘 표면에 너무 가까이 이미지를 복용 하지 않도록 (< 여기서 번호판 ~1.4 µ m) 어떤 분극 바이어스를 제외 하.
- TF에서 레이블이 참조 DNA의 완전 한 바인딩까지 측정의 10-25 주기 수행 합니다. 끝점은 바인딩 속도 론과 경쟁 DNA의 확산도 따라 1-2 h 후 일반적으로 도달 된다.
7. 원시 데이터에서 FA(z,t) 의 추출
- 일단 잘 접시 이미지가 포함 된 원시 형광 이미지에서 편광의 병렬 (I=) 및 수직 (I+) 지역 강도 구성 요소그림 1(c)의 평균 픽셀 값 계산 합니다. 이 엉덩이-FA 소프트웨어23을 사용 하 여 자동으로 수행할 수 있습니다.
참고: 힙합-FA 소프트웨어, 설명서, 및 테스트 데이터 집합 다운로드23될 수 있습니다. 아래에 자세히 설명 된 대로 또는= 그리고+ 추출 하 여 적정 곡선의 다운스트림 분석 수행 다른 사용자 작성 소프트웨어 사용. - 각 잘 FA를 계산 합니다. 각 잘 각 z 위치에 FA(z,t) 를 계산 하는 스크립트와 시간에 따라 t 포인트:
1 방정식: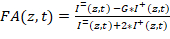
여기서 G 수직 채널 쪽으로 어떤 편견에 대 한 악기 G-팩터 수정입니다. - G-팩터 현미경 설치 프로그램의 알려진된 이방성의 형광 염료를 포함 하는 모든 솔루션의 FA를 측정 하 여 결정 합니다. 신호의 두 개의 분극 구성 요소를 추출 하 고 다음 공식 1 G, 알고 솔루션의 FA를 사용 하 여 (G =이 설치 프로그램에서 1.15).
8. 교정 곡선 FANB 에서 경쟁 DNA 농도의 결정에 대 한
- 각 정방향 및 역방향 참조 올리고 머 (100 m m 재고 농도; 사용할 수 경쟁 시퀀스 수로 동일한 길이와 어떤 임의의 시퀀스)의 120 µ L anneal 혼합 주의 포함 하는 바인딩 버퍼 x 3의 120 µ L (15 nM).
- 총에서 6 희석와 바인딩 버퍼 x 1에서 1:2 희석 한 희석 시리즈 준비. 1 x 5를 포함 하는 바인딩 버퍼에에서 0.5% 낮은 녹는점 (T > 35 ° C) agarose 젤의 200 µ L와이 희석의 믹스 50 µ L triplicates에 NB의 nM.
- 96 잘 접시에 이전 단계에서 준비 6 솔루션의 200 µ L을 추가 하 고 완전 한 겔 화, 실시간 측정 솔루션의NB FA에서 엉덩이-FA 설치를 사용 하 여 다음 1 시간을 보장 하기 위해 4 ° C에서 1 시간에 대 한 접시를 저장.
- 이전 단계에 따라 FANB (z, t)를 추출 하 고 언덕 방정식을 사용 하 여 데이터:
공식 2: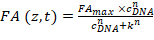
CDNA 는 DNA 올리고 머;의 농도 k 의 바인딩 사이트의 어느 반에 DNA 올리고 농도 점유 된다; FA최대 는 정규화 상수; 그리고 n 은 언덕 계수. k, FA최대 및 n 피팅 절차 동안 무료 매개 변수로 설정 됩니다. - (왼쪽된 하단 패널)에서 엉덩이-FA 소프트웨어에서 피팅 절차에서 얻은 세 개의 매개 변수를 입력 합니다.
- 보정 곡선 몇 개월 마다 또는 현미경 설치 프로그램에서 변경한 후 결정을 반복 합니다.
9입니다. 경쟁 DNA 농도의 결정
- 엉덩이-FA 소프트웨어를 사용 하 여 c를 추출 (z, t) FANB(z, t) 측정 (그림 3)에서. 먼저 이전 섹션에 설명 된 대로 보정 곡선을 얻을 하 고 소프트웨어를 피팅 매개 변수를 입력 (자세한 내용은 설명서 참조).
- 프로그램을 사용 하 여 자동으로 c(z,t) c < 100 nM (자세한 내용은 참조 설명서) 사용에 대 한 추정 식 3 (그림 3b)는 agarose 젤 매트릭스 내에서 경쟁 DNA의 1 차원 확산, 가정 무료 보급입니다.
식 3: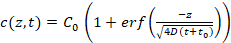
C0 는 DNA; 경쟁의 초기 농도 erf 오류 함수;는 z 는 위치; D 는 확산 계수입니다 경쟁 DNA; 그리고 t0 는 측정의 시작 시간입니다. 사용 가능한 매개 변수는 C0 와 z /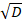 .
.
10. 매우 강한 DNA 바인딩 엉덩이 빠와 함께 기존의 경쟁 적정
- 직렬의 농도에서 96 잘 접시 (또는 384-잘 접시)의 행에서 다른 경쟁 DNA 올리고 희석: 0, 1.25, 3.5, 9, 19, 45, 90, 190, 425, 900, 1900, 그리고 4000 nM. DNA Cy5 표시 된 참조 추가 (1 nM) 및 바인딩 버퍼 (그림 5를)에 잘 당 200 µ L의 총 볼륨 일정 농도에서 TF (20-50 nM). 열역학 평형이 달성 될 때까지 40 분을 기다려 하 고 (와 함께 엉덩이 빠 설치) 취득 각 잘 z-스택 (가변성 계산된 FA 값을 평균 하 여 감소 잘 당 여러 이미지 획득).
- 평형 바인딩 적정 곡선을 생성 하 고 식 4 (그림 5b)와 함께 그들을 맞는. KDs는 기존 경쟁 적정에 의해 동일 하 여 가져온 엉덩이-FA agarose 젤 매트릭스20를 사용 하 여 결정 됩니다.
11. 피팅 FA 적정 곡선의 절차
- 엉덩이-FA 소프트웨어에 개별 경쟁 시퀀스에 대 한 재건축된 적정 곡선 표시 FA(z,t) f[c(z,t) =] 시각적으로 데이터 품질을 확인 하 고 (자세한 내용은 설명서 참조). 필요한 경우, 단계 10에서에서 경쟁 DNA 농도의 결심을 위해 사용 되는 매개 변수를 구체화 합니다.
- 경쟁력 있는 적정 분석 실험24에 대 한 분석 솔루션을 제공 하는 공식 4를 사용 하 여 자동으로 각 개별 적정 곡선에 맞게.
4 방정식: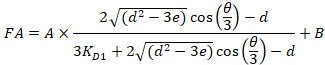
함께: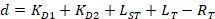
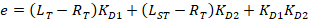
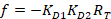
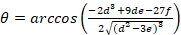
RT 는 단백질 농도; LT 는 레이블 없는 이며 L세인트 레이블이 DNA 농도; Kd 2 는 분리 상수 결정 됩니다; RT ; 활성 단백질의 농도 그리고 A 와 B 는 정규화 매개 변수.
먼저 Kd 1는 다른 Kd 2 값의 결정에 대 한 참조 역할을 결정 합니다. Kd 1 는 확인할 수 있습니다 즉시 분석 결과 함께 레이블이 없는 경쟁 DNA의 시퀀스로 염료 참조 DNA의 순서를 선택 하 여 (설명서 참조). - 소프트웨어에서 Kd 1 의 얻은 값을 입력 하 고 모든 경쟁자 DNA에 대 한 Kd 2 값을 계산.
참고: 피팅 절차의 무료 매개 변수는 Kd 2, RT, A 및 b. - 소프트웨어에서 "내보내기" 버튼을 클릭 하 여 분리 상수 Kd 2 와 접시의 모든 개별 적정 웰 스에 대 한 RT 활성 단백질의 농도 내보냅니다.
12. PWM 건설, 단백질-DNA 상호작용 및 의사의 특이성
앞에서 설명한20WebLogo 3.0 (http://weblogo.threeplusone.com/create.cgi) 온라인 도구를 사용 하 여 다른 Pwm에 대 한 시퀀스 로고를 만듭니다.
결과
분할 유전자 네트워크25,26, transcriptional 규칙을 통해 주로 초파리 배아의 앞쪽 후부 바디 패턴을 생성 하는 TFs에 적용할 엉덩이-FA 하 고. 이 네트워크에서 우리는 bZIP 선택 도메인 TF 자이언트 (Gt)에 대 한 상세한 분석 (그림 4). 전체 길이 녹음 방송 요인 표현 하 고 그들의 DNA 바인딩 도메인 (DBD)13으로 주로 동일한 바인딩 기본 설정 얻을 어려운 이기 때문에, 사용 하는 GST를 융합 하는 DBD을 대장균 GST 융해 단백질의 구조를 표현 DBDs 혼자20와 동일한 결과 제공 합니다.
Gt 합의 순서를 (ATTACGTAAC) 우리가 위에서 설명한 대로 결정 강한 바인딩 시퀀스를 나타냅니다. 우리는 다음 5'과 3' 끝에 추가적인 기지에 의해 형벌 10 메 르 Gt 합의 시퀀스 (총 30) 내의 모든 가능한 단일-지점 돌연변이의 결합 에너지에 영향을 조사. 그 젤 샘플 제작 자동화를 사용 하 여 두 개의 복제와 비교에 대 한 직접 생산 한 추가 복제를 측정 했습니다. > 2000 nM 단독 돌연변이 시퀀스, 0.6에서 배열 했다 KDs 그리고 우리는 또한 바인딩 "비-바인딩" 시퀀스 (데이터 표시 되지 않음)의 완전 한 부족을 확인 했다.
TF-DNA 바인딩 특이성 일반적으로 점수를 바인딩 주제에 각 위치에 각 가능한 뉴클레오티드에 할당 위치 무게 매트릭스 (PWM)를 사용 하 여 모델은. PWM 가정 각 위치 독립적으로 강도 바인딩에 기여 하 고 대부분의 경우에서 환경 설정27바인딩 TF에 대 한 충분 한 모델을 구성 합니다. 우리가 우리의 선호도 측정에 따라 개정 된 Pwm 생성 다음 절차28,29 를 설립 하 고 문학에서 이전에 보고 된 2 개의 Pwm에 비해. 첫 번째 바인딩 DNA 프린팅4,5, 식별 하는 사이트에서 뉴클레오티드 주파수 조사에 기반 하 고 두 번째 PWM 세균 한 하이브리드 (B1H) 선택 하 여 얻은 했다. 15
(그림 4, 상단 패널), 세 가지 복제에 대 한 Pwm의 높은 유사성 수동으로 준비 샘플 (복제 3) 등, 엉덩이-FA 방법의 높은 재현성을 보여줍니다. 힙합 빠로 얻은 Pwm 전체 얻은 Pwm 비슷한 다른 방법으로 (그림 4, 낮은 패널), 거기는 상당한 편차: 위치 2 (검은색 화살표), 코어 bZIP 모티브, 돌연변이 T의 시작 > (G, C, A)에 이어질 엉덩이-FA, 일치에 의해 얻은 주제에 바인딩의 손실 완료 B1H 모티브 아니라 DNase 프린팅, 바인딩 기지 (G, A)에 대 한 상대적으로 강한 유지와 함께 얻을. 반대로,에서 위치 7 (회색 화살표), 돌연변이 T > C가 이전 측정된 Pwm에 따라 예상 보다 훨씬 더 강한 바인딩 이끌어 낸다.
다른 편차는 미묘 하지만 덜 중요 한. 전반적으로, 힙합-FA PWM 합의에서 많은 돌연변이 적당히 강한 바인딩을 여전히 결과 사실 반영 다른 두 사람 보다 덜 구체적입니다. 이 정보 콘텐츠 (IC)를 사용 하 여 측정할 수 있습니다. IC는 IC에 비해 엉덩이-FA 매트릭스 (3 복제의 평균), 11.5 비트 13.4 비트 각각 16.8 비트 DNase 프린팅 및 B1H 행렬에 대 한 =. 일반적으로 (비록 아니라 보편적으로), 엉덩이 빠로 얻은 Pwm은 26 TFs에 따라 다른 방법으로 얻은 그 조사20보다 덜 특정.
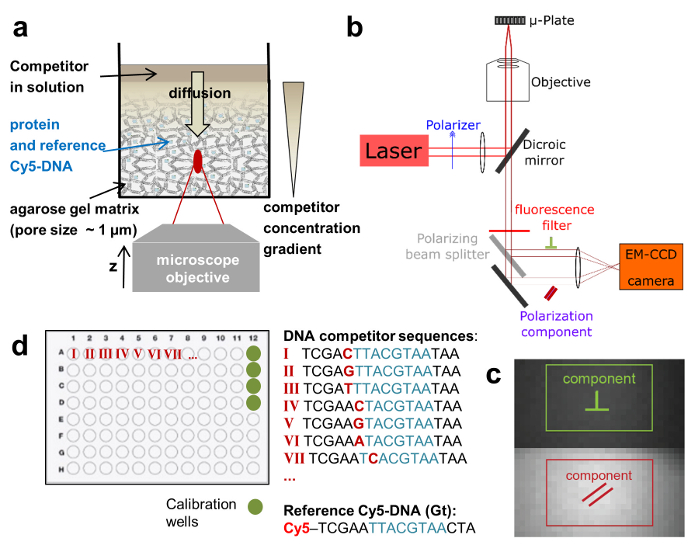
그림 1:엉덩이-FA 분석 결과 및 실험적인 체제의 도식 묘사. (a) 젤 넣는 경쟁 단일 우물에서 DNA에 대 한 배달 시스템. (b) 엉덩이-FA 현미경 설치 합니다. EM-CCD 카메라에 편광된 형광 빛 감지 자동된 widefield 현미경 사용자 지정. 병렬 (레드)를 결정 하는 데 사용 하는 관심의 두 지역 (c) 원시 형광 이미지와 수직 (녹색) 편광 구성 요소. (96 잘 접시 d) 전형적인 레이아웃. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
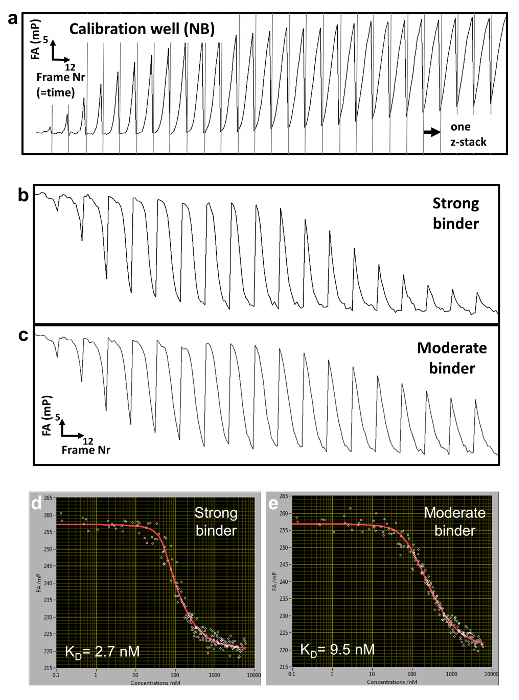
그림 2 : 원시 FA 데이터 및 재건축된 적정 곡선. (a) 전형적인 FA(z,t) 궤적 잘 NB.를 포함 하는 교정에 대 한 (b의 c) FA(z,t) 시간 궤도에 바인딩 및 더 강한 (b)를 측정 하는 2 개의 적정 우물에 대 한 온건한 (c) DNA 바인딩 경쟁자. (d, e) 해당 FA 적정 측정을 재구성 하며 강한 (d) 및 바인딩 온건한 (e)에 대 한 곡선. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
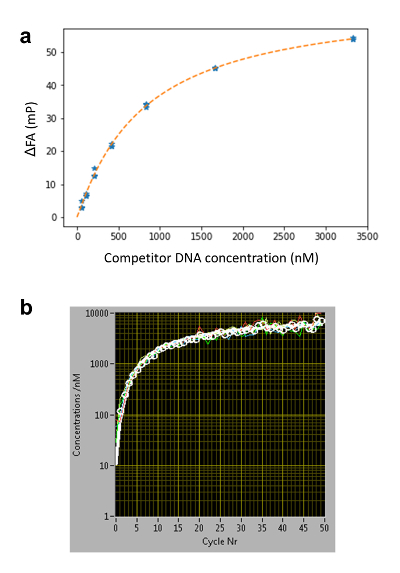
그림 3 : 경쟁 DNA c의 농도 결정 (z, t) 나 일 블루 (NB)를 사용 하 여. (a) FA 농도 16의 기본적인 쌍 DNA 올리고에 대 한 교정 곡선입니다. 기존의 적정 시리즈에서 NB 경쟁 DNA의 다른 농도 함께 agarose 젤에 포함 됩니다. DNA에 NB의 선호도 순서에 관계 없이20; 따라서, 동일한 보정 곡선 c를 결정 하는 데 사용할 수 있습니다 (z, t) 동일한 길이의 다른 DNA 순서에 대 한. (b) 경쟁자 DNA 시간 확산 프로 파일 5 개 교정 웰을 사용 하 여 결정 하는 임의의 z 높이에. 각 측정 주기 4 NB 포함 된 우물의 평균 FAs 흰색 점으로 표시 됩니다. 곡선 식 3 (흰 선, 색상에서 개별 우물)와 c를 사용 하 여 장착 됩니다 (z, t) 낮은 농도에서 (C < ~ 100 nM) 추정된 피팅 곡선에 의해 결정 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
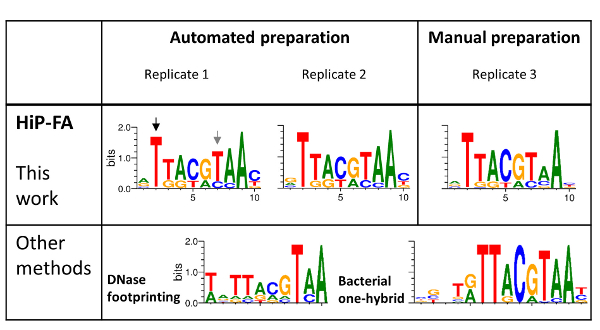
그림 4 : TF 자이언트 (Gt) bZIP 도메인 가족의 특이성을 바인딩. 3 복제의 엉덩이-FA Pwm: 자동화를 사용 하 여 준비 2 개와 수동으로 준비 (위 패널) Pwm DNase 프린팅 및 세균 한 하이브리드 (B1H) 선택 방법 (하단 패널)에 의해 생성 된와 비교 됩니다. 전반적으로, 힙합-FA 바인딩 모티브 이전 데이터와 동의 하지만 또한 중요 한 차이, 검은색과 회색 화살표와 함께 강조 표시. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
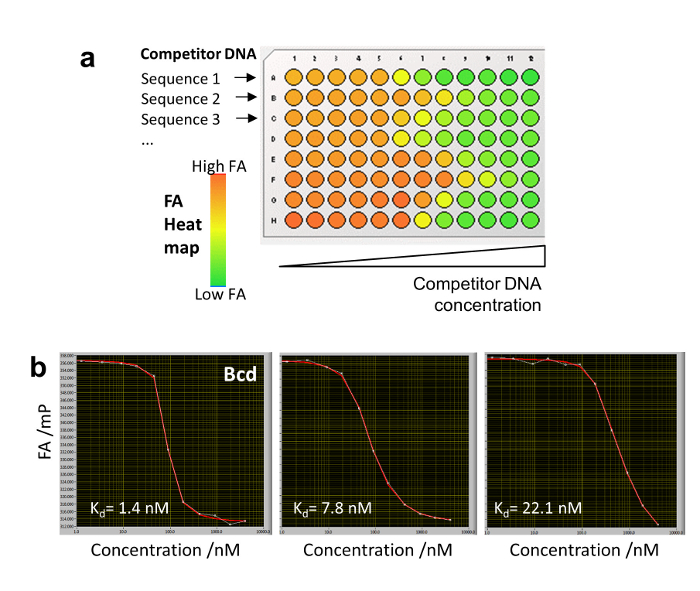
그림 5 : 엉덩이 빠와 함께 기존의 경쟁 적정. (a) 접시 디자인 8 다른 경쟁자 DNA 96 잘 접시의 단일 행에 바인딩 버퍼에 희석 순차적으로 보여줍니다. 전 열 지도 다른 임의의 바인딩 강점에 대 한 표시 됩니다. (3 경쟁자 DNAs의 b) 경쟁 적정 다른 선호도와 Bcd TF에 바인딩. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
HiP-FA TF DNA 상호 작용의 바인딩 기본 설정 풍경을 결정 하기 위한 포괄적인 새로운 방법입니다. 변종의 mutational DNA 모티브 직접 바인딩 기본 임계값 위에 바인더의 집합에 뉴클레오티드 발생의 주파수에 반영 됩니다 어떤 근본적인 가정 피하 바인딩 선호도 측정 합니다. 측정은 동원 정지 및 바인딩 반응, 평형 조건에 최대한 가깝게 기계적 또는 화학적 간섭 없이 솔루션에서 일어난다. 제어 전달 시스템 잘 단일 내에서 전체 적정 곡선의 측정을 허용 하 고 단백질을 절약 하는 동안 처리량과 안정성을 증가 시킵니다. 높은 빛 수집 효율 높은 수 가늠 구멍 및 EM-CCD 카메라와 함께 목표를 사용 하 여 매우 민감한 형광 빛 감지 수 있습니다. 따라서,이 설정으로 작은 FA 변경 낮은 10-15 mP는 정확 하 게 검출 될 수 있다; 실제로, 즉 대량 증가 후 바인딩 최소화 (낮은 2의 대량 비율으로) 쉽게 감지 되는 어떤 바인딩 반응. 이것은 보통 microplate 리더 같은 상용 시스템의 경우입니다. 그것의 높은 감도 때문에 엉덩이-FA 분리 상수 picomolar 범위에 안정적으로 측정할 수 있는 범위를 확장 합니다. 결합 에너지는 여러 개의 크기 순서에 정확 하 게 결정 됩니다.
수정 된 Pwm의 품질을 평가, 하 우리는 두 가지 유형의 분석20수행. 우리는 분할 유전자 네트워크의 5 개 요인에 대 한 다른 Pwm 21 분할 유전자의 genomic 지구에서 실험 칩 seq 프로필을 예측할 수 있는 얼마나 잘 테스트. 두 번째 테스트로 서 우리 식 참여 TFs의 바인딩 기본 설정 및 단백질 농도 기준 세분화 강화의 패턴을 예측 하는 시퀀스 식 모델4 를 사용 합니다. 둘 다 연습에서 우리 덜 특정 엉덩이-FA Pwm 크게 수행 하는 발견 보다는 보다 구체적인 프린팅 B1H Pwm20.
드 노 보 의 방법과 달리 엉덩이-FA 주어진된 TF의 바인딩 설정의 몇 가지 사전 지식이 필요합니다. 그러나, 합의 시퀀스 많은 TFs에 대 한 알려져 있다 그리고 많은 기존의 방법13,,1415그들을 제공할 수 있습니다. 필요 하다 면, 진정한 최적의 바인딩 시퀀스는 반복적으로 찾을 수 있습니다.
우리는 DNA 참조 올리고 붙일 Cy5와 Bodipy-650 개 사용. 이 염료는 바운드와 언바운드 표시 참조 DNA의 이방성은 다른 테스트 염료 중에서 가장 큰 이후 FA 측정용 잘 수행을 입증 했다. 이 FA 값에 대 한 최대 동적 범위를 보장합니다. 일반적으로, 모든 형광 염료 형광 일생 ≥ 1 ns는 먼저 테스트할 필요 하지만 적당 한 것 같다. 만약에 가능 하다 면, 근처-적외선 범위에서 fluorescing 염료를 사용 하 여 단백질 autofluorescence를 최소화 하는 것이 좋습니다.
실험 절차의 가장 중요 한 단계가입니다 잘 플레이트에 젤 pipetting. 좋은 재현성 젤 볼륨을을 최대한으로 통일 될 필요 합니다. 데이터를 평가할 때 젤 높이 변화 확산 경쟁 DNA 올리고 머 및 따라서 선호도의 명백한 변화에서의 변경으로 변환 됩니다. 이것은 기술 복제에는 분산의 주요 소스 이다. 전자 피펫으로 또는 자동화 기술 사용 하 여 재현성을 향상 시킵니다. 느리고 조심 pipetting으로 젤 내에서 기포를 피할 수 있습니다. 그것은 또한 가능한 작은 지연으로 함께 적정 우물 위에 모든 경쟁 업체 솔루션을 추가 하는 것이 중요입니다. 최고의 재현성에 대 한 전체 프로세스 자동화할 수 있습니다 열 incubators pipetting 로봇을 사용 하 여. 자동화 프로토콜을 전송 하기 위한 중요 한 부분은 보육 시간과 보육 온도의 필요한 최적화입니다. 젤의 점도 사이의 최적의 균형을 찾을 수 있는지 확인 하십시오 (즉., 너무 추 워)와 단백질 (즉, 너무 섹시 하지)의 안정성. 이 둘을 따라 우물과 사용 하는 단백질의 안정성에는 젤의 분사 속도에.
HiP-FA 경쟁 DNA 올리고에 대 한 제어 전달 시스템을 사용 합니다. Titrations 커브를 생성, 그것은 각 주어진된 z에 대 한 경쟁 DNA 농도 c(z,t) 를 결정 하는 데 필요한-젤 매트릭스 내에서 위치와 지점 t시간. 이것은 또 다른 중요 한 단계 이후 KDs 의 c(z,t)에 직접 따라 달라 집니다. DNA 농도 센서로 NB 염료를 포함 하는 교정 웰 (d그림 1, 그림 2는)이이 목적을 위해 사용 됩니다. 일반적으로, 3-5 교정 웰 플레이트 당 주의 포함 하는 충분 하다입니다. 어떤 엉덩이-FA를 평가 하기 전에 실험, NB 보정 곡선 경쟁 다른 농도 (그림 3에서 어떤 시퀀스의 DNA는 agarose 젤에 녹아 NB의 기존 적정 시리즈를 수행 하 여 설정에 대 한 건설 한다 는), 8 단계에 자세히 설명 된 대로. 매우 강한 바인딩 경우 (KD < 500 분), 추정 경쟁 DNA의 낮은 농도의 결정을 위해 사용 된다 제한, 때문에 그것은 직접 측정 보다 덜 정확. 그러나, 같은 낮은 kD의TFs에 대 한 엉덩이-FA 설치 agarose 젤 매트릭스 (그림 5)를 사용 하지 않고 바인딩 버퍼에서 기존의 경쟁 적정을 수행 하기 위해 사용할 수 있습니다. 예를 들어 한 전체 적정 경쟁 DNA의 12 다른 농도가 96 잘 접시의 단일 행에서 수행할 수 있습니다.
제어 배달 시스템도 필요 합니다 빠른 TF DNA 바인딩 속도 안정적인 단백질 보급 이후 agarose 젤은 역동적인 (비록 천천히). 두 속성은 바인딩할 때 그들의 각각 붙일 레이블이 참조 DNA의 TFs의 FA, 시간이 지남에 따라 엉덩이-FA 설치와 직접 테스트할 수 있습니다. 우리는 조사 요인에 대 한 KON 과OFF K 속도 측정 하 고 그들을 초20, 따라 다른 연구30밀리초 순서 발견. 이것은 측정 평형에서 열릴 수 있도록 충분히 빨리 이다. 느린 속도와 다른 바인딩 반응의 경우 경쟁 업체의 확산의 농도 낮추거나 젤 숨 구멍 크기를 감소 하 여 조정 될 수 있습니다. 시험 된 TFs의 경우 모든 빠른 T떨어져 있다 (~ 초), 약 1-2 h의 총 측정 시간 각 측정에서 열역학 평형 보장 하기 위해 충분 하다.
또 다른 잠재적인 문제는 단백질에 관련 된 FA 측정을 변경할 수 있는 단백질의 형성 이다. (Tensides) 같은 다른 첨가제를 포함 하는 다른 버퍼 상태를 사용 하 여 필요한 경우 집계 형성을 방지할 수 있습니다.
우리는 PWM;의 선형성 가정 했습니다. 그러나, 힙합-FA 합의 시퀀스의 모든 가능한 디-뉴클레오티드 돌연변이 포함 하도록 확장할 수 있습니다. 마지막으로, 엉덩이-FA 바인딩 상호 작용의 다른 유형을 측정에 적용할 수 있습니다. 전제 하는 것입니다 사용할 수 있는 적합 한 참조 분자 구속 붙일 붙일 수 있는 단백질. 제어 전달 시스템, 농도 기온 변화도 ligand;의 어떤 종류에 대 한 생성 될 수 있습니다. 따라서, 마약-단백질 및 단백질-단백질 상호 작용 마찬가지로 높은 충실도 및 처리량으로 측정할 수 있습니다.
공개
저자는 관심의 충돌을 선언합니다.
감사의 말
우리 제이 뮐러 cDNA 클론 및 특히 S. Bergelt 갈리아 연구소의 구성원에 대 한, 귀중 한 조언과 심도 있는 토론에 대 한 감사합니다. 이 작품은 SFB 646, 게놈 식 및 유지 보수 (C.J., 샌드위치), 통합 단백질 과학 (U.G.)를 위한 센터 및 대학원 양적 생물 과학 뮌헨 (석사)에 대 한 규제 네트워크에 의해 지원 되었다. U.G. Bundesministerium 위한 Bildung und Forschung (SFB 646, SFB 1064, CIPSM, QBM), 도이치 가운데에 의해 지원 인정 (BMBF: ebio-Innovationswettbewerb Systembiologie), 훔볼트 재단 (알렉산더 폰 훔볼트, 교수)입니다.
자료
| Name | Company | Catalog Number | Comments |
| Cy5-labled 16- / 18-bp DNA-oligomers | Eurofins | Custom synthesis | |
| 16- / 18-bp DNA-oligomers | Eurofins | Custom synthesis | |
| Nile Blue A | Sigma | N5632-25G | |
| Sensoplate plus microplate 96- or 384-well, PS | Greiner | 655891 | 175 µm thick glass bottom |
| 384 Well Sensoplate, black | Greiner | 788896 | |
| Agarose, low gelling temperature | Sigma | A9414-50G | |
| Sodium Chloride | Merck | 1.06404.1000 | |
| Tween-20 | Sigma | P1379-1L | |
| Di-Potassium hydrogen phosphate trihydrate | Merck | 1.05099.1000 | |
| Potassium dihydrogen phosphate | Merck | 1.04873.1000 | |
| Q-POD Element | Merck Millipore | ZMQSP0DE1 | |
| Millipak 40 Gamma Gold Filter | Merck Millipore | MPGL04GK2 | |
| Milli-Q Integral 3 Water Purification System | Merck Millipore | ZRXQ003WW | |
| Quantum TIX | Merck Millipore | QTUMOTIX1 | |
| DL-Dithiothreitol | Sigma | 43815-1G | |
| Mastercycler gradient | Eppendorf | Z316083 | |
| SafeSeal tube 1.5 mL | Sarstedt | 72.706.200 | |
| Tube 15 mL | Sarstedt | 62.554.502 | |
| Multiply-Pro cup 0.2 mL PP | Sarstedt | 72.737.002 | |
| MICROSCOPY SETUP: | |||
| Automated widefield microscope | LEICA | DMI6000 | |
| Long distance objective | LEICA | HCX PL FLUOAR L 60x/0.60 N.A. Dry | |
| 638 nm line continuous diode laser | Omicron | PHOxX 638-40, 40mW | |
| Back-illuminated EM-CCD Camera | Andor | iXon DV897 | |
| Dichroic mirror | AHF | 640nm cut-off | |
| Bandpass filter | AHF | ET bandpass 700/75 | |
| Linear polarizer | Thorlabs | LPVISC050-MP2 | |
| Polarizing beam splitter | Thorlabs | BS010 | |
| Achromatic lens | Thorlabs | 200 mm focal length | |
| Multimode optical fiber | Optronis | FVP600660710 | |
| ROBOTIC SYSTEM: | |||
| Our robotic system includes a Biomek NXP workstations with a 96-channel head and with Span-8 pipettors, connected with a servo-shuttle, are used for all liquid transfer steps. In addition, the system is equipped with orbital shakers and a microplate reader (Paradigm, Molecular device) served by the Span-8 gripper | Beckman Coulter | Biomek NXP | |
| SOFTWARE: | |||
| Programming language | National Instruments | Labview 9.0 | |
| Script for the HiP-FA software available at | https://github.com/GeneCenterMunich/HiP-FA |
참고문헌
- Berg, O. G., von Hippel, P. H. Selection of DNA binding sites by regulatory proteins. Statistical-mechanical theory and application to operators and promoters. Journal of Molecular Biology. 193, 723-750 (1987).
- Hammar, P., et al. Direct measurement of transcription factor dissociation excludes a simple operator occupancy model for gene regulation. Nature Genetics. 46, 405-408 (2014).
- Chen, J., et al. Single-molecule dynamics of enhanceosome assembly in embryonic stem cells. Cell. 156, 1274-1285 (2014).
- Segal, E., Raveh-Sadka, T., Schroeder, M., Unnerstall, U., Gaul, U. Predicting expression patterns from regulatory sequence in Drosophila segmentation. Nature. 451, 535-540 (2008).
- Schroeder, M. D., et al. Transcriptional control in the segmentation gene network of Drosophila. PLoS Biology. 2, 271(2004).
- He, X., Samee, M. A., Blatti, C., Sinha, S. Thermodynamics-based models of transcriptional regulation by enhancers: the roles of synergistic activation, cooperative binding and short-range repression. PLoS Computionnal Biology. 6, (2010).
- Wilson, M. D., et al. Species-Specific Transcription in Mice Carrying Human Chromosome 21. Science. 322, 434-438 (2008).
- Galas, D. J., Schmitz, A. Dnaase footprinting - simple method for detection of protein-DNA binding specificity. Nucleic Acids Research. 5, 3157-3170 (1978).
- Hellman, L. M., Fried, M. G. Electrophoretic mobility shift assay (EMSA) for detecting protein-nucleic acid interactions. Nature Protocols. 2, 1849-1861 (2007).
- Liedberg, B., Nylander, C., Lundstrom, I. Surface-plasmon resonance for gas-detection and biosensing. Sensors and Actuators. 4, 299-304 (1983).
- Wienken, C. J., Baaske, P., Rothbauer, U., Braun, D., Duhr, S. Protein-binding assays in biological liquids using microscale thermophoresis. Nature Communications. 1, (2010).
- Berger, M. F., et al. Compact, universal DNA microarrays to comprehensively determine transcription-factor binding site specificities. Nature Biotechnology. 24, 1429-1435 (2006).
- Nitta, K. R., et al. Conservation of transcription factor binding specificities across 600 million years of bilateria evolution. eLife. 4, (2015).
- Jolma, A., et al. DNA-Binding Specificities of Human Transcription Factors. Cell. 152, 327-339 (2013).
- Noyes, M. B., et al. A systematic characterization of factors that regulate Drosophila segmentation via a bacterial one-hybrid system. Nucleic Acids Research. 36, 2547-2560 (2008).
- Nutiu, R., et al. Direct measurement of DNA affinity landscapes on a high-throughput sequencing instrument. Nature Biotechnology. 29, (2011).
- Riley, T. R., et al. SELEX.-seq: a method for characterizing the complete repertoire of binding site preferences for transcription factor complexes. Methods Molecular Biology. 1196, 255-278 (2014).
- Maerkl, S. J., Quake, S. R. A systems approach to measuring the binding energy landscapes of transcription factors. Science. 315, 233-237 (2007).
- Isakova, A., et al. SMiLE-seq identifies binding motifs of single and dimeric transcription factors. Nature Methods. 14, 316-322 (2017).
- Jung, C., et al. True equilibrium measurement of transcription factor-DNA binding affinities using automated polarization microscopy. Nature Communications. 9, 1605(2018).
- Weber, G. Polarization of the fluorescence of macromolecules: Fluorescent conjugates of ovalbumin and bovine serum albumin. Biochemical Journal. 51, 155-168 (1952).
- Github. , Available from: https://github.com/Reutern/PySite (2018).
- Github. , Available from: https://githum.com/GeneCenterMunich/HiP-FA (2018).
- Roehrl, M. H., Wang, J. Y., Wagner, G. A general framework for development and data analysis of competitive high-throughput screens for small-molecule inhibitors of protein-protein interactions by fluorescence polarization. Biochemistry. 43, 16056-16066 (2004).
- St Johnston, D., Nuesslein-Volhard, C. The origin of pattern and polarity in the Drosophila embryo. Cell. 68, 201-220 (1992).
- Pankratz, M., Jäckle, H. The Development of Drosophila melanogaster, Vol. 1. Bate, M., Martinez Arias, A. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor. 467-516 (1993).
- Zhao, Y., Ruan, S. X., Pandey, M., Stormo, G. D. Improved Models for Transcription Factor Binding Site Identification Using Nonindependent Interactions. Genetics. 191, (2012).
- Noureddine, M. A., et al. Probing the functional impact of sequence variation on p53-DNA interactions using a novel microsphere assay for protein-DNA binding with human cell extracts. PLoS Genetics. 5, 1000462(2009).
- Veprintsev, D. B., Fersht, A. R. Algorithm for prediction of tumour suppressor p53 affinity for binding sites in DNA. Nucleic Acids Research. 36, 1589-1598 (2008).
- Geertz, M., Shore, D., Maerkl, S. J. Massively parallel measurements of molecular interaction kinetics on a microfluidic platform. Proceedings of the National Academy of Sciences. 109, 16540-16545 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유