Method Article
Metodo semi-minimo invasivo per indurre l'infarto miocardico nei ratti e la valutazione della funzione cardiaca da parte di un sistema cardiaco funzionante isolato
In questo articolo
Riepilogo
Questo articolo presenta un metodo efficiente per eseguire l'ischemia miocardiale e la successiva riperfusione cronica nei ratti utilizzando un approccio minimamente invasivo. Inoltre, la funzione emodinamica ventricolare sinistra dei ratti è valutata con ecocardiografia e metodi isolati del cuore di lavoro.
Abstract
L'infarto miocardico (MI) rimane il principale contributore alla morbilità e alla mortalità in tutto il mondo. Pertanto, la ricerca su questo argomento è obbligatoria. È necessaria una procedura di induzione MI facilmente e altamente riproducibile per ottenere ulteriori approfondimenti e una migliore comprensione dei cambiamenti patologici sottostanti. Questa procedura può essere utilizzata anche per valutare gli effetti o la potenza di nuovi e promettenti trattamenti (come farmaci o interventi) in MI acuta, successiva ristrutturazione e insufficienza cardiaca (HF). Dopo l'intubazione e la preparazione pre-operatoria dell'animale, è stato eseguito un protocollo anestetico con isoflurane e la procedura chirurgica è stata condotta rapidamente. Utilizzando un approccio minimamente invasivo, l'arteria discendente anteriore sinistra (LAD) è stata localizzata e occlusa da una legatura. L'occlusione può essere eseguita acutamente per la successiva reperfusione (lesione ischemia/reperfusione). In alternativa, la nave può essere costantemente migate per studiare lo sviluppo di MI cronica, rimodellamento o HF. Nonostante le insidie comuni, i tassi di abbandono sono minimi. Vari trattamenti come il condizionamento ischemico remoto possono essere esaminati per il loro potenziale cardioprotettivo pre-, peri- e post-operatorio. Il recupero post-operatorio è stato rapido in quanto l'anestesia è stata controllata con precisione e la durata dell'operazione è stata breve. L'analgesia post-operatoria è stata somministrata per tre giorni. La procedura minimamente invasiva riduce il rischio di infezione e infiammazione. Inoltre, facilita il rapido recupero. Le misurazioni del "cuore di lavoro" sono state eseguite ex vivo e hanno permesso un controllo preciso del precarico, del postcarico e del flusso. Questa procedura richiede attrezzature e formazione specifici per prestazioni adeguate. Questo manoscritto fornisce un'introduzione dettagliata passo-passo per condurre queste misurazioni.
Introduzione
Anche se l'incidenza è in continua diminuzione, l'infarto miocardico acuto (MI) è ancora il principale contributore alla morbilità e alla mortalità in tutto il mondo1. Ci sono restrizioni sulla valutazione dell'efficacia dei potenziali trattamenti come farmaci o procedure chirurgiche che prevengono e trattano l'AMI acuta. Prima che i loro effetti possano essere esaminati nell'uomo, questi trattamenti devono essere testati per i rischi in anticipo, compresi gli esami in vivo negli animali. Non c'è occasione migliore per studiare una patologia che in condizioni in vivo. Pertanto, l'induzione MI in ratti o topi e anche grandi modelli animali (maiali o pecore) permette lo studio di cambiamenti a breve (acuto) e a lungo termine (cronici) a causa di ischemia nelle arterie coronarie e nel miocardio circostante, nonché cambiamenti sistemici a causa della funzione cardiaca compromessa. In precedenza le dimensioni dell'infarto erano l'obiettivo principale, ma più recentemente i successivi processi di rimodellamento cardiaco in lesioni acute MI o ischemia/reperfusione, nonché in insufficienza cardiaca consecutiva (HF) sono diventati di grande interesse. Pertanto, è necessario un metodo comparabile e facilmente riproducibile per raggiungere risultati coerenti.
Mentre l'uso di crio-ablazione per ottenere MI è stato segnalato2, il nostro metodo si basa su altri studi in cui i ricercatori occludono l'arteria discendente anteriore sinistra (LAD) da una singola legatura punto. Rispetto alle procedure (emi-)sternotomia, l'approccio minimamente invasivo che sarà presentato in questo articolo, consente un recupero post-operatorio più veloce e riduce notevolmente il tempo di funzionamento. Una fase comune di altre procedure chirurgiche è il sollevamento del cuore dal torace per eseguire il punto cardiaco3. L'approccio di questo metodo rende questo passaggio non necessario. A seconda del protocollo, è possibile eseguire due diverse procedure: un'occlusione temporanea utilizzando un laccio emostatico per indurre ischemia/riperfusione in un tempo definito; o un'occlusione permanente dell'arteria fissando la legatura. Il successo dell'occlusione può essere valutato con l'elettrocardiogramma (ECG) e i cambiamenti macroscopici nel ventricolo sinistro (LV) e il suo ipraggio.
Un altro passo importante prima dell'intervento chirurgico è l'intubazione. Mentre nella maggior parte dei casi, l'intubazione viene eseguita tramite tracheotomia o tramite inserimento orale del tubo sotto la vista da un'incisione cutanea alla gola, questo protocollo descrive l'intubazione endotracheale dell'animale anestesizzato che riduce le difficoltà respiratorie o le infezioni post-operatorie4,5. Per evitare complicazioni post-operatorie, l'aria viene rimossa dal torace tramite una siringa prima di chiudere il torace.
Il secondo compito di questo articolo è la valutazione della funzione emodinamica attraverso un modello sperimentale cuore funzionante isolato, come viene utilizzato in altri progetti all'interno del nostro istituto6,7. Mentre l'ecocardiografia, la risonanza magnetica cardiaca (RM) e la quantificazione invasiva dei cicli di volume di pressione sono metodi ben noti e ampiamente utilizzati per valutare la funzione cardiaca in vivo, sono noti per avere alcune limitazioni. Gli approcci invasivi, come l'uso di cateteri per esaminare la funzione globale o parametri specifici del cuore, sono comunemente usati e rappresentano lo standard d'oro delle misurazioni cardiache. Al contrario, l'apparato cardiaco funzionante ex vivo è raramente usato a causa della sua complessità e dei suoi costi. Ci sono molti aspetti importanti, dalla miscela del perfusate all'adeguata cannulation del cuore, che sono cruciali per una valutazione di successo. L'apparato cardiaco funzionante isolato è stato descritto per la prima volta da Oskar Langendorff nel 18978 ed è stato modificato negli ultimi decenni9. Oggi, ci sono due modelli utilizzati: la modalità Langendorff (LD) e la modalità cuore di lavoro (WH). Nel nostro studio, la modalità LD viene utilizzata per acclimatare il cuore al suo nuovo ambiente (circa 15 min). In questa modalità, il cuore è cannulato attraverso l'aorta e le arterie coronarie sono perfuse anterogradamente, fornendo adeguatamente il miocardio. Nella modalità LD, il cuore non sta eseguendo alcun lavoro di volume di pressione. Al contrario, nella modalità WH, l'atrio sinistro è cannulato attraverso una vena polmonare, attraverso la quale il perfusate entra nell'atrio sinistro. Il cuore poi pompa questo perfusate fisiologicamente contro un afterload predefinito. Aumentando il postload nel tempo, la funzione cardiaca può essere continuamente misurata. Parametri come il flusso coronarico, l'uscita cardiaca (CO), il volume della corsa (SV) e il lavoro, il flusso atriale e le pressioni sistoliche e diastoliche possono essere misurati. L'impatto di vari trattamenti direttamente ed esclusivamente sul cuore può essere studiato6,10. Una recensione di Liao e Podesser9 ha presentato l'uso diffuso di questo metodo nella valutazione degli effetti farmacologici sulla funzione cardiaca e sul metabolismo, nonché nell'esplorazione di varie malattie come MI, HF, obesità e diabete.
In sintesi, questo protocollo presenta un metodo riproducibile per eseguire lesioni MI o miocardiodiale ischemia/reperfusione (MIR) in vivo. Inoltre, permette la caratterizzazione della funzione LV (dys-)su un cuore di ratto isolato dopo l'MI. Questo protocollo presenta una combinazione unica di trattamento e analisi.
Protocollo
Il protocollo sperimentale che ha fornito i risultati descritti in questo articolo è stato approvato dal Comitato Etico regionale per esperimenti sugli animali di laboratorio presso l'Università di Medicina di Vienna e dal Ministero federale austriaco dell'istruzione, della scienza e della ricerca (BMWFW-66.009/0023-WF/V/3b/2016). Tutti gli esperimenti sono conformi alla Guida per la cura e l'uso degli animali da laboratorio, pubblicata dal National Institutes of Health degli Stati Uniti (pubblicazione N. 85-23, rivista 1996).
NOTA: vengono utilizzati ratti Sprague Dawley di 10-12 settimane di peso corporeo di 250-300 g di peso corporeo (BW). Poiché le seguenti procedure e trattamenti vengono eseguiti in un ambiente sterile di una sala operatoria (OR), indossare scrub, guanti, maschere facciali e cappucci durante la movimentazione degli animali. Prima di entrare in OR, assicurarsi che le mani siano lavate e disinfettate. Se l'intenzione è quella di operare su più animali in una sessione chirurgica, lavare e disinfettare, o autoclavare gli strumenti tra le operazioni. Queste linee guida igieniche sono valide per tutte le procedure presentate nella sezione protocollo.
1. Preparazione preoperatoria e anestesia
- Avviare l'anestesia preoperatoria iniettando una miscela di xilazina (4 mg/kg BW) e ketamina (100 mg/kg BW) intraperitonealmente.
- Intubare i ratti con un tubo da 14 G e ventilazione controllata dal volume con una miscela di O2, aria e iroflurane (1 -2,5%) a 75-85 colpi/min, 100 mL/corsa/BW (Figura 1A). Se necessario, per una vista migliore durante l'intubazione: applicare xylocaina attraverso una punta di cotone-lana sul pharynx inferiore per ottenere il rilassamento locale.
- Posizionare i ratti su un tavolo operatorio riscaldato in posizione supina e fissare gli arti anteriori con nastro adesivo (Figura 1B).
- Misurare la temperatura rettale con una sonda.
N.B.: Deve essere mantenuto tra 37,5,38,5 gradi centigradi. - Rasare il torace e pulire l'area operativa con soluzione antisettica povidone iodio. Applicare unguento per gli occhi al ratto per evitare l'essiccazione degli occhi.
- Somministrare l'analgesia intraoperatoria iniettando piitramide (0,1 mL/kg BW) per via intraperita.
- Posizionare le sonde ECG sottocutaneamente alle estremità dell'animale.
- Controllare i riflessi della coda e delle punta prima di inizializzare la procedura chirurgica.
2. Procedura chirurgica: induzione di ischemia miocardiale
- Eseguire l'incisione cutanea utilizzando un bisturi. Assicurarsi di iniziare un parasterna di 2 mm sul torace sinistro al livello del terzo spazio intercostale e continuare fino alla linea ascellare anteriore al livello del quinto spazio intercostale (Figura 1C).
- Sostituire delicatamente i muscoli superficiali per rendere visibili le costole (Figura 1D).
- In caso di sanguinamento minore, utilizzare un battito per cancellare o scollegare il tessuto circostante.
- Eseguire la toracotomia a livello del 4o spazio intercostale e inserire un retrattore per ottenere visibilità del cuore e del polmone (Figura 1E). Aprire con attenzione la pleura per evitare sanguinamento.
- Occlude temporaneamente il LAD utilizzando un laccio emostatico per indurre ischemia/reperfusione (MIR) in un tempo definito; o occluderlo in modo permanente facendo 6-7 nodi utilizzando una sutura 6-0 per chiudere la legatura (Figura 1F,G).
NOTA: il punto giusto per l'occlusione del LAD si trova a circa 2/3 mm sotto il auricolo sinistro sul margine laterale ventrale/sinistro del cuore. L'occlusione riuscita è associata a modifiche ECG (elevazione del segmento ST) e modifiche macroscopiche nella LV come paling. - Nel caso del modello ischemia/reperfusione, riaprire il LAD rimuovendo il laccio emostatico dopo 30 min di occlusione.
- Chiudere il torace con tre suture a pulsante singolo utilizzando una sutura a monofilamento singolo 4-0 (Figura 1H). Prima di stringere l'ultima sutura, rimuovere l'aria residua dal torace con una siringa da 10 mL per evitare uno pneumotorace (Figura 1I).
- Riposizionare i muscoli e disattivare l'anestesia volatile.
- Suturare la pelle con una sutura continua utilizzando una sutura 4-0 (Figura 1J).
- Somministrare uno spray antisettico per proteggersi dalle infezioni e dal mordere della sutura dai ratti.
3. Criteri di trattamento ed esclusione postoperatori
- Tenere i topi sul tavolo di riscaldamento fino a quando non si svegliano. Estubare i ratti non appena iniziano a respirare spontaneamente.
- Mettere i ratti estostati in una gabbia sotto una lampada di riscaldamento per evitare che si raffreddino.
- Riportare i ratti alle case degli animali in condizioni standardizzate quando iniziano a comportarsi normalmente di nuovo.
- Aggiungere 2 annaci di piritramide e 30 mL del 5% di glucosio a 250 mL di acqua per l'analgesia post-operatoria per tre giorni.
- Controllare l'idoneità e il comportamento dei ratti con l'elenco di controllo e i criteri di esclusione (Tabella 1). Osservare gli animali due volte al giorno per la settimana successiva, poi due volte a settimana.
NOTA: In conformità con gli standard internazionali, presentare eventuali animali sofferenti, o animali che guadagnano fino a 6 punti nella valutazione con la lista di controllo, ai veterinari per prendere decisioni relative alla terapia. Tutti gli animali che guadagnano 7 o più punti devono essere immediatamente sacrificati con un sovradosaggio di ketamina e xilarina.
| Esame | Osservazione | Punteggio |
| Peso corporeo | Stabile | 0 |
| 10% di perdita | 4 | |
| 15% di perdita per 48 h | 7 | |
| 18% di perdita | 7 | |
| normale (coat flat e lucido) | 0 | |
| Aspetto esterno | piloerezione | 1 |
| Haematoma | 2 | |
| ferite/tagli/segni di morsi della pelle | 2 | |
| gravemente ridotto toelettatura | 4 | |
| (orifizi impuri/coagulati o umidi) | 7 | |
| gravi irritazioni cutanee o ferite | 7 | |
| postura intuizione >2 h | 7 | |
| significativa distensione addominale (ascite) | 7 | |
| Comportamento | normale (sonno, curiosità, contatti sociali, reazione quando toccato) | 0 |
| comportamento insolito, ad esempio l'attività compromessa | 2 | |
| auto-isolamento, pronunciata iperattività o stereotipia | 4 | |
| lethargia per <6 h | 4 | |
| lethargia per 6 h a 8 h | 7 | |
| apatia >8 h | 7 | |
| stereotipa ininterrotta per >10 min. e ancora persistente dopo 2 h | 7 | |
| segni di dolore quando toccato | 7 | |
| l'automutilazione | 7 | |
| Digestione | Normale | 0 |
| diarrea (feci morbide) | 3 | |
| diarrea per 72 h o acquoso | 7 | |
| sgabello sanguinosa | 7 |
Tabella 1: Lista di controllo e criteridi esclusione . Questa tabella contiene gli esami che devono essere osservati e il punteggio corrispondente. Di conseguenza, il trattamento post-operatorio dell'animale deve essere adattato o un veterinario deve essere consultato.
4. Misurazioni ecocardiografiche
NOTA: L'ecocardiografia viene di solito eseguita due volte, prima dell'induzione di MI e prima che gli organi vengano raccolti.
- Iniettare ratti con una miscela di xylazina (4 mg/kg BW) e ketamina (100 mg/kg BW) per via intraperitonealmente.
- Posizionare i ratti in posizione supina su un vassoio di riscaldamento. Applicare il gel eco al torace, che aiuta le onde a ultrasuoni viaggiare meglio e riduce le interferenze del segnale.
- Ottenere viste parasternali dell'asse corto della cavità LV a livello del muscolo papillare.
- Eseguire l'ecocardiografia in modalità M per misurare la frazione di espulsione e la morfologia a sinistra.
5. Raccolta di organi (senza cuore di lavoro)
- Somministrare xylazina (4 mg/kg BW) e ketamina (100 mg/kg BW) per via intraperitonele prima della raccolta degli organi. Assicurarsi che i riflessi siano negativi.
NOTA: non è richiesta alcuna intubazione in quanto la procedura non dura più di 1 min. - Utilizzare un bisturi per fare un'incisione cutanea sotto lo xifoide ed estenderlo parallelamente alle costole su entrambi i lati utilizzando le forbici.
- Tagliare le costole nella linea ascellare frontale e afferrare lo xifoide per sollevare il petto (Figura 2A).
- Rimuovere le aderenze anatomiche o fibrotiche rotando con attenzione il tessuto con due coppie di pinze.
- Prelevare campioni di sangue (per la valutazione del gas sanguigno o analisi molecolari) dalla vena cava inferiore con una siringa da 5 mL.
- Eseguire l'escissione di tutto il cuore a livello di uscita e di uscita (Figura 2B). Se necessario, procedere con la valutazione del cuore di lavoro come descritto nella sezione 6.
- Raccogliere organi, shock gelo in azoto liquido e conservare in -80 s per ulteriori analisi molecolari, o in formaldeide per scopi istologici.
6. Misurazioni emodinamiche ex vivo tramite un sistema cardiaco funzionante
NOTA: L'installazione generale e i componenti dell'apparecchio sono stati descritti in precedenza11. Il seguente protocollo descrive la manipolazione del cuore dell'animale e i passaggi necessari per valutare la funzione LV.
- Anestesizzare i ratti come descritto nel passaggio 5.1 e iniettare 200 UU di eparina per via endovenosa (vena femorale).
- Aprire il torace attraverso un'incisione sotto l'arco costale con un bisturi ed estenderlo a entrambe le linee ascellari anteriori con le forbici ed elevare lo sterno.
- Tagliare i grandi vasi vicino alla loro presa o inserito al cuore per accisa (Figura 2B).
- Immergere il cuore nel buffer Krebs-Henseleit ghiacciato e montarlo sul sistema di cuore isolato perfuso di eritrocite attraverso la cannulante dell'aorta (Figura 3A).
- Iniziare con la modalità LD con un costante afterload di 60 mmHg (periodo di stabilizzazione).
- Dopo 15 min di modalità LD, passare alla modalità WH. Pertanto, cannulare l'atrio sinistro tramite una vena polmonare (Figura 3B). Quindi, modificare la direzione di flusso nel sistema aprendo la clip che occlude la cannula atriale. Ciò si traduce in una perfusione dell'atrio sinistro e un flusso sanguigno fisiologico nel cuore sinistro11.
- Registrare le misurazioni emodinamiche per 20 min in modalità WH.
- Raccogliere le gocce di sangue delle coronarie con una siringa da 2 mL per misurare il flusso coronarico (CF, mL/min) ogni 5 min.
NOTA: LA CF viene misurata come differenza tra flusso atriale sinistro (LAF) e flusso aortico (AF). - Eseguire misurazioni continue di LAF (equivalente all'uscita cardiaca) e AF con una sonda di flusso.
NOTA: La sonda viene inserita tramite l'apparecchio WH nella LV. Tutti i dati vengono continuamente registrati. - Se il protocollo in corso richiede, inserire un catetere ad alta fedeltà retrogradamente tramite la valvola aortica nella LV e misurare la pressione sistolica del ventricolo sinistro (LVSP).
- Per valutare il lavoro di pressione-volume eseguito al minuto, calcolare il volume dell'ictus come uscita cardiaca divisa per la frequenza cardiaca.
- Calcolare il lavoro cardiaco esterno (EHW) secondo la seguente formula: CO x LVSP (g x m/min) normalizzato al peso cardiaco.
Risultati
I seguenti risultati sono stati pubblicati da Pilz et al.6. Con questa precisa procedura chirurgica, l'effetto cardioprotettivo del percondizionamento ischemico remoto (RIPerc) può essere studiato. Si tratta di un potenziale nuovo trattamento per i pazienti affetti da MI acuto o MIR e dal successivo rimodellamento ventricolare, che in molti casi porta a HF. In questo protocollo, gli animali sono stati sottoposti a 30 min di occlusione LAD seguiti da reperfusione (cioè MIR).
Per dimostrare la riproducibilità della procedura, sono stati eseguiti tagli e macchie istologiche (Figura 4A). Era chiaro che la cicatrice fibrotica negli animali trattati con MIR-RIPerc era paragonabile alla formazione di cicatrici degli animali Sham, mentre il confronto della fibrosi tra i gruppi Sham e MIR era significativo (Figura 4B). Inoltre, gli animali trattati con MIR-RIPerc hanno mostrato una fibrosi significativamente ridotta rispetto agli animali trattati con MIR. Tuttavia, le immagini istologiche rappresentative chiariscono la potenza di questa procedura chirurgica poiché l'infarto è esplicitamente sostenuto nel gruppo MIR (Figura 4A). L'uso dell'ecografia in vivo, la frazione di espulsione, i diametri di fine diastolicia e di fine sistolica (LVEDD e LVESD) sono stati misurati e hanno mostrato una funzione cardiaca significativamente ridotta a causa del trattamento MIR, mentre i parametri emodinamici sono stati preservati dalla RIPerc(Figura 4C-F). I dati emodinamici ex vivo hanno mostrato l'efficacia della procedura, in quanto il gruppo MIR ha mostrato diminuzioni significative in LVSP, uscita cardiaca (CO), volume di corsa (SV) e lavoro cardiaco esterno (EHW)(Figura 5A-G).
Una ricerca di letteratura su questa procedura chirurgica non ha riportato commenti negativi o insoddisfacenti e risultati quando è stato eseguito adeguatamente. Tuttavia, le insidie menzionate nell'introduzione e nella discussione devono essere prevenute e la formazione è obbligatoria per acquisire un livello stabile di prestazioni e ottenere risultati comparabili.
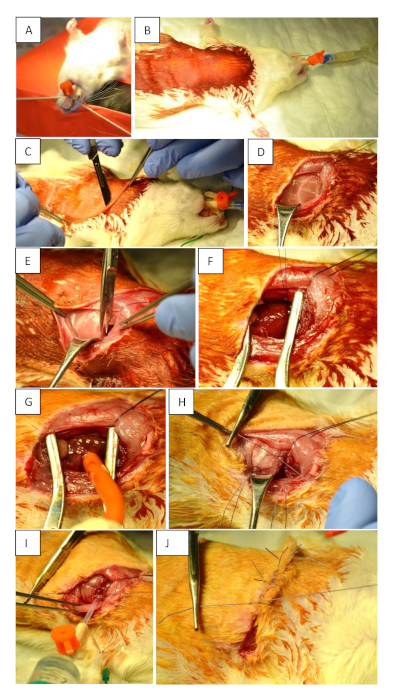
Figura 1: Preparazione preoperatoria e procedura chirurgica. (A) Intubazione dell'animale utilizzando un tubo da 14 G. (B) Posizionamento supino e disinfezione del campo chirurgico. (C) Incisione cutanea (2 mm parasterna sul torace sinistro al livello del terzo spazio intercostale). L'incisione deve raggiungere la linea ascellare anteriore al livello del quinto spazio intercostale. (D) Sorsidiare i muscoli per rendere visibili le costole. (E) Apertura del torace. (F) Occlusione permanente del LAD con 6 o7 nodi. (G) Occlusione transitoria del LAD con un laccio emostatico. (H) Chiusura del torace dopo ischemia miocardiale e reperfusione mettendo tre suture mononodo intorno alle costole. (I) Chiusura corretta del torace. Utilizzare una siringa da 10 mL per rimuovere l'aria residua dal torace prima di fissare saldamente l'ultimo nodo. Questo è parte integrante per prevenire uno pneumotorace. (J)Sutura cutanea. Fare clic qui per visualizzare una versione più grande di questa figura.
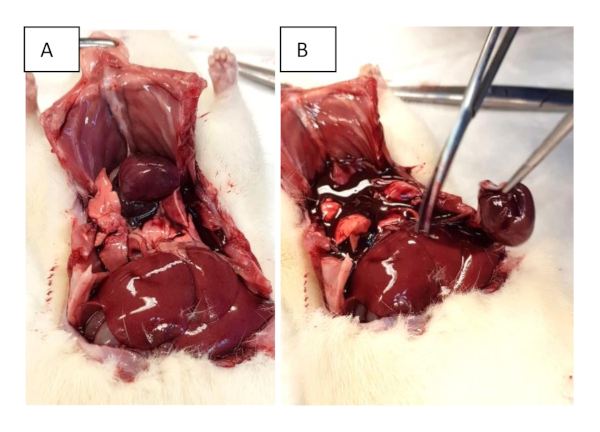
Figura 2: Raccolta di organi. (A) Aprire il torace con tagli sub-xifoziali ed estenderli a entrambe le linee a mezz'ascellazione. Ulteriori tagli attraverso le costole vengono eseguiti per facilitare il sollevamento dello sterno. (B) Escissione del cuore. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Apparecchi cardiaci isolati. (A) Modalità Langendorff. Il cuore è montato sull'apparato WH tramite cannulazione dell'aorta. (B) Modalità cuore di lavoro. Il sistema può essere commutato al modello WH per valutare la funzione cardiaca cannulando l'atrio sinistro. Fare clic qui per visualizzare una versione più grande di questa figura.
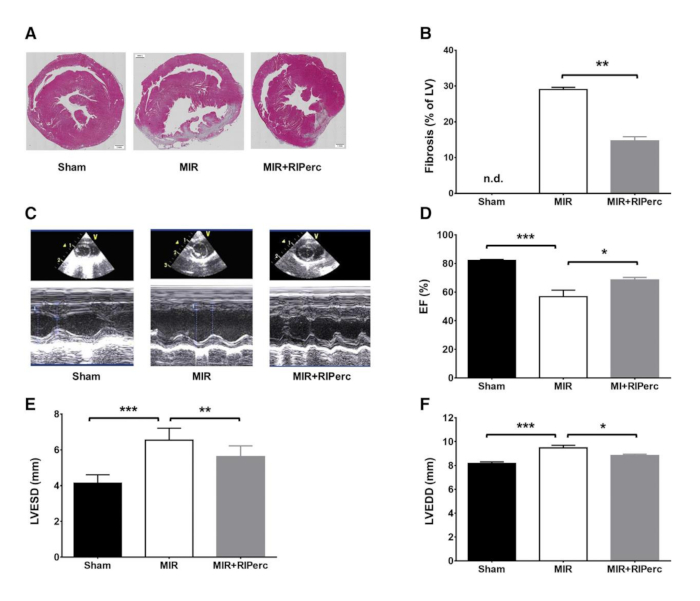
Figura 4: Effetto del condizionamento ischemico a distanza sulla formazione delle cicatrici, sulla funzione ventricolare sinistra e sulla ristrutturazione. (A) Fette di LV istologiche raccolte il giorno 14 di reperfusione post-miocardiale. (B) Risultati quantificati della fibrosi nei grafici a barre. (C) Rappresentante M-mode ecocardiogrammi. (D) Frazione di espulsione (EF) quantificata in grafici a barre. (E) Diametro finale-sistolico LV (LVESD) quantificato in grafici a barre. (F) LV diametro diastolico finale (LVEDD) quantificato in grafici a barre. MIR, miocardio-reperfusione; RIPerc, percondizionamento ischemico a distanza. I dati sono espressi come media: SEM. < 0,01; p < 0.001. Ristampato da Pilz et al.6 con il permesso di Elsevier. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Effetto di RIPerc sulla funzione emodinamica LV. (A) I risultati di pressione sistolica LV (LVSP),(B) di uscita cardiaca (CO) e(C)del volume di corsa (SV) sono stati ottenuti dal cuore di lavoro isolato il giorno 14 della reperfusione post-miocardiale. (D) Il CO è rappresentato in funzione dell'afterload; (F) lavoro cardiaco esterno in funzione del post-caricamento, risultati quantificati nel grafico a barre (E e G). I dati sono espressi come media: SEM e n - 4-7 per gruppo. < 0,05; < 0,01; p < 0.001. MIR, ischemia/reperfusione miocardiale; RIPerc, precondizionamento ischemico remoto; EHW, lavoro cardiaco esterno; SV, volume corsa; AUC, area sotto la curva. Ristampato da Pilz et al.6 con il permesso di Elsevier. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Il rimodellamento avverso post-MI è considerato un meccanismo chiave nello sviluppo dell'insufficienza cardiaca. Pertanto, per garantire la continuità della ricerca cardiovascolare, le procedure sperimentali e le tecniche dovrebbero essere riproducibili. Un protocollo sperimentale comprensibile e chiaramente definito è un elemento fondamentale della riproducibilità. La riproducibilità si riferisce a risultati che possono essere ripetuti da più scienziati e sono convalidati in tutti i laboratori. Questo studio mirava a presentare un metodo semi-minimamente invasivo per indurre MI cronici o ri-perfusi e valutare la funzione emodinamica cardiaca nei ratti.
Questi risultati e ulteriori dati pubblicati mostrano l'alta potenza di questo metodo chirurgico e la sua importanza nella ricerca su MI, rimodellamento e HF. Mentre la lesione ischemia/reperfusione può essere utilizzata per comprendere i cambiamenti nel MI con successiva riperfusione, l'occlusione permanente consente un'ulteriore comprensione dei processi di rimodellamento a breve e lungo termine del miocardio. Altri approcci chirurgici causano più danni ai tessuti e gli animali mostrano maggiori rischi di sviluppare infezioni e pneumotorace, con conseguente aumento dei tassi di abbandono. Al contrario, questa procedura ha lo scopo di ridurre la mortalità con miglioramenti specifici nella configurazione e nella gestione. Inoltre, mostrano variazioni nell'espansione della cicatrice fibrotica a causa dell'occlusione LAD instabile.
Il nostro protocollo fornisce un metodo semplice per l'intubazione, che è uno dei passaggi più critici dell'intera procedura. A differenza di diverse altre pubblicazioni12, la tracheotomia non viene eseguita nella nostra procedura. Ciò migliora il risveglio e la riabilitazione degli animali post-operatori, portando allo sviluppo dei cambiamenti patofisiologici previsti da questa procedura chirurgica prima che gli animali vengano sottoposti a misurazioni post-operatorie. Ovviamente, se si tratta di un protocollo di non sopravvivenza, la tracheotomia viene eseguita sotto visione ed è quindi più facile da eseguire. Inoltre, la chiusura della tracheotomia in un protocollo di sopravvivenza non è applicabile. Se il torace è aperto, è obbligatorio ventilare il polmone per prevenire il collasso. Pertanto, i ratti vengono intubati prima della procedura chirurgica. L'approccio minimamente invasivo non taglia le costole o lo sterno mantenendo così la compattezza e la stabilità del torace. Di conseguenza, il recupero degli animali è migliorato e il rischio di pneumotorace o sanguinamento spontaneo è relativamente basso.
Come accennato in precedenza, mentre l'intubazione è di chiaro vantaggio, è difficile da eseguire e può causare un più alto tasso di abbandono all'inizio degli esperimenti. Questo problema può essere mitigato con la formazione e alcune conoscenze anatomiche. È importante inserire il tubo ad angolo retto e allungare il corpo dell'animale fino a quando la luce brilla attraverso le labbra vocali dopo le quali il tubo può essere spinto delicatamente in avanti. Fare attenzione a non danneggiare le labbra vocali in quanto questo può causare gonfiore, successiva occlusione della glottis e soffocamento.
È anche importante che il LAD sia legato correttamente. La piccola finestra chirurgica, il cuore che batte velocemente e il polmone ventilato (evitare di toccarlo il più possibile, poiché ogni contatto può provocare sanguinamento nel polmone) rendono il vaso non chiaramente visibile. Pertanto, la conoscenza anatomica è indispensabile. Il auricolo sinistro è indispensabile per aiutare a standardizzare sia l'area a rischio che per posizionare la legatura intorno al LAD. Il punto deve essere eseguito per via intramuralmente, non transmuralmente nell'LV in quanto ciò può causare una riduzione del diametro e del volume della camera LV che non è dovuta ai processi patologici. L'occlusione di successo è associata alla cianosi dell'area miocardiale a rischio e all'elevazione del segmento ST su ECG. La limitazione principale di questa procedura è il corretto posizionamento della sutura. Per ottenere risultati comparabili, i punti devono essere allo stesso livello e devono utilizzare quantità simili di tessuto. Ciò richiede un alto livello di formazione e devono essere considerati i diversi pesi degli animali. Un altro punto da considerare è l'adeguata rimozione dello pneumotorace prima della chiusura dello spazio intercostale. Se questo non viene eseguito con precisione, gli animali mostreranno difficoltà nella respirazione in quanto l'inflazione del polmone sinistro sarà ostacolata da uno pneumotorace. Come già detto, questo può essere mitigato utilizzando una siringa per rimuovere qualsiasi aria residua dal torace.
Attualmente, questa procedura MI è un metodo comunemente usato che garantisce risultati comparabili e un alto tasso di sopravvivenza se i passaggi critici vengono eseguiti con alta precisione. Progetti futuri su vari trattamenti, dispositivi o farmaci in MI, HF o rimodellamento cardiaco possono essere valutati eseguendo questa tecnica minimamente invasiva.
Le misurazioni WH, come di cui sopra, non sono comunemente utilizzate in quanto la sua manutenzione e movimentazione richiede attrezzature e conoscenze specifiche. Per acquisire dati rappresentativi e comparabili, occorre evitare insidie. I passaggi più critici sono il montaggio del cuore e il passaggio dal modello D alla modalità WH. Se il cuore non viene assornato adeguatamente, il montaggio può essere difficile in quanto è necessaria una lunghezza sufficiente del tessuto aortico per fissare il cuore all'apparato. Poco dopo il collegamento alla modalità LD, la frequenza cardiaca può diminuire a causa del lavaggio nel tampone freddo, della disconnessione dei suoi stimoli fisiologici nel corpo o della reperfusione con il sangue di un'altra specie da parte dell'apparato. In questi casi, un pacemaker deve essere applicato sia per ripristinare che preservare la frequenza fisiologica. Ciò garantisce risultati comparabili in tutti gli animali. Poiché il volume sanguigno all'interno dell'apparato è un multiplo del volume fisiologico nei ratti, vengono utilizzati globuli rossi bovini in una sospensione basata sul buffer di Krebs-Henseleit.
Il passaggio dalla modalità LD alla modalità WH è sinonimo di passaggio dal lavoro passivo a quello attivo. La modalità LD viene utilizzata per abituare il cuore al suo nuovo ambiente. Nella modalità WH, il cuore deve eseguire le sue funzioni di espulsione fisiologica. Pertanto, è necessaria una breve fase di adattamento alle nuove circostanze prima della valutazione aumentando il postcarico.
Un altro passo critico che viene comunemente dimenticato è l'adeguata preparazione e manutenzione dell'apparato e del perfusate. Il volume preciso di ogni composto deve essere miscelato e la temperatura all'interno del sistema deve essere controllata e regolata. Tuttavia, la WH è un metodo elegante per valutare l'uscita cardiaca, il volume della corsa, la pressione sistolica ventricolare sinistra e il flusso coronarico contemporaneamente.
Questa procedura altamente riproducibile per indurre mi e i dati di rappresentanza acquisiti dall'apparato WH stanno dimostrando la loro capacità. L'approccio semi-minimamente invasivo, il livello di occlusione LAD e il metodo di intubazione facilitano il recupero rapido e la bassa variabilità nelle dimensioni infarto. Inoltre, l'analisi della funzione cardiaca nei cuori di lavoro isolati fornisce preziosi risultati emodinamici.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano l'operazione del team di teatro e i tecnici del Centro per la ricerca biomedica per il loro contributo, assistenza tecnica, prezioso contributo e consulenza. I progetti sono finanziati dall'Istituto Ludwig Boltzmann, Cluster for Cardiovascular Research (progetto REM).
Materiali
| Name | Company | Catalog Number | Comments |
| ANAESTHESIA & ANALGESIA | |||
| Isoflurane | Zoetis | TU061219 / 8-00487 | |
| Ketamine | Dr. E. Gräub AG | 100 mg/kg of bodyweight | |
| Piritramide | Hameln-Pharma Plus GmbH | 2 ampulles with 30 ml of Glucose 5% in 250ml water | |
| Xylazine | Bayer | 4 mg/kg of bodyweight | |
| INTUBATION | |||
| Air | |||
| Oxygen (pure) | |||
| Ventilation machine | Hugo Sachs Electronics | UGO Basile S.R.L. | Respirator |
| 14-gauge tube | Dickinson and Company | BD Venflon | |
| PREPARATION | |||
| Anti-septic povidine iodine solution | Mundipharma | Betaisodona solution | |
| Eye ointment | Fresenius Kabi Austria | Oleovital with Vitamin A + Dexpanthenol | |
| Shaver | |||
| SURGICAL INSTRUMENTS | |||
| Anatomical forceps | Martin | 12-272-15 | |
| Anatomical forceps small | Martin | 24-386-16 | |
| Anatomical forceps thin | Odelga | RU4042-15 | |
| Cautery Fine Tip | High Temp | bvi-Accu-Temp | |
| Cup (small, for liquids) | Martin | 56-231/11 | |
| Mensur | MTI | 29-260/25 | |
| Mosquito clamps | MTI | 05-055/12 | |
| Needleholder short | Martin | 20-658-14 | |
| Needleholder thin | Martin | ||
| Round hook | BT-190 | ||
| Scalpell size 3 | Swann Morton | No.10, 0301 | |
| Scissors for tissue preparation | Aesculap | BC259R | |
| Sharp scissors | MTI | 01-010/10 | |
| Small retractor | Alm | AM.416.10 | |
| Surcigal forceps | Martin | 12-321-13 | |
| Surgical scissors | |||
| SUTURES | |||
| PermaHand Silk 4-0 | Johnson & Johnson Medical Products GmbH | K891H | |
| Vicryl 4-0 | Johnson & Johnson Medical Products GmbH | JV2024 | single monofil suture |
| Vicryl 6-0 | Johnson & Johnson Medical Products GmbH | V301G | polyethylene suture |
| COMPUTER PROGRAMS & APPARATUS | |||
| Labchart 7 Pro | ADInstruments | v7.3.2 | Labchart Software |
| PowerLab System | ADInstruments | Powerlab 8/30 | |
| EX VIVO HEMODYNAMICS | |||
| Flowmeter Narcomatic RT-500 | Narco Bio-Systems | flow probe | |
| Isolated heart apparatus | Hugo Sachs Electronics | ||
| Labchart 7 Pro | ADInstruments GmbH | v7.3.2 | Labchart Software |
| Millar SPR-407 | Millar Instruments Inc. | 840-4079 | high-fidelity MicroTip catheter |
| Needle electrodes via Animal bio Amp | ADInstruments GmbH | MLA1203 | |
| Physiological Pressure Transducer (MLT844) with Clip-on BP Domes | ADInstruments GmbH | MLT844 | |
| PowerLab System | ADInstruments GmbH | Powerlab 8/30 |
Riferimenti
- WHO. Global Health Estimates 2015: Deaths by Cause, Age, Sex, by Country and by Region, 2000-2015. World Health Organization. , (2016).
- Jaquet, K., et al. Reduction of myocardial scar size after implantation of mesenchymal stem cells in rats: what is the mechanism. Stem Cells and Development. 14 (3), 299-309 (2005).
- Liu, P., Xu, B., Cavalieri, T. A., Hock, C. E. Age-related difference in myocardial function and inflammation in a rat model of myocardial ischemia-reperfusion. Cardiovascular Research. 56 (3), 443-453 (2002).
- Kolk, M. V. V., et al. LAD-Ligation: A Murine Model of Myocardial Infarction. Journal of Visualized Experiments. (32), e1438 (2009).
- Lugrin, J., Parapanov, R., Krueger, T., Liaudet, L. Murine Myocardial Infarction Model using Permanent Ligation of Left Anterior Descending Coronary Artery. Journal of Visualized Experiments. (150), e59591 (2019).
- Pilz, P. M., et al. Remote ischemic perconditioning attenuates adverse cardiac remodeling and preserves left ventricular function in a rat model of reperfused myocardial infarction. International Journal of Cardiology. 285, 72-79 (2019).
- Santer, D., et al. In vivo and ex vivo functional characterization of left ventricular remodelling after myocardial infarction in mice. ESC Heart Failure. 2 (3), 171-177 (2015).
- Langendorff, O. Untersuchungen am überlebenden Säugetierherzen II. Über den Einfluss von Wärme und Kälte auf das Herz der warmblütigen Tiere. Pflügers Archiv für die gesamte Physiologie des Menschen und der Tiere. 66 (67-68), 355-400 (1897).
- Liao, R., Podesser, B. K., Lim, C. C. The continuing evolution of the Langendorff and ejecting murine heart: new advances in cardiac phenotyping. American Journal of Physiology-Heart and Circulatory Physiology. 303 (2), 156-167 (2012).
- Podesser, B. K., et al. The erythrocyte-perfused "working heart" model: hemodynamic and metabolic performance in comparison to crystalloid perfused hearts. Journal of Pharmacological and Toxicological Methods. 41 (1), 9-15 (1999).
- Kiss, A., et al. Argon preconditioning enhances postischaemic cardiac functional recovery following cardioplegic arrest and global cold ischaemia. European Journal of Cardio-Thoracic Surgery. 54 (3), 539-546 (2018).
- Kiss, A., et al. Vagal nerve stimulation reduces infarct size via a mechanism involving the alpha-7 nicotinic acetylcholine receptor and downregulation of cardiac and vascular arginase. Acta Physiologica. 221 (3), 174-181 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon