Method Article
Test di stimolazione magnetica transcranica convenzionali e con tracciamento delle soglie per il funzionamento con una sola mano
In questo articolo
Riepilogo
Presentiamo una suite di protocolli di registrazione standardizzati di stimolazione magnetica transcranica (TMS) a impulso singolo e accoppiato, con opzioni per misurazioni di ampiezza convenzionali e tracciamento della soglia. Questo programma può controllare tre diversi tipi di stimolatori magnetici ed è progettato per consentire a tutti i test di essere eseguiti comodamente da un singolo operatore.
Abstract
La maggior parte dei parametri di stimolazione magnetica transcranica (TMS) a impulso singolo (ad esempio, soglia motoria, funzione stimolo-risposta, periodo di silenzio corticale) vengono utilizzati per esaminare l'eccitabilità corticospinale. I paradigmi TMS a impulsi accoppiati (ad esempio, inibizione intracorticale a breve e lungo intervallo (SICI/LICI), facilitazione intracorticale a breve intervallo (SICF) e inibizione afferente a latenza breve e lunga (SAI/LAI)) forniscono informazioni sulle reti inibitorie e facilitatori intracorticali. Questo è stato a lungo fatto con il metodo TMS convenzionale per misurare i cambiamenti nelle dimensioni dei potenziali evocati dal motore (MEP) in risposta a stimoli di intensità costante. Recentemente è stato introdotto un approccio alternativo di tracciamento delle soglie in base al quale viene tracciata l'intensità dello stimolo per un'ampiezza target. L'utilità diagnostica della SICI di tracciamento della soglia nella sclerosi laterale amiotrofica (SLA) è stata dimostrata in studi precedenti. Tuttavia, il TMS di tracciamento delle soglie è stato utilizzato solo in alcuni centri, in parte a causa della mancanza di software prontamente disponibile, ma forse anche a causa dell'incertezza sulla sua relazione con le misurazioni TMS convenzionali a impulso singolo e accoppiato.
È stata sviluppata una suite di programmi semi-automatici guidata da menu per facilitare l'uso più ampio delle tecniche TMS di tracciamento delle soglie e per consentire confronti diretti con le misurazioni di ampiezza convenzionali. Questi sono stati progettati per controllare tre tipi di stimolatori magnetici e consentire la registrazione da parte di un singolo operatore dei comuni protocolli TMS a impulso singolo e accoppiato.
Questo documento mostra come registrare una serie di protocolli TMS a impulso singolo e accoppiato su soggetti sani e analizzare le registrazioni. Questi protocolli TMS sono veloci e facili da eseguire e possono fornire biomarcatori utili in diversi disturbi neurologici, in particolare malattie neurodegenerative come la SLA.
Introduzione
La stimolazione magnetica transcranica (TMS) della corteccia motoria è un metodo non invasivo per esaminare la fisiologia corticale e la fisiopatologia di molte condizioni neurologiche, comprese le malattie neurodegenerative1. La corteccia motoria primaria viene stimolata utilizzando impulsi TMS soprasoglia per produrre una risposta motoria nel muscolo bersaglio. Questa risposta è chiamata potenziale evocato dal motore (MEP). TMS funge da strumento utile che interroga le reti motorie corticali e potenzialmente sottocorticali2. La TMS a impulso singolo può valutare la reattività corticale, la soglia del motore a riposo (RMT), l'ampiezza del MEP e il periodo di silenzio corticale (CSP)2. L'inibizione corticale può essere sondata utilizzando TMS a impulsi accoppiati a intervalli interstimoli (ISI) di 2-3 ms (SICI) o ~100 ms (LICI)3,4,5.
SiCI è mediato dall'acido gamma-aminobutirrico (GABA)A e LICI dai recettori GABAB come indicato dalla loro farmacologia4,5. Il circuito sottostante sicf è mediato in parte dai recettori glutamatergici dell'acido N-metil-D-aspartico (NMDA)6,7. L'ampiezza meppica è ridotta se la TMS è preceduta dalla stimolazione elettrica di un nervo sensoriale periferico. Questo effetto è chiamato inibizione afferente ed è noto come SAI quando l'ISI è ~ 20-25 ms e LAI a ISI più lunghi di 200-1000 ms tra la stimolazione elettrica del nervo periferico e il singolo impulso di TMS8,9,10. L'ISC è modulata dall'attività colinergica11; tuttavia, la LAI è significativamente poco studiata e i circuiti neurali alla base di questo fenomeno non sono chiari 10.
Le ampiezze MEP sono variabili e le stime degli endpoint nei metodi TMS convenzionali (cTMS) di solito utilizzano medie aritmetiche da 10 a 20 risposte evocate con un'intensità di stimolo fissa. Un approccio alternativo è il monitoraggio delle soglie TMS, descritto per la prima volta oltre 20 anni fa12,13. In questo caso, l'intensità degli stimoli successivi viene variata per ottenere una risposta di ampiezza target fissa. Sia le tecniche convenzionali che quelle di tracciamento delle soglie possono essere utilizzate con diversi ISI. Nella prima versione di questo approccio applicata alla SICI, ovvero il tracciamento "seriale" delle soglie (T-SICI), è stato utilizzato un metodo di tracciamento simile a quello impiegato nei test di eccitabilità nervosa: la "soglia" è stata prima stimata a un intervallo interstimolico (ISI) e poi tracciata in serie su ISI successivi. Questo metodo è stato ampiamente utilizzato da un gruppo e sostenuto come potenziale biomarcatore per la SLA a causa della sua elevata utilità diagnostica14,15,16,17. Tuttavia, i loro risultati devono ancora essere confermati da qualsiasi altro gruppo di ricerca14,15,16,17.
L'approccio seriale è efficiente quando le soglie di riferimento sono stabili, come nei nervi periferici. Tuttavia, quando le soglie fluttuano ampiamente, come nel caso dell'eccitabilità corticospinale, il tracciamento seriale ha lo svantaggio di distorcere seriamente la dipendenza ISI di SICI18. Pertanto, un paradigma alternativo di tracciamento delle soglie "parallelo" potrebbe essere più appropriato per SICI (T-SICIp)18,19 e altri protocolli a impulsi accoppiati, in cui le soglie sono stimate indipendentemente, in parallelo, per diversi ISI.
Nonostante la loro promessa, i metodi TMS esistenti non sono ancora stati accettati nelle cliniche come test diagnostici affidabili o biomarcatori negli studi clinici. Ciò può essere dovuto a diverse limitazioni dei metodi TMS esistenti, come il consumo di tempo, la richiesta di funzionamento manuale e la scarsa riproducibilità. Per aiutare a superare queste limitazioni, questo documento descrive una suite di protocolli TMS automatizzati, veloci, a impulso singolo e accoppiato di recente sviluppo, progettati per il funzionamento con una sola mano e per consentire il confronto tra approcci convenzionali e seriali e paralleli di tracciamento delle soglie.
L'attrezzatura utilizzata qui include una macchina TMS, uno stimolatore lineare bipolare a corrente costante isolato, un eliminatore di rumore per rimuovere le interferenze elettriche a 50-60 Hz, un amplificatore elettromiografico e un sistema di acquisizione dati. Il software è abbastanza versatile da funzionare con altri amplificatori, stimolatori e condizioni di registrazione.
Protocollo
NOTA: Tutti i soggetti devono dare il loro consenso scritto prima dell'esame e il protocollo deve essere approvato dalle commissioni di revisione etica locali appropriate. Tutti i metodi qui descritti sono stati approvati dal Comitato etico scientifico regionale e dall'Agenzia danese per la protezione dei dati.
Il metodo TMS prevede tre fasi: 1) preparazione del soggetto, 2) registrazione del TMS e 3) analisi dei risultati.
1. Preparazione del soggetto
- Valutare la storia medica dei soggetti e chiedere se il soggetto ha l'epilessia, un pacemaker o qualsiasi tipo di dispositivi metallici / impianti nel corpo e, per i soggetti di sesso femminile, se è incinta.
- Istruire il soggetto in dettaglio sugli esami e invitarlo a dare il consenso scritto.
- Informare il soggetto sull'applicazione della stimolazione magnetica al cuoio capelluto e che ogni esame richiede circa 10 minuti.
- Spiega che la stimolazione sarà ascoltata come un suono di clic e ha lo scopo di evocare una contrazione muscolare e che alcuni stimoli possono sembrare leggermente spiacevoli.
- Spiega che la stimolazione può essere disattivata in qualsiasi momento se segnalata dal soggetto.
- Chiedi al soggetto di indossare una cuffia.
- Pulire la mano del soggetto controlaterale all'emisfero studiato.
- Posizionare l'elettrodo di registrazione attivo sul primo muscolo interosseo dorsale (FDI) e l'elettrodo di riferimento sulla 2a articolazione metacarpo-falangea.
- Posizionare un elettrodo di terra sul dorso della mano.
- Collegare gli elettrodi di registrazione e di messa a terra all'amplificatore.
- Istruire il soggetto a rimanere vigile ma rilassato durante l'esame.
2. Registrazione TMS
NOTA: La descrizione riportata di seguito si applica ai software e agli strumenti specifici utilizzati (vedere la Tabella dei Materiali); questi dovranno essere adattati per altri hardware.
- Accendere il dispositivo TMS.
- Avviare il software di registrazione semi-automatizzato utilizzando il protocollo per le registrazioni TMS.
- Selezionare le opzioni di guadagno e gating dal menu (Tabella 1). Fare clic su OK per continuare.
- Selezionare il protocollo CSP dalle opzioni principali.
- Posizionare la bobina a circa 4 cm a sinistra nella linea binauricolare dal vertice, con la maniglia che punta di 45° sul piano parasagittale per l'induzione della corrente posteriore-anteriore.
- Aumentare manualmente l'intensità dello stimolo facendo clic sul tasto Inserisci fino a ottenere un MEP.
- Spostare leggermente la posizione della bobina mentre si monitorano i deputati per trovare l'hotspot.
- Disegna il contorno della bobina su una cuffia da nuoto una volta individuato l'hotspot per consentire il posizionamento costante della bobina.
- Fare clic su OK per avviare il protocollo di stimolazione automatica.
NOTA: la registrazione continua automaticamente, a partire dalla determinazione dell'RMT a 200 μV. - Istruire il soggetto a mantenere un'attivazione confortevole del muscolo FDI per misurare la soglia motoria attiva (AMT) per una risposta di 200 μV.
- Clicca su OK per misurare i periodi di silenzio con o senza pausa tra i 3 gruppi di 10 cicli di stimoli su e giù.
NOTA: per ogni gruppo di 10, lo stimolo viene aumentato da 0,8 a 1,6 × RMT200, a intervalli di 0,2, e quindi ripetuto nell'ordine inverso. - Dì al soggetto di rilassarsi dopo l'ultimo stimolo e fai clic su OK per tornare al menu principale.
- Selezionare il protocollo SICI dalle opzioni principali.
- Selezionare gli ISI pianificati da studiare dal menu Opzioni ISI SICI e il numero di stimoli in ogni ISI dal menu Numero di stimoli per ISI se non vengono utilizzati i valori predefiniti.
- Selezionare ASICI dal menu.
NOTA: La registrazione continua automaticamente, iniziando con la determinazione dell'RMT a 200 μV e poi a 1000 μV. La registrazione SICI inizia automaticamente dopo la determinazione dell'RMT e continua per circa 10 min. Lo stimolo di prova è fissato a RMT1000 e gli stimoli di condizionamento al 70% di RMT200. I seguenti ISI sono selezionati in ordine pseudocasuale: 1, 1.5, 2, 2.5, 3, 3.5, 4, 5 e 7 ms. Gli stimoli da soli vengono somministrati dopo ogni tre stimoli accoppiati. Pertanto, ogni stimolo accoppiato viene consegnato 10 volte, per un totale di 120 stimoli. - Assicurarsi che la posizione della bobina sia stabile osservando il contorno sulla cuffia, MEP sullo schermo e le contrazioni del muscolo durante la registrazione.
- Quando lo schermo ritorna automaticamente alle opzioni del menu principale al termine del protocollo, selezionare TSICIp dal menu.
NOTA: La registrazione continua automaticamente, iniziando con la determinazione dell'RMT a 200 μV e quindi la registrazione SICI per circa 10 min. RMT200 viene tracciata continuamente diminuendo lo stimolo dell'1% massima in uscita stimolatore (MSO) se la risposta è superiore a 250 μV e aumentandola dell'1% se la risposta è inferiore a 160 μV. Gli stimoli da soli test si alternano a stimoli accoppiati e gli stimoli accoppiati vengono consegnati con ISI pseudorandomizzati: 1, 1,5, 2, 2,5, 3, 3,5, 4, 5 e 7 ms. Pertanto, vengono erogati un totale di 120 stimoli, 10 volte per ciascuno dei 9 stimoli accoppiati e stimoli da soli test dopo ogni tre stimoli accoppiati. - Dopo che la schermata ritorna automaticamente alle opzioni del menu principale al termine del protocollo, fare clic su Fine a meno che non venga eseguito un altro protocollo.
- Termina la registrazione facendo clic sul pulsante Chiudi file e salva dati .
3. Analisi TMS
- Avviare il programma software di analisi per eseguire le analisi offline.
- Selezionare la registrazione che verrà analizzata e fare clic sul pulsante OK .
- Selezionate l'opzione Crea file TMS MEM (Create TMS MEM file ) dal menu TMS per l'analisi.
- Fare clic su OK per salvare il file MEM.
- Fare clic sull'opzione Plot TMS MEM/MEF dal menu TMS per il confronto della registrazione del singolo soggetto con un gruppo di controlli sani.
- Fare clic sulla 1a opzione nel menu del nome file MEF . Quindi, fare clic sul file MEF con cui verrà effettuato il confronto dall'elenco dei file MEF.
- Fare clic sulla 1a opzione nel menu del nome file MEM . Quindi, fare clic sul file MEM con cui verrà effettuato il confronto dall'elenco dei file MEM.
- Sovrapporre i file MEM e MEF utilizzando diverse opzioni di intervalli di confidenza del 95%, deviazioni standard o errori standard.
Risultati
I seguenti risultati sono stati ottenuti in un soggetto sano. RMT per una risposta picco-picco di 200 μV (RMT200) o 1000 μV (RMT1000) sono stati rilevati da una regola di tracciamento "4→2→1" e dalla regressione logaritmica come descritto in precedenza18. L'RMT200 era il 52,1% msO e l'RMT1000 era il 59,8% MSO.
Tutte le opzioni TMS a impulsi accoppiati possono essere determinate in modalità di ampiezza, tracciamento della soglia parallela e tracciamento della soglia seriale. Qui verranno riepilogate solo le modalità di monitoraggio dell'ampiezza e della soglia parallela. Di conseguenza, gli ISI, il numero di stimoli in ogni ISI e il livello di intensità dello stimolo per gli stimoli condizionanti possono essere selezionati dal menu. Qui, descriviamo solo le opzioni predefinite per questi.
La Figura 1 mostra la configurazione, compresa la stimolazione con una bobina a figura otto, la registrazione con elettrodi di superficie, il computer con software installato, la macchina TMS, l'eliminatore di rumore per rimuovere le interferenze elettriche a 50-60 Hz, lo stimolatore lineare lineare bipolare a corrente costante isolato, l'amplificatore elettromiografico e un sistema di acquisizione dati.
La Figura 2 mostra SICI come A-SICI (Figura 2A) e T-SICI in parallelo (Figura 2B) come descritto nella sezione protocollo. La Figura 3 mostra LICI come parallelo A-LICI (Figura 3A) e T-LICI (Figura 3B). Per A-LICI, dopo aver trovato l'hotspot, il programma determina RMT1000 e imposta sia gli stimoli di test che di condizionamento a questa ampiezza. Gli stimoli da soli vengono forniti come ogni 4 ° stimolo e gli stimoli di condizionamento + test a intervalli di 50, 100, 150, 200, 250 e 300 ms vengono consegnati pseudocasualmente. Dieci stimoli vengono consegnati a ciascun ISI. Allo stesso modo, per T-LICI, vengono erogati 10 impulsi accoppiati agli stessi 6 ISI di A-LICI da 50 a 300 ms e le soglie per RMT200 vengono tracciate mentre lo stimolo di condizionamento è impostato al 120% dell'RMT200 tracciato.
La Figura 4 mostra SICF come A-SICF (Figura 4A) e T-SICF in parallelo (Figura 4B). Per A-SICF, dopo aver trovato l'hotspot, il programma determina RMT50 e RMT1000. Gli stimoli di prova vengono quindi impostati su RMT1000 e gli stimoli di condizionamento al 90% di RMT50. L'intervallo di ISI va da 1 a 4,9 per 0,3 ms. Gli stimoli da soli vengono consegnati come ogni 4 ° o 5 ° stimolo e i 14 stimoli di condizionamento + test vengono consegnati in ordine pseudocasuale. Per quanto riguarda A-SICF, T-SICF viene misurato a 14 ISI da 1 a 4,9 ms e la soglia viene tracciata con 10 impulsi accoppiati a ciascun ISI.
La Figura 5 mostra l'ISC come A-SAI (Figura 5A) e T-SAI in parallelo (Figura 5B). I protocolli SAI prevedono la stimolazione delle afferenze somatosensoriali nel nervo e la registrazione degli effetti sul MEP eccitato ~ 20 ms più tardi. Questa latenza MEP ('N20') è importante per la tempistica degli stimoli. Il programma chiede all'utente di selezionare la latenza da un intervallo (16-23 ms) o di specificarla se al di fuori di questo intervallo. Per determinare la latenza N20, è possibile eseguire un potenziale evocato somatosensoriale convenzionale o utilizzare controlli di laboratorio corretti per età e altezza.
Per l'A-SAI, viene prima determinata l'intensità dello stimolo elettrico per un potenziale d'azione muscolare composto da 1 mV (EMT1000). Quindi, l'hotspot viene trovato per la stimolazione magnetica e viene determinato RMT1000. Il programma combina quindi stimoli magnetici ed elettrici con ISI da N20-2 a N20+12 ms. Gli stimoli test-alone sono dati come ogni 4 ° stimolo, mentre gli stimoli di condizionamento + test sono dati in ordine pseudocasuale. Per T-SAI simile ad A-SAI, EMT1000 viene prima determinato. Quindi, la stimolazione passa allo stimolo magnetico e l'hotspot viene determinato nel solito modo. Il programma determina quindi RMT200 in modo simile agli altri protocolli di tracciamento. Inoltre, il programma si imbatte direttamente nel monitoraggio SAI, con l'ISI tra stimolo elettrico e stimolo di prova magnetico aumentato in passi di 1 ms da N20-2 a N20 + 12 ms.
La Figura 6 mostra LAI come parallelo A-LAI (Figura 6A) e T-LAI (Figura 6B). I protocolli LAI per la registrazione dell'inibizione afferente a lungo intervallo sono gli stessi del SAI, tranne per il fatto che poiché gli intervalli sono molto più lunghi (da 200 a 1000 ms, in passi di 100 ms), l'intervallo N20 viene ignorato e non deve essere inserito.

Figura 1: La configurazione. La configurazione include la stimolazione con una bobina a figura otto, la registrazione con elettrodi di superficie, il computer con il software installato, la macchina TMS, l'eliminatore di rumore per rimuovere le interferenze elettriche a 50-60 Hz, lo stimolatore lineare lineare bipolare a corrente costante, l'amplificatore elettromiografico e un sistema di acquisizione dati. Abbreviazione: TMS = stimolazione magnetica transcranica. Fare clic qui per visualizzare una versione più grande di questa figura.
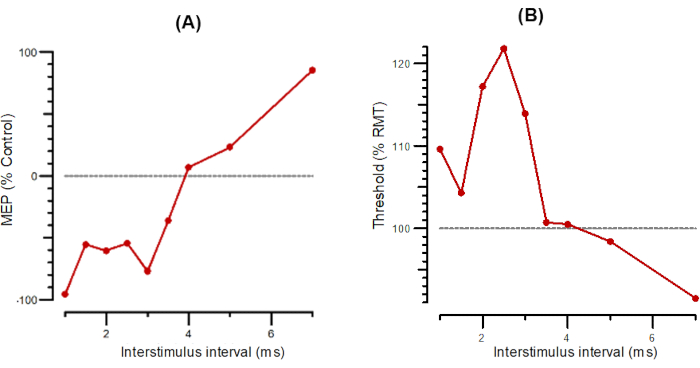
Figura 2: A-SICI e T-SICI tracciati in funzione di intervalli interstimoli da 1 ms a 7 ms. (A) A-SICI tracciato come ampiezza della risposta condizionata come percentuale di controllo. (B) T-SICI tracciato come variazioni di soglia (inibizione come percentuale di controllo). Abbreviazioni: A-SICI = ampiezza dell'inibizione intracorticale a breve intervallo; T-SICI = variazioni di soglia nell'inibizione intracorticale a breve intervallo; MEP = potenziale evocato dal motore; RMT = soglia del motore a riposo. Fare clic qui per visualizzare una versione più grande di questa figura.
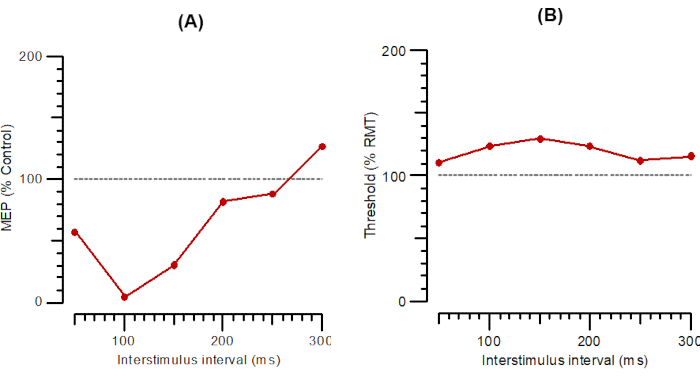
Figura 3: A-LICI e T-LICI tracciati in funzione di intervalli interstimoli da 1 ms a 300 ms. (A) A-LICI tracciato come ampiezza della risposta condizionata come percentuale di controllo. (B) T-LICI tracciato come variazioni di soglia (inibizione come percentuale di controllo). Abbreviazioni: A-SICI = ampiezza dell'inibizione intracorticale a breve intervallo; T-SICI = variazioni di soglia nell'inibizione intracorticale a breve intervallo; MEP = potenziale evocato dal motore; RMT = soglia del motore a riposo. Fare clic qui per visualizzare una versione più grande di questa figura.
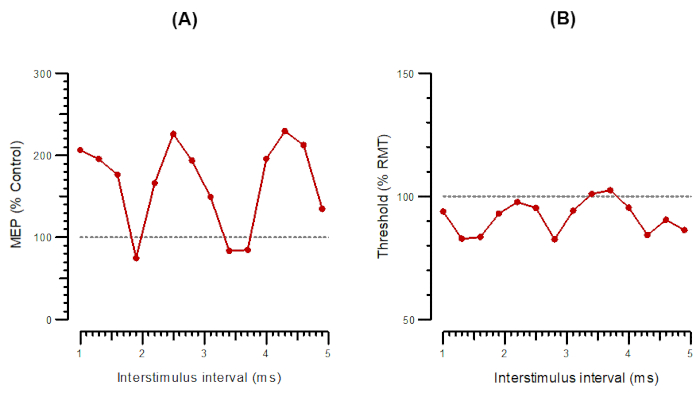
Figura 4: A-SICF e T-SICF tracciati in funzione di intervalli interstimoli da 1 ms a 4,9 ms. (A) A-SICF tracciato come ampiezza della risposta condizionata come percentuale di controllo. (B) T-SICF tracciato come variazioni di soglia (inibizione come percentuale di controllo). Abbreviazioni: A-SICF = ampiezza della facilitazione intracorticale a breve intervallo; T-SICF = variazioni di soglia nella facilitazione intracorticale a breve intervallo; MEP = potenziale evocato dal motore; RMT = soglia del motore a riposo. Fare clic qui per visualizzare una versione più grande di questa figura.
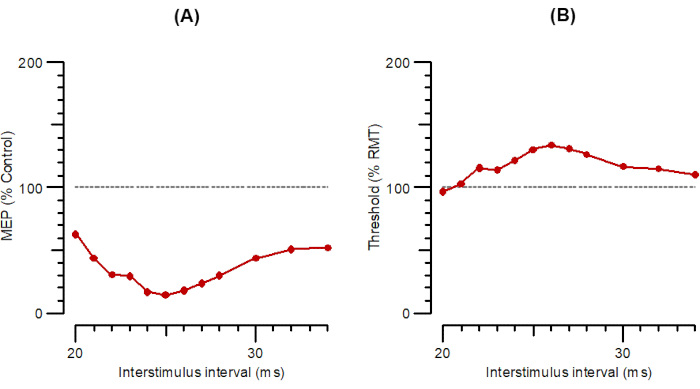
Figura 5: A-SAI e T-SAI tracciati in funzione di intervalli interstimoli da 20 ms a 35 ms. (A) A-SAI tracciati come ampiezza della risposta condizionata come percentuale di controllo. (B) T-SAI tracciato come variazioni di soglia (inibizione come percentuale di controllo). Abbreviazioni: A-SAI = ampiezza dell'inibizione afferente a bassa latenza; T-SAI = variazioni di soglia nell'inibizione afferente a bassa latenza; MEP = potenziale evocato dal motore; RMT = soglia del motore a riposo. Fare clic qui per visualizzare una versione più grande di questa figura.
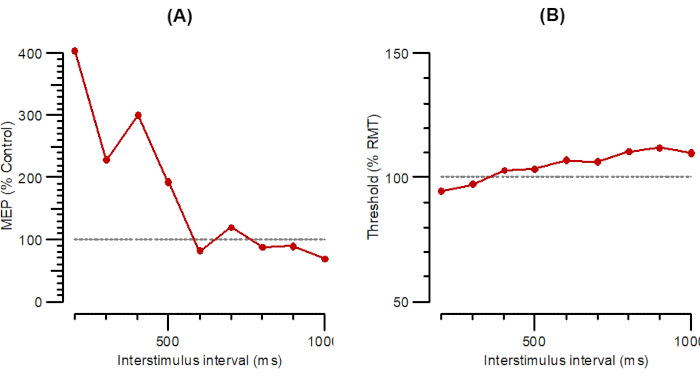
Figura 6: A-LAI e T-LAI tracciati in funzione di intervalli interstimoli da 200 ms a 1000 ms. (A) A-LAI tracciato come ampiezza della risposta condizionata come percentuale di controllo. (B) T-LAI tracciato come variazioni di soglia (inibizione come percentuale di controllo). Abbreviazioni: A-LAI = ampiezza dell'inibizione afferente a lunga latenza; T-LAI = variazioni di soglia nell'inibizione afferente a lunga latenza; MEP = potenziale evocato dal motore; RMT = soglia del motore a riposo. Fare clic qui per visualizzare una versione più grande di questa figura.
Tabella 1: I protocolli TMS disponibili nel software. Abbreviazioni: TMS = stimolazione magnetica transcranica; SICI = Inibizione intracorticale a breve intervallo; SICF = Facilitazione intracorticale a breve intervallo; LICI = Inibizione intracorticale a lungo intervallo; SAI = Inibizione afferente a bassa latenza; LAI = Inibizione afferente a lunga latenza; μV = microvolt. Fare clic qui per scaricare questa tabella.
Discussione
La misurazione TMS, come programmata nel software di registrazione, è una procedura altamente automatizzata. Tuttavia, è necessaria particolare attenzione per ottenere risultati affidabili. Nella fase di registrazione, è importante garantire una risposta MEP coerente sull'hotspot e quindi mantenere la bobina nella stessa posizione rispetto al cranio del soggetto durante l'intera registrazione. Poiché la vigilanza ha un'influenza prominente sull'eccitabilità corticale20, è necessaria un'attenzione particolare per mantenere il soggetto rilassato ma vigile.
Per mantenere l'argomento vigile, è necessario porre regolarmente brevi domande. Inoltre, l'esaminatore dovrebbe tenere d'occhio le contrazioni muscolari per accertare se il muscolo bersaglio viene stimolato. Inoltre, l'esaminatore dovrebbe monitorare lo schermo per osservare se l'ampiezza del MEP o le variazioni di soglia indicano uno spostamento della bobina, oltre a controllare il contorno sulla cuffia. Se la bobina è stata spostata, l'utente dovrebbe provare a sostituirla in posizione usando il disegno. Se questo non riesce, la registrazione deve essere riavviata. L'influenza dello spostamento della bobina è minimizzata in questi protocolli dall'ordine pseudocasuale degli ISI e dando uno stimolo da solo test dopo ogni serie di tre stimoli accoppiati. Un altro modo per consentire di tracciare la posizione di una bobina TMS in tempo reale è tramite un sistema di neuronavigazione. Tali sistemi sono disponibili in commercio ed efficaci; tuttavia, l'alto costo limita il loro utilizzo. Si prega di notare che qui non vengono forniti dati su pazienti con SLA o altre malattie neurodegenerative. Ulteriori sfide possono sorgere in questi pazienti come basse ampiezze dovute alla perdita di motoneuroni periferici, attività spontanea e ineccitabilità.
Tutti i protocolli di questo studio (single- e paired-pulse) sono stati effettuati con una bobina a figura di otto (Magstim, D70 Remote coil) collegata a un modulo Bistim2 . Questo è stato fatto per mantenere una forza comparabile del campo magnetico tra i protocolli in quanto lo stimolo viene attenuato quando passa attraverso il modulo Bistim. Il sistema è stato impostato sulla modalità Independent Bistim Triggering che consente l'attivazione esterna individuale delle due unità Magstim 2002 . Per i protocolli a impulso singolo, l'intensità di una delle unità è stata impostata su 0% MSO. Le registrazioni vengono effettuate utilizzando un protocollo di registrazione, che fa parte di un programma software. Per gli altri tipi di stimolatori magnetici, è necessaria una sola unità.
Una limitazione del metodo TMS è la variabilità. Studi precedenti hanno dimostrato che la variabilità interindividuale è superiore alla variabilità infragiornaliera o intergiornaliera sullo stesso soggetto19,21. Si dovrebbe prestare attenzione alla standardizzazione del metodo e all'eliminazione di possibili errori tecnici che possono influire sull'affidabilità. TMS non può essere usato in determinate condizioni come pazienti con pacemaker o epilessia. Le norme internazionali in materia di sicurezza dovrebbero essere seguite22. Inoltre, ci si può aspettare un leggero disagio, in particolare se si utilizza una bobina circolare23. Tuttavia, il disagio è spesso minimo e non è necessario causare l'interruzione dell'esame.
I metodi descritti in questo manoscritto sono automatizzati sia per le registrazioni che per le analisi rispetto ai metodi esistenti. Ciò consente di eseguire le registrazioni da un singolo operatore e l'operatore non ha bisogno di interferire con nient'altro che mantenere la bobina nello stesso posto. Ogni protocollo è stato progettato per richiedere ~ 10 minuti, il che rende possibile eseguire diversi protocolli in un'ora, il tempo che probabilmente richiederà per un protocollo con i metodi manuali esistenti. Gli stimoli magnetici vengono erogati ogni 4 s in questo studio; tuttavia, altri dispositivi magnetici consentono una stimolazione più rapida, consentendo di ridurre la durata della registrazione per ciascun protocollo a meno di 5 minuti. Il software qui descritto consente anche la selezione di diversi ISI, il numero di stimoli per ogni ISI e il livello di stimolo di condizionamento. Un importante progresso del metodo qui descritto è una funzione di gating, che rimuove automaticamente le tracce quando il soggetto non è rilassato.
In conclusione, i metodi qui descritti possono fornire informazioni preziose per comprendere i meccanismi alla base di diversi disturbi cerebrali, in particolare i disturbi neurodegenerativi, come la SLA, e possono avere un valore diagnostico. Sono necessari ulteriori studi per diverse popolazioni di pazienti e gruppi più ampi per determinare il valore diagnostico delle misure TMS convenzionali e di monitoraggio delle soglie e se queste misure possono effettivamente essere utilizzate come biomarcatori per le malattie neurodegenerative. Sono inoltre giustificati studi che registrano TMS in diversi muscoli e negli arti superiori e inferiori.
Divulgazioni
HB e JH ricevono royalties da UCL per le vendite del software Qtrac utilizzato in questo studio. Gli altri autori non hanno potenziali conflitti di interesse.
Riconoscimenti
Questo studio è stato sostenuto finanziariamente principalmente dalle due sovvenzioni della Lundbeck Foundation (numero di sovvenzione R290-2018-751) e dell'Independent Research Fund Denmark (numero di sovvenzione: 9039-00272B).
Materiali
| Name | Company | Catalog Number | Comments |
| 50 Hz Noise Eliminator | Digitimer Ltd | Humbug | |
| Analogue-to-Digital Converter | National Instruments | NI-6221 | |
| Recording program | Digitimer Ltd (copyright University College London) | QtracS.EXE | |
| TMS recording protocol | Digitimer Ltd (copyright QTMS Science) | QTMSG-12 recording protocol | |
| Disposable surface recording electrodes | AMBU | Ambu® BlueSensor NF | |
| Figure-of-8 coil | Magstim Co. Ltd, Whiteland, Wales, UK | Magstim® D70 Remote Coil | |
| Isolated EMG amplifier | Digitimer Ltd | D440 | |
| Isolated linear bipolar constant-current stimulator | Digitimer Ltd | DS5 | |
| TMS device | Magstim Co. Ltd, Whiteland, Wales, UK | Magstim® 2002 stimulators (2 MagStim units are required ) | |
| Analysis and plotting program | Digitimer Ltd (copyright University College London) | QtracP.EXE |
Riferimenti
- Rawji, V., Latorre, A., Sharma, N., Rothwell, J. C., Rocch, L. On the use of TMS to investigate the pathophysiology of neurodegenerative diseases. Frontiers in Neurology. 11, 584664 (2020).
- Rossini, P. M., et al. Non-invasive electrical and magnetic stimulation of the brain, spinal cord, roots and peripheral nerves: Basic principles and procedures for routine clinical and research application. An updated report from an I.F.C.N Committee. Clinical Neurophysiology. 126 (6), 1071-1107 (2015).
- Ziemann, U., Rothwell, J. C., Ridding, M. C. Interaction between intracortical inhibition and facilitation in human motor cortex. Journal of Physiology. 496, 873-881 (1996).
- Ziemann, U., Tergau, F., Wischer, S., Hildebrandt, J., Paulus, W. Pharmacological control of facilitatory I-wave interaction in the human motor cortex. A paired transcranial magnetic stimulation study. Electroencephalography and Clinical Neurophysiology. 109 (4), 321-330 (1998).
- Premoli, I., et al. Short-interval and long-interval intracortical inhibition of TMS-evoked EEG potentials. Brain Stimulation. 11 (4), 818-827 (2018).
- Ilic, T. V., et al. Short-interval paired-pulse inhibition and facilitation of human motor cortex: the dimension of stimulus intensity. Journal of Physiology. 545 (1), 153-167 (2002).
- Peurala, S. H., Muller-Dahlhaus, J. F., Arai, N., Ziemann, U. Interference of short-interval intracortical inhibition (SICI) and short-interval intracortical facilitation (SICF). Clinical Neurophysiolology. 119 (10), 2291-2297 (2008).
- Tokimura, H., et al. Short latency inhibition of human hand motor cortex by somatosensory input from the hand. Journal of Physiology. 523, 503-513 (2000).
- Chen, R., Corwell, B., Hallett, M. Modulation of motor cortex excitability by median nerve and digit stimulation. Experimental Brain Research. 129 (1), 77-86 (1999).
- Turco, C. V., et al. long-latency afferent inhibition; uses, mechanisms and influencing factors. Brain Stimululation. 11 (1), 59-74 (2018).
- Di Lazzaro, V., et al. Effects of lorazepam on short latency afferent inhibition and short latency intracortical inhibition in humans. Journal of Physiolology. 564, 661-668 (2005).
- Fisher, R. J., Nakamura, Y., Bestmann, S., Rothwell, J. C., Bostock, H. Two phases of intracortical inhibition revealed by transcranial magnetic threshold tracking. Experimental Brain Research. 143 (2), 240-248 (2002).
- Awiszus, F., Feistner, H., Urbach, D., Bostock, H. Characterisation of paired-pulse transcranial magnetic stimulation conditions yielding intracortical inhibition or I-wave facilitation using a threshold-hunting paradigm. Experimental Brain Research. 129 (2), 317-324 (1999).
- Vucic, S., Kiernan, M. C. Novel threshold tracking techniques suggest that cortical hyperexcitability is an early feature of motor neuron disease. Brain. 129, 2436-2446 (2006).
- Vucic, S., et al. Utility of threshold tracking transcranial magnetic stimulation in ALS. Clinical Neurophysiolology Practice. 3, 164-172 (2018).
- Vucic, S., Kiernan, M. C. Axonal excitability properties in amyotrophic lateral sclerosis. Clinical Neurophysiolology. 117 (7), 1458-1466 (2006).
- Vucic, S., Howells, J., Trevillion, L., Kiernan, M. C. Assessment of cortical excitability using threshold tracking techniques. Muscle Nerve. 33 (4), 477-486 (2006).
- Tankisi, H., et al. Short-interval intracortical inhibition as a function of inter-stimulus interval: Three methods compared. Brain Stimululation. 14 (1), 22-32 (2021).
- Samusyte, G., Bostock, H., Rothwell, J., Koltzenburg, M. Short-interval intracortical inhibition: Comparison between conventional and threshold-tracking techniques. Brain Stimululation. 11 (4), 806-817 (2018).
- Noreika, V., et al. Alertness fluctuations when performing a task modulate cortical evoked responses to transcranial magnetic stimulation. Neuroimage. 223, 117305 (2020).
- Boroojerdi, B., Kopylev, L., Battaglia, F., et al. Reproducibility of intracortical inhibition and facilitation using the paired-pulse paradigm. Nerve. 23 (10), 1594-1597 (2000).
- Rossi, S., et al. Safety and recommendations for TMS use in healthy subjects and patient populations, with updates on training, ethical and regulatory issues: Expert Guidelines. Clinical Neurophysiolology. 132 (1), 269-306 (2021).
- Ørskov, S., et al. Comparison of figure-of-8 and circular coils for threshold tracking transcranial magnetic stimulation measurements. Neurophysiologie Clinique. 51 (2), 153-160 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon