È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Pinzette magnetiche ad alta velocità per misure nanomeccaniche su elementi sensibili alla forza
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, descriviamo una configurazione di pinzette magnetiche ad alta velocità che esegue misurazioni nanomeccaniche su biomolecole sensibili alla forza alla velocità massima di 1,2 kHz. Presentiamo la sua applicazione a forcine di DNA e complessi SNARE come sistemi modello, ma sarà applicabile anche ad altre molecole coinvolte in eventi meccanobiologici.
Abstract
Le pinzette magnetiche a singola molecola (MT) sono servite come potenti strumenti per interrogare con forza le biomolecole, come gli acidi nucleici e le proteine, e sono quindi pronte per essere utili nel campo della meccanobiologia. Poiché il metodo si basa comunemente sul tracciamento basato su immagini delle sfere magnetiche, il limite di velocità nella registrazione e nell'analisi delle immagini, così come le fluttuazioni termiche delle perle, ha a lungo ostacolato la sua applicazione nell'osservazione di piccoli e veloci cambiamenti strutturali nelle molecole bersaglio. Questo articolo descrive metodi dettagliati per la costruzione e il funzionamento di una configurazione MT ad alta risoluzione in grado di risolvere dinamiche su scala nanometrica e millisecondi delle biomolecole e dei loro complessi. Come esempi applicativi, vengono dimostrati esperimenti con forcine di DNA e complessi SNARE (meccanismo di fusione a membrana), concentrandosi su come i loro stati transitori e transizioni possono essere rilevati in presenza di forze su scala piconewton. Ci aspettiamo che le MT ad alta velocità continueranno a consentire misurazioni nanomeccaniche ad alta precisione su molecole che rilevano, trasmettono e generano forze nelle cellule, e quindi approfondiscono la nostra comprensione a livello molecolare della meccanobiologia.
Introduzione
Le cellule percepiscono attivamente e rispondono agli stimoli meccanici. In tal modo, molte biomolecole mostrano proprietà dipendenti dalla forza che consentono cambiamenti strutturali dinamici. Esempi ben apprezzati includono canali ionici meccanosensibili ed elementi citoscheletrici che forniscono alle cellule informazioni meccaniche chiave dall'ambiente circostante.
Inoltre, le molecole che mostrano una natura portante unica possono anche essere considerate meccanosensibili in un senso più ampio. Ad esempio, la formazione locale e la fusione di duplex di acidi nucleici, così come strutture di ordine superiore come i G-quadruplex, svolgono ruoli cruciali nella replicazione, nella trascrizione, nella ricombinazione e, più recentemente, nell'editing del genoma. Inoltre, alcune proteine neuronali coinvolte nelle comunicazioni sinaptiche svolgono le loro funzioni generando forze fisiche che superano i livelli delle tipiche interazioni intermolecolari. Indipendentemente dall'esempio studiato, lo studio della nanomeccanica delle biomolecole coinvolte con elevata precisione spaziotemporale si rivelerà molto utile per rivelare i meccanismi molecolari dei processi meccanobiologici associati 1,2,3.
I metodi di spettroscopia di forza a singola molecola sono serviti come potenti strumenti per esaminare le proprietà meccaniche delle biomolecole 2,4,5,6. Possono monitorare i cambiamenti strutturali negli acidi nucleici e nelle proteine in concomitanza con l'applicazione della forza, esaminando così le proprietà dipendenti dalla forza. Due configurazioni ben note sono le pinzette ottiche e le pinzette magnetiche (MT), che impiegano perline di dimensioni micron per manipolare le molecole 5,6,7,8. In queste piattaforme, il polistirene (per le pinzette ottiche) o le perle magnetiche (per le MT) sono legati alle molecole bersaglio (ad esempio, acidi nucleici e proteine) tramite "maniglie" molecolari, tipicamente costituite da brevi frammenti di DNA a doppio filamento (dsDNA). Le perle vengono quindi spostate per esercitare forza e visualizzate per tracciare le loro posizioni che riportano i cambiamenti strutturali nelle molecole bersaglio. Le pinzette ottiche e magnetiche sono in gran parte intercambiabili nelle loro applicazioni, ma esistono importanti differenze nei loro approcci al controllo della forza. Le pinzette ottiche sono strumenti intrinsecamente posizionati che intrappolano le perline in posizione, a causa delle quali la forza applicata fluttua quando un costrutto bersaglio subisce cambiamenti di forma; L'aumento dell'estensione, ad esempio dall'apertura, allenta il cavo e riduce la tensione e viceversa. Sebbene il feedback attivo possa essere implementato per controllare la forza nelle pinzette ottiche, gli MT al contrario funzionano naturalmente come un dispositivo di morsetto, sfruttando le forze magnetiche stabili e a campo lontano da magneti permanenti, che possono anche resistere alle perturbazioni ambientali.
Nonostante la loro lunga storia e il design semplice, le MT sono rimaste indietro rispetto alle pinzette ottiche nelle loro applicazioni a misurazioni ad alta precisione, in gran parte a causa delle sfide tecniche nel tracciamento rapido delle perline. Recentemente, tuttavia, diversi gruppi hanno condotto congiuntamente un miglioramento multiforme sia dell'hardware che del software per gli strumenti MT 2,9,10,11,12,13,14,15,16,17,18,19 . In questo lavoro, presentiamo un esempio di tale configurazione in esecuzione a 1,2 kHz e descriviamo come usarla per eseguire misurazioni nanomeccaniche su biomolecole sensibili alla forza. Come sistemi modello, utilizziamo forcine di DNA e complessi SNARE neuronali ed esaminiamo i loro rapidi cambiamenti strutturali nel regime di Piconewton. Le forcine per capelli in DNA mostrano semplici transizioni a due stati in un intervallo di forza ben definito20,21, e quindi servono come modelli giocattolo per verificare le prestazioni di una configurazione pinzetta. Poiché le proteine SNARE si assemblano in un complesso sensibile alla forza che guida la fusione di membrana22, sono state anche ampiamente studiate mediante spettroscopia di forza a singola molecola 14,23,24,25. Vengono presentati approcci standard per l'analisi dei dati e l'estrazione di informazioni utili sulla termodinamica e sulla cinetica. Speriamo che questo articolo possa facilitare l'adozione di MT ad alta precisione negli studi meccanobiologici e motivare i lettori a esplorare i propri sistemi di interesse sensibili alla forza.
Protocollo
Tutti i materiali e le attrezzature descritti in questo protocollo sono elencati nella tabella dei materiali. Il software LabVIEW per gestire la configurazione MT ad alta velocità descritta di seguito, così come gli script MATLAB per analizzare i dati di esempio, sono depositati su GitHub (https://github.com/ShonLab/Magnetic-Tweezers) e disponibili pubblicamente.
1. Costruzione di apparecchi
NOTA: Il principio generale della costruzione MT ad alta velocità è simile ai sistemi MT standard e convenzionali, ad eccezione dell'uso di una telecamera CMOS (Complementary Metal Oxide Semiconductor) ad alta velocità e di una sorgente luminosa coerente ad alta potenza (Figura 1). Fare riferimento ad altre fonti per ulteriori descrizioni degli strumenti MT standard 5,26,27.
- Installare un microscopio invertito su un tavolo ottico antivibrante. Installa una fotocamera CMOS ad alta velocità e un frame grabber.
- Costruisci una fase di traduzione per manipolare i magneti in 3D. Montare un palco lineare motorizzato (>escursione di 20 mm) verticalmente sopra un palco XY manuale.
NOTA: Il movimento verticale controlla la forza, mentre lo stadio XY è per l'allineamento manuale dei magneti all'asse ottico per la costruzione iniziale del setup. - Installare un motore passo-passo rotativo e un sistema di cinghie e pulegge per magneti rotanti.
NOTA: La cinghia trasmette il moto rotatorio tra l'albero motore e i magneti che distano pochi centimetri l'uno dall'altro. La rotazione dei magneti è interna alla manipolazione traslazionale. - Montare i magneti. Utilizzare un supporto acrilico (ordinato da un'azienda produttrice; vedere la figura supplementare S1) che possa ospitare saldamente due magneti identici in parallelo, con uno spazio ben definito di 1 mm tra i magneti (Figura 1B). Per utilizzare la forza massima ottenibile con una data coppia di magneti, regolare la posizione verticale dello stadio di traslazione in modo che la superficie inferiore dei magneti si allinei con il piano del campione quando viene spostato nella posizione più bassa.
NOTA: Fare riferimento a Lipfert et al. per ulteriori informazioni sul design del supporto e sulla configurazione dei magneti28. L'altezza e l'orientamento dei magneti sono controllati dal software LabVIEW in combinazione con l'acquisizione dei dati. - Visualizzazione con un obiettivo a basso ingrandimento, allineare i magneti al centro del campo visivo. Verificare che la rotazione dei magneti non causi un grande spostamento del centro della coppia di magneti.
NOTA: Se il punto medio tra i magneti ruota attorno all'asse di rotazione, è probabile che i magneti siano decentrati a causa di un supporto imperfetto. Un piccolo livello di disallineamento rispetto alla dimensione dello spazio è tollerabile, poiché la rotazione del magnete serve solo per controllare i cavi e applicare coppie in applicazioni specifiche. - Installare un diodo superluminescente (SLD) per l'illuminazione delle perline. Far passare il fascio attraverso lo spazio di 1 mm tra i due magneti. Assicurarsi che il raggio sia correttamente collimato per adattarsi allo spazio e che l'illuminazione non sia ombreggiata dai magneti.
- Installare uno scanner per lenti piezoelettriche sul nasello e montare un obiettivo a immersione in olio 100x (apertura numerica [NA]: 1,45) per il tracciamento delle perline. Per evitare potenziali artefatti nel tracciamento dei risultati, assicurarsi che l'illuminazione sia mantenuta uniformemente quando i magneti vengono spostati. Infine, regola il livello di luce alla massima luminosità senza saturare i pixel.
NOTA: Per il confronto di diverse sorgenti luminose per il tracciamento ad alta velocità delle perline, fare riferimento a Dulin et al.29.
2. Calibrazione della forza magnetica
- Usando la reazione a catena della polimerasi (PCR; vedi Tabella 1), preparare frammenti di dsDNA a 5 kbp (usando Primer B, Primer Z_5k e λ-DNA) che sono etichettati con biotina su un'estremità (per l'attacco superficiale) e azide sull'altra estremità (per l'attacco del tallone).
- Seguendo la sezione 6, preparare una cella a flusso con le molecole da 5 kbp.
- Seguendo la sezione 7, identificare un buon costrutto bead-tether verificandone l'estensione e la rotazione. In particolare, assicurati di scegliere un tallone con una traiettoria di rotazione minima (cioè con un raggio <200 nm) per ridurre al minimo l'offset dell'altezza del tallone a causa dell'attacco decentrato30,31. Una volta identificato un buon legame, iniziare il tracciamento delle perline, facendo riferimento alla sezione 9.
- Se la configurazione è nuova, caratterizzarne il rumore e la stabilità per misurazioni affidabili ad alta risoluzione. Posizionare il magnete a ~3 mm dalla superficie della cella di flusso (per applicare >10 pN e sopprimere il moto browniano di una perla), tracciare la posizione z della perla a 1,2 kHz e calcolare la deviazione di Allan (AD) dalla serie di tempi delle coordinate z 32,33 (Figura 2C). Verificare che valori di AD di pochi nanometri siano ottenibili nel regime ad alta velocità (<0,1 s) e che il tracciamento differenziale (posizione del tallone magnetico rispetto a un tallone di riferimento) riduca l'AD nella scala temporale più lunga.
NOTA: in genere otteniamo un AD di <3 nm alla velocità massima (risoluzione di 1,2 kHz o 0,83 ms) e l'AD continua a diminuire almeno fino a 10 s, il che implica una deriva minima. Altri hanno riportato valori simili su configurazioni simili 9,10,11,12,34. - Con i magneti in posizione di riposo (F ~ 0 pN), registrare le coordinate x e y del tallone legato a 1,2 kHz. Registrare la posizione per un periodo sufficientemente lungo (cioè sufficientemente più lungo del tempo di rilassamento caratteristico della fluttuazione35) in modo che il moto browniano sia sufficientemente campionato.
NOTA: Qui, la direzione x è lungo la direzione del campo magnetico, mentre il movimento in y rappresenta il moto trasversale perpendicolare al campo. - Avvicinare i magneti alla cella di flusso e ripetere le misurazioni della posizione del tallone fino a quando i magneti toccano delicatamente la parte superiore della cella di flusso. Muoversi a grandi passi (ad esempio, 1-2 mm) quando i magneti si trovano a più di 7 mm di distanza dal piano del campione (poiché la forza applicata aumenta lentamente nel campo lontano dei magneti), ma ridurre gradualmente la dimensione del passo (ad esempio, 0,1-0,5 mm) man mano che si avvicinano per una calibrazione più fine a livelli di forza più elevati (Figura 2B).
- Calcola la forza in ciascuna posizione del magnete, d, utilizzando uno dei due metodi alternativi (viene fornito uno script MATLAB "force calibration.m" che include entrambi i metodi; vedi File supplementare 1).
- Misurare la varianza delle coordinate
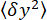 y del tallone (Figura 2D) e la posizione z media del tallone rispetto alla posizione
y del tallone (Figura 2D) e la posizione z media del tallone rispetto alla posizione 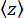 più bassa (Figura 2B, in basso). Quindi, utilizzare l'equazione (1)7,27,36 per stimare la forza (con un raggio fisso del tallone R = 1.400 nm ed energia termica kRT = 4,11 pN∙nm):
più bassa (Figura 2B, in basso). Quindi, utilizzare l'equazione (1)7,27,36 per stimare la forza (con un raggio fisso del tallone R = 1.400 nm ed energia termica kRT = 4,11 pN∙nm):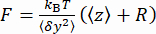 (1)
(1) - In alternativa, calcolare la densità spettrale di potenza (PSD) delle coordinate y, Sy (Figura 2E). Determinare la forza applicata F adattando un modello lorentziano doppio37 alla misura Sy usando l'equazione (2).
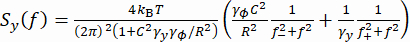 (2)
(2)
Qui, , R è il raggio del tallone, γ ye γφ sono rispettivamente i coefficienti di resistenza traslazionale e rotazionale (stimati dall'equazione di Stokes-Einstein), kRT è l'energia termica,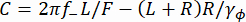 f+ e f- sono due frequenze caratteristiche ottenute usando l'equazione (3).
f+ e f- sono due frequenze caratteristiche ottenute usando l'equazione (3).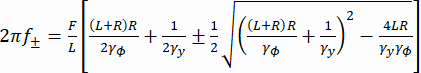 (3)
(3)
NOTA: Poiché l'estensione del cavo L è una funzione della forza che segue il modello WLC (Worm-Like Chain) ben consolidato, le espressioni precedenti lasciano F come unico parametro di adattamento (fissiamo R a 1.400 nm per semplicità perché è condiviso tra tutti i livelli di forza e il valore esatto non influenza sensibilmente i risultati). Quando necessario, il motion blur e l'aliasing dall'acquisizione di immagini basate su telecamera devono essere considerati38,39, ma questo effetto è trascurabile nelle nostre misurazioni ad alta velocità superiori a 1 kHz con cavi a 5 kbp.
- Misurare la varianza delle coordinate
- Ripetere i passaggi 2.4-2.7 per alcuni altri costrutti. Sonda da tre a cinque diverse perle per calcolare la media della variabilità della forza tra le sfere magnetiche.
NOTA: La variazione di forza tra le sfere magnetiche in uso deve essere considerata per determinare il numero corretto di costrutti per la media. Questa variabilità è piccola ma può portare a più di 1 pN di errore nella forza misurata, anche per i prodotti commerciali31. Per la maggior parte delle applicazioni, in cui la determinazione assoluta delle forze coinvolte non è cruciale, la media dei risultati di calibrazione da tre a cinque sfere è generalmente sufficiente. Un approccio alternativo per tenere conto di questa variazione è misurare la forza con singoli legami all'inizio dell'esperimento, che può richiedere molto tempo. Un'altra opzione è quella di incorporare strutture a forcina che si decomprimono a livelli di forza noti in ogni costrutto31. - Tracciare la forza misurata in funzione della distanza del magnete e adattare una doppia funzione esponenziale ai dati (Figura 2F) utilizzando l'equazione (4).
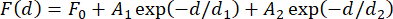 (4)
(4)
Qui, F0 (linea di base), A 1 e A 2 (ampiezze) e d 1 e d 2 (costanti di decadimento) sono parametri di adattamento. Assicuratevi che i valori di forza dei due metodi, così come i doppi adattamenti esponenziali risultanti, concordino ampiamente (Figura 2F,G).
NOTA: per verificare che la calibrazione della forza sia stata eseguita correttamente, verificare la relazione forza-estensione dei costrutti sondati tracciando l'estensione rispetto alla forza misurata. - Per correggere l'offset z off dell'altezza del tallone risultante dall'inclinazione dipendente dalla forza delle sfere magnetiche30,31, stimare z off dall'offset laterale x off, considerando la geometria di un cavo decentrato con un raggio del tallone usando l'equazione (5) e applicare i valori ai valori di estensione misurati. Questo passaggio è implementato nello script MATLAB "force calibration.m" (righe 252-254).
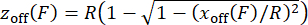 (5)
(5)
NOTA: Sebbene questa correzione apporti piccole modifiche all'estensione, specialmente per le perle con un piccolo raggio di rotazione (<200 nm), questo offset spesso influisce in modo critico sulla risposta elastica, come si vede nel passaggio dalla Figura 2H alla Figura 2I30,31. - Controllare la lunghezza di persistenza Lp adattando un modello WLC estensibile ai dati utilizzando l'equazione (6).
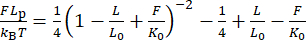 (6)
(6)
Qui, L 0 è la lunghezza del contorno (1,7 μm per 5 kbp) e K0 è il modulo per lo stretching entalpico.
NOTA: Sebbene l'L p del dsDNA sia ben accettato per essere 40-50 nm in un tipico tampone come la soluzione salina tamponata con fosfato (PBS), la formula WLC applicata alle molecole corte (<5 kbp) sottostima sistematicamente L p mentre L 0 diminuisce31,40. Questo perché il modello WLC classico presuppone un polimero la cui lunghezza della catena è sufficientemente più lunga della sua lunghezza di persistenza. Qui, abbiamo ottenuto L p = 40 ± 3 nm per il costrutto 5 kbp (Figura 2H), e la correzione dell'estensione ha ulteriormente prodotto un K0 omogeneo di 1.100 ± 200 pN (Figura 2I). L'applicazione di un modello WLC finito 31,40, così come una correzione per la non-gaussianità nella distribuzione di estensione 41, aumenterà leggermente Lp. - Una volta verificata la calibrazione della forza, applicare i parametri di adattamento ottenuti del modello a doppia esponenziale al software LabVIEW fornito (Supplemental File 2) e attendere che il software calcoli la forza corrente in tempo reale dalle letture del motore (ad esempio, posizione del magnete). Poiché non è disponibile un'espressione analitica per la funzione inversa d(F), preparare una tabella di ricerca di d rispetto a F in incrementi di 0,1 pN mediante stima numerica dei livelli di forza target d. Memorizza questa tabella anche nel software per comandare il controllo della forza.
3. Sintesi di forcine per capelli a DNA
NOTA: I costrutti a forcina di DNA per esperimenti di MT sono preparati mediante amplificazione PCR di una regione di 510 bp in λ-DNA con due primer personalizzati, uno dei quali contiene una struttura a forcina sulla sua estremità 5' (Figura 3A). In questo modo, un motivo a forcina viene posizionato a un'estremità del prodotto PCR.
- Preparare i primer.
- Primer in avanti: B_hp di primer marcato con 5′-biotina per l'attacco della superficie del vetro e si lega all'λ-DNA. Questo primer contiene un motivo a forcina con uno stelo da 8 bp e un anello da 6 nt, 5' alla regione di legame λ.
- Primer inverso: Primer Z_hp marcato con 5′-azide per l'attacco magnetico del tallone e si lega al λ-DNA a 1 kbp di distanza dal primer anteriore.
- Impostare ed eseguire la PCR con λ-DNA (modello), nTaq polimerasi e condizioni standard di PCR (vedere Tabella 1). Pulire il prodotto con un kit di purificazione commerciale.
- Misurare la concentrazione di DNA mediante assorbimento UV a 260 nm (A260) ed eseguire l'elettroforesi su gel di agarosio (gel al 2%) (vedere Tabella 2) per verificare le dimensioni del prodotto. Una resa tipica è ~ 35 μL di ~ 600 nM soluzione.
4. Preparazione delle proteine SNARE
NOTA: I complessi SNARE neuronali sono assemblati combinando tre proteine purificate di ratto espresse da E. coli: VAMP2/sinaptobrevina-2, sintassina-1A e SNAP-25 (Figura 3B). Per facilitare il loro assemblaggio, la sintassi e SNAP-25 sono co-espressi con un frammento VAMP2 (privo della regione N-terminale; definito "ΔN-VAMP2") in una struttura chiamata "ΔN-complesso", e poi mescolato con VAMP2 a lunghezza intera dopo l'attaccamento del DNA per formare complessi completi.
- Preparare plasmidi contenenti cDNA per l'espressione delle proteine SNARE (le sequenze di DNA per tutti i plasmidi sono riportate nella Tabella dei Materiali).
- Preparare VAMP2 marcato 6×His-His, privo del dominio transmembrana (2-97; L32C/I97C per i legami disolfuro) clonato in un vettore pET28a.
- Preparare la sintassina-1A priva di Habc e del dominio transmembrana (sostituzioni 191-267, I202C/I266C per legami disolfuro) clonato insieme a ΔN-VAMP2 marcato 6×His-(49-96) in un vettore pETDuet-1.
- Preparare l'isoforma b (2-206, tutta C ad A) clonata in un vettore pET28a. Questo sarà utilizzato per la preparazione di complessi ΔN.
- Preparare l'isoforma b (1-206, tutta C ad A) clonata in un vettore pET28a per l'aggiunta diretta al buffer di analisi MT con tag 6×His.
- Preparare due provette di cellule di E . coli di Rosetta (DE3). Trasformare un gruppo con plasmidi VAMP2 (dal punto 4.1.1), uno con entrambi i plasmidi sintassina-1A/ΔN-VAMP2 e SNAP-25 non marcati (dai punti 4.1.2 e 4.1.3) per esprimere il complesso ΔN, e l'altro con plasmidi SNAP-25 marcati con His-(dal punto 4.1.4).
- Trasferire le cellule trasformate in brodo di Luria-Bertani (LB) con antibiotici appropriati (qui, kanamicina e cloramfenicolo per VAMP2 e SNAP-25 con tag His; kanamicina, cloramfenicolo e ampicillina per il complesso ΔN). Coltivarli a 37 °C in un'incubatrice agitatrice (220 rpm) fino a quando la densità ottica (OD) del brodo raggiunge 0,7-0,9.
- Aggiungere 1 mM di isopropile β-d-1-tiogalattopiranoside (IPTG) per indurre l'espressione proteica e incubare le cellule per 3-4 ore a 37 °C in un incubatore agitatore (220 rpm).
- Pellet le cellule centrifugando la coltura a 4.500 × g per 15 minuti a 4 °C.
- Preparare tamponi per la purificazione delle proteine (vedere Tabella 2).
- Sospendere i pellet cellulari che esprimono SNARE in 40 ml di tampone di lisi ghiacciato e lisare le cellule mediante sonicazione su ghiaccio (ampiezza 15%, 5 s on e 5 s off, 30 min totali).
- Centrifugare il lisato a 15.000 × g per 30 minuti a 4 °C per rimuovere i materiali insolubili.
- Far passare il surnatante attraverso una colonna gravitazionale riempita con 1 mL di resina Ni-NTA. Lavare la resina con tampone di lavaggio A, quindi con tampone di lavaggio B ed eluire le proteine con 10 ml di tampone di eluizione.
- Rimuovere tris(2-carbossietil)fosfina (TCEP) e imidazolo dall'eluente utilizzando una colonna di desalinizzazione (seguire le istruzioni del produttore). Eluire il campione con PBS.
- Concentrare le proteine con filtri centrifughi (cutoff di 10 kDa) a ~70 μM mantenendo le proteine in PBS (producendo tipicamente 2 ml). Misurare la concentrazione proteica mediante assorbimento ultravioletto (UV) a 280 nm (A280) o mediante il saggio di Bradford.
- Preparare piccole aliquote, congelare in azoto liquido e conservare a -80 °C fino all'uso.
NOTA: I complessi SNARE completi saranno assemblati dopo aver coniugato il complesso ΔN su un manico di DNA (vedi sotto).
5. Attacco delle maniglie del DNA
NOTA: Due maniglie di dsDNA da 510 bp contenenti gruppi amminici primari su un'estremità vengono prima preparati mediante PCR e i gruppi amminici vengono quindi convertiti in gruppi maleimmide utilizzando un reticolante bifunzionale, SM (PEG) 2. I due manici sono quindi legati covalentemente ai complessi SNARE attraverso i loro gruppi di cisteina per la coniugazione sito-specifica (Figura 3B).
- Preparare i primer.
- Preparare primer in avanti: Primer B (per amplificare il manico B) che è marcato con 5′-biotina per l'attacco della superficie del vetro e si lega al λ-DNA; Primer Z (per amplificare Handle Z) che è etichettato con 5′-azide per l'attacco del tallone magnetico e ha la stessa sequenza del Primer B.
- Preparare un primer inverso: Primer N (condiviso per Handle B e Handle Z) che è marcato con 5′-ammina per la coniugazione proteica e si lega al λ-DNA a 510 bp di distanza dal primer anteriore.
- Impostare ed eseguire due serie di reazioni PCR (18 provette di reazione da 200 μL per ciascuna maniglia) con λ-DNA (modello), nTaq polimerasi e condizioni PCR standard (vedere Tabella 1). Pulire il prodotto con un kit di pulizia PCR ed eluire ogni maniglia con 45 μL di acqua ultrapura. Utilizzare un volume minimo di acqua per ottenere alte concentrazioni di maniglie per una reazione efficace nelle fasi successive.
- Misurare la concentrazione di DNA mediante A260. La resa tipica è ~650 μL di ~2 μM di soluzione per ogni maniglia. Tenere piccoli campioni separati per una successiva verifica nell'elettroforesi su gel di agarosio.
- Reagisci ogni impugnatura (1 μM in PBS) con 5 mM SM(PEG)2. Incubare a temperatura ambiente con una leggera rotazione. Dopo 1 ora, utilizzare un kit di purificazione del DNA per rimuovere SM(PEG)2 non reagito. Eluire ogni maniglia con 250 μL di PBS per ottenere ~2 μM di soluzioni.
- Mescolare le soluzioni di Handle B e ΔN-complex ad un rapporto molare di 1:16 (ad esempio, 1 μM Handle B e 16 μM ΔN-complex) in PBS e incubare per 2 ore a temperatura ambiente con agitazione. Tenere da parte un piccolo campione per l'elettroforesi su gel di agarosio.
- Aggiungere una soluzione di VAMP2 in un eccesso molare di 2,5 volte sul complesso ΔN utilizzato nel passaggio precedente. Incubare la miscela per un'altra 1 ora a temperatura ambiente con agitazione. I complessi SNARE completi sono assemblati in questa fase.
- Rimuovere le proteine libere mediante scambio tampone con PBS fresco e un filtro centrifugo (cutoff 100 kDa): centrifugare a 14.000 × g per 5 minuti a 4 °C, ripetere almeno 6 volte e far funzionare per 15 minuti per l'ultimo giro. Misurare l'aumento del rapporto A260/A280 per monitorare la rimozione delle proteine libere. Tenere da parte un piccolo campione per l'elettroforesi su gel di agarosio.
- Aggiungere il manico Z alla soluzione in un eccesso molare di 15 volte rispetto al manico B. Mantenere la concentrazione del manico Z almeno al di sopra di 1 μM per facilitare la reazione. Incubare la miscela per una notte a 4 °C agitando.
- Verificare gli intermedi (Handle B e i suoi coniugati proteici) e il prodotto finale (complesso SNARE con due maniglie) mediante elettroforesi su gel di agarosio (Figura 3B, riquadro) (vedere Tabella 2).
NOTA: se le proteine sono attaccate correttamente al manico B, verrà rilevato uno spostamento della mobilità. In particolare, la formazione di complessi SNARE completi sulle maniglie del DNA può essere confermata dalla loro resistenza al dodecilsolfato di sodio (SDS), a differenza dei complessi ΔN, che sono disassemblati in SDS e lasciano solo la sintassi legata al DNA (confronta b e c in Figura 3B). - Preparare piccole aliquote, congelare in azoto liquido e conservare a -80 °C fino all'uso.
NOTA: sebbene la soluzione finale contenga maniglie non reagite, durante l'assemblaggio del campione in una cella a flusso verrà selezionato solo il costrutto desiderato doppiamente etichettato con biotina e azide.
6. Fabbricazione di celle a flusso
NOTA: Le celle di flusso per le misure MT sono costituite da due vetrini di vetro incollati insieme da nastro biadesivo (Figura 3C). Un coprislip è rivestito con una miscela di PEG e glicole polietilenico biotinilato (PEG) per evitare legami non specifici e per consentire il legame specifico delle molecole bersaglio tramite il legame biotina-NeutrAvidin (Figura 3D). Quindi, le soluzioni dei materiali per gli esperimenti MT vengono infuse sequenzialmente in una cella di flusso utilizzando una pompa a siringa (Figura 3C, D).
- Preparare due vetrini di vetro, uno ciascuno per la superficie superiore (24 mm × 50 mm, spessore n. 1,5) e uno inferiore (24 mm × 60 mm, spessore n. 1,5). Pulire i coperchi sonicando in 1 M KOH per 30 minuti. Dopo la sonicazione, sciacquare i coperchi con acqua distillata e tenerli in acqua fino al passaggio successivo.
- PEGylate il coprislip inferiore seguendo i protocolli pubblicati42,43. Utilizzare N-[3-(trimetossisilil)propil]etilendiammina per la silanizzazione e una miscela 1:100 (ww) di biotina-PEG-SVA e mPEG-SVA in tampone bicarbonato da 100 mM. Mantenere i coprivetrini PEGilati asciutti a -20 °C e conservarli per alcune settimane.
- Il giorno degli esperimenti, estrarre i foglietti di copertura PEGilati e asciugarli con una pistola ad azoto. Ispezionali visivamente per lo sporco per assicurarti che siano puliti.
- Per realizzare i canali del campione, preparare strisce di nastro biadesivo larghe ~ 2 mm e stendere quattro strisce su un coprivetro inferiore (superficie PEGilata verso l'alto), parallele e separate l'una dall'altra da ~ 5 mm (Figura 3C).
NOTA: In questo modo, è possibile creare tre canali di campionamento larghi 5 mm in una singola cella di flusso. - Posizionare un coprislip superiore al centro del coperchio inferiore, lasciando ~ 5 mm di spazio sui bordi corti per le entrate e le uscite del canale. Premere delicatamente il retro del coperchio superiore con una pinzetta per sigillare saldamente i canali.
- Per creare un serbatoio di ingresso, tagliare il bordo di una punta di pipetta da 200 μL. Tagliare ~10 mm dall'apertura più ampia per consentire di contenere ~200 μL di soluzione. Fatene tre per i tre canali di flusso. Per configurare le prese, preparare tre aghi per siringa che si adattano al tubo per la pompa della siringa.
- Utilizzando resina epossidica di 5 minuti, incollare i serbatoi e i mozzi dell'ago alla cella di flusso. Assicurarsi che si formi una guarnizione completa per evitare perdite e che i canali non siano bloccati con colla in eccesso. Lasciate asciugare per almeno 30 min.
7. Assemblaggio di costrutti bead-tether
NOTA: Le soluzioni dei materiali per gli esperimenti di MT, comprese quelle per i costrutti bead-tether, vengono introdotte sequenzialmente nelle celle a flusso utilizzando una pompa a siringa (Figura 3C,D).
- Preparare perline magnetiche. Prelevare 5 mg di sfere di resina epossidica M270 da una soluzione madre (~3,3 × 108 sfere in 167,5 μL di dimetilformammide) e sostituire il solvente con tampone fosfato (vedere Tabella 2) mediante separazione magnetica delle sfere.
- Preparare le sfere a ~1,1 × 109 sfere mL−1 in un tampone fosfato con 1 M solfato di ammonio e reagire con 2 mM di dibenzocicloottino (DBCO)-NH2. Incubare la miscela per 3 ore su un miscelatore rotante a temperatura ambiente. Dopo la reazione, lavare le perle 3 volte con tampone fosfato fresco per rimuovere le molecole non reagite.
NOTA: Le perle lavate possono essere conservate senza ulteriore rotazione a 4 °C per diverse settimane prima dell'uso. - Collegare un ago all'uscita del canale della cella di flusso alla pompa a siringa con tubi in polietilene. Equilibra i canali con PBS.
- Introdurre le seguenti soluzioni sequenzialmente nel canale mediante aspirazione con la pompa: NeutrAvidin, costrutti target (forcine per capelli di DNA o complessi SNARE con maniglie di DNA), perle di polistirene di riferimento e perle magnetiche rivestite DBCO. Prima dell'uso, vortice accuratamente le soluzioni di perline per disperdere potenziali aggregati di perline.
- Lavare via le perline non legate applicando 0,1 pN di forza.
NOTA: L'applicazione di una piccola forza verso l'alto facilita la rimozione delle perline non legate e aiuta ad evitare la rottura dei costrutti di perline specificamente legati. - Per gli esperimenti con complessi SNARE, includere 1,5 μM SNAP-25 nel buffer finale.
NOTA: Le molecole libere di SNAP-25 possono rilegare i complessi SNARE dopo lo sviluppo e consentire misurazioni ripetute su un singolo complesso.
8. Identificazione dei costrutti target
- Sulla superficie di un canale di cella a flusso, cercare le sfere magnetiche che sono legate da singole molecole del costrutto bersaglio. Assicurati che un tallone di riferimento si trovi nelle vicinanze.
- Ruota un tallone candidato e controlla che ruoti liberamente. Se la perla è legata da più molecole, mostra un movimento vincolato.
- Ruota il tallone per alcuni giri completi e scopri il raggio di rotazione (questa funzione è implementata nel software fornito). Preferibilmente, scegli una perlina con un piccolo raggio di rotazione.
NOTA: Questo raggio indica quanto il tallone è decentrato rispetto all'asse del legatura, che viene determinato casualmente durante l'assemblaggio perlina-cavo30,31. In tutti gli esperimenti, il minimo decentrare un tallone allevia molti artefatti associati all'elevato rapporto di estensione del raggio del tallone e del cavo che utilizziamo. - Aumentare la forza da 0 a 5 pN per identificare buone perline single-lethered. Cerca un grande cambiamento nel modello di diffrazione di una perlina risultante dall'allungamento di un cavo da 1 kbp (o delle due maniglie equivalenti da 510 bp). Se il modello di diffrazione non cambia in modo significativo, ridurre la forza a zero ed eseguire la scansione per un altro tallone candidato.
NOTA: Il sollevamento di ~ 300 nm di una perlina può essere facilmente notato dalle immagini raw senza effettivamente avviare il processo di tracciamento.
9. Inseguimento delle perline per le misure di estensione
NOTA: Il tracciamento delle perline viene eseguito analizzando le immagini delle perline in tempo reale nel software LabVIEW fornito con questo articolo. Il metodo di tracciamento e le sue varianti sono stati utilizzati nella maggior parte dei sistemi MT convenzionali e sono spiegati nella letteratura precedente 2,5,7,26. Misurando la posizione di una scura magnetica rispetto a una perla di riferimento fissa (cioè il tracciamento differenziale), le misurazioni della posizione diventano estremamente robuste per una perturbazione esterna.
- Una volta individuata una perla magnetica corretta insieme a una perlina di riferimento, fare clic sul pulsante Calibra per iniziare a prepararsi per il tracciamento delle perline.
- Fare clic sulle perline nell'immagine per definire le posizioni delle perline. Le immagini verranno quindi ritagliate in regioni di interesse (ROI) (ad esempio, 150 x 150 pixel per una perla da 3 μm) attorno alle perline e quindi ulteriormente analizzate per estrarre le coordinate precise delle perline.
- Attendere il completamento della rotazione del magnete. Questo processo registra le coordinate x e y del tallone (calcolando la correlazione incrociata 2D44 o utilizzando la simmetria radiale45 delle immagini delle perline, con prestazioni comparabili) mentre ruota i magneti per documentare l'attacco decentrato del tallone31.
- Per il tracciamento nella direzione z, attendere che il software generi una tabella di ricerca di immagini di diffrazione delle perline a diverse distanze dal piano focale. Ciò viene effettuato facendo calpestare l'obiettivo con uno scanner piezoelettrico a passi equidistanti e registrando le immagini delle perline mediate dalle fluttuazioni in ogni posizione. Quindi, le coordinate z delle perle negli esperimenti reali vengono determinate confrontando le immagini delle perline in tempo reale con la tabella di ricerca con l'interpolazione7.
- Al termine della generazione della tabella di ricerca, abilitare il tracciamento e la messa a fuoco automatica (premere Track ? e AF? Pulsanti) e fare clic sul pulsante Acquisisci per avviare la registrazione delle posizioni delle perline.
NOTA: la messa a fuoco automatica è facoltativa, ma si consiglia di correggere la deriva dello stadio in z durante l'acquisizione.
10. Schemi di applicazione forzata
- Esperimenti di forza-rampa: Per verificare la relazione forza-estensione del costrutto, applicare una rampa di forza su e giù a una velocità di carico costante (± 1,0 pN s−1) (Figura 4A). Ad esempio, applicate tre arrotondamenti di un ciclo 0-20-0 pN per verificare la lunghezza complessiva del costrutto e la curva forza-estensione delle maniglie.
- Specificando i parametri di tether nel software, sovrapporre una curva di estensione della forza WLC sopra i dati misurati e determinare se il tallone target è legato da un costrutto campione autentico con maniglie di DNA appropriate. Utilizzare la lunghezza nota del contorno (ad esempio, ~340 nm per 1 kbp dsDNA) e la lunghezza di persistenza WLC (30-45 nm per il dsDNA breve31) del costrutto come punto di partenza. Se necessario, applicare il metodo di correzione dell'estensione descritto al punto 2.11.
- Se il costrutto è verificato, esaminare la risposta forza-estensione in dettaglio per cercare un'estensione aggiuntiva risultante dalle molecole bersaglio-forcine o complessi SNARE.
- Esperimenti a forza costante: Variare gradualmente la forza applicata in passi discreti per sondare la sensibilità alla forza delle molecole bersaglio (Figura 4B).
NOTA: Gli MT consentono esperimenti di forza costante semplici ed efficaci perché la forza applicata viene mantenuta costante quando i magneti sono tenuti fermi.- Per le forcine del DNA, applicare 4-8 pN di forza con passi di 0,2-0,5 pN e misurare la posizione del tallone per ~ 10 s a ciascun livello di forza.
- Per i complessi SNARE, applicare 14-16 pN di forza con passi di 0,1-0,2 pN e misurare la posizione del tallone per ~ 10 s a ciascun livello di forza.
- Esperimenti di salto di forza: Osservare gli eventi di transizione dei complessi SNARE.
NOTA: Gli esperimenti di salto di forza, come gli esperimenti di forza costante, comportano cambiamenti nei livelli di forza. Tuttavia, i salti di forza impiegano cambiamenti più bruschi nella forza applicata, consentendo il monitoraggio di eventi innescati dalla forza nelle molecole sondate, come un'improvvisa rottura dei complessi proteici. Ad esempio, poiché i complessi SNARE mostrano isteresi strutturale nel ciclo di forza23, è informativo eseguire esperimenti di salto di forza e misurare la latenza alla transizione (Figura 4C).- Decompressione: Staccamento di una molecola VAMP2 da un complesso SNARE ternario intatto, lasciando un complesso binario di sintassi-1A e SNAP-25.
- Rezipping: Zipping della molecola VAMP2 decompressa per rigenerare un complesso SNARE intatto.
- Svolgimento: Smontaggio completo di un complesso SNARE accompagnato dalla completa dissociazione di SNAP-25. Solo le molecole di VAMP2 e sintassi rimangono nel costrutto dopo lo spiegamento.
- Ripiegatura: Rigenerazione di un complesso SNARE dopo il legame di una molecola libera di SNAP-25 dal tampone.
- A 2 pN, indurre l'assemblaggio di un complesso SNARE intatto aspettando (~30 s) l'associazione di una molecola libera di SNAP25. Un'improvvisa diminuzione dell'estensione si osserva alla formazione di un complesso SNARE.
- Per osservare gli eventi di decompressione, attendere alcuni secondi a 10-12 pN, quindi passare bruscamente a 14-15 pN con la massima velocità del motore possibile. A seconda della forza target, il complesso SNARE mostrerà una transizione reversibile tra intermedi parzialmente decompressi (come negli esperimenti a forza costante) o un salto di ~ 25 nm a uno stato più alto e decompresso dopo un tempo di attesa casuale (o latenza).
- Per osservare gli eventi di ricompressione, abbassare la forza a 10-12 pN immediatamente dopo aver osservato la decompressione. Ancora una volta, il complesso SNARE mostra una transizione stocastica allo stato inferiore, zippato dopo una certa latenza casuale. Se lo sviluppo si è verificato dopo la decompressione, il complesso non riuscirà a ricomprimersi, poiché mancherà una molecola SNAP-25.
- Per osservare gli eventi in corso, attendere un periodo più lungo dopo la decompressione per rilevare un ulteriore aumento dell'estensione (~ 2 nm).
11. Analisi dei dati
NOTA: I tipi di analisi che è possibile condurre con i dati MT dipendono dal sistema di destinazione. Tuttavia, esistono approcci comuni per estrarre informazioni utili dai rispettivi esperimenti descritti nella Figura 4. Tutte le analisi vengono eseguite con MATLAB (R2021a) utilizzando i codici personalizzati forniti con questo articolo. Questi codici generano grafici utilizzando gli stessi dati presentati in questo articolo. Si noti che mentre i dati grezzi dal tracciamento a 100 Hz sono stati presi direttamente per l'analisi, i dati dal tracciamento a 1,2 kHz sono stati tipicamente filtrati mediana (con una finestra scorrevole a cinque punti) prima dell'analisi per ridurre il rumore (ad eccezione dell'analisi del rumore).
- Esperimenti di forza-rampa: Analizzare la relazione forza-estensione (ad esempio, elasticità dei polimeri) e transizione della forza per estrarre informazioni sulle proprietà nanomeccaniche.
- Esperimenti a forza costante: Analizzare le popolazioni statali e il tempo di permanenza (o tasso di transizione) in funzione della forza per estrarre i parametri strutturali (ad esempio, le regioni coinvolte nella transizione), termodinamici (ad esempio, la differenza di energia libera) e cinetici (ad esempio, barriera energetica) dei cambiamenti conformazionali.
- Esperimenti di salto di forza: Analizzare la cinetica di rottura (ad esempio, le interazioni proteina-proteina e il legame recettore-ligando) o la durata di vita di intermedi transitori (ad esempio, lo sviluppo di biomolecole) per estrarre la stabilità delle molecole bersaglio e i loro stati.
- Come applicazioni rappresentative, analizzare i dati campione per forcine di DNA e complessi SNARE:
- Transizioni a due stati di una forcina di DNA: forza di decompressione, distanza di apertura, dipendenza dalla forza dello spostamento della popolazione e assegnazione dello stato e misurazione della velocità di transizione con un modello di Markov nascosto (HMM) (codici MATLAB forniti).
- Cambiamenti conformazionali dei complessi SNARE: forza di decompressione, dipendenza dalla forza degli stati intermedi e latenza di decompressione, isteresi nel rezipping e comportamento di spiegamento/ripiegamento.
NOTA: I modelli di estensione della forza per maniglie del DNA, forcine per capelli del DNA e conformazioni complesse SNARE sono riportati nei riferimenti precedenti14,31.
Risultati
Calibrazione della forza
I risultati dei due metodi di misurazione della forza (varianza dello spostamento laterale delle perle e analisi dello spettro di potenza) differivano di 0-2 pN (Figura 2G). Secondo i risultati della Figura 2F, possiamo raggiungere in modo affidabile fino a 30 pN con magneti al neodimio regolari.
Transizioni a due stati di una forcina di DNA da 8 bp
Per prima cosa abbiam...
Discussione
In questo lavoro, abbiamo introdotto una configurazione di spettroscopia di forza a singola molecola in grado di osservare i cambiamenti strutturali delle biomolecole ad alta precisione spaziotemporale. La telecamera CMOS ad alta velocità utilizzata acquisisce 1.200 fotogrammi s-1 con risoluzione 1.280 x 1.024, consentendo il tracciamento delle perline a 1,2 kHz. Tuttavia, la velocità delle misurazioni è attualmente limitata dal software di tracciamento delle perline, quindi il ROI è in genere ridotto ad a...
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla sovvenzione della National Research Foundation of Korea (NRF) finanziata dal governo coreano (MSIT) (NRF-2022R1C1C1012176, NRF-2021R1A4A1031754 e NRF- 2021R1A6A1A10042944). S.-H.R. è stato sostenuto dalla sovvenzione NRF (2021R1C1C2009717).
Materiali
| Name | Company | Catalog Number | Comments |
| Materials for construct synthesis | |||
| Agarose gel electrophoresis system | Advance | Mupid-2plus | |
| DNA ladder | Bioneer | D-1037 | |
| nTaq polymerase | Enzynomics | P050A | |
| PCR purification kit | LaboPass | CMR0112 | |
| PEGylated SMCC crosslinker / SM(PEG)2 | ThermoFisher Scientific | 22102 | For SNARE–DNA coupling |
| Primer B | Bioneer | 5'-Biotin/TCGCCACCATCATTTCCA-3' | For 5-kbp force calibration construct and DNA handles |
| Primer B_hp | IDT | 5'-Biotin/TTTTTTTTTTGTTCTCTATTT TTTTAGAGAAC /AP site/ /AP site/ TCGCCACCATCATTTCCA-3' | For hairpin construct |
| Primer N | Bioneer | 5'-C6Amine/CATGTGGGTGACGCGAAA-3' | For DNA handles |
| Primer Z | Bioneer | 5'-Azide/TCGCCACCATCATTTCCA-3' | For DNA handles |
| Primer Z_5k | Bioneer | 5'-Azide/TTAGAGAGTATGGGTATATGACA TCG-3' | For 5-kbp force calibration construct |
| Primer Z_hp | Bioneer | 5'-Azide/GTGGCAGCATGACACC-3' | For hairpin construct |
| SYBR Safe DNA Gel Stain | ThermoFisher Scientific | S33102 | |
| λ-DNA | Bioneer | D-2510 | Template strand for PCR |
| DNA sequences for SNARE proteins | |||
| 6×His-tagged SNAP-25b (2-206; capitalized) in pET28a | homemade | tggcgaatgggacgcgccctgtagcggcgca ttaagcgcggcgggtgtggtggttacgcgca gcgtgaccgctacacttgccagcgccctagc gcccgctcctttcgctttcttcccttccttt ctcgccacgttcgccggctttccccgtcaag ctctaaatcgggggctccctttagggttccg atttagtgctttacggcacctcgaccccaaa aaacttgattagggtgatggttcacgtagtg ggccatcgccctgatagacggtttttcgccc tttgacgttggagtccacgttctttaatagt ggactcttgttccaaactggaacaacactca accctatctcggtctattcttttgatttata agggattttgccgatttcggcctattggtta aaaaatgagctgatttaacaaaaatttaacg cgaattttaacaaaatattaacgtttacaat ttcaggtggcacttttcggggaaatgtgcgc ggaacccctatttgtttatttttctaaatac attcaaatatgtatccgctcatgaattaatt cttagaaaaactcatcgagcatcaaatgaaa ctgcaatttattcatatcaggattatcaata ccatatttttgaaaaagccgtttctgtaatg aaggagaaaactcaccgaggcagttccatag gatggcaagatcctggtatcggtctgcgatt ccgactcgtccaacatcaatacaacctatta atttcccctcgtcaaaaataaggttatcaag tgagaaatcaccatgagtgacgactgaatcc ggtgagaatggcaaaagtttatgcatttctt tccagacttgttcaacaggccagccattacg ctcgtcatcaaaatcactcgcatcaaccaaa ccgttattcattcgtgattgcgcctgagcga gacgaaatacgcgatcgctgttaaaaggaca attacaaacaggaatcgaatgcaaccggcgc aggaacactgccagcgcatcaacaatatttt cacctgaatcaggatattcttctaatacctg gaatgctgttttcccggggatcgcagtggtg agtaaccatgcatcatcaggagtacggataa aatgcttgatggtcggaagaggcataaattc cgtcagccagtttagtctgaccatctcatct gtaacatcattggcaacgctacctttgccat gtttcagaaacaactctggcgcatcgggctt cccatacaatcgatagattgtcgcacctgat tgcccgacattatcgcgagcccatttatacc catataaatcagcatccatgttggaatttaa tcgcggcctagagcaagacgtttcccgttga atatggctcataacaccccttgtattactgt ttatgtaagcagacagttttattgttcatga ccaaaatcccttaacgtgagttttcgttcca ctgagcgtcagaccccgtagaaaagatcaaa ggatcttcttgagatcctttttttctgcgcg taatctgctgcttgcaaacaaaaaaaccacc gctaccagcggtggtttgtttgccggatcaa gagctaccaactctttttccgaaggtaactg gcttcagcagagcgcagataccaaatactgt ccttctagtgtagccgtagttaggccaccac ttcaagaactctgtagcaccgcctacatacc tcgctctgctaatcctgttaccagtggctgc tgccagtggcgataagtcgtgtcttaccggg ttggactcaagacgatagttaccggataagg cgcagcggtcgggctgaacggggggttcgtg cacacagcccagcttggagcgaacgacctac accgaactgagatacctacagcgtgagctat gagaaagcgccacgcttcccgaagggagaaa ggcggacaggtatccggtaagcggcagggtc ggaacaggagagcgcacgagggagcttcca gggggaaacgcctggtatctttatagtcctgt cgggtttcgccacctctgacttgagcgtcga tttttgtgatgctcgtcaggggggcggagcc tatggaaaaacgccagcaacgcggccttttt acggttcctggccttttgctggccttttgct cacatgttctttcctgcgttatcccctgatt ctgtggataaccgtattaccgcctttgagtg agctgataccgctcgccgcagccgaacgacc gagcgcagcgagtcagtgagcgaggaagcgg aagagcgcctgatgcggtattttctccttac gcatctgtgcggtatttcacaccgcatatat ggtgcactctcagtacaatctgctctgatgc cgcatagttaagccagtatacactccgctat cgctacgtgactgggtcatggctgcgccccg acacccgccaacacccgctgacgcgccctga cgggcttgtctgctcccggcatccgcttaca gacaagctgtgaccgtctccgggagctgcat gtgtcagaggttttcaccgtcatcaccgaaa cgcgcgaggcagctgcggtaaagctcatcag cgtggtcgtgaagcgattcacagatgtctgc ctgttcatccgcgtccagctcgttgagtttc tccagaagcgttaatgtctggcttctgataa agcgggccatgttaagggcggttttttcctg tttggtcactgatgcctccgtgtaaggggga tttctgttcatgggggtaatgataccgatga aacgagagaggatgctcacgatacgggttac tgatgatgaacatgcccggttactggaacgt tgtgagggtaaacaactggcggtatggatgc ggcgggaccagagaaaaatcactcagggtc aatgccagcgcttcgttaatacagatgtaggt gttccacagggtagccagcagcatcctgcga tgcagatccggaacataatggtgcagggcgc tgacttccgcgtttccagactttacgaaaca cggaaaccgaagaccattcatgttgttgctc aggtcgcagacgttttgcagcagcagtcgct tcacgttcgctcgcgtatcggtgattcattc tgctaaccagtaaggcaaccccgccagccta gccgggtcctcaacgacaggagcacgatcat gcgcacccgtggggccgccatgccggcgata atggcctgcttctcgccgaaacgtttggtgg cgggaccagtgacgaaggcttgagcgagggc gtgcaagattccgaataccgcaagcgacagg ccgatcatcgtcgcgctccagcgaaagcggt cctcgccgaaaatgacccagagcgctgccgg cacctgtcctacgagttgcatgataaagaag acagtcataagtgcggcgacgatagtcatgc cccgcgcccaccggaaggagctgactgggtt gaaggctctcaagggcatcggtcgagatccc ggtgcctaatgagtgagctaacttacattaa ttgcgttgcgctcactgcccgctttccagtc gggaaacctgtcgtgccagctgcattaatga atcggccaacgcgcggggagaggcggtttgc gtattgggcgccagggtggtttttcttttca ccagtgagacgggcaacagctgattgccctt caccgcctggccctgagagagttgcagcaag cggtccacgctggtttgccccagcaggcgaa aatcctgtttgatggtggttaacggcgggat ataacatgagctgtcttcggtatcgtcgtat cccactaccgagatatccgcaccaacgcgca gcccggactcggtaatggcgcgcattgcgcc cagcgccatctgatcgttggcaaccagcatc gcagtgggaacgatgccctcattcagcattt gcatggtttgttgaaaaccggacatggcact ccagtcgccttcccgttccgctatcggctga atttgattgcgagtgagatatttatgccagc cagccagacgcagacgcgccgagacagaa cttaatgggcccgctaacagcgcgatttgctgg tgacccaatgcgaccagatgctccacgccca gtcgcgtaccgtcttcatgggagaaaataat actgttgatgggtgtctggtcagagacatca agaaataacgccggaacattagtgcaggcag cttccacagcaatggcatcctggtcatccag cggatagttaatgatcagcccactgacgcgt tgcgcgagaagattgtgcaccgccgctttac aggcttcgacgccgcttcgttctaccatcga caccaccacgctggcacccagttgatcggcg cgagatttaatcgccgcgacaatttgcgacg gcgcgtgcagggccagactggaggtggcaac gccaatcagcaacgactgtttgcccgccagt tgttgtgccacgcggttgggaatgtaattca gctccgccatcgccgcttccactttttcccg cgttttcgcagaaacgtggctggcctggttc accacgcgggaaacggtctgataagagacac cggcatactctgcgacatcgtataacgttac tggtttcacattcaccaccctgaattgactc tcttccgggcgctatcatgccataccgcgaa aggttttgcgccattcgatggtgtccgggat ctcgacgctctcccttatgcgactcctgcat taggaagcagcccagtagtaggttgaggccg ttgagcaccgccgccgcaaggaatggtgcat gcaaggagatggcgcccaacagtcccccggc cacggggcctgccaccatacccacgccgaaa caagcgctcatgagcccgaagtggcgagccc gatcttccccatcggtgatgtcggcgatata ggcgccagcaaccgcacctgtggcgccggtg atgccggccacgatgcgtccggcgtagagga tcgagatctcgatcccgcgaaattaatacga ctcactataggggaattgtgagcggataaca attcccctctagaaataattttgtttaactt taagaaggagatataccATGGGCAGC AGCCATCATCATCATCATCACA GCAGCGGCCTGGTGCCGCGC GGCAGCCATACTAGCGGAGAT ATCGCCGAGGACGCAGACAT GCGCAATGAGCTGGAGGAGA TGCAGAGGAGGGCTGACCAG CTGGCTGATGAGTCCCTGGA AAGCACCCGTCGCATGCTGC AGCTGGTTGAAGAGAGTAAA GATGCTGGCATCAGGACTTT GGTTATGTTGGATGAGCAAG GCGAACAACTGGAACGCATT GAGGAAGGGATGGACCAAAT CAATAAGGACATGAAAGAAG CAGAAAAGAATTTGACGGAC CTAGGAAAATTCGCCGGCCT TGCCGTGGCCCCCGCCAAC AAGCTTAAATCCAGTGATGC TTACAAAAAAGCCTGGGGC AATAATCAGGATGGAGTAGT GGCCAGCCAGCCTGCCCG TGTGGTGGATGAACGGGAG CAGATGGCCATCAGTGGTG GCTTCATCCGCAGGGTAAC AAATGATGCCCGGGAAAAT GAGATGGATGAGAACCTG GAGCAGGTGAGCGGCATC ATCGGAAACCTCCGCCAC ATGGCTCTAGACATGGGCA ATGAGATTGACACCCAGA ATCGCCAGATCGACAGGA TCATGGAGAAGGCTGATT CCAACAAAACCAGAATTG ATGAAGCCAACCAACGTG CAACAAAGATGCTGGGAA GTGGTTAAggatccgaattcgag ctccgtcgacaagcttgcggccgcactc gagcaccaccaccaccaccactgagat ccggctgctaacaaagcccgaaagga agctgagttggctgctgccaccgctgag caataactagcataaccccttggggcct ctaaacgggtcttgaggggttttttgctga aaggaggaactatatccggat | |
| 6×His-tagged VAMP2 (2-97, L32C/I97C; capitalized) in pET28a | homemade | tggcgaatgggacgcgccctgtagcggcgca ttaagcgcggcgggtgtggtggttacgcgca gcgtgaccgctacacttgccagcgccctagc gcccgctcctttcgctttcttcccttccttt ctcgccacgttcgccggctttccccgtcaag ctctaaatcgggggctccctttagggttccg atttagtgctttacggcacctcgaccccaaa aaacttgattagggtgatggttcacgtagtg ggccatcgccctgatagacggtttttcgccc tttgacgttggagtccacgttctttaatagt ggactcttgttccaaactggaacaacactca accctatctcggtctattcttttgatttata agggattttgccgatttcggcctattggtta aaaaatgagctgatttaacaaaaatttaacg cgaattttaacaaaatattaacgtttacaat ttcaggtggcacttttcggggaaatgtgcgc ggaacccctatttgtttatttttctaaatac attcaaatatgtatccgctcatgaattaatt cttagaaaaactcatcgagcatcaaatgaaa ctgcaatttattcatatcaggattatcaata ccatatttttgaaaaagccgtttctgtaatg aaggagaaaactcaccgaggcagttccatag gatggcaagatcctggtatcggtctgcgatt ccgactcgtccaacatcaatacaacctatta atttcccctcgtcaaaaataaggttatcaag tgagaaatcaccatgagtgacgactgaatcc ggtgagaatggcaaaagtttatgcatttctt tccagacttgttcaacaggccagccattacg ctcgtcatcaaaatcactcgcatcaaccaaa ccgttattcattcgtgattgcgcctgagcga gacgaaatacgcgatcgctgttaaaaggaca attacaaacaggaatcgaatgcaaccggcgc aggaacactgccagcgcatcaacaatatttt cacctgaatcaggatattcttctaatacctg gaatgctgttttcccggggatcgcagtggtg agtaaccatgcatcatcaggagtacggataa aatgcttgatggtcggaagaggcataaattc cgtcagccagtttagtctgaccatctcatct gtaacatcattggcaacgctacctttgccat gtttcagaaacaactctggcgcatcgggctt cccatacaatcgatagattgtcgcacctgat tgcccgacattatcgcgagcccatttatacc catataaatcagcatccatgttggaatttaa tcgcggcctagagcaagacgtttcccgttga atatggctcataacaccccttgtattactgt ttatgtaagcagacagttttattgttcatga ccaaaatcccttaacgtgagttttcgttcca ctgagcgtcagaccccgtagaaaagatcaaa ggatcttcttgagatcctttttttctgcgcg taatctgctgcttgcaaacaaaaaaaccacc gctaccagcggtggtttgtttgccggatcaa gagctaccaactctttttccgaaggtaactg gcttcagcagagcgcagataccaaatactgt ccttctagtgtagccgtagttaggccaccac ttcaagaactctgtagcaccgcctacatacc tcgctctgctaatcctgttaccagtggctgc tgccagtggcgataagtcgtgtcttaccggg ttggactcaagacgatagttaccggataagg cgcagcggtcgggctgaacggggggttcgtg cacacagcccagcttggagcgaacgacctac accgaactgagatacctacagcgtgagctatg agaaagcgccacgcttcccgaagggagaaa ggcggacaggtatccggtaagcggcagggtc ggaacaggagagcgcacgagggagcttcca gggggaaacgcctggtatctttatagtcctgt cgggtttcgccacctctgacttgagcgtcga tttttgtgatgctcgtcaggggggcggagcc tatggaaaaacgccagcaacgcggccttttt acggttcctggccttttgctggccttttgct cacatgttctttcctgcgttatcccctgatt ctgtggataaccgtattaccgcctttgagtg agctgataccgctcgccgcagccgaacgacc gagcgcagcgagtcagtgagcgaggaagc ggaagagcgcctgatgcggtattttctccttac gcatctgtgcggtatttcacaccgcatatat ggtgcactctcagtacaatctgctctgatgc cgcatagttaagccagtatacactccgctat cgctacgtgactgggtcatggctgcgccccg acacccgccaacacccgctgacgcgccctga cgggcttgtctgctcccggcatccgcttaca gacaagctgtgaccgtctccgggagctgcat gtgtcagaggttttcaccgtcatcaccgaaa cgcgcgaggcagctgcggtaaagctcatcag cgtggtcgtgaagcgattcacagatgtctgc ctgttcatccgcgtccagctcgttgagtttc tccagaagcgttaatgtctggcttctgataa agcgggccatgttaagggcggttttttcctg tttggtcactgatgcctccgtgtaaggggga tttctgttcatgggggtaatgataccgatga aacgagagaggatgctcacgatacgggttac tgatgatgaacatgcccggttactggaacgt tgtgagggtaaacaactggcggtatggatgc ggcgggaccagagaaaaatcactcagggtc aatgccagcgcttcgttaatacagatgtaggt gttccacagggtagccagcagcatcctgcga tgcagatccggaacataatggtgcagggcgc tgacttccgcgtttccagactttacgaaaca cggaaaccgaagaccattcatgttgttgctc aggtcgcagacgttttgcagcagcagtcgct tcacgttcgctcgcgtatcggtgattcattc tgctaaccagtaaggcaaccccgccagccta gccgggtcctcaacgacaggagcacgatcat gcgcacccgtggggccgccatgccggcgata atggcctgcttctcgccgaaacgtttggtgg cgggaccagtgacgaaggcttgagcgagggc gtgcaagattccgaataccgcaagcgacagg ccgatcatcgtcgcgctccagcgaaagcggt cctcgccgaaaatgacccagagcgctgccgg cacctgtcctacgagttgcatgataaagaag acagtcataagtgcggcgacgatagtcatgc cccgcgcccaccggaaggagctgactgggtt gaaggctctcaagggcatcggtcgagatccc ggtgcctaatgagtgagctaacttacattaa ttgcgttgcgctcactgcccgctttccagtc gggaaacctgtcgtgccagctgcattaatga atcggccaacgcgcggggagaggcggtttgc gtattgggcgccagggtggtttttcttttca ccagtgagacgggcaacagctgattgccctt caccgcctggccctgagagagttgcagcaag cggtccacgctggtttgccccagcaggcgaa aatcctgtttgatggtggttaacggcgggat ataacatgagctgtcttcggtatcgtcgtat cccactaccgagatatccgcaccaacgcgca gcccggactcggtaatggcgcgcattgcgcc cagcgccatctgatcgttggcaaccagcatc gcagtgggaacgatgccctcattcagcattt gcatggtttgttgaaaaccggacatggcact ccagtcgccttcccgttccgctatcggctga atttgattgcgagtgagatatttatgccagc cagccagacgcagacgcgccgagacagaa cttaatgggcccgctaacagcgcgatttgctgg tgacccaatgcgaccagatgctccacgccca gtcgcgtaccgtcttcatgggagaaaataat actgttgatgggtgtctggtcagagacatca agaaataacgccggaacattagtgcaggcag cttccacagcaatggcatcctggtcatccag cggatagttaatgatcagcccactgacgcgt tgcgcgagaagattgtgcaccgccgctttac aggcttcgacgccgcttcgttctaccatcga caccaccacgctggcacccagttgatcggcg cgagatttaatcgccgcgacaatttgcgacg gcgcgtgcagggccagactggaggtggcaac gccaatcagcaacgactgtttgcccgccagt tgttgtgccacgcggttgggaatgtaattca gctccgccatcgccgcttccactttttcccg cgttttcgcagaaacgtggctggcctggttc accacgcgggaaacggtctgataagagacac cggcatactctgcgacatcgtataacgttac tggtttcacattcaccaccctgaattgactc tcttccgggcgctatcatgccataccgcgaa aggttttgcgccattcgatggtgtccgggat ctcgacgctctcccttatgcgactcctgcat taggaagcagcccagtagtaggttgaggccg ttgagcaccgccgccgcaaggaatggtgcat gcaaggagatggcgcccaacagtcccccggc cacggggcctgccaccatacccacgccgaaa caagcgctcatgagcccgaagtggcgagccc gatcttccccatcggtgatgtcggcgatata ggcgccagcaaccgcacctgtggcgccggtg atgccggccacgatgcgtccggcgtagagga tcgagatctcgatcccgcgaaattaatacga ctcactataggggaattgtgagcggataaca attcccctctagaaataattttgtttaactt taagaaggagatataccATGGGCAGC AGCCATCATCATCATCATCAC AGCAGCGGCCTGGTGCCGC GCGGCAGCCATATGGCAGAT CTCTCGGCTACCGCTGCCAC CGTCCCGCCTGCCGCCCCG GCCGGCGAGGGTGGCCCCC CTGCACCTCCTCCAAATCTTA CCAGTAACAGGAGATGCCAG CAGACCCAGGCCCAGGTGG ATGAGGTGGTGGACATCATG AGGGTGAATGTGGACAAGGT CCTGGAGCGAGACCAGAAG CTATCGGAACTGGATGATCG CGCAGATGCCCTCCAGGCA GGGGCCTCCCAGTTTGAAA CAAGTGCAGCCAAGCTCAA GCGCAAATACTGGTGGAAA AACCTCAAGATGATGTGCTA Aggatccgaattcgagctccgtcg acaagcttgcggccgcactcgagcaccacca ccaccaccactgagatccggctgctaacaaa gcccgaaaggaagctgagttggctgctgcca ccgctgagcaataactagcataaccccttgg ggcctctaaacgggtcttgaggggttttttg ctgaaaggaggaactatatccggat | |
| 6×His-tagged ΔN-VAMP2 (49–96; capitalized) and Syntaxin-1A (191–267, I202C/I266C; capitalized) in pETDuet-1 | homemade | ggggaattgtgagcggataacaattcccctc tagaaataattttgtttaactttaagaagga gatataccATGGGCAGCAGCCATCA TCATCATCATCACAGCAGCGG CCTGGAAGTTCTGTTCCAGGG GCCCGGTAATGTGGACAAGGT CCTGGAGCGAGACCAGAAGCT ATCGGAACTGGATGATCGCGC AGATGCCCTCCAGGCAGGGGC CTCCCAGTTTGAAACAAGTGC AGCCAAGCTCAAGCGCAAATAC TGGTGGAAAAACCTCAAGATGAT GTAAgcggccgcataatgcttaagtcgaaca gaaagtaatcgtattgtacacggccgcataa tcgaaattaatacgactcactataggggaat tgtgagcggataacaattccccatcttagta tattagttaagtataagaaggagatatacat ATGGCCCTCAGTGAGATCGAGA CCAGGCACAGTGAGTGCATC AAGTTGGAGAACAGCATCCG GGAGCTACACGATATGTTCAT GGACATGGCCATGCTGGTGG AGAGCCAGGGGGAGATGATT GACAGGATCGAGTACAATGTG GAACACGCTGTGGACTACGTG GAGAGGGCCGTGTCTGACACC AAGAAGGCCGTCAAGTACCAG AGCAAGGCACGCAGGAAGAA GTGCATGATCTAActcgagtc tggtaaagaaaccgctgctgcgaaatttgaa cgccagcacatggactcgtctactagcgcag cttaattaacctaggctgctgccaccgctga gcaataactagcataaccccttggggcctct aaacgggtcttgaggggttttttgctgaaag gaggaactatatccggattggcgaatgggac gcgccctgtagcggcgcattaagcgcggcgg gtgtggtggttacgcgcagcgtgaccgctac acttgccagcgccctagcgcccgctcctttc gctttcttcccttcctttctcgccacgttcg ccggctttccccgtcaagctctaaatcgggg gctccctttagggttccgatttagtgcttta cggcacctcgaccccaaaaaacttgattagg gtgatggttcacgtagtgggccatcgccctg atagacggtttttcgccctttgacgttggag tccacgttctttaatagtggactcttgttcc aaactggaacaacactcaaccctatctcggt ctattcttttgatttataagggattttgccg atttcggcctattggttaaaaaatgagctga tttaacaaaaatttaacgcgaattttaacaa aatattaacgtttacaatttctggcggcacg atggcatgagattatcaaaaaggatcttcac ctagatccttttaaattaaaaatgaagtttt aaatcaatctaaagtatatatgagtaaactt ggtctgacagttaccaatgcttaatcagtga ggcacctatctcagcgatctgtctatttcgt tcatccatagttgcctgactccccgtcgtgt agataactacgatacgggagggcttaccatc tggccccagtgctgcaatgataccgcgagac ccacgctcaccggctccagatttatcagcaa taaaccagccagccggaagggccgagcgca gaagtggtcctgcaactttatccgcctccatc cagtctattaattgttgccgggaagctagag taagtagttcgccagttaatagtttgcgcaa cgttgttgccattgctacaggcatcgtggtg tcacgctcgtcgtttggtatggcttcattca gctccggttcccaacgatcaaggcgagttac atgatcccccatgttgtgcaaaaaagcggtt agctccttcggtcctccgatcgttgtcagaa gtaagttggccgcagtgttatcactcatggt tatggcagcactgcataattctcttactgtc atgccatccgtaagatgcttttctgtgactg gtgagtactcaaccaagtcattctgagaata gtgtatgcggcgaccgagttgctcttgcccg gcgtcaatacgggataataccgcgccacata gcagaactttaaaagtgctcatcattggaaa acgttcttcggggcgaaaactctcaaggatc ttaccgctgttgagatccagttcgatgtaac ccactcgtgcacccaactgatcttcagcatc ttttactttcaccagcgtttctgggtgagcaaa aacaggaaggcaaaatgccgcaaaaaagg gaataagggcgacacggaaatgttgaatact catactcttcctttttcaatcatgattgaag catttatcagggttattgtctcatgagcgga tacatatttgaatgtatttagaaaaataaac aaataggtcatgaccaaaatcccttaacgtg agttttcgttccactgagcgtcagaccccgt agaaaagatcaaaggatcttcttgagatcct ttttttctgcgcgtaatctgctgcttgcaaa caaaaaaaccaccgctaccagcggtggtttg tttgccggatcaagagctaccaactcttttt ccgaaggtaactggcttcagcagagcgcaga taccaaatactgtccttctagtgtagccgta gttaggccaccacttcaagaactctgtagca ccgcctacatacctcgctctgctaatcctgt taccagtggctgctgccagtggcgataagtc gtgtcttaccgggttggactcaagacgatag ttaccggataaggcgcagcggtcgggctgaa cggggggttcgtgcacacagcccagcttgga gcgaacgacctacaccgaactgagataccta cagcgtgagctatgagaaagcgccacgcttccc gaagggagaaaggcggacaggtatccggta agcggcagggtcggaacaggagagcgcac gagggagcttccagggggaaacgcctggtatc tttatagtcctgtcgggtttcgccacctctg acttgagcgtcgatttttgtgatgctcgtca ggggggcggagcctatggaaaaacgccagc aacgcggcctttttacggttcctggccttttg ctggccttttgctcacatgttctttcctgcg ttatcccctgattctgtggataaccgtatta ccgcctttgagtgagctgataccgctcgccgc agccgaacgaccgagcgcagcgagtcagtg agcgaggaagcggaagagcgcctgatgcgg tattttctccttacgcatctgtgcggtatttc acaccgcatatatggtgcactctcagtacaa tctgctctgatgccgcatagttaagccagta tacactccgctatcgctacgtgactgggtca tggctgcgccccgacacccgccaacacccgc tgacgcgccctgacgggcttgtctgctcccg gcatccgcttacagacaagctgtgaccgtct ccgggagctgcatgtgtcagaggttttcacc gtcatcaccgaaacgcgcgaggcagctgcgg taaagctcatcagcgtggtcgtgaagcgatt cacagatgtctgcctgttcatccgcgtccag ctcgttgagtttctccagaagcgttaatgtc tggcttctgataaagcgggccatgttaaggg cggttttttcctgtttggtcactgatgcctc cgtgtaagggggatttctgttcatgggggta atgataccgatgaaacgagagaggatgctca cgatacgggttactgatgatgaacatgcccg gttactggaacgttgtgagggtaaacaactg gcggtatggatgcggcgggaccagagaaaaa tcactcagggtcaatgccagcgcttcgttaa tacagatgtaggtgttccacagggtagccag cagcatcctgcgatgcagatccggaacataa tggtgcagggcgctgacttccgcgtttccag actttacgaaacacggaaaccgaagaccatt catgttgttgctcaggtcgcagacgttttgc agcagcagtcgcttcacgttcgctcgcgtat cggtgattcattctgctaaccagtaaggcaa ccccgccagcctagccgggtcctcaacgaca ggagcacgatcatgctagtcatgccccgcgc ccaccggaaggagctgactgggttgaaggct ctcaagggcatcggtcgagatcccggtgcct aatgagtgagctaacttacattaattgcgtt gcgctcactgcccgctttccagtcgggaaac ctgtcgtgccagctgcattaatgaatcggcc aacgcgcggggagaggcggtttgcgtattgg gcgccagggtggtttttcttttcaccagtga gacgggcaacagctgattgcccttcaccgcc tggccctgagagagttgcagcaagcggtcca cgctggtttgccccagcaggcgaaaatcctg tttgatggtggttaacggcgggatataacat gagctgtcttcggtatcgtcgtatcccacta ccgagatgtccgcaccaacgcgcagcccgga ctcggtaatggcgcgcattgcgcccagcgcc atctgatcgttggcaaccagcatcgcagtgg gaacgatgccctcattcagcatttgcatggt ttgttgaaaaccggacatggcactccagtcg ccttcccgttccgctatcggctgaatttgat tgcgagtgagatatttatgccagccagccag acgcagacgcgccgagacagaacttaatggg cccgctaacagcgcgatttgctggtgaccca atgcgaccagatgctccacgcccagtcgcgt accgtcttcatgggagaaaataatactgttg atgggtgtctggtcagagacatcaagaaata acgccggaacattagtgcaggcagcttccac agcaatggcatcctggtcatccagcggatag ttaatgatcagcccactgacgcgttgcgcga gaagattgtgcaccgccgctttacaggcttc gacgccgcttcgttctaccatcgacaccacc acgctggcacccagttgatcggcgcgagatt taatcgccgcgacaatttgcgacggcgcgtg cagggccagactggaggtggcaacgccaatc agcaacgactgtttgcccgccagttgttgtg ccacgcggttgggaatgtaattcagctccgc catcgccgcttccactttttcccgcgttttc gcagaaacgtggctggcctggttcaccacgc gggaaacggtctgataagagacaccggcata ctctgcgacatcgtataacgttactggtttc acattcaccaccctgaattgactctcttccg ggcgctatcatgccataccgcgaaaggtttt gcgccattcgatggtgtccgggatctcgacg ctctcccttatgcgactcctgcattaggaag cagcccagtagtaggttgaggccgttgagca ccgccgccgcaaggaatggtgcatgcaagga gatggcgcccaacagtcccccggccacgggg cctgccaccatacccacgccgaaacaagcgc tcatgagcccgaagtggcgagcccgatcttc cccatcggtgatgtcggcgatataggcgcca gcaaccgcacctgtggcgccggtgatgccgg ccacgatgcgtccggcgtagaggatcgagat cgatctcgatcccgcgaaattaatacgactc actata | |
| SNAP-25b (1–206, all C to A; capitalized) in pET28a | homemade | tggcgaatgggacgcgccctgtagcggcgca ttaagcgcggcgggtgtggtggttacgcgca gcgtgaccgctacacttgccagcgccctagc gcccgctcctttcgctttcttcccttccttt ctcgccacgttcgccggctttccccgtcaag ctctaaatcgggggctccctttagggttccg atttagtgctttacggcacctcgaccccaaa aaacttgattagggtgatggttcacgtagtg ggccatcgccctgatagacggtttttcgccc tttgacgttggagtccacgttctttaatagt ggactcttgttccaaactggaacaacactca accctatctcggtctattcttttgatttata agggattttgccgatttcggcctattggtta aaaaatgagctgatttaacaaaaatttaacg cgaattttaacaaaatattaacgtttacaat ttcaggtggcacttttcggggaaatgtgcgc ggaacccctatttgtttatttttctaaatac attcaaatatgtatccgctcatgaattaatt cttagaaaaactcatcgagcatcaaatgaaa ctgcaatttattcatatcaggattatcaata ccatatttttgaaaaagccgtttctgtaatg aaggagaaaactcaccgaggcagttccatag gatggcaagatcctggtatcggtctgcgatt ccgactcgtccaacatcaatacaacctatta atttcccctcgtcaaaaataaggttatcaag tgagaaatcaccatgagtgacgactgaatcc ggtgagaatggcaaaagtttatgcatttctt tccagacttgttcaacaggccagccattacg ctcgtcatcaaaatcactcgcatcaaccaaa ccgttattcattcgtgattgcgcctgagcga gacgaaatacgcgatcgctgttaaaaggaca attacaaacaggaatcgaatgcaaccggcgc aggaacactgccagcgcatcaacaatatttt cacctgaatcaggatattcttctaatacctg gaatgctgttttcccggggatcgcagtggtg agtaaccatgcatcatcaggagtacggataa aatgcttgatggtcggaagaggcataaattc cgtcagccagtttagtctgaccatctcatct gtaacatcattggcaacgctacctttgccat gtttcagaaacaactctggcgcatcgggctt cccatacaatcgatagattgtcgcacctgat tgcccgacattatcgcgagcccatttatacc catataaatcagcatccatgttggaatttaa tcgcggcctagagcaagacgtttcccgttga atatggctcataacaccccttgtattactgt ttatgtaagcagacagttttattgttcatga ccaaaatcccttaacgtgagttttcgttcca ctgagcgtcagaccccgtagaaaagatcaaa ggatcttcttgagatcctttttttctgcgcg taatctgctgcttgcaaacaaaaaaaccacc gctaccagcggtggtttgtttgccggatcaa gagctaccaactctttttccgaaggtaactg gcttcagcagagcgcagataccaaatactgt ccttctagtgtagccgtagttaggccaccac ttcaagaactctgtagcaccgcctacatacc tcgctctgctaatcctgttaccagtggctgc tgccagtggcgataagtcgtgtcttaccggg ttggactcaagacgatagttaccggataagg cgcagcggtcgggctgaacggggggttcgtg cacacagcccagcttggagcgaacgacctac accgaactgagatacctacagcgtgagctatg agaaagcgccacgcttcccgaagggagaaa ggcggacaggtatccggtaagcggcagggtc ggaacaggagagcgcacgagggagcttcc agggggaaacgcctggtatctttatagtcctgt cgggtttcgccacctctgacttgagcgtcga tttttgtgatgctcgtcaggggggcggagcc tatggaaaaacgccagcaacgcggccttttt acggttcctggccttttgctggccttttgct cacatgttctttcctgcgttatcccctgatt ctgtggataaccgtattaccgcctttgagtg agctgataccgctcgccgcagccgaacgacc gagcgcagcgagtcagtgagcgaggaagc ggaagagcgcctgatgcggtattttctccttac gcatctgtgcggtatttcacaccgcatatat ggtgcactctcagtacaatctgctctgatgc cgcatagttaagccagtatacactccgctat cgctacgtgactgggtcatggctgcgccccg acacccgccaacacccgctgacgcgccctga cgggcttgtctgctcccggcatccgcttaca gacaagctgtgaccgtctccgggagctgcat gtgtcagaggttttcaccgtcatcaccgaaa cgcgcgaggcagctgcggtaaagctcatcag cgtggtcgtgaagcgattcacagatgtctgc ctgttcatccgcgtccagctcgttgagtttc tccagaagcgttaatgtctggcttctgataa agcgggccatgttaagggcggttttttcctg tttggtcactgatgcctccgtgtaaggggga tttctgttcatgggggtaatgataccgatga aacgagagaggatgctcacgatacgggttac tgatgatgaacatgcccggttactggaacgt tgtgagggtaaacaactggcggtatggatgc ggcgggaccagagaaaaatcactcagggtc aatgccagcgcttcgttaatacagatgtaggt gttccacagggtagccagcagcatcctgcga tgcagatccggaacataatggtgcagggcgc tgacttccgcgtttccagactttacgaaaca cggaaaccgaagaccattcatgttgttgctc aggtcgcagacgttttgcagcagcagtcgct tcacgttcgctcgcgtatcggtgattcattc tgctaaccagtaaggcaaccccgccagccta gccgggtcctcaacgacaggagcacgatcat gcgcacccgtggggccgccatgccggcgata atggcctgcttctcgccgaaacgtttggtgg cgggaccagtgacgaaggcttgagcgagggc gtgcaagattccgaataccgcaagcgacagg ccgatcatcgtcgcgctccagcgaaagcggt cctcgccgaaaatgacccagagcgctgccgg cacctgtcctacgagttgcatgataaagaag acagtcataagtgcggcgacgatagtcatgc cccgcgcccaccggaaggagctgactgggtt gaaggctctcaagggcatcggtcgagatccc ggtgcctaatgagtgagctaacttacattaa ttgcgttgcgctcactgcccgctttccagtc gggaaacctgtcgtgccagctgcattaatga atcggccaacgcgcggggagaggcggtttgc gtattgggcgccagggtggtttttcttttca ccagtgagacgggcaacagctgattgccctt caccgcctggccctgagagagttgcagcaag cggtccacgctggtttgccccagcaggcgaa aatcctgtttgatggtggttaacggcgggat ataacatgagctgtcttcggtatcgtcgtat cccactaccgagatatccgcaccaacgcgca gcccggactcggtaatggcgcgcattgcgcc cagcgccatctgatcgttggcaaccagcatc gcagtgggaacgatgccctcattcagcattt gcatggtttgttgaaaaccggacatggcact ccagtcgccttcccgttccgctatcggctga atttgattgcgagtgagatatttatgccagc cagccagacgcagacgcgccgagacagaa cttaatgggcccgctaacagcgcgatttgctgg tgacccaatgcgaccagatgctccacgccca gtcgcgtaccgtcttcatgggagaaaataat actgttgatgggtgtctggtcagagacatca agaaataacgccggaacattagtgcaggcag cttccacagcaatggcatcctggtcatccag cggatagttaatgatcagcccactgacgcgt tgcgcgagaagattgtgcaccgccgctttac aggcttcgacgccgcttcgttctaccatcga caccaccacgctggcacccagttgatcggcg cgagatttaatcgccgcgacaatttgcgacg gcgcgtgcagggccagactggaggtggcaac gccaatcagcaacgactgtttgcccgccagt tgttgtgccacgcggttgggaatgtaattca gctccgccatcgccgcttccactttttcccg cgttttcgcagaaacgtggctggcctggttc accacgcgggaaacggtctgataagagacac cggcatactctgcgacatcgtataacgttac tggtttcacattcaccaccctgaattgactc tcttccgggcgctatcatgccataccgcgaa aggttttgcgccattcgatggtgtccgggat ctcgacgctctcccttatgcgactcctgcat taggaagcagcccagtagtaggttgaggccg ttgagcaccgccgccgcaaggaatggtgcat gcaaggagatggcgcccaacagtcccccggc cacggggcctgccaccatacccacgccgaaa caagcgctcatgagcccgaagtggcgagccc gatcttccccatcggtgatgtcggcgatata ggcgccagcaaccgcacctgtggcgccggtg atgccggccacgatgcgtccggcgtagagga tcgagatctcgatcccgcgaaattaatacga ctcactataggggaattgtgagcggataaca attcccctctagaaataattttgtttaactt taagaaggagatataccATGGCCGA GGACGCAGACATGCGCAATG AGCTGGAGGAGATGCAGAGG AGGGCTGACCAGCTGGCTGA TGAGTCCCTGGAAAGCACCC GTCGCATGCTGCAGCTGGTT GAAGAGAGTAAAGATGCTGG CATCAGGACTTTGGTTATGTT GGATGAGCAAGGCGAACAAC TGGAACGCATTGAGGAAGGG ATGGACCAAATCAATAAGGAC ATGAAAGAAGCAGAAAAGAAT TTGACGGACCTAGGAAAATTC GCCGGCCTTGCCGTGGCCCC CGCCAACAAGCTTAAATCCAG TGATGCTTACAAAAAAGCCTG GGGCAATAATCAGGATGGAGT AGTGGCCAGCCAGCCTGCCC GTGTGGTGGATGAACGGGAG CAGATGGCCATCAGTGGTGGC TTCATCCGCAGGGTAACAAAT GATGCCCGGGAAAATGAGATG GATGAGAACCTGGAGCAGGT GAGCGGCATCATCGGAAACCT CCGCCACATGGCTCTAGACAT GGGCAATGAGATTGACACCCA GAATCGCCAGATCGACAGGAT CATGGAGAAGGCTGATTCCAA CAAAACCAGAATTGATGAAGC CAACCAACGTGCAACAAAGAT GCTGGGAAGTGGTTAA ctcgagcaccaccaccaccaccactgag atccggctgctaacaaagcccgaaagga agctgagttggctgctgccaccgctgagc aataactagcataaccccttggggcctc taaacgggtcttgaggggttttttgctgaa aggaggaactatatccggat | |
| Materials for protein purificaiton | |||
| 2-Mercaptoethanol | SIGMA | M3148-25ML | |
| Agar | LPS Solution | AGA500 | |
| Ampicillin, Sodium salt | PLS | AC1043-005-00 | |
| Chloramphenicol | PLS | CR1023-050-00 | |
| Competent cells (E. coli) | Novagen | 70956 | Rosetta(DE3)pLysS |
| Glycerol | SIGMA | G5516-500ML | |
| HEPES | SIGMA | H4034-100G | |
| Hydrochloric acid / HCl | SIGMA | 320331-500ML | |
| Imidazole | SIGMA | I2399-100G | |
| Isopropyl β-D-1-thiogalactopyranoside / IPTG | SIGMA | 10724815001 | |
| Kanamycin Sulfate | PLS | KC1001-005-02 | |
| Luria-Bertani (LB) Broth | LPS Solution | LB-05 | |
| Ni-NTA resin | Qiagen | 30210 | |
| PD MiniTrap G-25 (desalting column) | Cytiva | GE28-9180-07 | For instructions, see: https://www.cytivalifesciences.com/en/us/shop/chromatography/prepacked-columns/desalting-and-buffer-exchange/pd-minitrap-desalting-columns-with-sephadex-g-25-resin-p-06174 |
| Phenylmethylsulfonyl fluoride / PMSF | ThermoFisher Scientific | 36978 | |
| Plasmids for SNARE proteins | cloned in house | N/A | Available upon request |
| Protease inhibitor cocktail | genDEPOT | P3100 | |
| Sodium chloride | SIGMA | S5886-500G | |
| Sodium phosphate dibasic / Na2HPO4 | SIGMA | S7907-100G | |
| Sodium phosphate monobasic / NaH2PO4 | SIGMA | S3139-250G | |
| Tris(2-carboxyethyl)phosphine / TCEP | SIGMA | C4706-2G | |
| Trizma base | SIGMA | T1503-250G | |
| Materials for sample assembly | |||
| Biotin-PEG-SVA | LAYSAN BIO | BIO-PEG-SVA-5K-100MG & MPEG-SVA-5K-1g | For PEGylation |
| Dibenzocyclooctyne-amine / DBCO-NH2 | SIGMA | 761540-10MG | For bead coating |
| Double-sided tape | 3M | 136 | For flow cell assembly |
| Epoxy glue | DEVCON | S-208 | For flow cell assembly |
| Glass coverslip for bottom surface | VWR | 48393-251 | Rectangular, 60×24 mm, #1.5 |
| Glass coverslip for top surface | VWR | 48393-241 | Rectangular, 50×24 mm, #1.5 |
| Magnetic bead | ThermoFisher Scientific | 14301 | Dynabeads M-270 Epoxy, 2.8 μm |
| mPEG-SVA | LAYSAN BIO | mPEG-SVA 1g | For PEGylation |
| N,N-Dimethylformamide / DMF | SIGMA | D4551-250ML | For bead coating |
| N-[3-(trimethoxysilyl)propyl]ethylenediamine | SIGMA | 104884-100ML | For PEGylation |
| Neutravidin | ThermoFisher Scientific | 31000 | For sample tethering |
| Phosphate buffered saline / PBS, pH 7.2 | PLS | PR2007-100-00 | |
| Plastic syringe | Norm-ject | A5 | 5 ml, luer tip |
| Polyethylene Tubing | SCI | BB31695-PE/4 | PE-60 |
| Reference bead | SPHEROTECH | SVP-30-5 | Streptavidin-coated Polystyrene Particles; 3.0-3.4 µm |
| Syringe needle | Kovax | 21G-1 1/4'' | 21 G |
| Syringe pump | KD SCIENTIFIC | 788210 | |
| Equipment for magnetic tweezer instrument | |||
| 1-axis motorized microtranslation stage | PI | M-126.PD1 | For vertical positioning of magnets |
| 2-axis manual translation stage | ST1 | LEE400 | For alignment of magnets to the optical axis |
| Acrylic holder for magnets | DaiKwang Precision | custum order | Drawing available upon request |
| Frame grabber | Active Silicon | AS-FBD-4XCXP6-2PE8 | |
| High-speed CMOS camera | Mikrotron | EoSens 3CXP | |
| Inverted microscope | Olympus | IX73P2F-1-2 | |
| Neodymium magnets | LG magnet | ND 10x10x12t | Dimension: 10 mm × 10 mm × 12 mm; two needed |
| Objective lens | Olympus | UPLXAPO100XO | Oil-immersion, NA 1.45 |
| Objective lens nanopositioner | Mad City Labs | Nano-F100S | |
| Rotation stepper motor | AUTONICS | A3K-S545W | For rotating magnets |
| Superluminescent diode | QPHOTONICS | QSDM-680-2 | 680 nm |
| Software | |||
| LabVIEW | National Instruments | v20.0f1 | |
| MATLAB | MathWorks | v2021a |
Riferimenti
- Le, S., Liu, R., Lim, C. T., Yan, J. Uncovering mechanosensing mechanisms at the single protein level using magnetic tweezers. Methods. 94, 13-18 (2016).
- Choi, H. -. K., Kim, H. G., Shon, M. J., Yoon, T. -. Y. High-resolution single-molecule magnetic tweezers. Annual Review of Biochemistry. 91 (1), 33-59 (2022).
- Yang, T., Park, C., Rah, S. -. H., Shon, M. J. Nano-precision tweezers for mechanosensitive proteins and beyond. Molecules and Cells. 45 (1), 16-25 (2022).
- Neuman, K. C., Nagy, A. Single-molecule force spectroscopy: optical tweezers, magnetic tweezers and atomic force microscopy. Nature Methods. 5 (6), 491-505 (2008).
- De Vlaminck, I., Dekker, C. Recent advances in magnetic tweezers. Annual Review of Biophysics. 41 (1), 453-472 (2012).
- Bustamante, C. J., Chemla, Y. R., Liu, S., Wang, M. D. Optical tweezers in single-molecule biophysics. Nature Reviews Methods Primers. 1, 25 (2021).
- Gosse, C., Croquette, V. Magnetic tweezers: micromanipulation and force measurement at the molecular level. Biophysical Journal. 82 (6), 3314-3329 (2002).
- Smith, S. B., Finzi, L., Bustamante, C. Direct mechanical measurements of the elasticity of single DNA molecules by using magnetic beads. Science. 258 (5085), 1122-1126 (1992).
- Lansdorp, B. M., Tabrizi, S. J., Dittmore, A., Saleh, O. A. A high-speed magnetic tweezer beyond 10,000 frames per second. Review of Scientific Instruments. 84 (4), 044301 (2013).
- Cnossen, J. P., Dulin, D., Dekker, N. H. An optimized software framework for real-time, high-throughput tracking of spherical beads. Review of Scientific Instruments. 85 (10), 103712 (2014).
- Dulin, D., et al. High spatiotemporal-resolution magnetic tweezers: calibration and applications for DNA dynamics. Biophysical Journal. 109 (10), 2113-2125 (2015).
- Huhle, A., et al. Camera-based three-dimensional real-time particle tracking at kHz rates and Ångström accuracy. Nature Communications. 6 (1), 5885 (2015).
- Popa, I., et al. A HaloTag anchored ruler for week-long studies of protein dynamics. Journal of the American Chemical Society. 138 (33), 10546-10553 (2016).
- Shon, M. J., Kim, H., Yoon, T. -. Y. Focused clamping of a single neuronal SNARE complex by complexin under high mechanical tension. Nature Communications. 9 (1), 3639 (2018).
- Tapia-Rojo, R., Eckels, E. C., Fernández, J. M. Ephemeral states in protein folding under force captured with a magnetic tweezers design. Proceedings of the National Academy of Sciences. 116 (16), 7873-7878 (2019).
- Löf, A., et al. Multiplexed protein force spectroscopy reveals equilibrium protein folding dynamics and the low-force response of von Willebrand factor. Proceedings of the National Academy of Sciences. 116 (38), 18798-18807 (2019).
- Tapia-Rojo, R., Alonso-Caballero, A., Fernandez, J. M. Direct observation of a coil-to-helix contraction triggered by vinculin binding to talin. Science Advances. 6 (21), (2020).
- Rieu, M., et al. Parallel, linear, and subnanometric 3D tracking of microparticles with Stereo Darkfield Interferometry. Science Advances. 7 (6), (2021).
- Rieu, M., Valle-Orero, J., Ducos, B., Allemand, J. -. F., Croquette, V. Single-molecule kinetic locking allows fluorescence-free quantification of protein/nucleic-acid binding. Communications Biology. 4 (1), 1083 (2021).
- Woodside, M. T., et al. Nanomechanical measurements of the sequence-dependent folding landscapes of single nucleic acid hairpins. Proceedings of the National Academy of Sciences. 103 (16), 6190-6195 (2006).
- Camunas-Soler, J., Ribezzi-Crivellari, M., Ritort, F. Elastic properties of nucleic acids by single-molecule force spectroscopy. Annual Review of Biophysics. 45 (1), 65-84 (2016).
- Südhof, T. C., Rothman, J. E. Membrane fusion: grappling with SNARE and SM proteins. Science. 323 (5913), 474-477 (2009).
- Gao, Y., et al. Single reconstituted neuronal SNARE complexes zipper in three distinct stages. Science. 337 (6100), 1340-1343 (2012).
- Zorman, S., et al. Common intermediates and kinetics, but different energetics, in the assembly of SNARE proteins. eLife. 3, e03348 (2014).
- Zhang, Y., Hughson, F. M. Chaperoning SNARE folding and assembly. Annual Review of Biochemistry. 90 (1), 581-603 (2021).
- Vilfan, I. D., Lipfert, J., Koster, D. A., Lemay, S. G., Dekker, N. H. Magnetic tweezers for single-molecule experiments. Handbook of Single-Molecule Biophysics. , 371-395 (2009).
- You, H., Le, S., Chen, H., Qin, L., Yan, J. Single-molecule manipulation of G-quadruplexes by magnetic tweezers. Journal of Visualized Experiments. (127), e56328 (2017).
- Lipfert, J., Hao, X., Dekker, N. H. Quantitative modeling and optimization of magnetic tweezers. Biophysical Journal. 96 (12), 5040-5049 (2009).
- Dulin, D., Barland, S., Hachair, X., Pedaci, F. Efficient illumination for microsecond tracking microscopy. PLoS One. 9 (9), e107335 (2014).
- Klaue, D., Seidel, R. Torsional stiffness of single superparamagnetic microspheres in an external magnetic field. Physical Review Letters. 102 (2), 028302 (2009).
- Shon, M. J., Rah, S. -. H., Yoon, T. -. Y. Submicrometer elasticity of double-stranded DNA revealed by precision force-extension measurements with magnetic tweezers. Science Advances. 5 (6), 1697 (2019).
- Czerwinski, F., Richardson, A. C., Oddershede, L. B. Quantifying noise in optical tweezers by Allan variance. Optics Express. 17 (15), 13255-13269 (2009).
- Lansdorp, B. M., Saleh, O. A. Power spectrum and Allan variance methods for calibrating single-molecule video-tracking instruments. Review of Scientific Instruments. 83 (2), 025115 (2012).
- Ostrofet, E., Papini, F. S., Dulin, D. High spatiotemporal resolution data from a custom magnetic tweezers instrument. Data in Brief. 30, 105397 (2020).
- Yu, Z., et al. A force calibration standard for magnetic tweezers. Review of Scientific Instruments. 85 (12), 123114 (2014).
- Strick, T. R., Allemand, J. -. F., Bensimon, D., Bensimon, A., Croquette, V. The elasticity of a single supercoiled DNA molecule. Science. 271 (5257), 1835-1837 (1996).
- Daldrop, P., Brutzer, H., Huhle, A., Kauert, D. J., Seidel, R. Extending the range for force calibration in magnetic tweezers. Biophysical Journal. 108 (10), 2550-2561 (2015).
- te Velthuis, A. J. W., Kerssemakers, J. W. J., Lipfert, J., Dekker, N. H. Quantitative guidelines for force calibration through spectral analysis of magnetic tweezers data. Biophysical Journal. 99 (4), 1292-1302 (2010).
- Ostrofet, E., Papini, F. S., Dulin, D. Correction-free force calibration for magnetic tweezers experiments. Scientific Reports. 8 (1), 15920 (2018).
- Seol, Y., Li, J., Nelson, P. C., Perkins, T. T., Betterton, M. D. Elasticity of short DNA molecules: theory and experiment for contour lengths of 0.6-7 µm. Biophysical Journal. 93 (12), 4360-4373 (2007).
- Burnham, D. R., Vlaminck, I. D., Henighan, T., Dekker, C. Skewed Brownian fluctuations in single-molecule magnetic tweezers. PLoS One. 9 (9), 108271 (2014).
- Paul, T., Myong, S. Protocol for generation and regeneration of PEG-passivated slides for single-molecule measurements. STAR Protocols. 3 (1), 101152 (2022).
- Lee, H. -. W., et al. Profiling of protein-protein interactions via single-molecule techniques predicts the dependence of cancers on growth-factor receptors. Nature Biomedical Engineering. 2 (4), 239-253 (2018).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative comparison of algorithms for tracking single fluorescent particles. Biophysical Journal. 81 (4), 2378-2388 (2001).
- Parthasarathy, R. Rapid, accurate particle tracking by calculation of radial symmetry centers. Nature Methods. 9 (7), 724-726 (2012).
- Woodside, M. T., Block, S. M. Reconstructing folding energy landscapes by single-molecule force spectroscopy. Annual Review of Biophysics. 43 (1), 19-39 (2014).
- Evans, E., Ritchie, K. Dynamic strength of molecular adhesion bonds. Biophysical Journal. 72 (4), 1541-1555 (1997).
- Zhang, Y. Energetics, kinetics, and pathway of SNARE folding and assembly revealed by optical tweezers. Protein Science. 26 (7), 1252-1265 (2017).
- Chen, H., et al. Improved high-force magnetic tweezers for stretching and refolding of proteins and short DNA. Biophysical Journal. 100 (2), 517-523 (2011).
- Cho, S., et al. Tension exerted on cells by magnetic nanoparticles regulates differentiation of human mesenchymal stem cells. Biomaterials Advances. 139, 213028 (2022).
- Shon, M. J., Cohen, A. E. Nano-mechanical measurements of protein-DNA interactions with a silicon nitride pulley. Nucleic Acids Research. 44 (1), 7 (2016).
- Cheng, Y. Single-particle cryo-EM-How did it get here and where will it go. Science. 361 (6405), 876-880 (2018).
- Jumper, J., et al. Highly accurate protein structure prediction with AlphaFold. Nature. 596 (7873), 583-589 (2021).
- Neupane, K., et al. Direct observation of transition paths during the folding of proteins and nucleic acids. Science. 352 (6282), 239-242 (2016).
- Choi, H. -. K., et al. Watching helical membrane proteins fold reveals a common N-to-C-terminal folding pathway. Science. 366 (6469), 1150-1156 (2019).
- Kim, C., et al. Extreme parsimony in ATP consumption by 20S complexes in the global disassembly of single SNARE complexes. Nature Communications. 12 (1), 3206 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon