Amministrazione composta III
Panoramica
Fonte: Kay Stewart, RVT, RLATG, CMAR; Valerie A. Schroeder, RVT, RLATG. Università di Notre Dame, IN
Ci sono molte vie comunemente usate per la somministrazione di composti in topi e ratti di laboratorio. Tuttavia, alcuni protocolli possono richiedere l'uso di vie meno comunemente usate, tra cui iniezioni intratradermali, intranasali e intracranica. La formazione specializzata è essenziale affinché queste procedure vengano eseguite con successo. Potrebbe essere necessario fornire una giustificazione per questi percorsi per ottenere l'approvazione del Comitato istituzionale per la cura e l'uso degli animali (IACUC).
Procedura
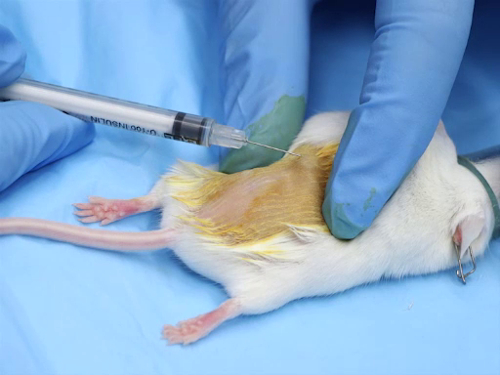
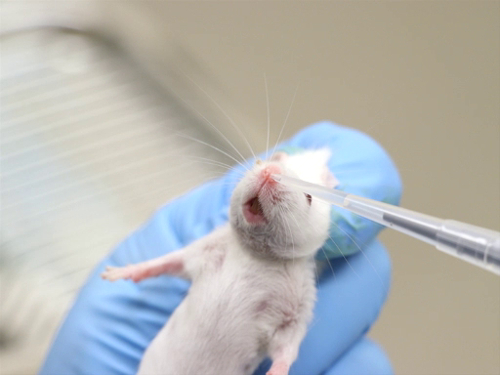
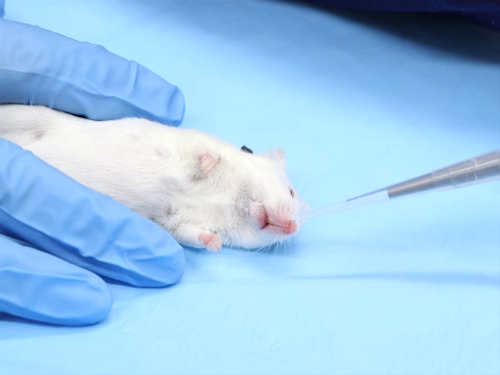
1. Somministrazione intradermica
- La maggior parte delle iniezioni intradermiche sono composti a base acquosa. Le soluzioni devono essere tamponate fisiologicamente per avere un pH neutro, al fine di evitare necrosi tissutale nel sito di iniezione.
- La gamma di dimensioni dell'ago è di 25-30 gauge, la più piccola possibile.
- L'intervallo di dosaggio per sito di iniezione è di 50-100 μL. L'iniezione di volumi eccessivi può provocare necrosi nel sito di iniezione o perdite del composto fuori dal
Applicazione e Riepilogo
La somministrazione di composti negli animali può avere un effetto significativo sia sul benessere dell'animale che sull'esito dei dati sperimentali e sul valore scientifico. Il corretto metodo di consegna è essenziale per il successo dell'esperimento. Molti fattori devono essere considerati per determinare la via migliore, tra cui l'obiettivo scientifico dello studio, il pH della sostanza, il volume di dosaggio richiesto, la viscosità della sostanza e il benessere degli animali. La competenza tecnica è anche un requ...
Riferimenti
- Turner, P.V., Pekow, C., Vasbinder, M. A., and Brabb, T. 2011. Administration of substances to laboratory animals: equipment and considerations, vehicle selection, and solution preparation. JAALAS. 50: 614-627.
- Dhuria, S.V., Hanson, L.R., and Frey II, W.H. 2010. Intranasal delivery to the central nervous system: mechanisms and experimental considerations. Journal of Pharmaceutical Sciences. 99: 1654-1673.
- Stevens, J., Suidgeest, E, Van der Graaf, P.H., Danhof, M., and De Lange, E.C. 2008. Development and evaluation of a new, minimal-stress animal model for intranasal administration in freely moving rats. Poster presentation at American Association of Pharmaceutical Scientists Annual Meeting, Atlanta, Georgia.
- Morton, D.A., Jennings, M., Buckwell, A., Ewbank, R., Godfrey, C., Holgate, B., Inglis, I., James, R., Page, C., Sharman, I., Verschoyle, R., Westall, L., and Wilson, A.B. 2001. Refining procedures for the administration of substances Report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement. Members of the Joint Working Group on Refinement. Laboratory Animals. 35: 1-41.
Vai a...
Video da questa raccolta:

Now Playing
Amministrazione composta III
Lab Animal Research
31.4K Visualizzazioni

Tecniche di manipolazione e contenzione dei roditori
Lab Animal Research
174.3K Visualizzazioni

Procedure di assistenza di base
Lab Animal Research
27.9K Visualizzazioni

Fondamenti di allevamento e svezzamento
Lab Animal Research
35.7K Visualizzazioni

Identificazione dei roditori I
Lab Animal Research
54.7K Visualizzazioni

Identificazione dei roditori II
Lab Animal Research
25.6K Visualizzazioni

Amministrazione composta I
Lab Animal Research
100.4K Visualizzazioni

Amministrazione composta II
Lab Animal Research
34.9K Visualizzazioni

Somministrazione composta IV
Lab Animal Research
51.6K Visualizzazioni

Prelievo di sangue I
Lab Animal Research
171.5K Visualizzazioni

Astinenza di sangue II
Lab Animal Research
73.1K Visualizzazioni

Induzione e manutenzione dell'anestesia
Lab Animal Research
50.4K Visualizzazioni

Considerazioni per la chirurgia dei roditori
Lab Animal Research
22.5K Visualizzazioni

Necroscopia diagnostica e prelievo di tessuti
Lab Animal Research
58.0K Visualizzazioni

Raccolta di tessuti sterili
Lab Animal Research
34.8K Visualizzazioni