Test di suscettibilità agli antibiotici: test dell'epsilometro per determinare i valori MIC di due antibiotici e valutare la sinergia antibiotica
Panoramica
Fonte: Anna Bläckberg1, Rolf Lood1
1 Dipartimento di Scienze Cliniche Lund, Divisione di Medicina delle Infezioni, Centro Biomedico, Università di Lund, 221 00 Lund Svezia
La conoscenza delle interazioni tra antibiotici e batteri è importante per capire come i microbi evolvono la resistenza agli antibiotici. Nel 1928, Alexander Fleming scoprì la penicillina, un antibiotico che esercita la sua funzione antibatterica interferendo con la rigenerazione della parete cellulare (1). Successivamente sono stati scoperti altri antibiotici con diversi meccanismi d'azione, tra cui farmaci che inibiscono la replicazione del DNA e la traduzione proteica nei batteri; tuttavia, negli ultimi anni non sono stati sviluppati nuovi antibiotici. La resistenza agli antibiotici attuali è in aumento, con conseguenti gravi malattie infettive che non possono essere trattate efficacemente (2). Qui, descriviamo diversi metodi per valutare la resistenza agli antibiotici nelle popolazioni batteriche. Ognuno di questi metodi funziona, indipendentemente dal meccanismo d'azione degli antibiotici utilizzati, perché la morte batterica è il risultato misurato. La resistenza agli antibiotici non è solo rapidamente diffusa in modo specifico attraverso le impostazioni ospedaliere, ma anche in tutta la società. Al fine di studiare tali mezzi di resistenza, sono stati sviluppati diversi metodi, tra cui il test Epsilometro (E-test) e il test di diluizione del brodo (3).
L'E-test è un metodo consolidato ed è uno strumento economico che quantifica i dati della concentrazione minima inibitoria (MIC), la concentrazione più bassa di un antimicrobico che inibisce la crescita visibile di un microrganismo. A seconda del ceppo batterico e degli antibiotici utilizzati, il valore del MIC può variare tra sub μg/mL e >1000 μg/mL (4). L'E-test viene eseguito utilizzando una striscia di plastica contenente un gradiente antibiotico predefinito, che è impresso con la scala di lettura MIC in μg / mL. Questa striscia viene trasferita direttamente sulla matrice di agar quando viene applicata alla piastra di agar inoculata. Dopo l'incubazione, una zona di inibizione ellittica simmetrica è visibile lungo la striscia poiché viene impedita la crescita batterica. MIC è definito dall'area di inibizione, che è il punto finale in cui l'ellisse interseca la striscia. Un altro metodo comune per determinare la MIC è il metodo di diluizione delle microbroti. La diluizione dei microbroti incorpora diverse concentrazioni dell'agente antimicrobico aggiunto a un mezzo di brodo contenente batteri inoculati. Dopo l'incubazione, la MIC è definita come la più bassa concentrazione di antibiotico che impedisce la crescita visibile (5). È anche un metodo quantitativo e può essere applicato a diversi batteri. Gli svantaggi di questo metodo includono la possibilità di errori durante la preparazione delle concentrazioni dei reagenti e il gran numero di reagenti necessari per l'esperimento. Misurare la resistenza agli antibiotici è imperativo sia dal punto di vista clinico che di ricerca, e questi metodi in vitro per studiare la resistenza sono discussi e mostrati di seguito.
Il profilo di resistenza per un batterio specifico può essere applicato al fine di ottimizzare il trattamento antibiotico per determinare se un paziente trarrebbe beneficio dal trattamento combinato rispetto alla singola terapia. Per l'uso di più di un antibiotico alla volta, è imperativo conoscere le loro interazioni tra loro e se hanno un effetto additivo, sinergico o antagonista. Un effetto additivo può essere visto quando l'effetto congiunto degli antibiotici è uguale alla potenza dei singoli antibiotici somministrati a una dose uguale. La sinergia tra antibiotici, d'altra parte, è presente quando l'effetto congiunto degli antibiotici è più potente che se il farmaco fosse somministrato da solo (6). L'applicazione di combinazioni di trattamento antimicrobico viene utilizzata per evitare il verificarsi di resistenza antimicrobica, migliorando così l'effetto del trattamento antibiotico individuale (7). La conoscenza dell'antagonismo è anche altrettanto importante per prevenire l'uso non necessario di combinazioni antimicrobiche. La metodologia E-test offre modi semplici e diversi per determinare possibili sinergie e antagonismi tra diversi agenti antimicrobici. Per far fronte alla proliferazione di patogeni resistenti agli antibiotici, è importante conoscere i possibili meccanismi sinergici e antagonisti di alcuni antibiotici con conseguente efficacia clinica e lotta contro la multifarmaco-resistenza.
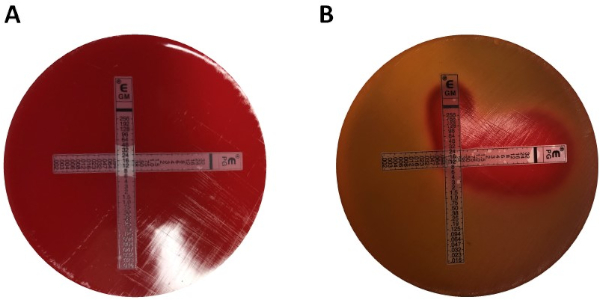
La determinazione della sinergia utilizzando gli E-test può essere suddivisa in due approcci generali: cross e non cross testing. Mentre entrambi i test sinergici si basano sulla precedente conoscenza dei singoli valori MIC, i due approcci sono leggermente diversi nella metodologia e nell'approccio concettuale. In un test di sinergia non incrociata, il primo antibiotico nella coppia da testare viene posto su una piastra di agar inoculata con batteri. Dopo aver permesso agli antibiotici della prima striscia di infondere la piastra (ad esempio dopo 1 ora), la striscia viene rimossa e una nuova striscia contenente il secondo antibiotico viene posizionata nello stesso punto esatto del primo, assicurandosi di posizionare i due singoli valori MIC uno sopra l'altro. La zona di inibizione risultante può quindi essere analizzata come descritto sopra e la sinergia calcolata in base all'equazione 1.
Equazione 1 - Concentrazioni inibitorie frazionarie (FIC)
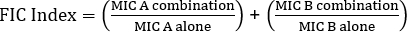
Valori >0,5 dimostra sinergia.
Mentre premia l'esaminatore con piastre facili da analizzare, il metodo è un po 'laborioso e richiede tempo a causa del cambio di strisce, nonché della necessità di utilizzare due piastre per esperimento. Invece, viene spesso utilizzato un test incrociato. Invece di aggiungere le due diverse strisce E-test successivamente una sopra l'altra (dopo la rimozione della prima), entrambe vengono posizionate contemporaneamente ma sotto forma di una croce  (angolo di 90 °), con i due valori MIC precedentemente determinati che formano l'angolo di 90 °. Con questo approccio è necessaria una sola piastra per test sinergico, oltre a meno lavoro, rendendola una scelta preferita nonostante sia leggermente più difficile da analizzare. I nuovi valori MIC nell'approccio combinato agli antibiotici possono essere visualizzati come zone di inibizione modificate, dopo di che la sinergia può essere determinata dall'equazione 1.
(angolo di 90 °), con i due valori MIC precedentemente determinati che formano l'angolo di 90 °. Con questo approccio è necessaria una sola piastra per test sinergico, oltre a meno lavoro, rendendola una scelta preferita nonostante sia leggermente più difficile da analizzare. I nuovi valori MIC nell'approccio combinato agli antibiotici possono essere visualizzati come zone di inibizione modificate, dopo di che la sinergia può essere determinata dall'equazione 1.
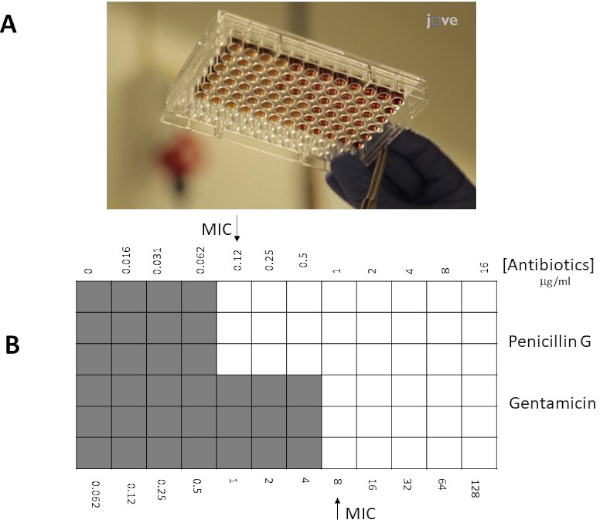
Invece di utilizzare un approccio a piastra di agar, un approccio a microbroto può spesso essere preferenziale a causa della sua maggiore flessibilità (ad esempio la capacità di scegliere concentrazioni specifiche di antibiotici al di fuori dei limiti di una striscia reattiva E). Inoltre, si suggerisce che i test delle microbrotole siano più sensibili a causa della loro distribuzione uniforme degli antibiotici in una soluzione liquida, non dipendenti dalla dissociazione all'interno di una fase solida (piastra di agar). I pozzetti in una micropiastra a 96 pozzetti saranno inoculati con un determinato numero di batteri (106 cfu / mL: la concentrazione batterica può essere stimata da misurazioni OD600 nm, standard di torbidità o diffondendo campioni di placcatura da 10x diluizioni seriali batteriche) e antibiotici in diverse diluizioni saranno aggiunti ai pozzetti. Allo stesso modo, per le strisce reattive E MIC è determinato come l'intersezione (pozzo / spot) con la più bassa concentrazione di antibiotici che inibiscono la crescita visibile dei batteri.
Obiettivo sperimentale
- Il progetto seguente descrive le strategie per determinare i valori MIC della penicillina G e della gentamicina dello streptococco gruppo G con due diversi metodi, E-test e diluizione dei microbroti. Per l'E-test, le placche di agar Mueller-Hinton inoculate con Streptococcus gruppo G sono state utilizzate in combinazione con strisce sfumate di penicillina G e/o gentamicina; mentre il brodo MH con il 50% di sangue di cavallo llisi e 20 mg/mL di β-NAD è stato utilizzato con antibiotici solubili insieme allo Streptococco di gruppo G in un approccio a microbroto.
Materiali
- Colonie batteriche su una piastra di agar nel sangue, conservate <7 giorni in 4°C
- Piastre di agar di sangue
- 0.5 Standard McFarland
- 1% BaCl2
- 1% H2SO4
- Tubo salino (2 mL)
- Applicatore con punta in cotone
- Piastre di agar Mueller-Hinton (piastre MHA)
- Brodo MH con sangue di cavallo lisato al 50% e 20 mg/mL β-NAD (MH-F)
- E-test penicillina/gentamicina (o antibiotici di interesse) (BioMerieux, Marcy l'Etoile, Francia, Svezia)
- Antibiotici penicillina/gentamicina (o antibiotici di interesse (polvere/soluzione))
Nota: i mezzi specifici utilizzati per la crescita batterica possono variare a seconda delle specie.
Procedura
1. Test epsilometrici (E-test)
-
Configurazione
- Indossare guanti e un cappotto da laboratorio
- Prepara lo spazio di lavoro sterilizzandolo con etanolo al 70%
- Raccogli le piastre di agar Mueller-Hinton (piastre MHA)
-
Preparazione di uno standard di torbidità McFarland n. 0.5
- Preparare una soluzione all'1% di cloruro di bario (BaCl2):
Aggiungere 1 grammo di cloruro di bario anidro (BaCl<
- Preparare una soluzione all'1% di cloruro di bario (BaCl2):
Risultati
Valori MIC in E-test
I valori MIC individuali sono stati identificati nella Figura 1 come 0,094 μg/mL per la penicillina G e 8 μg/mL per la gentamicina. Per i test sinergici, entrambi hanno dimostrato un valore MIC per la penicillina G di 0,064 μg /mL (Figure 2, 3), mentre la gentamicina ha avuto un MIC 4 μg / mL per test incrociati e non incrociati. Si noti che può verificarsi una leggera discrepanza tra i test incrociati e non incrociat...
Applicazione e Riepilogo
La resistenza agli antibiotici è un problema di salute in tutto il mondo. Al fine di determinare i meccanismi di resistenza dei microbi, i metodi di test per la sinergia e l'antagonismo con diversi antibiotici sono cruciali. Il metodo E-test è rapido, facile da replicare e può essere utilizzato per studiare qualsiasi potenziale sinergico delle terapie combinate. Il metodo di diluizione del brodo può anche essere valutato per prevedere l'attività battericida. Al fine di studiare i meccanismi di resistenza di diversi ...
Riferimenti
- Tan SY, Tatsumura Y. Alexander Fleming (1881-1955): Discoverer of penicillin. Singapore Medical Journal. 56 (7):366-7. (2015)
- Aminov RI. A brief history of the antibiotic era: lessons learned and challenges for the future. Frontiers in Microbiology. 1:134. (2010)
- Pankey GA, Ashcraft DS, Dornelles A. Comparison of 3 E-test (®) methods and time-kill assay for determination of antimicrobial synergy against carbapenemase-producing Klebsiella species. Diagnostic Microbiology and Infectious Disease. 77 (3):220-6. (2013)
- EUCAST: European Committee On Antimicrobial Susceptibility Testing (www.eucast.org).
- Wiegand I, Hilpert K, Hancock RE. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols. 3 (2):163-75. (2008)
- Doern CD, When does 2 plus 2 equal 5? A review of antimicrobial synergy testing. Journal of Clinical Microbiology. 52 (12):4124-28. (2014)
- Worthington RJ, Melander C. Combination approaches to combat multi-drug resistant bacteria. Trends in Biotechnology. 31 (3):177-84. (2013)
Vai a...
Video da questa raccolta:

Now Playing
Test di suscettibilità agli antibiotici: test dell'epsilometro per determinare i valori MIC di due antibiotici e valutare la sinergia antibiotica
Microbiology
93.4K Visualizzazioni

Creazione di una colonna di Winogradsky: un metodo per arricchire le specie microbiche presenti in un campione di sedimento
Microbiology
128.0K Visualizzazioni

Diluizioni seriali e piastratura: la conta microbica
Microbiology
313.5K Visualizzazioni

Culture di arricchimento: coltura di microbi aerobici e anaerobici su terreni selettivi e differenziali
Microbiology
131.6K Visualizzazioni

Colture pure e piastratura per striscio: isolamento di singole colonie batteriche da un campione misto
Microbiology
165.5K Visualizzazioni

Sequenziamento dell'rRNA 16S: una tecnica basata sulla PCR per identificare le specie batteriche
Microbiology
187.7K Visualizzazioni

Curve di crescita: generazione di curve di crescita utilizzando le unità formanti colonia e la misurazione della densità ottica
Microbiology
292.3K Visualizzazioni

Microscopia e colorazioni: la colorazione di Gram, delle endospore e del capside
Microbiology
362.3K Visualizzazioni

Saggio delle placche: un metodo per determinare il titolo virale in unità formanti placca (UFP)
Microbiology
185.5K Visualizzazioni

Trasformazione di cellule di E. coli tramite l'utilizzo di una procedura basata sul metodo del cloruro di calcio
Microbiology
86.2K Visualizzazioni

Coniugazione: un metodo per trasferire la resistenza all'ampicillina dal donatore al ricevente E. coli
Microbiology
38.0K Visualizzazioni

La trasduzione batterica tramite fagi: un metodo per trasferire la resistenza all'ampicillina da una cellula donatore di E. coli ad una ricevente
Microbiology
28.9K Visualizzazioni